一种用于SPECT成像的当归多糖衍生物及其合成方法与流程
本发明属于药物示踪领域,更具体地,涉及一种用于SPECT成像的当归多糖衍生物及其合成方法。
背景技术:
自1999年美国哈佛大学weissleder教授提出分子影像概念以来,分子影像技术迅速发展,其不仅在临床医学中发挥着重要作用,而且在基础医学、药学以及材料科学研究中都发挥着独特的作用。在各种分子显像模态(核医学、磁共振、光学、靶向超声等)中,核医学的SPECT和PET显像已广泛应用于临床。特别是18F-FDG(氟代脱氧葡萄糖)获得FDA批准,成功应用于临床后,大大促进了PET/CT显像的发展
但是,18F-FDG反映的是糖代谢水平,因此缺乏特异性,对肿瘤和炎性反应的鉴别存在困难,对糖代谢缓慢的肿瘤(如前列腺癌等)的显像诊断也存在局限性;其次,PET的检查费用较贵。因此开发新型显像剂是核医学显像领域的重要研究内容。
近年来,多糖类化合物是新世纪研究领域最活跃的方向之一,特别是天然大分子的植物多糖的结构和药理活性的研究。由于天然大分子植物多糖分子量大、结构不确定性,这给其研究带来困难。在多糖研究的体内外实验中,经常要对其标记示踪,以清晰观察其在体内外的吸收、分布,研究其药理活性机制。
当归为伞形科植物,入肝、脾,具有补血活血、保肝护脾等功效,为临床使用频率最高的中药之一,素有“十方九归”之称,而当归多糖是当归主要活性成分。目前,常用的荧光素和核素主要用于标记多肽类、脂类、 激素类化合物,而较少标记多糖,特别是天然大分子多糖。如果能利用放射性核素产生的γ射线对当归多糖进行标记,将有助于人们对当归多糖在体内过程、作用机制进行研究。
技术实现要素:
本发明的目的在于提供一种当归多糖衍生物及其制备方法,该化合物化学稳定性强、化学纯度高、生物性能好、制备简单,可用于体内SPECT/CT成像。
按照本发明的一个方面,提供了一种当归多糖衍生物,其特征在于,结构式如式Ⅰ所示:
其中,n为80~130的整数。
按照本发明的另一方面,提供了一种式Ⅰ所示当归多糖衍生物的合成方法,其特征在于,合成路线如下:
其中,n为80~130的整数。
优选地,该合成方法包括以下步骤:
步骤一:二乙三胺五乙酸二酐与式Ⅱ化合物溶于二甲基亚砜,在4-二甲氨基吡啶的催化下反应,生成式Ⅲ化合物;其中,式Ⅱ化合物为水提法制备的精制当归多糖,分子量为80000~130000Da;
步骤二:高锝酸盐被SnCl2还原成低价锝,再和式Ⅲ化合物发生螯合反应,纯化反应产物后生成式Ⅰ化合物。
优选地,所述精制当归多糖的制备方法如下:
步骤一:当归饮片加水煮沸后过滤得到当归水提液;将8%~12%的Ca(OH)2乳浊液缓慢加入所述当归水提液中,直至pH为11~13并产生絮状物;将所述当归水提液静置并离心,取上清液过滤,向滤液中加入硫酸溶液调节pH值至5~6并产生CaSO4沉淀,再减压蒸馏浓缩至原体积的1/13~ 1/10;抽滤除去沉淀,滤液醇沉后搅匀并于1℃~4℃静置直至分层,取下层沉淀物烘干得到粗制当归多糖;
步骤二:将所述粗制当归多糖溶解后,抽滤除去固体杂质,滤液进行冻融和微滤除杂,然后透析去除小分子杂质,最后微滤取滤液;
步骤三:用葡聚糖凝胶柱层析法收集含有所需分子量范围的当归多糖层析液,冷冻干燥法除去水分,即得到所需的精制当归多糖。
本发明还提供了这种当归多糖衍生物在SPECT成像以及SPECT/CT断层扫描中的应用,结果显示当归多糖具有肝脏靶向性,这也解释了当归多糖具有保护肝脏的药理作用。
本发明还提供了这种当归多糖衍生物作为肝脏靶向剂的应用。
总体而言,通过本发明所构思的以上技术方案与现有技术相比,具有如下有益效果。
1、为当归多糖提供了一种简单的标记方法;
2、当归多糖的标记率高,标记生成当归多糖衍生物的成像明显;
3、当归多糖衍生物具有良好的环境稳定性,在PBS缓冲液和胎牛血清中24小时后均有较好的活性;
4、在大鼠和大白兔体内均有较好的成像效果,证明了当归多糖的肝脏靶向性。
附图说明
图1是实施例2制备的精制当归多糖和ASP-DTPA中间体的傅里叶红外光谱分析曲线;
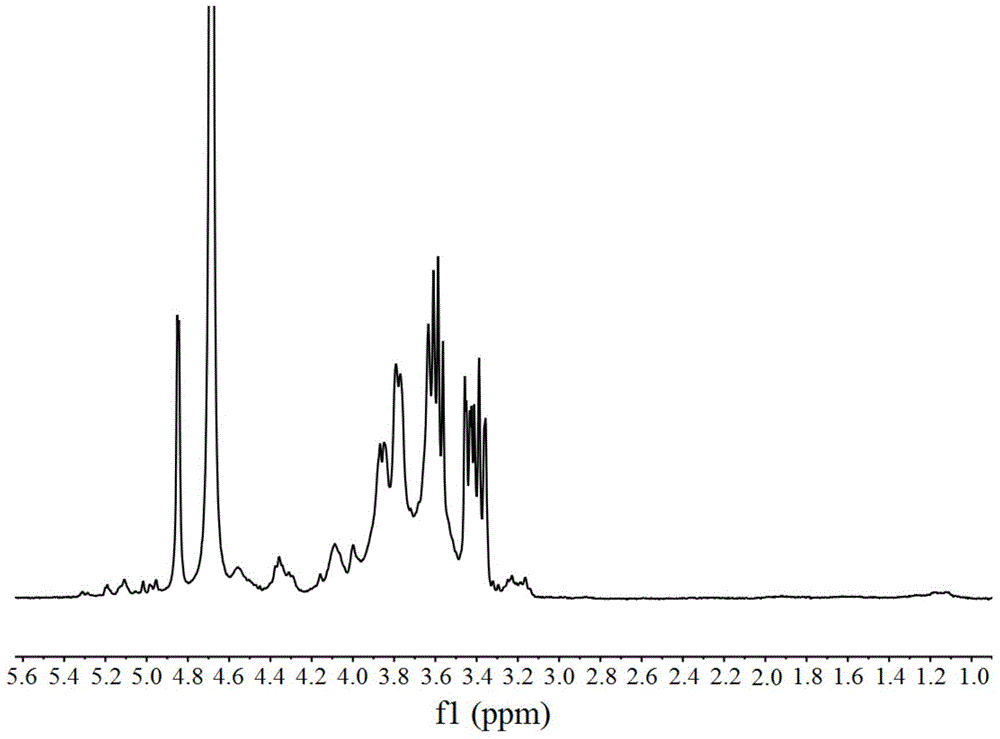
图2是实施例2制备的精制当归多糖和ASP-DTPA中间体的核磁共振氢谱分析曲线;
图3是实施例2制备的当归多糖衍生物(ASP-DTPA-99mTc)的薄层层析(ITLC-SG)和γ计数器检测结果;
图4是实施例2制备的ASP-DTPA-99mTc在PBS溶液和血清中的稳定性测试结果;
图5是实施例2制备的ASP-DTPA-99mTc在SD大鼠中的SPECT成像和SPECT/CT断层扫描结果;
图6是实施例2制备的ASP-DTPA-99mTc在大白兔中的SPECT成像和SPECT/CT断层扫描结果。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。此外,下面所描述的本发明各个实施方式中所涉及到的技术特征只要彼此之间未构成冲突就可以相互组合。
实施例1当归多糖的提取、分离和纯化
1、当归粗多糖的提取
取当归饮片200g,加水2000mL煮沸1h,用纱布过滤取水提液,滤渣继续同法处理一次,合并两次水提液,约1.5L。配制10%Ca(OH)2乳浊液,匀速搅拌下缓慢加入当归水提液中,调节pH至12,此时烧杯中有大量棕色絮状物。将上述溶液静置24h,使絮状物质聚集,4000rpm离心15min,除去絮状物得上清液,约0.8L。上清液经抽滤除去少量不溶性杂质后得滤液,向滤液中加入3mol/L的硫酸溶液,调节pH至5~6,滤液100℃浓缩至约400ml,继续减压旋蒸浓缩至80~120mL,冷却静置,出现大量白色不溶物CaSO4,抽滤除去CaSO4,滤液用95%乙醇1.5倍醇沉,搅匀并于4℃冰箱静置24h,7500rpm离心15min,取沉淀于60℃烘箱中烘干,得棕褐色粗制当归多糖,称重并计算其产率,烘干后约5g,产率约2.5%。经苯酚硫酸法检测,粗制当归多糖的糖含量为43%,
2、当归粗多糖的透析
透析袋活化:在1000ml 2%NaHCO3和1mmol/L(0.3722g/L)EDTA溶液中将透析袋煮沸10min。取出透析袋,用去离子水清洗透析袋。再用1000ml1mmol/L(0.3722g/L)EDTA溶液将透析袋煮沸10min,冷却后存于4℃冰箱中备用。
取50g当归粗多糖于500ml去离子水中搅拌24h后,抽滤除去白色不溶物,滤液进行冻融,解冻后采用滤膜微滤除杂,同法三次以上至解冻后不见明显不溶物。将滤液装入上述透析袋中,采用去离子水透析除小分子,勤换水,4h后平衡水的离子强度接近去离子水。透析结束后,母液过滤且微滤,得滤液,此滤液浓度约为100mg/ml且符合上柱条件。
3、当归多糖的纯化
G50凝胶柱活化:取适量G50凝胶于1000ml 0.5mol/L NaCl溶液和0.5mol/L NaOH溶液中,在80-100℃温度下煮30min,轻轻搅拌。冷却至室温后存于4℃冰箱中备用。
G50凝胶柱条件:柱高60cm,流动相为去离子水,流速25mL/min,上样量40mL。
上样后开始收集洗脱液,按10mL/管收集。从各管中依次各取300μL,然后加入0.6mL 5%苯酚和3mL浓硫酸,采用苯酚-硫酸法显色,于490nm处测定吸光度A。以洗脱液体积为横坐标,各管中洗脱液的吸光度A为纵坐标,作洗脱曲线图。
收集490nm处测定吸光度A高的截留液,先置-20℃冰箱预冻,再置真空冷冻干燥机中冷冻干燥24h,得白色精制当归多糖。经苯酚硫酸法检测,制当归多糖糖含量为96%。
实施例2当归多糖衍生物(ASP-DTPA)的合成
步骤一:ASP-DTPA中间体的合成
取当归多糖(ASP)150mg与二乙三胺五乙酸二酐(DTPAA)300mg,和100mg 4-二甲氨基吡啶(DMAP)一起溶于无水二甲基亚砜(DMS0)80ml中,40℃搅拌反应24h;反应结束后,装入活化后的3500MW透析袋去除未反应的小分子,以去离子水为平衡液(5×7L);透析结束后,母液于-20℃冷冻后,置冷冻干燥机中冻干除水,得到ASP-DTPA中间体。
其中,DMAP是一种高效的酰化催化剂,可以催化酯化反应的进行。同时DMAP是一种弱碱,可以除去酯化反应产生的有机弱酸。由于DPTAA是酸酐结构,容易水解,故采用无水DMSO作溶剂,同时氮气保护反应。
步骤二:当归多糖衍生物(ASP-DTPA-99mTc)的合成
取1ml新鲜淋洗的99mTcO4-(74×107Bq/20mCi,浓度20mCi/mL),加入5μL氯化亚锡(2mg/mL)还原剂,涡旋混合备用。取含0.5mlASP-DTPA(10mg/ml)生理盐水溶液,加入上述混合物中,涡旋10s后,室温放置0.5h使反应完全。
将PD-10脱盐凝胶柱(Sephadex G-25)用25ml洗脱液(生理盐水)平衡,控制流速在5ml/min左右。将上述1.5ml标记好的当归多糖衍生物(ASP-DTPA-99mTc)用注射器上样,每次用0.5ml的洗脱液洗脱,先用1.5ml的洗脱液淋洗后,收集随后的1ml淋洗液,得到去杂质的当归多糖衍生物(ASP-DTPA-99mTc)的生理盐水溶液。
实施例3理化性质分析
采用压片法对实施例2中的精制当归多糖(ASP)和ASP-DTPA中间体进行傅里叶红外光谱分析。取适量的样品于干燥、洁净的压片模具中,制成透明试样薄片,随即上机扫描,测定各样品在4000cm-1~400cm-1红外吸收光谱,结果如图1所示。从图1可看出,两者都明显在3200cm-1有羟基特征峰吸收,在1630cm-1有碳碳双键(C=C)特征峰的伸缩振动吸收,在1000cm-1左右有糖环上的碳氧碳键(C-O-C)的伸缩振动。而ASP-DTPA中间体的红外图谱比ASP明显在1725cm-1多一个羰基吸收峰,说明该样品中存在羰 基(C=O)结构,这符合DTPA的羰基结构特征,证明ASP与DTPAA反应成功生成ASP-DTPA中间体。
对实施例2中的ASP和ASP-DTPA中间体进行核磁共振氢谱分析(1H NMR,D2O,400MHz),结果ASP如图2a,ASP-DTPA中间体如图2b。如图2所示,由于ASP是多种单糖组成的大分子多糖,主要含C、H、O三种元素。故其氢的化学环境较为相似,氢归属主要集中在3ppm~5.5ppm。而在ASP-DTPA中间体的氢谱中含有DTPAA的化学位移(δ2.554H,2.604H,3.102H,3.188Hppm,DTPA)。
取实施例2制得的当归多糖衍生物的生理盐水溶液,经薄层层析(ITLC-SG)和γ计数器检测,结果如图3,纵坐标表示γ计数强度,横坐标表示ITLC-SG长度(mm),图3表示,在15cm的ITLC-SG试纸中,每个位置的γ计数强度,经PD-10脱盐柱纯化后只有一个强峰而无杂质峰,说明99mTc的标记有效。
取0.1mCi的当归多糖衍生物分别溶解于pH7.2~7.4的PBS缓冲液0.5ml,和胎牛血清0.5ml中,置37℃烘箱,于1h,2h,4h,8h,24h取出。采用ITLC-SG和γ计数器测量每段碎片(1cm)的放射计数,每个时间点测量三次取平均值。稳定性数据处理后如图4所示。
可以看出,当归多糖的初始标记率为96%,37℃下,当归多糖在PBS 24h后标记率约91%,在血清24h后标记率约83%,稳定性良好,证实该当归多糖衍生物可用于体内成像。
实施例4ASP-DTPA-99mTc的体内SPECT成像和SPECT/CT断层。
将实施例2制得的ASP-DTPA-99mTc的生理盐水溶液用0.22μm的微滤膜过滤,除病菌热源,备用。取健康雄性Sprague-Dawley(SD)大鼠(230±20g)。禁食禁水12h后,经大鼠尾静脉注射该溶液0.1mCi/只,给药后,按1.3g/Kg剂量腹腔注射浓度为0.4g/mL的乌来糖生理盐水溶液进行麻醉。麻醉完成后,大鼠仰卧位,用胶布固定于板上,分别于30min,1h,2h,4h 时间点利用SPECT(单光子发射计算机断层成像计数,siemens西门子双探头)低能探头静态收集γ射线成像,结果见图5a,可看到肝脏处有明显的亮斑,而在血液、心、肺等非靶向器官的放射性浓集很低。为了排除小鼠其它组织对SPECT成像的干扰,取1h时间点的SD大鼠解剖,取其肺、胃、肝、脾、肾,置离体组织于SPECT下静态收集γ计数成像。结果如图5b所示,仍然在肝脏处可见明显的亮斑。
将实施例2制得的ASP-DTPA-99mTc的生理盐水溶液用0.22μm的微滤膜过滤,除病菌热源,备用。经大白兔(约2Kg)耳静脉注射该溶液0.15mCi/只,乌拉坦麻醉后,于15min、30min、1h、2h、4h时间点SPECT静态收集γ计数成像,结果如图6a所示,可看到肝脏和膀胱处有明显的亮斑;于1h时间点,做SPECT/CT断层扫描,结果如图6b-c。图6b是大白兔Z轴方向的肝脏SPECT/CT断层扫描,图6c从左至右依次是大白兔Z轴方向、Y轴方向、X轴方向的SPECT/CT断层扫描,图6b和6c均能看到肝脏处的明显亮斑均为肝脏,从三维角度确认当归多糖靶向肝脏。
从图5和图6的SPECT成像和SPECT/CT断层扫描结果显示,当归多糖在肝脏中有极高的靶向摄取率,且长时间不会浓集于其它器官,而在血液、心、肺等非靶向器官的放射性浓集很低,这为当归多糖作为药物载体,制备肝靶向纳米粒提供了理论基础。
本领域的技术人员容易理解,以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 用于生产化学品及其衍生物的组合物和方法与制造工艺
- 7‑OH‑8‑[(1‑胺基‑1‑苯基衍生物)‑次甲基]‑黄酮化合物及其制备方法及其应用与制造工艺
- 联苯胺衍生物、其制造方法和电子照相感光体与制造工艺
- 包含环糊精衍生物的可注射美法仑组合物及其制备和使用方法与制造工艺
- 含D型非天然氨基酸的抗菌肽类似物及其合成与应用的制造方法与工艺
- 一种黄芪甲苷衍生物及其制备方法和应用与制造工艺
- (Z,E)5‑OH‑3‑(苯基衍生物‑次甲基)‑二氢黄酮‑7‑O‑糖苷及其制备及其应用的制造方法与工艺
- 喹唑啉衍生物的制造方法与工艺
- 一种白杨素氨基酸衍生物的制备方法与制造工艺
- Harrisotone A衍生物的组合物在防治肝脏损伤药物中的应用的制造方法与工艺