一种苜蓿疫霉菌巢式PCR检测方法与流程
本发明属于作物病害预警检测及防治技术领域,涉及一种分子快速检测的方法与应用,具体涉及苜蓿疫霉菌巢式PCR检测方法及其应用。
背景技术:
苜蓿是豆科、苜蓿属多年生草本植物,是我国乃至世界上种植最多的牧草品种,由于其适应性广、产量高、品质好等优点,素有“牧草之王”的美称。由苜蓿疫霉菌(Phytophthora medicaginis)侵染引起的苜蓿根腐病是导致苜蓿产量损失的主要病害之一,苜蓿根腐病可导致苜蓿感病品种产量损失达68%以上。苜蓿疫霉菌被我国列为禁止进境检疫对象,目前,中国尚未有苜蓿疫霉根腐病发生的报道,但随着近来年我国畜牧业的不断发展,我国口岸进口苜蓿草料和种子的增多以及国内苜蓿草料及种子的大量调运,势必增加该病菌由疫区传入非疫区的危险,该病菌一旦传入,为害非常严重,而检疫是防止该病菌在我国定殖、传播最经济、最有效的方法。因此很有必要对苜蓿疫霉菌进行深入研究,尽快建立其快速而准确的检测方法。
疫霉菌传统分类鉴定主要是基于形态学特征(菌落形态、菌丝形态、厚垣孢子的有无、孢子囊特征、孢囊梗层出方式、孢子囊的脱落性及雄器的类型等)、致病性测定、生理生化特征等。在进行形态学鉴定时需对病原菌进行分离,然而同一选择性培养基上,其他生长速度较快的微生物会抑制疫霉菌生长,造成分离存在一定的困难。另外,疫霉属种间的形态学性状常出现重叠现象,疫霉种内各菌株形态学性状存在差异,而且易受环境条件影响(宿主、培养基、温度等)而出现不稳定性状。虽然传统方法在疫霉菌检测中发挥了重要作用,但是费时费力,而且要求操作者具备专业的疫霉菌分离、形态学鉴定知识和丰富的经验;同时传统分类鉴定方法耗时长、灵敏度低、易受人为及环境等诸多因素的干扰,不能在病害潜伏期和发病初期做出诊断,很难对病害发生进行及时的监测和有效控制。
随着分子生物学技术的发展,近年来,利用PCR扩增病原菌核糖体某一特异分子片段(internal transcribed spacer ITS转录间隔区)进行病原菌鉴定、检测及病害诊断为国际上广泛使用,应用病原菌特异引物通过PCR扩增可直接对植物组织、土壤及水体等样品中的病原菌进行检测。由于这种方法特异性强、灵敏度高、简便、快速、无放射性污染、易推广等突出优势,越来越受到各国病理学家的高度重视。然而疫霉属卵菌的分子检测技术研究结果表明,rDNA/ITS在疫霉属近缘种之间变化很小,从ITS序列上设计引物很难将两个相似高的种区分开。因此要对疫霉属病原菌进行高灵敏性和特异性检测,应从疫霉菌其它基因上设计引物。已有研究表明,疫霉属中的Ypt1基因含有多个外显子和内含子,外显子具有保守性,而这些内含子在不同种之间具有多变性,非常适合于设计引物进行疫霉属卵菌近缘种的特异性分子检测、鉴定。
本发明以Ypt1基因为苜蓿疫霉菌检测靶点,设计特异性引物并与PCR技术相结合,建立特异性强、灵敏度高、耗时短的检测方法。本发明在苜蓿疫霉菌的鉴定、监测、病害检测与防治等方面具有一定的应用前景。
技术实现要素:
本发明的目的是提供了一种检测苜蓿疫霉菌的特异性引物、PCR检测方法及其应用,本发明可应用于携带苜蓿疫霉菌的苜蓿草植物组织和土壤检测。利用本发明检测苜蓿疫霉菌准确性高、特异性强、灵敏度高、易于操作、检测时间短且结果可靠。
实现本发明的目的包括下列步骤(技术方案):
1. 苜蓿疫霉菌特异性引物的设计:通过测定苜蓿疫霉菌(Phytophthora medicaginis)和其它疫霉菌(Phytophthora spp)的Ypt1基因序列,对疫霉属不同种间Ypt1基因序列进行比对分析,设计出对苜蓿疫霉菌具有特异性扩增作用的1对引物,即特异PCR检测引物的序列为:
上游引物PMF:5'- GTCTACAGTGGATTTGGATCTCTTG -3',
下游引物PMR:5'- CAAAATATAACAGTAAAGTTGAGTTCG -3';
对苜蓿疫霉菌特异性扩增出225bp的产物。
疫霉菌Ypt1基因通用引物ph1F/Yph2R,其序列为:
ph1F:5'-CGACCATTGGCGTGGACTTT-3',
Yph2R:5'-ACGTTCTCGCAGGCGTATC- T-3'。
2. 苜蓿疫霉菌巢式PCR检测方法的建立,包括以下步骤:
(1)提取待测样品基因组DNA。
用于检测病原菌纯培养物时,采用CTAB 法进行提取基因组DNA,具体方法如下:取少量菌丝粉于1.5mL离心管中(菌丝粉刚盖过半圆形底部为宜),加入900 µL 2%CTAB(十六烷基三甲基溴化铵)提取液(2% CTAB;100 mmol/L Tris-HCl, pH 8.0;20 mmol/L EDTA,pH8.0;1.4 mol/L NaCl)和90 µL SDS(十二烷基苯磺酸钠)【注:CTAB,SDS需60℃预热】,使用振荡器振荡混匀,60℃水浴1h(DNA释放至缓冲液中),12000 r·min-1离心15 min;取上清液700 µL,加等体积酚、氯仿、异戊醇(25:24:1),轻轻振荡混匀,12000 r·min-1离心9 min;取上清液500 µL,加入等体积氯仿再抽提一次,12000 r·min-1离心5 min;取上清液350 µL,加入1/10体积3 mol·L-1 NaAc和2倍体积无水乙醇,-20℃沉淀30 min,12000 r·min-1离心5 min;弃去上清液,加入700µL 冰70%乙醇进行洗涤(稍离心;倾掉上清液),在超净工作台上晾干无酒精味,加入30~60 µL TE(10 mmol/L Tris-HCl,0.1 mmol/L EDTA,pH 8.0) 溶液进行溶解,得到 DNA 溶液,用紫外分光光度计检测 DNA 浓度并稀释至25 ng/µL待用。
用于检测苜蓿草植物组织中存在苜蓿疫霉菌时,采用NaOH快速裂解法提取DNA,具体过程如下:向每毫克植物组织中加入10µL 0.5 mol/L NaOH,在研钵中将组织充分磨碎成糊后转入1.5mL离心管中,12,000 rpm离心6 min,取上清液5 µl加入495µL 0.1 mol/L Tris-HCl(pH=8.0)混合均匀,取1.0 µL作为PCR模板进行扩增;
用于检测土壤样品中存在苜蓿疫霉菌时,采用土壤DNA提取试剂盒,提取DNA。
(2)巢式PCR第1轮扩增:以步骤(1)提取的DNA为模板,利用Ypt1基因通用引物ph1F/Yph2R(ph1F:5'-CGACCATTGGCGTGGACTTT-3'和Yph2R:5'-ACGTTCTCGCAGGCGTATCT-3')进行第1轮PCR扩增,扩增反应体系和反应程序如下:PCR反应体系25 µL,包括2×Taq PCR Master Mix 12.5µL,10 µmol/L的ph1F /Yph2R引物各1.0µL,DNA模板1.0µL,用无菌超纯水补足至25 µL;扩增反应程序为:94℃预变性5min;94℃变性1 min、58℃退火30 S、72℃延伸1 min,35个循环,最后72℃延伸10 min。
(3)巢式PCR第2轮扩增:待步骤(2)第一轮PCR扩增结束后,取1.0μl 第一轮PCR扩增产物或扩增产物的稀释液为模板与引物PMF/PMR(PMF:5'- GTCTACAGTGGATTTGGATCTCTTG -3',PMR:5'- CAAAATATAACAGTAAAG- TTGAGTTCG -3')组合进行第2轮PCR扩增,PCR扩增的条件为:PCR反应体系25 µL,包括2×Taq PCR Master Mix 12.5µL,10 µmol/L的 PMF/PMR引物各1.0µL,DNA 模板(第1轮PCR扩增产物)1.0µL,用无菌超纯水补足至25 µL;扩增参数为95 ℃预变性5 min,94 ℃变性30 s,57 ℃退火45 s,72 ℃延伸30 s,共35个循环,最后72 ℃延伸10 min;
(4)凝胶电泳检测:取5.0µL步骤(3)第2轮PCR扩增产物用1.5%琼脂糖凝胶进行电泳分离,电压为4-5V/cm,电泳40 min后经溴化乙锭染色于紫外灯下观察,根据扩增产物的有无及其片段大小对结果进行判断,如果能特异性地扩增出约225bp大小的产物,即可判断所述的检测样品中存在苜蓿疫霉菌,否则所述的检测样品中未存在该菌。
本发明与现有技术相比,具有以下的技术优势和有益效果:
1.特异性强、准确性高:本发明通过测序和查询GenBank中的数据,得到了苜蓿疫霉菌(Phytophthora medicaginis)和其它疫霉菌(Phytophthora spp)的Ypt1基因序列,并对疫霉属不同种Ypt1序列进行分析,设计了苜蓿疫霉菌一对特异性引物PMF/PMR,利用该对引物对疫霉菌和其它真菌进行PCR扩增,发现只能从苜蓿疫霉菌的DNA中扩增出大小约为225bp的条带,而其它菌株均扩增不出条带,说明本发明的引物具有很强的特异性;
2.重复性好、灵敏度高:重复性和灵敏度是病原菌检测的一个重要指标,它关系到能否把PCR快速检测技术直接应用于出入境植物和植物产品的检验检疫中。多次试验证实本发明具有很好的重复性,目标物DNA只需要10 pg/µL,就可以检测、鉴定出苜蓿疫霉菌;
3.操作简便、快速:应用本发明方法,对待测样品基因组DNA进行提取、PCR扩增和常规的琼脂糖电泳后即可判定结果,整个检测过程采用DNA快速提取方法,操作简单,无需对病原菌进行分离培养,大大缩短了检测时间,一般整个检测过程可在6小时内完成;
4. 应用性好:直接从病组织或带菌土壤中检测苜蓿疫霉菌具重要的实际应用价值,苜蓿疫霉菌随贸易往来最可能的传播途径是随苜蓿中的土壤或病残体(如根、茎等)传播,在贸易口岸中,检疫部门主要是通过土壤和病残体中病原菌的分离、鉴定来判断是否携带苜蓿疫霉菌。但是对病原菌的分离纯化中易受一些腐生菌的干扰,无法满足海关检疫的需要。本发明通过设计了一对特异性引物,结合PCR检测方法可以有效地检测植物组织和土壤中的苜蓿疫霉菌,可参考应用于出入境植物和植物产品的检验检疫和田间调查,对控制苜蓿疫霉菌传入我国具有重要意义,同时,本发明体系的建立也为其它病原菌的检测提供了技术指导和理论依据。
附图说明
图1为本发明所述特异性引物的PCR扩增电泳图,图中:泳道M为2000bp Marker,泳道1-3为苜蓿疫霉菌,泳道4-7分别为辣椒疫霉菌、晚疫病菌、大豆疫霉菌和豇豆疫霉菌,泳道8为阴性对照。
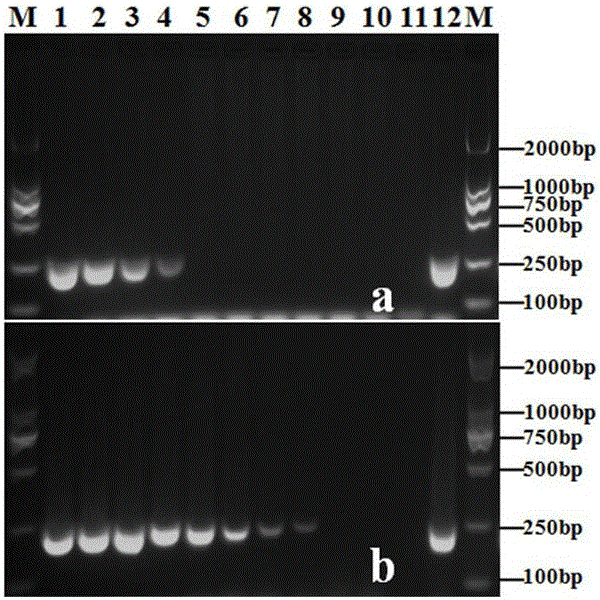
图2为本发明特异性引物的灵敏性检测扩增电泳图,图2-a为单重PCR对苜蓿疫霉菌的灵敏性检测结果,图2-b为巢式PCR对苜蓿疫霉菌的灵敏性检测结果,图中泳道M为2000bp Marker,泳道1为100 ng,泳道2为10 ng,泳道3为1 ng,泳道4为100 pg,泳道5为10 pg,泳道6为1 pg,泳道7为100 fg,泳道8为10 fg,泳道9为1 fg,泳道10-11为阴性对照,泳道12为阳性对照。
图3为本发明检测方法对紫花苜蓿草茎部组织和土壤样品中苜蓿疫霉菌检测结果电泳图,图中泳道M为2000bp Marker,泳道1为阳性对照,泳道2为阴性对照,泳道3为人工接种发病的苜蓿草茎部组织,泳道4为健康苜蓿草茎部组织,泳道5为携带苜蓿疫霉菌的土壤,泳道6为高压灭菌土壤,泳道7为携带苜蓿疫霉菌的土壤,泳道8为高压灭菌土壤。
具体实施方式
以下结合具体实施例对本发明作进一步阐述, 但不用来限制本发明的范围。以下实施例均按照常规实验条件,或已发表相关文献中所述的操作技术规程,或按照厂商所建议的实验条件。
实施例 1:苜蓿疫霉菌PCR检测特异性引物的设计及引物的特异性验证
1.苜蓿疫霉菌基因组DNA的提取
采用CTAB 法提取不同地区来源的苜蓿疫霉菌基因组 DNA,具体方法如下:取少量菌丝粉于1.5 mL离心管中(菌丝粉刚盖过半圆形底部为宜),加入900 µL 2%CTAB(十六烷基三甲基溴化铵)提取液(2% CTAB;100 mmol/L Tris-HCl, pH 8.0;20 mmol/L EDTA,pH8.0;1.4 mol/L NaCl)和90 µL SDS(十二烷基苯磺酸钠)【注:CTAB,SDS需60℃预热】,使用振荡器振荡混匀,60℃水浴1h(DNA释放至缓冲液中),12000 r·min-1离心15 min;取上清液700 µL,加等体积酚、氯仿、异戊醇(25:24:1),轻轻振荡混匀,12000 r·min-1离心9 min;取上清液500 µL,加入等体积氯仿再抽提一次,12000 r·min-1离心5 min;取上清液350 µL,加入1/10体积3 mol·L-1 NaAc和2倍体积无水乙醇,-20℃沉淀30 min,12000 r·min-1离心5 min;弃去上清液,加入700µL 冰70%乙醇进行洗涤(稍离心;倾掉上清液),在超净工作台上晾干无酒精味,加入30~60 µL TE(10 mmol/L Tris-HCl,0.1 mmol/L EDTA,pH 8.0) 溶液进行溶解,得到 DNA 溶液,用紫外分光光度计检测 DNA 浓度并稀释至100 ng/µL待用。
2.苜蓿疫霉菌检测靶标Ypt1基因扩增及测序
以Ypt1基因通用引物(ph1F:5'-CGACCATTGGCGTGGACTTT-3'和Yph2R:5'-ACGTTCTCGCAGGCGTATCT-3')对供试苜蓿疫霉菌(Phytophthora medicaginis)的Ypt1基因进行扩增,PCR反应体系25 µL,包括2×Taq PCR Master Mix(北京天根生化科技有限公司)12.5µL,10 µmol/L的ph1F / Yph2R引物各1.0µL,DNA 模板1.0µL,用无菌超纯水补足至25 µL。扩增反应程序为:94℃预变性5min;94℃变性1 min、58℃退火30 S、72℃延伸1 min,35个循环,最后72℃延伸10 min。将PCR扩增产物送至上海生工生物工程有限公司进行测序。
3.苜蓿疫霉菌检测特异性引物的设计
将测序得到的苜蓿疫霉菌(P.medicaginis)的Ypt1基因序列与GenBank中疫霉属18个不同种的Ypt1基因序列进行同源性比较分析,根据苜蓿疫霉菌与其它种间的差异位点(在BioEdit中比对),用Primer Primer5软件设计了苜蓿疫霉菌(P.medicaginis)的特异性引物,上游引物PMF:5'- GTCTACAGTGGATTT- GGATCTCTTG -3',下游引物PMR:5'- CAAAATATAACAGTAAAGTTGAGTTCG -3',引物由上海生工生物工程有限公司合成。
4.苜蓿疫霉菌特异PCR检测方法的建立及引物特异性PCR验证
在已设计特异性引物的基础上,通过PCR反应体系和扩增参数的优化,建立了苜蓿疫霉菌PCR检测方法,PCR反应体系25 µL,包括2×Taq PCR Master Mix 12.5µL,10 µmol/L的PMF/PMR引物各1.0µL,DNA 模板1.0µL,用无菌超纯水补足至25 µL。扩增反应程序为:94℃预变性5min;94℃变性1 min、57℃退火45S、72℃延伸30 s,35个循环,最后72℃延伸10 min。以供试的苜蓿疫霉菌及其它病原菌的基因组DNA为模板,采用已建立好的苜蓿疫霉菌PCR检测扩增体系和扩增程序对苜蓿疫霉菌特异引物(上游引物PMF:5'- GTCT- ACAGTGGATTTGGATCTCTTG -3',下游引物PMR:5'- CAAAATATAACAG- TAAAGTTGAGTTCG -3')的特异性进行验证。取5 µL PCR产物进行1.5%琼脂糖电泳检测,经溴化乙锭染色后于紫外灯下观察,根据DNA条带的有无及大小对苜蓿疫霉菌特异引物的特异性进行验证。
5.引物特异性验证结果
PCR扩增结果表明,引物PMF/PMR只能特异性地从供试的苜蓿疫霉菌基因组DNA中扩增出大小约为225bp的条带(图1),而其它病原菌及阴性对照均无扩增条带。说明该对引物可以将苜蓿疫霉菌与其它病原菌区分开来,具有种的特异性,可用于苜蓿疫霉菌快速可靠的检测和鉴定。
实施例2:苜蓿疫霉菌巢式PCR检测的灵敏度测定
1.常规PCR检测
用无菌超纯水对苜蓿疫霉菌基因组DNA进行稀释,配制成10倍数量级的系列浓度备用。使用本发明所述引物PMF/PMR对不同系列浓度的基因组DNA进行PCR扩增,评估该引物对苜蓿疫霉菌基因组DNA检测的灵敏性,扩增反应体系和反应程序如下:PCR反应体系25 µL,包括2×Taq PCR Master Mix(北京天根生化科技有限公司)12.5µL,10 µmol/L的PMF/PMR引物各1.0µL,DNA 模板1.0µL,用无菌超纯水补足至25 µL。扩增反应程序为:94℃预变性5min;94℃变性1 min、57℃退火45 S、72℃延伸1 min,35个循环,最后72℃延伸10 min。
2.巢式PCR检测
(1)DNA模板的稀释:用无菌超纯水对苜蓿疫霉菌基因组DNA进行稀释,配制成10倍数量级的系列浓度备用。
(2)巢式PCR第1轮扩增:以不同稀释浓度的DNA为模板,利用Ypt1基因通用引物ph1F/ph2R(ph1F:5'-CGACCATTGGCGTGGACTTT-3'和Yph2R:5'-ACGTTCTCGCAGGCGTATCT-3')进行巢式PCR第1轮扩增,扩增反应体系和反应程序如下:PCR反应体系25 µL,包括2×TaqPCR Master Mix(北京天根生化科技有限公司)12.5µL,10 µmol/L的ph1F /Yph2R引物各1.0µL,DNA模板1.0µL,用无菌超纯水补足至25 µL。扩增反应程序为:94℃预变性5min;94℃变性1 min、58℃退火30 S、72℃延伸1 min,35个循环,最后72℃延伸10 min。
(3)巢式PCR第2轮扩增:待第一轮PCR扩增结束后,取1.0μl 第一轮PCR扩增产物或扩增产物的稀释液为模板与苜蓿疫霉菌特异性引物PMF/PMR组合进行巢式PCR第2轮扩增。PCR反应体系25 µL,包括2×Taq PCR Master Mix(北京天根生化科技有限公司)12.5µL,10 µmol/L的PMF/PMR引物各1.0µL,第一轮PCR产物1.0µL,用无菌超纯水补足至25 µL。扩增反应程序为:94℃预变性5min;94℃变性1 min、57℃退火45 S、72℃延伸1 min,35个循环,最后72℃延伸10 min。
3.常规PCR和巢式PCR灵敏度比较:当以特异性引物PMF/PMR进行常规PCR扩增时,反应灵敏度可以达到100pg DNA 25μl-1反应体系(图2中的a)。进一步以Ypt1基因通用引物ph1F /Yph2R进行第一轮扩增得到的PCR产物作为模板,以PMF/PMR作为第二轮扩增引物进行巢式PCR扩增,从电泳图可以看出巢式PCR的特异性扩增条带比常规PCR要亮得多,能够使原来看不到条带的样品(10pg、1 pg、100fg、10fg/25μl反应体系)产生可见条带(图2中的b),灵敏度达到10fg DNA 25μl-1反应体系,比常规PCR要提高10000倍左右。
实施例3:苜蓿草茎部发病组织中苜蓿疫霉菌的检测
人工接种发病组织的获得:将供试的苜蓿疫霉菌转至黑麦培养基平板上,25℃黑暗培养5 d后从菌落边缘切取2 mm×2 mm的菌丝块创伤接种于紫花苜蓿草(品种:中苜1号)茎杆上,25℃黑暗保湿培养,待发病后切取发病组织备用。
发病组织基因组DNA的提取:采用NaOH快速裂解法提取DNA,具体过程如下:向每毫克植物组织中加入10µL 0.5 mol/L NaOH,在研钵中将组织充分磨碎成糊后转入1.5mL离心管中,12,000 rpm离心6 min,取上清液5 µl加入495µL 0.1 mol/L Tris-HCl(pH=8.0)混合均匀,取1.0 µL作为PCR模板进行扩增。
巢式PCR扩增检测:以所提的DNA为模板,利用Ypt1基因通用引物ph1F/ph2R(ph1F:5'-CGACCATTGGCGTGGACTTT-3',Yph2R:5'-ACGTTC- TCGCAGGCGTATCT-3')进行巢式PCR第1轮扩增,扩增反应体系和反应程序如下:PCR反应体系25 µL,包括2×Taq PCR Master Mix(北京天根生化科技有限公司)12.5µL,10 µmol/L的ph1F /Yph2R引物各1.0µL,DNA模板1.0µL,用无菌超纯水补足至25 µL。扩增反应程序为:94℃预变性5min;94℃变性1 min、58℃退火30 S、72℃延伸1 min,35个循环,最后72℃延伸10 min。待第一轮PCR扩增结束后,取1.0μl 第一轮PCR扩增产物或扩增产物的稀释液为模板与苜蓿疫霉菌特异性引物PMF/PMR组合进行巢式PCR第2轮扩增。PCR反应体系25 µL,包括2×Taq PCR Master Mix(北京天根生化科技有限公司)12.5µL,10 µmol/L的PMF/PMR引物各1.0µL,第一轮PCR产物1.0µL,用无菌超纯水补足至25 µL。扩增反应程序为:94℃预变性5min;94℃变性1 min、57℃退火45 S、72℃延伸1 min,35个循环,最后72℃延伸10 min。
检测结果:取巢式PCR第2轮扩增产物5.0 µL用1.5%琼脂糖电泳分离,电压为4-5V/cm,电泳结束经溴化乙锭染色后于紫外灯下观察,根据扩增产物的有无及其片段大小对结果进行判断,如果能特异性地扩增出约225bp的产物,即可判断发病组织中带有苜蓿疫霉菌。检测结果(图3)表明,发病根部中可检测出苜蓿疫霉菌,而健康组织及阴性对照则无特异性条带出现,说明该套技术能用于植物组织中苜蓿疫霉菌的快速分子检测。
实施例4:土壤中苜蓿疫霉菌的检测
带菌土壤的制备:将供试的苜蓿疫霉菌转至黑麦培养基平板上,25℃黑暗培养,待菌丝长满平板后,用适量的无菌水将平板中的菌丝体洗下得到菌丝体悬浮液,用植物组织破碎机将菌丝悬浮液中的菌丝打碎,然后与适量土壤混合,混合后的土壤在室温下风干,得到携带苜蓿疫霉菌土壤。
带菌土壤基因组DNA的提取:采用Sigma公司的土壤DNA提取试剂盒(Sigma,DNB100,Soil DNA Isolation Kit)提取土壤中的总DNA,取1.0 µL作为PCR模板进行扩增。
巢式PCR扩增检测:以所提的DNA为模板,利用Ypt1基因通用引物ph1F/ph2R(ph1F:5'-CGACCATTGGCGTGGACTTT-3',Yph2R:5'-ACGTTC- TCGCAGGCGTATCT-3')进行巢式PCR第1轮扩增,扩增反应体系和反应程序如下:PCR反应体系25 µL,包括2×Taq PCR Master Mix(北京天根生化科技有限公司)12.5µL,10 µmol/L的ph1F /Yph2R引物各1.0µL,DNA模板1.0µL,用无菌超纯水补足至25 µL。扩增反应程序为:94℃预变性5min;94℃变性1 min、58℃退火30 S、72℃延伸1 min,35个循环,最后72℃延伸10 min。待第一轮PCR扩增结束后,取1.0μl 第一轮PCR扩增产物或扩增产物的稀释液为模板与苜蓿疫霉菌特异性引物PMF/PMR组合进行巢式PCR第2轮扩增。PCR反应体系25 µL,包括2×Taq PCR Master Mix(北京天根生化科技有限公司)12.5µL,10 µmol/L的PMF/PMR引物各1.0µL,第一轮PCR产物1.0µL,用无菌超纯水补足至25 µL。扩增反应程序为:94℃预变性5min;94℃变性1 min、57℃退火45 S、72℃延伸1 min,35个循环,最后72℃延伸10 min。
检测结果:取巢式PCR第2轮扩增产物5.0 µL用1.5%琼脂糖电泳分离,电压为4-5V/cm,电泳结束经溴化乙锭染色后于紫外灯下观察,根据扩增产物的有无及其片段大小对结果进行判断,如果能特异性地扩增出约225bp的产物,即可判断土壤样品中存在苜蓿疫霉菌。检测结果(图3)表明,带菌土壤中可检测出该菌,而高压灭菌的土壤及阴性对照则无特异性条带出现,说明该套技术能用于土壤中苜蓿疫霉菌的快速分子检测。
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
SEQUENCE LISTING
<110> 福建省农业科学院植物保护研究所
<120> 一种苜蓿疫霉菌巢式PCR检测方法
<130> 4
<160> 4
<170> PatentIn version 3.3
<210> 1
<211> 25
<212> DNA
<213> 人工序列
<400> 1
gtctacagtg gatttggatc tcttg 25
<210> 2
<211> 27
<212> DNA
<213> 人工序列
<400> 2
caaaatataa cagtaaagtt gagttcg 27
<210> 3
<211> 20
<212> DNA
<213> 人工序列
<400> 3
cgaccattgg cgtggacttt 20
<210> 4
<211> 20
<212> DNA
<213> 人工序列
<400> 4
acgttctcgc aggcgtatct 20
- 还没有人留言评论。精彩留言会获得点赞!