一种用于检测紫杉醇亚细胞分布动力学的方法及模型建立与流程
本发明属于药物筛选模型建立技术领域。更具体地,涉及一种用于检测紫杉醇亚细胞分布动力学的方法及模型建立,可应用于考察另一种化合物是否能够影响紫杉醇的细胞药动学过程,即其分布于细胞骨架的浓度是否提高。
背景技术:
药物代谢动力学是定量研究药物在生物体内吸收、分布、代谢、排泄规律的一门学科,贯穿于新药发现、临床前研究的整个过程。在药物研发过程中,药效差、毒性强以及药动学性质不理想是淘汰候选化合物的三个主要原因。相关调查显示,国际上临床研究淘汰的药物中,近 50% 研发失败的药物是由于其疗效不佳,而另约 40% 候选化合物最终不能进入临床研究是因为其药物代谢动力学特征不理想。
经典药物代谢动力学理论是建立在血浆药物浓度测定的基础上,认为血浆药物浓度与药效成正比,并通过建立房室模型等数学模型,求算相应的药代动力学参数后,描述或预测药物的体内过程。然而,越来越多的研究发现基于血浆药物浓度的经典药代动力学研究并不能完全解释药物在一些特定组织(如肿瘤、脑组织)中的药理学作用,常难以准确有效地预测体内药物的药效,出现药动学/药效学不相关的问题。目前已知很多药物的靶点位于细胞内,包括DNA、核受体、各种激酶、代谢酶等,所以这些药物必须穿过多重生物屏障,才能发挥药效。细胞内药物的处置过程及药物与靶点的结合是药物治疗效果的决定因素。因此,针对这些靶点位于细胞内的药物,研究其细胞/亚细胞器内的药物浓度比研究血浆药物浓度具有更重要的意义。
紫杉醇(PTX)作为广谱抗癌药,自1992年美国FDA批准上市以来,已广泛应用于某些常见恶性肿瘤,如非小细胞肺癌、卵巢癌和乳腺癌等。紫杉醇通过结合到微管蛋白,稳定微管聚合体,抑制微管解聚,抑制有丝分裂,从而抑制细胞分裂增殖。紫杉醇在细胞内起效,组织分布具有可饱和性,呈现非线性药代动力学特征。因此,测定血浆中紫杉醇的浓度不能准确反映药物在靶组织的浓度。此外,紫杉醇在靶组织浓度与细胞内浓度不相关。紫杉醇在细胞亚结构单位上的分布可以反映它结合到微管的能力,因此在亚细胞水平研究紫杉醇的分布很有意义。
目前,在亚细胞水平定量紫杉醇具有难度,因为在治疗相关剂量下,紫杉醇在细胞隔室中浓度低。目前,已有报道使用LC-MS/MS方法,测定用一定浓度紫杉醇孵育后的A549细胞隔室中紫杉醇的浓度。但是,该方法并未筛选出适当的孵育时间及孵育浓度,仅用于测定细胞隔室中紫杉醇浓度,不能有效地筛选出能够促进紫杉醇与微观结合的化合物。
技术实现要素:
本发明要解决的技术问题是克服上述现有技术的缺陷和不足,提供一种用于检测紫杉醇亚细胞分布动力学的方法,以及其筛选模型的建立。
本发明上述目的通过以下技术方案实现:
一种用于检测紫杉醇亚细胞分布动力学的方法及模型建立,包括如下步骤:
S1. 细胞培养;
S2. 对步骤S1的细胞进行不同时间点给药后收样;
S3. 对步骤S2收样得到的细胞进行细胞亚结构提取物的制备;
S4. 对步骤S3得到的提取物进行蛋白定量;
S5. 检测步骤S3得到的提取物的紫杉醇含量;
S6. 通过分析紫杉醇含量和蛋白定量的比值,筛选出合适的给药时间及紫杉醇浓度,建立检测紫杉醇亚细胞分布动力学的方法及模型。从而应用于考察另一种化合物是否能够影响紫杉醇的细胞药动学过程,即其分布于细胞骨架的浓度是否提高。
其中,优选地,步骤S1所述细胞培养为:取对数生长期细胞接种至细胞培养皿中,连续培养。
优选地,步骤S2是对S1连续培养过程中的细胞进行不同时间点给药后收样处理。
优选地,步骤S3步骤S3进行细胞亚结构提取物的制备时,根据细胞膜/细胞器、细胞质、细胞骨架、细胞核的蛋白溶解性不同,从细胞中提取不同细胞蛋白;且细胞贴壁培养,在提取细胞不同部分的过程中细胞依旧贴壁,防止提取过程中四部分混合。
具体地,是利用ProteoExtract® Subcellular Proteome Extaction Kit 试剂盒进行细胞亚结构提取物的制备。
优选地,步骤S4是利用BCA蛋白定量分析试剂盒对步骤S3得到的提取物进行蛋白定量。
优选地,步骤S5是利用UPLC-MS/MS方法检测步骤S3得到的提取物的紫杉醇含量。
其中所述UPLC-MS/MS 方法的具体步骤为:首先配制紫杉醇标准系列溶液和内标多西紫杉醇工作溶液,然后待测样本经过预处理后,上样进行UPLC-MS/MS分析。
UPLC-MS/MS的条件为:使用超高效液相-串联四极杆质谱的 SRM 模式测定。
UPLC-MS/MS分析时,是以Waters ACQUIT YUPLCTM BEH C18 (2.1 mm×50 mm,1.7 μm) 色谱柱进行分离。
UPLC-MS/MS分析时,以甲醇:0.1%甲酸 (80:20,v/v) 流动相进等度洗脱。
所述待测样本的预处理方法为:
待测样本100μL,加入10μL内标多西紫杉醇工作溶液,涡旋10s 混匀,加入叔丁基甲醚400 μL,涡旋1min,室温静置5min,然后14000rpm 4℃离心5min,吸取有机层,室温下通风挥干,加入100μL 10mM 醋酸铵:甲醇(1:1,v/v)溶液溶解,涡旋1min,14000rpm,4℃,离心5min,取上清液。上清液80μL置进样瓶中,10μL上样分析。
本文应用UPLC-MS/MS 方法,具有很高的灵敏度,可以用于测定低浓度的紫杉醇,测定了用一定浓度紫杉醇处理后A549细胞隔室中紫杉醇的浓度。
另外,优选地,步骤S1所述细胞为非小细胞肺癌A549细胞株。
本发明所筛选出来的最适给药时间为:5min、10min、20min、0.5h、1h、1.5h、2h、3h。即连续培养72h后的给药时间,即分别在给药5min、10min、20min、0.5h、1h、1.5h、2h、3h后收样。
本发明所筛选出来的最适紫杉醇浓度为0.1μg/mL。
本发明可应用于考察另一种化合物是否能够影响紫杉醇的细胞药动学过程,即考察某化合物是否能够影响紫杉醇分布于细胞骨架的浓度,具体的方法为:细胞培养72h后,分别进行两种给药方式:(1)0.1μg/mL紫杉醇,(2)0.1μg/mL紫杉醇和10μg/mL某化合物;然后按照不同时间点5min、10min、20min、0.5h、1h、1.5h、2h、3h,同一时间收样处理,进行细胞亚结构提取物的制备,进行UPLC-MS/MS分析紫杉醇含量,利用0.1μg/mL紫杉醇和10μg/mL某化合物处理后紫杉醇在细胞亚结构提取物中随时间分布变化图与单独给药0.1μg/mL紫杉醇处理后紫杉醇在细胞亚结构提取物中随时间分布变化图相比较,分析紫杉醇在细胞骨架的分布有无提高,即可说明待测某化合物是否可提高紫杉醇在细胞骨架的分布。
本发明具有以下有益效果:
本发明所涉及的细胞/亚细胞水平药代动力学可以更加准确的反映药物在作用靶点上的浓度,即紫杉醇在细胞微管的结合分布水平,直观的反映紫杉醇的药效。
本发明可用于考察另一种化合物是否能够影响紫杉醇的细胞药动学过程,即其分布于细胞骨架的浓度是否提高。对于提高紫杉醇生物利用度具有重要意义。筛选方法简单,易于操作。
附图说明
图1是A549细胞用0.5μg/mL PTX 处理后各细胞亚结构中紫杉醇浓度的变化图。
图2是A549细胞用0.01μg/mL PTX 处理后在四部分提取物中随时间分布变化图。
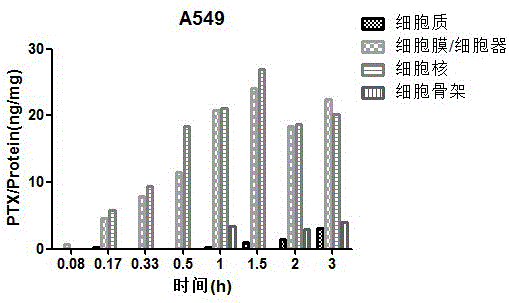
图3是A549细胞用0.1μg/mL PTX 处理后紫杉醇在四部分提取物中随时间分布变化图。
图4是A549细胞用 1μg/mL PTX 处理后紫杉醇在四部分提取物中随时间分布变化图。
图5是A549细胞用0.1μg/mL紫杉醇+10μg/mL金松双黄酮处理后紫杉醇在四部分提取物中随时间分布变化图。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。
实施例1 细胞培养
1、取A549细胞(人非小细胞肺癌细胞A549细胞株),在配制好的 DMEM 培养基(高糖型)中,在100mm培养皿中连续培养(5% CO2、37℃ 培养箱)。
2、取对数生长期细胞,弃培养基,用2mL PBS冲洗培养皿,用2mL胰酶消化3min后,加入4mL培养基终止反应,之后1000rpm离心3min,弃上清,加2mL 培养基混匀之后加入到含有20mL培养基的离心管中稀释,按 1×106 个/每皿细胞的密度种到直径 60mm的细胞培养皿中,加培养基到4mL,放置在培养箱中培养72小时。
实施例2 药物处理及细胞亚结构提取物的制备
1、实施例1中细胞培养72h 后,进行如下实验:
实验一:按照不同时间点(5min、10min、20min、0.5h、1h、1.5h、2h、3h、4h)给药紫杉醇,0.5μg/mL;
实验二:按照不同时间点(5min、10min、20min、0.5h、1h、1.5h、2h、3h)分别给药紫杉醇,0.01μg/mL、0.1μg/mL、1μg/mL;
实验三:按照不同时间点(5min、10min、20min、0.5h、1h、1.5h、2h、3h)给药,0.1μg/mL紫杉醇+10μg/mL金松双黄酮(Sci),同一时间收样处理。
2、根据亚细胞部分(细胞膜/细胞器、细胞质、细胞骨架和细胞核)的蛋白溶解性不同,通过ProteoExtract® Subcellular Proteome Extaction Kit 试剂盒从 A549 细胞中提取不同细胞蛋白。细胞贴壁培养,在提取细胞不同部分的过程中细胞依旧贴壁,防止提取过程中四部分混合。
按照试剂盒说明书,提取过程为:
(1)细胞质部分的制备:用 400μL 提取缓冲液Ⅰ 孵育细胞,4℃ 摇床振荡 10min,转移至 1.5mL EP管;
(2)细胞膜/细胞器部分的制备:用 400μL 提取缓冲液Ⅱ孵育细胞,4℃ 摇床振荡 30min,转移至 1.5 mL EP管;
(3)细胞核部分的制备:用 200μL 提取缓冲液Ⅲ孵育细胞,4℃ 摇床振荡 10min,转移至 1.5mL EP管;
(4)细胞骨架部分的制备:用 200μL 提取缓冲液Ⅲ孵育细胞,4℃ 摇床振荡 5min,转移至 1.5mL EP管。
3、制备的样品然后经超声(4×30s on half-power),9000×g,4℃ 离心20min,上清分装100μL 于新的 EP 管,置于 -80℃ 冰箱,用于 UPLC – MS/MS 检测各部分紫杉醇含量,上清剩余部分进行蛋白含量测定。
4、空白样品的制备:A549细胞(106)培养三天,弃去培养基,加入 wash buffer 2mL,用细胞刷将细胞刮下,按上述步骤处理,用于方法确证中。置于-80℃ 储存。
实施例3 蛋白含量测定
使用BCA蛋白定量分析试剂盒对上述实施例2的各细胞亚结构提取物进行蛋白定量:
(1)取上述上清14μL 加入含有 100μL PBS 的 EP 管中,涡旋混匀;
(2)取 96 孔酶标板,每个样本加2 个复孔,再加入200μL 双缩脲试剂 AB 液/孔(A:B = 50:1);
(3)37℃ 孵育 30 min,除去气泡,用酶标仪检测蛋白含量。
实施例4 紫杉醇的检测
1、溶液配制
(1)紫杉醇储备液
称取0.560mg 紫杉醇对照品,加入到25mL 容量瓶中,用甲醇溶液稀释,定容到刻度,配制成22.4μg/mL 的紫杉醇储备液。
(2)标准系列溶液
取紫杉醇储备液适量,用甲醇梯度稀释为浓度为 8.75、17.5、35、70、140、280、560、1120ng/mL 与 0.3、0.6、1.2、2.4、4.8、9.6、19.2、38.4、76.8ng/mL 的紫杉醇标准系列溶液。
(3)内标多西紫杉醇储备液及工作溶液
称定25.0mg多西紫杉醇对照品,转移至25mL容量瓶中,加甲醇溶解,并用甲醇稀释、定容到刻度,配制成1mg/mL多西紫杉醇的储备液,取适量多西紫杉醇储备液用甲醇稀释成浓度为 2μg/mL的内标工作溶液。
2、样品的预处理
待测样本100μL,置于1.5mL EP管中,加入10μL内标溶液(多西紫杉醇),涡旋10s 混匀,加入叔丁基甲醚400 μL,涡旋1min,室温静置5min,14000rpm,4℃,离心5min,吸取有机层至另一干净离心管中,室温下放置通风厨中挥干,加入100μL 10mM 醋酸铵:甲醇(1:1,v/v)溶液溶解,涡旋1min,14000rpm,4℃,离心5min,取上清液80μL置进样瓶中,10μL上样分析。
3、UPLC-MS/MS测定方法和条件
UPLC-MS/MS条件:使用超高效液相-串联四极杆质谱的 SRM 模式测定。以 Waters ACQUIT YUPLCTM BEH C18 (2.1 mm×50 mm,1.7 μm) 色谱柱进行分离,以甲醇:0.1%甲酸 (80:20,v/v) 流动相进等度洗脱。
4、紫杉醇在细胞亚结构提取物中浓度的测定
根据所建立的 UPLC-MS/MS 分析方法,进样进行定量测定,结果分别如附图1~5所示。
图1是A549细胞用0.5μg/mL PTX 处理后各细胞亚结构中紫杉醇浓度的变化图。结果显示,在各细胞亚结构中紫杉醇浓度均在1h之前达到峰值,时间在 3h 之后基本到了继续下降没有新的变化趋势,因此选择时间点:5min、10min、20min、0.5h、1h、1.5h、2h、3h 作为该检测模型时间点。
图2、图3、图4分别是A549细胞用0.01μg/mL、0.1μg/mL、1μg/mL PTX 处理后在四部分提取物中随时间分布变化图。结果显示,比较包括图1在内的四种不同浓度紫杉醇处理后各细胞亚结构中紫杉醇浓度变化情况,可以看出用0.5 μg/mL紫杉醇处理细胞组细胞的药动学过程最为理想,紫杉醇在微管中浓度最高。抗有丝分裂药物可以通过减少微管蛋白的溶解性、引起蛋白从细胞质(可溶性)到细胞骨架(不溶性)的再分布稳定微管,测得的分布结果与上述理论一致。微管蛋白是细胞骨架的动态结构成分,因此紫杉醇结合到细胞骨架聚合的微管的量可以反映紫杉醇对微管聚合的作用。由于该模型用于考察另一种化合物能否提高紫杉醇在细胞骨架的分布,所以最终选择0.1μg/mL作为给药浓度。
图5是A549细胞用0.1μg/mL紫杉醇+10μg/mL金松双黄酮处理后紫杉醇在四部分提取物中随时间分布变化图。对比图3可看出,紫杉醇在细胞骨架的分布明显提高,即说明金松双黄酮可提高紫杉醇在细胞骨架的分布。
- 还没有人留言评论。精彩留言会获得点赞!