干扰素调节因子6及其抑制剂在脑卒中疾病中的应用的制作方法
本发明属于基因的功能与应用领域,特别涉及IRF6作为药物靶标在筛选治疗缺血性脑卒中的药物中应用,以及IRF6的抑制剂在制备预防、缓解和/或治疗缺血性脑卒中疾病的药物中应用。
背景技术:
脑卒中是一种突然起病的脑血液循环障碍性疾病,目前已成为世界范围内首要致死和致残的原因[1,2]。脑卒中大体可分成两大类:缺血性脑卒中,约占70%~80%%;出血性脑卒中,约占20%~30%[3]。缺血性脑卒中是由于血栓或栓子阻塞了脑大血管或其分支,导致的永久性或暂时性脑组织缺血缺氧损伤,目前是全球第四大致死因素及第二大致残因素,其发后数分钟至数小时内即出现不可逆转的脑损伤,对患者的生命和健康造成严重危害。
缺血性脑卒中的病理生理改变主要涉及以下几个因素:兴奋性中毒、Ca2+离子超载、氧化应激、炎症、凋亡和梗死周边区去极化。在缺血性卒中发生后,脑组织由于能量代谢障碍而导致兴奋性氨基酸如谷氨酸大量且迅速的释放,并伴有兴奋性氨基酸的再摄取障碍。大量聚集的谷氨酸过度激活一系列下游的信号通路,包括钙超载、活性氧的产生。活性氧物质会导致脂质过氧化、线粒体和DNA损伤、激活或抑制许多炎症反应、细胞凋亡、细胞坏死相关的信号通路[4]。与此同时,缺血的脑组织会释放损伤相关模式分子如热休克蛋白、ATP、硫酸乙酰肝素、DNA、RNA等,进而在趋化因子和粘附分子的调节下产生无菌性炎症反应[5,6]。缺血性脑卒中其病因可分为以下5类:大动脉粥样硬化、心源性、穿支动脉疾病、其他病因、病因不确定[7]。多数研究认为,恢复脑组织供血是治疗脑缺血最有效的方法。1996年起组织纤溶酶原激活剂(tPA)即批准用于缺血性脑卒中治疗,迄今为止其仍然是美国药监局(FDA)唯一审核通过的溶栓药物。阐明脑卒中发生后较长一段时间内促进或保护脑组织损伤的分子机制对于研究有效的卒中治疗靶点或者策略具有重要意义。
IRF家族是一大类对IFN起调控作用的转录因子。IRF家族有10个成员,其中,IRF1-9普遍表达于哺乳动物中,IRF10则特异性地在鸟类和鱼类中表达[8,9]。在结构上,IRF家族成员的N末端含有相对保守的DNA结合结构域(DNA binding domain,DBD),C末端包含有IRF相关结构域(IRF associateddomain,IAD)、自我抑制结构域、磷酸化位点等,提示着IRF家族成员生物学功能的统一性和特异性[10]。IRF家族在天然免疫网络中起着重要调控作用,IRF6虽然在结构上与IRF家族其他成员类似,但是IRF6在天然免疫上的功能知之甚少,甚至大量的研究认为IRF6与天然免疫没有关系。目前关于IRF6的研究主要集中在调控上皮细胞的成熟分化方面,并且IRF6执行其生物学功能都通过非免疫依赖的方式实现的[11,12]。但是,IRF6能否通过非免疫依赖的方式调节神经系统疾病,特别是缺血性脑卒中尚不清楚。
参考文献:
[1]Mozaffarian D,Benjamin E J,Go A S,et al.Heart Disease and Stroke Statistics-2016Update:A Report From the American Heart Association[J].Circμlation.2016,133(4):e38-e360.
[2]Rothwell P M,Algra A,Amarenco P.Medical treatment in acute and long-term secondary prevention after transient ischaemic attack and ischaemic stroke[J].Lancet.2011,377(9778):1681-1692.
[3]中华医学会神经病学分会,中华医学会神经病学分会脑血管病学组.中国急性缺血性脑卒中诊治指南2014[J].中华神经科杂志.2015,48(4):246-257.
[4]Chamorro A,Dirnagl U,Urra X,et al.Neuroprotection in acute stroke:targeting excitotoxicity,oxidative and nitrosative stress,and inflammation[J].Lancet Neurol.2016,15(8):869-881.
[5]Chen G Y,Nunez G.Sterile inflammation:sensing and reacting to damage[J].Nat Rev Immunol.2010,10(12):826-837.
[6]Gelderblom M,Leypoldt F,Steinbach K,et al.Temporal and spatial dynamics of cerebral immune cell accumμlation in stroke[J].Stroke.2009,40(5):1849-1857.
[7]Adams H J,Bendixen B H,Kappelle L J,et al.Classification of subtype of acute ischemic stroke.Definitions for use in a mμlticenter clinical trial.TOAST.Trial of Org 10172in Acute Stroke Treatment[J].Stroke.1993,24(1):35-41.
[8]Zhang X J,Zhang P,Li H.Interferon regμlatory factor signalings in cardiometabolic diseases[J].Hypertension.2015,66(2):222-247.
[9]Li S,Lu L F,Feng H,et al.IFN regμlatory factor 10is a negative regμlator of the IFN responses in fish[J].J Immunol.2014,193(3):1100-1109.
[10]Chen W,Royer W J.Structural insights into interferon regμlatory factor activation[J].Cell Signal. 2010,22(6):883-887.
[11]Moretti F,Marinari B,Lo I N,et al.A regμlatory feedback loop involving p63and IRF6links the pathogenesis of 2genetically different human ectodermal dysplasias[J].J Clin Invest.2010,120(5):1570-1577.
[12]Restivo G,Nguyen B C,Dziunycz P,et al.IRF6is a mediator of Notch pro-differentiation and tumour suppressive function in keratinocytes[J].EMBO J.2011,30(22):4571-4585.
技术实现要素:
为解决临床防治脑卒中疾病现有技术的缺陷和不足,本发明的目的是确定IRF6基因的表达与脑卒中疾病之间的相互关系。提供一种以IRF6作为药物靶标在筛选防治脑卒中疾病的药物中的应用,进而提供一种IRF6的抑制剂在制备预防、缓解和/或治疗脑卒中疾病的药物中的应用。
本发明的目的通过下述技术方案实现:
本发明以神经元特异性IRF6基因敲除小鼠以及IRF6基因过表达小鼠为实验对象,通过小鼠大脑中动脉缺血再灌注损伤造成脑卒中模型,研究IRF6基因与脑卒中的关系,结果表明与野生型小鼠(对照组)相比,IRF6基因敲除小鼠梗死体积明显降低,神经功能明显好转,死亡神经细胞数量减少;IRF6基因过表达小鼠梗死体积明显增加,神经功能明显恶化,死亡神经细胞数量增多。体外细胞实验表明,腺病毒介导的IRF6干扰可保护原代皮层神经元细胞由缺氧/复氧导致的损伤,抑制神经元细胞凋亡。这提示IRF6具有恶化神经功能的作用,能加重促进脑卒中的发展,将为研究预防、缓解和/或治疗脑卒中疾病的新靶点和新策略提供了理论依据和临床基础。
因此,IRF6基因可作为药物靶点,构建IRF6基因过表达的体外细胞模型或动物模型,用于筛选预防、缓解和/或治疗脑卒中疾病的药物;IRF6基因也可作为基因治疗中的靶基因,设计并制备预防、缓解和/或治疗脑卒中疾病的药物和/或生物学试剂,通过基因工程技术达到预防、缓解和/或治疗脑卒中疾病的目的。例如以IRF6为靶基因,设计可干扰IRF6表达的双链siRNA,通过化学方法合成以后,注射入人体通过RNA干扰的方法使IRF6基因沉默来治疗脑卒中疾病;还可以设计并构建IRF6的突变体,注射后进入细胞,竞争IRF6原形的作用底物,从而抑制IRF6的功能,起到治疗目的;此外,还可以以IRF6为靶点设计小分子化合物抑制剂,利用IRF6基因过表达的体外细胞模型或动物模型,通过筛选,发现其中能够特异性抑制IRF6的分子,从而为脑卒中疾病的治疗提供新的治疗策略。
针对IRF6的上述功能,提供IRF6作为药物靶标在筛选保护神经功能的药物中的应用。
针对IRF6的上述功能,提供IRF6作为药物靶标在筛选预防、缓解和/或治疗脑卒中疾病的药物中的应用。
针对IRF6的上述功能,提供IRF6的抑制剂在制备保护神经功能的药物中的应用。
针对IRF6的上述功能,提供IRF6的抑制剂在制备治疗脑卒中疾病的药物中的应用。
一种预防、缓解和/或治疗脑卒中疾病的药物,包含IRF6的抑制剂。
所述的IRF6的抑制剂优选为IRF6基因的siRNA、IRF6基因的RNA干扰载体,IRF6的抗体及其他能够抑制IRF6表达的抑制剂。
本发明相对于现有技术具有如下的优点及效果:
(1)本发明发现IRF6的新功能,即IRF6具有恶化脑卒中疾病的作用。
(2)基于IRF6在恶化脑卒中疾病中的功能,其为研制预防、缓解和/或治疗脑卒中疾病的药物提供靶标。
(3)IRF6的抑制剂可用于制备预防、缓解和/或治疗脑卒中疾病的药物。
附图说明
图1是神经元特异性IRF6转基因小鼠和神经元特异性IRF6敲除小鼠的构建及鉴定结果图
A为神经元特异性IRF6转基因小鼠的构建图;
B为神经元特异性IRF6转基因小鼠的鉴定结果图;
C为神经元特异性IRF6敲除小鼠的构建图;
D为神经元特异性IRF6敲除小鼠的鉴定结果图;
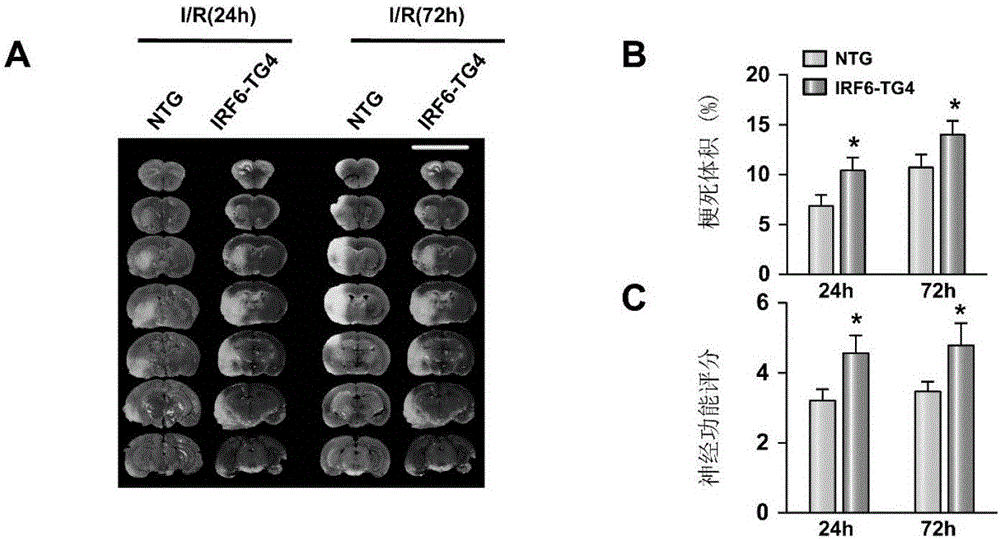
图2是NTG小鼠和IRF6-TG4小鼠大脑缺血/再灌注损伤严重程度的评估结果图(*:p<0.05vs NTG对照组)
A为TTC染色结果图;
B为脑梗体积统计柱状图;
C为神经功能评分统计柱状图;
图3是IRF6flox/flox和IRF6-KO小鼠大脑缺血/再灌注损伤严重程度的评估结果图(*:p<0.05vs IRF6flox/flox对照组)
A为TTC染色结果图;
B为脑梗体积统计柱状图;
C为神经功能评分统计柱状图;
图4是NTG和IRF6-TG4小鼠Fluoro Jade B小鼠的脑组织梗死周边区神经元细胞凋亡情况测定结果图(*:p<0.05vs NTG组)
A为Fluoro Jade B检测显示图和统计结果图;
B为TUNEL细胞凋亡图和统计结果图;
图5是IRF6flox/flox和IRF6-KO小鼠Fluoro Jade B小鼠的脑组织梗死周边区神经元细胞凋亡情况测定结果图(*:p<0.05vs IRF6flox/flox组)
A为Fluoro Jade B检测显示图和统计结果图;
B为TUNEL细胞凋亡图和统计结果图;
图6为经腺病毒AdshIRF6转染后OGD处理的原代皮层神经元细胞相对活性和乳酸脱氢酶释放的结果图(*:p<0.05vs AdshRNA组)
A为神经元细胞相对活性检测结果图;
B为乳酸脱氢酶释放检测结果图。
具体实施方式
通过以下详细说明结合附图可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。
实验用动物及饲养
实验动物:选用雄性,8-12周龄,体重在24-27g,背景为C57BL/6的野生型小鼠(WT,购自北京华阜康生物科技有限公司,质量合格证号:949431)、神经元特异性IRF6转基因小鼠(IRF6-TG,由武汉大学李红良教授实验室构建)、非转基因小鼠(NTG,同窝对照非转基因小鼠)、IRF6flox/flox小鼠(IRF6flox/flox,由武汉大学李红良教授实验室构建)及神经元特异性IRF6基因敲除(IRF6-KO)小鼠(由IRF6flox/flox小鼠与CaMKIIα-Cre(购自Jackson Laboratory,Stock No.005359)小鼠杂交得到)为实验对象。
(1)神经元特异性IRF6转基因小鼠的构建过程(构建策略见图1A):
载体构建:用上游引物:5’-GCTCTAGAGCCACCATGGCCCTCCACCCCC -3’;下游引物:5’-GCTCTAGATTACTGGGGAGGCAGGGC-3’扩增小鼠IRF6基因(NCBI,Gene ID:54139,NM_006147.3)cDNA,把扩增的IRF6基因cDNA和pCAG-CAT-LacZ载体(北京协和医学院基础学院杨青林老师实验室提供,制备过程参见参考文献:Kim T,Zhelyabovska O,Liu J,et al.Generation of an Inducible,Cardiomyocyte-Specific Transgenic Mouse Model with PPAR b/d Overexpression[J].Peroxisome Proliferator-Activated Receptors(PPARs),57.)经限制性内切酶XbaI(NEB,R0145L)酶切后连接,形成pCAG-loxP-CAT-loxP-IRF6-hGHpA载体。IRF6的表达由CAG启动子驱动得到。将构建的载体通过显微注射构造成受精胚胎(C57BL/6J背景),得到IRF6-floxed转基因小鼠。神经元特异性IRF6转基因小鼠由IRF6-floxed转基因小鼠和CaMKIIα-Cre小鼠杂交繁殖得到。
通过蛋白质印迹法(Western Blot)实验检测不同转基因鼠脑组织中IRF6蛋白的表达量:提取不同转基因鼠脑组织蛋白,通过聚丙烯酰胺凝胶电泳(SDS-PAGE),验证IRF6过表达。我们构建了几株神经元特异性IRF6转基因小鼠(IRF6-TG2、3、4、6),在不同转基因小鼠体内IRF6蛋白表达含量相对于NTG小鼠有不同程度提高(图1B)。为了反映病理生理状态下IRF6的改变,我们选择了IRF6-TG4小鼠进行实验,Western Blot及定量分析显示,其脑组织中IRF6表达量约为正常组织3.12倍。
(2)神经特异性IRF6基因敲除小鼠的构建(构建策略见图1C):
利用CRISPR-Cas9技术构建神经特异性IRF6基因敲除小鼠。首先,通过在线CRISPR设计工具(http://crispr.mit.edu)分别在内含子2和3中各设计一个CRISPR的打靶位点,靶序列分别为:
IRF6 sgRNA1:GAATTGAGTTATTGGGCACCTGG
IRF6 sgRNA2:GTCTGGGGCGACATTGTACAGCAGG
此外还设计了一个用于同源修复的供体质粒,它包括两侧同源臂它包括两侧同源臂、中间的外显子3以及两个同向的loxp序列。
①打靶载体的构建:分别将sgRNA1和sgRNA2对应的两条引物融合成双链DNA,然后用T4 DNA连接酶连入经过限制性内切酶XbaI处理过的pUC57-sgRNA(Addgene 51132)载体中。该载体上游有一个T7启动子,可以用于后续的体外转录实验。
②条件性敲除骨架载体pBluescript SK(+)-2loxp的构建:
分别合成4条寡聚单链核苷酸序列:
loxp1-F:
AGCTTGACGTCATAACTTCGTATAGCATACATTATAGCAATTTATACCGGTGAT;
loxp1-R:
ATCACCGGTATAAATTGCTATAATGTATGCTATACGAAGTTATGACGTCA;
loxp2-F:
GATCCCTTAAGATAACTTCGTATAGCATACATTATAGCAATTTATACGCGTA;
loxp2-R:
CTAGTACGCGTATAAATTGCTATAATGTATGCTATACGAAGTTATCTTAAGG;
上述寡核苷酸序列退火后形成loxp1和loxp2两条双链。将pBluescript II SK(+)载体用HindIII(NEB,R0104L)和EcoRV(NEB,R0195L)双酶切后连接入loxp1退火双链,再将测序正确的载体用BamHI(NEB,R0136L)和SpeI(NEB,R0133L)双酶切,连接入loxp2退火双链,得到条件性敲除骨架载体,命名为pBluescript SK(+)-2loxp。
③供体载体(Donor Vector)的构建:根据引物设计原则,设计如下引物(表1),以小鼠gDNA为模板,扩增供体载体的左右同源臂(LA和RA)以及中间的外显子部分(M)。上述扩增得到的产物及pBluescript SK(+)-2loxp载体经表1中所示限制性内切酶酶切后一一连接,得到供体载体。
表1构建供体载体所需引物序列及对应酶切位点
④打靶载体的转录:对CRIPR/Cas9系统包含的两个部分(负责切割作用的Cas9蛋白和引导Cas9蛋白定位到靶位点的gRNA)分别进行转录。对于Cas9蛋白,将其表达载体pST1374-Cas9(Addgene 44758)用PmeI进行酶切,以纯化后回收线性化质粒为转录模板,用T7mMESSAGE mMACHINE试剂盒(AM1345,Ambion)进行体外转录,获得加帽的mRNA产物。并用Poly(A)Tailing试剂盒(Ambion)对上述产物加尾,获得成熟的mRNA产物;对于sgRNA,使用MEGAshortscriptTM Kit(AM1354,Ambion公司)进行体外转录。将转录得到的Cas9和sgRNA的mRNA使用miRNeasy Micro Kit(Qiagen,217084)进行纯化。
⑤IRF6flox/flox条件性敲除小鼠的制作
将上述成熟的mRNA产物与供体质粒一同注入小鼠受精卵中,移植到代孕母鼠体内进行培育。得到的小鼠进行鉴定。取出生一周后的小鼠脚趾或尾部组织,提取基因组,并通过PCR方法筛选阳性首建鼠。从确定发生同源重组的小鼠中随机挑选一只作为F0代进行后续的繁殖,最终获得IRF6flox/flox纯合小鼠。
⑥神经特异性IRF6基因敲除小鼠的制作
将上述IRF6flox/flox小鼠与神经细胞特异性CaMKIIα-Cre转基因小鼠交配,筛选得到IRF6flox/flox/CaMKIIα-Cre小鼠,待该小鼠长至6周龄左右后,腹腔注射Tamoxifen,诱导Cre酶的表达,Cre酶特异性的识别两个同向的loxp,并切除两者之间的序列及其中的一个loxp,最后得到神经细胞特异性IRF6基因敲除小鼠。
通过蛋白质印迹法(Western Blot)实验检测肝细胞特异性IRF6基因敲除小鼠脑组织中IRF6蛋白的表达量:提取脑、脂肪、肺、肾脏组织蛋白,通过聚丙烯酰胺凝胶电泳(SDS-PAGE),验证IRF6表达,结果见图1D,在小鼠脂肪、肺、肾脏组织中,WT型小鼠和基因敲除小鼠IRF6蛋白表达含量变化不大,而在脑组织中,相比于WT型小鼠,基因敲除小鼠IRF6蛋白表达含量明显降低。
饲养环境:所有实验小鼠均饲养在武汉大学SPF级实验动物中心。SRF级小鼠饲料购自北京华阜康生物科技有限公司。饲养条件:室温在22-24℃之间,湿度在40-70%之间,明暗交替照明时间为12h,自由饮水摄食。
【实施例1】小鼠脑梗死模型获得
1.实验动物分组:小鼠脑梗死模型由大脑中动脉缺血再灌注(I/R)获得。动物被随机分为4组,每组10只小鼠,分别为对照组:非转基因同窝对照I/R术组(NTG I/R)、IRF6flox/flox I/R术组(IRF6flox/flox I/R)以及神经元特异性IRF6转基因I/R术组(IRF6-TG4I/R)、神经元特异性IRF6基因敲除I/R术组(IRF6-KO I/R)
2.线栓法脑梗死I/R手术MCAO(middle cerebral artery occlusion,大脑中动脉闭塞)模型操作流程:
(1)抓取小鼠,使用3%异氟烷麻醉小鼠,8%硫化钠脱去颈部的鼠毛,颅顶鼠毛用手术剪迅速剪掉,3%活力碘消毒颈部及颅顶皮2次,75%酒精脱碘1次。
(2)在小鼠的颅顶部位横向切口,暴露颅骨,用镊子轻轻剥离颅骨表面的结缔组织。将激光多普勒血流仪的光纤探头用生物胶固定在前囟后方2mm、左侧5mm的部位。
(3)将小鼠仰卧固定,颈正中线切口,沿胸锁乳突肌内缘分离肌肉和筋膜,分离左侧颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA)。用微动脉夹暂时夹闭ICA、CCA,在ECA远心端结扎和剪一小口,将线栓由剪口送入ICA,当线栓进入深度在9-11mm左右至血流下降遇阻力停,整个过程必须维持小鼠的肛温在37±0.5℃。
(4)从线栓进入脑血管至血流下降遇阻力时开始计时,45min后将线栓拔出,并将ECA近心端结扎,迅速松开CCA处动脉夹。注意观察血流恢复情况,选择血流下降75%以上,血流恢复达70%以上的小鼠纳入实验。
(5)缝合小鼠颈部及头部皮肤,并用活力碘消毒伤口。手术结束后,将小鼠放在温箱中,箱温维持在28℃,给水和饲料,分别在24h、72h取材。
【实施例2】小鼠脑梗死模型脑梗死体积测定
脑缺血/再灌注损伤严重程度的评估指标主要包括大脑梗死体积和神经功能评分,这些指标均与缺血/再灌注损伤严重程度正相关。
(1)分别在手术后24h、72h取材前进行神经功能及行为学评分;
基于Berderson神经功能评分改进方法(9分制):
0分:无神经受损的症状;
1分:提尾时对侧前肢蜷曲,或者不能完全到达患侧前肢;
2分:提尾时对侧肩膀内收;
3分:平推:向对侧推动时阻力下降;
4分:可自发的向各个方向运动,但在脱尾巴时只向对侧转弯;
5分:自发运动时转圈或只向对转;
6分:无自主运动,只在刺激时运动;
7分:无自主运动,刺激时也无运动;
8分:与脑缺血有关的死亡。
(2)抓取小鼠,腹腔注射3%戊巴比妥钠麻醉小鼠,取脑。
(3)将取下的脑组织放入1mm小鼠脑模,置于-20℃冰箱冻存。
(4)脑组织2,3,5-三苯基氯化四氮唑(2,3,5-Triphenyltetrazolium chloricej,TTC)染色:从-20℃冰箱取出脑组织,立即切成1mm厚的切片,共切7片。将切片立即置于10mL 2%TTC溶液中,37℃恒温孵育10min。正常脑组织染色后呈鲜红色,而梗死区呈苍白色。
(5)用10%中性福尔马林溶液固定脑组织切片,大体拍照。
(6)脑梗体积计算(Image-Pro Plus 6.0软件):梗死体积%=(对侧大脑半球体积-梗死侧未梗死体积)/(对侧大脑半球体积×2)×100%;
总梗死体积为各自7张大脑切片结果数据之和。
TTC是脂溶性光敏感复合物,它是呼吸链中吡啶-核苷结构酶系统的质子受体,与正常组织中的脱氢酶反应而呈红色,而缺血组织内脱氢酶活性下降,不能反应,呈苍白色。
NTG、IRF6-TG4组TTC染色结果如图2A所示,经过I/R缺血45min再灌注24小时后IRF6-TG4小鼠梗死体积较对照组小鼠增加,且在I/R术后72小时仍然持续(图2B);且I/R组IRF6-TG4小鼠神经功能评分在术后24小时、72小时均比对照组小鼠高(图2C)。相反的,IRF6-KO小鼠I/R术后24h、72h梗死体积较对照组小鼠均降低(图3A、B),神经功能评分也比对照组小鼠低(图3C)。这一结果表明IRF6基因的缺失可减少缺血再灌注损伤引起的脑卒中小鼠的大脑梗死体积,可保护神经功能,即IRF6基因对缺血再灌注损伤引起的脑卒中小鼠的大脑梗死以及神经功能损伤具有恶化作用。
【实施例3】脑组织梗死周边区神经元细胞凋亡情况测定
1.脑组织冰冻切片制备
(1)抓取小鼠,腹腔注射3%戊巴比妥钠麻醉小鼠。
(2)开胸暴露心脏,用注射针头穿刺入左心室,同时剪开右心房。
(3)用PBS(0.01M,pH 7.4)100mmHg压力灌流至肝脏变白后,用4%多聚甲醛灌流15min。
(4)开颅迅速取出小鼠大脑,室温4%多聚甲醛后固定6-8h。
(5)切除脑组织的嗅球和小脑,再延正中线将大脑分为先后两个部分,用先前的固定液再固定15min。
(6)随后浸没于含30%蔗糖的PBS(0.01M,pH 7.4)中,4℃冰箱沉底过夜。
(7)30%蔗糖与OCT包埋剂按1:1(v/v)混合后,倒适量到包埋框中,将前一步的组织取出,在纱布上吸去液体后在该包埋框中浸泡一会儿,再将其转入到先已加入2滴OCT的另一个包埋框中,调整组织的位置,使其正好位于包埋框的正中。
(8)将盛组织的包埋框,移入干冰中,尽量使其处于水平位,稍待一会儿后,继续加入OCT,浸没组织一定的高度,待OCT凝固后,将其储存于-80℃的冰箱中。
(9)用冰冻切片机的标准程序切5μm的冰冻切片备用。
2.FJB(Fluoro Jade B)染色
(1)将冰切组织切片在烘箱中烘干1小时;
(2)1%NaOH+80%无水乙醇5min;
(3)70%无水乙醇2min;
(4)ddH2O 2min;
(5)Flouro Jade B稀释液(AG310,Millipore,Billerica,MA),室温,避光20min;
(6)ddH2O 1min×3;
(7)在烘箱中烘片5-10min;
(8)二甲苯>1min;
(9)封片,拍照。
3、TUNEL试剂盒染色检测凋亡
用TUNEL试剂盒染色检测凋亡。(TUNEL试剂盒: Plus In Situ Apoptosis Fluorescein Detection Kit(S7111,Chemicon)):
(1)将冰切组织切片置于(pH 7.4)1%的多聚甲醛中,室温固定水解10分钟;
(2)PBS洗两次,每次5min;
(3)置于预冷的乙醇:乙酸(2:1)溶液中,-20℃浸泡5分钟,去除多余液体,但注意不要干燥;
(4)PBS洗两次,每次5min;
(5)滤纸小心吸去多余液体,立即在切片上按75μl/5cm2直接加入平衡缓冲液,室温孵育1-5min;
(6)滤纸小心吸去多余液体,立即在切片上按55μl/5cm2直接加入TdT酶反应液,置于避光保湿盒中作用1h(阴性对照加入不含TdT酶的反应液);
(7)将切片置于终止/洗涤缓冲液中,轻轻摇动15sec,室温孵育10min;此时准备适量抗地高辛抗体,预热至室温,注意避光;
(8)PBS洗三次,每次1min;
(9)滤纸小心吸去多余液体,直接在切片上按65μl/5cm2加入抗地高辛抗体,室温下于避光保温湿盒中作用1h;
(10)PBS洗四次,每次2min;
(11)SlowFade Gold antifade reagent with DAPI(Invitrogen,S36939)封片;
(12)荧光镜下观察,拍照。若需保存,于暗湿盒中4℃保存。在荧光显微镜下观察,拍照,计数凋亡神经元细胞。(若需保存,于暗湿盒中4℃保存)
脑组织梗死周边区神经元细胞凋亡情况测定结果如图4、图5所示。图4是是IRF6-TG4小鼠和NTG小鼠I/R术后24小时脑组织梗死周边区神经元细胞凋亡情况,Fluoro Jade B染色(A)和TUNEL染色(B)结果显示IRF6-TG4小鼠神经元细胞凋亡率均比NTG小鼠增大。图5是IRF6-KO小鼠和IRF6flox/flox小鼠I/R术后24小时脑组织梗死周边区神经元细胞凋亡情况,Fluoro Jade B染色(A)和TUNEL染色(B)检测细胞凋亡,结果显示IRF6-KO小鼠神经元细胞凋亡率比IRF6flox/flox组小鼠低。这些结果表明,减少IRF6基因的表达可以改善脑组织缺血/再灌注损伤,且可能与神经元细胞凋亡密切相关;IRF6基因可恶化脑组织缺血/再灌注损伤的发生,促进神经元细胞凋亡。
【实施例4】IRF6干扰(AdshIRF6)对缺氧复氧(OGD)处理刺激的原代皮层神经元细胞活力的影响
4.1新生SD乳鼠神经元的培养
Sprague-Dawley乳鼠购买于武汉大学实验动物中心。
(1)准备培养平皿,加入DMEM培养基,在冰上预冷。
(2)将出生1天的SD乳鼠,75%乙醇浸泡消毒。
(3)用小剪和镊子逐层分离乳鼠皮肤及颅骨,取出脑放入平皿并在冰上分离皮层。
(4)将脑皮层转入置于冰上的盛有DMEM液的培养皿中,剪碎脑组织。
(5)将剪碎的脑组织转入15mL离心管,将DMEM液吸尽,加入0.125%酶消化液5mL。
(6)将离心管置于37℃水中消化20min左右,用含20%FBS的DMEM/F12培养液终止消化。
(7)1000r/min离心×5min,吸弃上清,加入4ml含20%FBS的DMEM/F12培养液重悬,用200目网筛过滤。
(8)将细胞接种于10mg/L多聚赖氨酸过夜包被的培养皿。
(9)4-6h后全量换成Neurobasal+B27培养基。
(10)接种第2d,根据情况加入终浓度5μmol/L的阿糖胞苷处理24h后,全量换Neurobasal+B27培养液。
(11)每隔两天半量换液,第5d左右细胞进行后续试验。
4.2氧糖剥夺实验(OGD):将细胞培养皿Neurobasal+B27培养液弃去,换成无血清无糖的OGD液,放入95%N2和5%CO2低氧培养装置,培养1h,到时间后取出培养皿弃去ODG液换成Neurobasal+B27培养液继续培养,到相应的时间后,收集样品。对照组在正常培养基和培养条件下培养。
4.3构建腺病毒表达载体,转染原代神经细胞:
(1)AdshRNA和AdshIRF6载体的构建方法参见文献:Chen K,Gao L,Liu Y,et al.Vinexin-βprotects against cardiac hypertrophy by blocking the Akt-dependent signalling pathway[J].Basic Res Cardiol,2013,108(2):1-14.。
(2)腺病毒的包装:
1)用Pac I处理重组的阳性质粒,用乙醇沉淀后重悬于20μl无菌水中。
2)使用VigoFect将6μg的质粒转染汇合率为50~70%的293A细胞,8h后移除混合液,加入4ml含10%胎牛血清和1%青霉素/链霉素双抗的DMEM完全培养液,观察绿色荧光蛋白转染效率。
3)转染后的7~10d,观察到细胞病变效应(cytopathic effect,CPE)时,用移液器将细胞吹下,移到50ml锥形离心管中。离心后用1ml PBS使细胞重悬。液氮冻结细胞,再用37℃水浴融化,并剧烈振荡,重复4次。之后离心,取上清液,得到第一代病毒,-80℃保存。
4)将293A细胞铺在100mm培养皿内,汇合率为50~70%,加入含病毒的上清液0.5ml。2~3d可观察到明显的细胞裂解或CPE现象。感染后3~5d,当1/3~1/2的细胞脱离时收集病毒,并按上述方法获得病毒上清液。
5)将获得的病毒上清液感染100mm培养皿的细胞,收集病毒,使其感染150mm细胞培养皿的293A细胞,进一步扩增,获得足量病毒。
6)将富集的病毒颗粒上清液滴加在CsCl梯度溶液上,30000rpm超速离心,4℃,16h。离心后出现两个条带,颜色弱、位置高的条带为腺病毒空壳;颜色亮、位置低的条带含活病毒颗粒,用16号针头收集该条带。
7)之后在TBS中透析1h,再用含有10%甘油的TBS透析两次,每次1h。将获得的纯化腺病毒装进EP管中。用紫外分光光度计测定透析液中的总蛋白,1μg病毒蛋白≈4×109病毒颗粒。腺病毒短期保存在4℃冰箱,长期应保存在-80℃超低温冰箱。
(3)腺病毒转染原代神经细胞:通过梯度感染法确定所需病毒用量。感染原代神经细胞的感染复数(mμltiplicity of infection,MOI)为100:1。将Ploybrene加入培养液,二者比例为1:1000。感染后8~12h换液,加入适量完全培养基。
4.4细胞活性的测定:细胞活性检测用CCK8试剂盒,其原理是WST-8在电子耦合剂存在时,可以被活细胞中的脱氢酶还原生成高度水溶性的橙黄色的甲臜产物,进而可以反应活细胞数量。用CCK8试剂盒(CK04,Dojindo,Japan)检测神经细胞活性,具体操作步骤按照说明书:
(1)在神经元培养96孔板中,感染相应腺病毒,并OGD处理指定时间后。
(2)加入10μl/每孔CCK-8溶液,空白对照组加入相应量的培养液。
(3)将培养板放在细胞培养箱中继续培养1h。
(4)在450nm测定吸光度,同时使用630nm的波长作为参考波长进行波长测定。
4.5细胞LDH释放检测:活细胞的胞浆内含有乳酸脱氢酶(LDH),正常情况下,LDH不能透过细胞膜,当细胞受到损伤后,LDH释放到细胞外。进而可以通过测定LDH的释放来反应细胞损伤毒性。用LDH试剂盒(G1782,Promega)检测细胞释放LDH,具体操作步骤按照说明书:
(1)将培养的神经元感染相应病毒,并用OGD处理指定时间。
(2)将待测的96孔细胞培养板从细胞培养箱取出,放进离心机以250g,离心4分钟。
(3)分别移取50μl/孔上清液到新的96孔板的相应孔里,避免触摸细胞,同时注意做好标记。
(4)每孔分别加入50μl底物混合液,混匀,在室温下孵育30分钟,避免光照。
(5)每孔分别加入50μl终止液。在波长490nm测定吸光度值。
IRF6干扰(AdshIRF6)对缺氧复氧(OGD)处理刺激的原代皮层神经元细胞活力结果如图6所示。经缺氧/复氧处理后,原代皮层神经元细胞相对活力降低,乳酸脱氢酶的释放量增加,而经AdshIRF6转染的原代皮层神经元细胞相对活力的下降程度以及乳酸脱氢酶释放的增加程度明显小于AdshRNA对照组。说明体外敲低IRF6基因可保护原代皮层神经元细胞对抗缺氧/复氧损伤,抑制神经元细胞凋亡。
研究结果表明,在大脑中动脉缺血再灌注引起的损伤中,IRF6敲除小鼠梗死体积显著减少,神经功能明显好转,凋亡的神经细胞数量也明显减少;IRF6过表达小鼠梗死体积显著增加,神经功能明显恶化,凋亡的神经细胞数量也明显增多,体外利用AdshIRF6敲低IRF6基因表达获得与载体动物实验一致的结果,敲低IRF6基因表达的原代皮层神经元细胞经OGD处理后,细胞活力增加;这些结果说明IRF6在脑卒中疾病模型中有着重要的恶化作用。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
SEQUENCE LISTING
<110> 武汉大学
<120> 干扰素调节因子6及其抑制剂在脑卒中疾病中的应用
<160> 14
<170> PatentIn version 3.3
<210> 1
<211> 30
<212> DNA
<213> 人工序列
<400> 1
gctctagagc caccatggcc ctccaccccc 30
<210> 2
<211> 26
<212> DNA
<213> 人工序列
<400> 2
gctctagatt actggggagg cagggc 26
<210> 3
<211> 23
<212> DNA
<213> 人类
<400> 3
gaattgagtt attgggcacc tgg 23
<210> 4
<211> 25
<212> DNA
<213> 人类
<400> 4
gtctggggcg acattgtaca gcagg 25
<210> 5
<211> 54
<212> DNA
<213> 人工序列
<400> 5
agcttgacgt cataacttcg tatagcatac attatagcaa tttataccgg tgat 54
<210> 6
<211> 50
<212> DNA
<213> 人工序列
<400> 6
atcaccggta taaattgcta taatgtatgc tatacgaagt tatgacgtca 50
<210> 7
<211> 52
<212> DNA
<213> 人工序列
<400> 7
gatcccttaa gataacttcg tatagcatac attatagcaa tttatacgcg ta 52
<210> 8
<211> 52
<212> DNA
<213> 人工序列
<400> 8
ctagtacgcg tataaattgc tataatgtat gctatacgaa gttatcttaa gg 52
<210> 9
<211> 29
<212> DNA
<213> 人工序列
<400> 9
ccgctcgagc gatctcgatc tcgttcctc 29
<210> 10
<211> 31
<212> DNA
<213> 人工序列
<400> 10
acgcgtcgac agcaggcttt atgaaaccct t 31
<210> 11
<211> 27
<212> DNA
<213> 人工序列
<400> 11
tctaccggtg tacaatgtcg ccccaga 27
<210> 12
<211> 30
<212> DNA
<213> 人工序列
<400> 12
ggcgatatcg cccaataact caattcaagt 30
<210> 13
<211> 28
<212> DNA
<213> 人工序列
<400> 13
ggactagtac ctggagcctc tgtttctt 28
<210> 14
<211> 36
<212> DNA
<213> 人工序列
<400> 14
ataagaatgc ggccgccaag ttgttcgtgg cacagt 36
- 还没有人留言评论。精彩留言会获得点赞!
- 干扰素调节因子8(irf8)在脑卒中疾病中的应用的制作方法
- 通过抑制干扰素相关发育调节因子1(ifrd1)的天然反义转录物而治疗ifrd1相关疾病的制作方法
- 通过抑制干扰素调节因子8(irf8)的天然反义转录物而治疗irf8相关疾病的制作方法
- 干扰素调节因子4基因在治疗动脉粥样硬化中的应用的制作方法
- 干扰素调节因子1基因在治疗动脉粥样硬化中的应用的制作方法
- 重组人干扰素调节因子4结合蛋白表达体系及制备方法与应用的制作方法
- 干扰素调节因子9(irf9)及其抑制剂在冠状动脉粥样硬化性心脏病中的应用的制作方法
- 分析活检样品中干扰素调节因子-1特异性核糖核酸以诊断癌症,癌变前状态的方法
- 在致瘤性诊断中的干扰素调节因子1和2的制作方法
- 一种新的多肽——干扰素调节因子10.34和编码这种多肽的多核苷酸的制作方法
- 肾外髓质钾通道的抑制剂的制作方法与工艺
- 一种抑制植物细胞组织在培养中褐化的方法与流程
- 干扰素调节因子5及其抑制剂在脑卒中疾病中的应用的制作方法与工艺
- 干扰素调节因子6(IRF6)及其抑制剂在治疗心肌肥厚中的应用的制作方法与工艺
- 人喉组织中水通道的表达定位方法与流程
- 补体因子H抑制剂及与之相关的用途的制作方法与工艺
- 干扰素调节因子5(IRF5)及其抑制剂在治疗心肌肥厚中的应用的制作方法与工艺
- 作为因子XIA抑制剂的环状P1连接体的制作方法与工艺
- 作为补体因子B抑制剂用于治疗眼科疾病的2‑(1H‑吲哚‑4‑基甲基)‑3H‑咪唑并[4,5‑B]吡啶‑6‑甲腈衍生物的制作方法与工艺
- 能够结合组织因子途径抑制剂(1‑161)上的两个表位的抗体的制作方法与工艺
- 干扰素调节因子5(IRF5)及其抑制剂在治疗心肌肥厚中的应用的制作方法与工艺
- 作为因子XIA抑制剂的环状P1连接体的制作方法与工艺
- 能够结合组织因子途径抑制剂(1‑161)上的两个表位的抗体的制作方法与工艺
- 针对组织因子途径抑制剂(TFPI)的优化的单克隆抗体的制作方法与工艺
- 一种作为自分泌运动因子抑制剂的咔唑类化合物及其制备方法和应用与流程
- 外周血单核细胞活化抑制剂在制备治疗急性肝衰竭的药物中的用途的制造方法与工艺
- 对NEDD8活化酶(NAE)抑制剂的反应的生物标记的制造方法与工艺
- 一种肺癌调节因子SRSF5及其抑制剂与应用的制造方法与工艺
- 自分泌运动因子抑制剂的制造方法与工艺
- 一种BCL‑2抑制剂Venetoclax的合成方法与流程