用于筛选强迁移能力的脐带间充质干细胞的流式试剂盒的制作方法
本专利主要用于脐带间充质干细胞制剂的质量控制,并可为相关研究提供评估细胞迁移能力的方法,尤其是一种用于筛选强迁移能力的脐带间充质干细胞的流式试剂盒。
背景技术:
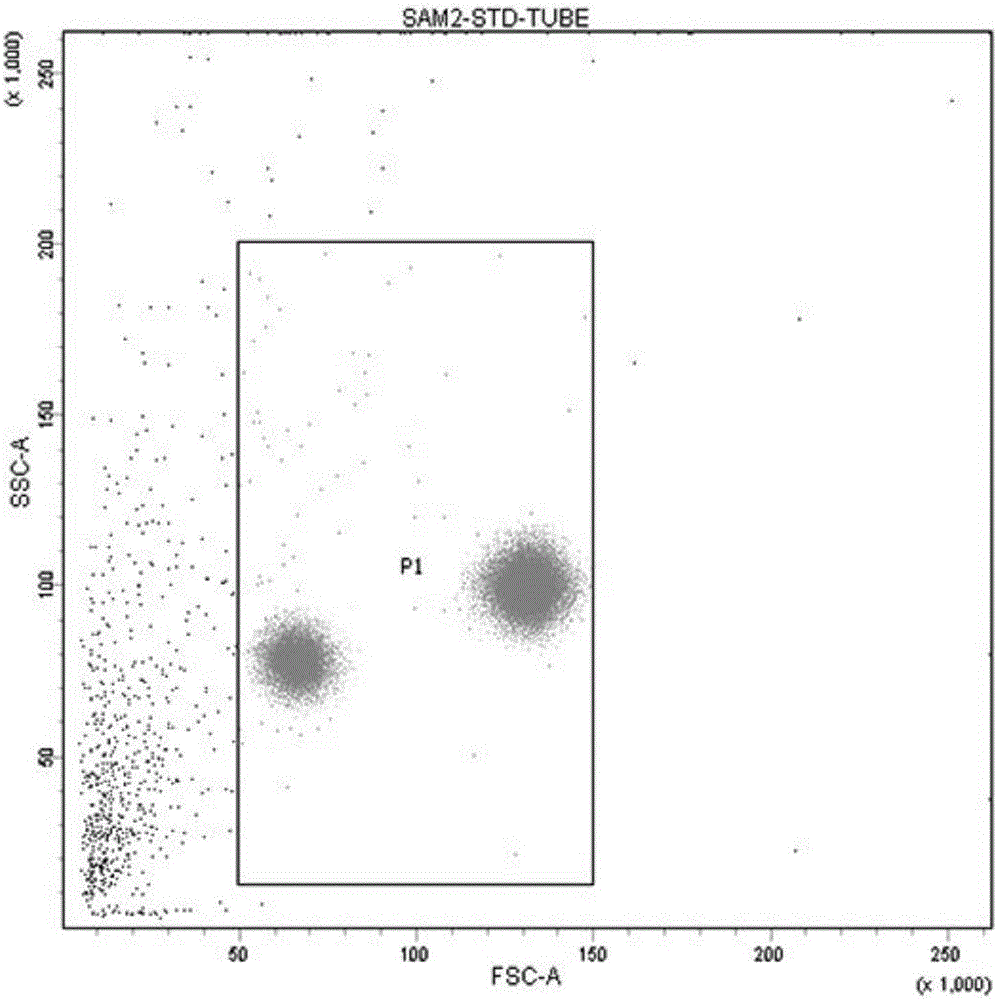
:脐带间充质干细胞(UC-MSC,umbilicalcordmesenchymalstemcells)是间充质干细胞家族的重要成员,属于多能干细胞。脐带间充质干细胞具有较高的分化潜能,可向软骨、脂肪、内皮等多个方向分化,并具有一定的免疫调控作用,此外,UC-MSC与广为人知的骨髓间充质干细胞(BM-MSC,bonemarrowmesenchymalstemcells)相比,具有来源丰富、制备简单等优点。目前,UC-MSC制剂在骨关节疾病、神经退行性疾病、糖尿病等疾病的治疗中均展现出良好的临床应用前景,CFDA也于2015年8月21日发布了《干细胞制剂质量控制及临床前研究指导原则》。根据《干细胞制剂质量控制及临床前研究指导原则》中“干细胞制剂的质量控制—干细胞制剂的检验—细胞检验”所述,应对细胞表面标志物进行纯度检测,以确保干细胞治疗的安全性和有效性。然而,实践表明通过流式细胞术检测得到相近纯度的不同细胞样本,却在迁移能力等方面存在较大差异,这将直接影响制剂的有效性。此外,考虑到干细胞制剂涉及到临床应用,最大限度保障患者人身安全更是纯度检测过程中的重中之重。因此确立一套更为精准有效且能反应细胞制剂安全性与有效性的细胞表面标志物检测方法已成为业内公认的难题。目前业内普遍采用P2-P5代脐带间充质干细胞用于临床前研究,实践表明每根脐带经剪切分离法平均仅可获得约1.98*107的P1代脐带间充质干细胞,因此降低质量控制过程中对细胞样本的消耗显得尤为重要。然而通过流式细胞术的方法对UC-MSC的表面标志物进行检测时,需满足以下多种条件方能保证检查的准确度。首先,目前业内公认的最优检测体系为每管含0.5mL密度为1*106的细胞样本,检测管数由需要检测的表面标志物种类决定;其次,考虑到使用不同荧光染料进行多色标记时,发射光会溢漏至其他检测通道中,需要使用单色光对照管和FMO对照管以获得准确的实验数据;若使用单色染料进行检测,由于脐带间充质干细胞的特性,需检测多种阳性表面标志物,同样会导致样本管数增加,造成样本损失。此外,考虑到目前流式细胞仪的市场应用情况,目前主流的流式细胞仪的配置多为488nm和633nm双波长激发光,除两个散射光检测通道外,一般只配备4-8个发射光检测通道。总的来说,如何在控制细胞样本消耗量和保证检测精度之间找到平衡点,设计出一套适用于主流流式细胞仪的实验方案成为了脐带间充质干细胞纯度检测的一大难点。技术实现要素:本发明的目的在于克服现有技术的不足之处,提供一种用于筛选具有较强迁移能力的脐带间充质干细胞的流式检测试剂盒。本发明通过对检测方法进行优化,从而使检测结果与细胞样本的迁移能力与有效性直接关联。本发明采用的技术方案是:一种用于筛选具有较强迁移能力的脐带间充质干细胞的流式检测试剂盒,试剂盒组成:具体说明如下:⑴StandardMixture:将ZPH-MMA30K型30微米标准微球溶于1.5mL蒸馏水,与F-13838型15微米标准微球相混合,超声处理30s后振荡混匀,存放于4℃条件下,得到StandardMixture;⑵IsotypeMixture:将350μL的PE-IgG1k(554680)抗体、250μL的APC-IgG1k(554681)抗体、1150μL的FITC-IgG1k(555748)抗体、250μL的PerCP-Cy5.5-IgG1k(550795)抗体相混合,避光存放于4℃条件下,得到IsotypeMixture;⑶PositiveMixture:将295μL的PE-CD105(560839)抗体、295μL的APC-CD73(560847)抗体、115μL的FITC-CD90(555595)抗体、295μL的PerCP-Cy5.5-CD166(562131)抗体相混合,避光存放于4℃条件下,得到PositiveMixture;⑷NegativeMixture:将240μL的FITC-CD11b(562793)抗体、952μL的PE-CD34/FITC-HLA-DR(333181)抗体、952μL的PE-CD45(555483)抗体、952μL的PE-CD19(555413)抗体、952μL的PE-CD80(557227)抗体、952μL的PE-CD86(560957)抗体相混合,避光存放于4℃条件下。而且,操作步骤如下:(1)取1.5*106量的脐带间充质干细胞样本,经离心、洗涤,用PBS重悬后制成密度为5*106cells/mL的细胞悬液A;(2)取4支一次性流式上样管,分别命名为STD管、ISO管、POS管、NEG管;(3)向STD管加入0.5mLPBS,向ISO管、POS管、NEG管分别加入100μL细胞悬液A;(4)向ISO管、POS管、NEG管分别加入20μLIsotypeMixture、10μLPositiveMixture、50μLNegativeMixture,在15℃条件下避光孵育30min;(5)向ISO管、POS管、NEG管均加入2mLPBS,在15℃条件下200g离心3min后去除上清液,重复本步骤2次;(6)将StandardMixture超声处理30s后振荡混匀后取25μL加入至STD管,向ISO管、POS管、NEG管分别加入500μLPBS,将STD管、ISO管、POS管、NEG管振荡混匀;(7)依照STD管、ISO管、POS管、NEG管的顺序上机检测。本发明具有的有益效果:本发明通过检测更多种有实际意义的细胞表面标志物,从而最大限度的保障临床患者的安全。本发明在不影响准确度且不减少标志物种类的前提下减少检测细胞表面标志物过程中对细胞样本的消耗量。本发明在不影响准确度且不减少标志物种类的前提下通过优化实验方案降低对仪器设备的要求。本发明通过设置标准“Gate”和增加检测CD166使检测结果直接与细胞迁移能力与有效性相关联;本发明确保多种免疫排斥相关的细胞表面标志物如CD80\CD86为阴性,从而保证临床患者人身安全;本发明减少了检测细胞表面标志物的过程中对细胞样本的消耗量。附图说明图1为不同样本迁移能力比较示意图;图2为SAM2中STD-FSC/SSC散点图;图3为SAM2中ISO-FSC/SSC散点图;图4为SAM2中ISO-PE/FITC散点图;图5为SAM2中ISO-PerCP-Cy5.5/APC散点图;图6为SAM2中POS-PE/FITC散点图;图7为SAM2中POS-PerCP-Cy5.5/APC散点图;图8为SAM2中NEG-PE/FITC散点图。具体实施方式下面结合具体实施例对本发明作进一步详述,以下实施例只是描述性的,不是限定性的,不能以此限定本发明的保护范围。本发明通过15μm和30μm标准直径的微球来辅助设定FSC-SSC图中需要采集荧光信号的区域,即业内称呼的“Gate”;增加了对于CD166、CD86、CD80的检测;使用了PE-CD105、APC-CD73、FITC-CD90、PerCP-Cy5.5-CD166的PositiveMixture及FITC-CD11b、PE-CD34、PE-CD45、PE-CD19、PE-CD80、PE-CD86、FITC-HLA-DR的NegativeMixture;StandardMixture、IsotypeMixture、PositiveMixture、NegativeMixture的配方;进行检测时的实验步骤及数据处理方法,包括但不限于各种试剂与样本管之间的滴加关系、纯度计算方式、如何通过标准微球来设定信号采集区域等。一种用于筛选具有较强活性的脐带间充质干细胞的流式检测试剂盒,具体说明如下:一、试剂盒组成:1.StandardMixture:将ZPH-MMA30K型标准微球溶于1.5mL蒸馏水,与F-13838型15微米标准微球相混合,超声处理30s后振荡混匀,存放于4℃条件下,得到StandardMixture(共2.5mL,100tests,25μL/test);2.IsotypeMixture:将350μL的554680抗体、250μL的554681抗体、1150μL的555748抗体、250μL的550795抗体相混合,避光存放于4℃条件下,得到IsotypeMixture(各组分品牌均为BD,共2mL,100tests,20μL/test);3.PositiveMixture:将295μL的560839抗体、295μL的560847抗体、115μL的555595抗体、295μL的562131抗体相混合,避光存放于4℃条件下,得到PositiveMixture(各组分品牌均为BD,共1mL,100tests,10μL/test);4.NegativeMixture:将240μL的562793抗体、952μL的333181抗体、952μL的555483抗体、952μL的555413抗体、952μL的557227抗体、952μL的560957抗体相混合,避光存放于4℃条件下,得到NegativeMixture(各组分品牌均为BD,共5mL,100tests,50μL/test)。二、实验步骤1、取1.5*106量的脐带间充质干细胞样本,经离心、洗涤,用PBS重悬后制成密度为5*106cells/mL的细胞悬液A;2、取4支一次性流式上样管,分别命名为STD管、ISO管、POS管、NEG管;3、向STD管加入0.5mLPBS,向ISO管、POS管、NEG管分别加入100μL细胞悬液A;4、向ISO管、POS管、NEG管分别加入20μLIsotypeMixture、10μLPositiveMixture、50μLNegativeMixture,在15℃条件下避光孵育30min;5、向ISO管、POS管、NEG管均加入2mLPBS,在15℃条件下200g离心3min后去除上清液,重复本步骤2次;6、将StandardMixture超声处理30s后振荡混匀后取25μL加入至STD管,向ISO管、POS管、NEG管分别加入500μLPBS,将STD管、ISO管、POS管、NEG管振荡混匀;7、依照STD管、ISO管、POS管、NEG管的顺序上机检测。三、数据处理1.以BD-Diva7.0系统为例,首先检测STD管,设立FSC/SSC散点图(图2),调整电压至令STD管中两群颗粒的FSC值分布于50*103-150*103之间,以FSC值为50*103-150*103,SSC值为20*103-200*103设定“Gate”为P1;2.在STD管的电压下检测ISO管,取P1内高密度的区域为P2(图3),在P2下创建PE/FITC散点图(图4)和PerCP-Cy5.5/APC散点图(图5),调整电压将细胞群的荧光强度控制于3*103左右;3.在上述电压下检测POS管,调节单色光补偿后,分别记录PE/FITC散点图(图6)中双阳性区域的数值为A1,PerCP-Cy5.5/APC散点图(图7)中全部APC阳性区域的数值为A2,PerCP-Cy5.5/APC散点图中全部PerCP-Cy5.5阳性区域的数值为A3;4.在上述电压下检测NEG管,记录PE/FITC散点图(图8)中双阳性区域的数值为A4。四、数据分析与参考标准1、活性计算公式为:活性%=[P1*P2*(100-A4)*A1*A2*A3]%(注:此公式中,若Pn/An的值为X%,运算时直接采用X来计算)1.判定标准为:①若活性大于70%,且A4小于2%,且A1*A2大于95%,则判定该细胞样本为合格;②若活性小于70%,或A4大于2%,或A1*A2小于95%,则判定该细胞样本为不合格。五、实验举例及结果验证1.选取三例典型样本分别命名为SAM1、SAM2、SAM3,检测数据如下:样本号P1P2A1A2A3A4活性SAM186.9%91.6%96.9%99.2%98.7%1.2%74.61%SAM271.4%86.8%97.2%98.9%96.7%1.0%57.03%SAM384.2%88.3%97.3%99.0%82.3%1.2%58.23%2.通过细胞迁移实验验证细胞活性,结果如下(结果比较见附图1):当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1