完全利用脐带资源制备间充质干细胞的方法与流程
本发明涉及一种干细胞制备的方法,尤其涉及一种完全利用脐带资源制备间充质干细胞的方法,以提高对脐带资源的利用效率。
背景技术:
间充质干细胞(Mesenchymal Stem Cell,MSCs)来源于发育早期的中胚层和外胚层,存在于全身结缔组织和器官组织中,是一类具有高度自我更新和多向分化潜能的成体干细胞。MSCs最初在骨髓中发现,因其具有多向分化潜能、造血支持和促进干细胞植入、免疫调控和自我复制等特点而受到关注。由于MSCs在体内或体外特定的诱导条件下,可分化为脂肪、骨、软骨、肌肉、肌腱、韧带、神经、肝、心肌和内皮等多种组织细胞,连续传代培养和冷冻保存后仍具有多向分化潜能,可作为理想的种子细胞用于衰老和病变引起的组织器官损伤的修复。MSCs能分泌产生多种促进生长分化的细胞因子,包括TGF-β、EGF、SDF-1、HGF、VEGF和IL-6等细胞因子,具有免于调控功能。因此,其在生物工程和细胞治疗等领域有广阔的应用前景。
MSCs最初是在骨髓中发现的,后来发现脐带、脐血、胎盘和其他一些组织也存在MSCs。但在成人骨髓中MSCs数量较少、容易被病毒感染、有较强的免疫原性等因素限制了其临床应用。人脐带来源的MSCs从细胞含量、细胞增殖能力、免疫原性低、取材方便等方面都优于骨髓MSCs。脐带来源的MSCs是骨髓MSCs的理想替代物。从脐带中提取间充质干使得脐带能够变废为宝。
脐带MSCs使用虽然无伦理学争议,但脐带采集是要通过医院伦理委员会的批准,经产妇及其家属知情同意后才能采集。
采集的脐带长度、粗细、色泽、采集时间等个体差异的影响获得的间充质干细胞的数量不一样,细胞增殖能力也不一样。
从脐带中2条动脉和1条静脉、包绕脐带动静脉的黏蛋白样结缔组织即为华通氏胶(Wharton’s Jelly)、脐带静脉内皮、内皮下层和血管周围组织中都可以分离得到间充质干细胞。
间充质干细胞在体外分离和扩增时,添加一定浓度的胎牛血清以提供细胞生长必须的营养成份;提供结合蛋白、解毒作用;是细胞贴壁、铺展在培养基质上所需因子来源;起缓冲液作用;提供蛋白酶抑制剂,使在细胞传代时使剩余胰蛋白酶失活,保护细胞不受伤害。目前用人血清、血小板衍生物、血小板裂解液、血球裂解液和脐血清等加入间充质干细胞的培养体系中以提供更好的细胞增殖环境越来越受到研究者的关注。
细胞接种密度(Incxulum Density)在很大程度上影响细胞生长和生存。种浓度较低时,细胞生长繁殖较慢,最终的细胞产量也低,尤其是贴壁细胞,当接种浓度低到某一临界值时,细胞甚至不会在介质面上扩展,也造成培养基的浪费。在脐带间充质干细胞细胞体外培养过程中,寻找最适的细胞接种浓度,是得到稳定性好和产率高的干细胞产品的关键因素。
目前脐带间充质干细胞获得的方式常见有酶消化静脉内膜法,Wharton’s Jelly组织贴壁法,胶原酶与胰酶联合消化法。
酶消化静脉内膜法:夹闭脐静脉一端,灌入胶原胶酶,置于含双抗的PBS中,37℃环境孵育0.5小时,收集酶液,用PBS反复灌洗,收集灌洗液,与酶液同时离心洗涤弃上清液后,以完全培养基重悬,接种培养,3天后全量换液,以后每周换液两次,观察贴壁生长情况。此方法操作繁琐,初始获得间充质干细胞数量级低,上皮细胞占比利高。
Wharton’s Jelly组织贴壁法:将脐带置于含双抗的PBS中,洗净残存血按血管螺旋走式剔除两条动脉和一条静脉,用有齿镊剥开外包膜将Wharton’s Jelly撕下,用DPBS浸泡洗涤后,将脐带组织剪碎至1mm3~3mm3大小,DPBS洗涤后,进行贴壁培养。一般约5-7天后可见贴壁生长的单个长条梭形细胞从组织中爬出,两周取贴块即可获得MSCs。此方法分离的间充质干细胞的操作繁琐,获得的原代细胞时间长。
专利CN101608174 B公开了一种胶原酶与胰酶联合消化法:将脐带组织切成小块置于胶原酶内消化,洗涤过滤后,以完全培养基重悬,接种培养,2天后换液弃非贴壁生长细胞,以后根据细胞生长汇合情况,使用含胰酶的洗脱液洗脱贴壁生长的细胞进行传代换液。此法细胞收获量高,保持细胞的生物原性,培养周期短。
技术实现要素:
本发明的另一个目的在于提供一种完全利用脐带资源制备间充质干细胞的方法,以减小脐带长度、粗细、色泽、采集时间、制备细胞增殖能力等个体差异的影响,获得了更多的原代细胞数量。
一种完全利用脐带资源制备间充质干细胞的方法,包括如下步骤:
步骤一,清洗去大部分脐带的残留血液,并保留动、静脉内部10v/v%~2v/v%的残留未凝固血液;
步骤二,将脐带制成2mm3~5mm3大小组织碎块(如:2.5mm3),并用胶原酶II消化(如:加入2~3倍组织碎块体积的0.2w/v%胶原酶II);
步骤三,加入DMEM培养基进行300r/min10分钟离心,完全提取残剩组织碎块和上层液交界的胶状液体,收集上层液;
步骤四,上层液中再次加入洗脱液,重悬后1800r/min离心15分钟;
步骤五,弃上层液后收集沉淀,加入洗脱液重悬,1000r/min离心10分钟,重复清洗两次,即获得脐带内部蕴含的间充质干细胞;
步骤六,将5.0×104/cm2~1.0×105/cm2获得的原代脐带间充质干细胞接种于含有10v/v%胎牛血清(FBS)的LG-DMEM培养基中,混匀后置温度37℃,CO2浓度5v/v%二氧化碳培养箱培养,3天后第一次换完全培养基,弃去非贴壁细胞,以后每2天后更换完全培养基,待贴壁细胞融合率达到80%以上后消化分散贴壁细胞,按需求进行提纯。
本发明的方法,使用缓冲液清洗去大部分脐带的残留血液,缓冲液为磷酸盐缓冲液(pH7.20,离子强度I=0.05)含有青霉素10万单位/L、链霉素100mg/L、3.00mmol/L还原型谷胱甘肽和2v/v%巯基乙醇。
本发明的方法,其消化分散的贴壁细胞,加入无血清冷冻保护剂进行分装。
本发明的方法,其步骤二的利用恒温摇床提高消化效率和稳定环境,获得消化后组织残剩组织碎块和悬液混合物。
本发明技术方案实现的有益效果:
本发明提供的方法利用了全部采集脐带制备脐带间充质干细胞,充分利用有限的脐带组织资源,减少造成不必要的浪费,增加了用于制备的组织体积,并且充分利用采集全部脐带资源,最大程度上地提取具有有效生物活性的脐带间充质干细胞,有利于高产地获得脐带内部蕴含间充质干细胞。
采用0.2w/v%胶原酶II消化,以及恒温摇床的存在使Wharton’s Jelly及其它组织更为暴露,增大了组织和酶的接触面积,在相同的时间内可以提高原代间充质干细胞的产率。
在缓冲液加入还原型谷胱甘肽和巯基乙醇,准确调节其pH值,新鲜配制以保持细胞外环境,避免或减少细胞的损害,增加细胞活性。
用缓冲液冲洗掉脐带大部分残留血液,保留10v/v%~20v/v%的残留未凝固血液,培养系统中残留血液可以提供外界无法获得的微量血液因子,促进细胞生长,缩短脐带间充质干细胞在非人体条件下的培养时间。
按5.0×104/cm2~1.0×105/cm2接种细胞,促使细胞贴壁时间短、增殖速度快、生长形状稳定、细胞成活率高,避免脐带个体差异造成的细胞扩增的影响。
附图说明
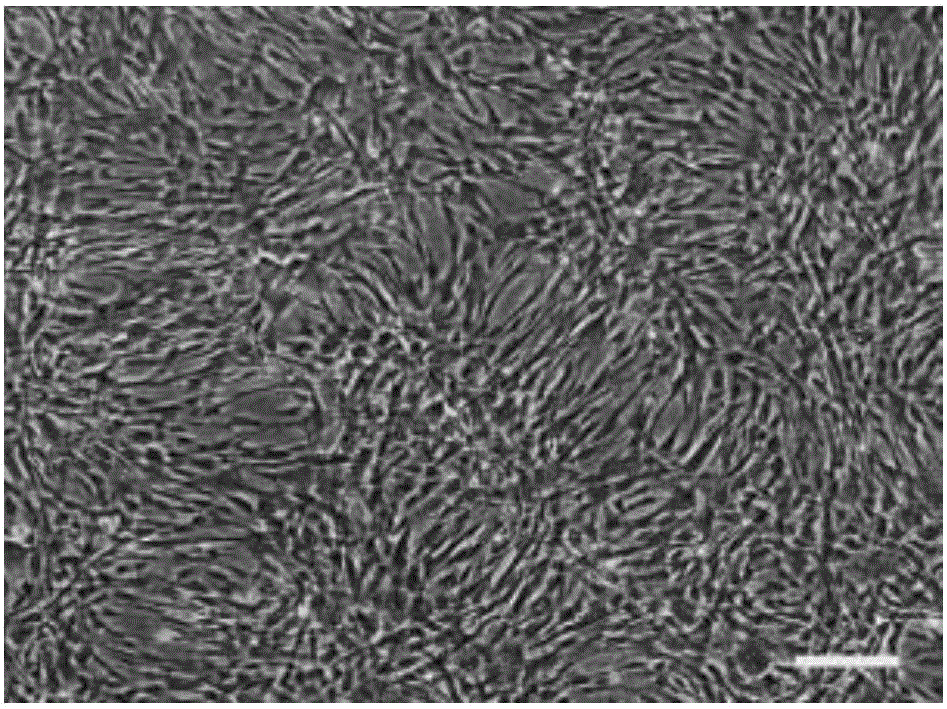
图1A实施例1的P0代脐带间充质干细胞生长进行镜检图;
图1B实施例1的P1代例脐带间充质干细胞生长进行镜检图;
图2为实施例4的P1、P2、P3、P4和P5代脐带间充质干细胞的增殖曲线图,图中横轴为细胞代数,纵轴为细胞数量;样本1、样本2和样本3为三个平行细胞样本随着传代;
图3为实施例5部分利用脐带与完全利用脐带制备脐带间充质干细胞数量对比图;
图4A为实施例1培养至P5代细胞制成细胞悬液进行流式细胞仪检测,而得阴性对照散点图;
图4B为实施例1培养至P5代细胞制成细胞悬液进行流式细胞仪检测,而得强表达散点图;
图5A为实施例1培养至P5代细胞制成细胞悬液,进行流式细胞仪检测而得的CD34、CD45、CD73、CD90和CD105阴性对照图;
图5B为实施例1培养至P5代细胞制成细胞悬液,进行流式细胞仪检测而得的CD34、CD45、CD73、CD90和CD105强表达曲线图。
具体实施方式
以下结合附图详细描述本发明的技术方案。本发明实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围中。
本发明以下实施例所用实际和仪器详见如下表1,其它所用的试剂若未经说明,均购自康宁(Corning)公司。
表1
本发明实施例脐带间充质干细胞的制备方法如下:
实施例1
(1)配制脐带清洗缓冲液:1.00v/v%青霉素/链霉素、3.00mmol/L还原型谷胱甘肽、2w/w%巯基乙醇的磷酸盐缓冲液(pH7.20,I=0.05),青霉素/链霉素母液浓度为青霉素(10,000units/ml)/链霉素(10,000μg/ml);
(2)按照国家规范采集初生婴儿的脐带,用清洗缓冲液冲洗除去脐带内外大部分残留血液(保留动静脉内部10v/v~20v/v%的残留未凝固血液),全部剪碎获得全部脐带组织碎块;
(3)向步骤(2)所获得人脐带组织中加入2~3倍组织体积的0.2w/v%胶原酶II消化处理,环境温度37℃条件下消化2小时,利用恒温摇床提高消化效率和稳定环境,获得消化后组织残剩组织碎块和悬液混合物;
(4)加DMEM培养基于步骤(3)消化后的混合物内混匀,300r/min离心10分钟;
(5)弃步骤(4)离心后沉淀,收集上层液,需完全提取残剩组织碎块和上层液交界的胶状液体;
(6)步骤(5)获得的上层液中加入洗脱液,重悬后1800r/min离心15分钟;
(7)步骤(6)弃上层液后收集沉淀,加入组织块洗脱液进行重悬,1000r/min离心10分钟,重复上述步骤清洗两次,即获得脐带内部蕴含的间充质干细胞;
(8)将步骤(7)得到的人脐带间充质干细胞按5.0×104/cm2~1.0×105/cm2浓度接种于盛有10v/v%FBS的LG-DMEM完全培养基的塑料培养容器中,混匀后置温度37℃,CO2浓度5v/v%二氧化碳培养箱培养。3天后第一次换完全培养基,弃去非贴壁细胞,以后每2天后更换完全培养基,待贴壁细胞融合率达到80%以上后按需求进行提纯、消化分散贴壁细胞,加入无血清冷冻保护剂进行分装。
表2
实施例2
将实施例1中步骤(2)用清洗缓冲液冲洗除去脐带内外大部分残留血液对照成清洗除去脐带内外残留的全部血液,取一案例结果如表3所示,相对于表2的结果,有着更长的生长周期和较少的的上东城数量。
表3
实施例3
将实施例1中步骤(2)剪碎获得全部脐带组织碎块对照成剪碎获得部分脐带组织碎块,取一案例结果如表4所示,相对于表2的结果制备数量减少,冻存数量较少。
表4
实施例4
将实施例1中步骤实验于三例脐带样本,扩增至P5代。
实施例5
将实施例1中步骤实验于三例脐带样本,得到制备原代间充质干细胞数量对照实例一制备数量。
取实施例1脐带间充质干细胞生长进行镜检。刚分离的脐带间充质干细胞细胞呈球形悬浮于培养液中,并混有一定的红细胞。接种12小时~24小时内细胞贴壁并伸展,36h~48h后细胞贴壁伸展扩大并混有非成纤维形状特征的杂细胞,细胞穿增殖后以梭形细胞为主,可见多角形、星形,折光性好(见图1A)。原代脐带间充质干细胞分布不匀的增殖细胞族,优选出的接种浓度在5d~7d便可达到80%以上的融合。传代培养至P1代,传代细胞仍以梭形为主,杂细胞逐渐减少,细胞比较均一,完全融合呈平行涡旋状,较原代更大(见图1B)。
取实施例1的P1代细胞利用台盼蓝拒染原理染色后,Life Technologies自动细胞计数仪进行计数分析。本发明方法得到的各代间充质干细胞细胞据拒染实验活性均可达到97.00%~100.00%。
取实施例4的细胞P1、P2、P3、P4和P5代脐带间充质干细胞的增殖情况进行验证(参见图2),由图3可见,随着传代代数的增加,细胞数量呈倍数增加。理论上经过4次传代为细胞原数量16倍,由于细胞会随着代数增加而伸展延伸,实际P5时的细胞数量为P1的15倍左右。
取实施例5细胞经部分利用脐带与完全利用脐带制备脐带间充质干细胞数量对比可见,由于充分利用脐带,完全利用脐带增大了制备源,较部分利用脐带得到原代细胞多(参见图3)
按实施例1培养至P5代细胞,分散成单个细胞后用PBS洗涤2次~3次,制成1.0×106的细胞悬液,流式检测CD34、CD45、CD73、CD90和CD105等5个表面标记物(参见图5A和图5B)。用流式分析软件Flow Jo进行分析,传代过程中间充质干细胞逐渐纯化,杂细胞量越来越少。P5、P6收获时,强表达标记细胞达95%以上,不表达细胞小于2%(参见图4A和图4B),符合国家颁布标准要求,证明细胞的免疫表型非常稳定,保证了制备出的脐带间充质干细胞细胞安全性。
- 还没有人留言评论。精彩留言会获得点赞!