一种与大豆抗疫霉病相关的miRNA及其应用的制作方法
本发明涉及一种与大豆抗疫霉病相关的miRNA及其应用,属于生物技术领域。
背景技术:
大豆疫霉根腐病(Phytophthora Root Rot of Soybean,PRR),是由大豆疫霉菌(Phytophthora sojae,P.sojae)引起的危害大豆生产的毁灭性病害之一。1948年在美国的印第安那州首次发现该病,迄今在世界大豆主产区呈扩大蔓延趋势。我国沈崇尧等于1989年首次在我国东北地区分离到大豆疫霉。目前在其他大豆生产区也分离到大豆疫霉,表现出丰富的毒力多样性,该病已经在我国一些大豆生产区发生并在局部地区造成较大损失。大豆疫病是一种土传病害,可以在大豆的任何生育期进行侵染并造成危害,因此大豆疫霉根腐病的防治非常困难。
microRNAs(miRNAs)是一类内源性表达的非编码的小分子RNA,它对基因的转录和表达起着重要的负调控作用,主要通过与其靶基因的完全配对降解靶基因或者不完全配对阻遏靶基因的翻译来发挥作用,在植物的生长发育过程中起着重要的调控作用。近年来,越来越多的研究发现miRNA在植物响应生物胁迫的过程中起着重要作用(Katiyar-Agarwal S,Jin H(2010)Role of small RNAs in host-microbe interactions.Annu Rev Phytopathol 48:225-246)。拟南芥miR393是第一个发现的参与植物PTI过程的miRNA,miR393被细菌短肽flg22诱导产生,并降解生长素受体(TIR1)进而负向调控生长素信号通路(Navarro L,Dunoyer P,Jay F,Arnold B,Dharmasiri N,Estelle M,Voinnet O,Jones JDG(2006)A plant miRNA contributes to antibacterial resistance by repressing auxin signaling.Science 312:436-439)。在油菜中,miR1885受芜菁花叶病毒(TuMV)的特异性诱导,靶标是TIR-NBS-LRR类型的抗性基因,并经过5ˊRACE的验证(He XF,Fang YY,Feng L,Guo HS(2008)Characterization of conserved and novel microRNAs and their targets,including a TuMV-induced TIR-NBS-LRR class R gene-derived novel miRNA in Brassica.FEBS letters 582:2445-2452)。slmiR482f和slmiR5300通过抑制NB结构域基因的表达,从而调控番茄对尖孢镰刀菌的抗性(Ouyang S,Park G,Atamian HS,Han CS,Stajich JE,Kaloshian I,Borkovich KA(2014)MicroRNAs suppress NB domain genes in tomato that confer resistance to Fusarium oxysporum.PLoS Pathog 10:e1004464)。在大豆中,也鉴定到一些特定的miRNAs,在大豆疫霉菌侵染过程中调控抗病相关基因的表达。郭娜等通过芯片数据分析,鉴定到一些参与响应大豆疫霉菌侵染的miRNAs(Guo N,Ye WW,Wu XL,Shen DY,Wang YC,Xing H,Dou DL(2011)Microarray profiling reveals microRNAs involving soybean resistance to Phytophthora sojae.Genome/National Research Council Canada=Genome/Conseil national de recherches Canada 54:954-958)。James Wong等利用Illumina测序也对响应大豆疫霉菌的miRNAs进行分析,发现miR393和miR166参与大豆的基础防卫反应(Wong J,Gao L,Yang Y,Zhai J,Arikit S,Yu Y,Duan S,Chan V,Xiong Q,Yan J,Li S,Liu R,Wang Y,Tang G,Meyers BC,Chen X,Ma W(2014)Roles of small RNAs in soybean defense against Phytophthora sojae infection.The Plant journal:for cell and molecular biology79:928-940)。这些结果表明,miRNA对植物响应生物胁迫的研究,并通过小RNA的遗传操作增强植物的抗病性,将为解决作物的抗病性提供新思路,并具有重要的应用前景。
技术实现要素:
针对上述现有技术,本发明提供了一种与抗大豆疫霉病相关的、来源于大豆的miRNA——gma-miR1510b。
本发明的另一目的是提供该miRNA的应用。
本发明是通过以下技术方案实现的:
一种与大豆抗疫霉病能力相关的miRNA,该miRNA命名为gma-miR1510b,其具有序列表中SEQ ID NO:1所示的序列。
所述的与大豆抗疫霉病能力相关的miRNA在培育抗疫霉病大豆新品种中的应用。
所述的应用优选抑制gma-miR1510b,从而提高其靶标基因Glyma.16G135500的表达,提高大豆对疫霉病菌的抗性;所述的靶基因Glyma.16G135500的核酸序列如SEQ ID NO:2所示。
gma-miR1510b所调控的靶基因Glyma.16G135500的核酸序列如SEQ ID NO:2所示。
本发明通过5’RACE的方法发现gma-miR1510b通过裂解mRNA的方式调控靶基因Glyma.16G135500。
有益效果:
本发明利用Stem-loop实时荧光定量PCR结果显示,gma-miR1510b受大豆疫霉菌的调控,其表达量呈现下调趋势,其靶标基因Glyma.16G135500在大豆受疫霉菌侵染后则呈现上调表达的趋势,两者呈现负相关,进一步证实了gma-miR1510b与其靶基因Glyma.16G135500的调控关系,说明其在大豆的抗病机制中起重要作用。
本发明构建了大豆gma-miR1510b的过表达载体pCAMBIA2301-gma-miR1510b,将该植物表达载体转入农杆菌K599感受态细胞,采用大豆子叶节介导的转基因方法转化大豆发状根。对获得的转基因大豆发状根进行抗病性分析表明,转基因发状根明显降低了对大豆疫霉根腐病的抗性,具有良好的应用前景,为后续的研究奠定了基础。
附图说明
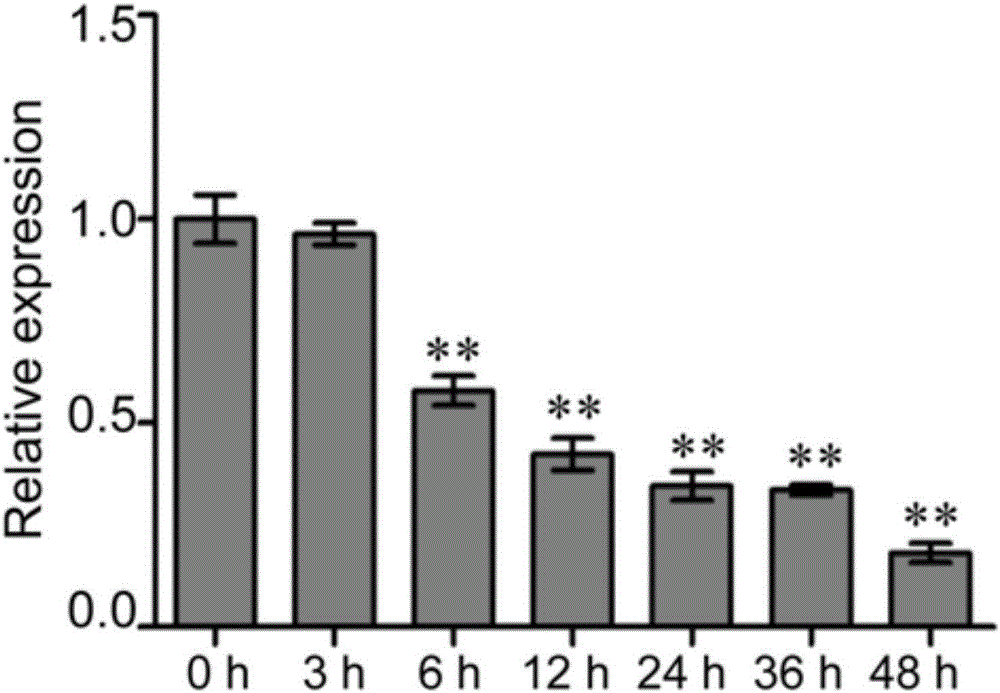
图1为实时荧光定量PCR对gma-miR1510b在大豆疫霉菌侵染后表达模式的分析结果,结果显示gma-miR1510b的表达受到明显下调,说明其在大豆抗疫霉病过程中起着重要作用。
图2为gma-miR1510b对靶基因Glyma.16G135500的裂解示意图,裂解位点位于NB-ARC结构域内。
图3为大豆受大豆疫霉菌侵染后gma-miR1510b和靶基因Glyma.16G135500的表达模式,结果显示gma-miR1510b与Glyma.16G135500的表达量变化呈负相关,进一步证明了gma-miR1510b对Glyma.16G135500的负向调控。
图4为pRS300载体示意图,包含拟南芥miR319a前体。
图5为gma-miR1510b在转基因大豆发状根中的表达检测示意图,图中EV:转空载体对照。
图6为大豆疫霉菌在大豆发状根中的相对积累量,结果显示过表达gma-miR1510b后促进了大豆疫霉的侵染。
具体实施方式
以下实施例中进一步定义本发明,根据以上的描述和这些实施例,本领域技术人员可以确定本发明的基本特征,并且在不偏离本发明精神和范围的情况下,可以对本发明做出各种改变和修改,以使其适用各种用途和条件。除特殊注明外,本发明采用的均为本领域现有技术。
实施例1.Stem-loop实时荧光定量PCR(Stem-loop qPCR)分析gma-miR1510b在大豆抗疫霉根腐病机制中的作用
1、gma-miR1510b反转录及Stem-loop定量PCR的引物设计
根据gma-miR1510b成熟miRNA的序列和大豆内参基因——GmSnoR I的序列,设计引物如下:
(1)gma-miR1510b Stem-loop RT引物:
GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACGGTGGA(SEQ ID NO:3),
(2)gma-miR1510b正向引物:CTGTGCTGTGTTGTTTTACCTAT(SEQ ID NO:4),
(3)gma-miR1510b反向引物:GTGCAGGGTCCGAGGT(SEQ ID NO:5),
(4)GmSnoR I正向引物:GAAGATGAAGAGCTTTGTATATTC(SEQ ID NO:6),
(5)GmSnoR I反向引物:ACTCAGAGAGTTGCTTTCTGTG(SEQ ID NO:7)。
2、材料培养及大豆疫霉菌侵染
(1)大豆疫霉菌株P6497的培养:
将10%V8固体培养基倒入灭菌的培养皿内制成平板,待培养基凝固后移入直径为5mm的菌块,在25℃黑暗条件下培养7天用于接种。
(2)大豆栽培品种Williams的种植及下胚轴创伤接种:
取大豆栽培品种Williams播种于以蛭石为基质的塑料花盆中,每盆7-9粒,温室温度控制在25℃左右,培养7d至第一片真叶展开后用于接种。用消毒后的刀片在大豆子叶下1cm处向下划1cm长的伤口,从培养7d的P6497菌落外缘割取2mm×10mm带有菌丝体的培养基,将割取的小块培养基有菌丝体的一面贴在伤口处进行接种。按照时间点0、3、6、12、24、36、48h取下胚轴接种部位附近2cm,液氮冷冻,-80℃储藏。
3、大豆总RNA的提取,使用Trizol试剂,提取方法如下:
(1)匀浆处理:所取样本用液氮在研钵内快速研磨,每50~100mg组织加1ml Trizol,使组织溶解在Trizol试剂中;
(2)将匀浆样品涡旋振荡混匀,在室温条件下放置5min,以使核蛋白体充分解离;
(3)4℃,10000×g离心10min,取上清转入一个新的RNase free的离心管中;
(4)每1ml Trizol加0.2ml氯仿,盖紧离心管盖,剧烈振荡15s,室温静置10min;
(5)4℃,10000×g离心15min,将上层无色的水相转入新的RNase free的离心管中;
(6)向上清液中加入0.5ml异丙醇沉淀RNA,盖紧离心管盖,轻轻翻转几次充分混匀,室温条件下静置10min;
(7)4℃,10000×g离心10min,弃上清液;
(8)用1ml 75%的乙醇洗涤沉淀;
(9)4℃,7500×g离心5min,弃上清液,自然干燥5~10min,使乙醇挥发,干燥沉淀;
(10)加入50μL RNase free H2O溶解沉淀,保存于-80℃冰箱。
4、反转录,利用Takara PrimeScriptTM RT reagent试剂盒将RNA进行反转录,得到cDNA。
(1)去除RNA样品中的基因组DNA,反应体系如表1所示:
表1去除基因组DNA反应体系
(2)利用特异的茎环RT引物对去除基因组DNA的RNA进行反转录,得到指定的miRNA。利用通用的反转录引物RT Primer Mix对RNA进行反转录,用于扩增内参基因。反应体系如表2所示:
表2反转录PCR体系
5、Stem-loop实时定量PCR及结果分析:
(1)Stem-loop实时定量PCR:利用Vazyme AceQ qPCR SYBR Green Master Mix进行定量PCR,反应体系如表3所示。
表3 miRNA Stem-loop qPCR反应体系
(2)结果分析:利用方法进行结果的分析。
参看图1,实时荧光定量PCR分析的结果显示,gma-miR1510b的表达受到大豆疫霉菌的调节,大豆受大豆疫霉菌侵染后gma-miR1510b的表达明显下调,这表明在大豆中抑制或过表达gma-miR1510b,将影响大豆对疫霉菌的抗性,培育出抗大豆疫霉菌的转基因大豆,对提高大豆的产量具有重大意义。
实施例2.gma-miR1510b靶基因的验证:用5’RACE方法验证gma-miR1510b对靶基因Glyma.16G135500的裂解位点
1、5’RACE引物设计如下:
Glyma.16G135500 Outer reverse primer:CCGTGAAGGACATCTCTTCCATTCCAATA(SEQ ID NO:8),
Glyma.16G135500 Inner reverse primer:CTCCCAATTCATAATCTTTGAAGCAACAAGC(SEQ ID NO:9)。
2、RNA提取同实施例1。
3、mRNA的富集:
(1)使用Promega公司的mRNA Isolation Systems试剂盒,对mRNA进行分离。
取1mg总RNA,加入RNase Free dH2O稀释至500μl;65℃温育10min,加入3μl Oligo dT,13μl的20×SSC,轻轻混匀后室温冷却10min;取一管磁珠,轻弹管底重悬磁珠,置于磁柱上30s后除去上清;用300μl 0.5×SSC清洗磁珠三次,重悬于100μl的0.5×SSC中;加入与Oligo dT退火后的总RNA,室温放置10min,每2min轻混一次;静置于磁柱30s去上清,用300μl 0.1×SSC清洗四次;用RNase Free dH2O清洗磁珠,将mRNA转移到新离心管。
(2)使用Invitrogen公司的GeneRacer试剂盒的部分试剂。
向分离的mRNA中分别加入5μl糖原、25μl醋酸钠和550μl 95%的乙醇,轻轻混匀后-20℃过夜;4℃、20000rpm离心20min;用500μl 75%乙醇清洗沉淀,干燥后用15μl RNase Free dH2O溶解。
4、5’RACE实验
(1)连接RNA接头:
取7μl mRNA样品,加入GeneRacer RNA Oligo,65℃预热5min,冰上2min;加入1μl 10×T4 RNA Ligase Buffer、1μl 10mM ATP、1μl RNaseOutTM、1μl T4 RNA Ligase,37℃温育1h后放冰上;加入90μl RNase Free dH2O和苯酚/氯仿/异戊醇,涡旋30s混匀;4℃、20000rpm离心5min,将上清液转移到新离心管;分别加入2μl糖原、10μl醋酸钠和220μl 95%的乙醇,轻轻混匀后-20℃过夜;4℃、20000rpm离心20min;用500μl 75%乙醇清洗沉淀,干燥后用10μl RNase Free dH2O溶解。
(2)反转录为cDNA:
向连接RNA接头的产物中加入1μl Random Primer、1μl dNTP Mix和1μl RNase Free dH2O,65℃温育5min,冰上2min;加入4μl 5×First Strand Buffer、1μl 0.1M DTT、1μl RNaseOutTM、1μl SuperScriptTM III RT,50℃温育30~60min,70℃15min,冰上2min;加入1μl RNase H,37℃温育20min;获得第一链cDNA,分装后-20℃保存。
(3)巢式PCR扩增:
第一轮扩增采用Touchdown PCR,使用引物GeneRacerTM 5’Primer(试剂盒提供)和Glyma.16G135500Outer reverse primer;第二轮扩增使用引物GeneRacerTM 5’Nested Primer(试剂盒提供)和Glyma.16G135500Inner reverse primer,采用普通PCR反应条件。
(4)特异条带的克隆、测序
根据设计的5’RACE引物,得到扩增的断裂靶基因的大小,切胶回收符合预测长度的特异条带;4℃过夜连接T载体;取50μl大肠杆菌感受态细胞,加入5μl连接产物,轻轻混匀,冰上20min;42℃热激90s,冰上2min,加入500μl无抗LB液体培养基,37℃、220rpm培养1h;室温离心,除去部分培养液后混匀涂添加有卡那霉素的LB平板,37℃过夜培养;挑取菌斑,菌落PCR验证插入片段大小;选取菌落PCR条带符合预测长度的单克隆送测序。
(5)5’RACE结果分析:
选取符合预测长度的阳性克隆测序,用BioEdit软件进行测序结果与靶基因裂解位点的分析,分析结果见图2,基因Glyma.16G135500在预测位点发生裂解,说明它是gma-miR1510b的一个靶标基因。对Glyma.16G135500氨基酸序列进行分析,发现它包含一个TIR结构域和一个NB-LRR结构域,是一类植物抗病相关的基因,很有可能参与大豆对大豆疫霉菌的抗性。
实施例3.gma-miR1510b和靶基因Glyma.16G135500在大豆响应大豆疫霉菌过程中的功能分析
1、大豆的种植、疫霉菌的培养、接种方法、RNA的提取、反转录及实时荧光定量参考实施例1,取样时间点为0、6、12h。
2、Glyma.16G135500定量引物设计如下:
Glyma.16G135500正向引物:CTGGTTCCGTAACAAACTCCC(SEQ ID NO:10)
Glyma.16G135500反向引物:GAAAAACCCACCAAACAAAGG(SEQ ID NO:11)
3、参看图3,实时荧光定量PCR分析的结果发现,在接种大豆疫霉菌后gma-miR1510b的表达量在6h和12h呈显著下调趋势,而Glyma.16G135500在6h和12h时表达量明显上调,这说明当大豆接种疫霉菌后,gma-miR1510b和Glyma.16G135500的表达情况都受到了影响,进一步说明gma-miR1510b和Glyma.16G135500都与大豆响应大豆疫霉菌的侵染相关,而且从图3中可以看出,gma-miR1510b的表达量变化与Glyma.16G135500的表达量变化呈负相关,这说明gma-miR1510b确实通过调控具有TIR和NB-LRR结构域的基因Glyma.16G135500,从而调控大豆对大豆疫霉根腐病的抗性。
实施例4.大豆gma-miR1510b植物表达载体pCAMBIA2301-gma-miR1510b的构建
采用构建人工microRNA的方法,以拟南芥miR319前体为骨架,设计引物通过PCR反应将miR319和miR319*序列替换成miR1510b和miR1510b*,从而过表达gma-miR1510b。
1、用于大豆人工gma-miR1510b构建的引物设计
本方法选用http://wmd3.weigelworld.org/cgi-bin/webapp.cgi?page=Oligo;project=stdwmd网站来获得四个gma-miR1510b特异的扩增引物,四个gma-miR1510b特异的扩增引物和两个通用引物序列如下:
gma-miR1510b-I:gaTGTTGTTTTACCTATTCCACCtctctcttttgtattcc(SEQ ID NO:12)
gma-miR1510b-II:gaGGTGGAATAGGTAAAACAACAtcaaagagaatcaatga(SEQ ID NO:13)
gma-miR1510b-III:gaGGCGGAATAGGTATAACAACTtcacaggtcgtgatatg(SEQ ID NO:14)
gma-miR1510b-IV:gaAGTTGTTATACCTATTCCGCCtctacatatatattcct(SEQ ID NO:15)
universal primer A:CTGCAAGGCGATTAAGTTGGGTAAC(SEQ ID NO:16)
universal primer B:GCGGATAACAATTTCACACAGGAAACAG(SEQ ID NO:17)
2、构建大豆人工gma-miR1510b前体的PCR扩增体系及反应条件
以含有拟南芥miR319a前体的载体质粒pRS300(载体图参看图4)为模板,进行两轮PCR来最终获得人工gma-miR1510b载体。第一轮PCR以质粒pRS300为模板,利用三对引物universal primer A和gma-miR1510b-IV、gma-miR1510b-II和gma-miR1510b-III以及gma-miR1510b-I和universal primer B,三个PCR反应同时进行扩增,反应体系:2×Phanta Max Buffer 25μl,dNTP Mix 1μl,模板30ng,primer F 2μl,primer R2μl,Phanta Max Super-Fidelity DNA Polymerase 1μl,ddH2O补足50μl。反应条件为95℃预变性3min;95℃变性15s,55℃退火15s,72℃延伸30s,30个循环;72℃延伸5min。反应结束后将符合大小的特异条带进行切胶回收,PCR产物用Axygen凝胶纯化试剂盒进行纯化。第二轮PCR反应以第一轮PCR的混合产物为模板,用universal primer A和B进行扩增,反应体系和反应条件同第一轮PCR。PCR产物经Axygen凝胶纯化试剂盒纯化后,利用TransGenSimple Cloning Vector进行PCR片段的克隆,条件如下:Cloning Vector 1μl,PCR片段回收产物4μl,混匀后25℃反应5min。反应结束后,将5μl连接产物加入到50μl大肠杆菌感受态细胞中,轻轻混匀后置冰上30min,42℃热激90s,立即放置冰上2min,向离心管中加入无抗LB液体培养基500μl,置于37℃摇床上220rpm培养1h,离心后弃部分上清,吸打混匀后将培养液涂布于含有50mg/L卡那霉素的固体LB培养基上,37℃倒置过夜培养。挑取菌斑,菌落PCR验证插入片段大小,选取菌落PCR条带符合预测长度的单克隆送测序。测序完成后,通过BioEdit软件进行序列比对分析,同时含有miR319a前体序列和gma-miR1510b、gma-miR1510b*序列的测序序列即是构建好的大豆人工gma-miR1510b前体。
3、构建由35S启动子驱动的gma-miR1510b过表达植物载体
利用Axygen质粒抽提试剂盒抽提pEASY-Blunt-gma-amiR1510b中间载体质粒。将提取的质粒与植物表达载体pCAMBIA2301同时用TakaRa公司的限制性内切酶Kpn I和Sac I进行双酶切后,切胶回收DNA片段。用TakaRa公司的T4连接酶进行连接,连接体系:pCAMBIA2301载体1μl,人工gma-miR1510b前体DNA 5μl,10×T4连接酶buffer 1μl,T4连接酶0.5μl,ddH2O补足10μl,16℃过夜连接。然后将连接产物转化大肠杆菌感受态细胞,菌落PCR鉴定阳性单克隆,并提取质粒进行酶切验证。将正确的植物表达载体pCAMBIA2301-gma-miR1510b电击转化到发根农杆菌感受态细胞K599中,卡那霉素(50mg/L)抗性筛选阳性克隆。
实施例5.转基因大豆发状根的获得
1、挑取K599农杆菌单菌落(实施例4中获得的携带重组质粒的农杆菌)接种于含卡那霉素的LB液体培养基中,28℃,180rpm振荡培养24h;收集菌液于2ml离心管中,4500rpm离心5min,弃培养液;用10mMMgCl2清洗菌体两次,最后用MgCl2进行悬浮,浓度(OD600)稀释至0.5备用。
2、大豆种子用氯气消毒后在组培瓶中种植培养,在组培室生长5天待子叶变绿后收集子叶,将收集的子叶用手术刀在靠近子叶节一端切一个直径大约0.4cm的圆形伤口,将处理好的子叶放在含有white培养基的培养皿中。
3、在每个子叶的切口处滴加20μl K599菌液,用封口膜封好后放回组培室暗培养。
4、大约3周后,侵染处即可长出发状根。将长度大于3cm的发状根切下移至新的white培养基中扩大培养。
实施例6.gma-miR1510b成熟体在转基因大豆发状根中的表达检测
1、采用Stem-loop荧光定量PCR的方法对转基因大豆发状根中gma-miR1510b的表达量进行检测。
2、用Trizol法提取总RNA,方法同实施例1。
3、反转录使用Takara公司的PrimeScriptTM RT reagent和gma-miR1510b Stem-loop RT primer,方法同实施例1。
4、以大豆GmSnoR I为内参基因,利用Vazyme AceQ qPCR SYBR Green Master Mix进行定量PCR,反应体系及条件同实施例1。根据反应结果,作图分析gma-miR1510b在转基因大豆发状根中能否成功表达及其表达丰度。从图5中可以看出,gma-miR1510b在转基因大豆发状根中成功表达,与空载体对照形成极显著差异,表明转入的大豆gma-miR1510b可以在大豆发状根中过表达,并成功加工形成成熟体。
实施例7.gma-miR1510b过表达大豆发状根对大豆疫霉菌的抗性鉴定
1、大豆疫霉游动孢子诱导:P6497在V8固体培养基上培养4天,切取边缘新鲜的菌丝块在液体V8中于25℃暗培养3天,用灭菌自来水反复洗4~5遍,最后加少许水在黑暗条件下诱导孢子囊的产生,孵育12h左右游动孢子从孢子囊释放,用纱布过滤收集游动孢子液,浓度稀释至104个游动孢子/ml,备用。
2、选取生长状态及长度一致的发状根,放入4ml离心管中,加入3ml备用的游动孢子液使发状根浸没在里面,接种后的发状根分别在12h和24h后取样,液氮冷冻,-80℃储藏。每一处理均设3次重复。
3、利用荧光定量PCR的方法,通过测定大豆疫霉在发状根中的积累量来鉴定转基因发状根对大豆疫霉菌的抗性。
大豆疫霉定量引物设计如下:
PsTEF正向引物:TGATCGTGCTGAACCACCC(SEQ ID NO:18)
PsTEF反向引物:CGAGCGACGGTCCATCTT(SEQ ID NO:19)
由图6可以看出在gma-miR1510b过表达大豆发状根中,大豆疫霉的积累量要明显高于空载体发状根中的疫霉生物量。因此gma-miR1510b在大豆抗大豆疫霉病的研究中有很好的应用前景。
SEQUENCE LISTING
<110> 南京农业大学
<120> 一种与大豆抗疫霉病相关的miRNA及其应用
<160> 19
<210> 1
<211> 21
<212> RNA
<213> 大豆
<400> 1
uguuguuuua ccuauuccac c 21
<210> 2
<211> 3144
<212> DNA
<213> 大豆
<400> 2
atggctgtgc gatcattctc ctacgatgtg ttccttagct tccgagggga agatactcgt 60
tatagtttca ctggcaatct ctacaatgtc cttcgggaaa ggggaattca caccttcatt 120
gatgacgacg agttccagaa aggggaccaa atcacgtcag cacttgagga agcaattgag 180
aagtccaaga ttttcatcat cgtgctctct gaaaactacg catcttcctc cttttgctta 240
aacgaactca ctcacatcct taactttact aaggggaaga atgatctgtt ggttttgcca 300
gttttttata tagtggatcc ttcagatgtc cgacaccaca gaggtagttt tggagaagca 360
ctggcaaatc atgaaaagaa gttgaactct gataacatgg agaatcttga gacctggaaa 420
atggctctgc accaagtttc taacatttct ggccatcatt tccaacatga tgggaacaaa 480
tatgaataca agtttattaa ggagatagtt gaatcagtgt ctagcaagtt taatcatgct 540
cttttacaag ttcctgatgt cttggttggg ctagagtcac ccgtgctaga agtaaagtcg 600
cttctggatg ttggatctga tgatgtcgtt cacatggtgg ggatccatgg actcggtgga 660
gtgggtaaaa caacacttgc cgttgcagtc tataattcca ttgctggcca ttttgaagct 720
tcttgctttc ttgaaaatgt gagagaaact tccaacaaaa aggggttaca acatctccaa 780
agcatccttc tttctaaaac agttggagag aagaaaatta agttaacaaa ttggagagaa 840
ggaattccca taataaagca taagctcaag caaaaaaagg ttcttttgat tctagatgat 900
gttgatgaac ataaacactt acaagcaatt attggcagcc ctgattggtt tggttgtggt 960
agtagagtca tcatcaccac tcgaaacgaa catttgttag cgctacacaa tgttaaaata 1020
acatataagg tgagagagtt gaatgagaaa catgctcttc aattacttac tcagaaggct 1080
tttgagttgg aaaaagaagt tgattcaagt tacaatgata ttttgaatcg agcgctaatt 1140
tatgcttcag gccttccgtt ggctttagaa gtaataggtt ccaacttatt tggaaaaagt 1200
ataaaagaat gggaatctgc tctaaatgga tatgaaagaa ttcctgataa aagtatctat 1260
atgatactta aagtaagcta tgatgctttg aatgaagatg agaaaagtat ttttcttgat 1320
attgcttgtt gcttcaaaga ttatgaattg ggagagctcc aagatatact ttatgctcat 1380
tatggtcgtt gcatgaaata tcatattggg gtgttggtta aaaaatctct tataaacatt 1440
catgggtcat gggattataa ggtcatgaga ttgcatgact tgatagaaga catgggtaaa 1500
gaaattgtcc gaagagaatc accaacagag cctgggaaac gtagcaggtt atggtcccat 1560
gaggatataa atcaggtttt acaagaaaat aaggggacta gtaagattga aatcatatgt 1620
atgaattttt cctcatttgg agaagaagtt gaatgggatg gagatgcctt caagaagatg 1680
aaaaatctca aaacacttat tatcaaaagt gattgtttta ccaaaggtcc caaatatctt 1740
cctaatactt taagggtatt ggaatggaag agatgtcctt cacgggattg gccacataat 1800
tttaacccaa agcaacttgc tatatgcaag ttacgccata gtagctttac gtcactagag 1860
ttggccccat tatttgaaaa gaggttcgtg aatttgacaa ttttaaactt ggacaagtgt 1920
gatagtttaa cagagatacc agatgtatct tgtctctcaa aattggaaaa attgtcattt 1980
gcaaggtgtc ggaatttgtt tacaattcac tattcagttg gtttattgga aaagcttaag 2040
atcttgtatg ctggaggttg cccagagctt aagagttttc caccattgaa gttgacctct 2100
cttgaacagt ttgaactttc gggttgtcac aatctcgaga gttttcctga aatattagga 2160
aaaatggaaa atataacagt acttgacttg gatgaatgtc gcataaaaga attccgacct 2220
tcatttcgaa atcttactcg gcttcaagag ttatatctgg gacaggaaac ttaccggtta 2280
agaggctttg atgctgccac cttcatttca aacatttgca tgatgccaga actagctcgg 2340
gttgaagcta cccaattgca atggaggcta ttgcctgacg atgttttgaa attgagctcg 2400
gtcgtgtgtt caagcatgca gcatcttgaa ttcataggct gcgacctgtc agatgagctt 2460
ctttggctat ttctctcatg ttttgtaaat gtgaagaatt taaacctgtc agcgagtaaa 2520
ttcacagtta ttcccgaatg catcaaagac tgccgctttt taactaccct tactttggat 2580
tattgcgatc gtcttcaaga aattagaggg attcctccaa acttgaaata tttctctgca 2640
ttaggatgcc tagccttgac ttcctcaagt ataagcatgt tacagaatca ggaactacat 2700
gaggttggag acaccttctt tattttgcca agtggaaaga ttccagggtg gtttgagtgc 2760
catagtcggg gaccgtcaat ttttttctgg ttccgtaaca aactcccagc catagttgtt 2820
tgctttgtta aggaagattt tttgaacttt acctcagatc tagttttgag cgtgatcatt 2880
aatggacatg aacatcaaca taaacctttg tttggtgggt ttttcttcga atcaccttgt 2940
acagctcttt ttcatcttca aatgaaagat aatttagatg aagcactatt agagaatgaa 3000
tggaaccttg cagagattgt atatggagat ttgtgtgatg aaaacggaat ccatgtattg 3060
aaaaagcaaa gtagcgtgga cgatattcga ttcattgatc cttgtagaaa aaaaaaatta 3120
aatgatgatc tcattagttc ataa 3144
<210> 3
<211> 50
<212> DNA
<213> 人工序列
<400> 3
gtcgtatcca gtgcagggtc cgaggtattc gcactggata cgacggtgga 50
<210> 4
<211> 23
<212> DNA
<213> 人工序列
<400> 4
ctgtgctgtg ttgttttacc tat 23
<210> 5
<211> 16
<212> DNA
<213> 人工序列
<400> 5
gtgcagggtc cgaggt 16
<210> 6
<211> 24
<212> DNA
<213> 人工序列
<400> 6
gaagatgaag agctttgtat attc 24
<210> 7
<211> 22
<212> DNA
<213> 人工序列
<400> 7
actcagagag ttgctttctg tg 22
<210> 8
<211> 29
<212> DNA
<213> 人工序列
<400> 8
ccgtgaagga catctcttcc attccaata 29
<210> 9
<211> 31
<212> DNA
<213> 人工序列
<400> 9
ctcccaattc ataatctttg aagcaacaag c 31
<210> 10
<211> 21
<212> DNA
<213> 人工序列
<400> 10
ctggttccgt aacaaactcc c 21
<210> 11
<211> 21
<212> DNA
<213> 人工序列
<400> 11
gaaaaaccca ccaaacaaag g 21
<210> 12
<211> 40
<212> DNA
<213> 人工序列
<400> 12
gatgttgttt tacctattcc acctctctct tttgtattcc 40
<210> 13
<211> 40
<212> DNA
<213> 人工序列
<400> 13
gaggtggaat aggtaaaaca acatcaaaga gaatcaatga 40
<210> 14
<211> 40
<212> DNA
<213> 人工序列
<400> 14
gaggcggaat aggtataaca acttcacagg tcgtgatatg 40
<210> 15
<211> 40
<212> DNA
<213> 人工序列
<400> 15
gaagttgtta tacctattcc gcctctacat atatattcct 40
<210> 16
<211> 25
<212> DNA
<213> 人工序列
<400> 16
ctgcaaggcg attaagttgg gtaac 25
<210> 17
<211> 28
<212> DNA
<213> 人工序列
<400> 17
gcggataaca atttcacaca ggaaacag 28
<210> 18
<211> 19
<212> DNA
<213> 人工序列
<400> 18
tgatcgtgct gaaccaccc 19
<210> 19
<211> 18
<212> DNA
<213> 人工序列
<400> 19
cgagcgacgg tccatctt 18
- 还没有人留言评论。精彩留言会获得点赞!