一种采用连续离子交换色谱技术分离核苷酸的工艺的制作方法
本发明属于生物分离
技术领域:
,具体涉及采用连续离子交换色谱技术分离核苷酸的工艺。
背景技术:
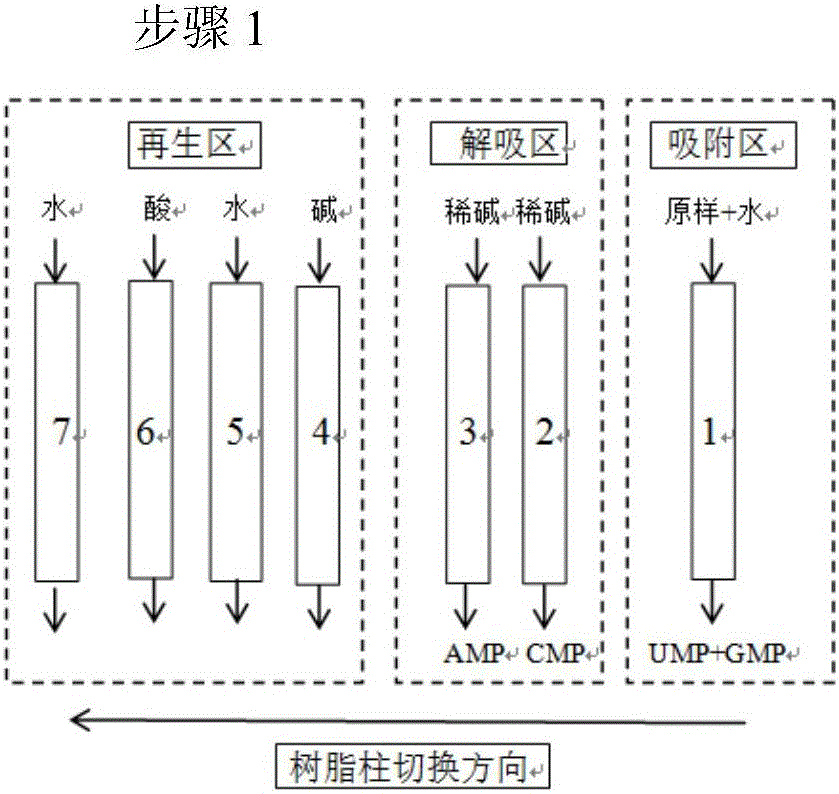
:5’-核苷酸是参与组成生物大分子核酸的基本单位,在农业、食品行业和医药行业上有着广泛的用途。尤其是在婴儿食品和医药领域的应用中,有着不可替代的功能。在婴儿食品中,作为婴儿食品的添加剂可以明显提高婴儿的免疫能力,促进肠道的成熟,促进脂蛋白和多不饱和脂肪酸的合成,减少婴儿感冒和腹泻等疾病的发生,有利于婴儿的正常生长和发育。作为医药中间体,核苷酸可以合成许多抗病毒、抗肿瘤药物,其相应的衍生物在治疗中枢神经系统、循环系统和泌尿系统等方面疾病有很重要的作用。目前,国内外生产核苷酸的方法主要有以下三种:化学合成法、微生物发酵法及RNA酶解法。首先,化学法生产核苷酸,主要是利用核苷进行磷酸酯化反应,而化学法所涉及的试剂具有一定毒性,生产成本偏高;其次是微生物发酵法生产核苷酸,主要是利用微生物菌株的生物合成途径来生产核苷酸。但由于核苷酸是一种糖基磷酸酯,即核苷的磷酸酯,难于透过细胞膜,因此增加了菌体发酵生产核苷酸的难度。再次,利用酶法生产核苷酸,核酸酶P1降解RNA可以一次得到四种核苷酸的混合物,且酶反应收率较高,该方法较适合工业化大规模生产核苷酸。需要注意的是,在酶解完成之后,需要通过色谱分离技术分离酶解液混合物中的四种核苷酸。色谱分离技术根据操作过程的特性分为:批处理色谱和连续色谱。批处理色谱即柱式固定床色谱,它是一种间歇制备色谱。固定床制备色谱的缺点是床层和吸附剂的利用率低,溶剂消耗大,产品的浓度低,增加了回收投入;并且操作不连续,原料的处理量较小。而连续色谱的优点是连续进样,使填料得到充分利用,降低溶剂消耗量,产量也有所提高。技术实现要素:本发明所要解决的技术问题是提供一种采用连续离子交换色谱技术分离酶解液中四种5’-核苷酸的方法,以解决核苷酸分离难度大、收率低等难题。为解决上述技术问题,本发明采用的技术方案如下:一种采用连续离子交换色谱技术分离核苷酸的工艺,RNA酶解液经脱色预处理后,采用三区式两步骤的连续离子交换色谱分离四种5’-核苷酸UMP、GMP、CMP和AMP。其中,所述的RNA酶解液为RNA经过核酸酶P1酶解得到的溶液。其中,所述的酶解液脱色预处理采用脱色树脂柱进行脱色处理。其中,所述的脱色树脂为吸附型树脂SX-1。其中,采用三区式两步骤的连续离子交换色谱分离四种5’-核苷酸为利用7~25根装有凝胶型强酸性阳离子交换树脂柱的连续分离装置分离四种5’-核苷酸。其中,所述的凝胶型强酸性阳离子交换树脂以聚苯乙烯二乙烯基苯为骨架,磺酸基-SO3-为功能基团,其型号优选为NH-1,平均粒径为394.1~416.5μm,湿密度为1.02~1.06g/L,含水量为30~60%。第一种处理工艺:当连续分离装置中树脂柱数量为7根时,采用三区式两步骤的连续离子交换色谱分离四种5’-核苷酸的方法包括循环操作的两个步骤:步骤1:7根树脂柱分为吸附区、解吸区和再生区三个区,其中,吸附区为1根树脂柱,解吸区为2根树脂柱,再生区为4根树脂柱;吸附区:按0.02~0.05g5’-核苷酸/g湿树脂的上样量吸附预处理后的酶解液,大部分UMP未被树脂柱吸附而流出,吸附完成后,用水洗脱树脂柱,水洗脱初期剩余UMP被快速洗出,随后部分GMP也被洗出同时与UMP完全分离,水洗脱过程持续到CMP即将流出为止;解析区:两根树脂柱独立设置,分别用稀碱洗脱两根树脂柱,分别得到AMP和CMP;再生区:四根树脂柱独立设置,分别通入碱、水、酸、水进行再生;步骤2:7根树脂柱分为解吸区和再生区两个区,其中,解吸区为2根树脂柱,再生区为5根树脂柱;步骤1中再生区的最后一根树脂柱切换到步骤1中吸附区的树脂柱之后与其串联,形成步骤2中的解吸区;步骤1中解吸区的两根树脂柱同时切换到步骤1中的再生区,串联后作为步骤2中再生区的第一根和第二根树脂柱;解吸区:两根树脂柱串联,通入水洗脱,步骤1中未洗脱完全的剩余GMP完全洗出,通入水洗脱至两根树脂柱中的第一根树脂柱内完全为AMP,第二根树脂柱中完全是CMP;再生区:串联的两个树脂柱通入碱,其余树脂柱依旧独立,分别通入水、酸、水进行再生;将步骤2中解吸区中的两根串联的树脂柱分开,切换至步骤1中解析区;步骤2中再生区的最后一根树脂柱切换到步骤1中的吸附区,同时将再生区串联的树脂柱分开;循环进行步骤1和步骤2;保证所有树脂柱同步切换,同时再生区按照碱-水-酸-水的方向进行切换,树脂柱切换时间优选为120min~300min。其中,解吸区中所述的稀碱为浓度为0.05~0.50mol/L的氢氧化钠水溶液。其中,再生区中所述的酸为浓度为0.80~1.50mol/L的盐酸水溶液;所述的碱为浓度为0.80~1.50mol/L的氢氧化钠水溶液。其中,吸附区,吸附流速为0.2~2.5BV/h;解吸区,解吸流速为1.5~5.5BV/h;再生区,再生流速为0.3~3.5BV/h。第二种处理工艺:当连续分离装置中树脂柱数量为8~25根时,采用三区式两步骤的连续离子交换色谱分离四种5’-核苷酸的方法包括循环操作的两个步骤:步骤1:树脂柱分为吸附区、解吸区和再生区三个区,其中,吸附区为1根树脂柱,解吸区为3根以上的树脂柱,再生区为4根以上的树脂柱;吸附区:按0.02~0.05g5’-核苷酸/g湿树脂的上样量吸附预处理后的酶解液,大部分UMP未被树脂柱吸附而流出,吸附完成后,用水洗脱树脂柱,水洗脱初期剩余UMP被快速洗出,随后部分GMP也被洗出同时与UMP完全分离,水洗脱过程持续到CMP即将流出为止;解析区:3根以上的树脂柱串联,用稀碱洗脱,在倒数第二根树脂柱出口处安装三通阀,使得倒数第二根树脂柱流出液中一半流出收集AMP,另外一半流入最后一根树脂柱,最后一根树脂柱出口收集CMP;再生区:4根树脂柱独立设置,分别通入碱、水、酸、水进行再生;超过4根的树脂柱则并入碱、水、酸再生的任一环节与该环节中的其他树脂柱串联;步骤2:树脂柱分为解吸区和再生区两个区,其中,再生区中树脂柱数量不变;其余树脂柱为解吸区;步骤1中再生区的最后一根树脂柱切换到步骤1中吸附区的树脂柱之后与其串联,形成步骤2中的解吸区的第一部分;步骤1中解吸区的第一根树脂柱同时切换到步骤1中的再生区,作为步骤2中再生区的第一根树脂柱;步骤1中解析区的第二根及与其串联的之后的树脂柱依旧保持串联,作为步骤2中解吸区的第二部分;步骤2中解析区的第一部分和第二部分独立处理;解吸区:第一部分,通入水洗脱,将步骤1中未洗脱完全的剩余GMP完全洗出,通入水洗脱至两根树脂柱中的第一根树脂柱内完全为AMP,第二根树脂柱中完全是CMP;第二部分,通入稀碱洗脱至最后一根树脂柱中无AMP流出,并且在最后一根树脂柱出口收集AMP;再生区:4根树脂柱独立设置,分别通入碱、水、酸、水进行再生;超过4根的树脂柱则并入碱、水、酸再生的任一环节与该环节中的其他树脂柱串联;将步骤2中解吸区第二部分第一根树脂柱切换至步骤2中的再生区作为步骤1中再生区的第一根树脂柱;步骤2中再生区的最后一根树脂柱切换到步骤1中的吸附区;步骤2中解吸区第二部分的第二根树脂柱与解吸区第一部分的树脂柱串联,作为步骤1中的解吸区;循环进行步骤1和步骤2;保证所有树脂柱同步切换,同时再生区按照碱-水-酸-水的方向进行切换,树脂柱切换时间优选为120min~300min。其中,解吸区中所述的稀碱为浓度为0.05~0.50mol/L的氢氧化钠水溶液。其中,再生区中所述的酸为浓度为0.80~1.50mol/L的盐酸水溶液;所述的碱为浓度为0.80~1.50mol/L的氢氧化钠水溶液。其中,吸附区,吸附流速为0.2~2.5BV/h;解吸区,解吸流速为1.5~5.5BV/h;再生区,再生流速为0.3~3.5BV/h。通过上述两种工艺,得到的四种核苷酸产品中除UMP外其他三种核苷酸的纯度可达98%,UMP纯度为92%~95%,另外,产品中四种核苷酸的平均收率可达到97%。有益效果:本发明开发了一种新型的连续离子交换色谱技术分离四种核苷酸,具有如下优点:1)该分离工艺所用的吸附剂只有一种凝胶型强酸性阳离子交换树脂,再生较容易;而邱蔚然等人在2001年发表的专利《从核糖核酸酶解液中分离核苷酸的方法》中提出采用两根阳离子交换树脂柱、一根大孔弱碱性阴离子交换树脂柱和一根弱碱性阴离子交换树脂柱分离核苷酸,不仅操作繁琐,而且再生困难,我们的工艺与之相比较,优势明显。2)该分离工艺使用了较少的树脂柱(7~25根)分离四种组分;而应汉杰、吕浩等人在2006年发表专利《一种利用模拟移动床分离制备5”-核苷酸的方法》,该篇专利中使用树脂柱数目较多(6~60根),我们的工艺与之相比,树脂柱数目较少,分离效率较高。3)该分离工艺采用稀碱作为洗脱CMP和AMP的解吸剂,洗脱速率比用水作洗脱剂时速度有所提高,而应汉杰、吕浩等人2006年的专利《一种利用模拟移动床分离制备5”-核苷酸的方法》中使用水作为洗脱剂,我们的工艺与之相比,洗脱速率比用水作为洗脱剂的洗脱速率快,从而降低核苷酸在树脂中的停留时间,减少核苷酸的降解,因此核苷酸的收率也比2006年专利中核苷酸产品的收率更高。4)本发明采用一种新型的三区式、两步骤的连续离子交换技术完成四种核苷酸的连续分离,突破了传统的四区式模拟移动床的方法,这种新型的两步骤的操作方式在核苷酸以及其他物质分离工艺上很少有使用,应汉杰、吕浩等人2006年的专利《一种利用模拟移动床分离制备5”-核苷酸的方法》中采用四区式的分离方式,缺乏创新性,我们的工艺与之相比大大提高了分离效率。5)本发明较四区式工艺分离四种核苷酸,可实现树脂用量节约40%~60%,解吸剂、再生剂的用量节约20%~45%,操作费用节约35%~65%,投资费用节约45%~60%,所有操作均可在室温下进行,大大降低了分离过程的能耗。6)本发明的连续分离工艺简单易行,设备投资、运行成本低廉,并可进行工艺放大,实现从公斤级到吨级的分离,效果好。废水排放量低,避免环境污染问题,是一种简单高效的生产工艺,不仅可用于核苷酸的分离,还可应用于其他糖类、同分异构体等化学物质的分离提纯。附图说明图1实施例2连续分离工艺的步骤1的示意图;图2实施例2连续分离工艺的步骤2的示意图;图3实施例3连续分离工艺的步骤1的示意图;图4实施例3中步骤1中的吸附区出口UMP、GMP的流出曲线;图5实施例3中步骤1中的解吸区出口CMP的流出曲线;图6实施例3中步骤1中的解吸区出口AMP的流出曲线;图7实施例3连续分离工艺的步骤2的示意图;图8实施例3中步骤2中的解吸区出口GMP的流出曲线;图9实施例2中步骤2中的解吸区出口AMP的流出曲线;图10实施例4连续分离工艺的步骤1的示意图;图11实施例4连续分离工艺的步骤2的示意图。具体实施方式根据下述实施例,可以更好地理解本发明。然而,本领域的技术人员容易理解,实施例所描述的内容仅用于说明本发明,而不应当也不会限制权利要求书中所详细描述的本发明。以下实施例中使用外标法对料液中的5’-尿嘧啶核苷酸、5’-胞嘧啶核苷酸、5’-鸟嘌呤核苷酸、5’-腺嘌呤核苷酸浓度进行检测,色谱条件为:1)检测器:Agilent1200型高效液相色谱仪-紫外检测器;2)色谱柱:安捷伦液相色谱柱(C18,5μm,250×4.6mm);3)流动相:20mmol/L磷酸二氢铵,3.5%甲醇;4)流速:1mL/min;5)柱温:25℃;检测方法及步骤:1)色谱柱的平衡:配制好的流动相20mmol/L磷酸二氢铵用孔径0.22μm的混合微孔滤膜过滤,再进行超声处理30min。用处理好的流动相以梯度洗脱的方法流速冲洗色谱柱,同时开启柱温箱,开始采集基线,待基线趋于直线时,平衡结束。梯度洗脱方法见表1。表1时间%B%C流速0.00100.00.01.0002.00100.00.01.0008.0089.011.01.0009.0089.011.01.00010.00100.00.01.00015.00100.00.01.0002)样品的检测:按照色谱条件编写进样序列及方法,将过膜处理后的标准品及样品按照进样序列置于自动进样器的相应位置上,开始进样并收集图谱信息。使用以下公式计算解吸后的核苷酸的收率:收率(%)=m解吸/m进×100%其中m解吸、m进分别表示为核苷酸在吸附段进样与解吸段流出的质量之比。以下实施例采用三区式两步骤的连续离子交换色谱分离四种5’-核苷酸为利用7~25根装有凝胶型强酸性阳离子交换树脂柱的连续分离装置分离四种5’-核苷酸。其中,所述的凝胶型强酸性阳离子交换树脂以聚苯乙烯二乙烯基苯为骨架,磺酸基-SO3-为功能基团,其型号优选为NH-1,平均粒径为394.1~416.5μm,湿密度为1.02~1.06g/L,含水量为30~60%。实施例1:酶解液的获得。称取质量30~70gRNA粉末,用超纯水溶解,然后升温至70℃,在其中加入占RNA粉末5~8wt%的核酸酶P1进行酶解反应,酶解进行4h后,在溶液中加入0.2wt%的活性炭,继续酶解1h,然后再在溶液中加入占RNA粉末的10wt%的壳聚糖絮凝剂,酶解液制作完成。将酶解得到的酶解液经过10min的离心之后,再经过脱色树脂柱SX-1脱色,脱色10h后得到我们所需要的酶解液。实施例2:连续离子交换色谱技术分离酶解液中四种核苷酸。连续分离装置中树脂柱数量为7根,采用三区式两步骤的连续离子交换色谱分离四种5’-核苷酸的方法包括循环操作的两个步骤:步骤1(图1):7根树脂柱分为吸附区、解吸区和再生区三个区,其中,吸附区为1根树脂柱,解吸区为2根树脂柱,再生区为4根树脂柱;每根树脂柱装填100g树脂(NH-1),树脂柱直径3.0cm,高度23cm。吸附区:按0.036g5’-核苷酸/g湿树脂的上样量吸附预处理后的酶解液,酶解液浓度:尿嘧啶核苷酸4g/L,胞嘧啶核苷酸6g/L,鸟嘌呤核苷酸10g/L,腺嘌呤核苷酸11g/L,上样时间为2h,上样流速为0.42BV/h;此时大部分UMP不与树脂发生离子交换流出,其余几种核苷酸与树脂发生离子交换并吸附至树脂中,吸附完成后,用水洗脱树脂柱,洗脱流速为1.56BV/h,水洗脱初期树脂间隙中剩余UMP被快速洗出,随后部分GMP也被洗出同时与UMP完全分离,洗脱出来的GMP的量大约为440mL,水洗脱过程持续到CMP即将流出为止;解吸区:两根树脂柱独立设置,分别用0.2mol/L氢氧化钠水溶液洗脱两根树脂柱,分别得到AMP和CMP,流速为2.39BV/h。再生区:四根树脂柱独立设置,分别通入碱、水、酸、水进行再生;即:使用1.2mol/L氢氧化钠对再生区中第一根树脂柱进行杂质的去除,流量1.3BV/h,使用纯水以1.5BV/h流量将再生区中第二根树脂柱中氢氧化钠冲洗干净至流出液pH为9.5,使用1.2mol/L的盐酸将再生区中第三根树脂转化为氢离子型,流量1.3BV/h,使用纯水以1.5BV/h流量将再生区中第四根树脂柱中树脂间隙里的盐酸冲洗干净至流出液pH为4,再生完全。步骤2(图2):7根树脂柱分为解吸区和再生区两个区,其中,解吸区为2根树脂柱,再生区为5根树脂柱;步骤1中再生区的最后一根树脂柱切换到步骤1中吸附区的树脂柱之后与其串联,形成步骤2中的解吸区;步骤1中解吸区的两根树脂柱同时切换到步骤1中的再生区,串联后作为步骤2中再生区的第一根和第二根树脂柱;解吸区:两根树脂柱串联,通入水洗脱,洗脱流速为1.52BV/h。步骤1中未洗脱完全的剩余GMP完全洗出,通入水洗脱至两根树脂柱中的第一根树脂柱内完全为AMP,第二根树脂柱中完全是CMP;再生区:串联的两个树脂柱通入碱,其余树脂柱依旧独立,分别通入水、酸、水进行再生;其中,使用1.2mol/L氢氧化钠对再生区中第一根树脂柱进行杂质的去除,流量0.65BV/h,使用纯水以1.5BV/h流量将再生区中第二根树脂柱中氢氧化钠冲洗干净至流出液pH为9.5,使用1.2mol/L的盐酸将再生区中第三根树脂转化为氢离子型,流量1.3BV/h,使用纯水以1.5BV/h流量将再生区中第四根树脂柱中树脂间隙里的盐酸冲洗干净至流出液pH为4,再生完全。将步骤2中解吸区中的两根串联的树脂柱分开,切换至步骤1中解吸区;步骤2中再生区的最后一根树脂柱切换到步骤1中的吸附区,同时将再生区串联的树脂柱分开;循环进行步骤1和步骤2;所有树脂柱同步切换,同时再生区按照碱-水-酸-水的方向进行切换,树脂柱切换时间为240min。通过该连续离子交换色谱工艺实现了四种5’-核苷酸的连续分离,四种核苷酸也实现完全分离,并且经过六次切换之后得到四种核苷酸产物,分别是:尿苷酸(UMP)、鸟苷酸(GMP)、胞苷酸(CMP)和腺苷酸(AMP),经检测纯度分别为91.64%、98.25%、98.12%、98.36%,收率分别为98.75%、98.35%、98.34%、97.56%。另外四种核苷酸产物的浓度分别为2.51g/L、0.65g/L、0.40g/L、0.36g/L。实施例3:连续离子交换色谱技术分离酶解液中四种核苷酸。连续分离装置中树脂柱数量为9根,采用三区式两步骤的连续离子交换色谱分离四种5’-核苷酸的方法包括循环操作的两个步骤:步骤1(图3):树脂柱分为吸附区、解吸区和再生区三个区,其中,吸附区为1根树脂柱,解吸区为3根树脂柱,再生区为5根树脂柱;吸附区:按0.025g5’-核苷酸/g湿树脂的上样量吸附预处理后的酶解液,酶解液浓度:尿嘧啶核苷酸4g/L,胞嘧啶核苷酸6g/L,鸟嘌呤核苷酸10g/L,腺嘌呤核苷酸11g/L,上样时间为2h,上样流速为0.26BV/h;此时大部分UMP不与树脂发生离子交换流出,其余几种核苷酸与树脂发生离子交换并吸附至树脂中,吸附完成后,用水洗脱树脂柱,洗脱流速为1.52BV/h,水洗脱初期树脂间隙中剩余UMP被快速洗出,随后部分GMP也被洗出同时与UMP完全分离,洗脱出来的GMP的量大约为200mL,水洗脱过程持续到CMP即将流出为止;如图4核苷酸随时间变化的浓度曲线可知,UMP与GMP实现完全分离。解吸区:3根树脂柱串联,用0.05mol/L氢氧化钠溶液洗脱,洗脱流速为2.39BV/h在倒数第二根树脂柱出口处安装三通阀,使得倒数第二根树脂柱流出液中一半流出收集AMP,另外一半流入最后一根树脂柱,最后一根树脂柱出口收集CMP;如图5和图6所示,AMP随时间变化的浓度曲线呈现上升的趋势,而CMP随时间变化呈现先上升再下降的趋势,因此CMP和AMP可以实现完全分离,图中没有其他核苷酸的渗入。再生区:5根树脂柱左边3根树脂柱独立设置从左往右分别泵入再生剂水、酸、水进行再生,后面两根树脂柱串联泵入碱进行再生;即使用1.2mol/L氢氧化钠对再生区中前两根即右边两根树脂柱进行杂质的去除,流量0.65BV/h,使用纯水以1.5BV/h流量将再生区中第二根树脂柱中氢氧化钠冲洗干净至流出液pH为9.5,使用1.2mol/L的盐酸将再生区中第三根树脂转化为氢离子型,流量1.3BV/h,使用纯水以1.5BV/h流量将再生区中第四根树脂柱中树脂间隙里的盐酸冲洗干净至流出液pH为4,再生完全。步骤2(图7):9根树脂柱分为解吸区和再生区两个区,其中,解吸区为4根树脂柱,再生区为5根树脂柱;步骤1中再生区的最后一根树脂柱切换到步骤1中吸附区的树脂柱之后与其串联,形成步骤2中的解吸区的第一部分;步骤1中解吸区的第一根树脂柱同时切换到步骤1中的再生区,作为步骤2中再生区的第一根树脂柱;步骤1中解析区的第二根及与其串联的之后的树脂柱依旧保持串联,作为步骤2中解吸区的第二部分;步骤2中解析区的第一部分和第二部分独立处理;解吸区:第一部分,通入水洗脱,将步骤1中未洗脱完全的剩余GMP完全洗出,通入水洗脱至两根树脂柱中的第一根树脂柱内完全为AMP,第二根树脂柱中完全是CMP,洗脱流速为1.26BV/h;如图8所示,GMP随时间变化呈现先上升再下降的趋势,并且没有其他核苷酸的渗入。第二部分,通入0.05mol/L氢氧化钠水溶液洗脱至前一根树脂柱中无AMP流出,并且在最后一根树脂柱出口收集AMP,体积大约为600mL;如图9所示,AMP随时间变化呈现上升的趋势,并没有下降的趋势。再生区:同步骤1中的操作。将步骤2中解吸区第二部分第一根树脂柱切换至步骤2中的再生区作为步骤1中再生区的第一根树脂柱;步骤2中再生区的最后一根树脂柱切换到步骤1中的吸附区;步骤2中解吸区第二部分的第二根树脂柱与解吸区第一部分的树脂柱串联,作为步骤1中的解吸区;循环进行步骤1和步骤2;保证所有树脂柱同步切换,同时再生区按照碱-水-酸-水的方向进行切换。树脂柱切换时间优选为240min。通过该连续离子交换色谱工艺实现了四种5’-核苷酸的连续分离,四种核苷酸也实现完全分离,并且经过六次切换之后得到四种核苷酸产物,分别是:尿苷酸(UMP)、鸟苷酸(GMP)、胞苷酸(CMP)和腺苷酸(AMP),经检测纯度分别为91.65%、97.28%、97.16%、97.39%,收率分别为97.76%、97.32%、97.39%、96.58%。另外四种核苷酸产物的浓度分别为2.53g/L、0.68g/L、0.39g/L、1.96g/L,其中AMP浓度较实施例2中浓度有所提高。实施例4:连续离子交换色谱技术分离酶解液中四种核苷酸。连续分离装置中树脂柱数量为12根,采用三区式两步骤的连续离子交换色谱分离四种5’-核苷酸的方法包括循环操作的两个步骤:步骤1(图10):树脂柱分为吸附区、解吸区和再生区三个区,其中,吸附区为1根树脂柱,解吸区为5根树脂柱,再生区为6根树脂柱;吸附区:按0.042g5’-核苷酸/g湿树脂的上样量吸附预处理后的酶解液,酶解液浓度:尿嘧啶核苷酸4g/L,胞嘧啶核苷酸6g/L,鸟嘌呤核苷酸10g/L,腺嘌呤核苷酸11g/L,上样时间为2h,上样流速为0.52BV/h;此时大部分UMP不与树脂发生离子交换流出,其余几种核苷酸与树脂发生离子交换并吸附至树脂中,吸附完成后,用水洗脱树脂柱,洗脱流速为1.65BV/h,水洗脱初期树脂间隙中剩余UMP被快速洗出,随后部分GMP也被洗出同时与UMP完全分离,洗脱出来的GMP的量大约为540mL水洗脱过程持续到CMP即将流出为止;解吸区:5根树脂柱串联,用0.2mol/L氢氧化钠溶液洗脱,洗脱流速为3.9mL/min在倒数第二根树脂柱出口处安装三通阀,使得倒数第二根树脂柱流出液中一半流出收集AMP,另外一半流入最后一根树脂柱,最后一根树脂柱出口收集CMP;再生区:6根树脂柱左边两根树脂柱串联设置,第三根树脂柱独立设置,第四根和第五根树脂柱串联,最后一根独立设置,从左往右分别泵入再生剂水、酸、水、碱进行再生,即:使用1.2mol/L氢氧化钠对再生区中最右边一根树脂柱进行杂质的去除,流量1.3BV/h,使用纯水以0.75BV/h流量将再生区中第四根和第五根树脂柱中氢氧化钠冲洗干净至流出液pH为9.5,使用1.2mol/L的盐酸将再生区中第三根树脂转化为氢离子型,流量1.3BV/h,使用纯水以0.75BV/h流量将再生区中第一根和第二根树脂柱中树脂间隙里的盐酸冲洗干净至流出液pH为4,再生完全。步骤2(图11):12根树脂柱分为解吸区和再生区两个区,其中,解吸区为6根树脂柱,再生区为6根树脂柱;步骤1中再生区的最后一根树脂柱切换到步骤1中吸附区的树脂柱之后与其串联,形成步骤2中的解吸区的第一部分;步骤1中解吸区的第一根树脂柱同时切换到步骤1中的再生区,作为步骤2中再生区的第一根树脂柱;步骤1中解析区的第二根及与其串联的之后的树脂柱依旧保持串联,作为步骤2中解吸区的第二部分;步骤2中解析区的第一部分和第二部分独立处理;解吸区:第一部分,通入水洗脱,将步骤1中未洗脱完全的剩余GMP完全洗出,通入水洗脱至两根树脂柱中的第一根树脂柱内完全为AMP,第二根树脂柱中完全是CMP,洗脱流速为3.6mL/min;第二部分,通入0.2mol/L的氢氧化钠水溶液洗脱至前一根树脂柱中无AMP流出,并且在最后一根树脂柱出口收集AMP,体积大约为800mL;再生区:同步骤1中再生区的操作。将步骤2中解吸区第二部分第一根树脂柱切换至步骤2中的再生区作为步骤1中再生区的第一根树脂柱;步骤2中再生区的最后一根树脂柱切换到步骤1中的吸附区;步骤2中解吸区第二部分的第二根树脂柱与解吸区第一部分的树脂柱串联,作为步骤1中的解吸区;循环进行步骤1和步骤2;保证所有树脂柱同步切换,同时再生区按照碱-水-酸-水的方向进行切换。树脂柱切换时间优选为240min。通过该连续离子交换色谱工艺实现了四种5’-核苷酸的连续分离,四种核苷酸也实现完全分离,并且经过六次切换之后得到四种核苷酸产物,分别是:尿苷酸(UMP)、鸟苷酸(GMP)、胞苷酸(CMP)和腺苷酸(AMP),经检测纯度分别为92.89%、98.79%、98.54%、98.89%,收率分别为98.57%、98.82%、98.94%、97.39%。另外四种核苷酸产物的浓度分别为2.53g/L、0.68g/L、0.46g/L、2.03g/L,其中AMP浓度较实施例2中浓度有所提高,与实施例3中浓度相类似。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1