类角膜内皮细胞的获取方法与流程
本发明涉及一种类角膜内皮细胞的获取方法,属于细胞生物技术领域。
背景技术:
角膜内皮细胞是一个有规律六边形排列的单层细胞,是角膜基质与房水前房隔开的生理屏障,并在保持角膜透明度方面发挥关键作用。角膜内皮细胞减少或损伤的原因有:①随着年龄的增加逐渐减少;②感染、炎症、外伤(如机械伤、化学伤、产伤、激光射线等)、眼部手术(如白内障手术,抗青光眼手术,及其他眼内操作如前房异物取出等)、遗传性疾病、代谢性疾病等都可引起内皮细胞的减少和损伤。因为成体角膜内皮细胞没有增殖能力,受损后主要依赖损伤区周边细胞的扩展和移行进行修复,当角膜内皮细胞的密度变得极低,内皮细胞障碍物和泵的功能将不足以维持适当的基质水合作用,导致角膜失代偿或大疱性角膜病变或角膜水肿,患者视力受损并最终视力丧失。
临床上,角膜移植是治疗人类角膜内皮细胞疾病唯一有效的疗法。但是角膜供体来源匮乏是全世界面临的难题,极大地限制了角膜移植手术的开展,使众多角膜病患者不能得到及时医治,只能在痛苦中等待角膜材料,带来极大的社会负担。近年来,随着角膜移植技术的进步,Descemet膜技术(DMEK)的开发,即只有角膜内皮和Descemet膜来实现良好的视力恢复技术。然而,这种疗法显著限制于角膜内皮细胞捐赠来源的短缺。因此,基于干细胞的技术被认为是替代治疗人角膜内皮细胞缺失引起的疾病的一种很有前途的方法。
技术实现要素:
本发明的目的在于克服上述不足之处,提供了体外分化人类多能干细胞获取类角膜内皮细胞的方法。
本发明还提供了体外分化获取的类角膜内皮细胞的鉴定指标。
为实现上述技术目的,达到上述技术效果,本发明通过以下技术方案实现:
类角膜内皮细胞的获取方法,步骤如下:
(1)拟胚体的获取:将人类胚胎干细胞培养在小鼠胚胎成纤维细胞上,用胶原酶Ⅳ和DispaseII铺满培养器皿进行消化后,采用无血清培养基培养,以获取拟胚体;
(2)预分化培养:将步骤(1)获取的拟胚体采用补充了头蛋白和TGF-β1受体抑制剂的分化培养基A中培养4~5天或分化培养基B中培养12~16天,即获得预分化培养中间细胞;
(3)分化培养:将步骤(2)预分化培养后中间细胞转移至包被了硫酸软骨素和层粘连蛋白的培养器皿中,采用分化培养基C培养7~8天或采用分化培养基D培养25~40天,即获得类角膜内皮细胞。
步骤(1)中所述的胶原酶Ⅳ和中性蛋白酶DispaseII的配比是1:1~5,其中配置前,胶原酶Ⅳ的浓度为400-1000U/mL,中性蛋白酶DispaseII的浓度为1~6U/mL;
无血清培养基:基础培养基为DMEM/F12培养基,并添加了10%~20%的血清替代物,10~20ng/mL的碱性成纤维细胞生长因子,1×非必需氨基酸,2mM的GlutaMAXTM培养基及添加剂,100单位/mL的青-链双抗,0.1mM的β-巯基乙醇;
所述的步骤(2)中补充头蛋白后的浓度是300~1000ng/mL;补充TGF-β1受体抑制剂后的浓度是2.5~15μM。
步骤(2)中所述分化培养基A:基础培养基DMEM/F12培养基,添加了1×N2添加剂,10~20ng/mL碱性成纤维细胞生长因子,1×非必需氨基酸,2mM GlutaMAXTM培养基及添加剂,100单位/mL青-链双抗,2~10ng/mL重组人胰岛素;
分化培养基B:基础培养基DMEM/F12培养基,按质量比添加5%~20%血清替代物,1×非必需氨基酸,2mM GlutaMAXTM培养基及添加剂,100单位/mL青-链双抗,0.1mMβ-巯基乙醇。
所述的步骤(3)培养器皿包被的硫酸软骨素浓度为10~50mg/mL;层粘连蛋白浓度为1~10μg/mL;
步骤(3)中所述分化培养基C:基础培养基由DMEM/F12和M199以1~1.5:1的比例配制而成,并添加了5%~20%胎牛血清,1×非必需氨基酸,2mM GlutaMAXTM培养基及添加剂,100单位/mL青-链霉素青链双抗,2~10ng/mL重组人胰岛素,20~50mg/mL左旋维生素C,10~20ng/mL碱性成纤维细胞生长因子。
所述的步骤(3)中的分化培养基D是:以分化培养基C培养牛角膜内皮细胞,并收集培养过牛角膜内皮细胞的条件培养基,将条件培养基和新鲜的分化培养基C以1:1~1.5的比例配制而成,并添加了由200~1000nM重组人Dickkopf相关蛋白、2.5~20ng/mL血小板衍生生长因子和2.5~10ng/mL转化生长因子β组成的趋化因子组合物。
所述条件培养基的获取步骤为:牛角膜内皮细胞的培养,将装有牛角膜内皮细胞的冻存管从超低温冰箱取出,迅速转移至37℃水浴锅内将管内快速溶解,将冻存管内细胞悬液移至15mL离心管内,加入5~10mL分化培养基C,1000转/分钟离心5分钟后弃上清,再加入4~6mL分化培养基C重悬细胞沉淀,最后将细胞加入1~10μg/mL层粘连蛋白和10~50μg/mL硫酸软骨素包被的培养瓶内,置于37℃,体积浓度为5%CO2的培养箱内培养,过夜后换液;每两日换液一次,收集每两日培养过牛角膜内皮细胞的培养基,即得条件培养基。
将预分化培养所获取的中间细胞的标志物HNK-1和P75免疫荧光染色呈阳性表达;获取的类角膜内皮细胞的标志物钠-钾-ATP酶,S100A4蛋白,水通道蛋白-1,即AQP-1和紧密连接蛋白ZO-1免疫染色呈阳性表达。
所述的类角膜内皮细胞在人角膜内皮细胞缺失引起的疾病中的应用。
本发明的有益效果是:
(1)本发明提供的通过体外分化人类多能干细胞的方法获得类角膜内皮细胞,可以作为替代捐赠的角膜内皮细胞的理想细胞来源。
(2)本发明方法采用商业化的人类胚胎干细胞,因为其具有自我复制和无限增殖的能力以及分化潜能,因此类角膜内皮细胞的获得具有充足的来源。
(3)本发明解决了类角膜内皮细胞在体外分化率低的问题,提高了类角膜内皮细胞在体外分化效率,自拟胚体阶段至获取类角膜内皮细胞时间最快为11天。
(4)本发明提供的体外分化获取的类角膜内皮细胞的鉴定方法,可以被用于进行类角膜内皮细胞的质量控制,为未来使用类角膜内皮细胞治疗角膜内皮细胞缺失疾病铺平了道路。
(5)本发明方法获得类角膜内皮细胞,为Descemet膜技术(DMEK)的开发,奠定了基础,具有非常重要的临床意义和广阔的应用前景。
(6)本发明方法技术方案简便、易操作。
附图说明
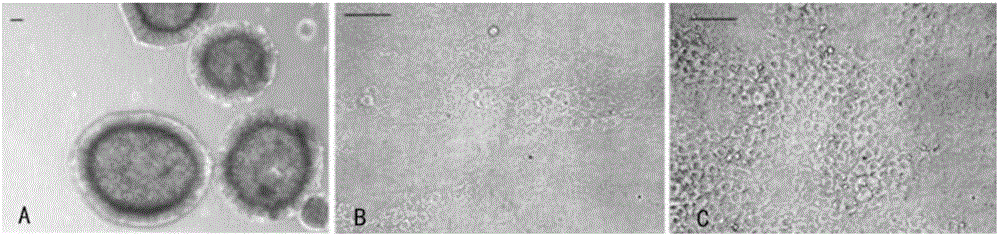
图1细胞示意图。a、拟胚体分化示意图;b、实施例4-2类角膜内皮细胞示意图;c、实施例4-3类角膜内皮细胞示意图。
图2免疫荧光染色结果示意图。a、实施例5-1免疫荧光染色结果;b、钠-钾-ATP酶免疫荧光染色结果示意图;c、S100A4蛋白免疫荧光染色结果示意图;d、水通道蛋白-1免疫荧光染色结果示意图;e、紧密连接蛋白ZO-1免疫荧光染色结果示意图。
具体实施方式
下面将参考附图并结合实施例,来详细说明本发明。
本发明所用培养基及其添加物如无特殊说明,均来自Gibco公司和Sigma公司。
实施例1培养基的配置
1.无血清培养基的配制
基础培养基为DMEM/F12培养基,并添加了15%的血清替代物,15ng/mL的碱性成纤维细胞生长因子,1×非必需氨基酸,2mM的GlutaMAXTM培养基及添加剂,100单位/mL的青-链双抗,0.1mM的β-巯基乙醇,配制成无血清培养基,4℃避光保存备用。
2.分化培养基A的配制
基础培养基为DMEM/F12培养基,并添加了1×N2添加剂,12ng/mL碱性成纤维细胞生长因子,1×非必需氨基酸,2mM GlutaMAXTM培养基及添加剂,100单位/mL青-链双抗,2ng/mL重组人胰岛素,配制成分化培养基A,4℃避光保存备用。
3.分化培养基B的配制
基础培养基为DMEM/F12培养基,并添加了10%血清替代物,1×非必需氨基酸,2mM GlutaMAXTM培养基及添加剂,100单位/mL青-链双抗,0.1mMβ-巯基乙醇,配制成分化培养基B,4℃避光保存备用。
4.分化培养基C的配制
基础培养基由DMEM/F12和M199以1.2:1配制而成,并添加了5%胎牛血清,1×非必需氨基酸,2mM GlutaMAXTM培养基及添加剂,100单位/mL青-链双抗,2ng/mL重组人胰岛素,30mg/mL左旋维生素C,12ng/mL碱性成纤维细胞生长因子,配制成分化培养基C,4℃避光保存备用。
5.分化培养基D的获取和配制
(1)条件培养基的获取
牛角膜内皮细胞的培养,将装有牛角膜内皮细胞的冻存管从超低温冰箱取出,迅速转移至37℃水浴锅内将管内快速溶解,将冻存管内细胞悬液移至15m1离心管内,加入5mL分化培养基C,1000转/分钟离心5分钟后弃上清,再加入4mL分化培养基C重悬细胞沉淀,最后将细胞加入l0ug/mL层粘连蛋白和l0ug/mL硫酸软骨素包被的培养瓶内,置于37℃,5%CO2培养箱内培养,过夜后换液,以后每两日换液一次,收集每两日培养过牛角膜内皮细胞的培养基为条件培养基。
(2)分化培养基D的配制
将条件培养基和新鲜的分化培养基C以1:1.2的比例配制,并添加了由200nM重组人Dickkopf相关蛋白2、5ng/mL血小板衍生生长因子和5ng/mL转化生长因子β组成的趋化因子组合物,配制成分化培养基D,4℃避光保存备用。
实施例2类角膜内皮细胞的获取方法
1.商业化人胚胎干细胞的培养
常规培养小鼠胚胎成纤维细胞,取其3-4代作为饲养层,采用添加白血病抑制因子(LIF)的培养基中诱导增殖,并维持其未分化状态。
2.拟胚体的获取
将上述培养的商业化人胚胎干细胞用胶原酶Ⅳ和DispaseII以1:2配比配制并消化后,采用所配制的无血清培养基培养人胚胎干细胞,直至其分化形成菊形团,即为拟胚体,如图1a所示。
实施例3预分化培养
1.预分化培养之操作一
将实施例2获取的拟胚体采用补充了500ng/mL头蛋白和10μM TGF-β1受体抑制剂的具体实施例1中配制的分化培养基A中培养4天;
2.预分化培养之操作二
将实施例2中获取的拟胚体采用补充了500ng/mL头蛋白和10μM TGF-β1受体抑制剂的具体实施例1中配制的分化培养基B中培养2周;
实施例4类角膜内皮细胞的获取
1.类角膜内皮细胞的获取之操作一
将实施例3操作一中预分化培养后的中间细胞转移至包被了25mg/mL硫酸软骨素和1μg/mL层粘连蛋白的T25培养瓶中培养7天,采用具体实施例1中配制的分化培养基C,即获得类角膜内皮细胞。
2.类角膜内皮细胞的获取之操作二
(1)将实施例3操作一中预分化培养后的中间细胞转移至包被了25mg/mL硫酸软骨素和1μg/mL层粘连蛋白的T25培养瓶中培养25天,采用具体实施例1中配制的分化培养基D,即获得类角膜内皮细胞。
(2)将实施例3操作一中预分化培养后的中间细胞转移至包被了25mg/mL硫酸软骨素和1μg/mL层粘连蛋白的T25培养瓶中培养30天,采用具体实施例1中配制的分化培养基D,即获得类角膜内皮细胞。
(3)将实施例3操作一中预分化培养后的中间细胞转移至包被了25mg/mL硫酸软骨素和1μg/mL层粘连蛋白的T25培养瓶中培养40天,采用具体实施例1中配制的分化培养基D,即获得类角膜内皮细胞,如图1b所示。
3.类角膜内皮细胞的获取之操作三
将具体实施例3操作二中预分化培养后的中间细胞转移至包被了25mg/mL硫酸软骨素和1μg/mL层粘连蛋白的T25培养瓶中培养7天,采用具体实施例1中配制的分化培养基C,即获得类角膜内皮细胞。
4.类角膜内皮细胞的获取之操作四
(1)将实施例3操作二中预分化培养后的中间细胞转移至包被了25mg/mL硫酸软骨素和1μg/mL层粘连蛋白的T25培养瓶中培养25天,采用具体实施例1中配制的分化培养基D,即获得类角膜内皮细胞。
(2)将实施例3操作二中预分化培养后的中间细胞转移至包被了25mg/mL硫酸软骨素和1μg/mL层粘连蛋白的T25培养瓶中培养28天,采用具体实施例1中配制的分化培养基D,即获得类角膜内皮细胞。
(3)将实施例3操作二中预分化培养后的中间细胞转移至包被了25mg/mL硫酸软骨素和1μg/mL层粘连蛋白的T25培养瓶中培养38天,采用具体实施例1中配制的分化培养基D,即获得类角膜内皮细胞,如图1c所示。
实施例5
1.将实施例3操作一和操作二中预分化培养后的中间细胞进行免疫染色,具体操作是:
(1)将拟胚体用含4%多聚甲醛的0.1M PBS缓冲溶液在室温下固定30分钟;
(2)用0.5%triton X-100(PBS配制)对细胞透化处理10分钟;
(3)PBS洗三遍,每次5分钟;
(4)2%BSA封闭30分钟,PBS洗两遍;
(5)加入一抗:HNK-1(1:100),室温孵育1小时;
(6)PBS洗三遍,每次5分钟;
(7)加入标记有Cy2和Cy3的二抗,室温孵育30-45分钟;
(8)PBS洗四遍,每次5分钟;
(9)加入0.5μg/mL DAPI(PBS配制)染色10分钟;
(10)用PBS洗三遍,去除多余的DAPI;
(11)加入20μl封片剂封片。
免疫荧光染色结果显示:预分化培养所获取的中间细胞的标志物HNK-1免疫染色呈阳性表达,如图2a所示。
2.将具体实施例4操作二第(1)步中获得类角膜内皮细胞进行免疫染色,具体操作是:
(1)实验前一天,将细胞分别接种至铺有22×22mm盖玻片的六孔板中。
(2)第二天,待细胞汇合度达到70%左右开始进行染色步骤。
(3)将类角膜内皮细胞用含4%多聚甲醛的0.1M PBS缓冲溶液在室温下固定30分钟;
(4)用0.5%triton X-100(PBS配制)对细胞透化处理10分钟;
(5)PBS洗三遍,每次5分钟;
(6)2%BSA封闭30分钟,PBS洗两遍;
(7)分别加入一抗:钠-钾-ATP酶(1:100)、S100A4蛋白(1:100)、AQP-1(1:100)和ZO-1(1:100),室温孵育1小时;
(8)PBS洗三遍,每次5分钟;
(9)加入标记有Cy2和Cy3的二抗,室温孵育30-45分钟;
(10)PBS洗四遍,每次5分钟;
(11)加入0.5μg/mL DAPI(PBS配制)染色10分钟;
(12)用PBS洗三遍,去除多余的DAPI;
(13)加入20μl封片剂封片。
免疫荧光染色结果显示:获取的类角膜内皮细胞的标志物钠-钾-ATP酶,S100A4蛋白,水通道蛋白-1(AQP-1)和紧密连接蛋白ZO-1免疫染色呈阳性表达,如图2b、2c、2d和2e所示。
以上内容是结合具体的优选实施方式对本发明所做的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员而言,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换,这些都应当视为属于本发明由所提交的权利要求书确定的专利保护范围。
- 还没有人留言评论。精彩留言会获得点赞!