用于快速活微生物列举的光谱强度比(SIR)分析的制作方法
相关申请的交叉引用本申请案主张于2015年1月12日提出申请的美国临时申请案第62/102,506号的权益。本文描述快速测量样品中的活细菌数的方法。所述方法可用于例如以定量方式验证在许多工业中丰富的不同消毒程序(例如巴斯德灭菌(pasteurizing)、用氯处理、uv、臭氧)的效率且用于评价消耗用食物或水中的活生物体数。
背景技术:
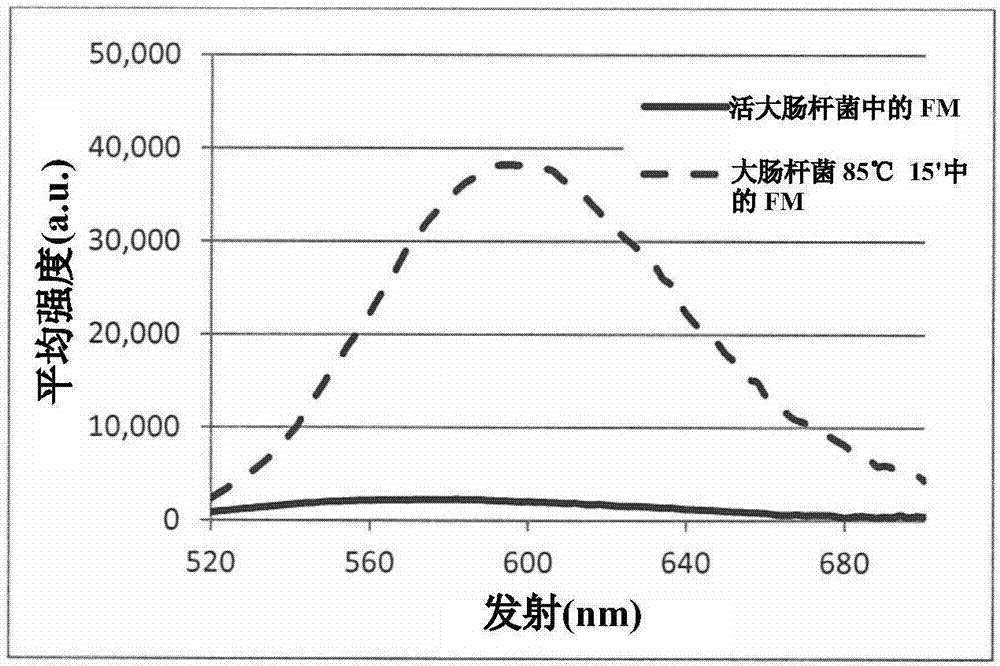
:样品中的细菌水平对例如打算用于人类和动物消耗的食物和水来说极其重要。诸如水和饮料公司、食品业、制药等许多工业使用多种消毒方法来确保在消毒程序后没有细菌或最少量细菌存活于食品中。活微生物的定量通常为基于细菌培养物生长的专门实验室程序。需要在长培育时间内维持固体和液体培养基上的微生物生长的特定条件,在培育时间结束时确定每单位体积的群落形成单位(cfu)数(例如cfu/ml)。在实验室中,cfu通常是根据样品的稀释次数和体积通过正规化所计数群落的总数来计算。此方法需要实验室设备、合格人员和可介于一天到一个月之间的长时间段。常用程序是将样品散布于琼脂板上,和将其培育数小时或有时数天的时段,且然后对生长于板上的群落数进行计数。对于未生长于固体培养基上的微生物和有时对于厌氧生物体,标准为“最大估计计数”(mec)。(霍尔姆斯w.(holmsw.),普通微生物学杂志(j.gen.microbiol.)54:255-260(1968);桥水l.(bridgewaterl.),美国公共卫生协会(americanpublichealthassociation)、美国给水工程协会(americanwaterworksassociation)和水环境联合会(waterenvironmentfederation),用于检验水和废水的标准方法(standardmethodsfortheexaminationofwaterandwastewater).由柳真w.莱斯(eugenew.rice)编辑.第22版.华盛顿(washington,d.c.):美国公共卫生协会,2012)。此方法利用试管连续稀释和视觉检查液体透明度,随后计算起始微生物浓度。然而,需要培养细菌的方法较为缓慢、昂贵且可受细菌凝集、使生物体生长的培养基的类型以及死细胞和碎片存在的影响。另外,一些细菌在培养物中不生长。因此,对于许多工业有利的是具有通过在不依赖于基于培养物的分析下区分活细菌与灭活细菌验证其消毒方案的快速工具。技术实现要素:本发明方法利用单一染料荧光染色和分析来产生用于快速检测活细菌的新颖工具。在本发明方法中,组合强度和光谱发射二者的差异以区分活细菌与灭活细菌。在一实施例中,本申请案提供用于区别经处理样品中的活细菌与灭活细菌的方法,其包括:用单一膜缔合染料对样品进行染色;用λ激发下的入射光照射样品;测量每一细菌细胞的(i)波长λ1下发射光的强度i1;和(ii)波长λ2下发射光的强度i2;计算比率i2/i1;和基于所计算i2/i1大于还是小于预定阈值,确定细菌细胞为活的还是灭活的。在另一实施例中,可对于整个样品而非对于每一细胞个别地实施此相同过程,以测量整个样品强度。在一些实施例中,可使用荧光分析、流式细胞术和显微术。其它实施例(例如但不限于涉及流式细胞术和显微术的那些)采用单一细菌检测和定量。欲分析的测试样品可为液体、半液体或干燥样品。在一实施例中,样品可从饮用水、食品或饮料获得。在不同实施例中,样品是从医药产品、个人护理产品或体液获得。体液可包含(但不限于)血浆、唾液、尿、咽喉样品或胃肠液。在另一实施例中,样品是从市政水系统、井、可饮水、废水、天然水源、改水或土壤获得。在不同实施例中,测试样品来自医疗装置。优选地,医疗装置是植入物、贴片或瓣膜。在一些实施例中,膜缔合染料是苯乙烯基染料。在优选实施例中,膜缔合染料是fm1-43或fm4-64。在一些实施例中,激发波长介于约360nm与约600nm之间,且测量i1和i2时的波长介于约520nm与约720nm之间。在优选实施例中,激发波长为488nm且测量i1和i2时的发射波长分别为530nm和610nm。在其它实施例中,激发波长介于约360nm与约600nm之间,且测量i1和i2时的波长介于约600nm与约800nm之间。在所述实施例中,激发波长介于488nm到570nm范围内,且测量i1和i2时的发射波长分别为670nm和780nm。前述一般描述和详细描述具有例示性和解释性且打算提供对所主张的本发明的进一步解释。为详细理解本发明,结合附图提到优选实施例的以下详细描述。所属领域技术人员根据本发明的以下详细描述将容易明了其它目标、优点和新颖特征。附图说明图1是经染色细菌的光谱检测和活细菌与灭活细菌之间的光谱/强度区分的示意图。图2显示以下各项的荧光光谱:以下经染色细菌中的苯乙烯基染料fm1-43:洗涤并重悬浮于pbs中之大肠杆菌(e.coli)8739号(107cfu/ml,于对数期)(实线),和在85℃中灭活15min后之相同细菌(虚线)。在4.9μmfm1-43中进行5min细菌染色,且通过离心步骤洗掉过量染料。在488nm下进行激发图3显示以下各项的正规化荧光光谱:pbs中的苯乙烯基染料fm1-43(点线)。洗涤并重悬浮于pbs中之大肠杆菌8739号(107cfu/ml,于对数期)(实线)。在85℃中灭活5min后之相同细菌(虚线)。在4.9μmfm1-43中进行5min细菌染色,通过离心步骤洗掉过量染料。在488nm下进行激发。双箭头分别指示在530nm和610nm下用于sir计算的所选波长。图4显示如所标记在不同灭活方法后经fm1-43染色的大肠杆菌8739号(107/ml)的正规化荧光光谱。图5是在fm1-43染色后两种细菌(大肠杆菌8739号,107cfu/ml)样品的流式细胞术点图叠加,(左下象限)活细菌;(右上象限)经加热细菌(巴斯德灭菌-85℃,15min)),如通过荧光活化细胞分选所观察到。通过光散射参数(fsc/ssc)对细菌群体的流式细胞术点图门控,荧光过滤器为530(30)nm和610(20)nm。激发是通过488nm激光进行。图6a-6f显示在fm1-43染色后大肠杆菌8739号(107cfu/ml)样品的分开点图:图6a活细菌;图6b加热(85℃,15min),图6c氯处理,图6d.70%酒精,图6e.uv-低压,图6fuv-中压。通过光散射参数(fsc/ssc)对细菌群体的流式细胞术点图门控,荧光过滤器为:530(30)nm和610(20)nm。激发是通过488nm激光进行。通过cfu,所有灭活样品(在6b.-f.中)显示计数减小5到6log。点图中x和y的数值分别代表在经标记门内在530nm和610nm下发射的平均值。图7显示在不同灭活方法后经fm4-64染色的大肠杆菌8739号(107/ml)的正规化荧光光谱,黑色实线-活,虚线-加热,点线-氯处理。图8a-c是在fm4-64染色后细菌(大肠杆菌8739号,107cfu/ml)样品的点图叠加。图8a.活(黑色点)对加热(85℃,5min)灭活(灰色点);图8b.活(黑色点)对氯灭活(灰色点);图8c.活(黑色点)对uv-mp灭活(灰色点)。通过光散射参数(fsc/ssc)对细菌群体的流式细胞术点图门控。荧光过滤器为:670(14)nm和780(60)nm。激发是通过561nm激光进行。图9a-b是粪肠球菌(e.faecalis)107cfu/ml活(黑色点)和加热(85℃,15min)(灰色点)的点图叠加,(图9a)经fm1-43和(图9b)经fm4-64染色。图10是流式细胞术和fm1-43计算与cfu之间的细菌浓度的关联图。将计算的数值和测量值之间的对数误差纳入小表中。图11绘示流式细胞术和fm4-64计算与cfu之间的细菌浓度的关联图。将计算的数值和测量值之间的对数误差纳入小表中。图12a1-a3、b1-b3是使用显微荧光成像产生,经fm1-43染色的大肠杆菌的激发=470nm,发射=525(50)nm。图12a1-a3:活细菌。i=35(±5)gl。图12b1-b3:加热灭活细菌。i=40(±10)gl。灰度级(gl)分析是通过斐济软件(fijisoftware)根据对象来进行。图13a-13e是使用显微荧光成像产生,经fm1-43染色的大肠杆菌的激发=470nm,发射=600(50)nm。图13a:活细菌。i=20-50gl。图13b:加热灭活细菌。i=128(±20)gl。图13c:氯处理灭活细菌。i=135(±20)gl。在显微测量之前用10mm硫代硫酸盐将样品处理5min。图13d:70%酒精灭活细菌。i=90(±10)gl。图13e:uv-mp灭活细菌。i=120(±20)gl。灰度级(gl)分析是通过斐济软件根据对象来进行。图14a-14c是生长5小时、然后(图14a)在无抗生素下生长1小时、(图14b)在700μg氨苄西林(ampicillin)下生长1小时和(图14c)在1500μg氨苄西林下生长1小时的大肠杆菌k12的流式细胞术点图。具体实施方式本发明是基于以下发现:在用荧光膜染料(例如苯乙烯基染料)对细菌染色后,活细菌相对于灭活细菌的发射荧光较弱且移位。所述现象可为相对于染料插入细胞质的更亲水环境的灭活细胞,在活细胞的亲脂性膜环境中的染料的相互作用的结果。如本文所用“活细胞”或“活细菌”意指具有生长和分裂潜力的细菌细胞。“死的”和“灭活”可互换使用且係指死细菌细胞。本发明涉及区别活细菌与灭活细菌的方法。所述方法是使用细胞膜染料的光谱强度比分析来进行。所述方法是基于以下发现:在特定波长下激发样本时,活细菌与灭活细菌之间的最大发射峰和发射强度二者的可测量差异较为明显。因此,可使用在两个指定波长或光谱强度比(sir)下发射强度的比率i2/i1作为区别活细菌与灭活细菌的方法。本发明方法可通过依赖基于激发/发射的分析而非基于培养物的验证以及需要使用仅一种染料成功地区别来准确且快速地区别活细胞与灭活细胞。因此,所述方法包含以下步骤:用单一膜缔合染料对样品进行染色;用λ激发下的入射光照射样品;测量每一细菌细胞的(i)波长λ1下发射光的强度i1;和(ii)波长λ2下发射光的强度i2;计算比率i2/i1;和基于计算的i2/i1是大于还是小于预定阈值,确定细菌细胞是活的还是灭活的。在另一实施例中,可对整个样品而非对每一细胞个别地实施此相同过程。在其它所述实施例中,可测量整体强度以确定样品含有活细菌还是灭活细菌。执行本发明方法的系统优选地是能够激发膜缔合染料且测量所规定波长λ1和λ2下的发射强度的装置,例如(但不限于)流式细胞仪、荧光显微镜或能够进行荧光分析的其它仪器。用光谱分析仪或发射过滤器测量发射光谱曲线。激发波长介于约360nm与约600nm之间且测量i1和i2时的波长介于约520nm与约800nm之间。在优选实施例中,激发波长为488nm且测量i1和i2时的发射波长分别为530nm和610nm。对于fm4-64,激发波长可介于488nm到570nm之间且测量i1和i2时的发射波长分别为670nm和780nm在优选实施例中,基于相对于所规定阈值的sir值(i2/i1)将每一细菌细胞分类为活的或灭活的。在一些实施例中,基于样品的计算的sir是大于还是小于预定阈值确定细菌细胞是活的还是灭活的过程涉及通过用样品的sir除以活细菌对照的sir计算的无活力参数(nvp)。然后比较所述nvp与阈值以确定细菌是活的还是灭活的。在其它实施例中,nvp为约1将指示活细菌,而nvp显著大于1将指示死细菌。在一些实施例中,在计算整个样品的sir时,活细菌对照的浓度应与测试样品相同。在其它实施例中,当测试样品含有均质细菌群体或已知比率的异质细菌群体时,可使用活细菌对照的sir值的标准曲线来确立用于确定细菌细胞是活的还是灭活的预定阈值。染料包含(但不限于)纳入脂质双层中的荧光染料。荧光染料的实例包含苯乙烯基染料和酞菁染料。代表性苯乙烯基染料包含1-43、1-43fx、4-64和4-64fx、2-10染料。代表性酞菁染料包含cy2、cy3、cy3b、cy3.5、cy5、cy5.5和cy7。fm1-43是n-(3-三乙基铵丙基)-4-(4-(二丁基氨基)苯乙烯基)吡啶鎓二溴化物,购自生命技术(lifetechnology)(编号t-35356),且由西格玛(sigma)以“synaptogreen”出售(编号s6814)。fm4-64是购自生命技术(编号t-13320)或以“synaptored”(编号s6689)购自西格玛的n-(3-三乙基铵丙基)-4-(6-(4-(二乙基氨基)苯基)己三烯基)吡啶鎓二溴化物。可使用一种以上的染料,但本发明方法可用单一染料来进行。使用单一染料不仅会简化所述方法,且减小因存在两种染料引起的可变性。欲分析的测试样品可为液体、半液体或干燥样品。样品可从饮用水、食品或饮料、医药产品、个人护理产品或体液获得。体液可包含(但不限于)血浆、唾液、尿、咽喉样品或胃肠液。测试样品还可从市政水系统、井、可饮水、废水、天然水源、改水或土壤获得。在不同实施例中,测试样品是从医疗装置获得。医疗装置的实例包含(但不限于)植入物、贴片和心脏瓣膜。在一些实施例中,可分析测试样品的细菌灭活处理的成功或失败,所述处理是例如(但不限于)抗生素或抗细菌处理、氯灭活、加热、酒精和uv中压辐射。在其它实施例中,阈值可通过获取预处理样品的i2/i1且然后与测试样品的i2/i1比较来确定细菌灭活处理的效率。细菌可包含(但不限于)大肠杆菌类、肠杆菌、沙门菌属(salmonella)、利斯特菌属(listeria)、志贺菌属(shigella)、假单胞菌属(pseudomonas)、葡萄球菌属(staphylococcus)或甲烷杆菌属(methanobacterium)。以下实例陈述为本发明的特定和优选实施例的代表。这些实例不应理解为以任何方式限制本发明的范围。应理解,可作出许多变化和修改,同时仍在本发明的精神和范围内。材料和方法染料:n-(3-三乙基铵丙基)-4-(4-(二丁基氨基)苯乙烯基)吡啶鎓二溴化物以fm1-43(编号t-35356)购自生命技术或以“synaptogreen”(编号s6814)购自西格玛。n-(3-三乙基铵丙基)-4-(6-(4-(二乙基氨基)苯基)己三烯基)吡啶鎓二溴化物以fm4-64(编号t-13320)购自生命技术或以“synaptored”(编号s6689)购自西格玛。细菌:除非另外规定,否则细菌是购自生物工业(biologicalindustries),拜特·海默克(beithaemek),以色列(israel)。根据atcc说明书回收干燥细菌且将各等份存储于-20℃甘油中。细菌灭活:通过以下程序中的一者灭活磷酸盐缓冲盐水(pbs)中的细菌:巴斯德灭菌(加热)-85℃,5-15min;氯(次氯酸钠)-0.01%,10min;酒精-70%,10min;uv-mp辐射-4-70mj,安特兰德技术有限公司(atlantiumtech.ltd)的中压灯(200-300nm);uv-lp辐射:4-70mj,安特兰德技术有限公司的低压灯(254nm)。显微术:在室温中用pbs中的fm1-43(4.9μm)或synaptored(15μm)对活细菌或灭活细菌染色5min。使用tacounts独特过滤系统,通过具有0.4μm截止值的聚碳酸酯膜过滤样品。使用1mlpbs洗涤过滤器且然后使用荧光显微镜(axioscopea1,蔡司(zeiss),德国)成像。激发/发射过滤器基于蔡司设置中的cube38。对于fm1-43-激发:470(±20)nm,分束器ft495,发射:bp525(±25)nm或600(±25)nm。对于fm4-64-激发:535±25nm,发射:590lp。使用斐济软件实施定量显微成像分析。灰度级(gl)独立于色彩且指示个别像素的亮度,将人眼的色彩敏感性考虑在内。流式细胞术:在室温中用pbs中的fm1-43(4.9μm)或fm4-64(15μm)对活细菌或灭活细菌染色5min。初步工作显示立即测量无需洗涤步骤。使用荧光活化细胞分选(facs。在此处使用facsariaiii,bd,usa)测量样品。用于经fm1-43染色的细菌的光学设置包含使用530(±15)nm、610(±10)nm的束径过滤器通过初级488nm激发和fsc/ssc检测器和荧光测量的光散射参数。对于经fm4-64染色的细菌,通过561nm激光激发并使用670±7nm和780±30nm的束径过滤器来检测荧光参数。使用fcsexpress4(德诺软件(denovosoftware),usa)来处理结果。荧光分光光度法:如所述用pbs中的fm1-43或fm4-64对107/ml活细菌或灭活细菌进行染色。将细菌离心(14,000rpm,3min)且重悬浮于1mlpbs中。将250μl细菌溶液转移到深色96孔板(品牌科技(brandtechscientific))。用490nm激发经fm1-43染色的样品且在520nm与700nm之间测量荧光光谱(synergyh1多模式读取器,生物保健科技(bio-tek),加拿大)。用490nm激发经fm4-64染色的样品且在530nm与850nm之间测量荧光光谱(infinite200pro,帝肯(tecan),瑞士)。实例以下实例说明本发明,且并不打算具有限制性。实例1-经fm1-43染色的细菌的扫描荧光结果:pbs中的苯乙烯基染料(fm1-43)和经染色细菌的荧光光谱呈现于图2中的荧光光谱和图3中的其正规化形式中以增强光谱变化的可见度。明确显示与灭活细菌和游离染料相比,在活细菌中染料的最大发射峰向蓝光移位。最大峰为:635nm-游离染料,对于灭活细菌为595nm且对于活细菌为560nm。还显示与在595nm下i=40,000的灭活细菌相比,在活细菌中荧光的强度较低且在560nm下i=3000。因此显而易见,可使用两个参数(光谱位移和强度)来区别活细菌与灭活细菌群体。为对所述现象进行定量,计算两个不同波长中的荧光强度的比率,其将反映最大作用且可用于将来实施。如图3中所标记的所选波长为530nm和610nm。这些波长的强度值呈现于表1中。可观察到,对于灭活细菌,荧光强度在530nm中增加4倍且在610nm中增加20倍。此指示在死细菌中不仅存在增加的荧光染色,且荧光光谱发生移位。在两个波长中与活细菌相比灭活细菌的不同增强使得能够计算sir和nvp,且汇总于表1中。在不同灭活方法(例如氯灭活、加热、酒精和uv中压和低压辐射)中获得相同的光谱分析。对于所述方法,活力降低5到6log,如通过cfu方法所显示。输出荧光光谱的叠加显示于图4中,且汇总于表1中。可注意到,在除uv-lp外的所有方法中,nvp>1,此与如cfu中所展示细菌的无活力状态相关联。通过uv-lp处理细菌的确引起其灭活(5log),然而不会发生sir作用,此可能归因于在uv-lp中辐射限于仅损伤dna且不会损伤蛋白质或细胞膜的254nm。已知uv辐射可损伤dna,从而导致细胞无法复制,但仍能够代谢一段时间。表1:源自fm1-43染色的大肠杆菌*的荧光计测量的荧光强度值的sir和nvp计算*所有样品必须含有相同的细菌浓度用于可比较强度测量。**在200-300nm范围内用介于4mj到70mj范围内的中压uv(uv-mp)辐射细菌可导致活力降低至少5log。用低压uv(uv-lp)辐射也可导致细菌灭活,但不具sir效应。实例2-经fm1-43染色的细菌的流式细胞术结果:尽管荧光计测量是定量的,但其是对全部样品的宏观测量,因此其取决于溶液中的细菌浓度。为验证还可用单一细菌检测到所述现象,进行经染色细菌样品的流式细胞术测量。为使流式细胞术适应如经fm1-43染色的细菌的荧光光谱中所显示的光谱特性化,使用流式细胞术的488nm激发通道以及使用530(30)nm和610(20)nm作为λ1和λ2的两个荧光通道以进行sir计算。在图5中,显示在610nm/530nm的荧光参数下,活细菌、大肠杆菌对比灭活(通过加热)细菌的叠加点图。显而易见,灭活群体在波长610nm和530nm二者下具有增强的荧光,其在610nm下更显著。对五个不同灭活程序使用相同细菌来重复所述过程且其荧光结果显示于上文扫描荧光计和此处610nm/530nm发射过滤器的流式细胞术分析中。不同细菌状况流式细胞术分析的所得点图呈现于图6中。对于每一点图,经门控群体代表细菌且其针对530nm和610nm的平均荧光发射分别显示为x和y。根据这些值可计算sir。例如,对于活细菌,平均荧光强度为:i530=42和i610=31以获得sir活=0.73。对于经加热灭活细菌,平均荧光为:i530=457和i610=4045以获得sir加热=8.8。因此,经加热细菌的nvp将为9。剩余样品sir和nvp值汇总于表2中。在灭活细菌的所有情形下,sir且因此nvp值大于1,但经uv-lp处理的细菌除外。另外,根据流式细胞术推断出的数据与来自荧光计测量的数据一致。尽管稍有不同,但其的确显示相似的量值和趋势。uv-lp辐射(限于254nm)可仅通过dna损伤且无膜或蛋白质灭活来灭活细菌,此可能在分子水平上维持细菌结构。因此,当与活细菌相比时,利用不同的fm1-43染色,uv-lp辐射灭活可不产生灭活细菌。然而,在大量水处理中,uv-lp并非细菌的推荐处理。实际上,对于大量水处理,uv-mp是由诸如epa等权威推荐;对于uv-mp,计算的nvp为5。表2:源自fm1-43染色的大肠杆菌的流式细胞术测量的荧光强度值的sir和nvp计算实例3-经fm4-64染色的细菌.苯乙烯基染料的另一成员是synaptored或fm4-64,其特征在于比fm1-43长的疏水区和红移发射特性化(在λmax=750nm下)。在图7中可观察到,经fm4-64染色的活、经加热(85℃,15min)和氯处理大肠杆菌的所得正规化荧光光谱。对于活细菌最大发射峰移位到690nm,对于灭活细菌最大发射峰分别在740nm和760nm下。根据光谱可定义两个用于计算sir的波长,其为780nm和670nm。使用这些波长作为流式细胞术设置中的光学过滤器用于每个单一细菌的sir分析。在图8中可观察到,670(14)/780(60)nm发射通道上的活、经加热和氯处理细菌群体的点图叠加。如可观察到,灭活细菌群体在低670/780通道中,其中对于灭活细菌群体,在780(60)nm通道上的发射增加。为计算源自流式细胞术的sir,统计两个波长中的平均荧光强度以计算sir值和nvp。表3中的这些值显示细菌的灭活状态与nvp值之间的关联,如对于灭活细菌nvp>1。比较经fm4-64与经fm1-43染色的大肠杆菌的nvp值揭露对于fm1-43更不同的值,然而两种染料显示nvp>1,因此可用于区分活/灭活细菌。表3:对于经fm4-64染色的大肠杆菌8739号在670(14)/780(60)nm通道下通过流式细胞术分析的sir和nvp计算.对于经加热和氯处理细菌,cfu结果显示减小6log.细菌状况sir计算nvp计算活3.5加热(85℃,15min)144uv-mp133.7氯处理123.4实例4-革兰氏阳性(grampositive)细菌.革兰氏阳性细菌与革兰氏阴性细菌的膜结构的不同之处在于在细胞膜外部具有较厚肽多糖层,而在革兰氏阴性细菌中薄肽多糖在外细胞膜内部。由于此处所呈现染色的类型是膜依赖性染色,所以预期革兰氏阳性细菌的行为将不同于革兰氏阴性细菌。已观察到,对于革兰氏阳性细菌,所述现象利用fm1-43染料较弱且使用更亲脂染料fm4-64更显著。尽管观察到不同,但令人惊奇的是在此方法中可检验革兰氏阳性和阴性细菌二者。作为革兰氏阳性细菌的实例,已对重要水污染指示剂粪肠球菌(enterococcusfaecalis)进行染色且通过荧光计分析(数据未显示)和流式细胞术分析来分析。在图9中呈现活和通过加热灭活的经染色粪肠球菌的流式细胞术分析,二者经fm1-43(a)和fm4-64(b)染色。如氯和uv-mp等其它灭活方法显示相似的点图叠加。显而易见,与活细菌相比,在两种染色中对于灭活细菌存在不同的sir,且使用fm4-64染色具有较强作用。sir和nvp是通过使用流式细胞术门控统计数据来计算且呈现于图9中。对于灭活细菌fm1-43和fm4-64二者显示nvp>1,其中fm4-64具有较高结果。由此展示使用更疏水染料更好地区分活/灭活。表4:在fm1-43和fm4-64染色后活和灭活(加热和氯)的粪肠球菌的通过流式细胞术分析的sir和nvp计算.通过cfu,灭活细菌减小5-6log。实例5-扩大对若干细菌的作用所有革兰氏阴性细菌对此处的所有灭活方法具有显著sir作用:uv-mp、加热和氯处理。对于革兰氏阴性细菌,fm1-43优于fm4-64。革兰氏阳性细菌显示sir作用较弱但呈阳性,在fm4-64中较好。对于uv-mp,结果较差。uv-lp-无作用表5:通过fm1-43和fm4-64染色通过若干革兰氏阴性和阳性细菌的流式细胞术分析计算的nvp值对细菌计数:通过fm1-43或fm4-64染色和流式细胞术分析的细菌的双重荧光分析和sir作用使得能够区分代表活细菌的事件与代表碎片、聚集物和灭活细菌的其它事件,如所述。在流式细胞术分析期间对这些对应于活细菌的nvp事件计数。样品的浓度可通过知晓每一样品分析的流速和时间衍生而来,如先前文献中所述。等式1将事件计数(g)转换成细菌浓度/ml(c):等式1:[c]=g*1000/(流速)*时间.其中流速以μl/min表示,且时间以min表示。结果为[fm1-43和fm4-64染色分别呈现于图10和图11中。在1000到106个细菌范围内两种方法之间存在极高度关联(r2>0.99)。在小于1000的低水平下,杂讯的数量可多于信号而无任何区分杂讯与细菌的能力。在所有浓度(1000到100万之间)中,误差小于0.5log,如微生物学计数中所接受。实例7-显微术结果在荧光显微镜中在标准发射过滤器525(50)nm中观察活细菌和灭活细菌显示强度存在极小差异,参见图12,此与本发明的发现一致。在通过600(50)nm发射过滤器观察荧光细菌时,在图13中显而易见,活细菌的20-50gl的强度到不同灭活细菌的90-150的范围变化。实例8-使用氨苄青霉素(ampicillin)的大肠杆菌k12在研究中使用大肠杆菌k12(mg1655,从atcc获得)进一步验证所揭示方法。在培养基中生长5小时后,将大肠杆菌分成三组:(a)在无抗生素下生长一小时,(b)在700微克氨苄西林下生长一小时,和(c)在1500微克氨苄西林下生长一小时。根据前文所述的方法,将细菌悬浮于pbs中并用fm1-43(5μm)染色。进行经染色细菌样品的流式细胞术测量。为将流式细胞术调整到如经fm1-43染色的细菌的荧光光谱所显示的光谱特性化,使用流式细胞术的[确认:488]nm激发通道以及使用530(30)nm和610(20)nm作为λ1和λ2的两个荧光通道进行sir计算。结果于下文中列成表格且绘示于图14中。表6:通过流式细胞术分析的大肠杆菌k12的sir计算这些数据展示sir技术适用于通过抗微生物药物杀死或灭活的细菌。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1