尖孢镰刀菌株及其在制备3β,7α,15α-三羟基雄甾-5-烯-17-酮中的应用的制作方法
本发明涉及微生物菌株、其培养方法及其在甾体生物转化上的应用,尤其涉及一株具有立体选择性羟化去氢表雄酮(Dihydroepiandroe,DHEA)的霉菌及优化后的转化培养基组成和转化条件,属于生物催化技术领域。
背景技术:
屈螺酮(Drospirenone)具有孕激素活性,同时又具有抗雄性激素的作用,主要用于女性口服避孕药和激素替代治疗药物。屈螺酮作为目前最好的第四代口服避孕药物之一,其具有的抗盐皮质激素活性可减少体液潴留,这使其在表现出良好避孕效果的同时,还具有降血压,降低体重等优点。并且调查表明,使用屈螺酮还有改善皮肤问题、缓解女性经前期综合症(PMS)、预防妇女骨质疏松等作用。目前,屈螺酮的复方口服避孕药Yasmin(优思明)已经在多个国家上市,是世界上使用量最大的口服避孕药物。
屈螺酮的合成方法有多种,可分为有微生物参与的合成路线及无微生物参与的纯化学路线两类,有微生物参与的路线无论在立体选择性方面还是总收率方面均明显优于纯化学路线,其中以3β,7α,15α‐三羟基雄甾‐5‐烯‐17‐酮作为中间体的路线总收率较佳。3β,7α,15α‐三羟基雄甾‐5‐烯‐17‐酮用化学合成法难以得到,利用微生物转化法则具有很大优势。
甾体微生物转化反应是利用微生物的酶对甾体底物的某一部位进行特定的化学反应来获得一定的产物,其在甾体药物生产中占有重要地位,常常被用于某些甾体激素类药物中间体的合成。与化学方法相比,甾体微生物转化反应具有立体专一性强,收率高,副产物少,反应条件温和及价格低廉等优点。
本发明筛选到一株对去氢表雄酮具有羟基化作用的霉菌,目前国内外均未见其用于转化DHEA获得3β,7α,15α‐三羟基雄甾‐5‐烯‐17‐酮的报道。
技术实现要素:
本发明目的是为了提供一株尖孢镰刀菌株,将其用于3β,7α,15α‐三羟基雄甾‐5‐烯‐17‐酮的制备,在3β,7α,15α‐三羟基雄甾‐5‐烯‐17‐酮制备过程中实现步骤简单、成本低廉、环境友好、产率高等优势;另一目的在于提供利用该菌株制备3β,7α,15α‐三羟基雄甾‐5‐烯‐17‐酮的方法。
为达到发明目的,本发明采用的技术方案是:
所述菌株为一株尖孢镰刀菌株(Fusarium oxysporum LZ0202),该菌株已于2013年3月5日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为:CGMCC No.7276。该菌株能产生具有立体选择性的羟化酶,其特征在于可在去氢表雄酮的7α,15α等位置选择性地进行羟基化。
该菌株形态特征:在酵母膏蛋白胨培养基上,菌落呈突起絮状,高3‐5mm,菌落呈粉白色或浅粉色。显微镜下可见小型分生孢子着生于单生瓶梗上,常在瓶梗顶端聚成球团,单胞,卵形;大型分生孢子镰刀形,少许弯曲。
该菌株生理生化特征:菌丝的生长和孢子萌发与温度、湿度、pH值和培养基质有密切关系。菌株在20~32℃均有不同程度的生长,30℃生长速度最快;菌株对环境pH值有较强的适应性,在pH值4~7的弱酸性条件下均能生长,最适pH值为5.0;菌株在相对湿度为60~80%时孢子萌发率较低,饱和湿度时萌发率最高,可见充足的水分是孢子萌发的必要条件;孢子在无营养的蒸馏水中不能萌发,必须有一定的有机物作为营养或刺激,不同营养物质对其孢子萌发也有影响,在营养成分复杂的有机物浸汁如酵母膏蛋白胨培养基中萌发率最高,可达到95%以上,而在成分比较简单的无机溶液如察氏培养基中的萌发率最低,只有不到50%。
所述尖孢镰刀菌来自:尖孢镰刀菌经发酵培养获得的发酵液或由发酵液过滤得到的湿菌体。可将湿菌体加入含有底物的溶液中,或直接按需要量将底物加入发酵液中,作为反应体系。
具体的,本发明用微生物转化制备3β,7α,15α‐三羟基雄甾‐5‐烯‐17‐酮的方法按如下步骤进行:
(l)斜面培养:培养基各组分终浓度为:葡萄糖20~40g/L,蛋白胨5~20g/L,酵母膏0.1~5g/L,磷酸二氢钾2~10g/L,琼脂20~40g/L,pH 4~9,121℃灭菌,灭菌后冷却,制成斜面,接入尖孢镰刀菌菌株,20~40℃培养1~7天,作为斜面活化种子;
(2)发酵培养:培养基各组分终浓度为:麦芽糖5~50g/L,蛋白胨5~50g/L,酵母膏0.01~10g/L,磷酸氢二钠0.1~10g/L,pH 4~9,121℃灭菌,灭菌后经冷却,取斜面活化种子,以接种量5~10%体积比接种于发酵培养基中,摇床转速100~250r/min,20~40℃,培养l~5天,得发酵液;
(3)微生物转化:将去氢表雄酮(DHEA)溶解在丙酮中加入上述发酵液中,或将上述发酵液过滤后得到的湿菌体加入含有DHEA与葡萄糖的无菌缓冲液中,使DHEA在缓冲液中的质量浓度为1~50%,湿菌体用量为0.3~6g/L,在20~50℃、100~250r/min的条件下反应,反应结束,将菌体与转化清液分离,用乙酸乙酯分别萃取菌体与清液,合并乙酸乙酯,在乙酸乙酯相中依次加入饱和碳酸氢钠溶液、饱和氯化钠溶液、蒸馏水进行洗涤,干燥后再将乙酸乙酯进行减压蒸馏,所得固体经柱层析(氯仿:甲醇=25:1)分离,得到所述3β,7α,15α‐三羟基雄甾‐5‐烯‐17‐酮(1)及另一产物3β,7α‐二羟基‐5‐雄甾烯‐17‐酮(2)。其中产物2经过培养基和转化条件优化后可基本消失。
尖孢镰刀菌对DHEA的转化路线
本发明创新点及优点在于:经过培养基组成和转化条件优化,培育筛选出一株尖孢镰刀菌株(Fusarium oxysporum LZ0202),发现其对去氢表雄酮7α,15α位置有羟基化作用,为此,以DHEA为底物,以尖孢镰刀菌(Fusarium oxysporum LZ0202)为菌株,进行微生物催化反应,制备3β,7α,15α‐三羟基雄甾‐5‐烯‐17‐酮,能够以较高的收率得到目标产物,收率达69.1%以上。反应收率高,成本低廉,不需要价格昂贵的试剂。所用菌株对人体无毒,便于大规模培养,反应条件温和,对环境污染少,反应操作简便,易于进行工业化生产。该化合物是合成第四代口服避孕药屈螺酮的重要中间体,其收率决定着终产物屈螺酮的总收率。长远来看,本发明为建立屈螺酮重要手性中间体的创新生物合成路线奠定基础,对有效利用宝贵的皂素资源,开发高端激素药物及促进我国皮质激素制药工业的发展具有深远意义。
该菌株已于2013年3月5日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为:CGMCC No.7276。
附图说明
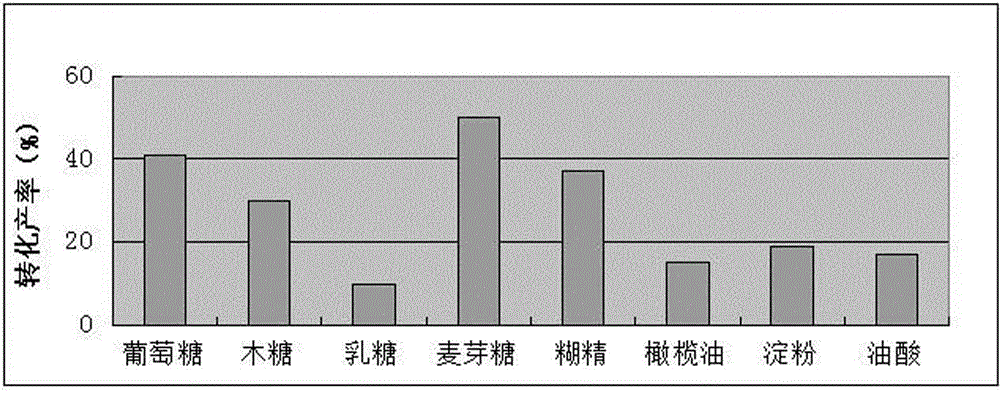
图1为碳源种类对目标物转化产率影响的柱状图;
图2为氮源种类对目标物转化产率影响的柱状图;
图3为微量离子种类对目标物转化产率影响的柱状图;
图4为转化时间对化合物1产率的影响曲线;
图5为摇瓶装液量对化合物1转化产率的影响曲线;
图6为本发明尖孢镰刀菌生长曲线。
具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此,以下所述百分比没明确说明的均为质量百分比。
实施例1
斜面培养:葡萄糖30g/L,蛋白胨12g/L,酵母膏1g/L,磷酸二氢钾2g/L,琼脂30g/L,pH 4.5,121℃灭菌20分钟,灭菌后冷却,制成斜面,接种尖孢镰刀菌菌株,30℃培养5天,作为斜面活化种子。
初始发酵培养:葡萄糖30g/L,蛋白胨12g/L,酵母膏1g/L,磷酸二氢钾0.9g/L,pH 5。121℃灭菌20分钟,灭菌后冷却。将尖孢镰刀菌菌株用接种针从斜面上取三接种环菌丝接种在含有110mL发酵培养基的500mL锥形瓶中,菌丝接种量50mL,于30℃,摇床转速210r/min,培养2天,得发酵液。
底物的添加:将底物DHEA溶于丙酮中(100mg/mL),以100mg/瓶的浓度加入到含上述发酵液的500mL锥形瓶中,发酵液装入量100mL,30℃、210r/min发酵反应96小时。
转化产物的后处理:反应结束后,将菌体与转化清液分离,用乙酸乙酯分别萃取菌体与清液3次,合并乙酸乙酯,在乙酸乙酯相中依次加入饱和碳酸氢钠溶液、饱和氯化钠溶液、蒸馏水进行洗涤,无水硫酸钠干燥后再将乙酸乙酯进行减压蒸馏,得到淡黄色固体,转化产物经柱层析(氯仿:甲醇=25:1)分离,得白色固体产物:3β,7α,15α‐三羟基雄甾‐5‐烯‐17‐酮(1)和3β,7α‐二羟基‐5‐雄甾烯‐17‐酮(2)。其中化合物1的转化率为58.9%。
化合物1 Yield:58.9%;1H NMR(DMSO‐d6,400M Hz)δ:5.43(1H,d,J=4.52Hz,H‐6),4.09(1H,d,J=4.00Hz,H‐7),4.26(1H,bs,H‐15),2.91(1H,dd,J=20.00,8.00Hz,H‐16α),1.95(1H,dd,J=20.00,8.00Hz,H‐16β),0.82(3H,s,H‐18),0.93(3H,s,H‐19);13C NMR(DMSO‐d6,100M Hz)δ:216.8,145.0,123.4,70.1,68.6,63.9,51.6,49.6,46.3,42.9,42.4,37.5,37.1,37.0,31.7,31.6,20.1,18.5,14.8.HR‐MS m/z%:343.1883[M+Na]+(calcd.343.1885).
化合物2 Yield:12.3%;1H NMR(DMSO‐d6,400MHz)δ:5.45(1H,d,J=4.96Hz,H‐6),3.75(1H,d,J=4.64Hz,H‐7),3.29(1H,m,H‐3),0.79(3H,s,H‐18),0.90(3H,s,H‐19);13C NMR(DMSO‐d6,100MHz)δ:220.4,144.3,124.7,70.2,62.9,46.9,45.0,42.5,42.3,37.4,37.4,37.0,35.7,31.7,31.5,21.8,20.1,18.4,13.4.HR‐MS m/z%:327.1938[M+Na]+(calcd.327.1936).
转化产物采用HPLC法定量,仪器:Waters1525;检测条件:柱温30℃;紫外检测波长205nm;流动相:乙腈/水=26/74;标准曲线Y=18892X+41090。
实施例2:
基本操作如实施例1,测定方法均为实施例1中转化率的测定方法。
(1)碳源的优化
固定初始发酵培养基的其他成分(蛋白胨1.2%,酵母膏0.1%,KH2PO40.09%,pH 5.5),只改变碳源种类(3%)分别使用葡萄糖、木糖、乳糖、麦芽糖、糊精、淀粉、橄榄油、油酸。将筛选出的尖孢镰刀菌接种至这八种已灭过菌的培养基中,30℃培养48h后,加入0.1%去氢表雄酮,在摇床中30℃,210r/min转化96h后测定。结果如图1所示,使用麦芽糖为碳源时化合物1的转化产率最好。
将碳源确定为麦芽糖后,固定发酵培养基的其他成分(蛋白胨1.2%,酵母膏0.1%,KH2PO4 0.09%,pH 4.5),只改变麦芽糖的浓度(1.25~7.25%)。将筛选出的尖孢镰刀菌接种至这七种已灭过菌的培养基中,30℃培养48h后,加入0.1%去氢表雄酮,在摇床中30℃,210r/min转化96h后测定。结果如表1和图1,结果表明,麦芽糖的浓度为3.25g/100mL时化合物1的转化产率达到最高。
表1
(2)氮源的测定
固定发酵培养基的其他成分(麦芽糖3%,KH2PO4 0.09%,pH 5.5),只改变氮源种类:玉米浆0.1%、天冬氨酸1.2%、蛋白胨1.2%、甘氨酸1.2%、硝酸铵1.2%、豆饼粉1.2%、牛肉膏0.1%、酵母膏0.1%。将筛选出的尖孢镰刀菌接种至这八种已灭过菌的培养基中,30℃培养48h后,加入0.1%去氢表雄酮,在摇床中30℃,210r/min转化96h后测定目标产物的浓度。从图2中的结果可以看出采用酵母膏和蛋白胨为氮源时化合物1的转化收率都比较高。综合考虑,我们采用蛋白胨和酵母膏作为复合氮源。
将氮源确定为蛋白胨与酵母膏后,分别改变蛋白胨的浓度(0.65~2.75%)与酵母膏的浓度(0.02~0.14%),其他条件不变,将筛选出的尖孢镰刀菌接种至这八种已灭过菌的培养基,30℃培养48h后,加入0.1%去氢表雄酮,在摇床中30℃,210r/min转化96h后测定。表2结果表明,蛋白胨的浓度为2.05g/100mL,酵母膏浓度0.04g/100ml时化合物1的转化产率达到最高。
表2
(3)微量离子的优化
固定培养基的其他成分(麦芽糖3.25%,蛋白胨2.05%,酵母膏0.04%,pH5.5),分别向培养基中添加不同种类的微量元素(0.1%):硫酸钙、硫酸镁、磷酸氢二钠、磷酸二氢钾、硫酸亚铁,将筛选出的尖孢镰刀菌接种至这五种已经灭菌的培养基中,30℃培养48h后,加入0.1%去氢表雄酮,在摇床中30℃,210r/min转化96h后测定。从图3中的结果可以明显看出Na+可对转化起到促进作用,将其作为微量元素添加入培养基后,化合物1的收率可提高。
(4)pH的优化
在选定的培养基基础上(麦芽糖3.25%、蛋白胨2.05%、酵母膏0.04%),分别将培养基pH调为4-7,将筛选出的尖孢镰刀菌接种至这七种已灭过菌的培养基中,30℃培养48h后,加入0.1%去氢表雄酮,在摇床中30℃,210r/min转化96h后测定。如表3所示,培养基的初始pH为5.5时,化合物1的转化产率最高。
表3
(5)正交实验
以麦芽糖3.25%、蛋白胨2.05%与酵母膏0.04%、磷酸氢二钠0.1%、pH 5.5为单因素,进行四因素三水平的正交实验,后续操作如实施例1。结果如表4、5,在麦芽糖浓度为2.65%,蛋白胨浓度为1.45%,酵母膏浓度为0.02%,磷酸氢二钠浓度为0.1%,初始pH为5的条件下化合物1转化产率最高,达到71%。
表4
表5
实施例3:
将本发明所述尖孢镰刀菌菌株用接种针从斜面上取三接种环菌丝分别接入7瓶含有50ml液体培养基的250ml锥形瓶中,于30℃,摇床转速210r/min的条件下培养。
将底物去氢表雄酮溶于丙酮中(100mg/mL),以50mg/瓶的浓度加入到发酵液中,30℃、210r/min进行反应。每24h取出3瓶,如实施例1中所述方法进行HPLC测定,不同反应时间对化合物1转化产率的影响见图4。
从图4可以看出,在转化开始的96h内化合物1的转化产率呈上升趋势,96h左右达到最高,之后便开始缓慢下降,因此我们选择96h为加入底物后的反应时间。
实施例4:
将尖孢镰刀菌菌株用接种针从斜面上取三接种环菌丝分别接入含有80mL、90mL、100mL、110mL、120mL液体培养基的500mL锥形瓶中,于30℃,摇床转速210r/min的条件下培养。考察摇瓶装液量对化合物1转化产率的影响见图5。
微生物在生长与转化的过程中都需要氧气的参与,氧的浓度与摇瓶中的装液量有着很大关系。从图5可以看出,500mL摇瓶装液量为100mL时,目标产物的转化产率最高,因此我们选择100mL为最佳装液量。
实施例5:
将尖孢镰刀菌菌株用接种针从斜面上取三接种环菌丝分别接入10瓶含有50mL的液体培养基的250ml锥形瓶中,于30℃,摇床转速210r/min的条件下培养。
每隔12h取一次样,将培养基抽滤后得到的菌丝体烘至恒重。以菌丝干重为纵坐标,培养时间为横坐标作图,得生长曲线,见图6。
从图6可以看出,尖孢镰刀菌经48h的摇床培养后菌丝体的量达到最多。因此,选择在菌体培养48h后加入底物。
实施例6
斜面培养:葡萄糖30g/L,蛋白胨12g/L,酵母膏1g/L,磷酸二氢钾2g/L,琼脂30g/L,pH 4.5,121℃灭菌20分钟,灭菌后冷却,制成斜面,接种尖孢镰刀菌菌株,30℃培养5天,作为斜面活化种子。
初始发酵培养:麦芽糖26.5g/L,蛋白胨14.5g/L,酵母膏0.2g/L,磷酸二氢钠1g/L,pH5。121℃灭菌20分钟,灭菌后冷却。将尖孢镰刀菌菌株用接种针从斜面上取三接种环菌丝接种在含有100mL发酵培养基的500mL锥形瓶中,菌丝接种量25mL,于30℃,摇床转速210r/min,培养2天,得发酵液。
底物的添加:将底物DHEA溶于丙酮中(100mg/mL),以100mg/瓶的浓度加入到含上述发酵液的500mL锥形瓶中,发酵液装入量100mL,30℃、210r/min发酵反应96小时。
转化产物的后处理:反应结束后,将菌体与转化清液分离,用乙酸乙酯分别萃取菌体与清液3次,合并乙酸乙酯,在乙酸乙酯相中依次加入饱和碳酸氢钠溶液、饱和氯化钠溶液、蒸馏水进行洗涤,无水硫酸钠干燥后再将乙酸乙酯进行减压蒸馏,得到淡黄色固体,转化产物经柱层析(氯仿:甲醇=25:1)分离,得白色固体产物:3β,7α,15α‐三羟基雄甾‐5‐烯‐17‐酮(1)和3β,7α‐二羟基‐5‐雄甾烯‐17‐酮(2)。其中化合物1的转化率为71%。
- 还没有人留言评论。精彩留言会获得点赞!