异丁香酚单加氧酶突变体及其应用的制作方法
本发明涉及生物技术领域,尤其涉及一种异丁香酚单加氧酶突变体及其应用。
背景技术:
香草醛(vanillin)的主要作用包括以下几点:(1)食品添加剂:香草醛含有浓郁的奶香味、神秘的兰花香味,素有“天然香料皇后”的美名,是食品添加剂行业中非常重要的一味香料,主要在冰激凌、饼干、糖果、饮料等中起作增香剂、调香剂、定香剂,在含有奶香味的奶制品中尤其明显;(2)药物的中间体及重要原料:比如,由香草醛可通过生物转化法合成3,4,5-三甲氧基苯甲醛(TMB),TMB是用于磺胺增效剂甲氧苄氨嘧啶(TMP);与甘氨酸缩合成内酯,香草醛是治疗帕金森症的合成药物L一多巴的中间体;以及在合成联苯双酯、利喘贝、哌唑等药物过程中,香草醛是这些药物重要的中间体;(3)化学添加剂:如塑料中的抗硬化剂和橡胶中的防臭剂等;(4)香草醛可用来检验蛋白质氮杂荀、单宁酸以及间苯二酚的存在;(5)香草醛又可充当植物生长的促进剂、甘蔗的催熟剂,还可作昆虫引诱剂、制备成除草剂;(6)香草醛还可用作润滑油的消泡剂、印制线路板生产的导电剂等。
当前市场上的香草醛绝大部分是化学合成的,然而根据美国和欧盟的规定,合成香草醛在农产品和食品添加剂中的使用易引起法律方面的争议,且经欧盟专家委员会研究发现大剂量使用化学合成香草醛会导致头痛、恶心、呕吐、呼吸困难,对人体有较大危害,严重影响了香草醛的应用。
随着生物科技的飞速发展,人类比以往任何时候更加关注自身的健康和环境问题。2015年初,新的《环境保护法》正式施行,这部被誉为史上最严厉的环境保护法的出台,反应了政府大力改进中国环保现状的决心。2015年3月中央政治局会议首提“绿色化”:“四化”变“五化”。“绿色化”是指“科技含量高、资源消耗低、环境污染少的产业结构和生产方式”。颠覆传统“高污染、高耗能、高碳排放”化学合成产业的绿色生物合成将成为下一轮产业经济新的增长点,并将成为生物经济的发动机。
尽管通过生物催化技术生产香草醛不仅高效且低碳环保,具有很强的竞争力,但用于生物催化技术生产香草醛的异丁香酚单加氧酶的活力受香草醛的抑制,影响着该技术的工业化应用。因此,取消或减少产物抑制是降低绿色生物合成香草醛生产成本的关键因素。
技术实现要素:
本发明要解决的技术问题在于,针对现有相关的上述缺陷,提供一种具有高催化活性的异丁香酚单加氧酶突变体及其应用。
本发明解决其技术问题所采用的技术方案是:提供一种异丁香酚单加氧酶突变体,包括SEQ 2所示的氨基酸序列,其具有选自第120位、第121位、第281位、第298位和第470位中的至少一个突变。
优选地,所述第120位的天冬酰胺(Nsn)突变为异亮氨酸(Ile)。
优选地,所述第121位苏氨酸(Thr)突变为脯氨酸(Pro)。
优选地,所述第281位的苯丙氨酸(Phe)突变为谷氨酰胺(Gln)。
优选地,所述第298位的甲硫氨酸(Met)突变为赖氨酸(Lys)。
优选地,所述第470位的亮氨酸(Leu)突变为丝氨酸(Ser)。
本发明还提供一种以上任一项所述的异丁香酚单加氧酶突变体的应用,应用于以异丁香酚为底物制备香草醛。
本发明的有益效果:通过对异丁香酚单加氧酶基因进行定点突变,以获得具高催化活性的异丁香酚单加氧酶突变体。该突变体能以异丁香酚为底物,高效率催化生成香草醛;以异丁香酚为底物其具有比亲本高出至少117%的异丁香酚单加氧酶催化活性。
附图说明
下面将结合附图及实施例对本发明作进一步说明,附图中:
图1是本发明中ISO定点饱和突变Asn120测序结果;
图2是本发明中ISO定点饱和突变Thr121测序结果;
图3是本发明中ISO定点饱和突变Phe281测序结果;
图4是本发明中ISO定点饱和突变Met298测序结果;
图5是本发明中ISO定点饱和突变Leu470测序结果;
图6是本发明中诱导前后的SDS凝胶电泳结果示意图;
图7-图11是本发明中用突变菌株与原始菌转化获得香草醛的浓度对比图。
具体实施方式
本发明中所用的术语“亲本”是指来自pseudomonas putida IE27的异丁香酚单加氧酶(ISO),其核苷酸序列如序列1所示(参考GenBank nucleotide AB291707),氨基酸序列如序列2所示(参考GenBank protein BAF62888)。
本发明中所用的术语“参考序列”,当其为核苷酸序列时,是指序列表中的序列1;当其为氨基酸序列时,是指序列表中的序列2。在将参考序列和突变的异丁香酚单加氧酶序列进行排序比较时,可以手工进行,也可以用计算机进行(可供利用的计算机软件,例如CLUSTALW程序等)。
本发明的异丁香酚单加氧酶突变体制备时,可以利用本领域已知的技术,先构建含有亲本异丁香酚单加氧酶基因的载体质粒,然后设定定点突变的位点以及突变后的氨基酸种类,再合成适当的引物。以含亲本异丁香酚单加氧酶基因的载体质粒为模板,PCR扩增DNA片段、装配所扩增的DNA片段以及PCR扩增全长突变基因。
将获得的全长突变基因克隆到适当的载体上并转化适当的宿主细胞,经培养筛选出具有异丁香酚单加氧酶活性的阳性克隆。最后从阳性克隆中提取质粒DNA,进行DNA序列测定分析,以确定引入的突变。
在本发明的异丁香酚单加氧酶突变体的制备中,可采用任何适当的载体。例如,适用的载体包括但不限于原核表达载体,如pRSET和pES21等;包括但不限于克隆载体,如pUC18/19和pBluscript-SK。
在本发明的异丁香酚单加氧酶突变体的制备中,所获得的异丁香酚单加氧酶突变体基因可以在原核细胞或真核细胞胞内表达,也可采用本领域已知的任何其它适当方法实现在原核细胞或真核细胞胞外表达。
在本发明的异丁香酚单加氧酶突变体的制备中,所述载体的宿主细胞为原核细胞或真核细胞。原核细胞包括但不限于大肠杆菌;真核细胞包括但不限于酿酒酵母和毕赤巴斯德酵母。
下面以具体实施例对本发明进一步说明。
一、异丁香酚单加氧酶编码基因的扩增与克隆
根据异丁香酚单加氧酶(ISO)基因序列,对5个氨基酸位点(Asn120,Thr121,Phe281,Met298,Leu470)进行饱和定点突变,根据毕赤酵母中密码子偏好性设计突变位点。利用DANMAN软件,设计出6对PCR扩增引物,引物由上海生工合成。引物设计如下表1所示。
(1)第一次PCR
定点前半部分基因突变a体系(50μL):引物NdeI-F和引物突变点-R各1.5μL、模板(ISO菌液)2μL、ddH2O 20μL、Max DNA聚合酶25μL。体系混匀后,进行PCR扩增:按3.3.13程序扩增。扩增结束后,取3μL混合物于1%琼脂糖凝胶电泳上观察a片段大小。切胶纯化。
定点前半部分基因突变b体系(50μL):引物XhoI-R和引物突变点-F各1.5μL、模板(ISO菌液)2μL、ddH2O 20μL、Max DNA聚合酶25μL。体系混匀后,进行PCR扩增:按3.3.13程序扩增。扩增结束后,取3μL混合物于1%琼脂糖凝胶电泳上观察b片段大小。切胶纯化。
(2)第二次PCR
定点饱和突变完整的基因f体系(50μL):引物NdeI-F 1.5μL、引物XhoI-R1.5μL、模板(a)0.5μL、模板(b)0.5μL ddH2O 20μL、Max DNA聚合酶25μL。体系混匀后,进行PCR扩增:按3.3.13程序扩增。扩增结束后,取3μL混合物于1%琼脂糖凝胶电泳上观察f片段大小。切胶纯化。
PCR扩增反应程序为:
扩增的产物经限制性内切酶NdeI和Xhol酶切后与经同样限制性内切酶NdeI和Xhol酶切的载体pET30a连接,得质粒pET30a-ISO。经DNA测序,确定该被克隆的异丁香酚单加氧酶的核苷酸序列,具体如下序列1,相应的氨基酸序列如下序列2。
表1
序列1:异丁香酚单加氧酶DNA序列
序列2:异丁香酚单加氧酶氨基酸序列
MATFDRNDPQLAGTMFPTRIEANVFDLEIEGEIPRAINGSFFRNTPEPQVTTQPFHTFIDGDGLASAFHF
EDGQVDFVSRWVCTPRFEAERSARKSLFGMYRNPFTDDPSVEGIDRTVANTSIITHHGKVLAAKEDGLPY
ELDPQTLETRGRYDYKGQVTSHTHTAHPKFDPQTGEMLLFGSAAKGERTLDMAYYIVDRYGKVTHETWFK
QPYGAFMHDFAVTRNWSIFPIMPATNSLERLKAKQPIYMWEPERGSYIGVLPRRGQGKDIRWFRAPALWV
FHVVNAWEEGNRILIDLMESEILPFPFPNSQNLPFDPSKAVPRLTRWEIDLNSGNDEMKRTQLHEYFAEM
PIMDFRFALQDHRYAYMGVDDPRRPLAHQQAEKIFAYNSLGVWDNHRKDYELWFTGKMSAAQEPAFVPRS
PDAPEGDGYLLSVVGRLDEDRSDLVILDTQCLAAGPVATVKLPFRLRAALHGCWQSKN
具体地,异丁香酚单加氧酶氨基酸序列:Met Ala Thr Phe Asp Arg Asn Asp Pro Gln Leu Ala Gly Thr Met Phe Pro Thr Arg Ile Glu Ala Asn Val Phe Asp Leu Glu Ile Glu Gly Glu Ile Pro Arg Ala Ile Asn Gly Ser Phe Phe Arg Asn Thr Pro Glu Pro Gln Val Thr Thr Gln Pro Phe His Thr Phe Ile Asp Gly Asp Gly Leu Ala Ser Ala Phe His Phe Glu Asp Gly Gln Val Asp Phe Val Ser Arg Trp Val Cys Thr Pro Arg Phe Glu Ala Glu Arg Ser Ala Arg Lys Ser Leu Phe Gly Met Tyr Arg Asn Pro Phe Thr Asp Asp Pro Ser Val Glu Gly Ile Asp Arg Thr Val Ala Asn Thr Ser Ile Ile Thr His His Gly Lys Val Leu Ala Ala Lys Glu Asp Gly Leu Pro Tyr Glu Leu Asp Pro Gln Thr Leu Glu Thr Arg Gly Arg Tyr Asp Tyr Lys Gly Gln Val Thr Ser His Thr His Thr Ala His Pro Lys Phe Asp Pro Gln Thr Gly Glu Met Leu Leu Phe Gly Ser Ala Ala Lys Gly Glu Arg Thr Leu Asp Met Ala Tyr Tyr Ile Val Asp Arg Tyr Gly Lys Val Thr His Glu Thr Trp Phe Lys Gln Pro Tyr Gly Ala Phe Met His Asp Phe Ala Val Thr Arg Asn Trp Ser Ile Phe Pro Ile Met Pro Ala Thr Asn Ser Leu Glu Arg Leu Lys Ala Lys Gln Pro Ile Tyr Met Trp Glu Pro Glu Arg Gly Ser Tyr Ile Gly Val Leu Pro Arg Arg Gly Gln Gly Lys Asp Ile Arg Trp Phe Arg Ala Pro Ala Leu Trp Val Phe His Val Val Asn Ala Trp Glu Glu Gly Asn Arg Ile Leu Ile Asp Leu Met Glu Ser Glu Ile Leu Pro Phe Pro Phe Pro Asn Ser Gln Asn Leu Pro Phe Asp Pro Ser Lys Ala Val Pro Arg Leu Thr Arg Trp Glu Ile Asp Leu Asn Ser Gly Asn Asp Glu Met Lys Arg Thr Gln Leu His Glu Tyr Phe Ala Glu Met Pro Ile Met Asp Phe Arg Phe Ala Leu Gln Asp His Arg Tyr Ala Tyr Met Gly Val Asp Asp Pro Arg Arg Pro Leu Ala His Gln Gln Ala Glu Lys Ile Phe Ala Tyr Asn Ser Leu Gly Val Trp Asp Asn His Arg Lys Asp Tyr Glu Leu Trp Phe Thr Gly Lys Met Ser Ala Ala Gln Glu Pro Ala Phe Val Pro Arg Ser Pro Asp Ala Pro Glu Gly Asp Gly Tyr Leu Leu Ser Val Val Gly Arg Leu Asp Glu Asp Arg Ser Asp Leu Val Ile Leu Asp Thr Gln Cys Leu Ala Ala Gly Pro Val Ala Thr Val Lys Leu Pro Phe Arg Leu Arg Ala Ala Leu His Gly Cys Trp Gln Ser Lys Asn
二、异丁香酚单加氧酶的定点突变
实施例1:异丁香酚单加氧酶位点120的定点突变
定点突变技术可参考Ho et al.Gene.1989,77:51-33的描述。具体过程如下:
为了将亲本氨基酸序列中第120位点的Nsn(N)突变为Ile(I)获得突变体N 120I,以质粒pET30a-ISO为模板,设计引物对Nsn120-F和Nsn120-R(见表1)。
用引物对NdeI-F和N120-R,扩增F-NR片段,用引物对Nsn120-F和XhoI-R,扩增NF-R片段。扩增反应条件为:25μL Max DNA聚合酶(TaKaRa,Japan),2μL pET21a-ISO,以及1.5μL引物NdeI-F和1.5μL引物Nsn120-R(或者,1.5μL引物Nsn120-F和1.5μL引物XhoI-R),用无菌水调反应体积至50微升。PCR扩增反应程序为:98℃2分钟,30圈循环:98℃10秒、60℃15秒和72℃10秒,最后72℃5分钟。经1%琼脂糖胶电泳分离并用商业试剂盒回收,分别得到F-NR片段和NF-R片段。然后扩增全长基因。扩增反应条件为:1.5μL引物NdeI-F和1.5μL XhoI-R,25μL Max DNA聚合酶(TaKaRa,Japan),0.5μL F-NR片段与0.5μL NF-R片段,用无菌水调反应体积至50微升。PCR扩增反应程序为:98℃2分钟,30圈循环:98℃10秒、60℃15秒和72℃10秒,最后72℃5分钟。经1%琼脂糖胶电泳分离并用商业试剂盒回收,得到全长突变基因N120I。
将N120I片段回收并经酶切再回收后与载体pET-30a连接,得质粒pET30a-N120I。将质粒pET30a-N120I转入感受态细菌细胞E.coli BL21。经DNA测序确定引入的点突变无误。N120I的测序结果见图1。
由图1中可知,ISO定点饱和突变120位氨基酸Asn已成功突变成其他6种不同的氨基酸,分别有N120I、N120L、N120S、N120V、N120F、N120C。
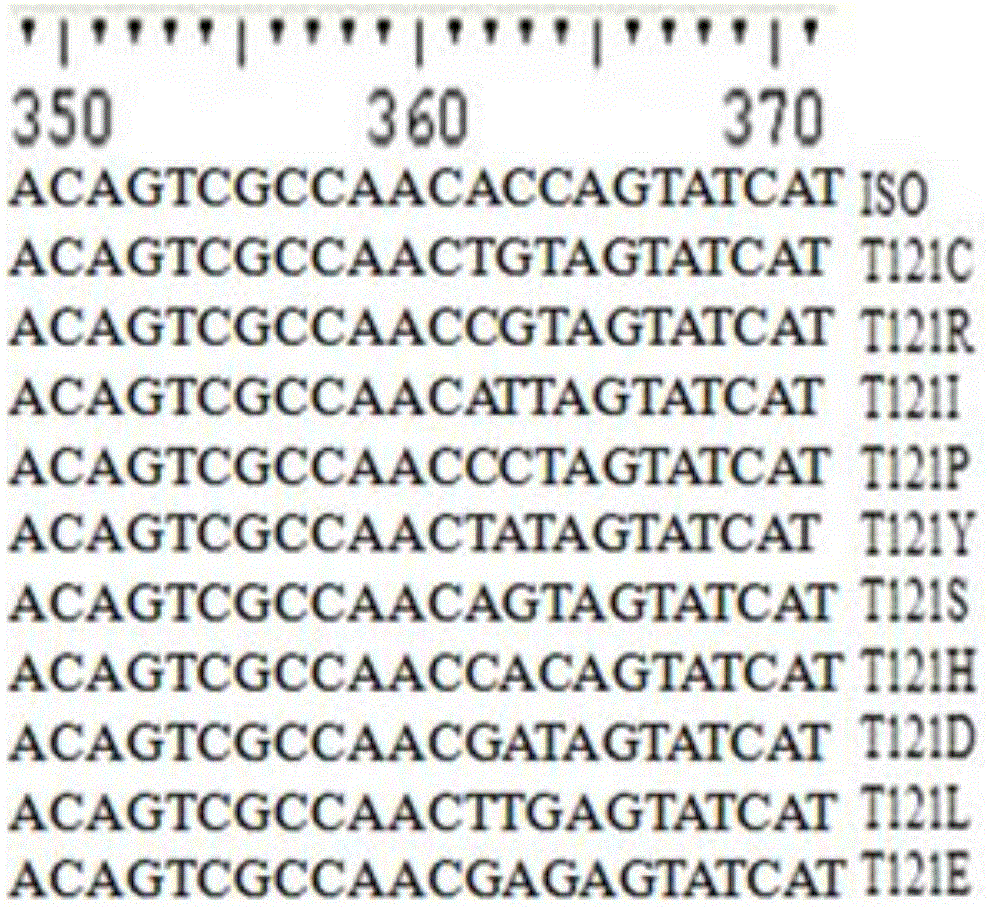
实施例2:异丁香酚单加氧酶位点121的定点突变
定点突变技术可参考Ho et al.Gene.1989,77:51-33之描述。具体过程如下:
为了将亲本氨基酸序列中第121位点的Thr(T)突变为Pro(P)获得突变体T120P,以质粒pET30a-ISO为模板,设计引物对Thr121-F和Thr121-R(见表1)。
用引物对NdeI-F和Thr121-R,扩增F-TR片段,用引物对Thr121-F和XhoI-R,扩增TF-R片段。扩增反应条件为:25μL Max DNA聚合酶(TaKaRa,Japan),2μL pET21a-ISO,以及1.5μL引物NdeI-F和1.5μL引物Thr121-R(或者,1.5μL引物Thr121-F和1.5μL引物XhoI-R),用无菌水调反应体积至50微升。PCR扩增反应程序为:98℃2分钟,30圈循环:98℃10秒、60℃15秒和72℃10秒,最后72℃5分钟。经1%琼脂糖胶电泳分离并用商业试剂盒回收,分别得到F-TR片段和TF-R片段。然后扩增全长基因。扩增反应条件为:1.5μL引物NdeI-F和1.5μL XhoI-R,25μL Max DNA聚合酶(TaKaRa,Japan),0.5μL F-TR片段与0.5μL TF-R片段,用无菌水调反应体积至50微升。PCR扩增反应程序为:98℃2分钟,30圈循环:98℃10秒、60℃15秒和72℃10秒,最后72℃5分钟。经1%琼脂糖胶电泳分离并用商业试剂盒回收,得到全长突变基因T121P。
将T121P片段回收并经酶切再回收后与载体pET-30a连接,得质粒pET30a-T121P。将质粒pET30a-T121P转入感受态细菌细胞E.coli BL21。经DNA测序确定引入的点突变无误。T121P的测序结果见图2。
由图2中可知,ISO定点饱和突变121位氨基酸Thr已成功突变成其他10种不同的氨基酸,分别有T121C、T121R、T121I、T121P、T121Y、N120S、T121H、T121D、T121L、T121E。
实施例3:异丁香酚单加氧酶位点281的定点突变
定点突变技术可参考Ho et al.Gene.1989,77:51-33之描述。具体过程如下:
为了将亲本氨基酸序列中第281位点的Phe(F)突变为Gln(Q)获得突变体F281Q,以质粒pET30a-ISO为模板,设计引物对Phe281-F和Phe281-R(见表1)。
用引物对NdeI-F和Phe281-R,扩增F-FR片段,用引物对Phe281-F和XhoI-R,扩增FF-R片段。扩增反应条件为:25μL Max DNA聚合酶(TaKaRa,Japan),2μL pET21a-ISO,以及1.5μL引物NdeI-F和1.5μL引物Phe281-R(或者,1.5μL引物Phe281-F和1.5μL引物XhoI-R),用无菌水调反应体积至50微升。PCR扩增反应程序为:98℃2分钟,30圈循环:98℃10秒、60℃15秒和72℃10秒,最后72℃5分钟。经1%琼脂糖胶电泳分离并用商业试剂盒回收,分别得到F-FR片段和FF-R片段。然后扩增全长基因。扩增反应条件为:1.5μL引物NdeI-F和1.5μL XhoI-R,25μL Max DNA聚合酶(TaKaRa,Japan),0.5μL F-FR片段与0.5μL FF-R片段,用无菌水调反应体积至50微升。PCR扩增反应程序为:98℃2分钟,30圈循环:98℃10秒、60℃15秒和72℃10秒,最后72℃5分钟。经1%琼脂糖胶电泳分离并用商业试剂盒回收,得到全长突变基因F281Q。
将F281Q片段回收并经酶切再回收后与载体pET-30a连接,得质粒pET30a-F281Q。将质粒pET30a-F281Q转入感受态细菌细胞E.coli BL21。经DNA测序确定引入的点突变无误。F281Q的测序结果见图3。
由图3中可知,ISO定点饱和突变281位氨基酸Phe已成功突变成其他9种不同的氨基酸,分别有F281D、F281H、F281V、F281S、F281Y、F281Q、F281W、F281I、F281N。
实施例4:异丁香酚单加氧酶位点298的定点突变
定点突变技术可参考Ho et al.Gene.1989,77:51-33之描述。具体过程如下:
为了将亲本氨基酸序列中第298位点的Met(M)突变为Lys(K)获得突变体M298K,以质粒pET30a-ISO为模板,设计引物对Met298-F和Met298-R(见表1)。
用引物对NdeI-F和Met298-R,扩增F-MR片段,用引物对Met298-F和XhoI-R,扩增MF-R片段。扩增反应条件为:25μL Max DNA聚合酶(TaKaRa,Japan),2μL pET21a-ISO,以及1.5μL引物NdeI-F和1.5μL引物Met298-R(或者,1.5μL引物Met298-F和1.5μL引物XhoI-R),用无菌水调反应体积至50微升。PCR扩增反应程序为:98℃2分钟,30圈循环:98℃10秒、60℃15秒和72℃10秒,最后72℃5分钟。经1%琼脂糖胶电泳分离并用商业试剂盒回收,分别得到F-MR片段和MF-R片段。然后扩增全长基因。扩增反应条件为:1.5μL引物NdeI-F和1.5μL XhoI-R,25μL Max DNA聚合酶(TaKaRa,Japan),0.5μL F-MR片段与0.5μL MF-R片段,用无菌水调反应体积至50微升。PCR扩增反应程序为:98℃2分钟,30圈循环:98℃10秒、60℃15秒和72℃10秒,最后72℃5分钟。经1%琼脂糖胶电泳分离并用商业试剂盒回收,得到全长突变基因M298K。
将M298K片段回收并经酶切再回收后与载体pET-30a连接,得质粒pET30a-M298K。将质粒pET30a-M298K转入感受态细菌细胞E.coli BL21。经DNA测序确定引入的点突变无误。M298K的测序结果见图4。
由图4中可知,ISO定点饱和突变298位氨基酸Met已成功突变成其他13种不同的氨基酸,分别有M298I、M298F、M298K、M298Y、M298N、M298E、M298V、M298S、M298H、M298R、M298T、M298L、M298G。
实施例5:异丁香酚单加氧酶位点470的定点突变
定点突变技术可参考Ho et al.Gene.1989,77:51-33之描述。具体过程如下:
为了将亲本氨基酸序列中第470位点的Leu(L)突变为Ser(S)获得突变体T120P,以质粒pET30a-ISO为模板,设计引物对Leu470-F和Leu470-R(见表1)。
用引物对NdeI-F和Leu470-R,扩增F-LR片段,用引物对Leu470-F和XhoI-R,扩增LF-R片段。扩增反应条件为:25μL Max DNA聚合酶(TaKaRa,Japan),2μL pET21a-ISO,以及1.5μL引物NdeI-F和1.5μL引物Leu470-R(或者,1.5μL引物Leu470-F和1.5μL引物XhoI-R),用无菌水调反应体积至50微升。PCR扩增反应程序为:98℃2分钟,30圈循环:98℃10秒、60℃15秒和72℃10秒,最后72℃5分钟。经1%琼脂糖胶电泳分离并用商业试剂盒回收,分别得到F-LR片段和LF-R片段。然后扩增全长基因。扩增反应条件为:1.5μL引物NdeI-F和1.5μL XhoI-R,25μL Max DNA聚合酶(TaKaRa,Japan),0.5μL F-LR片段与0.5μL LF-R片段,用无菌水调反应体积至50微升。PCR扩增反应程序为:98℃2分钟,30圈循环:98℃10秒、60℃15秒和72℃10秒,最后72℃5分钟。经1%琼脂糖胶电泳分离并用商业试剂盒回收,得到全长突变基因L470S。
将L470S片段回收并经酶切再回收后与载体pET-30a连接,得质粒pET30a-L470S。将质粒pET30a-L470S转入感受态细菌细胞E.coli BL21。经DNA测序确定引入的点突变无误。L470S的测序结果见图5。
由图5中可知,ISO定点饱和突变470位氨基酸Leu已成功突变成其他9种不同的氨基酸,分别有L470E、L470Y、L470K、L470T、L470S、L470I、L470N、L470H、L470Q。
三、异丁香酚单加氧酶突变体的诱导提取
将含突变异丁香酚单加氧酶基因的质粒pET30a-ISO转化感受态细菌细胞E.coli BL21,在4mL Luria broth(LB)平板(含4μL氨苄抗生素)上37℃培养24小时。将培养过夜的菌液50μL再接种到5mL LB液体培养基(含有5μL氨苄抗生素)于37℃,200r/min振摇培养至光密度0.8时,加入IPTG并使其终浓度为0.2mM。含突变异丁香酚单加氧酶基因包括上述实施例1-实施例5所获得的基因。
离心收集菌体,用含有6M尿素的PDG缓冲液震荡悬浮,超声破碎40min,离心(4℃,15000g离心40min)收集上清,以针头过滤器(0.45um)过滤后,经HiTrap Chelating HP柱纯化,收集UV280各峰组分,经SDS凝胶电泳确定50kDa处的目的蛋白,透析甘氨酸-NaOH(100mM)缓冲液获得异丁香酚单加氧酶。SDS凝胶电泳结果见图6。
图6中,位于左侧的第一泳道为不加IPTG诱导的结果,位于右侧的第二泳道为加IPTG诱导的结果,约50kDa对应处条带即为表达的蛋白(异丁香酚单加氧酶(目标带大小约为50kD)在大肠杆菌BL21中有表达)。结果表明:加IPTG诱导成功表达了异丁香酚单加氧酶。
四、异丁香酚单加氧酶突变体转化效率提高的验证
往Ep管加入0.7g湿菌体(分别为实施例1-实施例5所转化获得)、pH10.5甘氨酸-氢氧化钠缓冲溶液7mL、异丁香酚40g/L,于25℃,200rpm转化48h。将转化液加入等体积无水乙醇(沉淀蛋白,溶解瓶壁上吸附的壳聚糖),取样离心取上清,用50%乙醇稀释一定倍数,用0.22μm有机滤头过滤,按照条件如色谱柱:ZORBAX Eclipse Plus C18;反相色谱柱4.6x 150mmol/L;流动相(梯度洗脱):0-6min纯甲醇/纯水(0.1%冰乙酸)=40/60;6-15min纯甲醇/纯水(0.1%冰乙酸)=60/40;流速:1mL/min,波长280nm处紫外检测,进样量20μL、柱温:30℃,用HPLC检测香草醛的浓度,检测结果见图7-图11,图中纵坐标为香草醛浓度(g/L)。
图7为ISO定点饱和突变Asn120对转化的影响,从图中可知,突变菌株N120I(最高柱)相对原始菌ISO(IEM柱)香草醛浓度高117%。
图8为ISO定点饱和突变Thr121对转化的影响,从图中可知,突变菌株T121P(最高柱)相对原始菌ISO(IEM柱)香草醛浓度高125%。
图9为ISO定点饱和突变Phe281对转化的影响,从图中可知,突变菌株F281Q(最高柱)相对原始菌ISO(IEM柱)香草醛浓度高203%。
图10为ISO定点饱和突变Met298对转化的影响,从图中可知,突变菌株M298K(最高柱)相对原始菌ISO(IEM柱)香草醛浓度高186%。
图11为ISO定点饱和突变Leu470对转化的影响,从图中可知,突变菌株L470S(最高柱)相对原始菌ISO(IEM柱)香草醛浓度高165%。
以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本发明的专利保护范围内。
<110>深圳大学
<120>异丁香酚单加氧酶突变体及其应用
<130>CN1618493YZ
<160> 2
<210> 1
<211> 1438
<212> DNA
<213> 人工序列
<400> 1
atggcaacgt ttgaccgcaa tgatccacag ttgagcaggc acgatgttcc ccacccgaat
agaggcgaat gtctttgacc ttgaaattga gggcgagatc ccacgtgcaa tcaacgggag
cttcttccgc aacacccccg aacctcaggt caccacgcaa cctttccaca ccttcatcga
tggggatggt ttggcgtctg cttttcattt cgaagatggc caggtcgact ttgtcagccg
ttgggtatgt actcctcgct ttgaagctga gcggtcggct cgtaaatcac tcttcggtat
gtaccgcaat ccgttcactg atgatccatc ggtagaaggt attgatcgta cagtcgccaa
caccagtatc atcactcatc acgggaaagt actggccgca aaggaagatg gactacctta
tgagcttgac ccccaaaccc tggaaacccg aggtcgttat gattacaagg ggcaggtaac
cagccataca catacagcgc accctaagtt cgacccccag acaggtgaaa tgttactctt
cggctccgct gctaaaggcg aacgaacgct tgatatggcg tactatattg ttgatcgcta
cggcaaggtg acacatgaga cctggtttaa gcagccttac ggtgcattca tgcacgactt
tgctgtcacg cgcaactggt caatctttcc gatcatgcct gcgacaaata gccttgagcg
tcttaaagca aagcagccca tttacatgtg ggagcctgag cgaggaagct atataggagt
acttcctcgt cgtggtcagg gcaaggacat tcgttggttc cgtgccccgg cgttgtgggt
tttccatgtc gtgaatgctt gggaggaagg gaatagaatt ctgattgact tgatggaaag
tgagattttg ccgttcccat tcccgaactc gcagaacctt ccatttgatc cctccaaggc
tgttccgcgt ctaacccgtt gggaaattga tctcaatagt ggtaacgatg agatgaaacg
tacgcagcta cacgaatatt ttgcagaaat gcctatcatg gatttccgtt ttgcgctcca
ggatcatcgc tacgcctaca tgggggttga cgatcctcgt cgccccttag ctcatcagca
agctgaaaaa atctttgcct acaattcgtt aggggtttgg gacaaccatc gtaaagatta
tgaactttgg tttacgggaa aaatgtctgc agcgcaggaa ccggcgtttg ttcctagaag
cccagatgcg cctgagggcg atggctacct actcagtgta gtagggcggc tcgatgaaga
tcgtagcgat ctagttatcc ttgatacgca atgtttggca gctgggcctg tggccactgt
caagcttccc ttccgtctcc gagcagcgtt gcacggttgt tggcagtcta agaactga 1438
<210> 2
<211> 478
<212> PRT
<213> 恶臭假单胞菌(Pseudomonas putide)
<400>2
Met Ala Thr Phe Asp Arg Asn Asp Pro Gln Leu Ala Gly Thr Met Phe
5 10 15
Pro Thr Arg Ile Glu Ala Asn Val Phe Asp Leu Glu Ile Glu Gly Glu
20 25 30
Ile Pro Arg Ala Ile Asn Gly Ser Phe Phe Arg Asn Thr Pro Glu Pro
35 40 45
Gln Val Thr Thr Gln Pro Phe His Thr Phe Ile Asp Gly Asp Gly Leu
50 55 60
Ala Ser Ala Phe His Phe Glu Asp Gly Gln Val Asp Phe Val Ser Arg
65 70 75 80
Trp Val Cys Thr Pro Arg Phe Glu Ala Glu Arg Ser Ala Arg Lys Ser
85 90 95
Leu Phe Gly Met Tyr Arg Asn Pro Phe Thr Asp Asp Pro Ser Val Glu
100 105 110
Gly Ile Asp Arg Thr Val Ala Asn Thr Ser Ile Ile Thr His His Gly
115 120 125
Lys Val Leu Ala Ala Lys Glu Asp Gly Leu Pro Tyr Glu Leu Asp Pro
130 135 140
Gln Thr Leu Glu Thr Arg Gly Arg Tyr Asp Tyr Lys Gly Gln Val Thr
145 150 155 160
Ser His Thr His Thr Ala His Pro Lys Phe Asp Pro Gln Thr Gly Glu
165 170 175
Met Leu Leu Phe Gly Ser Ala Ala Lys Gly Glu Arg Thr Leu Asp Met
180 185 190
Ala Tyr Tyr Ile Val Asp Arg Tyr Gly Lys Val Thr His Glu Thr Trp
195 200 205
Phe Lys Gln Pro Tyr Gly Ala Phe Met His Asp Phe Ala Val Thr Arg
210 215 220
Asn Trp Ser Ile Phe Pro Ile Met Pro Ala Thr Asn Ser Leu Glu Arg
225 230 235 240
Leu Lys Ala Lys Gln Pro Ile Tyr Met Trp Glu Pro Glu Arg Gly Ser
245 250 255
Tyr Ile Gly Val Leu Pro Arg Arg Gly Gln Gly Lys Asp Ile Arg Trp
260 265 270
Phe Arg Ala Pro Ala Leu Trp Val Phe His Val Val Asn Ala Trp Glu
275 280 285
Glu Gly Asn Arg Ile Leu Ile Asp Leu Met Glu Ser Glu Ile Leu Pro
290 295 300
Phe Pro Phe Pro Asn Ser Gln Asn Leu Pro Phe Asp Pro Ser Lys Ala
305 310 315 320
Val Pro Arg Leu Thr Arg Trp Glu Ile Asp Leu Asn Ser Gly Asn Asp
325 330 335
Glu Met Lys Arg Thr Gln Leu His Glu Tyr Phe Ala Glu Met Pro Ile
340 345 350
Met Asp Phe Arg Phe Ala Leu Gln Asp His Arg Tyr Ala Tyr Met Gly
355 360 365
Val Asp Asp Pro Arg Arg Pro Leu Ala His Gln Gln Ala Glu Lys Ile
370 375 380
Phe Ala Tyr Asn Ser Leu Gly Val Trp Asp Asn His Arg Lys Asp Tyr
385 390 395 400
Glu Leu Trp Phe Thr Gly Lys Met Ser Ala Ala Gln Glu Pro Ala Phe
405 410 415
Val Pro Arg Ser Pro Asp Ala Pro Glu Gly Asp Gly Tyr Leu Leu Ser
420 425 430
Val Val Gly Arg Leu Asp Glu Asp Arg Ser Asp Leu Val Ile Leu Asp
435 440 445
Thr Gln Cys Leu Ala Ala Gly Pro Val Ala Thr Val Lys Leu Pro Phe
450 455 460
Arg Leu Arg Ala Ala Leu His Gly Cys Trp Gln Ser Lys Asn
465 470 475
- 还没有人留言评论。精彩留言会获得点赞!