一种适配体筛选用多腔室微流控PCR芯片及其制造方法与应用与流程
本发明属于生物检测技术领域,具体涉及一种适配体筛选用多腔室微流控PCR芯片及扩增方法。
背景技术:
适配体具有与抗体相类似的性质,但是在许多方面还体现出了优于抗体的特点:(1)特异性更强;(2)更容易获得;(3)可以针对不同种类的目标靶分子进行筛选,拓宽应用范围;(4)无免疫原性,可在体内反复使用;(5)稳定性优于抗体,利于储存。正是基于适配体的各种优点,适配体在分析、临床、环境、分子识别及药物筛选等方面都显示出了广阔的应用前景。因此,适配体筛选技术的进步直接影响了适配体的有效获取和应用。
在适配体筛选过程中,PCR扩增技术作为一个关键环节尤为重要,通过PCR技术可以成千上万倍的扩大筛选后的文库的库容量,保证下一轮筛选的顺利进行,因此,对适配体筛选中PCR扩增方法的研究具有重要的意义。目前,适配体筛选中的PCR扩增方法依然采用固定轮数扩增,对扩增结果没有定量的监控,这就导致了经分离后的次级文库的库容量、文库的质量均不相同。近几年一些科学工作者开始重视扩增轮数的优化问题,但采用的是离线的扩增条件优化方法,其方法琐碎、复杂,不利于加速筛选流程。发展一种更加简单、快速的微流控PCR芯片扩增方法十分重要。实时快速观察PCR扩增的最优条件,控制扩增产物的库容量,保证次级文库的优质性、一致性对于适配体筛选的成功具有重要影响。本发明方法优化了PCR扩增优化过程使得整个适配体筛选过程更加简单化、快速化。
技术实现要素:
本发明所要解决的技术问题是提供一种适配体筛选用多腔室微流控PCR芯片及扩增方法。
为解决上述技术问题,本发明采用的技术方案如下:
一种适配体筛选用多腔室微流控PCR芯片,该多腔室微流控PCR芯片包括微流PCR反应片、温度循环加热板、玻璃基底、芯片夹具,所述PDMS反应片上设有反应液注入孔、Z型混合单元、流入微流通道、PCR反应池、流出微流通道、反应液流出孔,所述反应液注入孔、Z型混合单元、流入微流通道、PCR扩增室、流出微流通道、反应液流出孔依次联通。
作为优选,所述微流PCR反应片置于玻璃基底上,所述玻璃基底置于温度循环加热板上。
作为优选,所述芯片夹具通过固定螺丝与温度循环加热板连接。
作为优选,所述PCR反应池的数量为2~16个。
上述适配体筛选用多腔室微流控PCR芯片的制造方法,包括如下步骤:
(1)利用打印机打印微流控PCR芯片的基体;
(2)微流控PCR芯片的基体通过紫外曝光后将图形转移至涂有感光胶的镉板上通过湿法刻蚀制备微流控通道模板;
(3)将PDMS前聚体与固化剂按照质量比为5:1~20:1的比例混合均匀后,将其放入真空干燥器中,除气泡,再浇到微流控通道模板上,经固化后得到2~6mm厚的PDMS微流控通道;
(4)用4~10mm打孔器在微流控通道模板上打孔,得到扩增反应腔室,再用等离子处理,得到微流PCR反应片;
(5)将玻璃片紧密贴合在微流控通道模板上,得到微流控PCR芯片。
利用多腔室微流控PCR芯片适筛选配体的方法,包括如下步骤:
(1)多腔室微流控PCR芯片准备:向多腔室微流控PCR芯片通入5~20mg/mL BSA和0.01~0.5mM随机序列短链ssDNA,在25~40℃条件下封闭1~3h,之后用500μL 1×PBST溶液清洗通道,最后用高纯氮气吹干备用;
(2)扩增样品制备:将适配体筛选产物75μL与300μL2×SYBR Premix Ex TaqTM酶,12μL、20μM TAMRA标记的前向引物和12μL、20μM生物素化的后向引物及216μL超纯水混合通过注射泵经芯片在在微流控通道内的Z型混合单元中混合后平均分配至2~16个PCR反应池,最后每个反应腔室中加入10~100μL的矿物油防止溶剂挥发;
(3)PCR扩增过程:将步骤(2)制备好的芯片放置于温度循环平板加热板上进行PCR扩增;扩增程序设置如下:95℃30s~150s,10~30轮循环:95℃30s,60.5℃30s,72℃30s,使用小型荧光探头直接置于反应腔室上方5~25mm采集反应腔室中的荧光信号。
适配体筛选后保留少量的核酸文库,需要使用PCR扩增进行成千上万倍的核酸文库以便于下一轮的筛选所用,Z型混合单元可提高筛选文库与PCR酶的在线混合,减少体外的人工操作,减少污染可能性,2-6个PCR腔室可提高PCR扩增后核酸序列的总量。
有益效果:
本发明公开一种适配体筛选用多腔室微流控PCR芯片及其制造方法与应用,该微流控PCR芯片采用多个反应腔室,可保证次级文库的高质、足量获取及核酸种类多样性;该微流控PCR芯片通过荧光实时扩增曲线可以快速获取最优扩增条件,将适配体筛选的核酸序列进行最优条件下扩增。根据扩增曲线达到荧光最高值之后曲线的变化可以来验证筛选文库筛选过程中多样性的变化。本发明方法可简单、快速的实时获取适配体筛选中次级文库扩增最优条件及文库多样性改变。本发明的微流控PCR芯片方法可以广范用于各类靶标适配体筛选的PCR扩增步骤,为其他适配体筛选工作者提供了很好的思路设计和参考。
附图说明
图1多腔室微流控PCR芯片整体示意图。
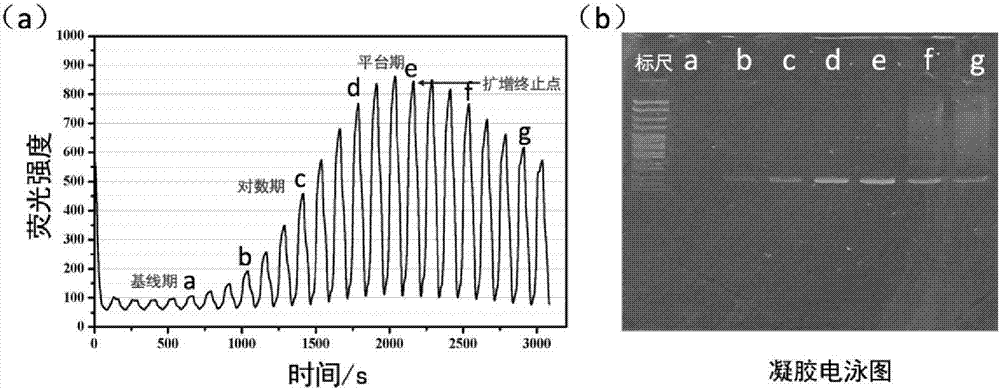
图2多腔室微流控PCR芯片扩增曲线图(a);PCR扩增过程中产物凝胶电泳图(b)。
图3多腔室微流控PCR芯片文库多样性监控图。
图4多腔室微流控PCR芯片俯视图。
图5多腔室微流控PCR芯片侧视图。
图6微流控PCR芯片PDMS流路的细节图。
具体实施方式
根据下述实施例,可以更好地理解本发明。然而,本领域的技术人员容易理解,实施例所描述的内容仅用于说明本发明,而不应当也不会限制权利要求书中所详细描述的本发明。
图4~5中,1温度循环加热板、2微流控PCR芯片玻璃基底、3微流控PCR芯片PDMS流路、4PMMA材质的芯片夹具、5夹具固定螺丝,6反应液注入孔、7Z型混合通道、8流入微流通道、9PCR反应池、10流出微流通道、11反应液流出孔。
实施例1:微流控PCR芯片的制备
使用Adobe Illustrator设计具有Z型混合单元及4个PCR扩增反应池的图形,高精密打印后通过紫外曝光后将图形转移至隔板上通过湿法刻蚀制备出芯片模板,将PDMS前聚体与固化剂按照质量比为10:1的比例混合均匀后将其放入真空干燥器中,连接循环水真空泵进行抽真空30min除气泡。后将其浇到微流控通道模板上,经固化后得到4mm厚的PDMS微流控通道,将PCR反应池用8mm打孔器进行打孔得到扩增反应池,等离子处理后,将微流控PCR芯片和薄玻璃片(厚度:0.13-0.17mm)紧密贴合后得到微流控PCR芯片;
实施例2:实时荧光微流控PCR芯片扩增
实时荧光微流控PCR芯片扩增的具体步骤,包括芯片制备、微流控PCR芯片准备、扩增样品制备、PCR扩增过程,具体如下:
(1)芯片制备:使用Adobe Illustrator设计具有Z型混合单元及4个PCR扩增反应池的图形,高精密打印后通过紫外曝光后将图形转移至隔板上通过湿法刻蚀制备出芯片模板,将PDMS前聚体与固化剂按照质量比为10:1的比例混合均匀后将其放入真空干燥器中,连接循环水真空泵进行抽真空30min除气泡。后将其浇到微流控通道模板上,经固化后得到4mm厚的PDMS微流控通道,将PCR反应池用8mm打孔器进行打孔得到扩增反应池,等离子处理后,将微流控PCR芯片和薄玻璃片(厚度:0.13-0.17mm)紧密贴合后得到微流控PCR芯片;
(2)微流控PCR芯片准备:将微流控PCR芯片通入10mg/mL BSA和0.1mM随机序列短链ssDNA(20nt)在37℃条件下封闭1h,之后用500μL 1×PBST溶液清洗通道后高纯氮气吹干后备用;;
(3)扩增样品制备:将适配体筛选的产物75μL与300μL 2×SYBR Premix Ex TaqTM酶,12μL、20μM TAMRA标记的前向引物和12μL、20μM生物素化的后向引物及216μL超纯水混合通过注射泵经芯片在线混合后平均分配至4个PCR扩增池,最后每个反应池中加入50μL的矿物油防止PCR过程中溶剂挥发;
(4)PCR扩增过程:将步骤(2)制备好的芯片放置于温度循环平板加热板上进行PCR扩增;扩增程序设置如下:95℃30s,10~30轮温度循环:95℃30s,60.5℃30s,72℃30s。
图2(a)多腔室微流控PCR芯片扩增曲线图。
实施例3:适配体筛选产物实时荧光PCR
适配体筛选产物实时荧光PCR的具体步骤,包括芯片制备、微流控PCR芯片准备、扩增样品制备、PCR扩增过程及扩增曲线采集等详细过程,具体如下:
(1)芯片制备:使用Adobe Illustrator设计具有Z型混合单元及4个PCR扩增反应池的图形,高精密打印后通过紫外曝光后将图形转移至隔板上通过湿法刻蚀制备出芯片模板,将PDMS前聚体与固化剂按照质量比为10:1的比例混合均匀后将其放入真空干燥器中,连接循环水真空泵进行抽真空30min除气泡。后将其浇到微流控通道模板上,经固化后得到4mm厚的PDMS微流控通道,将PCR反应池用8mm打孔器进行打孔得到扩增反应池,等离子处理后,将微流控PCR芯片和薄玻璃片(厚度:0.13-0.17mm)紧密贴合后得到微流控PCR芯片;
(2)微流控PCR芯片准备:将微流控PCR芯片通入10mg/mL BSA和0.1mM随机序列短链ssDNA(20nt)在37℃条件下封闭1h,之后用500μL 1×PBST溶液清洗通道后高纯氮气吹干后备用;;
(3)扩增样品制备:将适配体筛选的产物75μL与300μL 2×SYBR Premix Ex TaqTM酶,12μL、20μM TAMRA标记的前向引物和12μL、20μM生物素化的后向引物及216μL超纯水混合通过注射泵经芯片在线混合后平均分配至4个PCR扩增池,最后每个反应池中加入50μL的矿物油防止PCR过程中溶剂挥发;
(4)PCR扩增过程:将步骤(2)制备好的芯片放置于温度循环平板加热板上进行PCR扩增;扩增程序设置如下:95℃30s,10~30轮温度循环:95℃30s,60.5℃30s,72℃30s。荧光获取采用小型荧光探头直接置于反应池上方(8mm)直接获取其中一个反应池中的荧光信号。扩增程序与荧光采集程序同时开始,实时采集随扩增轮数的提高所引起的荧光信号的改变;
(5)PCR扩增曲线获取:通过扩增曲线的实时获取和观测可以对适配体筛选的产物进行最优扩增以此来保证扩增轮数不足(平台期以下轮数)引起的扩增产物少,又可以防止过扩增(平台期以后扩增将出现副产物增多)现象出现而导致偏向扩增情况,到达最佳扩增轮时候可通过计算机控制立即结束PCR扩增;
实施例4:适配体筛选产物实时荧光PCR
适配体筛选产物实时荧光PCR曲线的获取的具体步骤,包括芯片制备、微流控PCR芯片准备、扩增样品制备、PCR扩增过程及扩增曲线采集等详细过程,具体如下:
(1)芯片制备:使用Adobe Illustrator设计具有Z型混合单元及4个PCR扩增反应池的图形,高精密打印后通过紫外曝光后将图形转移至隔板上通过湿法刻蚀制备出芯片模板,将PDMS前聚体与固化剂按照质量比为10:1的比例混合均匀后将其放入真空干燥器中,连接循环水真空泵进行抽真空30min除气泡。后将其浇到微流控通道模板上,经固化后得到4mm厚的PDMS微流控通道,将PCR反应池用8mm打孔器进行打孔得到扩增反应池,等离子处理后,将微流控PCR芯片和薄玻璃片(厚度:0.13-0.17mm)紧密贴合后得到微流控PCR芯片;
(2)微流控PCR芯片准备:将微流控PCR芯片通入10mg/mL BSA和0.1mM随机序列短链ssDNA(20nt)在37℃条件下封闭1h,之后用500μL 1×PBST溶液清洗通道后高纯氮气吹干后备用;;
(3)扩增样品制备:将适配体筛选的产物75μL与300μL 2×SYBR Premix Ex TaqTM酶,12μL、20μM TAMRA标记的前向引物和12μL、20μM生物素化的后向引物及216μL超纯水混合通过注射泵经芯片在线混合后平均分配至4个PCR扩增池,最后每个反应池中加入50μL的矿物油防止PCR过程中溶剂挥发;
(4)PCR扩增过程:将步骤(2)制备好的芯片放置于温度循环平板加热板上进行PCR扩增;扩增程序设置如下:95℃30s,10~30轮温度循环:95℃30s,60.5℃30s,72℃30s。荧光获取采用小型荧光探头直接置于反应池上方(8mm)直接获取其中一个反应池中的荧光信号。扩增程序与荧光采集程序同时开始,实时采集随扩增轮数的提高所引起的荧光信号的改变;
(5)PCR扩增曲线获取:通过扩增曲线的实时获取和观测可以对适配体筛选的产物进行最优扩增以此来保证扩增轮数不足(平台期以下轮数)引起的扩增产物少,又可以防止过扩增(平台期以后扩增将出现副产物增多)现象出现而导致偏向扩增情况,到达最有扩增轮时候可通过计算机控制立即结束PCR扩增;
(6)PCR扩增产物凝胶电泳电泳分析:在微流控PCR芯片扩增过程中,取a:5轮,b:8轮,c:11轮,d:14轮,e:17轮,f:20轮,g:23轮进行SDS凝胶电泳验证,观察其微流控PCR芯片扩增过程中的各个阶段扩增情况,通过验证表明,当扩增未达到平台期时扩增效率较低,最优扩增条件为平台期时的扩增轮数,平台期后继续扩增将出现副产物增多的现象,不利于高质量次级文库的获取。
图2(b)PCR扩增过程中产物凝胶电泳图。
实施例5:适配体筛选产物实时荧光PCR曲线用于文库多样性监控
适配体筛选产物实时荧光PCR曲线用于适配体筛选多样性监控的具体步骤,包括芯片制备、微流控PCR芯片准备、扩增样品制备、PCR扩增过程及扩增曲线采集等详细过程,具体如下:
(1)芯片制备:使用Adobe Illustrator设计具有Z型混合单元及4个PCR扩增反应池的图形,高精密打印后通过紫外曝光后将图形转移至隔板上通过湿法刻蚀制备出芯片模板,将PDMS前聚体与固化剂按照质量比为10:1的比例混合均匀后将其放入真空干燥器中,连接循环水真空泵进行抽真空30min除气泡。后将其浇到微流控通道模板上,经固化后得到4mm厚的PDMS微流控通道,将PCR反应池用8mm打孔器进行打孔得到扩增反应池,等离子处理后,将微流控PCR芯片和薄玻璃片(厚度:0.13-0.17mm)紧密贴合后得到微流控PCR芯片;
(2)微流控PCR芯片准备:将微流控PCR芯片通入10mg/mL BSA和0.1mM随机序列短链ssDNA(20nt)在37℃条件下封闭1h,之后用500μL 1×PBST溶液清洗通道后高纯氮气吹干后备用;;
(3)扩增样品制备:将第一轮筛选产物75μL与300μL 2×SYBR Premix Ex TaqTM酶,12μL、20μM TAMRA标记的前向引物和12μL、20μM生物素化的后向引物及216μL超纯水混合通过注射泵经芯片在线混合后平均分配至4个PCR扩增池,最后每个反应池中加入50μL的矿物油防止PCR过程中溶剂挥发;
(4)PCR扩增过程:将步骤(3)制备好的芯片放置于温度循环平板加热板上进行PCR扩增;扩增程序设置如下:95℃30s,10~30轮温度循环:95℃30s,60.5℃30s,72℃30s。荧光获取采用小型荧光探头直接置于反应池上方(8mm)直接获取其中一个反应池中的荧光信号。扩增程序与荧光采集程序同时开始,实时采集随扩增轮数的提高所引起的荧光信号的改变;
(5)PCR扩增曲线获取:通过扩增曲线的实时获取和观测可以对适配体筛选的产物进行最优扩增以此来保证扩增轮数不足(平台期以下轮数)引起的扩增产物少,又可以防止过扩增(平台期以后扩增将出现副产物增多)现象出现而导致偏向扩增情况,到达最有扩增轮时候可通过计算机控制立即结束PCR扩增;
(6)对第二,第三,第三轮筛选产物分别进行PCR扩增,重复(3),(4),(5)实验操作,获取筛选的实时PCR扩增曲线。
图3为多通道微流控PCR芯片文库多样性监控图。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种舌癌细胞的核酸适配体及试剂盒的制造方法与工艺
- 金黄色葡萄球菌肠毒素C2的核酸适配体C203及其筛选方法和应用与制造工艺
- 胰岛素核酸适体INS5及其制备方法与制造工艺
- 一种高亲和力兴奋剂核酸适体EPO4及其制备方法与制造工艺
- 一种邻苯二甲酸酯类增塑剂单链DNA核酸适配体及其筛选与表征方法及电化学传感器与制造工艺
- 基于高特异性核酸适体荧光探针INS1胰岛素试剂盒及其检测方法与制造工艺
- 运用核酸适配体与溶菌酶特异性识别并形成G四链体进行荧光显现潜指纹的方法与制造工艺
- 基于快速识别核酸适体荧光探针INS2胰岛素试剂盒及其检测方法与制造工艺
- 一种用于检测沙门氏菌的增敏型核酸适配体试纸条及其制备方法
- 几种识别灭草松的核酸适配体序列及其衍生物的制作方法
- 一种舌癌细胞的核酸适配体及试剂盒的制造方法与工艺
- 金黄色葡萄球菌肠毒素C2的核酸适配体C203及其筛选方法和应用与制造工艺
- 胰岛素核酸适体INS5及其制备方法与制造工艺
- 一种高亲和力兴奋剂核酸适体EPO4及其制备方法与制造工艺
- 一种邻苯二甲酸酯类增塑剂单链DNA核酸适配体及其筛选与表征方法及电化学传感器与制造工艺
- 基于高特异性核酸适体荧光探针INS1胰岛素试剂盒及其检测方法与制造工艺
- 运用核酸适配体与溶菌酶特异性识别并形成G四链体进行荧光显现潜指纹的方法与制造工艺
- 基于快速识别核酸适体荧光探针INS2胰岛素试剂盒及其检测方法与制造工艺
- 一种用于检测沙门氏菌的增敏型核酸适配体试纸条及其制备方法
- 几种识别灭草松的核酸适配体序列及其衍生物的制作方法