一种邻苯二甲酸酯类增塑剂单链DNA核酸适配体及其筛选与表征方法及电化学传感器与流程
本发明涉及一种邻苯二甲酸酯类增塑剂单链DNA核酸适配体及其筛选与表征方法及应用其的电化学传感器,属于生物技术领域。
背景技术:
邻苯二甲酸酯类物质(Phthalate Esters或Phthalic Acid Esters,PAEs)是邻苯二甲酸形成的酯的统称,其化学结构是由一个平面芳烃和两个脂肪侧链组成。PAEs主要用于聚氯乙烯材料,使聚氯乙烯由硬塑胶变为有弹性的塑胶,起到增塑的作用。PAEs被广泛应用于玩具、食品包装材料、医用血袋和胶管、乙烯地板和壁纸、清洁剂、润滑油、个人护理用品(如指甲油、头发喷雾剂、香皂和洗发液)等数百种产品中。
PAEs是酯类化合物中较难降解的一类持久性有机污染物(persistent organic pollutants,POPs),也是公认的环境内分泌干扰物。PAEs是一类脂溶性物质,可通过呼吸、饮食和皮肤接触进入人体,对人体造成危害。研究表明PAEs在人体和动物体内发挥着类似雌性激素的作用,可干扰内分泌,使男子精液量和精子数量减少,精子运动能力低下,精子形态异常,严重的会导致睾丸癌,是造成男子生殖问题的“罪魁祸首”。它还会增加女性患乳腺癌的几率,还会 危害到她们未来生育的男婴的生殖系统。目前被认为是有害物质的PAEs为15种,其中邻苯二甲酸二(2-乙基己)酯(DEHP)、邻苯二甲酸二丁酯(DBP)、邻苯二甲酸二正辛酯(DNOP)、邻苯二甲酸丁苄酯(BBP)、邻苯二甲酸二异壬酯(DINP)、邻苯二甲酸二异癸酯(DIDP)6种已被欧盟列为总检出量必须低于1%的对人体和环境有害的物质。我国对生活饮用水、地表水和污水处理厂的污染物排放标准中都对多种PAEs有着明确限值。由于DBP潜在的内分泌干扰毒性最大,其限值均最低。比如我国生活饮用水卫生标准(GB5749-2006)对DBP的限值低达0.003mg/L(~1nM,3ppb)。现阶段国内外对增塑剂的检测还仅限于大型仪器,比如高效液相和质谱,不能实现现场高效和及时的监测。如何快速、准确、直接有效地检测食品和水体中的增塑剂,是环境和食品安全等相关科研工作者热切期待能够解决的技术难题。
核酸适配体是通过SELEX技术(Systematic Evolution of Ligands by Exponential Enrichment,即系统指数富集的适配体系统进化技术)获得的单链或双链的DNA或RNA(Nature,1990,346,818-822;Nature,1992,355,564-566)。核酸适配体能够特异性识别包括蛋白质、小分子、细胞和组织在内的多种多样的靶分子,其稳定性高,易于合成和修饰,成本低,在生物传感、成像和药物研发等领域都具有广泛的应用前景。目前,通过体外筛选技术获得的核酸适配体有很多,很多已经实现在线快速高灵敏检测,但是未见到特异性识别邻苯二甲酸酯类增塑剂核酸适配体的报道。
技术实现要素:
本发明的目的是提供一种邻苯二甲酸酯类增塑剂单链DNA核酸适配体及其筛选与表征方法及应用其的电化学传感器。本发明是利用SELEX技术筛选出能够与DBP等邻苯二甲酸酯类增塑剂特异性和高亲和力结合的单链DNA核酸适配体序列,并利用该核酸适配体构建能够对DBP等邻苯二甲酸酯类增塑剂进行高灵敏和高特异性检测的电化学传感器。
本发明提供的一种与邻苯二甲酸酯类增塑剂具有高特异性和高亲和力的单链DNA核酸适配体。该核酸适配体的单链DNA序列高度富集,来自同一富含C碱基家族:5'CTTTCTGTCCTTCCGTCACN1-4TCCCACGCATTCTCCACAT3'和/或者为其单碱基或双碱基的变异体。其中高通量测序中出现频率最高的两条核酸适配体分别为:DBP-1:5'CTTTCTGTCCTTCCGTCACATCCCACGCATTCTCCACAT3',和DBP-2:5'CTTTCTGTCCTTCCGTCACAGGTCCCACGCATTCTCCACAT3'。
本发明提供的一种邻苯二甲酸酯类增塑剂单链DNA核酸适配体的筛选与表征及应用其的电化学传感器的方法,包括如下步骤:步骤一:通过化学合成制备在其中一条线性脂肪侧链的末端具有氨基基团的邻苯二甲酸二丁酯(DBP)的衍生物(DBP-NH2);步骤二:通过氨基与琼脂糖微球上的环氧乙烷活化基团进行缩合反应将DBP-NH2共价连接到琼脂糖微球上;步骤三:进行基于固相分离的DNA核酸适配体的SELEX筛选;步骤四:筛选后对获得的富集文库进行高通量测序;步骤五:对高通量测序中出现频率最高的两条序列DBP-1和DBP-2进行亲和力和选择性的测试;步骤六:构建基于DBP-1的电化学传感器。
本发明还提供一种基于上述核酸适配体的电化学生物传感器,其 信号探针为DBP-1-10T-C-Fc或者DBP-1-C-Fc。
本发明通过化学合成制备了在其中一条线性脂肪侧链的末端具有氨基基团的邻苯二甲酸二丁酯(DBP)的衍生物(DBP-NH2)。然后通过氨基与琼脂糖微球上的环氧乙烷活化基团进行缩合反应将DBP-NH2共价连接到琼脂糖微球上。随后进行基于固相分离的核酸适配体筛选。4轮筛选后对获得的富集文库进行高通量测序,发现出现频率最高的前100条DNA序列均来自同一家族。利用实时定量PCR技术对出现频率最高的2条核酸适配体(DBP-1和DBP-2)对DBP-NH2的亲和力进行测试,分别为70±5nM和100±5nM。DBP-1和DBP-2对DBP、DEHP、BBP的亲和力比对DBP-NH2的亲和力高1.5-4.0倍。DBP-1和DBP-2均对DBP、DEHP、BBP具有很好的专一性,对葡萄糖、卡那霉素和乙醇等小分子和重金属离子(Hg2+,Pb2+,Ni2+,Cd2+)没有显著的亲合力。基于该核酸适配体构建了DBP电化学传感器。该传感器对DBP具有很好的选择性和灵敏度。检出限达到10pM,动力学区间10pM-1mM。由于邻苯二甲酸酯类增塑剂的结构相似性,可以预计本发明的核酸适配体对其它邻苯二甲酸酯类增塑剂也应该具有高的亲和力和选择性。
本发明具有如下特征和技术优势:
(1)本发明获得的单链DNA核酸适配体序列,与DBP、BBP和DEHP均具有很高的亲和力(解离常数Kd分别在nM范围),且具有很好的专一性。由于邻苯二甲酸酯类增塑剂的结构相似性,可以预计本发明的核酸适配体对其它邻苯二甲酸酯类增塑剂也应该具有高的亲和力和选择性。
(2)本发明中靶分子固相固定方式是首先将DBP的疏水侧链进行化学修饰获得DBP-NH2,然后通过氨基和环氧基团之间的缩合反应将DBP-NH2共价连接到环氧乙烷活化的琼脂糖微球上,使得邻苯二甲酸二酯基团暴露在微球的表面,这样就可以实现对邻苯二甲酸酯类增塑剂共同官能团的筛选,而不是仅筛选一种特定的邻苯二甲酸酯类增塑剂。
(3)(2)中所提及的靶分子固相固定方式还可以大幅减小界面的非特异性吸附和减少筛选轮数,本发明结合高通量测序技术,仅通过4轮筛选就获得了高度富集的核酸适配体。
(4)本发明的邻苯二甲酸酯类增塑剂的核酸适配体引物区序列没有参与与靶分子的结合,这样既可以省去工程化设计的复杂工作,又可以由于探针长度较短而大幅降低传感器的成本和简化传感器设计,非常便于该核酸适配体的应用。
(5)该核酸适配体序列可以与包括电化学传感器在内的各种各样的传感平台结合,实现对邻苯二甲酸酯类增塑剂的高灵敏和高特异性地检测;与基于大型仪器的检测技术相比,基于核酸适配体的传感器制备方法简单、操作更为便捷、成本低、适合现场检测。
本发明利用核酸适配体的体外筛选技术(SELEX:指数富集的配体系统进化技术技术),从化学合成的随机DNA文库中筛选获得与邻苯二甲酸酯类增塑剂具有高特异性和高亲和力的单链DNA核酸适配 体。为食品与环境中邻苯二甲酸酯类增塑剂的检测新方法的构建奠定基础。
本发明通过化学合成制备了在其中一条线性脂肪侧链的末端具有氨基基团的邻苯二甲酸二丁酯(DBP)的衍生物(DBP-NH2)。然后通过氨基与琼脂糖微球上的环氧乙烷活化基团进行缩合反应将DBP-NH2共价连接到琼脂糖微球上。随后进行基于固相分离的核酸适配体筛选。4轮筛选后对获得的富集文库进行高通量测序,发现出现频率最高的前100条DNA序列均来自同一家族。利用实时定量PCR技术对出现频率最高的2条核酸适配体,DBP-1和DBP-2,对DBP-NH2的亲和力进行测试,分别为70±5nM和100±5nM。DBP-1和DBP-2对DBP、DEHP、BBP的亲和力比对DBP-NH2的亲和力高1.4-4.0倍。DBP-1和DBP-2均具有很好的专一性,相对亲和力比葡萄糖、卡那霉素、氨苄西林和乙醇等代表性干扰物高240-1100倍。基于该核酸适配体构建了DBP电化学传感器。该传感器对DBP具有很好的选择性和灵敏度。检出限达到10pM,动力学区间10pM-1mM。由于邻苯二甲酸酯类增塑剂的结构相似性,可以预计本发明的核酸适配体对其它邻苯二甲酸酯类增塑剂也应该具有高的亲和力和选择性。本发明弥补了尚无邻苯二甲酸酯类化合物核酸适配体的空缺。做为一种具有高亲和力和特异性的生物识别,本发明的核酸适配体可以用于开发各种各样的检测技术和生物传感器。为食品或环境中的邻苯二甲酸酯类增塑剂的便捷检测有着重要应用价值。
附图说明
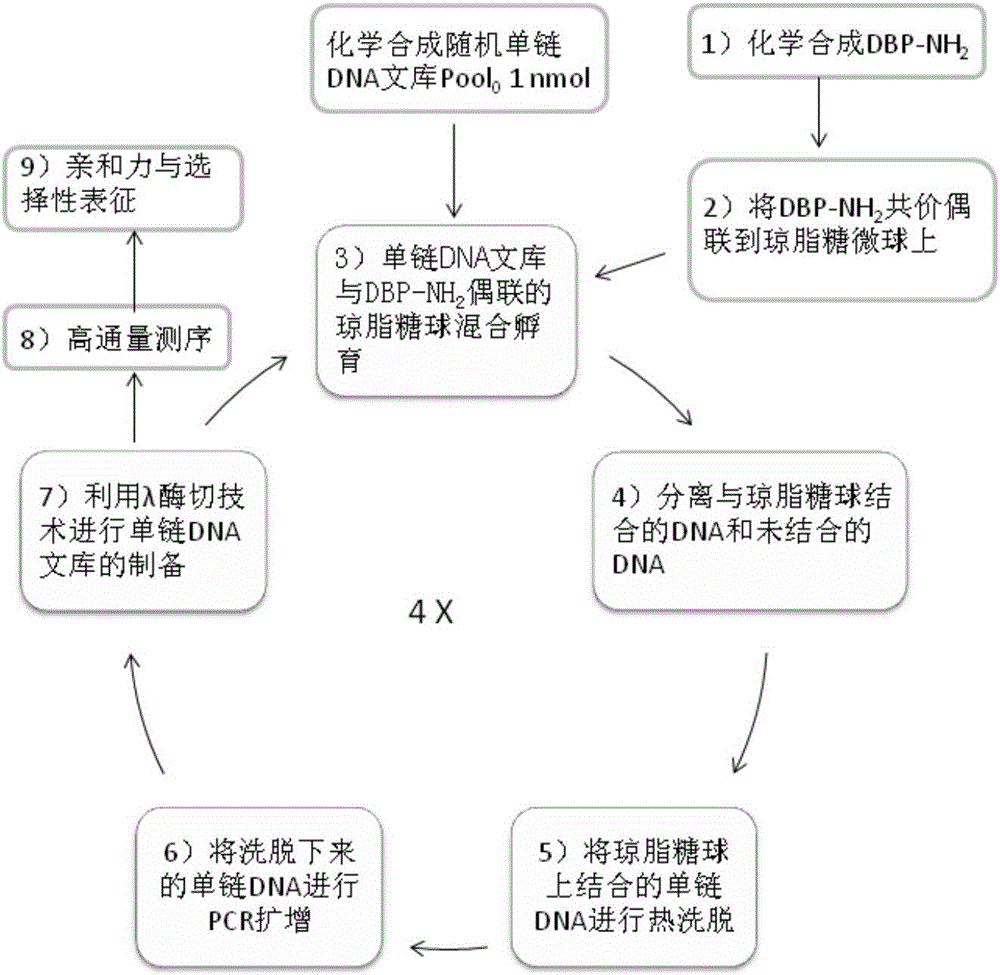
图1是本发明进行邻苯二甲酸酯类增塑剂单链DNA核酸适配体筛选的技术路线图。
图2是本发明中DBP-NH2的合成路线图。
图3是本发明中DBP-NH-Boc(化合物2)的一维核磁氢谱的表征数据。
图4是本发明中DBP-NH2(化合物3)的电喷雾质谱表征数据。
图5是本发明利用荧光倒置显微镜分别表征两条富集效率最高的核酸适配体(DBP-1和DBP-2)对DBP-NH2修饰琼脂糖微球的亲和力和选择性的荧光图片:(a)未修饰DBP-NH2的琼脂糖微球;(b)与DBP-1-FAM和DBP-2-FAM孵育后的未修饰DBP-NH2的琼脂糖微球;(c)与DBP-1-FAM和DBP-2-FAM孵育后的DBP-NH2修饰的琼脂糖微球。
图6是本发明利用实时定量PCR技术分别测定DBP-1(a)和DBP-2(b)对DBP-NH2的亲和力的数据图。
图7是本发明利用实时定量PCR技术对DBP-1(a)和DBP-2(b)对DBP-NH2、BBP、DBP、DEHP及对选择性测试溶液的相对亲和力测试数据,相对亲和力的数值为各测试样品竞争下来的DBP-1-RT-PCR或DBP-2-RT-PCR的数量除以选择性测试溶液存在时竞争下来的DBP-1-RT-PCR或DBP-2-RT-PCR的数量。
图8是本发明基于DBP-1构建的电化学传感器的原理图(a)、检测不同浓度的16种PAE混和标准品的方波伏安曲线(b、c)和对重金属离子(Hg2+,Pb2+,Ni2+)和抗生素(10μM卡那霉素和10μM磺胺地索辛混 合样品)的选择性测试(d)。其中(b)和(c)分别对应使用DBP-1-10T-C-Fc和DBP-1-C-Fc做为信号探针的传感器。
具体实施方式
表1:本发明中使用的核酸探针序列(表中下划线的序列为PCR中与引物结合的区域)
表2本发明中通过高通量测序获得的出现频率最高的前100条核酸序列(5'-3')
以高通量测序中序列出现频率从高到低排序。第一条序列的下划线部分是高度富集的保守序列。其它序列中的黑体加下划线的是与序列1相比的变异的部分。
实施例1:利用SELEX和高通量测序技术筛选邻苯二甲酸酯类增塑剂的单链DNA核酸适配体的技术路线
如图1所示,本发明的利用SELEX和高通量测序技术筛选邻苯二甲酸酯类增塑剂的单链DNA核酸适配体的技术路线包括以下步骤:(1)DBP-NH2的化学合成与表征;(2)DBP-NH2与环氧活化的琼脂糖微球(Epoxy-activated SepharoseTM6B)的偶联与表征;(3)将6×1014(1nmol)的商业合成的起始单链DNA文库(pool0,表1)与DBP-NH2偶联的琼脂糖微球混合孵育;(4)将结合了核酸适配体的琼脂糖微球与没有与琼脂糖微球结合的DNA序列进行分离和冲洗;(5)对冲洗后的琼脂糖微球上的核酸适配体进行热洗脱;(6)采用5端磷酸根修饰的反相引物(PO4-RP-SELEX,表1)和正向引物(FP-SELEX,表1),将洗脱下来的核酸适配体进行PCR扩增;(7)进行λ外切酶反应将磷酸根修饰的互补链降解,低成本制备单链DNA文库,该文库进入下一个筛选循环;(8)4轮SELEX后的文库(pool4)进行高通量测序;(9)对出现频率最高的两条核酸适配体DBP-1和DBP-2进行亲和力和选择性表征。
实施例2:DBP的氨基衍生物(DBP-NH2)的合成与表征
DBP-NH2的合成路线如图2所示。本实施例中所用的试剂均为分析纯,各步反应过程均用薄层色谱进行实时监测,产物通过硅胶柱进行分离纯化。具体的合成方法、条件和表征如下(1-3)所述:
(1)邻苯二甲酸单丁酯(化合物1)的制备
在含有邻苯二甲酸酸酐(8.5g,57mmol)和无水处理的四氢呋喃(7.5毫升)及洁净干燥的磁子的50毫升干燥的圆底烧瓶中加入正 丁醇(5毫升),在磁力搅拌下60℃加热回流9小时。有不溶的白色固体生成。放置室温后抽滤,用四氢呋喃洗瓶子后再次抽滤。旋蒸后得白色浆状物质。加入CH2Cl2后,有白色沉淀。抽滤旋蒸得到油状液体。加入100毫升去离子水,再用等体积的乙酸乙酯萃取3次,用饱和NaCl萃取有机相1次,最后用无水Na2SO4干燥有机相,放置过夜。过滤,旋干得10.986g,经硅胶柱分离纯化(二氯甲烷/甲醇(95:5)为流动相)。旋干后抽真空得2.1g邻苯二甲酸单丁酯(化合物1)。高效液相色谱(Agilent 1200)分离为单峰,产物纯净。
(2)DCC缩合产物(化合物2)的制备
本实验中邻苯二甲酸单丁酯(化合物1)和5-(N-叔丁氧基氨基)-1-戊醇按1:1.2投料。20mL无水四氢呋喃中加入邻苯二甲酸单丁酯(1.158g),磁力搅拌及冰水浴下,加入二环己基碳二亚胺(DCC,5.495g)。10分钟后加入4-二甲氨基吡啶(DMAP,0.217g),20分钟后加入5-(N-叔丁氧基氨基)-1-戊醇(1.723g,溶于5ml的无水四氢呋喃,逐滴加入)。在冰水浴搅拌1小时后,撤冰水浴室温反应24小时。将反应液进行抽滤,用无水的四氢呋喃洗涤烧瓶,抽滤,将滤液旋蒸。加入20毫升石油醚洗涤,抽滤。置于冰箱过夜抽滤,用石油醚洗涤烧瓶抽滤,旋蒸。接着过硅胶柱纯化产品(洗脱剂为石油醚:乙酸乙酯=4:1(v:v)),旋蒸。纯化后得到约0.5g DCC缩合产物(化合物2)。一维核磁氢谱表征(VNMRS-600兆赫,TMS为内标,CDCl 3为溶剂)证实得到预期的化合物2(图3)。
(3)烷基链末端氨基修饰的DBP衍生物(DBP-NH2)(化合物3) 的制备
将DCC缩合产物(化合物2)(0.5g),二氯甲烷(DCM,2毫升)和三氟乙酸(TFA,2毫升)加入三颈烧瓶中,在室温下磁力搅拌40分钟。然后将混合物过滤,旋转蒸发,得油状液体。油性液体用乙酸乙酯萃取三次,并用饱和NaHCO3洗涤一次,用无水硫酸钠干燥。最后,经过过滤,旋转蒸发,得到0.1g DBP-NH2。电喷雾质谱(Agilent LC/SMDTOF)显示分子离子峰为308.1856,与化合物3(C17H25O4N)的理论分子量吻合(图4),说明成功制备了化合物3。
实施例3:DBP-NH2在环氧活化的琼脂糖微球上的偶联
将0.1g环氧活化的琼脂糖微球加去离子水溶胀,并用20mL去离子水反复洗涤,获得350μL湿球。然后用0.2M Na2CO3(pH≈12)洗涤琼脂糖球。在500μL反应体系中加入46.7mg(0.15mmol)DBP-NH2,置于室温条件下振荡反应48小时。反应结束后用pH 4.5的醋酸钠缓冲溶液(0.1M醋酸钠,0.5M NaCl)和pH 12碳酸钠缓冲溶液(0.2M NaHCO3/Na2CO3,0.5M NaCl)反复交替洗涤琼脂糖微球三次,最后用水洗涤,并定容至500μL,4℃冰箱保存备用。元素分析(Elementar Vario MICROCUBE,德国)表明琼脂糖球的各组成元素C,H,N,S所占的比例分别为33.61%,9.26%,0.92%和1.09%。偶联DBP-NH2之后,各组成元素C,H,N,S所占的比例分别为50.21%,7.88%,2.3%和0.9%,其中偶联后C和N比例的大幅增加证实了DBP-NH2成功地偶联在环氧活化的琼脂糖微球上。
实施例4:SELEX筛选
本发明筛选所用的随机单链DNA文库(Pool0,表1)由生工生物工程(上海)股份有限公司合成,经聚丙烯酰胺凝胶电泳(PAGE)纯化。Pool0全长80个碱基,包括两端长度为20个碱基的固定序列和中间40个碱基长度的随机序列。固定序列是SELEX的PCR步骤中分别与上游引物(FP-SELEX,表1)和下游引物(PO4-RP-SELEX,表1)的结合区域。上游引物和下游引物均由宝生物工程(大连)有限公司(TaKaRa)合成。其中下游引物5’端进行磷酸化修饰。Pool0、FP-SELEX和PO4-RP-SELEX均用1×Tris-EDTA缓冲液(10mM Tris,1mM EDTA,pH 8.0)配制成100μM的储存液,于-80℃储存备用。
第一轮筛选:将1nmole的Pool0(100μM储存液,10μL)稀释在490μL的结合缓冲液BB中(20mM Tris,100mM氯化钠,2mM氯化镁,5mM氯化钾,1mM氯化钙,1%Tween20,0.03%triton X-100,2%DMSO,pH 7.9)。将上述溶液于95℃加热10分钟,冰水浴淬冷5分钟,放至室温。将实施例3中制备的连接了DBP-NH2的琼脂糖微球(100μL)用结合缓冲液BB洗涤三次。然后将在上述洗涤后的琼脂糖微球中加入上述热处理后的pool0溶液,室温旋转孵育1小时。用10K超滤管分离,将琼脂糖球用结合缓冲液BB洗涤三次后,加入100μL结合缓冲液BB,在90℃震荡加热十分钟后用超滤管分离,收集上清液。将洗脱液进行PCR扩增,反应的总体积为2mL。所获得的PCR产物用PAGE进行定性表征后用乙醇沉淀法纯化PCR产物。然后用Lamda核酸外切酶 消化法进行单链DNA的制备,再用乙醇沉淀法纯化获得富集的单链DNA文库Pool1。
第2-4轮SELEX:将第一轮SELEX获得的Pool复溶后定量,投入约300pmol进行下一轮的筛选,具体筛选过程与条件与第一轮筛选相同。最后获得富集的单链DNA文库Pool4。
实施例5:Pool4的高通量测序分析
将Pool4送至北京诺禾致源生物信息科技有限公司进行高通量测序。高通量测序结果(表2)显示出现频率最高的前100条单链DNA序列高度富集,来自同一家族(5'CTTTCTGTCCTTCCGTCACN1-4TCCCACGCATTCTCCACAT3'),而且富含C碱基。其中出现频率最高的前2条单链DNA序列分别为:
DBP-1:5'CTTTCTGTCCTTCCGTCACATCCCACGCATTCTCCACAT3'(39个碱基)
DBP-2:5'CTTTCTGTCCTTCCGTCACAGGTCCCACGCATTCTCCACAT3'(41个碱基)
这两个核酸适配体仅相差2个碱基(下划线标出)。
实施例6:利用荧光倒置显微镜测定DBP-1和DBP-2对DBP-NH2修饰琼脂糖微球的亲和力和选择性
将5’端荧光基团FAM修饰的DBP-1和DBP-2(1μM,DBP-1-FAM和DBP-2-FAM,表1,上海生工生物技术有限公司)分别与空白和10μL DBP-NH2修饰的琼脂糖微球在200μL结合缓冲液BB中孵育1小时,清洗后放于干净的载玻片上,利用荧光倒置显微镜观察并拍照。
如图5所示,琼脂糖微球本身荧光很弱(a);与DBP-1-FAM和DBP-2-FAM孵育后的空白琼脂糖微球的荧光也很弱(b);与DBP-1-FAM和DBP-2-FAM孵育后的DBP-NH2修饰的琼脂糖微球均显示强的荧光亮度(c)。实验结果说明DBP-1和DBP-2均对DBP-NH2修饰的琼脂糖微球有较强的亲和力,而且是选择性地与微球表面的DBP-NH2结合,不与琼脂糖微球基底结合。其中与DBP-1-FAM孵育后的DBP-NH2修饰的琼脂糖微球的荧光亮度率高于DBP-2-FAM孵育后的DBP-NH2修饰的琼脂糖微球,说明DBP-1对DBP-NH2的亲和力比DBP-2略高。该实验结果还表明,DBP-1和DBP-2无需Pool的引物区序列参与就能够对DBP-NH2具有很好的亲和力和选择性,这样既可以省去工程化设计的复杂工作,又可以由于探针长度较短而大幅降低传感器的成本和简化传感器设计,非常便于该核酸适配体的应用。
实施例7:实时定量PCR技术(RT-PCR)测定DBP-1和DBP-2对DBP-NH2的亲和力
(1)用于亲和力测试的核酸适配体探针的设计与合成
本实施例中利用RT-PCR技术定量与DMP-NH2修饰的磁珠结合的核酸适配体的数量。为此,分别在DBP-1和DBP-2的两端加上用于PCR扩增的引物区,得到两条序列DBP-1-RT-PCR和DBP-2-RT-PCR(表1,上海生工生物技术有限公司)。值得指出的是在该试验中所采用的引物 区序列与SELEX筛选过程中所使用的引物区不同,如果测试结果表明核酸适配体仍然具有亲和性,将充分证明DBP-1和DBP-2无需Pool的引物区序列参与就能够对DBP-NH2具有很好的亲和力和选择性。
(2)DBP-NH2修饰的磁珠的制备
吸取100μL DynabeadsTM M-270羧酸修饰的磁珠,与100μL 25mM的2-(N-吗啡啉)乙磺酸缓冲液(MES,pH 5.0)充分混合10分钟。将离心管放置于强力磁铁上4分钟进行磁性分离,除去上清液后用200μL MES溶液清洗两次。在上述MES溶液中分别新鲜制备50mg/mL的EDC溶液和50mg/mL的NHS溶液。依次加入100μL的上述EDC溶液和100μL的上述NHS溶液于洗过的磁珠中,充分混匀,室温下低速振摇30分钟。将离心管放置于强力磁铁上4分钟,移去上清液。用200μL MES溶液清洗2次。然后向活化后的磁珠中加入6μL 100mM的DBP-NH2,加入MES溶液,使溶液最终体积为300μL。充分混匀,在室温下孵育30分钟。在强力磁体上放置4分钟,移去上清液。用200μL结合缓冲溶液清洗4次。最后加入100μL 1XPBS(NaCl 137mM,KCl 2.7mM,Na2HPO410mM,KH2PO4 2mM,pH 7.4),放置于4℃备用。
(3)亲和力(解离常数Kd)的测定
在结合缓冲液BB中配置不同浓度的DBP-1-RT-PCR或DBP-2-RT-PCR(1pM、10pM、100pM、1nM、10nM、50nM、75nM、100nM、200nM、300nM)。上述核酸适配体溶液分别加入等量的步骤(2)所制备的DBP-NH2修饰的M-270磁珠(10μL),室温孵育30分钟。在强力磁体上放置4分钟后,移去上清液。用200μL结合缓冲 溶液清洗4次。加入100μL结合缓冲液BB,在90℃震荡加热十分钟后进行磁性分离,收集上清液。将上清液进行进行RT-PCR。根据标准曲线确定使用不同浓度的核酸适配体时,与磁珠结合的核酸适配体的量。绘制与磁珠结合的DBP-1-RT-PCR或DBP-2-RT-PCR的量与投入的DBP-1-RT-PCR或DBP-2-RT-PCR的浓度的关系曲线(图6)。按照核酸适配体与DBP-NH2为1:1的结合比例,利用非线性拟合计算出Kd值分别为:70±5nM(DBP-1-RT-PCR,图6a)和100±5nM(DBP-2-RT-PCR,图6b),误差来自三次重复性实验。而起始文库pool0对DBP-NH2修饰的磁珠没有亲和力。
实施例8:利用RT-PCR测试DBP-1和DBP-2对DBP-NH2、BBP、DBP、DEHP的相对亲和力测试以及对可能干扰物的选择性
由于环境中出现的增塑剂都是没有氨基修饰的,而且种类较多,必需测试所筛选出来的核酸适配体是否对这些增塑剂还具有很好的亲和力和选择性。为此我们进行了下面的竞争实验测定DBP-NH2、BBP、DBP、DEHP的相对亲和力测试以及对可能干扰物的选择性。
将相同体积相同浓度的DBP-1RT-PCR或DBP-2-RT-PCR(5μL,10μM)分别与等量(10μL)的DBP-NH2修饰的磁珠在500μL的结合缓冲溶液中孵育1个小时,然后用100μL结合缓冲溶液清洗3次。将清洗后的磁珠中分别与120μL浓度为10μM的DBP-NH2、DBP、DEHP、BBP或含有多种类型小分子的选择性测试溶液混合孵育1个小时。选择性测试溶液中含有葡萄糖、卡那霉素、氨苄西林、乙醇等代表性的干扰物, 浓度均为10μM。在强力磁体上放置4分钟后,移去上清液。对上清液中DBP-1-RT-PCR或DBP-2-RT-PCR的量进行RT-PCR,根据标准曲线确定上清液中DBP-1-RT-PCR或DBP-2-RT-PCR的量。
上述实验中DBP-1-RT-PCR或DBP-2-RT-PCR首先在DBP-NH2修饰的磁珠上结合,随后加入的DBP-NH2或DBP或DEHP或BBP或选择性测试溶液与DBP-NH2修饰的磁珠进行竞争,部分DBP-1-RT-PCR或DBP-2-RT-PCR与溶液中的DBP-NH2或DBP或DEHP或BBP或选择性测试溶液的成分结合,从而进入溶液。这样上清液中DBP-1-RT-PCR或DBP-2-RT-PCR的数量就反映了DBP-NH2或DBP或DEHP或BBP或选择性测试溶液的相对亲和力。
如图7所示,为表达简单直观,以选择性测试溶液竞争下来的DBP-1-RT-PCR或DBP-2-RT-PCR的相对数量为1,即相对亲和力的数值为各测试样品竞争下来的DBP-1-RT-PCR或DBP-2-RT-PCR的数量除以选择性测试溶液存在时竞争下来的DBP-1-RT-PCR或DBP-2-RT-PCR的数量。绘制DBP-1(a)和DBP-2(b)对DBP-NH2、BBP、DBP、DEHP的相对亲和力。DBP-1-RT-PCR或DBP-2-RT-PCR对DBP-NH2或DBP或DEHP或BBP的相对亲和力比对选择性测试溶液高约240~1100倍,说明本发明所筛选的核酸适配体具有很好的选择性。另外DBP-1-RT-PCR和DBP-2-RT-PCR对DBP、DEHP和BBP的相对亲和力均比对DBP-NH2的亲和力高约1.4~4.0倍。说明本发明所筛选的核酸适配体对增塑剂具有很好的亲和力,甚至比筛选时所使用的氨基修饰的DBP的亲和力还高。上述结果表明本发明所筛选的核酸适配体对常见增塑剂具有高亲和 力和特异性,这为基于核酸适配体的增塑剂检测新方法的构建奠定了分子识别的基础,对环境和食品中增塑剂的检测技术的发展具有重要意义。
实施例9:基于核酸适配体DBP-1的增塑剂电化学生物传感器的构建与增塑剂的检测
(1)圆盘金电极表面的清洁
用超纯水冲洗金圆盘电极(直径为2mm),依次用1μm、0.3μm、0.05μm的Al2O3抛光粉抛光电极表面(在抛光布上加少量超纯水和固体粉末打磨5-10分钟),每次打磨后用超纯水冲洗后,在超纯水中超声5分钟,再进行下一个打磨步骤。打磨光滑的电极通过三电极体系连接VMP3多通道电化学工作站在0.5M H2SO4中以-0.4~1.2V范围以100mV/s作循环伏安扫描36圈(以金电极为工作电极,以饱和硫酸亚汞电极为参比电极,铂电极为对电极),直到循环伏安图基本稳定。如观察不到明显的对应氧化还原峰,重新上述步骤打磨金电极。(2)基于信号探针链取代的增塑剂电化学传感器(SD-EAB)的构建
将100μL含有0.5μM HS-DBP-1(表1)和0.5μM 3'端修饰氧化还原基团二茂铁(Fc)的DBP-1-10T-C-Fc(表1)或者DBP-1-C-Fc(表1)的PBS/1M NaCl溶液(1×PB,1M NaCl,pH=7.4)在95℃水浴加热10min,缓冷至室温。然后加入1μL TCEP(10mM),室温放置1小时。将(1)中清洁后的圆盘金电极放入上述溶液,室温过夜组装。用PBS/1M NaCl溶液洗涤三次,将电极放入100μL 1mM [S(CH2)2(OCH2CH2)6OCH3]2(OEG6–OMe)的PBS/1M NaCl溶液,室温孵育1小时。用PBS/1M NaCl溶液洗涤三次,最后放置在结合缓冲溶液BB中平衡1小时,扫SWV获得稳定基线备用。
(3)PAE的检测和选择性测试
将不同浓度的16项PAE混合标准溶液(Chem Service,每种含10ppm)或者10μM的含有不同重金属离子(Hg2+,Pb2+,Ni2+,Cd2+)的结合缓冲溶液BB与电极孵育1小时后扫SWV。HS-DBP-1会特异性地与PAE结合,剔除互补的DBP-1-10T-C-Fc或者DBP-1-C-Fc,从而导致电流信号的降低(图8a)。这样就可以通过扫描方波伏安监测电流的变化,实现对DBP或者其它PAE的定量检测。
实验结果表明(图8),可利用筛选出的DBP-1通过工程化设计来构建电化学生物传感器检测,两种不同的信号探针设计:DBP-1-10T-C-Fc(图8b)或者DBP-1-C-Fc(图8c)均实现对PAE的高灵敏性检测,检出限低于160ppt,检测区间为160ppt~1.6ppm。另外10μM的Hg2+,Pb2+,Ni2+,以及10μM的卡那霉素和10μM的磺胺地索辛的混合物(Kana+Sulf)均显著小于1.6ppm(约合4μM)的16项PAE混合标准溶液的响应(图8d),说明该电化学传感器具有好的选择性。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种舌癌细胞的核酸适配体及试剂盒的制造方法与工艺
- 金黄色葡萄球菌肠毒素C2的核酸适配体C203及其筛选方法和应用与制造工艺
- 胰岛素核酸适体INS5及其制备方法与制造工艺
- 一种高亲和力兴奋剂核酸适体EPO4及其制备方法与制造工艺
- 一种邻苯二甲酸酯类增塑剂单链DNA核酸适配体及其筛选与表征方法及电化学传感器与制造工艺
- 基于高特异性核酸适体荧光探针INS1胰岛素试剂盒及其检测方法与制造工艺
- 运用核酸适配体与溶菌酶特异性识别并形成G四链体进行荧光显现潜指纹的方法与制造工艺
- 基于快速识别核酸适体荧光探针INS2胰岛素试剂盒及其检测方法与制造工艺
- 一种用于检测沙门氏菌的增敏型核酸适配体试纸条及其制备方法
- 一组特异性结合结核分枝杆菌的核酸适配体及其应用
- 一种舌癌细胞的核酸适配体及试剂盒的制造方法与工艺
- 金黄色葡萄球菌肠毒素C2的核酸适配体C203及其筛选方法和应用与制造工艺
- 胰岛素核酸适体INS5及其制备方法与制造工艺
- 一种高亲和力兴奋剂核酸适体EPO4及其制备方法与制造工艺
- 一种邻苯二甲酸酯类增塑剂单链DNA核酸适配体及其筛选与表征方法及电化学传感器与制造工艺
- 基于高特异性核酸适体荧光探针INS1胰岛素试剂盒及其检测方法与制造工艺
- 运用核酸适配体与溶菌酶特异性识别并形成G四链体进行荧光显现潜指纹的方法与制造工艺
- 基于快速识别核酸适体荧光探针INS2胰岛素试剂盒及其检测方法与制造工艺
- 一种用于检测沙门氏菌的增敏型核酸适配体试纸条及其制备方法
- 几种识别灭草松的核酸适配体序列及其衍生物的制作方法