一种基于液体活检的乳腺癌检测的试剂盒的制作方法
本发明涉及液体活检领域,具体地说是一种基于液体活检的乳腺癌检测的试剂盒。
背景技术:
乳腺癌是一种严重威胁女性健康的疾病,其发病率占所有肿瘤的23%,在女性中位居首位,致死率在所有癌症中也位居第二。据统计,在我国,每年平均每十万人口就有30~40名被诊断为乳腺癌患者,而且诊断为乳腺癌的平均年龄为45~55岁,比西方女性更加年轻。因而,对于乳腺癌的早期筛查以及疾病发展过程中的检测就显得尤为重要。
目前,针对乳腺癌的早期筛查,基于液体活检检测循环肿瘤细胞(CTC)的方法具有众多传统检测方法所没有的优势,包括无创、快捷、准确率高等优点。CTC是一种自发或因诊疗操作由实体瘤原发灶或转移灶释放进入外周血循环的肿瘤细胞。由于转移是癌症相关死亡的主要原因,而CTC被视为转移的种子,因此对CTC的检测在新的肿瘤生物标志物的发现、肿瘤预后判断及个体化治疗方面存在很大的应用潜力,是国内外肿瘤研究的热点之一。到目前为止,大多数乳腺癌CTC相关的研究主要集中于转移性乳腺癌(MBC)患者,而一些研究表明,在早期乳腺癌(EBC)患者中也同样存在CTC,其阳性率为9.4~48.6%。而血液中CTC的阳性率也与乳腺癌早期复发和低的生存期相关。其实,研究表明肿瘤在1mm时,血液中即可检出CTC,通过检测外周血循环中CTC的存在,可以在癌症的早期发现癌症。为此,有效的CTC捕获、富集分析方法对于基于CTC的早筛很重要。
虽然到目前为止,基于EpCAM的CTC捕获富集分析平台仍然被作为MBC中CTC检测的金标准,但是该方法是否适合用于EBC的检测仍存在争议,而且以EpCAM为生物标志物对于发生EMT的CTC的检测存在很高的假阴性,这一广谱的上皮生物标志物也不具有组织特异性,无法追溯CTC的具体组织来源,而这一点对于后续的肿瘤治疗具有重要意义。因此,发现并应用一些乳腺癌组织特异性的生物标志物进行CTC的检测分析显得尤为重要。
公告日为2014年1月15日,公告号为CN102313813B的中国专利中公开了一种通过免疫荧光染色对稀有细胞进行检测的方法,该方法对白细胞、稀有细胞和细胞核进行三色染色,再通过荧光检测。但是该方法仅能通过一种单抗来特异性识别该稀有细胞,容易造成漏检。同时,由于细胞的异质性,每个细胞表达的抗原量不一,导致有时荧光强度非常微弱,在荧光显微镜下难以分辨。
技术实现要素:
本发明的主要目的是针对现有技术存在的不足提供一种基于液体活检的乳腺癌检测的试剂盒,利用该试剂盒可以检测外周血中CTC的数量,对该CTC进行溯源分析、肿瘤分型及早期筛查,同时荧光显示细胞膜边界清晰、检测结果灵敏度高。
本发明是通过如下技术方案实现的:
一种基于液体活检的乳腺癌检测的试剂盒,所述试剂盒包括:用于增强染色效果的染色增强液和带荧光染色标记的特异性抗体;
其中所述特异性抗体包括:ERα抗体、VIM抗体、CD45抗体和HER2抗体;
所述染色增强液包括浓度为0.001~1mg/mL的表面活性剂。
所述染色增强液的溶剂为生物缓冲液。
优选的,所述表面活性剂可以为Triton X-100、二甲基亚砜、NP-40、十二烷基硫酸钠(SDS)中的任一种。更优选的,所述表面活性剂为Triton X-100或SDS。最优选的,所述染色增强液包括浓度为0.01~1mg/mL的SDS,染色增强液的溶剂为常用的生物缓冲液,如PBS缓冲液等。
优选的,所述试剂盒中还包括淋巴细胞分离液和用于去除白细胞的免疫磁珠。淋巴细胞分离液和免疫磁珠能够用于去除红细胞和白细胞的干扰,便于更好的富集CTC。
更优选的,所述用于去除白细胞的免疫磁珠为表面偶联有抗体CD45、CD14和CD15的免疫磁珠中的一种或多种,最优选包括全部的上述免疫磁珠。
优选的,所述特异性抗体ERα抗体、VIM抗体和HER2抗体带有至少两种不同发射波长的荧光染色标记,并且CD45抗体带有的荧光染色标记与上述所有荧光染色标记均不相同。根据本领域技术人员公知的,为了区分不同的特异性抗体,本发明应当采用不同的荧光染色标记。但是由于荧光显微镜通道的数量限制,通常使ERα抗体、VIM抗体和HER2抗体中的其中两种抗体带有同一种荧光染色标记。本发明优选为ERα抗体和HER2抗体带有同一种荧光染色标记。荧光染色标记染料可以采用本领域任何常用的荧光染料,只要通过调节激发光波长可区分即可。由于荧光染色标记的发射波长各自不同,因此通过荧光显微镜在不同的滤光片下可以完全区分开。其中,本发明优选采用的荧光染色标记为Alexa Fluor系列分子、花青染料。更优选为Alexa594、CY5和Alexa488,其中Alexa594发射波长为618nm,CY5发射波长为670nm,Alexa488发射波长为519nm。带荧光染色标记的CD45抗体优选为CD45-Alexa594(红色)、带荧光染色标记的ERα抗体为ERα-Alexa488(绿色)、带荧光染色标记的HER2抗体为HER2-Alexa488(绿色)、带荧光染色标记的VIM抗体为VIM-CY5(肉眼不可见,显微镜扫描赋以紫色)。
优选的,所述用于荧光原位杂交的荧光探针可以为用于染色体荧光原位杂交的探针,如CEP8荧光探针。
优选的,所述染色增强液中还包括占染色增强液质量百分含量0.1~3%的聚乙二醇。聚乙二醇与表面活性剂配合可以进一步加强染色液的染色效果。
作为本领域技术人员公知的,将带荧光染色标记的特异性抗体与细胞进行孵育从而进行荧光染色的过程可以为液体染色或固体染色。如果进行液体染色则先将需要进行细胞染色的细胞重悬成细胞悬液,然后依次进行染色预处理、细胞染色,再将细胞转移到载玻片上进行细胞固定、载玻片封片。而如果在载玻片上进行固体染色,则先将细胞在载玻片上进行细胞固定,然后依次进行染色预处理、细胞染色后,再对载玻片封片。
上述细胞固定是通过细胞固定液进行的,所述细胞固定液可以为本领域常用的细胞固定液,例如多聚甲醛、戊二醛、福尔马林、乙醇、丙酮中的一种或几种的组合。
利用上述基于液体活检的乳腺癌检测的试剂盒进行CTC检测的方法包括以下步骤:
富集外周血中的目标细胞;
利用染色增强液对目标细胞进行增强染色预处理;
利用带荧光染色标记的特异性抗体对目标细胞进行荧光染色;
目标细胞固定;
用荧光探针进行荧光原位杂交;
DAPI封片及镜检。
经过增强染色预处理之后的目标细胞,特异性抗体与目标细胞的结合更好,荧光染色更明显,细胞膜边界清晰。
作为本领域技术人员公知的,当肿瘤细胞特异性抗原存在于细胞内时,应当对细胞膜表面染色并固定目标细胞后,再将细胞膜破膜并利用带荧光染色标记的特异性抗体对目标细胞进行细胞内荧光染色。
优选的,所述富集外周血中的目标细胞包括以下步骤:
(1)将外周血离心分离血浆和血细胞,并去除血浆;
(2)向步骤(1)中加入细胞缓冲液和淋巴细胞分离液离心分层,去除红细胞层;
(3)向步骤(2)中加入用于去除白细胞的免疫磁珠并孵育得到悬浊液;
(4)将步骤(3)中的悬浊液磁分离去除白细胞以及剩余的红细胞,再洗涤后得到富集后的目标细胞。
所述的淋巴细胞分离液可以为本领域常用的淋巴细胞分离液,用于根据密度分离红细胞即可,本发明优选的采用Ficoll分离液。
本发明对目标细胞的富集包括两次去除红细胞,可以对红细胞去除更加干净,而且通过免疫磁珠,可以一次性去除白细胞和剩余红细胞,富集效率更高。经过上述富集处理后能够排除其他细胞对于荧光染色的干扰,有利于通过荧光显微镜进行更好的观察。
优选的,所述利用染色增强液对目标细胞进行增强染色预处理的处理时间为5~20分钟。染色增强液加入后表面活性剂的终浓度为0.2μg/mL~1mg/mL。其中,染色增强液优选的加入量为1~20μL。当染色增强液的加入量越多时,加强荧光的强度越高,但是可能会对细胞膜造成损伤,加入量过少时加强效果又不是太明显。
优选的,所述利用带荧光染色标记的特异性抗体对目标细胞进行荧光染色时,先将带荧光染色标记的特异性抗体按照1:(100~200)的体积比用缓冲液稀释,再将稀释后的特异性抗体与目标细胞混合孵育。
优选的,所述带荧光染色标记的特异性抗体加入后特异性抗体的终浓度为2~10μg/mL。其中,带荧光染色标记的特异性抗体按照1:200的体积比用缓冲液稀释。加入的特异性抗体浓度越高,越容易造成非特异性染色,影响结果的准确性。
上述缓冲液可以为一般的生物细胞缓冲液,例如PBS缓冲液。更优选的,PBS缓冲液为0.01M的磷酸盐缓冲液,其中Na2HPO4、NaCl、KH2PO4和KCl的浓度分别为8mM、136mM、2mM和2.6mM,pH值为7.2-7.4。
发明原理
在原发性乳腺癌中,大约75~80%表现为雌激素受体α阳性(ERα+),ERα的状态对于乳腺癌的分级和指导用药都具有重要作用。ERα的状态决定了乳腺癌患者是否适合激素治疗,而这种治疗方法目前仍然是ERα+乳腺癌患者主要的辅助治疗方法。所以基于ERα的CTC检测不仅具有组织特异性定位的能力,而且其表达状态对于乳腺癌的治疗也具有一定的指导意义。此外,人表皮生长因子受体2(HER2)也是一种重要的乳腺癌预测标志物,在原发性乳腺癌中大约有10~30%表现为HER2+,并且与差的预后和较高的浸润性相关。此外,约11%乳腺癌表现为ERα-/HER2+,这样联合ERα+和HER2+的检测灵敏度可以达到约80%,而且部分HER2-的原发性乳腺癌患者,其在发展的过程中也可能会产生HER2+的CTC。
除上述ERα+或HER2+的乳腺癌外,基底型乳腺癌往往表现为三阴性(TNBC)(ERα-/PR-/HER2-),此类乳腺癌CTC则无法用上述标志物检测。虽然TNBC仅占乳腺癌的15%左右,但因其具有较高的转移能力和较差的预后,所以不容忽视。对此,波形蛋白(VIM)广泛表达于不依赖于激素的乳腺癌组织中,很早就被用于检测激素受体阴性的基底型乳腺癌,其在该类乳腺癌中的检测灵敏度可达到约94%,所以可以作为一个很好的TNBC乳腺癌CTC的生物标志物。
8号染色体异常存在于多种实体瘤中,包括前列腺癌、卵巢癌、肾癌、乳腺癌、结直肠癌等,利用荧光原位杂交(FISH)的方法检测细胞或组织内8号染色体异常的情况已被广泛的用于临床诊断中,本发明在基于肿瘤标志物活检的同时,辅以8号染色体着丝粒区域(CEP8)的FISH检测验证,在双瘤标检测增加肿瘤检测灵敏度的同时进一步通过CEP8的检测保证检测的特异性。其中,CEP8探针为标记有SpectrumOrange的荧光探针,用于挑选全部细胞中8号染色体数目异常的细胞为目标细胞。通过荧光显微镜观察,调节激发光波长为559nm时SpectrumOrange发射光为588nm橙光,可与上述肿瘤标志物和白细胞标志物荧光进行同时检测,通过特异性橙光探针点数目的检测确定目标细胞8号染色体的数目。本发明在基于肿瘤标志物活检的同时,可以选择的辅以CEP8的FISH检测验证,在三瘤标检测增加CTC检测灵敏度的同时进一步通过CEP8的检测保证检测的特异性。
据此,联合ERα、HER2和VIM三个生物标志物检测乳腺癌CTC具有很高的灵敏度,此外还可以据此对乳腺癌CTC分型:ERα+为管腔型乳腺癌(Luminal);HER2+/ERα-为HER2阳性乳腺癌(HER2+);ERα-/HER2-/VIM+为基底型乳腺癌(Basal)。检测出的CTC可根据ERα和HER2的表达与否判定是否来源于乳腺,并且联合VIM的表达可以对乳腺癌进行分型,溯源的同时实现对乳腺癌的早期筛查。
本发明采用带Alexa594荧光染色标记的CD45抗体对白细胞表面特异性染色,用带Alexa488荧光染色标记的ERα抗体和HER2抗体,以及带CY5荧光染色标记的VIM抗体对捕获的循环肿瘤细胞进行特异性染色。通过荧光显微镜观察,调节激发波长为591nm时Alexa594发射光为618nm偏橙色红光;激发波长为650nm时CY5发射光为670nm远红光(肉眼不可见,显微镜扫描赋以紫色);激发波长为499nm时Alexa488发射光为519nm绿光。所以通过调节不同的激发波长以及曝光时间,可以观察到不同细胞上标记的不同荧光,进而可对目标细胞进行区分:CD45+为白细胞;HER2+或ERα+为肿瘤CTC细胞,其中HER2+/ERα+可确定其来源于乳腺癌的患者,而且根据不同特异性抗原的表达还可以对CTC进行进一步的分型:ERα+或HER2+为管腔型乳腺癌(Luminal)或HER2阳性乳腺癌(HER2+);而ERα-/HER2-/VIM+为基底型乳腺癌(Basal)。
选择多种带荧光染色标记的抗体有利于确认目标细胞的具体类型,然而当抗体种类多于一种时,目标细胞与抗体的结合就容易被干扰,导致荧光染色不佳,影响荧光显微镜观察。而本发明的染色增强液通过暴露细胞表面的膜蛋白抗原决定簇,使带荧光染色标记的抗体更容易结合在细胞表面的靶蛋白上,从而增强标记细胞膜的荧光强度,并且使细胞膜边界清晰。
本发明的基于液体活检的乳腺癌检测的试剂盒,可以有效的富集目标细胞,并且确认富集的目标细胞是否来源于乳腺癌的早期患者,以及进行肿瘤分型。同时,本发明通过三瘤标检测增加肿瘤检测灵敏度并且进一步通过CEP8的检测保证检测的准确性。此外本发明通过染色增强液加强染色效果,使多种带荧光染色标记的抗体都可以与目标细胞靶蛋白结合,对目标细胞染色,染色效果更好,荧光更强,而且边界清晰。这样可以同时增强血源性细胞表面特异性荧光染色和肿瘤细胞特异性标志物的荧光染色效果,使得CTC与血源性细胞更易于区分,降低检测的假阳性,提高检测的特异性。并且,本发明方法简单,成本低,具有很强的实用性。
附图说明
图1为MCF7人乳腺癌细胞系的荧光染色检测Merge图;
图2为SK-BR-3人乳腺癌细胞系的荧光染色检测Merge图;
图3为MDA-MB-231人乳腺癌细胞系的荧光染色检测Merge图;
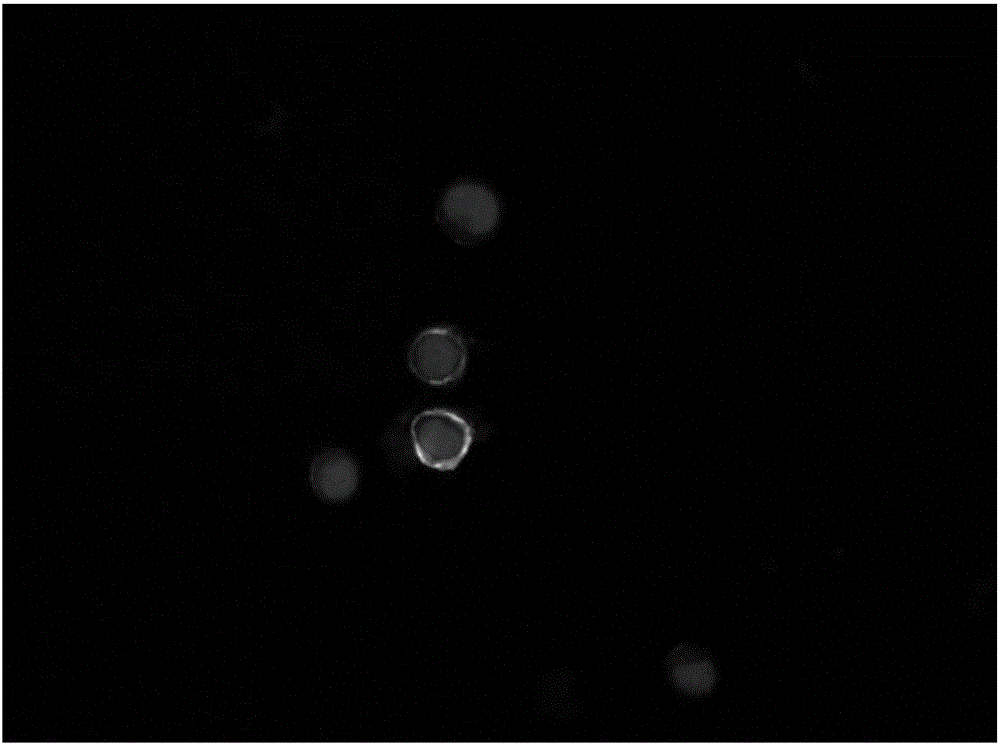
图4为肿瘤细胞捕获后的荧光染色检测Merge图。
具体实施方式
以下通过具体实施例来进一步说明本发明:下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
淋巴细胞分离液来自GE healthcare公司的Ficoll-Paque PLUS。
CD45免疫磁珠来自Thermo Fisher Scientific的CD45。
Alexa 594、Alexa 488和CY5荧光染料来自Thermo Fisher Scientific。
CEP8探针来自雅培公司的CEP 8SpectrumOrange DNA Probe Kit。
实施例1富集外周血中的目标细胞
(1)将外周血离心以去除血浆蛋白:将8.5mL外周血在水平离心机中800g,常温离心7min,弃去上清。
(2)向步骤(1)的血浆中加入5~6mL的PBS缓冲液和3mL的淋巴细胞分离液,在离心机中450g,常温离心7min。离心后分为三层,红色的底层为红细胞层,略带白色的中间层主要为白细胞和CTC等,黄色的上层为血浆,吸取红细胞层以上的全部液体,去除底部的红细胞层。
(3)向步骤(2)中逐滴加入200mL表面偶联有CD45抗体的免疫磁珠,在水平摇床上孵育得到悬浊液,水平摇床转速设置在120-150rpm,倾斜20-30°,常温,水平摇动20min。
(4)将步骤(3)中的悬浊液用大磁力架吸附2min。小心的吸取未附着在管壁上的液体,去除白细胞以及剩余的红细胞,用PBS缓冲液洗涤并重悬后得到富集后的目标细胞。
实施例2对富集后的目标细胞进行荧光染色
(1)增强染色预处理:向约50μL的富集后的目标细胞中加入2μL染色增强液,常温静置10min。所述染色增强液为SDS或Triton X-100的PBS缓冲液溶液,SDS浓度为0.1mg/mL。
(2)细胞表面染色:将CD45-Alexa 5941μL用199μL的PBS缓冲液稀释后,加入到步骤(1)预处理完成后的细胞悬液中,再避光孵育20min。孵育后加PBS缓冲液清洗细胞液体,950g离心4min,去上清至100μL。
(3)细胞固定:将步骤(2)中的细胞转移涂抹到载玻片上,然后加入固定液多聚甲醛,固定10min,PBS洗涤玻片2次,每次5min。
(4)细胞破膜:细胞固定后在载玻片上细胞区域滴加细胞破膜液200μL,孵育10min后加PBS缓冲液清洗玻片2次,每次5min。所述细胞破膜液为Triton X-100的PBS缓冲液溶液,Triton X-100浓度为0.5%。
(5)细胞胞内标志物染色:将ERα-Alexa488、Her2-Alexa 488和VIM-CY5各1μL用198μL的PBS缓冲液稀释后,加入到上述玻片上细胞区域,再避光孵育20min,然后加PBS缓冲液清洗玻片2次,每次5min。
(6)荧光原位杂交:向载玻片上滴加10μL的CEP8荧光探针,盖上盖玻片,四周加封片胶封片。在76℃下预杂交10min,然后在37℃下杂交4h。
(7)DAPI封片及镜检:撕去封片胶,用PBS缓冲液清洗2次(5min/次),并脱去盖玻片,在自然干燥后加入10μL封片剂封片并盖上盖玻片(其中封片剂的含量为DAPI:甘油=1:9),最后用Nikon DS-U3荧光显微镜观察,镜检条件为:激发光波长为591nm时Alexa594发射光为618nm红光,曝光时间100ms;激发光波长为650nm时CY5发射光为670nm远红光(肉眼不可见,显微镜扫描赋以紫色),曝光时间100ms;激发光波长为499nm时Alexa488发射光为519nm绿光,曝光时间100ms;激发光波长为345nm时DAPI发射光为455nm蓝光,曝光时间10~20ms;激发光波长为559nm时SpectrumOrange发射光为588nm橙光,曝光时间100ms,结果显示,正常人外周血分离的白细胞绝大多数呈现CD45阳性染色,瘤标阴性染色,FISH结果为CEP8二倍体,没有瘤标阳性或CEP8数目异常的细胞。
实施例3细胞系的荧光染色检测
将MCF7(ERα+/HER2-)或SKBr3(ERα-/HER2+)或MDA-MB-231(ERα-/HER2-/VIM+)细胞系(来源中国科学院细胞库购买),酶解消化后取105个细胞,大约50μL,按照实施例2的步骤进行细胞荧光染色和荧光显微镜镜检。镜检条件为:激发光波长为591nm时Alexa594发射光为618nm红光,曝光时间100ms;激发光波长为650nm时CY5发射光为670nm远红光(肉眼不可见,显微镜扫描赋以紫色),曝光时间100ms;激发光波长为499nm时Alexa488发射光为519nm绿光,曝光时间100ms;激发光波长为345nm时DAPI发射光为455nm蓝光,曝光时间10~20ms,结果如图1-3所示。
从图1-3可以看出,各细胞系的细胞在358nm激发光下均显示蓝光的细胞核,说明存在细胞;在591nm激发光下不显示红色,说明CD45呈阴性,不存在白细胞。
在499nm激发光下,MCF7细胞和SKBr3细胞显示绿色,说明ERα或HER2呈阳性;MDA-MB-231细胞不显示绿色,说明ERα和HER2呈阴性。
在650nm激发光下,MDA-MB-231细胞显示紫色,说明VIM呈阳性,MCF7细胞和SKBr3细胞不显示紫色,说明VIM呈阴性。
实施例4肿瘤细胞捕获效率检测
采集健康志愿者8.5ml血样,取MCF7、SK-BR-3和MDA-MB-231人乳腺癌细胞系分别为31、26和26个加入血样。然后按照实施例1的步骤进行肿瘤细胞富集,再按照实施例2的步骤进行肿瘤细胞的荧光染色和荧光显微镜镜检。镜检条件为:激发光波长为591nm时Alexa594发射光为618nm红光,曝光时间100ms;激发光波长为650nm时CY5发射光为670nm远红光(肉眼不可见,显微镜扫描赋以紫色),曝光时间100ms;激发光波长为499nm时Alexa488发射光为519nm绿光,曝光时间100ms;激发光波长为345nm时DAPI发射光为455nm蓝光,曝光时间10~20ms;激发光波长为559nm时SpectrumOrange发射光为588nm橙光,曝光时间100ms,结果如图4所示。
结果表明,肿瘤细胞(ERα+或Her2+或VIM+)捕获数目69个,捕获率83.13%。ERα或Her2阳性(ERα+或Her2+)细胞数目49个,阳性率59.04%;VIM阳性(VIM+)细胞数目20个,阳性率24.1%;瘤标均为阳性(ERα+或Her2+/VIM+)肿瘤细胞数目0个,阳性率0%;CEP8非二倍体(CEP8≠2)肿瘤细胞数目37个,非二倍体率44.58%。
从上述结果可以看出,利用本发明的试剂盒进行基于液体活检的CTC检测相对于现有的单瘤标检测而言,捕获血液中的肿瘤细胞灵敏度更高。同时根据检测的不同结果,可以进行乳腺癌的分型。并且根据CEP8的检测,可以增加检测的特异性,满足不同的检测目的。
以上所述的实施例只是本发明的一种较佳的方案,并非对本发明作任何形式上的限制,对于本技术领域的普通技术人员来说,在不脱离本发明实施例原理以及权利要求的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本发明实施例的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!