3R-吲哚甲基-6R-酰胺侧链氨基酸修饰的哌嗪-2,5-二酮,其合成,活性和应用的制作方法
本发明涉及(3r,6r)-3-(aa-氨基正己酰基氨基正丁基)-6-(吲哚-3-甲基)-哌嗪-2,5-二酮。涉及它们的制备方法、涉及它们的抗肿瘤活性,涉及它们的抗肿瘤转移活性,以及涉及它们的抗炎活性活性,因而本发明涉及它们在制备抗肿瘤药物,抗肿瘤转移药物和抗炎药物中的应用。本发明属于生物医药领域。
背景技术
肿瘤严重威胁人类的健康。除了自身对肿瘤患者的预后恶劣之外,肿瘤并发的转移进一步恶化患者的预后。例如,超过90%以上肿瘤患者都是死于转移。由于现有抗肿瘤药物没有抗肿瘤转移作用,所以肿瘤化疗的临床疗效不理想。发明抗肿瘤转移的药物是临床的迫切需求。此前,发明人曾公开s,s-,r,r-,r,s-和s,r-四种构型的的二酮哌嗪在0.5μm浓度可抑制hcclm3(高转移人肝癌细胞)迁移和侵袭。后来发明人又公开r,r-构型的二酮哌嗪在5μmol/kg剂量下可抑制c57bl/6小鼠的肿瘤向肺转移。可是最低有效剂量为5μmol/kg。为了降低最低有效剂量,发明人对r,r-构型的二酮哌嗪的丁氨基展开了各种修饰。经过3年探索,发现用l-gln和l-asn酰化的氨基己酸酰化r,r-构型的二酮哌嗪的丁氨基不仅可使抗肿瘤转移的最低有效剂量降至0.5μmol/kg,而且可使抗肿瘤和抗炎的最低有效剂量都降至0.5μmol/kg。因为药物的毒副作用都可以随剂量降低而消失,所以有效剂量降低10倍表明了这种结构修饰有突出的技术效果。根据这些发现,发明人提出了本发明。
技术实现要素:
本发明的第一个内容是提供下式的(3r,6r)-3-(aa-氨基正己酰基氨基正丁基)-6-(吲哚-3-甲基)-哌嗪-2,5-二酮(aa为l-gln残基和l-asn残基)。
本发明的第二个内容是提供(3r,6r)-3-(aa-氨基正己酰基氨基正丁基)-6-(吲哚-3-甲基)-哌嗪-2,5-二酮(aa为l-gln残基和l-asn残基)的合成方法,该方法包括:
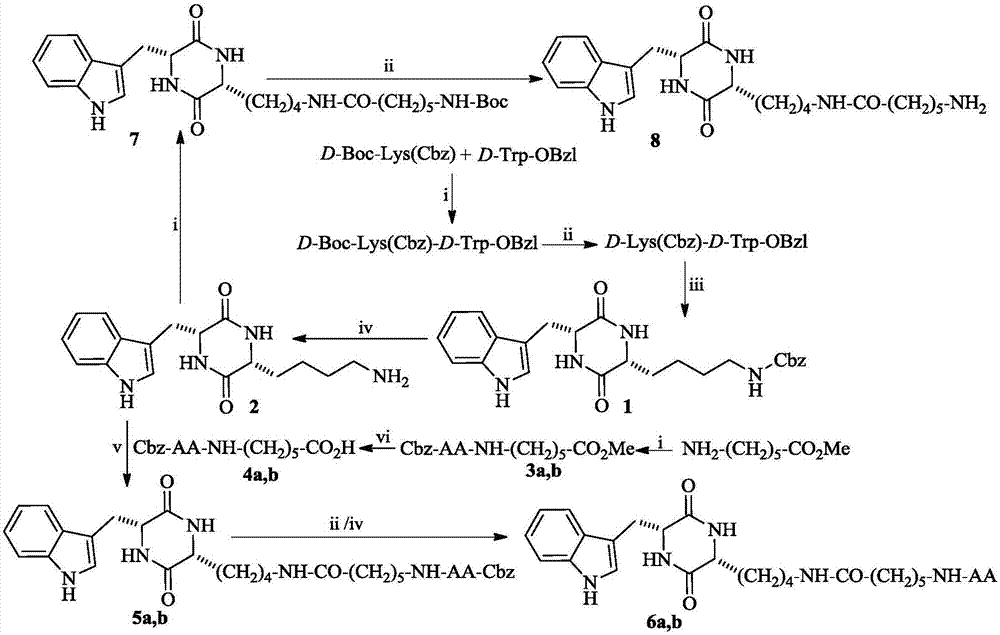
(1)d-boc-lys(cbz)与d-trp-obzl缩合得boc-lys(cbz)-trp-obzl;
(2)boc-lys(cbz)-trp-obzl在氯化氢的乙酸乙酯溶液中脱boc得lys(cbz)-trp-obzl;
(3)lys(cbz)-trp-obzl含5%碳酸氢钠水溶液的乙酸乙酯中环合生成(3r,6r)-3-(苄氧羰基氨基正丁基)-6-(吲哚-3-甲基)-哌嗪-2,5-二酮(1);
(4)化合物1氢解脱苄氧羰基得到(3r,6r)-3-(氨基正丁基基)-6-(吲哚-3-甲基)-哌嗪-2,5-二酮(2);
(5)氨基正己酸甲酯与cbz-aa(aa为gln残基和asn残基)缩合得cbz-aa-氨基正己酸甲酯(3a,b);
(6)化合物3a,b皂化脱除甲酯得到cbz-aa-氨基正己酸(4a,b);
(7)化合物2与化合物4a,b缩合得(3r,6r)-3-(cbz-aa-氨基正己酰基氨基正丁基)-6-(吲哚-3-甲基)-哌嗪-2,5-二酮(5a,b);
(8)化合物5a,b在二甲基甲酰胺中氢解脱cbz保护得到(3r,6r)-3-(aa-氨基正己酰基氨基正丁基)-6-(吲哚-3-甲基)-哌嗪-2,5-二酮(6a,b)。
本发明的第三个内容是评价(3r,6r)-3-(aa-氨基正己酰基氨基正丁基)-6-(吲哚-3-甲基)-哌嗪-2,5-二酮(aa为l-gln残基和l-asn残基)抑制c57bl/6小鼠抗肺癌转移活性。
本发明的第四个内容是评价(3r,6r)-3-(aa-氨基正己酰基氨基正丁基)-6-(吲哚-3-甲基)-哌嗪-2,5-二酮(aa为l-gln残基和l-asn残基)对icr小鼠炎症的抑制作用。
本发明的第五个内容是评价(3r,6r)-3-(aa-氨基正己酰基氨基正丁基)-6-(吲哚-3-甲基)-哌嗪-2,5-二酮(aa为l-gln残基和l-asn残基)对s180小鼠肿瘤生长的抑制应用。
附图说明
图1(3r,6r)-3-(aa-氨基正己酰基氨基正丁基)-6-(吲哚-3-甲基)-哌嗪-2,5-二酮(6a,b)的合成路线.3a-6a中aa为l-gln残基;3b-6b中aa为l-asn残基;i)二环己基碳二亚胺(dcc),1-羟基苯并三唑(hobt),n-甲基吗啉(nmm),四氢呋喃(thf);ii)氯化氢的乙酸乙酯溶液;iii)乙酸乙酯,5%碳酸氢钠;iv)二甲基甲酰胺(dmf),pd/c,h2;v)二环己基碳二亚胺(dcc),1-羟基苯并三唑(hobt),n-甲基吗啉(nmm),n,n-二甲基甲酰胺(dmf);vi)甲醇,naoh(2m)。
具体实施方式
为了进一步阐述本发明,下面给出一系列实施例。这些实施例完全是例证性的,它们仅用来对本发明进行具体描述,不应当理解为对本发明的限制。
实施例1制备boc-lys(cbz)-trp-obzl
将7.7g(20mmol)boc-lys(cbz)混悬于100ml无水四氢呋喃(thf)中,在冰浴下依次往悬浮液中加2.7g(20mmol)1-羟基苯并三氮唑(hobt)及5.0g(25mmol)二环己基碳二亚胺(dcc),然后搅拌30min。之后,加8.0g(25mmol)trp-obzl。反应化合物逐滴加入n-甲基吗啉(nmm)调节ph至9。反应混合物先在冰浴下搅拌1h,再室温搅拌12h。反应化合物过滤,滤液减压浓缩,残留物用150ml乙酸乙酯溶液溶解。得到的乙酸乙酯溶液依次用5%khso4水溶液洗3次,饱和nacl水溶液洗3次。乙酸乙酯层用无水na2so4干燥12h,过滤,滤液减压浓缩至干。得到的黄色糖浆物经硅胶柱层析纯化(ch2cl2/ch3oh,100:1)得到12.0g(88%)标题化合物,为无色固体。esi-ms(m/e):657[m+h]+。
实施例2制备lys(cbz)-trp-obzl
在冰浴与搅拌下3.8g(5mmol)boc-lys(cbz)-trp-obzl与52ml氯化氢的乙酸乙酯溶液(4m)缓慢混合。得到的溶液在冰浴中搅拌5h。之后,反应混合物减压浓缩。残留物用50ml无水乙酸乙酯溶解,得到的溶液减压浓缩。该操作重复三次。残留物用无水乙醚充分洗,得到3.41g(93%)标题化合物,为黄色粉末。esi-ms(m/e):557[m+h]+。
实施例3制备(3r,6r)-3-(苄氧羰基氨基正丁基)-6-(吲哚-3-甲基)-哌嗪-2,5-二酮(1)
将3.45g(6.2mmol)lys(cbz)-trp-obzl用150ml乙酸乙酯溶解。得到的溶液用浓度为5%的碳酸氢钠水溶液洗三次之后,乙酸乙酯溶液室温搅拌12h使无色固体充分析出。滤出1.8g(51%)标题化合物。esi-ms(m/e):449[m+h]+。
实施例4制备(3r,6r)-3-(氨基正丁基)-6-(吲哚-3-甲基)-哌嗪-2,5-二酮(2)
往1.9g(4.2mmol)(3r,6r)-3-(苄氧羰基丁氨基)-6-(吲哚-3-甲基)-哌嗪-2,5-二酮(1)与20ml无水n,n-二甲基甲酰胺(dmf)的溶液中加200mgpd/c,通入h2,室温搅拌反应48h。滤去pd/c,滤液减压浓缩得1.2g(92%)标题化合物,为无色粉末。esi-ms(m/e):315[m+h]+.
实施例5制备氨基正己酸甲酯
往40ml甲醇中滴加5.6ml二氯亚砜,活化30min后,加入2.62g(20mmol)氨基正己酸,室温搅拌12h。反应化合物37℃温水浴搅拌下用水泵将反应液减压抽干,加入干燥甲醇溶解后用水泵减压抽干,重复3次;加入无水乙醚混悬,37℃温水浴搅拌下减压抽干,重复3次,得到2.72g(95%)标题化合物。esi-ms(m/e):145[m+h]+
实施例6制备cbz-gln-氨基正己酸甲酯(3a)
采用实施例1的方法从1400mg(5.0mmol)cbz-gln和720mg(5.0mmol)氨基正己酸甲酯得到1640mg(81%)标题化合物,为无色固体。esi-ms(m/e):408[m+h]+。
实施例7制备cbz-asn-氨基正己酸甲酯(3b)
采用实施例1的方法从1330mg(5.0mmol)cbz-asn和720mg(5.0mmol)氨基正己酸甲酯得到1560mg(91%)标题化合物,为无色固体。esi-ms(m/e):394[m+h]+。
实施例8制备cbz-gln-氨基正己酸(4a)
将1.22g(3.0mmol)boc-gln-氨基正己酸甲酯(3a)用20mlch3oh溶解。得到的溶液在冰浴搅拌下加入naoh水溶液(2m)调节ph值至12,冰浴搅拌反应6h。冰浴搅拌下,反应液用饱和khso4溶液调节ph值至7,得到溶液减压浓缩。残留物用5%khso4水溶液调节ph值至2。得到的溶液用乙酸乙酯萃取3次,再将乙酸乙酯溶液用饱和nacl水溶液洗至中性。乙酸乙酯层用无水na2so4干燥12h,过滤,滤液减压浓缩至干。得到1.38g标题化合物,为淡黄色糖浆。esi-ms(m/e):394[m+h]+。
实施例9制备制备cbz-asn-氨基正己酸(4e)
采用实施例8的方法将1.17g(3.0mmol)cbz-asn-氨基正己酸甲酯(3b)得到1.44g标题化合物,为淡黄色糖浆。esi-ms(m/e):380[m+h]+。
实施例10制备(3r,6r)-3-(cbz-gln-氨基正己酰基氨基正丁基)-6-(吲哚-3-甲基)-哌嗪-2,5-二酮(5a)
采用实施例1的方法从1380mg淡黄色糖浆的cbz-gln-氨基正己酸(4a)和940mg(3.0mmol)(3r,6r)-3-丁氨基-6-(吲哚-3-甲基)-哌嗪-2,5-二酮(2)得到810mg(39%)标题化合物,为无色固体。esi-ms(m/e):690[m+h]+;1hnmr(300mhz,dmso-d6):δ/ppm=10.887(s,1h),8.063(s,1h),7.953(s,1h),7.865(t,j=5.4hz,1h),7.577(m,2h),7.335(m,8h),7.035(m,2h),6.927(t,j=7.5hz,1h),6.786(s,1h),5.017(s,2h),4.112(m,1h),3.932(m,1h),3.501(m,1h),3.250(dd,j1=3.9hz,j2=14.4hz,1h),3.015(m,3h),2.764(m,2h),1.993(m,7h),1.839(m,1h),1.712(m,1h),1.425(m,4h),1.200(m,5h),0.963(m,3h),0.581(m,3h)。
实施例11制备(3r,6r)-3-(cbz-asn-氨基正己酰基氨基正丁基)-6-(吲哚-3-甲基)-哌嗪-2,5-二酮(5b)
采用实施例1的方法从1440mg淡黄色糖浆的cbz-asn-氨基正己酸(4b)和940mg(3.0mmol)(3r,6r)-3-丁氨基-6-(吲哚-3-甲基)-哌嗪-2,5-二酮(2)得到560mg(28%)标题化合物,为无色固体。esi-ms(m/e):676[m+h]+;1hnmr(300mhz,dmso-d6):δ/ppm=10.884(s,1h),8.060(s,1h),7.947(s,1h),7.828(m,1h),7.577(m,2h),7.314(m,8h),6.976(m,4h),5.018(s,2h),4.279(q,j=5.1hz,1h),4.113(m,1h),3.502(m,1h),3.251(dd,j1=14.4hz,j2=3.9hz,1h),3.007(m,3h),2.7652(m,2h),2.395(m,2h),2.005(t,j=7.2hz,2h),1.412(m,4h),1.202(m,2h),0.963(m,3h),0.579(m,3h)。
实施例12制备(3r,6r)-3-(gln-氨基正己酰基氨基正丁基)-6-(吲哚-3-甲基)-哌嗪-2,5-二酮(6a)
按照实施例3的方法从300mg(0.4mmol)(3r,6r)-3-(cbz-gln-氨基正己酰基氨基正丁基)-6-(吲哚-3-甲基)-哌嗪-2,5-二酮(5a)得到180mg(76%)标题化合物,为无色固体。esi-ms(m/e):556[m+h]+;mp:117–118℃;
实施例13制备(3r,6r)-3-(asn-氨基正己酰基氨基正丁基)-6-(吲哚-3-甲基)-哌嗪-2,5-二酮(6b)
按照实施例4的方法从300mg(0.4mmol)(3r,6r)-3-(cbz-asn-氨基正己酰基氨基正丁基)-6-(吲哚-3-甲基)-哌嗪-2,5-二酮(5b)得到200mg(82%)标题化合物,为无色固体。esi-ms(m/e):542[m+h]+;mp:119–121℃;
实施例14制备(3r,6r)-3-(boc-氨基己酰基丁氨基)-6-(吲哚-3-甲基)-哌嗪-2,5-二酮(7)
采用实施例1的方法从0.97g(4.2mmol)boc-氨基己酸和1.9g(3.5mmol)(3r,6r)-3-丁氨基-6-(吲哚-3-甲基)-哌嗪-2,5-二酮(2)得到0.641g(21%)标题化合物,为无色固体。esi-ms(m/e):528[m+h]+;1hnmr(300mhz,dmso-d6):δ/ppm=10.872(s,1h),8.035(d,j=1.8hz,1h),7.928(d,j=1.8hz,1h),7.560(m,2h),7.303(d,j=5.7hz,1h),7.034(m,2h),6.925(t,j=7.5hz,1h),6.763(t,j=5.1hz,1h),4.108(m,1h),3.499(m,1h),3.246(dd,j1=14.4hz,j2=4.2hz,1h),3.009(dd,j1=14.4hz,j2=4.2hz,1h),2.890(q,j=6.6hz,2h),2.750(q,j=6.6hz,2h),2.002(t,j=7.2hz,2h),1.465(m,2h),1.350(m,12h),1.205(m,3h),0.951(m,3h),0.553(m,3h)。
实施例15制备(3r,6r)-3-(氨基己酰基丁氨基)-6-(吲哚-3-甲基)-哌嗪-2,5-二酮(8)
采用实施例3的方法从2.21g(4mmol)(3r,6r)-3-(boc-氨基己酰基丁氨基)-6-(吲哚-3-甲基)-哌嗪-2,5-二酮(7)得到1.45g(82%)标题化合物,为无色粉末。esi-ms(m/e):428[m+h]+;1hnmr(300mhz,dmso-d6):δ/ppm=11.003(s,1h),8.086(s,1h),7.999(s,1h),7.748(s,1h),7.578(s,j=8.1hz,1h),7.314(m,j=8.1hz,1h),7.023(m,2h),6.926(m,1h),4.117(m,1h),3.502(m,1h),3.269(m,1h),3.041(m,1h),2.736(m,4h),2.030(m,2h),1.542(m,4h),1.260(m,2h),0.981(m,3h),0.590(m,3h)。
实施例16测定化合物6a,b的抗肿瘤转移活性
本测定模型用lewis小鼠肺癌细胞(llc,购自atcc)接种,选用dmem培养基(含10%经灭活的胎牛血清,1×105u/l青霉素和100mg/l链霉素),按照贴壁细胞培养方法每两天传代一次,富集细胞。待细胞生长状态良好并处于对数生长期时消化细胞,用生理盐水调整细胞密度至1×107个/ml。胎盘蓝染色,使活细胞计数>95%。取近交系c57bl/6雄性小鼠(spf级,体重20±2g),左手固定小鼠。用75%乙醇对小鼠右前肢腋窝皮肤消毒。右手持1ml无菌注射器往小鼠腋部皮下注射llc肿瘤细胞悬液,每只小鼠注射0.2ml。小鼠接种10天后,长出直径约4-5mm的肿瘤即为瘤源。接种10天的lewis肺癌荷瘤小鼠乙醚麻醉,脱颈椎处死。用75%乙醇浸泡10min,消毒,在超净工作台上剥离瘤体。选择生长良好的肿瘤组织在无菌平皿中剪碎,置于玻璃制造的组织匀浆器内。按瘤块重比生理盐水体积为1比3(g比ml)的比例加温度为4℃的生理盐水,轻轻研磨制成细胞悬液。细胞悬液过200目细胞筛制单细胞悬液。用生理盐水调单细胞悬液的细胞密度至1.5×107个/ml。胎盘蓝染色,使活细胞计数>95%。左手固定近交系c57bl/6雄性小鼠,用75%的乙醇对小鼠右前肢腋窝皮肤消毒。右手持1ml无菌注射器于小鼠腋部皮下注射瘤细胞悬液,每只注射0.2ml。接种10天后小鼠长出直径4-5mm的肿瘤,按测得的肿瘤体积将接种小鼠随机分组。每组12只小鼠。接种肿瘤的第11天小鼠或口服公认的抗肿瘤转移肽rgds的生理盐水溶液(剂量为20μmol/kg/天)或口服化合物6a-e的生理盐水溶液(剂量为0.5μmol/kg/天)或口服化合物8的生理盐水溶液(剂量为5μmol/kg/天)或口服生理盐水(剂量为10ml/kg/天),每天给1次药,连续给药12天,每隔两天测量并记录肿瘤体积。最后一次给药的次日测量瘤体积,乙醚麻醉脱颈椎处死,取小鼠的肿瘤称重,取小鼠的肺并计算肿瘤肺部转移的瘤节数。用t检验对数据进行统计分析。结果见表1。在0.5μmol/kg剂量下化合物6a,b不仅有效地抑制肿瘤肺转移,而且活性与剂量比它们高40倍的rgds及剂量比它们高10倍的化合物8没有显著性差异。这些数据表明,本发明有显著的技术效果。
表1化合物6a,b的抗肿瘤转移活性
a)与生理盐水比p<0.01,与rgds及化合物8比p>0.05;n=11
实施例17测定化合物6a,b的抗肿瘤生长活性
测定前将阿霉素,化合物8和化合物6a,b都用生理盐水溶解,用于s180小鼠给药。在无菌环境中取接种于雄性icr小鼠10天生长旺盛的s180腹水瘤液,用生理盐水稀释成(1:2)的液体充分混合,将肿瘤细胞悬液用新鲜配制的0.2%台盼蓝染色,混匀后按白细胞计数方法计数,染蓝色者为死细胞,不染色者为活细胞。按细胞浓度=4大方格内活细胞数/4×104×稀释倍数=细胞数/ml计算细胞密度,按细胞存活率=活细胞数/(活细胞数+死细胞数)×100%计算细胞存活率。将存活率大于90%的瘤液用匀浆法制成密度为2.0×107个/ml的细胞悬液。该细胞悬液接种于小鼠右腋皮下(0.2ml/只),制造s180荷瘤小鼠。接种24h后s180荷瘤小鼠每日腹腔注射阿霉素的生理盐水溶液(剂量为2μmol/kg/天g)或每日口服化合物8的生理盐水溶液(剂量为5μmol/kg/天)或每日口服化合物6a,b的生理盐水溶液(剂量为0.5μmol/kg/天)。每天给药一次,连续给药12天。最后一次给药的次日测量瘤体积,乙醚麻醉脱颈椎处死,然后用镊子固定小鼠右腋肿瘤生长部位,剪开皮肤钝性剥离肿瘤并称重。用瘤重(均值±sdg)表示疗效,数据用t检验和方差分析。结果见表2。在0.5μmol/kg剂量下化合物6a,b不仅有效地抑制肿瘤生长,而且活性与剂量比它们高10倍的化合物8没有显著性差异。这些数据表明,本发明有显著的技术效果。
表2化合物6a,b对s180小鼠肿瘤生长的影响
a)与生理盐水比p<0.01,与化合物8比p>0.05;n=12.
实施例18测定化合物6a,b的抗炎活性
因为二甲苯引起的小鼠耳肿胀被公认为急性炎症模型,所以本发明在二甲苯引起的小鼠耳肿胀模型上测定化合物6a,b的治疗作用。因为阿司匹林是治疗急性炎症的阳性药,所以本发明选择阿司匹林为阳性对照药。icr雄性小鼠(体重20±2g)在温度为22℃的环境静息2天,自由饮水和进食。之后,随机分为生理盐水组(剂量为0.2ml/只),阿司匹林组(剂量为1.11mmol/kg),化合物8组(剂量为5μmol/kg)及化合物6a,b组(剂量为0.5μmol/kg),每组12只小鼠。测定时小鼠按所在组或口服生理盐水,或口服阿司匹林,或口服化合物8,或口服化合物6a,b。给药30min后,往小鼠的左耳廓均匀涂抹30μl二甲苯,2h后小鼠接受乙醚麻醉,断颈处死,剪下左右两耳,用7mm的打孔器在两耳的相同位置取圆形耳片,称重,求出两耳肿胀差值作为肿胀度。即肿胀度=左耳圆片重量–右耳圆片重量。结果见表2。在0.5μmol/kg剂量下化合物6a,b不仅有效地抑制二甲苯引起的小鼠耳肿胀,而且活性与剂量比它们高10倍的化合物8没有显著性差异。这些数据表明,本发明有显著的技术效果。
表3化合物6a,b对二甲苯引起的小鼠耳肿胀的影响
a)与生理盐水比p<0.01,与化合物8比p>0.05;n=12。
- 还没有人留言评论。精彩留言会获得点赞!