一种兔正常角膜上皮细胞及其用途的制作方法
本发明属于细胞生物学领域,涉及一种兔正常角膜上皮细胞及其原代分离培养和传代培养方法与用途。
背景技术:
现代医学是建立在动物实验的基础上发展而来。无论是疫苗研发,器官移植、生理学、药理学、毒理学的研究,还是化妆品的开发,都是伴随实验动物的牺牲而来。如果取消动物实验,现代医学的发展将停滞不前,人类将不可能战胜疾病。目前,国际上对于动物实验公认的一个原则就是“替代、减少、优化”。首先,研究人员要尽量寻求动物活体实验的替代方案,例如,利用计算机动态仿真及细胞组织培养等离体技术。其中,细胞组织培养是目前应用最广泛的替代方法,特异性分化的上皮细胞与不同器官的特异性功能直接相关,如肺的气体交换功能、肾的过滤功能、肝的解毒及中和功能、胰腺细胞产生胰岛素、皮肤具有保护机体免受外界环境的伤害。目前,分离来自哺乳动物的原代上皮细胞的体外培养仍然是很困难的。应用目前的无血清培养基,有的只能进行短期的原代培养(存活数天,如肺和胰腺等上皮细胞),有的只能进行有限的传代培养,有的甚至根本不能体外培养(如肝、结肠、前列腺等上皮细胞),只有来自于人体皮肤的角化上皮细胞可以传代培养10代左右。而且从每个动物或活体组织样品中获得的上皮细胞产量仍然很低,包括细胞的数量、直接分离或短期培养的细胞纯度都是很低的,这些原代和传代上皮细胞的增殖速度也极为有限。这种只能短期培养的细胞并不能真正意义上替代动物实验。
为了在体外进行上皮细胞的培养,目前国外尝试通过遗传操作,如转入病毒(sv40t或hpv16e6e7)或细胞癌基因,可以延长体外细胞存活的代数。然而遗传操作的最大缺点是会改变这些细胞的遗传背景和表型,以致让这些正常上皮细胞丢失其正常生理功能,如p53和prb信号通路常常被抑制。而且,这些经遗传修饰的细胞是不可能重新再移植进机体的。但是由于目前缺乏有效的体外培养上皮细胞的技术,上述这些细胞在当今世界的医学和生命科学研究中仍然备受青睐。在非癌症研究领域,它们就代表着最初来源的“功能”性的组织或器官。现阶段,国内外还从未有过“正常细胞”可以应用于基础和临床医学研究。
兔正常角膜上皮细胞主要功能:(1)角膜表面的上皮细胞构成了非角化的复层上皮。(2)组成物理屏障,可有效防止多种物理和化学损伤。(3)产生和分泌化学介质和细胞因子形成高度复杂的宿主防御系统。角膜上皮细胞与主要病理生理疾病有关,如角膜损伤、病毒性角膜炎。目前,国际上没有应用于体外药物药敏与毒性检测的兔角膜上皮细胞模型,已有的研究也只是在原代兔角膜上皮细胞的基础上开展实验,不能传代和扩增,因此就无法避免重复地进行实验动物创伤性地组织分离甚至处死实验动物。如果能获得体外稳定传代的兔正常角膜上皮细胞,并建立体外兔角膜3d模型,将有希望取代角膜相关药物临床与基础研究的活体动物实验,建立一种新的研究角膜药物药理与毒理的替代方法。
技术实现要素:
为了解决现有技术存在的不足,本发明公开了一种兔正常角膜上皮细胞,并建立体外兔角膜3d模型,将有希望取代角膜相关药物临床与基础研究的活体动物实验,建立一种新的研究角膜药物药理与毒理的替代方法。
本发明的目的通过下述技术方案实现:
本发明的第一方面,提供一种兔正常角膜上皮细胞,命名为兔正常角膜上皮细胞rncec/hl-032,拉丁文为:rabbitnormalcornealepithelialcellsrncec/hl-032,已于2016年10月18日保藏于中国典型培养物保藏中心(地址:中国.武汉.武汉大学),保藏编号为cctccno:c201677;该细胞是分离培养自新西兰兔的正常角膜缘组织的正常角膜上皮细胞。
所述的兔正常角膜上皮细胞的培养条件优选为用hl培养基于37℃、5%co2培养;所述的hl培养基为:dmem与无血清培养基sfm按体积比1:3混合,同时添加5%(v/v)的fbs(胎牛血清),以及0.4μg/ml皮质醇(hydrocortisone),5μg/ml胰岛素(insulin),8.4ng/ml霍乱毒素(choleratoxin),10ng/ml表皮生长因子(epithelialgrowthfactor(egf)),24μg/ml腺嘌呤(adenine),100u/ml青霉素(penicillin),100μg/ml链霉素(streptomycin),0.25µg/ml两性霉素b(fungizone),30μm法舒地尔(fasudil),上述培养基需经0.22μm孔径滤膜过滤。
上述兔正常角膜上皮细胞的原代分离培养方法,包括如下步骤:
(1)收集新西兰大白兔正常角膜缘细胞组织样品;
(2)配制消化液:所述消化液为含胶原酶/透明质酸酶混合液;
(3)依次用95-100%的乙醇清洗分离的正常细胞组织样品1次,pbs缓冲液清洗分离的正常细胞组织样品2次,然后将正常细胞组织样品放入含预冷pbs缓冲液的无菌培养皿中;
(4)将正常细胞组织样品放入含步骤(2)所配制消化液的离心管中消化37℃,时长1-3小时;将消化后的正常细胞组织样品低速离心1000prm,时长为5分钟去除上清;
(5)将步骤(4)处理后的正常细胞组织样品沉淀重悬于2-5ml,0.25%胰酶/edta中,置于冰上1小时或室温10分钟消化;然后再行加入含10%fbs的dmem培养基,低速离心1000prm,时长为5分钟去除上清;
(6)加入分散酶和200μl的1mg/mldnasei,用无菌的一次性塑料枪头反复吹打正常细胞组织样品1分钟;
(7)再行加入含10%fbs的dmem,用过滤器过滤细胞悬液,收集过滤后的细胞悬液,低速离心1000prm,时长为5分钟,去除上清;重悬细胞沉淀于hl培养基中,接种于培养瓶中,于37℃,5%co2培养箱中培养。
上述兔正常角膜上皮细胞的传代培养方法,包括如下步骤:
s1、当兔的正常角膜上皮细胞增殖至70-90%丰度时,用1xpbs缓冲液洗涤细胞2次,再用0.05%,消化时长2-5分钟胰酶/edta消化单层细胞;
s2、再用dmem培养基中和消化反应;
s3、1000prm,时长为5分钟低速离心去除上清;
s4、以1:2比例重悬细胞沉淀于hl培养基中接种培养。
本发明的第二方面,提供一种基于兔正常角膜上皮细胞的气-液3d培养方法,包括如下步骤:
步骤s1、将插入式细胞培养皿内置物放入培养皿;
步骤s2、用hl培养基重悬2x105上述正常角膜上皮细胞,然后接种到插入式细胞培养皿内置物中;
步骤s3、培养皿中加入hl培养基;
步骤s4、将放有内置物的培养皿放入湿热培养箱中培养,37℃,5%co2,培养时长为48小时;
步骤s5、将内置物内部及外围培养皿中的培养基更换为分化培养基(cellntec,switzerland);
步骤s6、将步骤s5中放有内置物的培养皿放入湿热培养箱中使细胞之间形成紧密连接,培养时长为15-17小时;
步骤s7、移除内置物内部及外围所有的培养基,外围培养皿中加入分化培养基,开始3d分化培养;
步骤s8、在37℃,5%co2湿热培养箱中培养细胞14至21天,每2-3天更换内置物外围的培养基。
在本发明的一个实施例中,将兔正常角膜上皮细胞rncec/hl-032经过actd处理后,结果如图3所示,其p53蛋白的表达量上调,说明该细胞对dna损伤具有正常的应答能力。
在本发明的一个实施例中,对兔正常角膜上皮细胞rncec/hl-032的组织特性进行鉴定,结果如图4所示,经染色后荧光显微镜,兔正常角膜上皮细胞表达角膜上皮特异性分子ck14、ck19和干性分子p63。
在本发明的一个实施例中,将兔正常角膜上皮细胞rncec/hl-032用于基质胶3d培养,结果经显微镜观察如图5所示,人正常角膜上皮细胞在基质胶分化条件下,可正常分化形成表面光滑的球形。
在本发明的一个实施例中,兔正常角膜上皮细胞rncec/hl-032用于气-液界面3d培养,气-液界面3d培养物,经常规组织固定、包埋、切片、免疫组化(dab染色),显微镜观察如图6所示,兔正常角膜上皮细胞在气-液界面3d分化培养条件下,可正常分化形成角膜上皮结构,并表达干性分子p63。
在本发明的一个实施例中,进行了兔正常角膜上皮细胞rncec/hl-032的八种抗病毒药物毒性检测,检测结果如图7,更昔洛韦作用48h时,浓度为14.9um才能引起50%细胞死亡;ifna2β作用48h时,浓度为5877iu/ml才能引起50%细胞死亡;5-fluorouracil对新西兰大白兔正常角膜上皮细胞存活率的影响在小浓度范围存在剂量-反应关系,5-fluorouracil作用48h时,浓度为7.8125um引起50%细胞死亡;tak-242和ku-55933对新西兰大白兔正常角膜上皮细胞存活率的影响在小浓度范围内不存在剂量-反应关系。tak-242作用48h时,浓度为300ug/ul时才能引起50%细胞死亡;ku-55933作用48h时,浓度为30um时才能引起50%细胞死亡;acyclovir、deferoxaminemesylate、phosphonoaceticacid长期毒性试验均未发现其病理学变化。
本发明的第三方面,提供兔正常角膜上皮细胞rncec/hl-032在药物药敏及毒性检测系统中的应用。
本发明的第四方面,提供兔正常角膜上皮细胞rncec/hl-032气-液界面3d培养物作为动物替代模型在药理学、药物毒理学、角膜相关疾病的发病机制研究中的应用。本发明相对于现有技术具有如下优点和效果:
1.本发明提供的兔正常角膜上皮细胞rncec/hl-032,原代分离培养自新西兰兔的正常角膜组织,未导入任何外源基因,该细胞表达角膜上皮特异性分子ck14、ck19和干性分子p63,在基质胶分化条件下,可正常分化形成表面光滑的球形,该细胞对dna损伤具有正常的应答能力。
2.本发明提供的兔正常角膜上皮细胞rncec/hl-032,显微镜下观察细胞的形态为、细胞较小、多角型的上皮细胞。可以体外快速增殖,保持稳定增殖状态,增殖1代大概可以获得4x106个细胞,因此可以获得大量的细胞用于不同药物的平行实验和重复实验,从而建立一个稳定的药物药敏、毒性检测系统。
3.本发明提供的兔正常角膜上皮细胞rncec/hl-032,通过3d培养显示具有正常分化的生理功能,可应用于实验动物替代研究中药理学、药物毒理学、角膜相关疾病的发病机制等研究,提供一种新的实验动物替代模型。
附图说明
图1是兔正常角膜上皮细胞rncec/hl-032的细胞形态
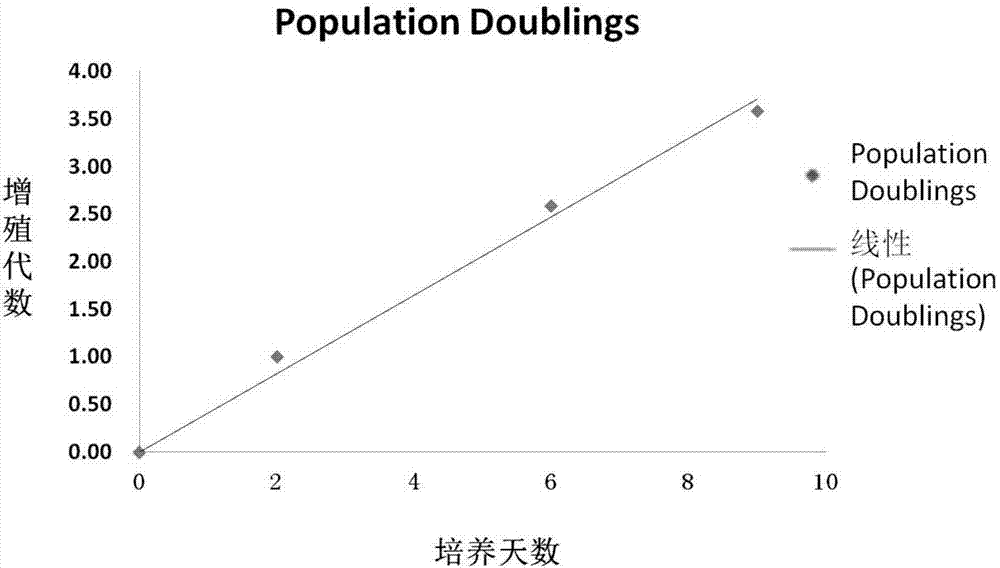
图2是兔正常角膜上皮细胞rncec/hl-032的生长曲线;
图3是兔正常角膜上皮细胞rncec/hl-032dna损伤应答实验;
图4兔正常角膜上皮细胞rncec/hl-032的组织特异性鉴定实验(p63、ck14、ck19的表达);
图5是兔正常角膜上皮细胞rncec/hl-032在基质胶3d培养条件下可正常分化;
图6是兔正常角膜上皮细胞rncec/hl-032在气-液界面3d培养条件下可正常分化;
图7是8种抗病毒药物对兔正常角膜上皮细胞rncec/hl-032药物毒性检测。
具体实施方式
通过以下详细说明结合附图可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。
【实施例1】兔正常角膜上皮细胞的原代分离培养方法
1)严格遵循arrive(animalresearch:reportingofinvivoexperiments)的动物实验操作流程和条例,收集兔正常角膜样品;
2)消化液的配制:含胶原酶和分散酶均0.2mg/ml的hl培养基;其中,hl培养基为:dmem(gibco#11965-092)与无血清培养基sfm(gibco#10744-019)按体积比1:3混合,同时添加5%(v/v)的胎牛血清,以及0.4μg/ml皮质醇(hydrocortisone),5μg/ml胰岛素(insulin),8.4ng/ml霍乱毒素(choleratoxin),10ng/ml表皮生长因子(epithelialgrowthfactor(egf)),24μg/ml腺嘌呤(adenine),100u/ml青霉素(penicillin),100μg/ml链霉素(streptomycin),0.25µg/ml两性霉素b(fungizone),30μm法舒地尔(fasudil),上述培养基需经0.22μm孔径滤膜过滤)。
3)用95-100%的乙醇洗分离的新鲜组织1次,再用pbs洗2次,然后将组织放入含预冷pbs的无菌培养皿中,在解剖显微镜下,用解剖镊子和剪刀去除组织中残留的脂肪。
4)将组织样品放入含上述消化液的14ml或50ml离心管中,37℃消化1-3小时。
5)将消化后的组织低速离心(1000rpm)5分钟,去除上清。
6)将细胞沉淀重悬于2-5ml的0.25%胰酶/edta中,置于冰上1小时或室温10分钟。
7)然后加入10ml含10%fbs的dmem培养基,低速1000rmp离心5分钟,尽量将上清去除干净。
8)加入2ml温浴的5mg/ml分散酶和200μl的1mg/mldnasei,用无菌的p1000一次性塑料枪头反复吹打样品1分钟。
9)加入10ml含10%fbs的dmem,用40-70μm孔径的过滤器过滤细胞悬液,收集过滤后的细胞悬液,低速1000rmp离心5分钟,去除上清。
10)重悬细胞沉淀于上述培养基中,接种于t25或t75的培养瓶培养,培养条件是37℃、5%co2。
按照上述方法分离培养成功的原代兔正常角膜上皮细胞,显微镜下观察细胞的形态见图1(细胞较小,排列紧密、多角型的上皮细胞)。该细胞命名为“兔正常角膜上皮细胞rncec/hl-032”,已于2016年10月18日保藏于中国典型培养物保藏中心(地址:中国.武汉.武汉大学),保藏编号为cctccno:c201677。
【实施例2】兔正常角膜上皮细胞rncec/hl-032的传代培养方法
1)当兔正常角膜上皮细胞增殖至70-90%丰度时,用1xpbs洗涤细胞两次,0.05%胰酶/edta消化单层细胞2-5分钟。
2)10ml完全的dmem中和消化反应。
3)1000rmp离心5分钟去上清。
4)以1:2比例,只要可以维持细胞贴壁和正常生长)重悬细胞沉淀于10ml实施例1中的培养基接种培养。
5)必要时可将1x106角膜上皮细胞重悬于1-2ml的细胞冻存液(90%胎牛血清和10%dmso)中,储存于液氮中备用。
按照上述方法传代培养的兔正常角膜上皮细胞,生长曲线如图2,细胞保持稳定增殖状态。
【实施例3】兔正常角膜上皮细胞rncec/hl-032的dna损伤应答实验
1)将兔正常角膜上皮细胞用0.05%胰酶消化,制备成单细胞悬液,接种到6孔板中,每孔1x106个细胞,于37℃、5%co2培养箱培养。
2)加入10μm浓度放线菌素d(actd),于37℃、5%co2培养箱培养24小时。
3)收集细胞,用200μlripa裂解液冰上裂解30分钟,4℃12000rpm离心30分钟,收集上清。
4)对收集到的蛋白样品进行westernblot检测。
结果如图3所示,兔正常角膜上皮细胞经过actd处理后,其p53蛋白的表达量上调,说明该细胞对dna损伤具有正常的应答能力。
【实施例4】兔正常角膜上皮细胞rncec/hl-032的组织特性鉴定
1)将兔正常角膜上皮细胞用0.05%胰酶消化,制备成单细胞悬液,接种到6孔板中,每孔5x105个细胞,于37℃、5%co2培养箱培养。
2)第二天加4%多聚甲醛固定,并用0.5%triton-x100/pbs透化后,3%小牛血清/pbs封闭30分钟。一抗1:1000作用4℃过夜,二抗1:100作用37℃2小时,dapi作用10分钟。
3)荧光显微镜观察并拍照。
结果如图4所示,经染色后荧光显微镜,兔正常角膜上皮细胞表达角膜上皮特异性分子ck14、ck19和干性分子p63。
【实施例5】兔正常角膜上皮细胞rncec/hl-032的基质胶3d培养
1)将基质胶(bd,bdbiosciences)放置4℃的条件下过夜融化。
2)在预冷的6孔板表面铺一薄层基质胶,将120μl的基质胶加入表面并用枪头均匀涂抹。
3)将6孔板放置37℃约15-30分钟,使基质胶凝固。
4)消化正常角膜上皮细胞至单个并离心。
5)轻轻将细胞重悬至1.2ml的基质胶中。
6)用枪头轻轻将基质胶与细胞混匀后将混合物加入到预先铺有基质胶的6孔板中,建议细胞数为1x105/孔。将6孔板在37℃条件下放置约30分钟使基质胶凝固。再加入1ml实施例1中的培养基。
将上述6孔板放置于37℃,5%co2湿热培养箱恒温培养10天,每2天更换1次培养基。
结果经显微镜观察,如图5所示,人正常角膜上皮细胞在基质胶分化条件下,可正常分化形成表面光滑的球形。
【实施例6】兔正常角膜上皮细胞rncec/hl-032的气-液界面3d培养
1)将0.4μm的millicellpcf内置物(12mmsize,millipore)放入60mm的培养皿。
2)用400μl的实施例1中的培养基重悬2x105细胞,然后接种到每个内置物中。
3)每个培养皿中加入11ml合适的生长培养基。
4)将放有内置物的培养皿放入37℃,5%co2湿热培养箱中培养48小时。
5)将内置物内部及外围培养皿中的培养基更换为分化培养基(cellntec,switzerland)
6)将放有内置物的培养皿放入湿热培养箱中约16小时使细胞之间形成紧密连接。
7)移除内置物内部及外围所有的培养基,外围培养皿中加入3.2ml的分化培养基,开始3d分化培养。
8)在37℃,5%co2湿热培养箱中培养细胞14至21天。每2-3天更换内置物外围的培养基。
气-液界面3d培养物,经常规组织固定、包埋、切片、免疫组化(dab染色),显微镜观察如图6所示,兔正常角膜上皮细胞在气-液界面3d分化培养条件下,可正常分化形成角膜上皮结构,并表达干性分子p63。
【实施例7】兔正常角膜上皮细胞rncec/hl-032的抗病毒药物毒性检测
(1)将兔正常角膜上皮细胞用0.05%胰酶消化,制备成单细胞悬液,接种于96孔板,每孔接种细胞悬液100μl,每孔约为5000个细胞,于37℃、5%co2培养箱培养。
(2)第二天加药(更昔洛韦、干扰素、acyclovir、5-fluorouracil、deferoxaminemesylate、phosphonoaceticacid、ku-55933、tak-242)处理,每孔加入100μl不同浓度药物,药物浓度梯度为更昔洛韦(由高到低):300、100、30、10、3、1、0.3、0.1μg/μl干扰素(由高到低):20、6.6、2、0.66、0.2、0.066、0.02、0.0066万iu;acyclovir(由高到低):3000、1500、750、375、187.5、93.75、46.87、23.4375、11.71875、5.859375μm;5-fluorouracil(由高到低):2000、1000、500、250、125、62.5、31.25、15.625、7.8125、3.90625μm;deferoxaminemesylate(由高到低):5000、2500、1250、625、312.5、156.25、78.125、39.0625、19.53125、9.7656μm;phosphonoaceticacid(由高到低):5000、2500、1250、625、312.5、156.25、78.125、39.0625、19.53125、9.7656μm;ku-55933(由高到低):300、100、30、10、3、1、0.3、0.1μm;tak-242(由高到低):1000、300、100、30、10、3、1、0.3μg/ml。每种药物的每个梯度设置6个复孔,同时设置细胞对照组(接种细胞不加药处理)及只加hl培养基的空白对照组,每组设置6个复孔。
(3)药物处理(37℃、5%co2培养箱培养)24小时后,吸去孔内溶液,每孔加入10μlckk-8检测试剂(碧云天,上海),即10μlcck-8+90μlhl培养基。
(4)在37℃、5%co2细胞培养箱内继续孵育0.5~2个小时,孵育时间跟细胞量的多少相关,具体时间根据预实验确定(可根据液体颜色变化来初步确定),吸光度范围控制在1.0~1.5之间最好。
(5)用酶标仪测定在450nm处的吸光度。
兔正常角膜上皮细胞对八种抗病毒药物,更昔洛韦、干扰素、acyclovir、5-fluorouracil、deferoxaminemesylate、phosphonoaceticacid、ku-55933、tak-242的敏感性(毒性)检测结果如图7,更昔洛韦作用48h时,浓度为14.9μm才能引起50%细胞死亡;ifna2β作用48h时,浓度为5877iu/ml才能引起50%细胞死亡;5-fluorouracil对新西兰大白兔正常角膜上皮细胞存活率的影响在小浓度范围存在剂量-反应关系,5-fluorouracil作用48h时,浓度为7.8125μm引起50%细胞死亡;tak-242和ku-55933对新西兰大白兔正常角膜上皮细胞存活率的影响在小浓度范围内不存在剂量-反应关系。tak-242作用48h时,浓度为300μg/μl时才能引起50%细胞死亡;ku-55933作用48h时,浓度为30um时才能引起50%细胞死亡;acyclovir、deferoxaminemesylate、phosphonoaceticacid长期毒性试验均未发现其病理学变化。
以上所述仅以实施例来进一步说明本发明的技术内容,以便于读者更容易理解,但不代表本发明的实施方式仅限于此,任何依本发明所做的技术延伸或再创造,均受本发明的保护。
- 还没有人留言评论。精彩留言会获得点赞!