纯化衍生自多能干细胞的细胞的方法与流程
本申请是分案室申请,其母案的中国申请号是201180011846x,国际申请号是pct/us2011/026443,申请日是2011年2月28日。相关专利申请的交叉引用本专利申请要求于2010年3月1日提交的系列号为61/309,193的临时申请的优先权。本发明涉及使多能干细胞分化的方法。具体来说,本发明提供利用独特的表面标记物对被分化为表达胰腺内分泌谱系特征性标记物的细胞的细胞进行表征的方法。本发明还提供富集或分选表达胰腺内分泌谱系特征性标记物的细胞的方法。本发明还提供清除可能污染由本发明方法形成的表达胰腺内分泌谱系特征性标记物的细胞群的细胞、从而降低移植后体内肿瘤形成的发生率的方法。
背景技术:
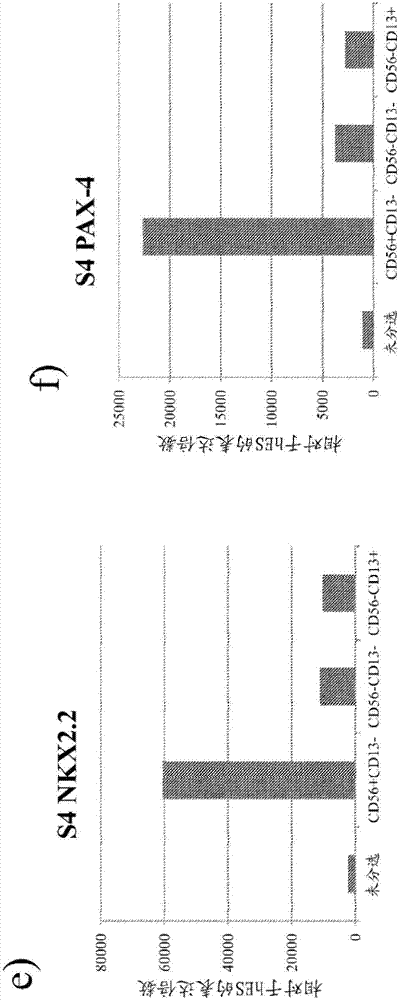
:多能干细胞具有产生构成所有体细胞组织和器官的分化细胞类型的潜能。大量能够发挥类似于人类胰岛作用的细胞的生产有利于使用细胞疗法治疗糖尿病。因此,需要生产这些衍生自多能干细胞的细胞,以及纯化此类细胞的可靠方法。多能干细胞和衍生自多能干细胞的细胞群上存在的蛋白质与其他细胞表面标记物,可用于制备分离和离析这些群体的试剂。细胞表面标记物还可用于这些细胞的进一步表征。在一个例子中,wo2009131568公开了纯化肠道内胚层细胞的方法,该方法包括:a)将衍生自多能干细胞的包含肠道内胚层细胞的细胞群暴露于能结合肠道内胚层细胞上表达的细胞表面标记物的配体,其中所述细胞表面标记物选自cd49e、cd99、cd165和cd334;以及b)将肠道内胚层细胞与不能结合该配体的衍生自多能干细胞的细胞分离,从而纯化所述肠道内胚层细胞。又如,wo2010000415公开了将能结合抗原tnap的抗体或该抗体的功能片段单独使用,或与能结合cd56的抗体或该抗体的功能片段联合使用,来分离具有脂肪细胞、软骨细胞和胰腺细胞分化潜能的干细胞。又如,us7371576公开了一种选择性细胞表面标记物的发现,该标记物使得可以选择具有很高的分化为产胰岛素细胞或产胰岛素细胞团的倾向的独特胰腺干细胞亚群。又如,us7585672公开了从衍生自人类胚胎干细胞的培养物中富集内胚层和胰腺谱系细胞的方法,该方法包括以下步骤:(a)培养人类胚胎干细胞的未受损集落以形成完整的、未受损的被脏层卵黄囊(vys)细胞围绕的胚状体,其中人类胚胎干细胞表达oct-4、表面阶段特异性胚胎抗原-3/4(ssea3/4)和上皮细胞粘附分子(epcam);(b)在允许胚状体细胞分化为包含内胚层和胰腺谱系细胞的细胞群的条件下培养步骤(a)的胚状体;(c)将步骤(b)的细胞群分散为单细胞;(d)对ssea3/4表达阳性细胞进行选择以从步骤(c)的细胞中清除未分化细胞;(e)对ssea-1表达阳性细胞进行选择以从步骤(d)的剩余细胞中清除vys细胞;以及(f)在步骤(e)剩余细胞中选择epcam表达阳性细胞以富集内胚层和胰腺谱系细胞。us7585672还公开了从衍生自人类胚胎干细胞的培养物中富集内胚层和胰腺谱系细胞的方法,该方法包括以下步骤:(a)培养人类胚胎干细胞的未受损集落以形成完整的、未受损的被脏层卵黄囊(vys)细胞围绕的胚状体,其中人类胚胎干细胞表达oct-4、表面阶段特异性胚胎抗原-3/4(ssea3/4)和上皮细胞粘附分子(epcam);(b)在允许胚状体细胞分化为包含内胚层和胰腺谱系细胞的细胞群的条件下培养步骤(a)的胚状体;(c)用有效量的成纤维细胞生长因子10(fgf10)处理步骤(b)的细胞群;以及(d)将步骤(c)的细胞群分散为富含内胚层和胰腺谱系细胞的单细胞;(e)对ssea-3/4表达阳性细胞进行选择以从步骤(d)的细胞中清除未分化干细胞;(f)对ssea-1表达阳性细胞进行选择以从步骤(e)的细胞中清除vys细胞;以及(g)在步骤(f)的剩余细胞中选择epcam表达阳性细胞以富集内胚层和胰腺谱系细胞。us7585672还公开了用于构建没有致瘤能力的干细胞衍生细胞群的富集方法,该方法包括以下步骤:(a)培养人类胚胎干细胞的未受损集落以形成完整的、未受损的被脏层卵黄囊(vys)细胞围绕的胚状体,其中人类胚胎干细胞表达oct-4、表面阶段特异性胚胎抗原-3/4(ssea3/4)和上皮细胞粘附分子(epcam);(b)在允许胚状体细胞分化为包含内胚层和胰腺谱系细胞的细胞群的条件下培养步骤(a)的胚状体;(c)将步骤(b)的细胞群分散为单细胞;(d)对ssea3/4表达阳性细胞进行选择以从步骤(c)的细胞中清除未分化细胞;(e)对ssea-1表达阳性细胞进行选择以从步骤(d)的细胞中清除vys细胞;以及(f)在步骤(e)的剩余细胞中选择epcam表达阳性细胞,由此得到的细胞注入免疫低下小鼠时不形成畸胎瘤。又如,us20050260749公开了从衍生自干细胞的培养物中富集内胚层和胰腺谱系细胞的方法,该方法包括以下步骤:培养干细胞到形成胚状体;以及在胚状体中选择物种相应(appropriate)细胞表面阶段特异性胚胎抗原的表达,并且仅培养不表达细胞表面阶段特异性抗原的胚状体以分化为内胚层和胰腺细胞。又如,us20100003749公开了分离的胰腺干细胞群,其中胰腺干细胞群富含cd133+cd49f+胰腺干细胞。us20100003749还公开了从原代胰腺组织中分离胰腺干细胞,通过以下步骤进行:从胰腺细胞、胰腺衍生细胞或胃肠衍生细胞群中选择cd133+、cd49f+或cd133+cd49f+的细胞;清除cd15+的细胞,其中剩余的细胞为cd15-;将剩余的细胞引入包含一种或多种生长因子的无血清培养基;以及使剩余细胞在培养基中增殖。又如,dorrell等人阐述道:“我们研发了一组新型的用于分离和研究人类胰腺所有主要细胞类型的细胞表面标记物。在用未受损的或解离的人类胰岛对balb/c小鼠进行消减免疫后选择杂交瘤细胞,并且通过免疫组织化学和流式细胞仪来评估细胞型特异性与细胞表面反应性。通过胰岛(泛内分泌(panendocrine)或α特异性的)和非胰岛类胰腺细胞亚群(外分泌与腺管)上的表面抗原的特异性结合来鉴定抗体。这些抗体单独或结合使用,以通过facs从原代人类胰腺分离α、β、外分泌腺或腺管细胞群,并且表征人类胰腺制品的详细细胞组成。它们也用于证实人类胰岛扩增培养物源于非内分泌细胞,并且胰岛素表达水平可以通过亚群体分选和转录因子pdx-1与ngn3过表达而增加至最高达正常胰岛细胞的1%,这相对于之前采用此培养体系得到的结果是个进步。这些方法使得可以分析和分离功能上不同的、具有细胞治疗潜力的胰腺细胞群。”(stemcellresearch,volume1,issue3,september2008,pages155-156(《干细胞研究》,第1卷,第3期,2008年9月,第155-156页))。又如,sugiyama等人阐述道:“我们最终鉴定了两种抗原,分别称为cd133和cd49f,可用于从小鼠中纯化ngn3+细胞。cd133(又称prominin-1)为功能未知的跨膜蛋白,并且是造血祖细胞和神经干细胞的已知标记物。cd49f又称α6整联蛋白,并且是层粘连蛋白的受体亚基。通过联合使用能识别cd133和cd49f的抗体,我们分级分离了四种不同的胰腺细胞群。免疫染色和rt-pcr表明cd49fhighcd133+细胞群(“级分i”,占投入的50%)主要包含表达carba的分化外分泌细胞。cd49flowcd133-级分(“级分iii”,占投入的10%)包含表达内分泌产物(如胰岛素和胰高血糖素)的激素+细胞。相反,cd49flowcd133+级分(“级分ii”,占投入的13%)包含ngn3+细胞,而不是激素+细胞。级分ii细胞的大约8%产生了可免疫染色的ngn3。在cd49f-cd133-级分中(“级分iv”,占投入的25%),我们没有检测到表达ngn3、carba或胰岛激素的细胞。”(diabetes,obesityandmetabolism,volume10,issues4,pages179-185(《糖尿病、肥胖症和代谢》,第10卷,第s4期,第179-185页))。又如,fujikawa等人阐述道:“当分选cd45-ter119-side-scatterlowgfphigh细胞时,具有高生长潜能的甲胎蛋白阳性的未成熟内胚层特征性细胞存在于此群体中。克隆分析和电子显微镜评估揭示,此群体的每个单细胞不仅可以分化为肝细胞,而且还可以分化为胆管上皮细胞,表明了其具有双谱系分化活性。当分析表面标记物时,它们为整联蛋白-α6和-β1阳性,却为c-kit和thy1.1阴性。(journalofhepatology,vol39,pages162-170(《肝脏病杂志》,第39卷,第162-170页))。又如,zhao等人阐述道:“在本研究中,我们首先鉴定了n-钙黏着蛋白为用于从hes细胞衍生物中纯化肝脏内胚层细胞的表面标记物,并且通过与小鼠胚胎基质饲养(sto)细胞共培养从纯化的肝脏内胚层细胞产生了肝脏祖细胞。这些肝脏祖细胞可扩增并传代超过100天。有趣的是,它们共表达了早期肝脏标记物afp和胆道谱系标记物krt7,表明它们为肝细胞和胆管上皮细胞的共同祖先。此外,这些祖细胞可大量扩增,同时仍保持双向分化为肝细胞样细胞和胆管上皮细胞样细胞的潜能,如基因表达和功能分析所验证。因此,这项工作提供研究肝脏发育的新体外模型,以及基于肝脏祖细胞的细胞疗法新来源。”(plosone4(7):e6468.doi:10.1371/joumal.pone.0006468)。又如,cai等人阐述道:“为了进一步提高pdx1+细胞纯度,我们使用cxcr4…分选了激活蛋白a-诱导的细胞,cxcr4为es细胞衍生的内胚层细胞的标记物。用cxcr4进行分选富集了内胚层细胞群,因为cxcr4+细胞群中几乎所有细胞对内胚层细胞标记物sox17均呈阳性,并且>90%的细胞对foxa2呈阳性。”(journalofmolecularcellbiology(《分子细胞生物学杂志》),最早于2009年11月12日在线先行出版。journalofmolecularcellbiology20102(1):50-60(《分子细胞生物学杂志》,2010年,第2卷,第1期,第50-60页);doi:10.1093/jmcb/mjp037)。又如,koblas等人阐述道:“我们发现人类cd133-阳性胰腺细胞群包含表达神经发生素-3的内分泌祖细胞和表达人类端粒酶、abcg2、oct-3/4、nanog以及rex-1(多能干细胞的标记物)的细胞。这些细胞能够在体外分化为产胰岛素细胞,并且以葡萄糖依赖性方式分泌c肽。基于我们的结果,我们认为cd133分子代表另一种适于鉴定和分离胰腺内分泌祖细胞的细胞表面标记物。”(transplantproc.2008mar;40(2):415-8(《移植学报》,2008年3月,第40卷,第2期,第415-418页))。又如,sugiyama等人阐述道:“我们发现cd133由ngn3+细胞所表达。cd133似乎定位于胰腺导管上皮细胞的顶膜。”(pnas2007104:175-180(《美国国家科学院院刊》,2007年,第104卷,第175-180页);印刷前在线发表于2006年12月26日,doi:10.1073/pnas.0609490104)。又如,kobayashi等人阐述道:“已知胚胎胰腺上皮和后来的导管上皮会产生发育中的胰腺的内分泌和外分泌细胞,但是还没有鉴定出这些细胞的特异性表面标记物。在此,我们利用二花豆凝集素(dolichosbiflorusagglutinin,dba)作为发育中小鼠胰腺中的这些上皮细胞的特异性标记物。由使用荧光素dba和胰腺特异性细胞标记物进行的免疫荧光研究的结果,我们发现dba能特异性检测上皮细胞,但既不能区分内分泌细胞也不能区分腺泡细胞。我们还在免疫磁性分离系统(dynabead系统)中应用了此标记物,以从混合的发育中胰腺细胞群纯化这些假定的多能细胞。此程序可应用于研究发育中胰腺中的分化和细胞谱系选择,还可应用于为潜在的细胞工程选择胰腺前体细胞。”(biochemicalandbiophysicalresearchcommunications,volume293,issue2,3may2002,pages691-697(《生物化学与生物物理学研究通讯》,第293卷,第2期,2002年5月3日,第691-697页))。对衍生自多能干细胞的细胞所表达的标记物进行鉴定将增进对这些细胞的认识,有助于其体内和体外鉴定,并将使它们能在体外进行阳性富集供研究和利用。因此,仍需要可用于分离和表征衍生自多能干细胞的细胞(尤其是表达胰腺内分泌谱系特征性标记物的细胞)的手段。技术实现要素:在一个实施例中,本发明提供将多能干细胞群分化为表达胰腺内分泌谱系特征性标记物的细胞群的方法,该方法包括以下步骤:a.培养多能干细胞群,b.使该多能干细胞群分化为表达定形内胚层谱系特征性标记物的细胞群,c.使该表达定形内胚层谱系特征性标记物的细胞群分化为表达原肠管谱系特征性标记物的细胞,d.使该表达原肠管谱系特征性标记物的细胞群分化为表达胰腺内胚层谱系特征性标记物的细胞群,以及e.使该表达胰腺内胚层谱系特征性标记物的细胞群分化为表达胰腺内分泌谱系特征性标记物的细胞群。在一个实施例中,将表达胰腺内分泌谱系特征性标记物的细胞群移植入动物体内,其中表达胰腺内分泌谱系特征性标记物的细胞形成产胰岛素细胞。在一个实施例中,通过在移植前富集细胞群中表达胰腺内分泌谱系特征性标记物的细胞,来提高产胰岛素细胞的形成效率。在一个实施例中,通过在移植后测量c肽的表达达到可检测水平所需时间,来确定产胰岛素细胞的形成效率。在一个替代实施例中,该富集可降低在移植后移植细胞形成畸胎瘤的能力。附图说明图1显示了通过实时pcr检测的neurod(小图a)、ngn3(小图b)、pdx1(小图c)、nkx6.1(小图d)、nkx2.2(小图e)和pax4(图f)在cd56+cd13-、cd56-cd13-和cd56-cd13+细胞群中的表达。所示表达倍数是相对于未分化h1胚胎干细胞而言的。图2显示了通过实时pcr检测的neurod(小图a)、ngn3(小图b)、pdx1(小图c)、nkx6.1(小图d)、nkx2.2(小图e)和pax4(小图f)在用cd133抗体分选的细胞群中的表达。所示表达倍数是相对于未分化h1胚胎干细胞而言的。图3显示了通过实时pcr检测的neurod(小图a)、ngn3(小图b)、pdx1(小图c)和nkx6.1(小图d)在用cd49c抗体分选的细胞群中的表达。所示表达倍数是相对于未分化h1胚胎干细胞而言的。图4显示了通过实时pcr检测的neurod(小图a)、ngn3(小图b)、pdx1(小图c)、nkx6.1(小图d)、胰岛素(小图e)和胰高血糖素(小图f)在用cd56和cd15抗体分选的细胞群中的表达。所示表达倍数是相对于未分化h1胚胎干细胞而言的。图5显示了通过实时pcr检测的neurod(小图a)、ngn3(小图b)、pdx1(小图c)、nkx6.1(小图d)、nkx2.2(小图e)、pax-4(小图f)、胰高血糖素(小图g)和胰岛素(小图h)在用cd15抗体分选的细胞群中的表达。所示表达倍数是相对于未分化h1胚胎干细胞而言的。图6显示了通过实时pcr检测的neurod(小图a)、ngn3(小图b)、pdx1(小图c)、nkx6.1(小图d)、nkx2.2(小图e)、胰岛素(小图f)和胰高血糖素(小图g)在用cd56和cd57抗体分选的细胞群中的表达。所示表达倍数是相对于未分化h1胚胎干细胞而言的。图7显示了通过实时pcr检测的zic1(小图a)、白蛋白(小图b)、cdx2(小图c)、ngn3(小图d)、pax4(小图e)、neurod(小图f)、nkx6.1(小图g)、ptf1α(小图h)和pdx1(小图i)在用cd56和cd184抗体分选的细胞群中的表达。所示表达倍数是相对于未分化h1胚胎干细胞而言的。图8显示了通过实时pcr检测的neurod(小图a)、ngn3(小图b)、胰岛素(小图c)和胰高血糖素(小图d)在用cd98抗体分选的细胞群中的表达。所示表达倍数是相对于未分化h1胚胎干细胞而言的。图9显示了通过实时pcr检测的neurod(小图a)、ngn3(小图b)、pdx1(小图c)、nkx6.1(小图d)、nkx2.2(小图e)和pax4(小图f)在用cd47抗体分选的细胞群中的表达。所示表达倍数是相对于未分化h1胚胎干细胞而言的。图10显示了通过实时pcr检测的pdx-1(小图a)、nkx6.1(小图b)、nkx2.2(小图c)、pax-4(小图d)、ptf1α(小图e)、ngn3(小图f)、胰岛素(小图g)和胰高血糖素(小图h)在用cd47抗体分选的细胞群中的表达。所示表达倍数是相对于未分化h1胚胎干细胞而言的。图11显示了通过实时pcr检测的hnf4α(小图a)和lif受体(小图b)在用lif受体的抗体分选的细胞群中的表达。所示表达倍数是相对于实例1中概述的分化方案的第ii阶段第2天的未分选细胞而言的。图12显示了通过实时pcr检测的oct4(小图a)、nanog(小图b)、sox2(小图c)和goosecoid(小图d)在用磁珠去除了表达ssea4的细胞的细胞群中的表达。所示表达倍数是相对于未分化h1胚胎干细胞而言的。图13显示了通过实时pcr检测的oct4(小图a)、nanog(小图b)、sox2(小图c)和goosecoid(小图d)在用facs去除了表达ssea4的细胞的细胞群中的表达。所示表达倍数是相对于未分化h1胚胎干细胞而言的。具体实施方式为了清晰说明本公开内容,以非限制性方式将本发明的具体实施方式分成下列描述或阐明本发明某些特征、实施例或应用的小节。定义“β-细胞谱系”是指对于转录因子pdx-1和下列转录因子中的至少一种具有阳性基因表达的细胞:ngn3、nkx2.2、nkx6.1、neurod、isl1、hnf-3β、mafa、pax4和pax6。表达β细胞谱系特征性标记物的细胞包括β细胞。如本文所用,“表达定形内胚层谱系特征性标记物的细胞”指表达至少一种如下标记物的细胞:sox17、gata4、hnf-3β、gsc、cer1、nodal、fgf8、brachyury、mix样同源盒蛋白、fgf4、cd48、脱中胚蛋白(eomes)、dkk4、fgf17、gata6、cd184、c-kit、cd99或otx2。表达定形内胚层谱系特征性标记物的细胞包括原条前体细胞、原条细胞、中内胚层细胞和定形内胚层细胞。“表达原肠管谱系特征性标记物的细胞”指表达至少一种如下标记物的细胞:hnf-1β或hnf-4α。如本文所用,“表达胰腺内胚层谱系特征性标记物的细胞”指表达至少一种如下标记物的细胞:pdx1、hnf-1β、ptf-1α、hnf6或hb9。表达胰腺内胚层谱系特征性标记物的细胞包括胰腺内胚层细胞。如本文所用,“表达胰腺内分泌谱系特征性标记物的细胞”指表达至少一种如下标记物的细胞:ngn3、neurod、isl1、pdx1、nkx6.1、pax4、ngn3或ptf-1α。表达胰腺内分泌谱系特征性标记物的细胞包括胰腺内分泌细胞、胰腺激素表达细胞和胰腺激素分泌细胞以及β-细胞谱系的细胞。如本文所用,“定形内胚层”指具有在原肠胚形成过程中从上胚层产生的细胞的特性并形成胃肠道及其衍生物的细胞。定形内胚层细胞表达下列标记物:cd184、hnf-3β、gata4、sox17、cerberus、otx2、goosecoid、c-kit、cd99和mixl1。如本文所用,“标记物”是在所关注的细胞中差异表达的核酸或多肽分子。就此而论,差异表达意指阳性标记物的水平增加,而阴性标记物的水平降低。标记物核酸或多肽的可检测水平在所关注细胞中充分地高于或低于在其他细胞中,使得可使用多种本领域公知的方法中的任何一种将所关注细胞与其他细胞鉴别和区分开来。如本文所用,“胰腺内分泌细胞”或“胰腺激素表达细胞”指能够表达至少一种下列激素的细胞:胰岛素、胰高血糖素、生长抑素和胰腺多肽。如本文所用,“胰腺激素分泌细胞”指能够分泌至少一种以下激素的细胞:胰岛素、胰高血糖素、生长抑素和胰多肽。如本文所用,“前原条细胞”指表达至少一种以下标记物的细胞:nodal或fgf8。如本文所用,“原条细胞”指表达至少一种以下标记物的细胞:brachyury、mix样同源盒蛋白或fgf4。干细胞是由它们在单细胞水平上既自我更新又分化产生子代细胞的能力来定义的未分化细胞,包括自我更新祖细胞、非更新祖细胞和末端分化细胞。干细胞的特征还在于:其具有在体外由多种胚层(内胚层、中胚层和外胚层)分化成各种细胞谱系的功能细胞,以及在移植后产生多种胚层的组织和注入胚泡后基本上促成大多数(如果不是所有的话)组织的能力。干细胞根据其发育潜能分为:(i)全能,指能够产生所有的胚胎和胚胎外细胞类型;(ii)多能,指能够产生所有的胚胎细胞类型;(iii)专能,指能够产生细胞谱系的亚群,但所有细胞谱系都只分布于特定组织、器官或生理系统内(例如造血干细胞(hsc)可产生的后代细胞包括:hsc(自我更新)、局限于血细胞的寡能祖细胞以及作为血液正常组分的所有细胞类型和成分(例如血小板));(iv)寡能,指能够产生比专能干细胞更局限的细胞谱系亚群;以及(v)单能,指能够产生单一细胞谱系(如生精干细胞)。分化是未特化的(“未定向的”)或特化不足的细胞获得特化细胞(如神经细胞或肌肉细胞)的特征的过程。分化的细胞或分化诱导的细胞是已经在细胞谱系中占据更特化的(“定向的”)位置的细胞。术语“定向的”当应用于分化过程时,指在分化途径中已经进行到这么一种程度的细胞:在正常环境下,它会继续分化成特定的细胞类型或细胞类型亚群,且在正常环境下不能分化成另一细胞类型或回复到分化程度较低的细胞类型。去分化是指细胞回复至细胞谱系内特化(或定向)程度较低的位置的过程。如本文所用,细胞谱系限定了细胞遗传性,也就是说,它来自哪些细胞和它能够产生什么细胞。细胞谱系将细胞定位于发育和分化的遗传计划内。谱系特异性标记物指与所关注谱系的细胞的表型明确相关的特征,可用来评估未定向细胞向所关注谱系的分化。有多个术语用于描述培养中的细胞。“维持”一般是指将细胞放置在处于这样的条件的生长培养基中,所述条件有利于细胞生长和/或分裂,会或不会产生更大的细胞群。“传代”指将细胞从一个培养容器移除并将它们放置在处于有利于细胞生长和/或分裂的条件下的第二个培养容器中的过程。细胞的特定群体或细胞系,有时由它已被传代的次数来指称或表征。例如,已传代十次的培养细胞群可以称为p10培养物。原代培养物(即,细胞从组织分离后的首次培养物)被指定为p0。在第一次继代培养后,细胞被描述为次代培养物(p1或第1代)。在第二次继代培养后,细胞变成三代培养物(p2或第2代),依此类推。本领域技术人员会理解,在传代期间可能有许多次群体倍增;因此培养物的群体倍增数目大于传代数目。细胞在传代间隔的时间内的扩增(即,群体倍增数)取决于多种因素,包括(但不限于)接种密度、基材、培养基、生长条件和传代间隔的时间。表达胰腺内分泌谱系特征性标记物的细胞的富集在一个实施例中,本发明提供将多能干细胞群分化为表达胰腺内分泌谱系特征性标记物的细胞群的方法,该方法包括以下步骤:a.培养多能干细胞群,b.使该多能干细胞群分化为表达定形内胚层谱系特征性标记物的细胞群,c.使该表达定形内胚层谱系特征性标记物的细胞群分化为表达原肠管谱系特征性标记物的细胞,d.使该表达原肠管谱系特征性标记物的细胞群分化为表达胰腺内胚层谱系特征性标记物的细胞群,以及e.使该表达胰腺内胚层谱系特征性标记物的细胞群分化为表达胰腺内分泌谱系特征性标记物的细胞群。在一个实施例中,将表达胰腺内分泌谱系特征性标记物的细胞群移植入动物体内,其中表达胰腺内分泌谱系特征性标记物的细胞形成产胰岛素细胞。在一个实施例中,通过在移植前富集表达胰腺内分泌谱系特征性标记物的细胞群,来提高产胰岛素细胞的形成效率。在一个实施例中,通过在移植后测量c肽表达达到可检测水平所需时间,来确定产胰岛素细胞的形成效率。在一个替代实施例中,富集降低了在移植后移植细胞形成畸胎瘤的能力。通过细胞表面上存在的抗原结合到特异性结合该细胞表面抗原的试剂,来鉴定或选择表达胰腺内分泌谱系标记物的细胞。在一个替代实施例中,表达胰腺内分泌谱系特征性标记物的细胞在移植入动物体内之前进一步分化为产胰岛素细胞。通过细胞表面上存在的抗原结合到特异性结合该细胞表面抗原的试剂,来鉴定或选择产胰岛素细胞。在一个替代实施例中,本发明提供使多能干细胞群分化为表达胰腺内分泌谱系特征性标记物的细胞群的方法,该方法包括以下步骤:a.培养多能干细胞群,b.使该多能干细胞群分化为表达定形内胚层谱系特征性标记物的细胞群,c.使该表达定形内胚层谱系特征性标记物的细胞群分化为表达原肠管谱系特征性标记物的细胞,d.富集该表达原肠管谱系特征性标记物的细胞群,e.使该表达原肠管谱系特征性标记物的细胞群分化为表达胰腺内胚层谱系特征性标记物的细胞群,以及f.使该表达胰腺内胚层谱系特征性标记物的细胞群分化为表达胰腺内分泌谱系特征性标记物的细胞群。在一个实施例中,将表达胰腺内分泌谱系特征性标记物的细胞群移植入动物体内,其中表达胰腺内分泌谱系特征性标记物的细胞形成产胰岛素细胞。在一个实施例中,通过在移植前富集该表达原肠管谱系特征性标记物的细胞群,来提高产胰岛素细胞的形成效率。通过细胞表面上存在的抗原结合到特异性结合该细胞表面抗原的试剂,来鉴定或选择表达原肠管谱系标记物的细胞。有利于富集表达胰腺内分泌谱系特征性标记物的细胞的表面抗原在一个实施例中,移植进入动物之前,将表达胰腺内分泌谱系特征性标记物的细胞群用至少一种能够结合选自cd9、cd13、cd15、cd47、cd56、cd73、cd117、cd133、cd184、cd200、cd318、cd326和ssea4的标记物的试剂处理。在一个实施例中,用至少一种试剂处理得到表达胰腺内分泌谱系特征性标记物的细胞群,所述细胞呈cd56表达阳性,标记物cd13表达阴性。在一个实施例中,用至少一种试剂处理得到表达胰腺内分泌谱系特征性标记物的细胞群,所述细胞呈cd56表达阳性,标记物cd15表达阴性。在一个实施例中,用至少一种试剂处理得到表达胰腺内分泌谱系特征性标记物的细胞群,所述细胞呈cd133表达阴性。在一个实施例中,用至少一种试剂处理得到表达胰腺内分泌谱系特征性标记物的细胞群,所述细胞呈cd15表达阴性。在一个实施例中,用至少一种试剂处理得到表达胰腺内分泌谱系特征性标记物的细胞群,所述细胞呈cd184表达阳性。在一个实施例中,用至少一种试剂处理得到表达胰腺内分泌谱系特征性标记物的细胞群,所述细胞呈ssea4表达阴性。有利于富集产胰岛素细胞的表面抗原在一个实施例中,移植进入动物前,表达胰腺内分泌谱系特征性标记物的细胞群进一步分化为产胰岛素细胞群。将产胰岛素细胞群用至少一种能够结合选自cd47、cd56、cd57、cd98和ssea4的标记物的试剂处理。在一个实施例中,用至少一种试剂处理得到产胰岛素细胞群,所述细胞呈cd56和cd57表达阳性。作为另外一种选择,产胰岛素细胞群可呈cd98表达阳性。作为另外一种选择,产胰岛素细胞群可呈cd47表达阴性。在一个实施例中,用至少一种试剂处理得到产胰岛素细胞群,所述细胞呈标记物ssea4表达阴性。cd13在大多数外周血单核细胞和粒细胞上表达。它也通过骨髓胚细胞危象(myeloidblastcrisis)中的的大多数急性骨髓性白血病、慢性骨髓性白血病,少数淋巴性白血病和骨髓细胞系而被表达。cd13也存在于若干种类型的非造血细胞如成纤维细胞和内皮细胞中,并且以可溶形式存在于血浆中。cd13不在b细胞、t细胞、血小板或红血球上表达。cd13在生物活性肽代谢、生长和分化控制、吞噬作用和杀菌/杀肿瘤活性中发挥作用。cd13还作为人冠状病毒(hcv)的受体。cd15是可在糖蛋白、糖脂和蛋白聚糖上表达的糖粘附分子。cd15介导可见于中性粒细胞上的吞噬作用和趋化作用;在霍奇金病、一些β细胞慢性淋巴细胞性白血病、急性淋巴母细胞性白血病和大多数急性非淋巴细胞性白血病患者中表达。它也称为lewisx和ssea-1(阶段特异性胚胎抗原1),并且代表鼠科多能干细胞的标记物,其中它在植入前胚胎中的细胞的粘附和迁移中具有重要作用。cd47是膜蛋白,它与细胞粘附于胞外基质时发生的胞内钙浓度增加有关。该蛋白也是血小板反应蛋白的c-端细胞结合域的受体,并且可在膜转运和信号转导中发挥作用。cd56也称为神经细胞粘附分子(ncam),它是在神经元、胶质、骨骼肌和自然杀伤细胞的表面上表达的嗜同性结合糖蛋白。已指出ncam在细胞-细胞粘附、神经突长出、突触可塑性以及学习和记忆中发挥作用。cd57也称为hnk-1或leu-7,它是某些细胞类型的胞外蛋白上检测到的抗原性低聚糖部分。在血液中,cd57存在于15-20%的单个核细胞(mononuclearcell)中,包括nk和t细胞亚群,但不存在于红细胞、单核细胞(monocyte)、粒细胞或血小板中。另外,cd57表达可见于多种神经细胞类型上。cd98是包含大型中性氨基酸转运蛋白(lat1)轻亚基的糖蛋白。lat1是优先转运中性支链氨基酸(缬氨酸、亮氨酸、异亮氨酸)和芳族氨基酸(色氨酸、酪氨酸)的异型二聚体膜转运蛋白。cd133是糖蛋白,在人和啮齿动物中也称为prominin1(prom1)。它是五次跨膜糖蛋白(5次跨膜,5-tm)成员,特异性地定位于细胞突起。cd133在造血干细胞、内皮祖细胞、胶质母细胞瘤、神经元和胶质干细胞中表达。参见corbeiletal,biochembiophysrescommun285(4):939-44,2001(corbeil等人,《生物化学和生物物理研究通讯》,第285卷,第4期,第939-944页,2001年)。doi:10.1006/bbrc.2001.5271.pmid11467842。有利于富集表达原肠管谱系特征性标记物的细胞的表面抗原在一个替代实施例中,本发明提供使多能干细胞群分化为表达胰腺内分泌谱系特征性标记物的细胞群的方法,该方法包括以下步骤:a.培养多能干细胞群,b.使该多能干细胞群分化为表达定形内胚层谱系特征性标记物的细胞群,c.使该表达定形内胚层谱系特征性标记物的细胞群分化为表达原肠管谱系特征性标记物的细胞,d.富集该表达原肠管谱系特征性标记物的细胞群,e.使该表达原肠管谱系特征性标记物的细胞群分化为表达胰腺内胚层谱系特征性标记物的细胞群,以及f.使该表达胰腺内胚层谱系特征性标记物的细胞群分化为表达胰腺内分泌谱系特征性标记物的细胞群。在一个实施例中,将表达胰腺内分泌谱系特征性标记物的细胞群移植入动物体内,其中表达胰腺内分泌谱系特征性标记物的细胞形成产胰岛素细胞。在一个实施例中,通过在移植前富集该表达原肠管谱系特征性标记物的细胞群,来提高产胰岛素细胞的形成效率。将表达原肠管谱系特征性标记物的细胞群用至少一种能够结合lif受体的试剂处理。可以富集、清除、离析、分离、分选和/或纯化表达胰腺内分泌谱系特征性标记物的细胞、表达原肠管谱系特征性标记物的细胞或产胰岛素细胞,如实例中进一步描述。如本文所用,术语“富集”或“纯化”或由于清除其他已知细胞群而富集或纯化,表示细胞经过了某种选择过程,从而使群体得到富集和/或纯化。另外,受试细胞也被视为相对富集的和/或纯化的,即与另一个细胞群相比,或与“富集”或“纯化”前的多能干细胞相比,或与原来或初始的细胞培养物相比,明显存在更多的特定的分化细胞群。富集或纯化给定的分化细胞类型可以涉及从另一种细胞类型中“清除”或“分离”或“分选”一种或多种已知的细胞类型。在一个实施例中,可以通过清除不期望的分化细胞类型来纯化细胞群。可能有利的是,通过清除已知或未知细胞类型的培养物来富集和纯化表达胰腺内分泌谱系特征性标记物的细胞。这样,富集或纯化的细胞群不会有结合或连接的抗体。因为不需要从纯化的群体去除抗体,所以可改善富集或纯化的细胞在细胞治疗中的用途。富集、清除、离析、分离、分选和/或纯化的方法可以包括例如选择性培养条件,其中所述培养条件不利于任何不期望的细胞类型。富集、清除、离析、分离、分选和/或纯化的方法也可以包括例如抗体包被的磁珠、亲和色谱法和用附着在固体基质或固相捕获介质(如平板、色谱柱)的抗体“淘选”或其他简便且可用的技术。提供准确分离的技术包括流式细胞术方法,这类方法可用于测量细胞表面和细胞内参数,以及形态变化和颗粒度,并且用于分析用作抗体或探针连接试剂的磁珠。流式细胞术测定的读出值包括(但不限于)与各个荧光抗体检测细胞表面分子或细胞因子相关的平均荧光,或者平均荧光强度、中值荧光强度、荧光强度变化,或者它们之间的某种关系。在包括涉及流式细胞术的分析步骤的实施例的一些方面,磁珠的最小参数或特性是散射(fs和/或ss)和至少一个荧光波长。流式细胞术可用于定量参数,例如细胞表面蛋白或其构象或翻译后修饰的存在;细胞内蛋白或分泌蛋白,其中透化作用允许抗体(或探针)进入等等。流式细胞术方法在本领域是已知的,并且在如下文献中有描述:flowcytometryandcellstoring(springerlabmanual),radbruch,ed.,springerverlag,2000(《流式细胞术和细胞分选(施普林格实验室手册)》,radbruch编辑,施普林格出版社,2000年);ormerod,flowcytometry,springerverlag,1999(ormerod,《流式细胞术》,施普林格出版社,1999年);flowcytometryprotocols(methodsinmolecularbiology,no91),jaroszeskiandheller,eds.,humanapress,1998(《流式细胞术方案(分子生物学方法,第91卷)》,jaroszeski和heller编辑,胡马纳出版社,1998年);currentprotocolsincytometry,robinsonetal.,eds,johnwiley&sons,newyork,n.y.,2000(《流式细胞术实验室指南》,robinson等人编辑,约翰·威利父子出版公司,纽约州纽约市,2000年)。细胞的染色强度可以通过流式细胞术监测,其中激光检测荧光染料的定量水平(该水平与特异性试剂(如抗体)所结合的细胞表面标记物的量成比例)。流式细胞术或facs也可用于根据结合特异性试剂的强度,以及其他参数如细胞大小和光散射来分离细胞群。虽然绝对染色水平可随着具体荧光染料和试剂制备物而有所差别,但数据可以归一化到对照。为了将分布归一化到对照,将每个细胞记录为具有具体染色强度的数据点。为了将分布归一化到对照,将每个细胞记录为具有具体染色强度的数据点。这些数据点可以根据对数标尺显示,其中度量单位为任意染色强度。在一个例子中,把细胞群中最亮的细胞指定为强度比最低染色水平的细胞大4个对数。当这样显示时,显而易见的是,落入最高染色强度对数范围的细胞是明亮的,而最低强度的细胞是阴性的。落入染色强度的2-3个对数范围的“低”染色细胞可具有不同于阴性和阳性细胞的特性。另选的对照可以利用其表面上具有确定密度的标记物的基材,例如提供强度阳性对照的制造磁珠或细胞系。“低”标识表示染色水平大于同种型匹配对照的亮度,但强度不如通常存在于群体中的最亮的染色细胞。所选参数的读出值能够同时读取,或在单次分析期间依次读取,例如通过使用细胞表面分子的荧光抗体。作为一个例子,这些分子可以被不同的荧光染料、荧光磁珠、标签(如量子点)等标记,使得可通过流式细胞术同时分析多达4种或更多种的荧光色。例如,阴性标识表示染色水平等于或低于同种型匹配阴性对照的亮度;而暗淡标识表示染色水平可接近阴性染色的水平,但也可比同种型匹配对照要亮。各个细胞(例如不同细胞类型或细胞类型变体)的标识符可以是荧光的,例如用不同水平的荧光化合物标记不同单位细胞类型,及上文所述的类似标识符。在要混合两种细胞类型的实施例的一些方面,一种细胞类型是经标记的,而另一种是未标记的。在要包括三种或更多种细胞类型的实施例的一些方面,每种细胞类型可以通过与不同浓度的标记化合物温育,或温育不同的时间而标记上不同水平的荧光。作为大量细胞的标识符,可以使用两种或更多种不同的荧光颜色的荧光标记强度矩阵,使得被标识的不同单位细胞类型的数量为一种颜色(如羧基荧光素琥珀酰亚胺酯(cfse))的荧光水平的数量乘以第二种颜色(如四甲基罗丹明异硫氰酸酯(tritc)等等)采用的荧光水平的数量乘以第三种颜色水平的数量等等。作为另外一种选择,不同细胞类型的固有光散射特性或在分析中所包括的测试参数的biomap特性,可作为荧光标签的补充来使用或者取代荧光标签来使用,作为单位细胞类型标识符。在另一方面,可以使用常规的亲和或抗体技术富集、清除、分离、分选和/或纯化细胞。例如,配体和/或抗体可以与如下标签缀合,以使特定细胞类型的分离变得容易:如磁珠;生物素,其与抗生物素蛋白或链霉抗生物素蛋白以高亲和力结合;荧光染料,其可用于荧光激活细胞分选仪;半抗原等等。在一个实施例中,本文所述的配体、试剂和/或抗体可以直接或间接缀合到磁性试剂,例如超顺磁性微粒(微粒)。与磁性颗粒的直接缀合可以通过使用本领域已知的各种化学连接基团实现。在一些实施例中,抗体通过侧链氨基或巯基和杂官能团交联试剂连接到微粒。有大量杂官能团化合物可用于连接到实体(entity)。例如,至少可以使用在抗体上具有活性巯基并且在磁性颗粒上具有活性氨基的3-(2-吡啶二硫代)丙酸n-羟基琥珀酰亚胺酯(spdp)或4-(n-马来酰亚胺基甲基)-环己烷-1-甲酸n-羟基琥珀酰亚胺酯(smcc)。磁性分离装置的例子在wo90/07380、pct/us96/00953和ep438,520中有描述,这些专利全文以引用方式并入本文。纯化的细胞群可以收集在任何适当的培养基中。合适的培养基可以包括例如达尔伯克氏改良伊格尔培养基(dmem)、汉克氏基本盐溶液(hbss)、达尔伯克氏磷酸盐缓冲盐水(dpbs)、rpmi、伊斯考夫改良达尔伯克氏培养基(imdm)、含5mmedta的磷酸盐缓冲盐水(pbs)等等,通常补充有胎牛血清(fcs)、牛血清白蛋白(bsa)、人血清白蛋白(hsa)和stempro®hescsfm。在一个实施例中,表达胰腺内分泌谱系特征性标记物的细胞通过用至少一种能选择不表达胰腺内分泌谱系特征性标记物的细胞的试剂进行处理来富集。在一个替代实施例中,表达胰腺内分泌谱系特征性标记物的细胞通过用至少一种能选择产胰岛素细胞的试剂进行处理来富集。与未处理的细胞群或细胞培养物相比,使用本文所述的方法,细胞群或细胞培养物可以在细胞含量上富集至少约2至约1000倍。在一些实施例中,与未处理的细胞群或细胞培养物相比,表达胰腺内分泌谱系特征性标记物的细胞可以富集至少约5至约500倍。在其他实施例中,与未处理的细胞群或细胞培养物相比,表达胰腺内分泌谱系特征性标记物的细胞可以富集至少约10至约200倍。在其他实施例中,与未处理的细胞群或细胞培养物相比,表达胰腺内分泌谱系特征性标记物的细胞可以富集至少约20至约100倍。在其他实施例中,与未处理的细胞群或细胞培养物相比,表达胰腺内分泌谱系特征性标记物的细胞可以富集至少约40至约80倍。在某些实施例中,与未处理的细胞群或细胞培养物相比,表达胰腺内分泌谱系特征性标记物的细胞可以富集至少约2至约20倍。衍生自多能干细胞的细胞的表征可以通过测定给定分化细胞类型特征性标记物的表达来确定分化细胞从多能干细胞的形成。在一些实施例中,通过某个标记物的表达或超过一个标记物的不同表达水平和模式来进行分化细胞的鉴定和表征。具体地讲,一个或多个标记物存在与否、高或低表达可代表和鉴定细胞类型。另外,某些标记物可以具有瞬时表达,因此标记物在发育的一个阶段高表达,而在发育的另一个阶段低表达。某些标记物的表达可以通过测量标记物存在于细胞培养物或细胞群的细胞中的、与标准化或归一化对照标记物相比的水平来确定。在这种过程中,标记物表达的测量可以是定性的或定量的。一种定量标记物基因所产生的标记物的表达的方法是通过使用定量pcr(q-pcr)。q-pcr的操作方法是本领域熟知的。还可使用本领域已知的其他方法定量标记物基因的表达。例如,标记物基因产物的表达可以使用对所关注的标记物基因产物具有特异性的抗体来检测(如蛋白质印迹、流式细胞术分析等等)。在某些实施例中,可以确定分化细胞特征性标记物基因的表达,以及分化细胞特征性标记物基因的明显表达的缺失。组织特异性基因产物的表达也可以通过rna印迹分析、斑点印迹杂交分析,或通过逆转录酶启动的聚合酶链式反应(rt-pcr)(使用序列特异性引物,以标准扩增方法进行)在mrna水平上检测。更多细节见美国专利no.5,843,780。本公开说明书中列出的具体标记物的序列数据可以从公用数据库例如genbank获得。多能干细胞可表达阶段特异性胚胎抗原(ssea)3和4中的一种或多种以及可用称为tra-1-60和tra-1-81的抗体检测的标记物(thomsonetal.,science282:1145,1998(thomson等人,《科学》,第282卷,第1145页,1998年))。多能干细胞体外分化导致丧失ssea-4、tra1-60和tra1-81的表达(如果存在的话),并且增加ssea-1的表达。未分化的多能干细胞通常具有碱性磷酸酶活性,该酶可通过用4%多聚甲醛固定细胞,然后用vectorred作为底物显影来检测,如生产商所描述(加州伯林盖姆媒介实验室(vectorlaboratories,burlingamecalif))。未分化的多能干细胞通常也表达oct4和tert,这通过rt-pcr检测。胰腺内胚层谱系特征性标记物选自pdx1、hnf1β、ptf1α、hnf6、hb9和prox1。适用于本发明的是表达至少一种胰腺内胚层谱系特征性标记物的细胞。在本发明的一个方面,表达胰腺内胚层谱系特征性标记物的细胞为胰腺内胚层细胞。定形内胚层谱系特征性标记物选自sox17、gata4、hnf3β、gsc、cer1、nodal、fgf8、brachyury、mix样同源盒蛋白、fgf4、cd48、脱中胚蛋白(eomes)、dkk4、fgf17、gata6、cd184、c-kit、cd99和otx2。适用于本发明的是表达至少一种定形内胚层谱系特征性标记物的细胞。在本发明的一个方面,表达定形内胚层谱系特征性标记物的细胞为原条前体细胞。在另一方面,表达定形内胚层谱系特征性标记物的细胞是中内胚层细胞。在另一方面,表达定形内胚层谱系特征性标记物的细胞是定形内胚层细胞。胰腺内分泌谱系特征性标记物选自ngn3、neurod、isl1、pdx1、nkx6.1、pax4、ngn3和ptf-1α。在一个实施例中,胰腺内分泌细胞能够表达以下激素中的至少一种:胰岛素、胰高血糖素、生长抑素和胰多肽。适用于本发明的是表达至少一种胰腺内分泌谱系特征性标记物的细胞。在本发明的一个方面,表达胰腺内分泌谱系特征性标记物的细胞为胰腺内分泌细胞。胰腺内分泌细胞可为表达胰腺激素的细胞。作为另外一种选择,胰腺内分泌细胞可为分泌胰腺激素的细胞。在本发明的一个方面,胰腺内分泌细胞是表达β细胞谱系特征性标记物的细胞。表达β细胞谱系特征性标记物的细胞可表达pdx1和至少一种下列转录因子:ngn3、nkx2.2、nkx6.1、neurod、isl1、hnf3β、mafa、pax4和pax6。在本发明的一个方面,表达β细胞谱系特征性标记物的细胞是β细胞。多能干细胞多能干细胞的表征多能干细胞可表达阶段特异性胚胎抗原(ssea)3和4中的一种或多种以及可用称为tra-1-60和tra-1-81的抗体检测的标记物(thomsonetal.,science282:11451998(thomson等人,《科学》,第282卷,第1145页,1998年))。多能干细胞体外分化导致丧失ssea-4、tra-1-60和tra-1-81的表达(如果存在的话),并且增加ssea-1的表达。未分化的多能干细胞通常具有碱性磷酸酶活性,该酶可通过用4%多聚甲醛固定细胞,然后用vectorred作为底物显影来检测,如生产商所描述(加州伯林盖姆媒介实验室(vectorlaboratories,burlingamecalif))。未分化的多能干细胞还通常表达oct-4和tert,这通过rt-pcr检测。增殖的多能干细胞的另一理想表型是分化成所有三个胚层即内胚层、中胚层和外胚层组织的细胞的潜能。可以例如通过如下方式来确认干细胞的多能性:将细胞注射入重症联合免疫缺陷(scid)小鼠,使用4%的多聚甲醛固定形成的畸胎瘤,然后对其进行组织学检测,找出来自三个胚层的细胞类型的证据。作为另外一种选择,可以通过产生胚状体并评估胚状体中三个胚层相关的标记物的存在来确定多能性。可以使用标准g带技术并与已公布的相应灵长类物种的核型相比较来分析增殖的多能干细胞系的核型。希望获得具有“正常核型”的细胞,其意指细胞为整倍体,其中所有人染色体都存在并且没有明显的改变。多能干细胞的来源非限制性的例子是人胚胎干细胞或人胚胎生殖细胞的确立细胞系,例如人胚胎干细胞系h1、h7和h9(wicell)。也可设想的是,在此类细胞的初始建立或稳定期间使用本公开的组合物,在此情况下,源细胞将是直接取自源组织的原代多能细胞。取自已经在不存在饲养细胞的情况下培养的多能干细胞群以及已经在存在饲养细胞的情况下培养的多能干细胞群的细胞也是合适的。同样合适的是突变型人胚胎干细胞系,例如bg01v(乔治亚州雅典bresagen(bresagen,athens,ga))。来源于成人体细胞的细胞也是合适的,例如,在takahashietal,cell131:1-12(2007)(takahashi等人,《细胞》,第131卷,第1-12页,2007年)中公开的细胞。在一个实施例中,人胚胎干细胞如thomson等人所述进行制备(美国专利no.5,843,780;science282:1145,1998(《科学》,第282卷,第1145页,1998年);curr.top.dev.biol.38:133ff.,1998(《发育生物学当前主题》,第38卷,第133页及以后,1998年);proc.natl.acad.sci.u.s.a.92:7844,1995(《美国国家科学院院刊》,第92卷,第7844页,1995年))。还设想到衍生自体细胞的多能干细胞。在一个实施例中,适用于本发明的多能干细胞可以根据takahashi等人(cell126:663-676,2006(《细胞》,第126卷,第663-676页,2006年))所述的方法衍生。在一个替代实施例中,适用于本发明的多能干细胞可以根据li等人(cellstemcell4:16-19,2009(《细胞干细胞》,第4卷,第16-19页,2009年))所述的方法衍生。在一个替代实施例中,适用于本发明的多能干细胞可以根据maherali等人(cellstemcell1:55-70,2007(《细胞干细胞》,第1卷,第55-70页,2007年))所述的方法衍生。在一个替代实施例中,适用于本发明的多能干细胞可以根据stadtfeld等人(cellstemcell2:230-240(《细胞干细胞》,第2卷,第230-240页))所述的方法衍生。在一个替代实施例中,适用于本发明的多能干细胞可以根据nakagawa等人(naturebiotechnology26:101-106,2008(《自然生物技术》,第26卷,第101-106页,2008年))所述的方法衍生。在一个替代实施例中,适用于本发明的多能干细胞可以根据takahashi等人(cell131:861-872,2007(《细胞》,第131卷,第861-872页,2007年))所述的方法衍生。在一个替代实施例中,适用于本发明的多能干细胞可以根据转让给centocorr&d,inc.公司的美国专利申请系列号61/256,149中所述的方法衍生。多能干细胞的培养在一个实施例中,在按照本发明的方法进行培养之前,将多能干细胞在以各种方式支持多能干细胞的饲养细胞层或胞外基质蛋白上培养。例如,将多能干细胞在支持多能干细胞增殖而不进行大量分化的饲养细胞层上培养。多能干细胞在饲养细胞层上生长而不分化是利用如下来支持的:(i)获得含有饲养细胞层的培养容器;以及(ii)通过先前用另一细胞类型进行培养而调理的培养基,或者(例如)不含血清的或者甚至是化学成分确定的未经调理的培养基。又如,将多能干细胞在基本上不含饲养细胞、但支持多能干细胞增殖而不进行大量分化的培养体系中培养。多能干细胞在不含饲养细胞的培养物中生长而不进行分化是利用以下条件来支持的:(i)固体基材表面上具有一种或多种胞外基质蛋白的吸附层(adlayer);和(ii)通过先前用另一细胞类型进行培养而调理的培养基或者未经调理的培养基(例如不含血清的培养基或甚至是化学成分确定的培养基)。在一个替代实施例中,将多能干细胞在含有至少约0.5%的n、o和n的总数大于或等于17.2%并且接触角为至少约13.9度的表面改性板上,在通过预先用另一细胞类型进行培养而调理的培养基或未经调理的培养基(例如不含血清的培养基或甚至是化学成分确定的培养基)中进行培养。培养基:适用于本发明的细胞培养基的一个例子可见于us20020072117。适用于本发明的细胞培养基的另一例子可见于us6642048。适用于本发明的细胞培养基的另一例子可见于wo2005014799。适用于本发明的细胞培养基的另一例子可见于xu等人(stemcells22:972-980,2004(《干细胞》,第22卷,第972-980页,2004年))。适用于本发明的细胞培养基的另一例子可见于us20070010011。适用于本发明的细胞培养基的另一例子可见于cheon等人(bioreproddoi:10.1095/biolreprod.105.046870;19oct2005(《生殖生物学》,doi:10.1095/biolreprod.105.046870;2005年10月19日))。适用于本发明的细胞培养基的另一例子可见于levenstein等人(stemcells24:568-574,2006(《干细胞》,第24卷,第568-574页,2006年))。适用于本发明的细胞培养基的另一例子可见于us20050148070。适用于本发明的细胞培养基的另一例子可见于us20050233446。适用于本发明的细胞培养基的另一例子可见于us6800480。适用于本发明的细胞培养基的另一例子可见于us20050244962。适用于本发明的细胞培养基的另一例子可见于wo2005065354。适用于本发明的细胞培养基的另一例子可见于wo2005086845。合适的培养基也可以由下列组分制成,例如,达尔伯克氏改良伊格尔培养基(dmem),gibco#11965-092;敲除的达尔伯克氏改良伊格尔培养基(kodmem),gibco#10829-018;ham'sf12/50%dmem基本培养基;200mml-谷氨酰胺,gibco#15039-027;非必需氨基酸溶液,gibco11140-050;β-巯基乙醇,sigma#m7522;人重组碱性成纤维细胞生长因子(bfgf),gibco#13256029。多能干细胞的分化在一个实施例中,使多能干细胞在培养物中增殖,然后以可促进其分化为另一细胞类型的方式处理多能干细胞。例如,可根据wo2007030870中公开的方法,使采用本发明的方法形成的多能干细胞分化为神经祖细胞或心肌细胞。又如,可根据美国专利6,458,589中公开的方法,使采用本发明方法形成的多能干细胞分化成肝细胞。采用本发明方法形成的多能干细胞分化成表达定形内胚层谱系特征性标记物的细胞可通过本领域的任何方法,使采用本发明方法形成的多能干细胞分化成表达定形内胚层谱系特征性标记物的细胞。例如,可根据d’amour等人在naturebiotechnology23,1534-1541(2005)(《自然生物技术》,第23卷,第1534-1541页,2005年)中公开的方法,使采用本发明方法形成的多能干细胞分化成表达定形内胚层谱系特征性标记物的细胞。例如,可根据shinozaki等人在development131,1651-1662(2004)(《发育》,第131卷,第1651-1662页,2004年)中公开的方法,使采用本发明方法形成的多能干细胞分化成表达定形内胚层谱系特征性标记物的细胞。例如,可根据mclean等人在stemcells25,29-38(2007)(《干细胞》,第25卷,第29-38页,2007年)中公开的方法,使采用本发明方法形成的多能干细胞分化成表达定形内胚层谱系特征性标记物的细胞。例如,可根据d’amour等人在naturebiotechnology24,1392-1401(2006)(《自然生物技术》,第24卷,第1392-1401页,2006年)中公开的方法,使采用本发明方法形成的多能干细胞分化成表达定形内胚层谱系特征性标记物的细胞。又如,可根据转让给理康公司(lifescan,inc.)的美国专利申请系列号11/736,908中公开的方法,使采用本发明方法形成的多能干细胞分化成表达定形内胚层谱系特征性标记物的细胞。又如,可根据转让给理康公司(lifescan,inc.)的美国专利申请系列号11/779,311中公开的方法,使采用本发明方法形成的多能干细胞分化成表达定形内胚层谱系特征性标记物的细胞。又如,可根据转让给理康公司(lifescan,inc.)的美国专利申请系列号12/493,741中公开的方法,使采用本发明方法形成的多能干细胞分化成表达定形内胚层谱系特征性标记物的细胞。又如,可根据转让给理康公司(lifescan,inc.)的美国专利申请系列号12/494,789中公开的方法,使采用本发明方法形成的多能干细胞分化成表达定形内胚层谱系特征性标记物的细胞。表达定形内胚层谱系特征性标记物的细胞的形成可通过在进行特定方案之前或之后检测该标记物的存在来确定。多能干细胞通常不表达这类标记物。因而,当细胞开始表达它们时即检测到多能细胞的分化。使用本发明方法形成的多能干细胞分化成表达胰腺内胚层谱系特征性标记物的细胞可通过本领域的任何方法,使采用本发明方法形成的多能干细胞分化成表达胰腺内胚层谱系特征性标记物的细胞。例如,可根据d’amour等人在naturebiotechnology24,1392-1401(2006)(《自然生物技术》,第24卷,第1392-1401页,2006年)中公开的方法,使多能干细胞分化成表达胰腺内胚层谱系特征性标记物的细胞。例如,还通过下述方式,将根据本发明的方法得到的表达定形内胚层谱系特征性标记物的细胞进一步分化成表达胰腺内胚层谱系特征性标记物的细胞:用成纤维细胞生长因子和hedgehog信号转导途径抑制剂kaad-环巴胺处理表达定形内胚层谱系特征性标记物的细胞,然后除去含有成纤维细胞生长因子和kaad-环巴胺的培养基,随后将细胞在含有视黄酸、成纤维细胞生长因子和kaad-环巴胺的培养基中进行培养。此方法的一个例子在naturebiotechnology24,1392-1401(2006)(《自然生物技术》,第24卷,第1392-1401页,2006年)中进行了公开。例如,根据转让给理康公司(lifescan,inc.)的美国专利申请系列号11/736,908中公开的方法,通过用视黄酸和至少一种成纤维细胞生长因子处理根据本发明的方法得到的表达定形内胚层谱系特征性标记物的细胞一段时间,来使所述表达定形内胚层谱系特征性标记物的细胞进一步分化成表达胰腺内胚层谱系特征性标记物的细胞。例如,通过用视黄酸(密苏里州西格玛奥德里奇公司(sigma-aldrich,mo))和毒蜥外泌肽4处理根据本发明方法得到的表达定形内胚层谱系特征性标记物的细胞,然后移除含有dapt(密苏里州西格玛奥德里奇公司(sigma-aldrich,mo))和毒蜥外泌肽4的培养基,随后在含有毒蜥外泌肽1、igf-1和hgf的培养基中培养细胞,可使所述表达定形内胚层谱系特征性标记物的细胞进一步分化为表达胰腺内胚层谱系特征性标记物的细胞。此方法的一个例子在naturebiotechnology24,1392-1401(2006)(《自然生物技术》,第24卷,第1392-1401页,2006年)中公开。例如,通过将根据本发明方法得到的表达胰腺内胚层谱系特征性标记物的细胞在含有毒蜥外泌肽4的培养基中进行培养,然后移除含有毒蜥外泌肽4的培养基,并且随后将细胞在含有毒蜥外泌肽1、igf-1和hgf的培养基中进行培养,使所述表达胰腺内胚层谱系特征性标记物的细胞进一步分化成表达胰腺内分泌谱系特征性标记物的细胞。此方法的一个例子在d’amour等人,naturebiotechnology,2006(《自然生物技术》,2006年)中公开。例如,通过在含有dapt(密苏里州西格玛奥德里奇公司(sigma-aldrich,mo))和毒蜥外泌肽4的培养基中培养根据本发明方法得到的表达胰腺内胚层谱系特征性标记物的细胞,使所述表达胰腺内胚层谱系特征性标记物的细胞进一步分化成表达胰腺内分泌谱系特征性标记物的细胞。此方法的一个例子在d’amour等人,naturebiotechnology,2006(《自然生物技术》,2006年)中公开。例如,通在含有毒蜥外泌肽4的培养基中培养表达根据本发明方法得到的胰腺内胚层谱系特征性标记物的细胞,使所述表达胰腺内胚层谱系特征性标记物的细胞进一步分化成表达胰腺内分泌谱系特征性标记物的细胞。此方法的一个例子在d’amour等人,naturebiotechnology,2006(《自然生物技术》,2006年)中公开。例如,根据转让给理康公司(lifescan,inc.)的美国专利申请系列号11/736,908中公开的方法,通过用抑制notch信号转导途径的因子处理根据本发明方法得到的表达胰腺内胚层谱系特征性标记物的细胞,使所述表达胰腺内胚层谱系特征性标记物的细胞进一步分化成表达胰腺内分泌谱系特征性标记物的细胞。例如,根据转让给理康公司(lifescan,inc.)的美国专利申请系列号11/779,311中公开的方法,通过用抑制notch信号转导途径的因子处理根据本发明方法得到的表达胰腺内胚层谱系特征性标记物的细胞,使所述表达胰腺内胚层谱系特征性标记物的细胞进一步分化成表达胰腺内分泌谱系特征性标记物的细胞。例如,根据转让给理康公司(lifescan,inc.)的美国专利申请系列号60/953,178中公开的方法,通过用抑制notch信号转导途径的因子处理根据本发明方法得到的表达胰腺内胚层谱系特征性标记物的细胞,使所述表达胰腺内胚层谱系特征性标记物的细胞进一步分化成表达胰腺内分泌谱系特征性标记物的细胞。例如,根据转让给理康公司(lifescan,inc.)的美国专利申请系列号60/990,529中公开的方法,通过用抑制notch信号转导途径的因子处理根据本发明方法得到的表达胰腺内胚层谱系特征性标记物的细胞,使所述表达胰腺内胚层谱系特征性标记物的细胞进一步分化成表达胰腺内分泌谱系特征性标记物的细胞。使用本发明的方法形成的多能干细胞分化成表达胰腺内分泌谱系特征性标记物的细胞可通过本领域的任何方法,使采用本发明方法形成的多能干细胞分化成表达胰腺内分泌谱系特征性标记物的细胞。例如,通过将根据本发明方法得到的表达胰腺内胚层谱系特征性标记物的细胞在含有毒蜥外泌肽4的培养基中进行培养,然后移除含有毒蜥外泌肽4的培养基,并且随后将细胞在含有毒蜥外泌肽1、igf-1和hgf的培养基中进行培养,使所述表达胰腺内胚层谱系特征性标记物的细胞进一步分化成表达胰腺内分泌谱系特征性标记物的细胞。此方法的一个例子在d’amour等人,naturebiotechnology,2006(《自然生物技术》,2006年)中公开。例如,通过在含有dapt(密苏里州西格玛奥德里奇公司(sigma-aldrich,mo))和毒蜥外泌肽4的培养基中培养根据本发明方法得到的表达胰腺内胚层谱系特征性标记物的细胞,使所述表达胰腺内胚层谱系特征性标记物的细胞进一步分化成表达胰腺内分泌谱系特征性标记物的细胞。此方法的一个例子在d’amour等人,naturebiotechnology,2006(《自然生物技术》,2006年)中公开。例如,通在含有毒蜥外泌肽4的培养基中培养根据本发明方法得到的表达胰腺内胚层谱系特征性标记物的细胞,使所述表达胰腺内胚层谱系特征性标记物的细胞进一步分化成表达胰腺内分泌谱系特征性标记物的细胞。此方法的一个例子在d’amour等人,naturebiotechnology,2006(《自然生物技术》,2006年)中公开。例如,根据转让给理康公司(lifescan,inc.)的美国专利申请系列号11/736,908中公开的方法,通过用抑制notch信号转导途径的因子处理根据本发明方法得到的表达胰腺内胚层谱系特征性标记物的细胞,使所述表达胰腺内胚层谱系特征性标记物的细胞进一步分化成表达胰腺内分泌谱系特征性标记物的细胞。例如,根据转让给理康公司(lifescan,inc.)的美国专利申请系列号11/779,311中公开的方法,通过用抑制notch信号转导途径的因子处理根据本发明方法得到的表达胰腺内胚层谱系特征性标记物的细胞,使所述表达胰腺内胚层谱系特征性标记物的细胞进一步分化成表达胰腺内分泌谱系特征性标记物的细胞。例如,根据转让给理康公司(lifescan,inc.)的美国专利申请系列号60/953,178中公开的方法,通过用抑制notch信号转导途径的因子处理根据本发明方法得到的表达胰腺内胚层谱系特征性标记物的细胞,使所述表达胰腺内胚层谱系特征性标记物的细胞进一步分化成表达胰腺内分泌谱系特征性标记物的细胞。例如,根据转让给理康公司(lifescan,inc.)的美国专利申请系列号60/990,529中公开的方法,通过用抑制notch信号转导途径的因子处理根据本发明方法得到的表达胰腺内胚层谱系特征性标记物的细胞,使所述表达胰腺内胚层谱系特征性标记物的细胞进一步分化成表达胰腺内分泌谱系特征性标记物的细胞。本发明通过以下实例进一步说明,但本发明并不受限于以下实例。实例实例1在不存在胎牛血清的情况下将细胞系h1的人胚胎干细胞分化成胰腺内分泌细胞使用如下的多步方案,将各代(p40至p52)的人胚胎干细胞系h1的细胞在matrigel(1:30稀释)包被的培养皿上培养并分化成胰腺谱系:a.第i阶段(定形内胚层):将人胚胎干细胞在补充有2%无脂肪酸的bsa(目录号68700,艾奥瓦州普罗利恩特公司(proliant,ia))和100ng/ml激活蛋白a(明尼苏达州安迪生物公司(r&dsystems,mn))加上20ng/mlwnt-3a(目录号1324-wn-002,明尼苏达州安迪生物公司(r&dsystems,mn))加上8ng/mlbfgf(目录号100-18b,新泽西州派普泰克公司(peprotech,nj))的rpmi培养基中培养一天。然后用补充有2%bsa和100ng/ml激活蛋白a加上8ng/mlbfgf的rpmi培养基再处理细胞两天,接下来b.第ii阶段(原肠管):将细胞用rpmi+2%无脂肪酸的bsa和50ng/mlfgf7和0.25µμsant-1(#s4572,密苏里州西格玛公司(sigma,mo))处理二至三天,接下来c.第iii阶段(后前肠):将细胞用补充有1:200稀释的its-x(加州英杰公司(invitrogen,ca))和0.1%bsa(富含脂质)(加州英杰公司(invitrogen,ca),no.11021-045)、50ng/mlfgf7、0.25µμsant-1、2µμ视黄酸(ra)(密苏里州西格玛公司(sigma,mo))、100ng/ml成头蛋白(明尼苏达州安迪生物公司(r&dsystems,mn))和20ng/ml激活蛋白a的dmem/高葡萄糖处理四天;在某些变型方案中,成头蛋白替换为2µμ浓度的ampk抑制剂6-[4-(2-哌啶-1-基乙氧基)苯基]-3-吡啶-4-基吡唑并[1,5-a]嘧啶(西格玛(sigma),no.p5499)。在其他变型方案中,加入2.5µμp38抑制剂(4-[4-(4-氟苯基)-1-(3-苯基丙基)-5-吡啶-4-基-1h-咪唑-2-基]丁-3-炔-1-醇)(在美国专利6,521655中公开),接下来d.第iv阶段(胰腺内分泌前体细胞):将细胞用补充有1:200稀释的its-x(加州英杰公司(invitrogen,ca))和0.1%bsa(加州英杰公司(invitrogen,ca))、100ng/ml成头蛋白、1µμalk5抑制剂(sd-208,在molecularpharmacology200772:152-161(《分子药理学》,2007年,第72卷,第152-161页)中公开)的dmem/高葡萄糖处理三天,接下来e.第v阶段(胰腺内分泌细胞):将细胞用补充有1:200稀释的its-x(加州英杰公司(invitrogen,ca))、0.1%bsa(加州英杰公司(invitrogen,ca))、1µμalk5抑制剂ii(目录号616452,加州calbiochem公司(calbiochem,ca))的dmem/高葡萄糖处理七天,接下来f.第vi阶段(成熟胰腺内分泌细胞):将细胞用补充有1:200稀释的its-x(加州英杰公司(invitrogen,ca))、0.1%bsa(加州英杰公司(invitrogen,ca))的dmem/高葡萄糖处理七天,每隔一天更换培养基。实例2富集的各种胰腺细胞谱系的流式细胞术表征和分选为了促进实例1中所概述分化过程的各个阶段的新型细胞群的分离和表征,通过流式细胞术详细表征了从各个阶段获得的细胞。在各个分化阶段使用的抗体和表面标记物表达水平的完整列表在表i中示出。使用实例1中描述的方案,将各代(p40至p52)的人胚胎干细胞系h1的细胞在matrigel包被的平板上培养并分化成胰腺内分泌细胞。将不同成熟阶段的细胞(后前肠(第iii阶段)、内分泌前体细胞(第iv阶段)、胰腺内分泌细胞(第v阶段)或成熟胰腺内分泌细胞(第vi阶段))通过在trypleexpress(加州英杰公司(invitrogen,ca),#12604)中在37℃下温育2-3分钟进行温和解离,用含2%bsa的bdfacs染色缓冲液(加州碧迪公司(bd,ca),#554657)洗涤两次。将大约0.5-1×106个细胞重悬于100-200µl封闭缓冲液(以1:4稀释于染色缓冲液(加州碧迪公司(bd,ca))中的0.5%人γ-球蛋白)中,用于染色。对于用直接缀合的一抗染色,将适当的抗体加入细胞中,最终稀释率为1:20,并在4℃下温育细胞30分钟。对于未缀合的抗体,将一抗以1:50-1:100稀释率加入细胞,并在4℃下温育细胞30分钟,然后在染色缓冲液中洗涤两次。然后将细胞以1:500稀释率在适当的二抗中温育。将染色的细胞重悬于300µl的染色缓冲液中,并在bdfacscantoii上分析前,加入5-10µl7aad区分活/死细胞。对于细胞分选,以类似于流式细胞术分析的方式处理大约3-4千万个细胞。用适当的抗体给细胞染色,如表ii所示。细胞分选为两个或三个亚群,如表ii所总结。基于同种型匹配对照来设定细胞分选门。在分选后,分析所分选细胞等分试样的纯度,然后通过pcr分析关键胰腺标记物的表达。使用rneasyminikit试剂盒(加州凯杰公司(qiagen,ca))从分选前样品和各个级分中收集rna。根据在实例1中概述的分化方案的不同阶段所分析的细胞群中各种标记物的表达,来选择用于分选的细胞表面标记物。本研究采用的标记物在表ii中公开。简言之,表ii中公开的表面标记物单独或组合用于各种细胞群的分选。所分选的细胞的样品通过实时pcr分析胰腺内分泌谱系特征性标记物的表达。表达胰腺内分泌谱系特征性标记物的细胞的分选抗cd56和cd13的抗体用于分选从实例1中概述的分化方案的第iv阶段获得的细胞群。鉴定出三种细胞群:a)cd56+cd13-、b)cd56-cd13-和c)cd56-cd13+细胞群。分选后,cd56+cd13-细胞群富集大约1.3倍,并且与第iv阶段未分选的细胞、或cd56-cd13-细胞群、或cd56-cd13+细胞群相比,高度富集了表达胰腺内分泌谱系特征性标记物(包括neurod、ngn3、pdx1、nkx6.1、nkx2.2和pax-4)的分选细胞。参见图1的小图a-f。在第二系列实验中,将抗cd133的抗体用于分选从实例1中概述的分化方案的第iv阶段获得的细胞群。鉴定出两种细胞群:a)cd133+和b)cd133-细胞群。分选后,cd133-细胞群富集大约1.9倍,并且与第iv阶段未分选的细胞或cd133+细胞群相比,高度富集了表达胰腺内分泌谱系特征性标记物(包括neurod、ngn3、pdx1、nkx6.1、nkx2.2和pax-4)的分选细胞。参见图2的小图a-f。在第三系列实验中,将抗cd49c的抗体用于分选从实例1中概述的分化方案的第iv阶段获得的细胞群。鉴定出两种细胞群:a)cd49chi和b)cd49clo细胞群。分选后,cd49clo细胞富集大约3.1倍,并且与未分选的细胞或cd49chi细胞相比,高度富集了表达胰腺内分泌谱系特征性标记物(包括neurod、ngn3、pdx1和nkx6.1)的分选细胞。参见图3的小图a-d。在第四系列实验中,将抗cd56和cd15的抗体用于分选从实例1中概述的分化方案的第iv阶段获得的细胞群。鉴定出如下细胞群:a)cd56+cd15lo、b)cd56+cd15hi、c)cd15+和d)cd15-细胞群。分选后,cd15-细胞群富集了大约1.1倍。与未分选的细胞或cd56+cd15hi细胞群相比,高度富集了表达胰腺内分泌谱系特征性标记物(包括neurod、ngn3、pdx1、nkx6.1、胰岛素和胰高血糖素)的cd56+cd15lo细胞群。参见图4的小图a-f。相似地,与未分选的细胞或cd15+细胞群相比,高度富集了使用单个标记物分选的表达胰腺内分泌谱系特征性标记物(包括neurod、ngn3、pdx1、nkx6.1、nkx2.2、pax-4、胰高血糖素和胰岛素)的cd15-细胞群。参见图5的小图a-h。在第五系列实验中,将抗cd56和cd57的抗体用于分选从实例1中概述的分化方案的第iv阶段获得的细胞群。鉴定出两种细胞群:a)cd56+cd57+和b)cd56+cd57-细胞群。分选后,cd56+cd57+细胞群富集了大约1.9倍。与未分选的细胞或cd56+cd57-细胞群相比,高度富集了表达胰腺内胚层谱系特征性标记物(包括neurod、ngn3、pdxi、nkx6.1、nkx2.2以及胰岛素和胰高血糖素)的cd56+cd57+细胞。参见图6的小图a-g。使用抗cd56和cd57的抗体分选实例1中概述的分化方案的第v阶段的细胞群时,也观察到相似的结果。在第六系列实验中,将抗cd56和cd184的抗体用于分选从实例1中概述的分化方案的第iv阶段获得的细胞群。鉴定出三种细胞群:a)cd184+、b)cd184-和c)cd56+cd184-细胞群。表iv汇总了富集前和富集后细胞中cd184的表达。富集了表达胰腺内分泌谱系特征性标记物(包括pax4、neurod、nkx6.1、pdx1和ptf1α)的cd184+细胞群。zic1、白蛋白和cdx2的表达下降。参见图7的小图a-i。产胰岛素细胞的分选将抗cd98的抗体用于分选从实例1中概述的分化方案的第vi阶段获得的细胞群。鉴定出两种细胞群:a)cd98+(hi)和b)cd98-(lo)细胞群。分选后,cd98+(hi)细胞群富集了大约1.6倍。富集了表达neurod、ngn3、胰岛素和胰高血糖素的cd98+(hi)细胞。参见图8的小图a-d。在另一系列实验中,将抗cd47的抗体用于分选从实例1中概述的分化方案的第v阶段获得的细胞群。鉴定出两种细胞群:a)cd47hi(+)和b)cd47lo(-)细胞群。分选后,cd47lo(-)细胞富集了大约3.3倍。富集了表达neurod、ngn3、pdx1、nkx6.1、nkx2.2和pax4的cd47lo(-)细胞。参见图9的小图a-f。在另一系列实验中,将抗cd47的抗体用于分选从实例1中概述的分化方案的第vi阶段获得的细胞群。鉴定出两种细胞群:a)cd47hi(+)和b)cd47lo(-)细胞群。富集了表达pdx-1、nkx6.1、nkx2.2、pax-4、ptf1a、ngn3、胰岛素和胰高血糖素的cd47lo(-)细胞。参见图10的小图a-h。实例3原肠管阶段(第2阶段)的lif受体阳性细胞的分选使用如下方案,将第44传代的人胚胎干细胞系h1的细胞在matrigel包被的平板上培养并分化为产胰岛素细胞:a.用补充有2%无脂肪酸的bsa(目录号68700,艾奥瓦州普罗利恩特公司(proliant,ia))和100ng/ml激活蛋白a(明尼苏达州安迪生物公司(r&dsystems,mn))加上20ng/mlwnt-3a(目录号1324-wn-002,明尼苏达州安迪生物公司(r&dsystems,mn))加上8ng/mlbfgf(目录号100-18b,新泽西州派普泰克公司(peprotech,nj))的rpmi培养基处理一天,然后用补充有2%bsa和100ng/ml激活蛋白a加上8ng/mlbfgf的rpmi培养基再处理两天(第i阶段),接下来b.用rpmi+2%bsa+50ng/mlfgf7+0.25µμsant-1(#s4572,密苏里州西格玛公司(sigma,mo))处理三天(第2阶段),接下来c.用dmem/高葡萄糖+1:200稀释的its-x(加州英杰公司(invitrogen,ca))+0.1%bsa(加州英杰公司(invitrogen,ca))+50ng/mlfgf7(新泽西州派普泰克公司(peprotech,nj))+0.25µμsant-1+2µμ视黄酸(ra)(密苏里州西格玛公司(sigma,mo))+100ng/ml成头蛋白(明尼苏达州安迪生物公司(r&dsystems,mn))和20ng/ml激活蛋白a处理四天(第3阶段),接下来d.用dmem/高葡萄糖+1:200稀释的its-x(加州英杰公司(invitrogen,ca))+0.1%bsa(加州英杰公司(invitrogen,ca))+100ng/ml成头蛋白+1µμalk5抑制剂(scio120)+处理三天(第4阶段)。使用trypleexpress(加州卡尔斯巴德英杰公司(invitrogen,carlsbad,ca))将第2阶段的细胞分散为单细胞,并在第4阶段的基本培养基(dm-hg+its-x+bsa)中洗涤。将解离的细胞离心,并将所得的细胞沉淀悬浮于由溶于pbs的2%bsa、0.05%叠氮化钠组成的染色缓冲液(密苏里州西格玛公司(sigma,mo))中。如适当,用0.1%γ-球蛋白(西格玛(sigma))溶液对细胞进行fc-受体封闭15分钟。用lif受体-藻红蛋白(pe)(明尼苏达州安迪生物公司(r&dsystems,mn))缀合的单克隆抗体(5µl抗体/106个细胞)温育等分试样(大约105个细胞)。对照包括适当的同种型匹配抗体和未染色的细胞。所有的与抗体的温育都是在4℃下进行30分钟,之后将细胞用染色缓冲液进行洗涤。在facsaria(加州碧迪公司(bd,ca))上分选染色的细胞。从分选前的样品、lif受体+级分和lif受体-级分收集rna(rneasyminikit试剂盒,加州凯杰公司(qiagen,ca))。lif受体表达水平和模式汇总于表iii中。表iii汇总了第2阶段第2和3天的lif受体的表达。到第2阶段第3天为止,大约70%的细胞表达了lif受体。如表iii中所汇总,lif受体只在第2阶段细胞中高表达,而第3和4阶段细胞显示出lif受体的表达极低。如图11的小图a-b所示出,与未分选的细胞或lif受体阴性细胞相比,富集lif受体的第2阶段细胞显示出hnf4α的表达显著增加。如实时pcr所测量,在包含lif-受体阳性细胞的细胞级分中,lif受体mrna的表达也增加。实例4用磁珠进行细胞分选,清除ssea-4+细胞,以减少体内肿瘤的形成ssea4抗原的表达是人胚胎干细胞多能性的关键指标,并且这个标记物的表达在分化过程期间大大下调。然而,残余的ssea-4阳性细胞可能会导致在部分分化的细胞移植后所观察到的肿瘤和/或畸胎瘤。为了减少畸胎瘤的形成,开发了在移植前从分化的细胞清除污染性ssea4+细胞的方法。将人胚胎干细胞系h1的细胞(第40-52次传代)分化到实例1中概述的分化方案的各阶段。为了测试ssea-4清除的概念验证和功效,本研究首先用仅分化到原肠管阶段(实例1中概述的分化方案的第2阶段)的细胞来进行,以确保细胞仍然保持高水平的ssea-4表达。在后续实验中,将表达ssea-4的细胞从实例1中概述的分化方案的第4阶段分化的细胞群清除。观察的结果参见表v。细胞通过在trypleexpress(加州英杰公司(invitrogen,ca),#12604)中在37℃下温育2-3分钟而温和解离成单细胞。为了增强清除期间细胞存活和活力,在收集前的细胞和在所有分离缓冲液中加入包括10µμy-27632(目录号y0503,密苏里州圣路易斯西格玛公司(sigma,stlouis,mo))或0.5µμthiazovivin(目录号04-0017,加州圣地亚哥stemgent公司(stemgent,sandiego,ca))的抗凋亡剂。用包含无ca2+和mg2+的磷酸盐缓冲盐水(pbs)、补充有0.1%bsa和2mmedta的分离缓冲液洗涤细胞。将10-100×106个的细胞重悬于分离缓冲液中,最终细胞密度为5×106个细胞/500µl。每500µl细胞加入25µlssea-4抗体,室温下将细胞在轻缓的振动器(确保连续混合)上温育15-20分钟。通过300×g离心8分钟使细胞在分离缓冲液中进行洗涤。移除上清液并将细胞重悬于原始缓冲液体积中,每500µl细胞悬浮液加入50µl预洗涤的ssea-4清除磁珠(dynabeads®ssea-4,英杰公司(invitrogen),#11160d)。将细胞和磁珠混合,在室温下温育15-20分钟,同时持续地轻缓倾斜旋转。通过轻缓抽吸来混合细胞,并在磁体上放置5分钟。将包含ssea-4阴性细胞的上清液转移至新试管中,重复该过程2-3次,以移除残余的磁珠。使磁珠结合的ssea4+细胞从磁场释放,对两种细胞群进行计数和处理,以作facs和pcr分析。ssea4在未分化h1细胞、原肠细胞和第iv阶段细胞中,在分选前和分选后细胞级分中的表达水平汇总于表v中。在实例1中概述的分化方案的第ii阶段分离的细胞群中,在分选前20.5%的细胞表达了ssea4标记物。相比之下,在分选后只有1.8%的细胞表达了ssea4(表v)。清除导致移除了91.2%的ssea-4阳性细胞。在另一个使用内分泌前体细胞的实验中,在清除前25.3%的细胞表达了ssea-4,但清除后只有0.9%表达了ssea-4,导致移除了95.5%的ssea-4阳性细胞(表v)。与分化的细胞相反,91.2%的未分化胚胎干细胞群表达了ssea4。高度富集了表达多能标记物(包括oct4、nanog、sox2和goosecoid)的分选ssea4+细胞(图12的小图a-d)。实例5通过facs分选ssea4+(hi)和ssea4-(lo)细胞为了通过流式细胞术研究和确认从分化细胞中清除了富含多能标记物(ssea-4+)的细胞,如实例1中所述将细胞分化至第vi阶段。使用trypleeexpress细胞解离缓冲液将细胞从培养物中解离,并如实例2中所述制备用于分选的细胞。将ssea-4抗体(明尼苏达州明尼阿波利斯安迪生物公司(r&dsystems,minneapolis,mn),目录号fab1435p)用于分离被鉴定为ssea-4(+)hi和ssea-4(-)lo细胞的两个细胞级分。如实例4中所述,通过rt-pcr分析分离的细胞级分的多能标记物表达。类似于实例5中所述使用磁珠分离获得的ssea-4清除和富集级分,高度富集了表达多能标记物oct4、nanog、sox2和goosecoid的分选ssea-4(+)hi细胞,这与ssea-4(-)lo细胞不同。参见图13的小图a-d。实例6清除了ssea-4的细胞群的体内移植在预试验中,使清除了ssea-4的细胞分化至实例1中概述的分化方案的第iv阶段,然后移植至小鼠的肾包膜中以测试细胞存活和移入。移植小鼠的数据汇总于表vi中。从taconicfarms购买五至六周龄的雄性scid-beige小鼠(c.b-igh-1b/gbrnstac-prkdescid-lystbgn7)。将小鼠圈养在微隔离笼(microisolatorcage)中,自由获得无菌食物和水。在手术准备中,小鼠通过耳部加标签来辨别,称量其体重,并使用手持式血糖仪(onetouch,lifescan)来测定其血糖。用异氟烷和氧气的混合物麻醉小鼠,用小型动物剪毛剪给手术部位剃毛。在手术前经皮下给予小鼠0.1mg/kgbuprenex。通过用70%异丙醇、10%聚维酮-碘和70%异丙醇连续洗涤来准备手术部位,并且产生穿透皮肤和肌肉层的左侧切口。使左肾暴露于外并用0.9%氯化钠保持润湿。将24g×3/4"静脉导管用于穿透肾包膜,并且移除针头。然后在肾包膜下推进导管至肾脏的远极。在小鼠的手术前准备期间,将细胞在1.5ml微量离心管中离心,移除大部分上清液,留下的量刚好足以收集细胞沉淀物。将细胞收集进raininpos-d正位移移液器中,并倒置该移液器以让细胞通过重力沉降。弃去过量的培养基,留下用于移植的浓集细胞制品。对于移植,将pos-d移液枪头牢固置于导管的插孔(hub)中,将细胞从移液器通过肾包膜下的导管分配,并递送至肾脏的远极。将导管的内腔用少量的培养基冲洗以递送剩余的细胞,并抽回导管。通过低温烧灼而封闭肾包膜,使肾回复至其初始解剖位置。通过用5-0vicryl缝线连续缝合来闭合肌肉,并用伤口夹闭合皮肤。在手术后经皮下给予小鼠1.0mg/kgmetacam。使小鼠脱离麻醉并让其完全恢复。在移植之后,每周称重小鼠一次,每周测量血糖两次。在移植之后的多个时间间隔,在经腹膜内给予小鼠3g/kg葡萄糖,并在注射葡萄糖后60分钟经由眶后窦抽取血液到装有少量肝素的微量离心管中。将血液离心,将血浆置于第二微量离心管中,在干冰上冷冻,然后在-80℃下保存直至进行人c肽测定。根据制造商的说明书,用mercodia/alpco诊断超敏c肽elisa来测定人c肽水平。到处死时,如上所述收集血液并使小鼠安乐死。从肾包膜收获移植物,通过实时qpcr、免疫组织化学和病理学进行分析。三组小鼠移植了约330万个细胞,每组包含i)细胞簇、ii)单细胞(未清除)和iii)清除了ssea4的单细胞。将分化至第iv阶段的细胞通过轻轻刮取以形成小细胞簇来解离,或用tryplee解离为单细胞,以用于ssea-4清除。如实例5中概述,在ssea-4清除后,移植前将细胞簇和单细胞制品二者都重新接种于含前体(第iv阶段)细胞分化培养基的低附着平板(costar,纽约州康宁公司(corningincorporated,ny),目录号3471)中过夜。向培养物中加入10µμ浓度的rock抑制剂y-27632二盐酸一水合物(西格玛(sigma),目录号y0503)过夜。移植后,如上所述监测小鼠最多12周。接受单细胞的小鼠(清除的或未清除的)中未明显表现出移植物的存活,但接受细胞簇的5只小鼠中有2只表现出移植物的存活。接受细胞簇的5只小鼠中有1只在移植后12周具有可检测的c-肽水平。移植物存活率低是由于预试验中细胞质量减低以及移植的细胞数量少。人胚胎细胞通过几个中间步骤(包括定形内胚层(de)、胰腺内胚层(pe)和胰腺前体细胞)向成熟胰腺内分泌细胞的多步骤分化与表面标记物表达的动态变化相关。虽然分化方案可以产生多个谱系的仍不确定的异质细胞群(包括外胚层和中胚层细胞类型),但跟踪胰腺分化培养基中表面标记物表达的变化可鉴定在细胞富集和纯化中有潜在用处的标记物。表vii示出了表面标记物的汇总,这些标记物表现出表达的增加或减少,并可用于胰腺内胚层细胞的阴性或阳性选择。在分化过程期间表达减少的标记物包括cd117、cd133、cd181、cd184、cd200、cd221、cd326、cd55、cd57、cd9和cd98。在分化过程期间表达增加的标记物包括cd13、cd141、cd15、cd318、cd46、cd47、cd49c、cd49e、cd56和cd73。这些标记物可以单个地或以各种组合用于纯化富集了胰腺内胚层和前体细胞的细胞群。实例7流式细胞术分选程序不同成熟阶段的细胞通过在tiypleexpress(加州英杰公司(invitrogen,ca),#12604)中在37℃下温育2-3分钟进行温和解离,并且在包含2%bsa的bdfacs染色缓冲液(加州碧迪公司(bd,ca),#554657)中洗涤两次。基于细胞收率,将20-50×106个单细胞重悬于2-3ml封闭缓冲液(以1:4稀释于染色缓冲液(加州碧迪公司(bd,ca))中的0.5%人γ-球蛋白)中用于染色。将荧光团缀合的一抗加入细胞中,最终稀释率为1:20,并将细胞在4℃下温育30分钟。洗涤后,将染色的细胞重悬于2-3ml染色缓冲液中,在分析和细胞分选前加入50-60µl的7aad以区分活/死细胞。同种型匹配对照igg抗体用于阴性对照染色。为了在分选前计算荧光团补偿值,将细胞保持未染色,或用异硫氰酸荧光素酯(fitc)、藻红蛋白(pe)或别藻蓝蛋白(apc)、核染料7-氨基放线菌素d(7-aad)的单个荧光团进行染色。细胞分选使用bdfacsaria细胞分选仪和bdfacsdiva软件进行。同种型匹配对照细胞用于设定每个细胞分选的阴性门。对于每个细胞分选实验,使用适当的荧光团补偿值调整光电倍增器(pmt)电压设置,以产生明亮的细胞群(阳性(+)或hi)和暗淡的细胞群或细胞亚群(阴性(-)或lo)。通常,阳性细胞群(+或hi)为4个数量级或更多(104),而阴性细胞群为2-3个数量级(102-103)。使用设定的门,用100µμ喷嘴和1.0的流速分选细胞。分选后,分析细胞的小等分试样,以评估分选的细胞亚群的纯度。使用rneasyminikit试剂盒(加州凯杰公司(qiagen,ca))从分选前和分选后的细胞中收集rna,用于rt-pcr分析。本文通篇中引用的出版物以引用方式全文并入。尽管上文已结合实例和优选实施例描述了本发明的各个方面,但应当理解本发明的范围不受以上描述内容的限定,而受以下在专利法原则下恰当理解的权利要求书的限定。表i.利用流式细胞术表征内胚层/胰腺分化的不同阶段的表面标记物表达表解:nd=不确定;+/-=0-10%;+=10-50%;++=50-85%;+++=85-100%表1续表ii用于富集胰腺细胞前体细胞的表面标记物表iii.lif受体的表达水平分化的阶段第2阶段第2天第2阶段第3天第3阶段第4天第4阶段第3天表达水平(%)47%70%5%1%表iv.富集前后cd184的表达水平表v.ssea-4抗原的表达水平表vi.用清除了ssea-4的细胞移植的小鼠的数据汇总表vii.与人胚胎干细胞分化成胰腺和内胚层谱系相关的表面标记物de—>pe—>内分泌细胞的分化期间表面标记物的变化表面标记物相关变化*用于富集胰腺内胚层/内分泌细胞的表面标记物富集的细胞级分cd117减少nd-cd13增加是cd13-cd133减少是cd133-cd142增加nd-cd15增加是cd15-cd181减少nd-cd184减少是cd184+cd200减少nd-cd221减少nd-cd318增加nd-cd326减少nd-cd46增加nd-cd47增加是cd47-cd49c增加是cd49c-cd49e增加nd-cd55减少nd-cd56增加是cd56+cd57减少是cd57+cd73增加nd-cd9减少nd-cd98减少是cd98+表面标记物相关变化表示随着细胞从定形内胚层(de,第i阶段)分化为胰腺内胚层(pe,第iii阶段)并最终分化为内分泌细胞(第v/vi阶段),特定表面标记物的表达水平增加还是减少。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1