一种结合AUDG和自避分子识别系统的多交叉恒温扩增方法与流程
本发明公开了一种多交叉置换恒温扩增检测微生物目的基因的方法,属于微生物和分子生物学技术领域。
背景技术:
在现代生物学和医学领域,核酸扩增是一种不可缺少的技术,已经广泛运用于基础研究、临床诊断、考古研究、流行病研究、转基因研究等领域。在已经发展的核酸扩增技术中,聚合酶链式反应(polymerasechainreaction,pcr)是第一个被建立的体外核酸扩增技术,具有划时代意义,该技术现已被广泛应用于生物相关领域。然而,pcr技术进行核酸扩增时,受到实验室条件的限制,依赖于复杂昂贵的热循环设备。除此之外,pcr产物的检测比较复杂,需要一套复杂的流程及设备。这些劣势限制了该技术的广泛应用,尤其在经济落后的地区及快速诊断领域。因此,对于生物及医学相关研究领域而言,非常有必要发展简单、快速、敏感的核酸扩增方法。为了克服pcr扩增技术的劣势,应运而生了许多恒温扩增技术。与pcr技术比较,恒温扩增技术不依赖于热循环扩增设备,反应速度快,敏感性好。因此,恒温扩增技术有利于实现快速扩增、现场诊断及便捷检测。到目前为止,已发展的恒温扩增技术有10余种,应用较为广泛的有环介导恒温扩增(lamp)、交叉扩增(cpa)、滚环扩增(rca)、链置换扩增(sda)、解旋酶依赖的恒温扩增(hda)等。然而,这些恒温技术实现核酸扩增需要多种酶同时工作,依赖于昂贵的试剂、复杂的操作步骤。因此这些恒温扩增方法的实用性、便捷性、可操作性有待于提高,尤其是在快速诊断领域及欠发达地区。
为了克服pcr技术及现有恒温扩增技术的劣势,实现敏感、便捷、快速及特异的扩增核酸序列,发明人近期已经建立了一种新的核酸扩增技术,命名为多交叉置换扩增(multiplecrossdisplacementamplification,mcda),相关内容公开于cn104946744a,该专利文件作为现有技术文件构成本申请说明书的一个部分。mcda在恒温条件下实现核酸扩增,仅使用一种恒温置换酶、扩增速度快、反应灵敏、特异性高。
类似于环介导恒温扩增(lamp)和交叉扩增(cpa),mcda的技术瓶颈在结果的判读,即扩增产物的检测。到目前为止,最常见的产物检测手段主要包括颜色指示剂、电泳、实时浊度。然而,这三种检测技术仅仅适用于单重检测(即单一靶标的检测)。此外,颜色指示剂判读扩增产物时,会出现模拟两可的结果,电泳判读结果时耗时较长,容易出现交叉污染,不适合于现场检测,实施浊度判读时需要特殊的仪器设备。为了克服这三种检测技术的劣势,使mcda技术在生物、医药及卫生领域应用更广泛、更经济。近期,发明人以mcda为基础,将mcda技术与纳米生物检测技术相结合,开发了依赖mcda技术、实现快速、敏感检测的纳米生物传感技术,该技术被命名为多交叉恒温扩增结合金纳米生物传感的核酸诊断技术(multiplecrossdisplacementamplificationlabel-basedgoldnanoparticleslateralflowbiosensor,mcda-lfb),相关内容公开于cn201610872509.4;cn201610942289.8;cn201610982015.1;cn201710566164.4,这些专利文件作为现有技术文件构成本申请说明书的一个部分。
为了将mcda扩增产物适用于纳米传感技术,传统的策略是在mcda扩增体系中同时添加两条标记的引物,一条引物在5’端标记生物素,另一条引物在5’端标记半抗原。当mcda扩增完毕,双标的扩增产物被构建(该双标的产物起源于两条标记的引物),一端标记生物素,另一端标记半抗原。然而,传统策略构建双标记的mcda产物会导致假阳性结果,甚至不需要扩增就能导致假阳性结果。该假阳性结果来源于标记引物之间的杂交。因此,为了克服传统标记策略的劣势,本发明设计了一种新的检测策略,该技术只需一条标记的引物就能构建双标的扩增产物,从而将扩增产物适用于生物传感技术。
为了将mcda扩增产物适用于生物传感技术的检测,打开反应管是一个必须的步骤,该步骤导致大量的扩增产物以气溶胶的形式挥发,从而导致交叉污染,产生假阳性结果。此外,类似于lamp和cpa技术,由于技术设计的原因,mcda会产生假阳性结果,该假阳性结果主要由引物之间的自配、引物内自配或脱靶杂交导致的。为了克服传统标记策略,交叉污染和技术设计导致的假阳性结果,在本发明中,发明人利用单标记的引物、南极热敏尿嘧啶脱氧核酸糖基化酶和自避分子识别系统,以mcda技术为基础,开发了mcda结合纳米传感、自避分子识别系统及南极热敏尿嘧啶脱氧核酸糖基化酶核酸检测技术[multiplecrossdisplacementamplificationcoupledwithnanoparticles-basedlateralflowbiosensor(lfb),self-avoidingmolecularrecognitionsystems(samrs)andantarcticthermalsensitiveuracil-dna-glycosylase(audg)forsimultaneousdetectionofnucleicacidsequenceandeliminationofcarryovercontamination;audg-samrs-mcda-lfb]。为了验证audg-samrs-mcda-lfb技术的可行性,结核分枝杆菌复合群(mycobacteriumtuberculosiscomplex,mtc)被应用于audg-samrs-mcda-lfb技术,建立检测mtc的audg-samrs-mcda-lfb诊断方法。
技术实现要素:
基于上述发明目的,本发明首先提供了一种多交叉置换恒温扩增结合高分子纳米生物传感检测目的基因的方法,所述方法包括以下步骤:
(1)提取待检测样品的基因组;
(2)提供在3’端倒数第二位碱基至倒数第五位碱基的4个碱基被samrs修饰的引物,该修饰可以增加引物的特异性,使引物特异性地与目标模板结合;而且还可以减少引物二聚体的形成及引物内的自体杂交,所述引物包括:置换引物f1和f2,所述置换引物f1的序列如seqidno:1所示,所述置换引物f2的序列如seqidno:2所示;交叉引物cp1和cp2,所述交叉引物cp1的序列如seqidno:3所示,所述交叉引物cp2的序列如seqidno:4所示;提供扩增引物c1和c2,d1和d2,r1和r2,引物c1的序列如seqidno:5所示,引物c2的序列如seqidno:6所示;引物d1的序列如seqidno:7所示,引物d2的序列如seqidno:8所示,引物r1的序列如seqidno:9所示,引物r2的序列如seqidno:10所示,同时提供在上述任一引物的5’端标记有半抗原的修饰引物;上述引物是针对目的基因为结核分枝杆菌复合群的is6110特异序列而设计的。
(3)在南极热敏尿嘧啶脱氧核酸糖基化酶、链移位型聚合酶、解链温度调节剂、引物、dntp,以及生物素化的脱氧尿嘧啶存在下,使用待检测样品的基因组核酸作为模板恒温扩增dna;
(4)使用高分子纳米生物传感器检测步骤(3)的扩增产物。
在一个优选的技术方案中,在5’端标记有半抗原的修饰引物为扩增引物c1。
在一个更为优选的技术方案中,所述在5’端标记的半抗原为荧光素。
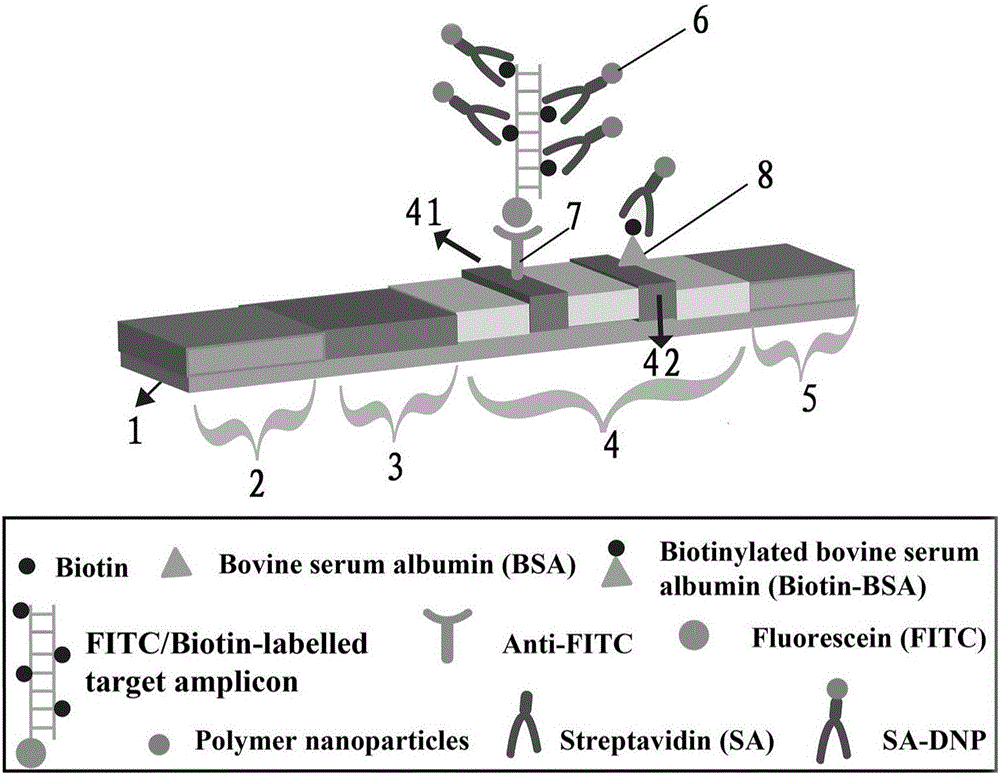
尤为优选地,所述高分子纳米生物传感器包括一背板1,在所述背板1上依次设置装有样品板2、结合板3、硝酸纤维素膜4及吸水板5,在所述硝酸纤维素膜4上依次设置检测线41及控制线42,在结合板3、检测线41、及控制线42区域依次包被有色基团修饰的亲和素化的高分子纳米粒子6、抗荧光素抗体7及生物素偶联的牛血清蛋白8。
在一个优选的技术方案中,所述恒温扩增是在60-62℃的环境中进行的。
在一个更为优选的技术方案中,所述恒温扩增是在61℃的环境中进行的。
其次,本发明还提供了一组用于恒温扩增结核分枝杆菌复合群is6110特异序列的引物序列,其特征在于,所述序列包括:如seqidno:1所示的置换引物f1,如seqidno:2所示的置换引物f2,如seqidno:3所示的交叉引物cp1,如seqidno:4所示的交叉引物cp2,如seqidno:5所示的扩增引物c1,如seqidno:6所示的扩增引物c2,如seqidno:7所示的扩增引物d1,如seqidno:8所示的扩增引物d2,如seqidno:9所示的扩增引物r1,如seqidno:10所示的扩增引物r2,同时提供在上述任一引物的5’端标记有半抗原的修饰引物。
在一个优选的技术方案中,在所述引物的3’端的4个碱基被samrs修饰,其中a被修饰为2-氨基嘌呤,t被修饰为2-硫代胸腺嘧啶,c被修饰为n4-乙酰胞嘧啶,g被修饰为次黄嘌呤。
在一个更为优选的技术方案中,在5’端标记有半抗原的修饰引物为扩增引物c1。
优选地,所标记的半抗原为荧光素。
本发明运用samrs成分对引物修饰后,samrs成分[a*,2-aminopurine(2-氨基嘌呤);t*,2-thiothymine(2-硫代胸腺嘧啶);c*,n4-ethylcytosine(n4-乙酰胞嘧啶);g*,hypoxanthine(次黄嘌呤)]只能与天然的碱基配对,即a*:t,t*:a,c*:g,g*:c),因此,引物在末端经samrs成分修饰后,保证了samrs引物只能与对应的目标结合,不能和非靶标结合,从而增加引物的特异性,保证方法的特异性,消除了脱靶杂交导致的假阳性结果。此外,samrs成分只能与天然的碱基配对(即a*:t,t*:a,c*:g,g*:c),而samrs成分之间不能配对(即不存在a*:t*和c*:g*配对),因此,含有samrs成分的引物间不能杂交或引物内不能杂交,消除引物之间的杂交(即引物之间不能形成二聚体)或引物内的自我杂交(即不能形成引物内二级结构),保证了引物的高效性和特异性,因此消除了由引物二聚体及二级结构导致的假阳性结果。
本发明所提供的方法针对结核分枝杆菌复合群的is6110特异序列的扩增产物能被高分子纳米生物传感器可视化检测。所述方法便捷、快速、敏感、特异,适宜于各种核苷酸片段检测。本发明整个反应扩增时间仅为45分钟,而且检测范围为2×106~2×101拷贝/微升,具有极高的灵敏度。在本发明中,audg的降解能力达1×10-14克/微升。因此本发明中的audg-samrs-mcda方法能够有效的消除污染子。
以常见的分枝杆菌型别及非分枝杆菌的基因组核酸为模板进行audg-samrs-mcda-lfb技术的特异性评价,结果显示,只有属于mtc的成员,经audg-samrs-mcda-lfb检测产生阳性结果,无假阳性及假阴性结果产生,说明本发明建立的audg-samrs-mcda-lfb方法具有优异的特异性。
附图说明
图1a.mcda扩增原理示意图;
图1b.高分子纳米生物传感器结构示意图;
图1c.高分子纳米生物传感器检测结果显示图;
图2a.mcda引物验证结果图谱;
图2b.samrs-mcda引物验证结果图谱;
图3.运用不同的菌株模板及空白对照评价mcda方法;
图4.运用不同的菌株模板及空白对照评价samrs-mcda方法;
图5.标准samrs-mcda最佳反应温度测试结果图谱;
图6a.smars-mcda方法的灵敏度结果图谱;
图6b.mcda方法的灵敏度结果图谱;
图7.audg-samrs-mcda消除污染子原理示意图;
图8a.audg-samrs-mcda消除污染子结果图谱;
图8b.audg不存在时samrs-mcda消除污染子结果图谱;
图9.audg-samrs-mcda-lfb技术的最佳反应时间测试结果图谱
具体实施方式
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的保护范围构成任何限制。
1.本发明中所涉及的试剂:
背板、样品垫、金标垫、纤维膜及吸水垫购于jie-yi公司。抗地高辛抗体(anti-dig),生物素化的小牛血清(b-bsa)购于abcam公司。有色基团(紫红色)修饰的,亲和素化的高分子纳米粒子(dyestreptavidincoatedpolymernanoparticles,sa-dnps,129nm)购买于bangslaboratories。dna提取试剂盒(qiaampdnaminikits;qiagen,hilden,germany)购于德国qiagen公司。恒温扩增试剂和显色剂(hydroxynaphthol,hnb)购买自北京海泰正元生物科技有限公司。生物素化的脱氧胞嘧啶(biotin-14-dctp),脱氧尿嘧啶(dutp)购买自thermoscientific公司。南极热敏尿嘧啶脱氧核酸糖基化酶(audg),脱氧胞嘧啶(dctp),脱氧胸腺嘧啶(dttp),脱氧腺嘌呤(datp)和脱氧鸟嘌呤(dgtp)购买自newenglandbiolabs公司。dl50dnamarker购于宝生物工程(大连)有限公司。其余试剂均为市售分析纯产品。
本发明实验中使用的主要仪器:恒温实时浊度仪la-320c(eikenchemicalco.,ltd,,japan)购于日本荣研公司。电泳设备为北京君意东方电泳设备有限公司产品;凝胶成像系统为bio-radgeldoxxr,美国bio-rad产品。
2.引物设计:
为了验证、评价audg-samrs-mcda-lfb技术及建立针对mtc病原体的快速、敏感和特异的audg-samrs-mcda-lfb检测体系。本发明针对mtc的特异插入序列6110(is6110;genbankno.x17348)设计扩增引物,旨在验证audg-samrs-mcda-lfb技术的可行性、敏感性、特异性及可靠性。
引物设计结果:
is6110特异序列存在于所有的mtc成员中,其特异性好,可以将mtc与其他密切相近的分枝杆菌属鉴别分开。利用引物设计软件primerexplorerv4(eikenchemical)(http://primerexplorer.jp/e/)和引物设计软件primerpremier5.0设计mcda引物,并将获得的特异性引物在ncbi数据库(http://blast.ncbi.nlm.nih.gov/blast.cgi)中进行序列比对分析,以排除引物与其他物种序列可能存在的非特异性匹配,最终获得优化后的mcda扩增引物,该引物针对mtc所有成员的检测。在标准mcda引物的基础上,运用samrs组分对标准的mcda引物进行修饰,构建samrs-mcda引物,该引物用于建立samrs-mcda扩增。标准的mcda及samrs-mcda引物序列及修饰见表1。
表1标准mcda引物序列
c1*,5'端标记fitc(该引物用于mcda-lfb检测体系);fitc,fluoresceinisothiocyanate(荧光素)。
nt,nucleitid(核苷酸);mer,monomeric(单体单元)。
samrs-mcda引物序列修饰见表2。
表2.samrs-mcda引物序列修饰
samrs,self-avoidingmolecularrecognitionsystem(自避分子识别系统)。samrs-c1*,5'标记fitc(该引物用于audg-samrs-mcda-lfb检测体系)。a*,2-aminopurine(2-氨基嘌呤);t*,2-thiothymine(2-硫代胸腺嘧啶);c*,n4-ethylcytosine(n4-乙酰胞嘧啶);g*,hypoxanthine(次黄嘌呤)。
3.横向流动纳米传感器(lfb)的设计
横向流动纳米传感器(lfb)的设计见图1b。lfb包含一背板1,在所述背板1上依次设置装有样品板2、结合板3、硝酸纤维素膜4及吸水板5,在所述硝酸纤维素膜4上依次设置检测线41及控制线42。图1b中,biotin为生物素,bsa为牛血清白蛋白,biotin-bsa为生物素化的牛血清白蛋白,fitc为荧光素,anti-fitc为抗荧光素抗体,fitc/biotin-labelledtargetamplicon为荧光素和生物素标记的扩增子,polymernanoparticles为高分子纳米粒子,sa为亲和素,sa-dnp为亲和素化的高分子纳米粒子。首先将样品板、结合板、纤维膜及吸水板依次组装在背板上。然后将sa-dnps,anti-fitc及b-bsa分别包被在金标垫、检测线41(tl1)及控制线42(cl),待干燥后备用
lfb的检测原理:将mcda产物滴加到lfb的样品垫区域,然后将缓冲液滴加到lfb的样品垫区域。mcda产物在虹吸作用下,从下往上运动(从样品垫向吸水垫方向运动)。当mcda产物达到结合垫后,标记到产物上的生物素与sa-dnps反应。当产物继续运动,双标产物的一端(半抗原标记端,即fitc标记端)与tl(检测线)区域的抗体(即抗fitc抗体)结合,将双标产物固定在检测线区域。随着产物在检测线区域的积累,通过结合的sa-dnps进行显色反应,从而对mcda产物进行可视化检测。此外,过剩的sa-dnps可与cl(质控线)区域的b-bsa反应,进行直接显色反应,判断lfb的功能是否正常。
lfb结果的判读(图1c):仅cl区域出现红色条带,表示阴性对照,没有阳性产物(ii);cl及tl区域同时出现红色条带,表示针对靶标的检测为阳性结果(i);当lfb不出现红线条带时,表示lfb失效;当tl出现红色条带时,cl无红色条带,代表结果不可行,需要重新检测。
mcda及samrs-mcda扩增结果判读:
mcda及samrs-mcda扩增之后,三种检测方法被用于扩增判别。首先,在反应混合物中加入可视染料(如hnb试剂),阳性反应管的颜色从紫色变为天蓝色,阴性反应管则保持原来的紫色。其次,mcda产物可以通过琼脂糖电泳后检测扩增子,由于产物中包含了不同大小的扩增片段,因此阳性扩增产物的电泳图呈特异性阶梯状,阴性反应不出现任何条带。更为直接简单的方法为通过lfb对产物进行检测。
可视颜色变化法:mcda和samrs-mcda在合成dna的同时产生大量的焦磷酸根离子,该离子能够与反应体系中的镁离子结合,形成不可溶的物质,从而改变溶液的ph值,使反应混合液的颜色发生改变。可以通过目视检测颜色变化判读结果,阳性反应管从紫色变为天蓝色,阴性反应保持紫色不变,见图2a(左图)和2b(左图)。
实施例1.mcda扩增
1.mcda反应原理
mcda反应体系包括10条引物,识别靶序列的10个区域,包括2条交叉内引物,即cp1和cp2(crossprimer,cp),2条置换引物(displacementamplification),即f1和f2,6条扩增引物(amplificationprimer),即d1,c1,r1,d2,c2和r2。为了构建可检测产物,选择10条引物中任意一条引物,在5’端标记半抗原(fitc,荧光素),新标记的引物被命名为f1*,f2*,cp1*,cp2*,c1*,c2*,d1*,d2*,r1*和r2*。在本发明中,以c1*为例子阐明本发明的原理。
在既定的恒温条件下,反应体系中的双链dna处于半解离和半结合的动态平衡状态中,任何一个引物向双链dna的互补部位进行碱基配对延伸时,另一条链就会解离,变成单链。首先在bst2.0dna聚合酶的作用下,以cp1引物p1区段的3′末端为起点,与对应的dna互补序列配对,启动链置换dna合成(图1a,步骤1)。处在上游的f1引物置换cp1引物扩增形成的产物,该产物能够同时结合五条引物(c1*,d1,r1,cp2和f2,步骤2)。当c1*引物退火到目标序列时,生物素化的脱氧胞嘧啶(biotin-14-dctp)被bst2.0dna酶整合到扩增子。随着mcda扩增的进行,形成大量的双标产物(一端标记半抗原,中间标记生物素),双标产物起源于标记的c1*引物和渗入到扩增子中生物素化的脱氧胞嘧啶(biotin-14-dctp)。该双标的产物能被高分子纳米生物传感器检测,从而进行可视检测。
图1a中,fitc为荧光素,c1为c1引物,c1*为荧光素标记的c1引物,biotin为生物素,biotin-14-dctp为生物素标记的dctp。
详细的mcda扩增见发明人的前期专利cn104946744a。
2.标准的mcda反应体系:
交叉引物cp1的浓度为40pmol,交叉引物cp2的浓度为40pmol,置换引物f1和f2的浓度为10pmol,扩增引物c1*,c2,r1,r2,d1和d2的浓度为20pmol,2m的betain,8mm的mgso4,2.5μl的10×bstdna聚合酶缓冲液,1.4mm的datp,0.7mm的dttp,0.7mm的dutp,1.38mm的dctp,0.02mm的biotin-14-dctp,1.4mm的dgtp,10u的链置换dna聚合酶,1u的南极热敏尿嘧啶脱氧核酸糖基化酶,1μl的模板,补加去离子水至25μl。整个反应恒温在61℃1小时,80℃5min终止反应。
3.验证mcda引物的可行性
图2a表示针对mtc的mcda引物的验证,2a1表示阳性扩增[反应管中加入2×103拷贝(10pg)的mtc模板,作为阳性对照],2a2表示阴性扩增(反应管中加入金黄色葡萄球菌模板,作为阴性对照测定是否存在交叉反应),2a3表示阴性扩增(反应管中加入肺炎克雷伯菌模板,作用阴性对照),2a4表示阴性扩增(1微升的双蒸水代替模板,作为空白对照)。只有阳性对照出现阳性扩增,说明针对mtc特异的is6110序列设计的检测mtc的mcda引物可用。
电泳检测法:将2a(左图)的产物进行电泳检测,由于mcda的扩增产物包含了许多大小不一的短片段及一系列反向重复的靶序列构成的茎环结构和多环花椰菜样结构的dna片段混合物,电泳后在凝胶上显现不同大小区带组成的阶梯式图谱,见图2a(右图)。通过电泳检测法判读mcda的扩增结果,阳性反应出现了预期的结果,而阴性反应和空白对照未出现任何扩增条带,进一步验证了本研究所设计的mcda及samrs-mcda引物可行,可用于靶序列扩增检测。
lfb检测:将2a(左图)的产物进行lfb检测,由于针对mtc检测的mcda引物(c1*)标记的半抗原为fitc,因此,当tl和cl出现红色条带时表示为mtc检测阳性。通过lfb检测法判读mcda扩增结果,阳性反应出现了预期的结果,而阴性反应和空白对照仅出现cl红色条带,验证了本研究所设计的mcda-lfb技术、mcda引物可行,能够用于目的靶序列的检测(图2a,中图)。
4.运用不同的菌株模板及空白对照评价mcda方法:
一共64个反应用于评价mcda,包括一个阳性对照反应[信号1,反应管中加入2×103拷贝(10pg)的mtc模板,作为阳性对照],31个阴性对照反应(信号2-32,反应管中加入非mtc模板,作为阴性对照)和32个空白对照反应(信号33-64,1微升的双蒸水代替模板,作为空白对照反应)。在61℃恒温1小时,mcda共产生四个假阳性结果(图3)。其中两个假阳性结果被称为非特异性扩增,扩增来自于mcda引物与非特异性模板之间的脱靶杂交(信号18和25)。其余的两个假阳性结果被称为自我扩增,扩增来自于引物之间或引物内自我匹配,引物反应体系中没有任何模板(信号37和57)。因此,标准mcda会导致假阳性结果。
实施例2.samrs-mcda反应体系
1.sams-mcda反应原理
sams-mcda的反应原理与普通mcda反应一样,仅仅用samrs成分对普通mcda引物进行修饰,增强了引物的特异性,从而增强了方法的特异性,因此消除由脱靶杂交、引物二聚体导致的假阳性结果。
2.sams-mcda反应体系
交叉引物samrs-cp1的浓度为40pmol,交叉引物samrs-cp2的浓度为40pmol,置换引物samrs-f1和samrs-f2的浓度为10pmol,扩增引物samrs-c1*,samrs-c2,samrs-r1,samrs-r2,samrs-d1和samrs-d2的浓度为20pmol,2m的betain,8mm的mgso4,2.5μl的10×bstdna聚合酶缓冲液,1.4mm的datp,0.7mm的dttp,0.7mm的dutp,1.38mm的dctp,0.02mm的biotin-14-dctp,1.4mm的dgtp,10u的链置换dna聚合酶,1u的南极热敏尿嘧啶脱氧核酸糖基化酶,1μl的模板,补加去离子水至25μl。整个反应恒温在61℃1小时,80℃5min终止反应。
3.验证samrs-mcda引物的可行性:
图2b表示针对mtc的samrs-mcda引物的验证,2b1表示阳性扩增(反应管中加入2×103拷贝的mtc模板,作为阳性对照),2b2表示阴性扩增(反应管中加入金黄色葡萄球菌模板,作为阴性对照测定是否存在交叉反应),2b3表示阴性扩增(反应管中加入肺炎克雷伯菌模板,作用阴性对照),2b4表示阴性扩增(1微升的双蒸水代替模板,作为空白对照)。只有阳性对照出现阳性扩增,说明标准的mcda引物经过samrs成分修饰后,仍然能够进行扩增,说明针对mtc特异的is6110序列设计的检测mtc的samrs-mcda引物可用。
电泳检测法:将2b(左图)的产物进行电泳检测,由于samrs-mcda的扩增产物包含了许多大小不一的短片段及一系列反向重复的靶序列构成的茎环结构和多环花椰菜样结构的dna片段混合物,电泳后在凝胶上显现不同大小区带组成的阶梯式图谱,见图2b(右图)。通过电泳检测法判读samrs-mcda的扩增结果,阳性反应出现了预期的结果,而阴性反应和空白对照未出现任何扩增条带,进一步验证了本研究所设计的samrs-mcda引物可行,可用于靶序列扩增检测。
lfb检测:将图2b(左图)的产物进行lfb检测。由于针对mtc检测的samrs-mcda引物(samrs-c1*)标记的半抗原为fitc,因此,当tl和cl出现红色条带时表示为mtc检测阳性。通过lfb检测法判读samrs-mcda扩增结果,阳性反应出现了预期的结果,而阴性反应和空白对照仅出现cl红色条带,验证了本研究所设计的samrs-mcda-lfb技术,samrs-mcda引物可行,能够用于目的靶序列的检测(图2b中图)。
4.运用不同的菌株模板及空白对照评价samrs-mcda方法
一共64个反应用于评价samrs-mcda反应,包括一个阳性对照反应[信号1,反应管中加入2×103拷贝(10pg)的mtc模板,作为阳性对照],31个阴性对照反应(信号2-32,反应管中加入非mtc模板,作为阴性对照)和32个空白对照反应(信号33-64,1微升的双蒸水代替模板,作为空白对照应)。在61℃恒温1小时,samrs-mcda不产生任何的假阳性结果(图4),甚至扩增时间延长到1.5小时。唯一的阳性扩增来自于阳性对照(信号1)。较mcda方法而言,samrs-mcda方法不产生任何假阳性结果。因此,samrs-mcda方法比标准的mcda方法更适合检测领域。
实施例3.samrs-mcda技术的最佳反应温度测定
在samrs-mcda反应体系条件下,加入mtc模板及所设计的对应的samrs-mcda引物,其模板浓度为2×103拷贝/微升(10pg/微升)。反应在恒温条件下进行(59-66℃),结果运用实时浊度仪进行检测,在不同的温度下得到不同的动态曲线图,见图5。60-62℃被推荐作为samrs-mcda引物的最佳反应温度。本发明中的后续验证选择61℃作为恒温条件进行samrs-mcda扩增。
实施例4.samrs-mcda-lfb检测的灵敏度评价
运用连续稀释好的模板(10ng,10pg,1pg,100fg,10fg,1fg和100aq/微升~2×106,2×103,2×102,2×101,2×100,2×10-1和2×10-2拷贝/微升)进行samrs-mcda扩增反应后,运用lfb检测显示结果。针对mtc检测,samrs-mcda-lfb的检测范围为2×106~2×101拷贝/微升,lfb在tl和cl区域出现红色线(图6a,下图,6a1-6a4)。当反应体系中基因组模板量降低至2×100拷贝及以下时,lfb仅在cl区域出现红色线,表示阴性结果(图6a,下图,6a5-6a8)。6a1到6a7表示mtc的模板量为10ng、10pg、1pg、100fg、10fg、1fg和100aq/微升,6a8表示空白对照(1微升双蒸水)。运用lfb可视化读取samrs-mcda的扩增结果与hnb(图6a,中图)、实时浊度(图6a,上图)读取的结果一致。此外,与标准的mcda方法比较,samrs-mcda方法的敏感度与标准mcda的敏感度一致。图6b表示mcda方法的敏感度,上图为运用实时浊度检测mcda的敏感度,中图为运用hnb检测mcda的敏感度,下图为运用lfb检测mcda的敏感度。
实施例5.南极热敏尿嘧啶脱氧核酸糖基化酶(audg)去除交叉污染评价
在反应体系中,由于加入了脱氧尿嘧啶(dutp),随着samrs-mcda扩增的进行,所有的扩增产物都被渗入脱氧尿嘧啶(dutp)。当扩增产物(渗入脱氧尿嘧啶的扩增子)进入扩增体系时,audg在常温条件下(如室温)移除单链或双链中脱氧尿嘧啶,从而使单链或双链dna出现缺口(图7,nucleicacid,靶标核酸;carryovercontamination,交叉污染子;hapten,半抗原;hapten-labeledprimer,半抗原标记的引物;bst2.0,bst2.0dna聚合酶;audg,audg酶;biotin,生物素;dctp,脱氧胞嘧啶;biotin-14-dctp,生物素化的脱氧胞嘧啶;dutp,脱氧尿嘧啶)。由于天然的模板不包含脱氧尿嘧啶,因此audg对天然的dna无催化作用。当进行mcda扩增时,温度较高(大于60℃),带有缺口的单链或双链dna在热力作用下降解,因此不能作为模板进行扩增,从而消除了反应体系的污染产物,达到去除交叉污染的目的。此外,audg在温度大于50℃时,会立即失活,从而不能降解新合成的扩增产物,即使扩增产物中包含脱氧尿嘧啶。因此本发明中选择的audg酶既能用于消除交叉污染,又不影响mcda的正常扩增。
为了证实audg能够作为有效的工具消除dutp渗入的扩增产物,samrs-mcda反应的扩增产物被连续稀释(1×10-12,1×10-13,1×10-14,1×10-15,1×10-16,1×10-17,1×10-18和1×10-19克/微升)。各个稀释度扩增产物被用作模板,用于samrs-mcda反应。在反应体系中无audg存在的情况下,samrs-mcda能够检测污染子的能力为1×10-18克/微升(图8b,上图为运用实时浊度判读samrs-mcda的结果,中图为运用hnb判读samrs-mcda的结果,下图为运用lfb判读samrs-mcda的结果);在反应体系中audg存在的情况下,samrs-mcda能够检测污染子的能力为1×10-14克/微升(图8a,上图为运用实时浊度判读samrs-mcda的结果,中图为运用hnb判读samrs-mcda的结果,下图为运用lfb判读samrs-mcda的结果)。在常规情况下,扩增产物导致的,能够产生交叉反应的污染子浓度通常为1×10-18克/微升。本发明中,audg的降解能达1×10-14克/微升。因此本发明中的audg-samrs-mcda方法能够有效的消除污染子。
实施例6.audg-samrs-mcda-lfb技术的最佳反应时间测定
在audg-samrs-mcda反应体系条件下,同时加入针对mtc扩增的samrs-mcda引物及稀释后的mtc模板(10ng,10pg,1pg,100fg,10fg,1fg和100aq/微升~2×106,2×103,2×102,2×101,2×100,2×10-1和2×10-2拷贝/微升)。反应在恒温条件下进行(61℃),恒温时间分别25分钟、35分钟、45分钟和55分钟。运用lfb检测显示:audg-samrs-mcda-lfb技术在检测目的靶标时,最佳反应时间为45分钟(图9)。当audg-samrs-mcda体系在扩增步骤恒温45分钟时,最低检测限水平的模板能够被检出(图9c)。图9c,lfb检测范围为10ng~100fg,lfb在tl和cl区域出现红色线(lfb1-lfb4)。当反应体系中基因组模板量降低至10fg及以下时,lfb仅在cl区域出现红色线,表示阴性结果(lfb5-lfb7)。图9运用lfb可视化读取audg-samrs-mcda体系从25分钟到55分钟的扩增结果;lfb1到lfb7表示mtc的模板量为10ng,10pg,1pg,100fg,10fg,1fg,100aq;lfb8表示空白对照(1微升双蒸水)。
实施例7.audg-samrs-mcda-lfb技术的特异性评价
以常见的分枝杆菌型别及非分枝杆菌的基因组核酸为模板评价audg-samrs-mcda-lfb技术的特异性(表3)。audg-samrs-mcda-lfb技术能准确地检测出mtc成员,说明audg-samrs-mcda-lfb方法的特异性良好,见表2。
表3菌株及特异性检测结果
a分枝杆菌参考菌株,来源于中国国家结核病参比实验室。
batcc,americantypeculturecollection(美国模式培养物保藏所);zg-cdc,zigongcenterfordiseasecontrolandprevention(自贡市疾病预防控制中心);icdc,nationalinstituteforcommunicablediseasecontrolandprevention,chinesecenterfordiseasecontrolandprevention(中国疾病预防控制中心,传染病预防控制所)。
cp,positive(audg-samrs-mcda-lfb检测阳性);n,negative(audg-samrs-mcda-lfb检测阴性)。表2中检测结果说明,只有属于mtc的成员,经audg-samrs-mcda-lfb检测产生阳性结果,说明所建立的audg-samrs-mcda-lfb方法能够准确鉴定mtc,无假阳性及假阴性结果产生。
序列表
<110>中国疾病预防控制中心传染病预防控制所
<120>一种结合audg和自避分子识别系统的多交叉恒温扩增方法
<141>2017-09-19
<160>10
<170>siposequencelisting1.0
<210>1
<211>19
<212>dna
<213>mycobacteriumtuberculosiscomplex
<400>1
ccaacaagaaggcgtactc19
<210>2
<211>18
<212>dna
<213>mycobacteriumtuberculosiscomplex
<400>2
ttgaaccagtcgacccag18
<210>3
<211>42
<212>dna
<213>mycobacteriumtuberculosiscomplex
<400>3
ctcgctgaaccggatcgatgtgcctgaaagacgttatccacc42
<210>4
<211>38
<212>dna
<213>mycobacteriumtuberculosiscomplex
<400>4
tagccgagacgatcaacggcctcgacatcctcgatgga38
<210>5
<211>22
<212>dna
<213>mycobacteriumtuberculosiscomplex
<400>5
ctcgctgaaccggatcgatgtg22
<210>6
<211>20
<212>dna
<213>mycobacteriumtuberculosiscomplex
<400>6
tagccgagacgatcaacggc20
<210>7
<211>18
<212>dna
<213>mycobacteriumtuberculosiscomplex
<400>7
tactgagatcccctatcc18
<210>8
<211>19
<212>dna
<213>mycobacteriumtuberculosiscomplex
<400>8
ctatacaagaccgagctga19
<210>9
<211>17
<212>dna
<213>mycobacteriumtuberculosiscomplex
<400>9
gaccgacggttggatgc17
<210>10
<211>19
<212>dna
<213>mycobacteriumtuberculosiscomplex
<400>10
agctcctatgacaatgcac19
- 还没有人留言评论。精彩留言会获得点赞!