一种用于细胞治疗的新抗原呈递细胞的制备方法与流程
本发明属于细胞工程领域,特别涉及一种用于细胞治疗的新抗原呈递细胞及其制备方法。
背景技术:
抗原递呈细胞(apc)能够摄取加工处理抗原,并将抗原递呈给淋巴细胞,能够辅助和调节t细胞、b细胞识别抗原并对抗原产生应答。专职的抗原递呈细胞有单核吞噬系统,如单核细胞-巨噬细胞和树突状细胞。这类细胞在外周血中含量较低,通常比例低于2%,不容易获得,并且存在处理过程复杂,自身不会自我扩增等局限性。非专职的抗原递呈细胞有血管内皮细胞、上皮细胞、间质细胞、成纤维细胞和活化的t细胞,这些细胞通常与炎症反应的发生和某些自身免疫性疾病的发生有关,且不容易获得。
既往及目前肿瘤特异性免疫治疗都是希望得到靶向肿瘤细胞的特异性免疫细胞,对肿瘤细胞进行杀伤,以期得到较好的治疗效果,如dc疫苗是使用dc细胞携带特异性抗原,回输到患者体内,发挥抗原递呈和激活体内特异性t细胞,但是,dc细胞较难获得和患者体内的肿瘤免疫微环境极大地限制了dc疫苗的效果。
技术实现要素:
为解决上述问题,本发明提供了一种用于细胞治疗的新抗原呈递细胞及其制备方法,所获得的抗原递呈细胞具有获得途径简便,数量较多,并且抗原递呈效果显著,在体外培养环境下即可有效激活特异性t细胞增殖。
本发明的目的是通过以下技术方案实现的:
一种用于细胞治疗的新抗原呈递细胞的制备方法,包括以下步骤:
1)抽取人外周血;
2)使用人外周血单个核细胞分离液分离白膜层,获得外周血单个核细胞(pbmc);
3)使用pbs洗细胞;
4)配制rpmi-1640培养基、rpmi-27γ培养基;
5)使用配制的rpmi-27γ培养基,37℃孵育pbmc2h;
6)将需要递呈的抗原多肽使用rpmi-1640配制成多肽溶液;
7)将配制的多肽溶液加入到孵育后的pbmc细胞中;
8)37℃继续孵育2h;
9)使用pbs洗细胞;
10)将孵育后的pbmc细胞与未孵育的pbmc细胞按照1:10~20的比例混合培养,即得到所述的新抗原呈递细胞。
进一步的,步骤2)中所述rpmi-1640培养基中含600u/mlil-2、800u/mlil-4、40ng/mlil-7和100pg/mlifn-γ。
本发明相比现有技术的有益效果为:
1、本发明所述的用于细胞治疗的新抗原呈递细胞的制备方法,操作简单、快捷,并能够获得大量抗原呈递细胞,可在医疗机构gmp实验室广泛开展;
2、本发明所述的用于细胞治疗的新抗原呈递细胞制备方法,是将人外周血单个核细胞经过体外处理后,使其具有较强的抗原递呈功能,并在体外进行抗原荷载后,进行诱导特异性t细胞增殖的方法,使特异性t细胞在体外扩增后,可以回输到患者体内;
3、本发明所述的新抗原呈递细胞,用于细胞治疗时,采用的是自身免疫细胞,在体外通过细胞因子和相关单克隆抗体在无血清培养基或用自身血浆加入培养基内培养,因此可以避免交叉感染,排斥反应轻微,安全性高,无明显毒副作用。
附图说明
图1为本发明所述新抗原呈递细胞制备方法的流程示意图;
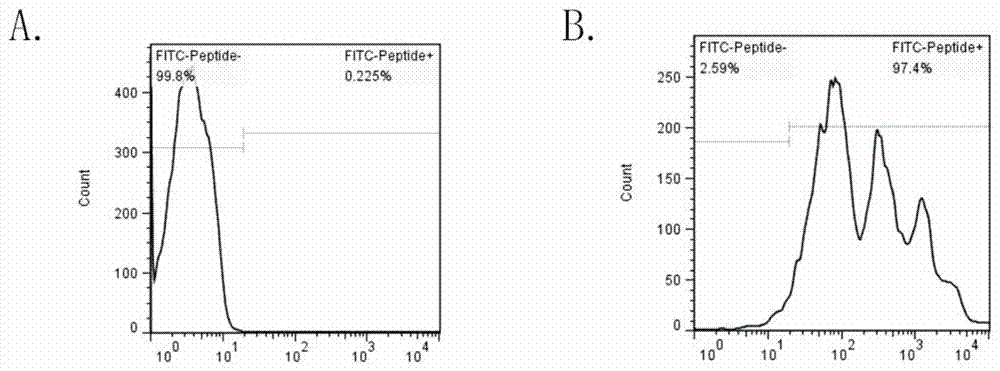
图2为本发明所述的新抗原呈递细胞荷载抗原多肽fitc-kvaelvhfl的流式细胞仪检测结果示意图;其中,a为对照组,b为多肽组;
图3为本发明所述的新抗原呈递细胞对再次接受抗原多肽fitc-kvaelvhfl刺激的免疫反应检测结果示意图;其中,a为对照组,b为多肽组。
具体实施方式
实施例
如图1所示,本实施例提供了一种用于细胞治疗的新抗原呈递细胞的制备方法,包括以下步骤:
1)抽取人外周血约10ml;
2)使用人外周血单个核细胞分离液分离白膜层,获得外周血单个核细胞(pbmc);
3)使用pbs洗细胞1次;
4)配制含600u/mlil-2、800u/mlil-4、40ng/mlil-7和100pg/mlifn-γ的rpmi-1640培养基,以及rpmi-27γ培养基;
5)使用1ml配制的rpmi-27γ培养基,37℃孵育pbmc2h;
6)将需要递呈的抗原多肽使用rpmi-1640配制成50ng/ml的多肽溶液;
7)将1ml配制的多肽溶液加入到孵育后的pbmc细胞中;
8)37℃继续孵育2h;
9)使用pbs洗细胞1次;
10)将孵育后的pbmc细胞与未孵育的pbmc细胞按照1:20的比例混合培养14天,即得到所述的所述的新抗原呈递细胞。
有效性检测:
使用1ml配制的rpmi-27γ培养基将1×106pbmc重悬,37℃孵育pbmc2h,将mage-a3蛋白第112到120号氨基酸序列进行人工合成,并在n端连接fitc染料。将人工合成的多肽fitc-kvaelvhfl使用rpmi-1640配制成50ng/ml的多肽溶液,取1ml多肽溶液将pbmc重悬,37℃孵育pbmc2h,使用流式细胞仪检测抗原递呈细胞荷载抗原多肽fitc-kvaelvhfl的效果。将孵育后的pbmc细胞与未孵育的pbmc细胞按照1:20的比例混合,同时取未经过多肽fitc-kvaelvhfl孵育过的pbmc做对照组,同时把两组细胞放入37℃细胞培养箱继续培养14天。
如图2的实验结果显示,经过多肽组孵育后的抗原递呈细胞有97.4%的细胞都携带有抗原肽fitc-kvaelvhfl,说明,经过处理的细胞可以正常携带抗原,具有作为递呈细胞的潜力。
检测经过共培养后的对照组细胞和多肽组细胞对再次接受抗原多肽fitc-kvaelvhfl刺激时,是否有相应的免疫反应。方法是:
首先,使用rpmi-1640培养基将多肽fitc-kvaelvhfl溶解成浓度2mg/ml,使用rpmi-1640培养基加入10%fbs,配制成全培养基rpmi-10。使用rpmi-10培养基将培养后的pbmc稀释成细胞浓度为5×105cell/ml。取稀释后的细胞悬液加入到24孔板各孔中,每孔1ml。取配制完成的多肽溶液各10ul加入到细胞悬液中;加入100ng/mlokt3(cd3单抗),作为阳性对照管;使用rpmi-10作为空白对照。将各孔细胞溶液轻拍混匀。
如图3的实验结果显示,对照组细胞对抗原多肽fitc-kvaelvhfl的再次刺激不能产生ifn-γ分泌现象,与对照rpmi-1640培养基组无显著性差异。多肽组细胞对抗原多肽fitc-kvaelvhfl的再次刺激可以产生ifn-γ分泌现象,说明,抗原递呈细胞已经把抗原多肽fitc-kvaelvhfl递呈给特异性t细胞,并且特异性t细胞在接收到抗原递呈细胞的激活信号后产生了增殖,和记忆效应。
安全性检测:
本发明用于细胞治疗时,采用的是自身免疫细胞,在体外通过细胞因子和相关单克隆抗体在无血清培养基或用自身血浆加入培养基内培养,因此可以避免交叉感染。效应细胞在回输前经3~4次无菌pbs或生理盐水洗涤,可以避免因异种抗原产生的过敏反应。另外,效应细胞在回输前还需经过细菌、真菌、热原和内毒素检测,并通过显微镜及革兰氏染色,可避免细菌污染的漏检。除少数患者可能产生轻度发热和感冒症状外(通常是由于加入细胞液中的il-2所致),病人能够充分耐受,无明显严重不良反应发生。总之,因回输的免疫细胞来自患者自身,所用的培养基为质量合格的无血清培养基,故排斥反应轻微,安全性高,无明显毒副作用。
本发明所述方法采用患者自身细胞在体外经过高科技程序化处理而产生的功能强大的特异性细胞,不存在违背医学伦理的问题。
- 还没有人留言评论。精彩留言会获得点赞!