天赐霉素的高产菌株及其发酵工艺和应用的制作方法
本发明涉及一种天赐霉素的高产菌株及其发酵工艺和应用,属于生物制药技术领域。
背景技术:
面对原创新药研发投入成本高,失败率高的研发困境,如何有效加快新药研发的进程受到广泛关注。1980年至今,79%抗肿瘤药物是基于天然产物(j.nat.prod.2012,75,311.),天然产物已被证明是现代药物的重要来源,尤其是抗肿瘤药物的重要来源。而其中烯二炔天然产物具有卓越的抗肿瘤活性,成药率高等优点,迄今为止已发现11个烯二炔化合物的结构,依据结构主要分为九元环和十元环,目前临床使用的有九元环烯二炔新制癌菌素,应用于肝癌的治疗。卡奇霉素已作为新一代抗体偶联药物的弹头,对抗肿瘤领域的靶向治疗产生了深远影响。2017年cd33,cd22与卡奇霉素的抗体偶联药物先后在欧洲及美国fda批准上市(drugs.2017.doi:10.1007/s40265-017-0802-5.),我国开发的以力达霉素为弹头的偶联化合物目前正在临床二期实验中。
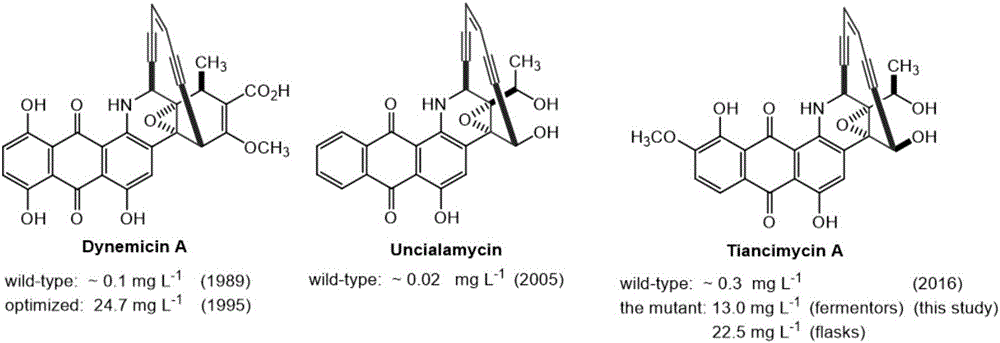
烯二炔类化合物特征结构为共轭炔-烯-炔的环状结构,具有优越的抗肿瘤活性(bioorg.med.chem.lett.2015,25,9)。烯二炔类天然产物抗肿瘤的具体机制如下,其烯二炔环状结构通过bergman或myers-saito重排,芳构化后形成的苯环双自由基可以进入dna小沟,通过夺取dna脱氧核糖上的氢离子后形成的自由基与分子氧反应,引起dna的断裂,达到抗肿瘤的目的(science.2002,297,1170)。天赐霉素(tiancimycina,tnma)是2016年从链霉菌属cb03234的发酵产物中分离发现的十元环的烯二炔类的抗肿瘤抗生素。结构与uncialamycin,dynemicin比较类似,但抗肿瘤活性较其更优越,具体见图1。
天赐霉素a与ucm对于乳腺癌细胞(mda-mb-468,mda-mb-231,skbr-3,kpl-4,bt474,dyt2),黑色素瘤细胞(m14,sk-mel-5),非小细胞肺癌细胞nci-h226,神经中枢细胞(sf-295,sf-539)的均有抑制作用,并测定其ic50值均达到nm级别。此外,ap-3,afp是fda批准进入临床使用的抗体偶联药物,天赐霉素a较二者针对于乳腺癌细胞skbr-3的抗肿瘤作用,起效更迅速(8h内),且对于癌细胞的杀死率更为彻底。
鉴于烯二炔类化合物其优越的抗肿瘤活性,复杂的分子结构,超高的成药率,新发现的烯二炔类化合物不但有极大希望成为新一代抗体偶联药物的先导化合物,而且将对天然药化领域及抗肿瘤领域的起到极大推动作用。
天赐霉素a复杂的分子结构使得通过传统的化学全合成方法来获取其相关衍生物的过程及其繁琐且效率十分低下,相关的烯二炔化合物产量低下(jantibiot.1991,44,1300,organiclett.2005,23,5233),uncialamycin(ucm),dynemicin发现时均是产量较低(分别为~0.02mgl-1,~0.1mgl-1),无法满足临床研究的需要和工业化生产的应用(见图1)。微生物发酵能够更好地获得该化合物,但是,原始菌株cb03234中的天赐霉素a发酵产率极低,约~0.5mgl-1,要推动后期的抗癌活性分析、作用机理等临床前期以及新药开发研究,就必需获得足量天赐霉素a。通过相关的遗传学改造,获得高产菌株,将此类化合物产量提升至~20mgl-1(工业化产量),将是对于该化合物的临床应用奠定良好基础。因此,进一步获得稳定的天赐霉素a高产菌株无论是从现阶段研究的需要,还是将来工业化应用的需求,都迫在眉睫。
技术实现要素:
本发明解决的技术问题是,提高链霉菌发酵合成天赐霉素a的产量,使天赐霉素a的工业化应用成为可能。
针对以上现有技术的不足,本发明提供了一种新型活性天赐霉素a的高产菌株。该高产菌株为一株链霉菌,该链霉菌为streptomycessp.cb03234-r-16,已于2017年9月30日保藏于中国典型培养物保藏中心,保藏编号为cctccm2017556。
本发明还提供上述链霉菌在制备天赐霉素a及其衍生物方面的应用,所述天赐霉素a的化学式为:
本发明中,如无特别说明,天赐霉素、天赐霉素a、天赐米星、tiancimycina、tnma均表示同一种发酵产物。
本发明进一步提供所述链霉菌的发酵工艺,在发酵过程中,控制发酵液的ph值为6-8,溶氧为10%-70%,优选溶氧为20%-60%。优选地,控制发酵液的ph值为6.5-7.5。
优选地,在发酵过程中,当发酵液的ph值上升至6.8以上时,优选控制ph值不超过7.2,向发酵液中添加酸,如盐酸、硫酸或其混合酸降低ph。盐酸优选0.5m以下的浓度,如0.2-0.3m。
优选地,以可溶性淀粉为碳源,以棉籽粉为氮源。
优选地,发酵培养基中碳源的浓度为8-50g/l;氮源的浓度为4-30g/l。优选碳源的浓度为30-50g/l;氮源的浓度为10-30g/l。
优选地,每升发酵培养基中含,每升发酵培养基中含可溶性淀粉8~50g,棉籽粉4~30g,cuso40.1~0.3g,nai5~25mg,caco32~10g,发酵培养基的ph值为6.5~7.5。
优选地,发酵温度设为常温即可(如22-33℃),发酵时间根据发酵的规模的不同有所变化,一般不超过13天,优选为6-10天。
优选地,先将所述链霉菌在25℃~32℃、200rpm~250rpm恒温摇床培养24h~50h;然后接种于生产培养基中,在25℃~32℃、200rpm~250rpm恒温摇床培养6~10天。
本发明的菌株是通过对产生活性天赐霉素a(天赐米星)的原始菌种cb03234进行基于化学诱变和核糖体工程的菌种进化,最终筛选而得的菌株。并优化发酵培养基,其发酵产率达(22.5±3.1)mgl-1,在此基础上,在15l发酵罐中通过对转速、ph值控制及溶氧等调控手段来调试和建立放大规模的天赐霉素a微生物发酵制备工艺,其发酵产率最终达到(13±1)mgl-1。
制备上述菌株的具体步骤如下:
1)链霉菌属cb03234化学/核糖体工程双重诱变及筛选;
2)链霉菌属cb03234-r-16的发酵培养基的优化;
3)链霉菌属cb03234-r-16在15l发酵罐中通过对转速、ph值控制及溶氧等调控手段来调试和建立放大规模的天赐霉素a微生物发酵制备工艺;
本发明通过对产生活性天赐霉素(天赐米星)的原始菌种cb03234进行基于化学诱变和核糖体工程的菌种进化,最终筛选获得一株高产菌株cb03234-r-16,其天赐霉素(tnma)的发酵产量与原始产量相比提高了8倍以上,达到(5.8±1.0)mgl-1,经过相关发酵工艺的优化,摇瓶(250ml)产量最终达到(22.5±3.1)mgl-1,约40倍提高,15l发酵罐产量达到(13±1)mgl-1。该菌株具备工业化生产天赐霉素a的潜力。
保藏证明
菌种名称:链霉菌cb03234-r-16;菌种的拉丁文属名:streptomycessp.;保藏编号:cctccno.:m2017556;保藏日期:2017年9月30日;保藏单位:中国典型培养物保藏中心;保藏单位地址:中国武汉,武汉大学。
附图说明
图1为现有技术中烯二炔类化合物的结构及其产量。
图2为链霉菌cb03234-r-16生物合成相关基因的表达。
图3为链霉菌cb03234-r-16优化发酵培养基的碳源。
图4为链霉菌cb03234-r-16优化发酵培养基的氮源。
图5为链霉菌cb03234-r-16在不同碳/氮源下的发酵产物的产量变化。
图6为链霉菌cb03234-r-16在不同碳/氮源及盐下的发酵产物的产量变化。
图7为链霉菌cb03234-r-16在15l发酵罐中的发酵曲线。
具体实施方式
实施例1:链霉菌属cb03234的化学诱变及核糖体工程
(1)将链霉菌属cb03234接种至g1固体生长培养基(所述g1固体生长培养基为:10g/l可溶性淀粉、1g/lmgso4·7h2o、1g/lk2hpo4、4g/lmgcl2、2g/l(nh4)2so4、2g/lcaco3、1g/l胰蛋白胨、0.5g/l酵母粉、0.001g/lmncl2·7h2o、0.001g/lfeso4·7h2o、20g/l琼脂,ph=7.0)平板上,在30℃恒温条件下培养7天左右,用无菌的20%甘油收集孢子。孢子通过平板稀疏涂布进行计数,最终制成均一的、浓度为109个/ml的孢子悬浮液。
(2)以乙醇为溶剂,配置成0.46m硫酸二乙酯(des)的溶液,然后取约109孢子悬浮液与其混匀,30℃条件下,在200r/min振荡不同时间(10-40分钟),将每个时间段的混合处理液迅速涂布在倒在5块gym固体生长培养基平板上(所述gym固体生长培养基为:4g/l葡萄糖、4g/l酵母粉、10g/l麦芽提取物、2g/lcaco3、20g/l琼脂,ph=7.2),将平板在30℃恒温条件下培养7-8天后观察存活的单菌落个数。为了接下来进一步的核糖体工程诱变,单菌落数量不能太少,即des诱变时间不能太长,最终确定最佳化学诱变时间为15分钟,致死率达99%。
(3)配制浓度为50mg/ml的利福霉素(rifa)母液,用二甲基亚砜(dmfo)溶解,并用0.22μm的无菌针头过滤器进行过滤除菌。分别配置含不同浓度rifa(1μg/ml,5μg/ml,10μg/ml,50μg/ml,100μg/ml)的固体gym生长培养基平板,每种浓度各2块平行。然后将取5ul的孢子悬浮液(106个/ml)均匀涂布在平板上,在30℃恒温条件下培养5-7天后计数,确定最小抑菌浓度(mic),最终确定rifa的mic为1ug/ml。
(4)联合化学诱变和核糖体工程:约109个cb03234孢子用0.46m的硫酸二乙酯室温处理10-40分钟,处理后的孢子涂布于含有不同浓度rifa的gym固体培养基平板(2,5,10μgml-1),单独应用核糖体工程:约109个cb03234孢子直接涂布在含有不同浓度rifa的gym固体培养基平板上(2,5,10μgml-1),在30℃恒温条件下培养7-10天后,观察其突变菌株生长情况。
获得的多株潜在高产菌株,再进行原始培养基(10g/l可溶性淀粉,5g/l棉籽粉,2g/l碳酸钙,0.05g/l硫酸铜,0.005g/l碘化钠)摇瓶发酵验证,将获得的潜在高产菌株依据突变类型每种选择一种进行摇瓶发酵验证,通过对发酵液中代谢产物的hplc分析挑选出包括cb03234-r-11,cb03234-r-10,cb03234-r-15,cb03234-r-16在内的4株突变菌,其tnma产量相对于原始菌cb03234有明显提高,其中cb03234-r-16的摇瓶发酵产量达到(5.8±1.0)mgl-1,与原始菌株相比产量提高了近8倍,通过相关的分子生物学操作,其突变类型鉴定为rpob基因存在突变,于1265位t突变为c,并在对应422位点的氨基酸由亮氨酸突变为脯氨酸。
实施例2:streptomycessp.cb03234-r-16的tnma相关生物合成基因的过量表达
选择streptomycessp.cb03234及streptomycessp.cb03234-r-16分别发酵48h,120h,160h的菌体各200ul,提取总rna,取相应的总rna进行反转录作为后续实时定量荧光pcr的模板。每份样品有三个生物学重复。荧光定量pcr条件:95℃保温10分钟,总共为40个循环,95℃为15s,55℃为60s。采用荧光定量pcr进行相对定量,以hrdb基因作为内参基因,计算方法采用2-δδct法。观测目的基因的表达情况,具体包括5个调控基因,tnmr1,tnmr3,tnmr2,tnmr4,tnmr7;天赐霉素合成相关的基因tnml(细胞色素p450酶),tnme10(二型硫酯酶);核糖体工程相关基因rela(3,5′鸟苷二磷酸合成酶)。结果可知,突变菌株较原始菌株在以上基因的表达量上都有所增加,其中与核糖体工程中应急机制中3′5′鸟苷二磷酸合成酶直接相关的rela基因的表达在突变菌株发酵后期增加明显,较原始菌株在第5天,7天分别有1.8倍及100倍的表达增加。与tnma合成直接相关的tnml,tnme10,突变菌株较原始菌株均呈现相关的增加,体现出本发明中高产菌株的优势。具体见图2。
实施例3:streptomycessp.cb03234-r-16的发酵培养基的优化
(1)基于原始培养基的主要成分,尝试实验室不同的碳源(10g/l),具体包括,可溶性淀粉(solublestarch)(原始),玉米粉(cornflour),糊精(dextrin),果糖(d-fructose),半乳糖(d-galactose),麦芽糖(d-maltose),木糖(d-xylose),甘油(glycerol),葡萄糖(glucose),乳糖(α-lactose),甘露醇(mannitol),脱脂奶粉(nonfatmilkpowder),蔗糖(sucrose)。尝试常见的不同的氮源(5g/l),具体包括:棉籽粉(pharmamedia)(原始),牛肉提取物(beefextract),酸水解酪蛋白(casaminoacids),玉米浆(cornsteepliquor),玉米蛋白粉(cornproteinpowder),鱼粉(fishmeal),鱼蛋白胨(fishpeptone),麦芽提取物(maltextract),燕麦(oatmeal),蛋白胨(peptone),花生蛋白粉(peanutproteinpowder),大豆粉(soyapeptone),胰蛋白胨(tryptone),酵母粉(yeastextract)。不添加树脂进行发酵,分别于发酵2天,4天,6天取发酵上清,检测其活性。最终确定其最佳碳源是可溶性淀粉,最佳的氮源是棉籽粉,具体见图3和图4。
(2)本发明进行了分别单独变换不同浓度的可溶性淀粉(15gl-1,20gl-1,30gl-1,40gl-1)或者(10gl-1,15gl-1,20gl-1,25gl-1)棉籽粉,其余组分不变的发酵。具体见图5,可见各个条件下tnma的产量。此外,还进行了同时变换碳氮源的用量以及无机盐,包括碘化钠(5mgl-1,15mgl-1,20mgl-1,25mgl-1,30mgl-1,35mgl-1,40mgl-1),硫酸铜(0.05gl-1,0.15gl-1,0.2gl-1,0.25gl-1,0.3gl-1,0.35gl-1,0.4gl-1),碳酸钙(2gl-1,4gl-1,6gl-1,8gl-1,16gl-1)。具体见图6。
最终确定摇瓶发酵培养基中,最优比例为,每升发酵培养基中含可溶性淀粉40g,棉籽粉20g,cuso40.2g,nai20mg,caco38g,发酵培养基的ph值为7.0。具体见图6。
实施例4:streptomycessp.cb03234-r-16在15l发酵罐中通过对转速、ph值控制及溶氧等调控手段来调试和建立放大规模的tnma微生物发酵制备工艺。
取streptomycessp.cb03234-r-16的孢子悬浮液(约109ml-1)接种至400ml胰蛋白胨肉汤(1ug/ml利福霉素),30℃培养36-48h,接种至15l的发酵罐中,发酵开始时添加hp2mgl树脂。尝试摇瓶里的最优培养基a(1l):可溶性淀粉40g,棉籽粉20g,cuso40.2g,nai20mg,caco38g,2ml消泡剂,ph7.0),尝试摇瓶里的最优培养基b(1l):可溶性淀粉30g,棉籽粉15g,cuso40.15g,nai15mg,caco36g,2ml消泡剂,ph7.0),尝试摇瓶里的最优培养基c(1l):可溶性淀粉30g,棉籽粉15g,cuso40.05g,nai5mg,caco32g,2ml消泡剂,ph7.0),在30℃,空气流速200l/h,罐内压力0.05mpa下,发酵9天。
streptomycessp.cb03234-r-16在发酵罐中的各向指标(产量titer、溶氧do和ph值)变化参见图7,当ph到达7.0时,添加0.2m的盐酸进行ph调控,维持在7.0上下。此外,在培养基c的条件下,通过探讨不同的接种量[(5%,10%,15%(v/v)],不同的溶氧水平,获得天赐霉素a的最高产量。不同接种量的尝试,最终确定10%的接种量最佳。不同溶氧条件的探讨最终确定,200-250rpm,20-60%为最佳。最终获得的最优发酵条件为:10%的接种量下,200-250rpm的转速下溶氧联动控制在(20%-60%)可以达到最优产量(13±1)mgl-1。具体见图7。
- 还没有人留言评论。精彩留言会获得点赞!