使用中靶靶标和脱靶靶标的多重靶标系统筛选靶特异性核酸酶的方法及其用途与流程
本发明涉及对具有高特异性和高活性的靶特异性核酸酶进行选择的方法,更具体而言,本发明涉及通过使用能够同时识别脱靶活性和中靶活性的多重靶标系统对靶特异性核酸酶系统进行筛选和选择的方法。
背景技术:
crispr-cas系统由引导rna和crispr酶组成,引导rna具有与待靶向的基因或核酸互补的序列,crispr酶为切割待靶向的基因或核酸的酶,引导rna与crispr酶形成crispr复合物,借助所形成的crispr复合物对所靶向的基因或核酸进行切割或修饰。
然而,一个尚未解决的问题在于,在产生上述对待靶向的基因或核酸进行修饰的效果的同时,非靶向的基因或核酸被修饰。
非靶向的基因或核酸可通过包含与引导rna部分互补的序列而部分地与引导rna相互作用,crispr复合物借助该相互作用对相应的基因(即,不期望的基因或核酸)进行切割或修饰。该效应称为脱靶效应。
因此,提高中靶效应以提高通过使用crispr-cas系统修饰靶基因或靶核酸的效率,或者降低或消除crispr-cas系统的脱靶效应以解决诸如由于不期望的基因或核酸被修饰而可能造成的遗传缺陷等问题是重要的。此外,随着上述crispr-cas系统脱靶效应的降低,可以期望待靶向的基因或核酸能够具有准确度和特异性地被精确修饰。
为了降低或消除crispr-cas系统的脱靶效应和/或改善crispr-cas系统的准确度和特异性,认为如下方面是很重要的部分:选择(即,选择具有低脱靶效应的靶标)或修饰具有低脱靶效应的引导rna以及调节crispr酶的活性(或效率)和特异性。
为了调节crispr酶的活性或特异性,尝试并开发了多种策略,例如调节细胞中cas9浓度或利用cas9切口酶造成单链dna断裂的方法、借助将foki核酸酶结构域与催化失活的cas9融合产生的融合蛋白的方法、以及使用去除了引导rna5′末端的部分序列的截短的引导rna。
因此,本发明的发明人开发了选择具有高特异性和/或活性的靶特异性核酸酶的筛选方法,并确认了使用该筛选方法能够从多种经修饰的核酸酶的候选组中有效地选出优异的靶特异性核酸酶,从而完成了本发明。
现有技术文献
专利文献
wo2013-098244
wo2015-123339
wo2014-093661
wo2014-204724
kr10-2016-0058703
非专利文献
1.anders,c.etal.,2014.structuralbasisofpam-dependenttargetdnarecognitionbythecas9endonuclease.nature513(7519),569-573.
2.anderson,e.m.,etal.,2015.systematicanalysisofcrispr?cas9mismatchtolerancerevealslowlevelsofoff-targetactivity.j.biotechnol.211,56-65.
3.frock,r.l.etal.,2015.genome-widedetectionofdnadouble-strandedbreaksinducedbyengineerednucleases.nat.biotechnol.33(2),179-186
4.bauer,d.e.etal.,2015.generationofgenomicdeletionsinmammaliancelllinesviacrispr/cas9.j.vis.exp.95.
5.brinkman,e.k.etal.,2014.easyquantitativeassessmentofgenomeeditingbysequencetracedecomposition.nucleicacidsres.42(22),e168.
6.cho,s.w.etal.,2014.analysisofoff-targeteffectsofcrispr/cas-derivedrna-guidedendonucleasesand
7.christian,m.etal.2010.targetingdnadouble-strandbreakswithtaleffectornucleases.genetics186(2),757-761.
8.cradick,t.j.etal.,2013.crispr/cas9systemstargetingβ-globinandccr5geneshavesubstantialoff-targetactivity.nucleicacidsres.41(20),9584-9592.
9.crosetto,n.etal.,2013.nucleotide-resolutiondnadouble-strandbreakmappingbynext-generationsequencing.nat.methods10(4),361-365.
10.dahlem,t.j.etal.,2012.simplemethodsforgeneratinganddetectinglocus-specificmutationsinducedwithtalensinthezebrafishgenome.plosgenet.8(8),e1002861.
11.doench,j.g.etal.,2016.optimizedsgrnadesigntomaximizeactivityandminimizeoff-targeteffectsofcrispr-cas9.nat.biotechnol.34(2),184-191
12.fu,y.etal.,2013a.highfrequencyoff-targetmutagenesisinducedbycrispr-casnucleasesinhumancells.nat.biotechnol.31(9),822-826
技术实现要素:
技术问题
本发明的一个目的在于提供使用多重靶标来选择靶特异性核酸酶的筛选系统,所述多重靶标包含一种或多种中靶靶标(on-targets)和一种或多种脱靶靶标(off-targets)。
本发明的另一目的在于提供使用多重靶标的靶特异性核酸酶的选择系统,所述多重靶标包含一种或多种中靶靶标和一种或多种脱靶靶标。
本发明的又一目的在于提供使用多重靶标来筛选和/或选择靶特异性核酸酶的试剂盒或组合物。
本发明的又一目的在于提供包含用于筛选和/或选择靶特异性核酸酶的多重靶标的细胞和/或生产该细胞的方法。
本发明的又一目的在于提供使用多重靶标来筛选和选择靶特异性核酸酶的系统以及使用该系统所选择的核酸酶的全部用途。
技术方案
为解决该问题,本发明提供了用于对具有高特异性或高活性的靶特异性核酸酶进行选择的筛选系统以及该筛选系统的多种用途。
靶特异性核酸酶可包含能够特异性识别靶标的部分以及能够切割或修饰所识别的靶标的部分,借助所述筛选系统可对能够特异性识别靶标的部分和/或能够切割或修饰所识别的靶标的部分进行筛选和/或选择。筛选系统
本文使用的术语“用于选择靶特异性核酸酶的筛选系统”指的是包括全部如下方面的概念:用于选择具有高特异性和高活性的靶特异性核酸酶的试剂盒以及组合物、其使用方法以及该过程中衍生的各种中间体。
因此,在本说明书中描述为“系统”的发明可解释为组合物或方法以适合相应发明的方面,只要该发明是用于选择所期望的靶特异性核酸酶。
本发明的一方面涉及用于筛选靶特异性核酸酶系统的方法以及用于该方法的组合物。
本发明的另一方面涉及借助该筛选方法对具有高特异性或高活性的靶特异性核酸酶进行选择的方法以及用于该方法的组合物。
作为一种优选的具体实施方式,本发明提供了:
用于选择具有高特异性或高活性的靶特异性核酸酶的筛选系统或组合物,所述筛选系统或组合物包含:
i)核酸酶,所述核酸酶包含能够识别靶标的部分和能够对所识别的靶标进行切割或修饰的部分;以及
ii)包含一种或多种选择元件的多重靶标,其中,所述多重靶标包含一种或多种中靶靶标以及一种或多种脱靶靶标。
作为另一优选的具体实施方式,本发明提供了:
用于选择具有高特异性或高活性的靶特异性核酸酶的筛选系统或组合物,所述筛选系统或组合物包含:
i)核酸酶,所述核酸酶包含能够识别靶标的部分和能够对所识别的靶标进行切割或修饰的部分;以及
ii)包含一种或多种选择元件的多重靶标,其中,所述多重靶标包含一种中靶靶标以及一种或多种脱靶靶标。
作为又一优选的具体实施方式,本发明提供了:
用于选择具有高特异性或高活性的靶特异性核酸酶的筛选系统或组合物,所述筛选系统或组合物包含:
i)核酸酶,所述核酸酶包含能够识别靶标的部分和能够对所识别的靶标进行切割或修饰的部分;以及
ii)包含一种选择元件的多重靶标,其中,所述多重靶标包含一种中靶靶标以及一种脱靶靶标。
该筛选系统可用于从多种靶标候选组中选择具有高特异性和/或高活性的优异的靶特异性核酸酶。
核酸酶
术语“靶特异性核酸酶”是指能够对期望的(靶标或靶向的)基因组中的核酸(dna或rna)的特定位置进行识别和切割的核酸酶。在本发明中,靶特异性核酸酶也作为包括使得特异性核酸酶得以执行期望功能所需的其它元件的概念而使用。
核酸酶可包括分别融合有能够识别基因组中特定靶序列的结构域(部分)以及能够对其进行切割的结构域(部分)的核酸酶,其实例可包括但不限于:大范围核酸酶;其中融合有转录激活因子样(tal)效应因子结构域(该结构域是源自植物致病基因的转录激活因子样效应因子核酸酶(talen),是能够识别基因组中特定靶序列的结构域)与切割结构域的融合蛋白;锌指核酸酶;或rna引导的工程化核酸酶(rgen)。在本发明中可优选使用rgen。
在本发明中,“rgen”包括crispr-cas系统,所述crispr-cas系统由靶特异性引导rna和crispr酶组成。
本发明的“crispr-cas系统”包含编码引导rna和crispr酶的序列,并包含参与诱导其表达或活性的全部元件。crispr-cas系统可为包含编码引导rna和crispr酶的序列的载体系统。
载体系统中包含的组成元件彼此可操作地连接。术语“可操作地连接”是指核酸序列间功能性连接,从而该序列编码期望的功能。例如,当连接的启动子和/或调控区功能性调控编码序列的表达时,期望的基因(例如选择标记的编码序列)与其启动子和/或其调控序列处于可操作地连接的状态。这是指编码序列间的连接,从而这些序列也可被同样的连接的启动子和/或调控区所调控,编码序列间的这种连接也可以指读码框或相同的编码框处的连接。术语“可操作地连接”也指具有功能但非编码的序列(例如自扩增序列或复制起点)的连接。当这些序列能够行使其正常功能(例如,当宿主细胞中包含这些序列的载体能够复制、扩增和/或分离)时,其处于可操作地连接的状态。
此外,本发明的“crispr-cas系统”包含引导rna的序列和crispr酶的蛋白或多肽,并包含参与诱导其表达或活性的全部元件,所述crispr-cas系统可为引导rna和crispr酶在其中形成复合物的核糖核蛋白(rnp)系统。在该情况下,rnp是蛋白-rna复合物,指的是由rna和rna结合蛋白相互作用形成的复合物的形式。
本发明的“crispr酶”是crispr-cas系统的主要蛋白组分,其与引导rna形成复合物,从而形成活性crispr-cas系统或非活性crispr-cas系统。
在该情况下,非活性crispr-cas系统是指包含的crispr酶中全部或部分crispr酶的功能无活性的crispr-cas系统;并且,其功能部分无活性的crispr-cas系统可作为切割单链核酸的切口酶。
作为一个实例,当crispr酶是cas9时,可通过将突变d10a或h840a引入cas9蛋白来制备crispr酶;当与引导rna结合时,d10acas9蛋白、h840acas9蛋白(即,仅将突变引入cas9蛋白的一个活性位点而制备的cas9蛋白)可作为切口酶。
作为另一实例,当非活性cas9蛋白与引导rna结合时,通过将突变d10a和h840a均引入cas9蛋白来制备的d10a/h10acas9蛋白,即,通过将突变引入cas9蛋白的两个活性位点来制备的非活性cas9蛋白(死cas9,dcas9)可形成核酸结合复合物而不切割靶基因或核酸序列。
crispr酶是具有编码crispr酶或多肽(或蛋白)的序列的核酸,典型地,通常使用ii型crispr酶或v型crispr酶。
ii型crispr酶的实例包括cas9,并且cas9可为源自多种微生物的cas9,例如放线菌门(actinobacteria)(例如内氏放线菌(actinomycesnaeslundii))cas9;产水菌门(aquificae)cas9;拟杆菌门(bacteroidetes)cas9;衣原体门(chlamydiae)cas9;绿弯菌门(chloroflexi)cas9;蓝细菌(cyanobacteria)cas9;迷踪菌门(elusimicrobia)cas9;纤维杆菌门(fibrobacteres)cas9;厚壁菌门(firmicutes)cas9(例如酿脓链球菌(streptococcuspyogenes)cas9、嗜热链球菌(streptococcusthermophilus)cas9、无害李斯特菌(listeriainnocua)cas9、无乳链球菌(streptococcusagalactiae)cas9、变异链球菌(streptococcusmutans)cas9以及屎肠球菌(enterococcusfaecium)cas9);梭杆菌门(fusobacteria)cas9;变形菌门(proteobacteria)(例如脑膜炎奈瑟菌(neisseriameningitides)、空肠弯曲杆菌(campylobacterjejuni))cas9和螺旋体门(spirochaetes)(例如密螺旋体(treponemadenticola))cas9。
“cas9”是能够通过与引导rna结合来切割或修饰待靶向的基因或核酸的序列或位置的酶,并可由hnh结构域(能够切割与引导rna互补结合的核酸链)、ruvc结构域(能够切割与引导rna非互补结合的核酸链)、rec结构域(能够识别靶标)以及pi结构域(能够识别pam)组成。对于cas9的具体结构特征,可参考hiroshinishimasu等,(2014)cell156:935-949。
此外,v型crispr酶的实例包括cpf1,并且cpf1可为源自如下微生物的cpf1:链球菌(streptococcus)、弯曲杆菌(campylobacter)、nitratifractor、葡萄球菌(staphylococcus)、parvibaculum、罗斯氏菌(roseburia)、奈瑟菌(neisseria)、葡糖醋杆菌(gluconacetobacter)、固氮螺菌(azospirillum)、sphaerochaeta、乳杆菌(lactobacillus)、真杆菌(eubacterium)、棒状杆菌(corynebacter)、肉食杆菌(carnobacterium)、红细菌(rhodobacter)、李斯特菌(listeria)、paludibacter、梭菌(clostridium)、毛螺菌(lachnospiraceae)、clostridiaridium、纤毛菌(leptotrichia)、弗朗西斯氏菌(francisella)、军团杆菌(legionella)、脂环酸芽孢杆菌(alicyclobacillus)、甲烷嗜甲基菌(methanomethyophilus)、卟啉单胞菌(porphyromonas)、普雷沃氏菌(prevotella)、拟杆菌(bacteroidetes)、创伤球菌(helcococcus)、letospira、脱硫弧菌(desulfovibrio)、desulfonatronum、丰佑菌(opitutaceae)、tuberibacillus、芽孢杆菌(bacillus)、短芽孢杆菌(brevibacilus)、甲基杆菌(methylobacterium)或氨基酸球菌(acidaminococcus)。
cpf1的实例包括对应于cas9的ruvc结构域的类似的ruvc结构域,其缺少cas9的hnh结构域而包含nuc结构域;cpf1可由rec结构域、wed结构域(能够识别靶标)和pi结构域(能够识别pam)组成。对于cpf1的具体结构特征,可参考takashiyamano等,(2016)cell165:949-962。
crispr酶可识别基因或核酸序列中的原型间隔区(protospacer)邻近基序(pam),而pam可根据crispr酶的类型和/或来源而改变。
例如,当crispr酶是spcas9时,pam可为5′-ngg-3′;当crispr酶是stcas9时,pam可为5′-nnagaaw-3′(w=a或t);当crispr酶是nmcas9时,pam可为5′-nnnngatt-3′;当crispr酶是cicas9时,pam可为5′-nnnvryac-3′(v=g或c或a,r=a或g,y=c或t),在该情况下,n可为a、t、g或c;或者a、u、g或c。此外,当crispr酶是fncpf1时,pam可为5′-ttn-3′;当crispr酶是ascpf1或lbcpf1时,pam可为5′-tttn-3′,在该情况下,n可为a、t、g或c;或者a、u、g或c。
可从公众所知的数据库(例如国家生物技术信息中心(ncbi)的genbank)获得crispr酶的信息,然而来源并不限于此。
本文使用的术语“引导rna”是指靶基因或核酸特异性rna,引导rna可通过与crispr酶结合将crispr酶导向靶基因或靶核酸。
引导rna可由crrna和tracrrna组成,crrna包含与待靶向的基因或核酸序列互补的序列,tracrrna结合crispr酶,在该情况下,crrna包含引导序列,该引导序列是能够与待靶向的基因或核酸序列互补结合的部分。
引导序列具有与待靶向的基因或核酸序列互补的序列,其作用在于识别待靶向的基因或核酸序列。此外,crrna包含其序列与tracrrna的一部分互补的部分,因此可部分地互补结合tracrrna。
在该情况下,引导rna可为双引导rna,其中crrna和tracrrna各自独立存在;或者引导rna可为单引导rna,其中crrna和tracrrna彼此相连,在引导rna为单引导rna时该引导rna可包含接头。根据crispr酶的类型,引导rna可仅包含crrna。
在本发明的另一实施方式中,靶特异性核酸酶可为锌指核酸酶(zfn)。
zfn包括经工程化以结合所选择的基因以及切割结构域或切割半结构域(cleavagehalf-domain)中的靶位点的锌指蛋白。可将锌指结合结构域工程化以结合所选择的序列。例如,可参考beerli等(2002)naturebiotechnol.20:135-141;pabo等(2001)ann.rev.biochem.70:313-340;isalan等(2001)naturebiotechnol.19:656-660;segal等(2001)curr.opin.biotechnol.12:632-637;choo等(2000)curr.opin.struct.biol.10:411-416。与天然存在的锌指蛋白相比,工程化锌指结合结构域可具有新结合特异性。工程化方法包括理性设计和多种类型的选择,但不限于此。理性设计包括使用数据库,该数据库包含例如三重(或四重)核苷酸序列以及单个锌指氨基酸序列,在该情况下,将结合特定三重或四重序列的一种或多种锌指序列与各三重或四重核苷酸序列进行组合。
本领域技术人员知晓靶序列的选择以及融合蛋白(和编码融合蛋白的多核苷酸)的设计和构建,其在美国专利公开号2005/0064474和2006/0188987中具体描述,以引用的方式将其整体内容并入本文。
此外,如这些参考文献和其它参考文献中所公开的,可借助任何合适的接头序列(例如包含五个以上氨基酸长度的接头)将锌指结构域和/或多指锌指蛋白连在一起。对于六个以上氨基酸长度的接头序列的实例,可参考美国专利号6,479,626;6,903,185;以及7,153,949。本文所述的蛋白可包含蛋白的各锌指间的合适接头的任意组合。
此外,靶特异性核酸酶(例如zfn和/或大范围核酸酶)可包含切割结构域或切割半结构域。
众所周知的是,例如,由于来自核酸酶的切割结构域不同于锌指dna结合结构域或者来自核酸酶的切割结构域不同于大范围核酸酶dna结合结构域,对dna结合结构域而言切割结构域可为异源的。可由任何核酸内切酶或核酸外切酶获得异源切割结构域。可作为切割结构域来源的示例性核酸内切酶包括限制性核酸内切酶和大范围核酸酶,但不限于此。
限制性核酸内切酶(限制性酶)存在于多种物种中,并可序列特异性结合至dna(在靶位点处),从而在结合位点处或者结合位点附近切割dna。一些限制性酶(例如iis型)在远离识别位点的位点处切割dna,并具有可分离的结合结构域和可切割结构域。例如,iis型酶foki在一条链上在距识别位点9个核苷酸处并在另一链上在距识别位点13个核苷酸处催化dna的双链切割。因此,在一个实施方式中,融合蛋白包含来自iis型限制性酶的至少一个切割结构域以及一个或多个锌指结构域(其可经工程化或可未经工程化)。
本文使用的术语“tale结构域”是指能够借助一个或多个tale重复模块以序列特异性方式结合核苷酸的蛋白结构域。tale结构域包含至少一个tale重复模块,优选1-30个tale重复模块,但不限于此。在本发明中,术语“tal效应因子结构域”和“tale结构域”可互换使用。tale结构域可包含tale重复模块的一半。
多重靶标
本发明的特征在于使用能够同时识别中靶效应(活性)和/或脱靶效应(活性)的同时靶标系统或多重靶标系统。
本发明的“靶标”是待由靶特异性核酸酶切割或修饰的对象,并可与靶或者期望的基因或期望的核酸或者它们的序列互换使用。
能够识别靶特异性核酸酶的“靶标”的部分包括与靶基因或核酸序列互补的核酸序列。核酸可为rna、dna或rna/dna杂合体,但不限于此。
本文使用的术语“多重靶标”是包含一种或多种中靶效应和一种或多种脱靶效应的概念,是指形成的系统能够同时或各自识别测试核酸酶的中靶效应和脱靶效应的靶标。
因此,“多重靶标”可为靶特异性核酸酶所靶向的基因或核酸序列,多重靶标可为两种以上的靶标,多重靶标可由中靶靶标和脱靶靶标组成。
中靶靶标是指靶特异性核酸酶互补结合的靶基因或核酸的序列或位置;脱靶靶标是指靶特异性核酸酶部分互补结合的靶基因或核酸的序列或位置,在该处出现不期望的核酸酶活性。脱靶靶标可为靶特异性核酸酶不靶向的基因或核酸的序列或位置,或者可为与中靶靶标的核酸序列具有少于100%的序列同源性的核酸序列。与中靶靶标的核酸序列具有少于100%的序列同源性的核酸序列是与中靶靶标的核酸序列类似的核酸序列,并可为其中包含一个或多个不同的碱基序列或者其中缺失一个或多个碱基序列的核酸序列。
多重靶标可由一种或多种中靶靶标和一种或多种脱靶靶标组成,中靶靶标和脱靶靶标各自的数量没有限制;此外,中靶靶标和脱靶靶标的数量可不同。也就是说,多重靶标可为包含一种中靶靶标和两种脱靶靶标的多重靶标;此外,多重靶标可为包含两种中靶靶标和五种脱靶靶标的多重靶标,并且多重靶标的设计可不限于此。
此外,为了提高本发明的筛选系统的选择可靠性,可将待由靶特异性核酸酶切割或修饰的对象设计为多个靶标、期望的基因、核酸或它们的序列。多个靶标意味着靶标的数量为两种以上,靶标的数量可为2、3、4、5、6、7种或更多种,并且其数量不受限制。
在该情况下,可基于靶标的多重性和所述多重靶标来设计系统的配置。
将多重靶标与能够识别中靶效应和脱靶效应的选择元件相连。
选择元件
本发明的术语“选择元件”是指用于检测靶基因或核酸序列是否被靶特异性核酸酶切割或修饰的标记。因此,“选择元件”可与“选择标记”互换使用。
基于选择元件是否表达,能够检测靶基因或核酸序列是否被靶特异性核酸酶切割或修饰。也就是说,能够检测中靶效应是否提高和/或脱靶效应是否降低。
选择元件可为毒素基因、抗生素抗性基因、编码荧光蛋白的基因、标签基因(tagginggene)、lacz基因或编码萤光素酶的基因,但不限于此。
“毒素基因”是编码毒性物质(蛋白)的基因或核酸序列,毒素基因的表达产生毒性物质,可通过产生的毒性物质对包含该毒素基因的细胞的活力(viability)进行调节。或者,毒素基因可为能够通过影响包含该毒素基因的细胞的活力所需的物质的合成或分解包含该毒素基因的细胞的活力所需的物质来调节细胞活力的物质。
毒素基因可为hok、fst、tisb、ldrd、flma、ibs、txpa/brnt、syme、xcv1262、ccdb、pare、mazf、yafo、hica、kid、zeta、dart、sxt基因、次黄嘌呤磷酸核糖基转移酶(hprt)基因或ura3,但不限于此。
当宿主是大肠杆菌(escherichiacoli)时,可使用毒素基因ccdb。
当宿主细胞是哺乳动物细胞时,可使用毒素基因hprt。
当宿主是酵母时,可使用毒素基因ura3。
“抗生素抗性基因”可为使得能够在暴露于抗生素的状态下表现出抗生素抗性特性的基因或核酸序列。
抗生素可为卡那霉素、壮观霉素、链霉素、氨苄青霉素、羧苄青霉素、博来霉素(bleomycin)、红霉素、多粘菌素b、四环素、zeocin、嘌呤霉素或氯霉素,但不限于此。
“荧光蛋白”是表现出荧光的蛋白,可为绿色荧光蛋白(gfp)、红色荧光蛋白(rfp)、黄色荧光蛋白(yfp)、青色荧光蛋白(cfp)、蓝色荧光蛋白(bfp)或橙色荧光蛋白(ofp),但不限于此。
标签可为avitag、钙调蛋白标签、多聚谷氨酸标签、e标签、flag标签、ha标签、his标签、myc标签、ne标签、s标签、sbp标签、softag1、softag3、strep标签、tc标签、v5标签、vsv标签、xpress标签、isopeptag、spytag、snooptag、生物素羧基载体蛋白(bccp)、谷胱甘肽-s-转移酶(gst)标签、halotag、麦芽糖结合蛋白(mbp)标签、nus标签、硫氧还蛋白标签、几丁质结合蛋白(cbp)、硫氧还蛋白(trx)或聚(nanp)。此外,标签可使用荧光蛋白。
作为本发明的一个具体实施方式,可使用一个或多个选择元件作为用于识别核酸酶的中靶效应和脱靶效应的选择元件。
作为一个实例,当使用lacz基因作为选择元件时,如果包含lacz的靶基因或核酸序列被靶特异性核酸酶切割或修饰,则lacz不表达,这可通过蓝白斑筛选方法来检测。蓝白斑筛选方法为借助由lacz基因表达的β-半乳糖苷酶的筛选方法,当无色的5-溴-4-氯-3-吲哚基β-d-吡喃半乳糖苷(x-gal)被β-半乳糖苷酶裂解时,形成5-溴-4-氯-吲哚并自发成为二聚体,从而形成5,5′-二溴-4,4′-二氯-靛蓝,其为不可溶的色素,被氧化而呈现鲜艳的颜色。因此,能够通过借助在x-gal的存在下表达β-半乳糖苷酶的细胞呈现出蓝色的现象来识别lacz基因是否表达,并能够通过借助相同的方式来预测包含lacz基因的靶基因或核酸序列的切割或修饰。
作为另一实例,当通过使用包含毒素基因作为选择元件的中靶靶标以及存在于细胞基因组中的脱靶靶标对靶特异性核酸酶进行筛选时,如果将包含中靶靶标的载体以及包含靶特异性核酸酶的载体导入细胞,可以预期的是,表现出高特异性的靶特异性核酸酶切割中靶靶标(其结果是毒素基因的表达被抑制)而不切割脱靶靶标(其结果是基因组不被切割)。因此,其中导入有具有高特异性的靶特异性核酸酶并且其中仅中靶靶标被切割而脱靶靶标不被切割的细胞能够存活;而其中中靶靶标和脱靶靶标均被切割的细胞不能存活,因为脱靶靶标的切割造成基因组被切割,由此可将两类细胞彼此区分开。
作为又一实例,当通过使用包含毒素基因作为选择元件的中靶靶标以及包含编码荧光蛋白的基因作为选择元件的脱靶靶标对靶特异性核酸酶进行筛选时,如果将包含中靶靶标的载体以及包含靶特异性核酸酶的载体导入细胞,可以预期的是,表现出高特异性的靶特异性核酸酶切割中靶靶标(其结果是毒素基因的表达被抑制)而不切割脱靶靶标(其结果是表达荧光蛋白)。因此,其中导入有具有高特异性的靶特异性核酸酶并且其中仅中靶靶标被切割而脱靶靶标不被切割的细胞能够存活,并可使用荧光蛋白来进行区分。
因此,能够基于这些选择元件是否表达来选择仅有效切割中靶靶标的具有高特异性的靶特异性核酸酶。
核酸酶的选择
通过使用所述筛选系统分选包含测试核酸酶之中的具有高特异性或高活性的靶特异性核酸酶的细胞,并可从中选择(识别)期望的核酸酶。
作为一个具体实施方式,本发明提供了对靶特异性核酸酶进行选择的方法,所述方法包括:
a)将筛选系统的组分i)和组分ii)导入细胞;
b)通过基于a)中选择元件是否表达对中靶效应和脱靶效应进行识别来分选所述细胞;以及
c)选择存在于b)中分选的细胞中的核酸酶作为具有高特异性或高活性的靶特异性核酸酶。
对于将组分i)和组分ii)导入细胞,可使用公众已知的方法。
在一些具体实施方式中,对细胞进行转染。合适的转染方法包括:磷酸钙介导的转染、核转染、电穿孔、阳离子聚合物转染(例如deae-葡聚糖或聚乙烯亚胺)、病毒转染、病毒体(virosome)转染、病毒粒子(virion)转染、脂质体转染、阳离子脂质体转染、免疫脂质体转染、非脂质体转染、树枝状大分子(dendrimer)转染、热击转染、磁转染、脂质转染、基因枪递送、impalefection、声致穿孔、光学转染以及增强核酸摄入的专用激动剂。转染方法是本领域广泛所知的(参见例如“currentprotocolsinmolecularbiology”,ausubel等,johnwiley&sons,newyork,2003或“molecularcloning:alaboratorymanual”,sambrook&russell,coldspringharborpress,coldspringharbor,ny,第三版,2001)。在优选实施方式中,可通过电穿孔将组分i)和组分ii)导入细胞。
在一个具体实施方式中,编码组分i)或组分ii)的dna可存在于载体中。合适的载体包括质粒载体、噬菌粒、粘粒、人工/kid染色体、转座子和病毒载体(例如慢病毒载体、腺相关病毒载体等)。
本文使用的术语“载体”是指用于转移期望(目的、特定或所需)的核酸的运载体核酸分子;载体可为单链核酸、双链核酸或部分双链的核酸;此外,载体可包含一个或多个游离末端或无游离末端(例如环状)。
载体中可包含“启动子”作为调节基因表达的调控元件。启动子可根据导入载体的细胞而改变。启动子可为聚合酶iii(poliii)启动子(例如u6启动子、h1启动子等)、聚合酶ii(polii)启动子(例如逆转录病毒劳斯氏肉瘤病毒(rsv)ltr启动子、巨细胞病毒(cmv)启动子、sv40启动子、二氢叶酸还原酶启动子、β-肌动蛋白启动子、磷酸甘油激酶(pgk)启动子、ef1α启动子等)或聚合酶i(poli)启动子。
在另一具体实施方式中,作为组分i)的crispr-cas系统可以以核糖核蛋白(rnp)的形式存在,其中引导rna和crispr酶形成复合物。
同时,在b)中,基于选择元件是否表达进行识别而对其中的中靶效应提高以及脱靶效应降低的细胞进行分选。
此外,在c)中,对从分选的细胞获得的核酸酶进行测序来获得核酸酶的序列,从而获得具有高特异性或高活性的靶特异性核酸酶。可使用由该方法获得的靶特异性核酸酶的序列来制备用于基因编辑等的核酸酶。
作为获取所获得的核酸酶的序列的方法,例如可执行如下方法。
也就是说,例如,当通过在30℃下在包含卡那霉素、氯霉素和阿拉伯糖的lb琼脂平板上对经电穿孔的大肠杆菌培养16小时而使菌落生长至大小能够为肉眼所见时,将各菌落接种至10ml包含氯霉素的lb培养基中,随后在摇床中42℃培养12小时。离心获得大肠杆菌沉淀后,使用小提试剂盒从沉淀中提取质粒。可使用例如sanger测序方法对提取的质粒进行测序。对于引物,可使用存在于cas9n端和c端外侧的通用测序引物(例如cmv-f或bgh-r)以及cas9中间部分的测序引物。
筛选试剂盒
此外,本发明提供了用于对具有高特异性或高活性的靶特异性核酸酶进行选择的筛选试剂盒,所述筛选试剂盒包含:多重靶标,该多重靶标包含一种或多种选择元件。试剂盒可为组合物的形式。
在该情况下,所述多重靶标包含一种或多种中靶靶标和一种或多种脱靶靶标,其描述与上文所述的相同。
如有必要,可以将本发明的试剂盒作为包含含有一种或多种选择元件的多重靶标的1液型(oneliquid-type)试剂盒来提供。
如有必要,可以将本发明的试剂盒作为分别包含含有一种或多种选择元件的多重靶标和宿主细胞的2液型(twoliquid-type)试剂盒来提供。
在该情况下,还可以通过在宿主细胞中包含含有选择元件的多重靶标来将所述试剂盒作为1液型提供。例如,试剂盒可以作为单独的质粒包含在宿主细胞中,也可以通过整合至宿主细胞基因组中来提供。
如有必要,可以将本发明的试剂盒作为分别包含含有一种或多种选择元件的多重靶标、宿主细胞和测试核酸酶的3液型(threeliquid-type)试剂盒来提供。
在该情况下,还可以通过在宿主细胞中包含含有选择元件的多重靶标来将所述试剂盒作为2液型提供。例如,试剂盒可以作为单独的质粒包含在宿主细胞中,也可以通过整合至宿主细胞基因组中来提供。
如上所述,本发明涉及用于对具有高特异性和高活性的靶特异性核酸酶系统进行选择的系统;优选地,本发明既包括通过使用能够同时识别脱靶活性和中靶活性的多重靶标系统对靶特异性核酸酶系统进行筛选和选择的系统,还包括其多种用途。
以下详细描述对使用本发明原理的示例性实施方式进行了描述,通过参考以下详细描述将更好地理解本发明的特征和优势。这些实施方式和其它实施方式由以下详细描述作出说明或者由以下详细描述而变得显而易见,并包含于以下详细描述中。
有益效果
在通过使用靶特异性核酸酶对基因进行修正或操纵时仍存在出现脱靶的问题。为了克服该问题,开发具有高特异性而不出现脱靶的靶特异性核酸酶是重要的。
因此,本发明开发了用于对具有高特异性或高活性的靶特异性核酸酶进行筛选的系统。本发明的筛选系统是能够对脱靶效应降低且中靶效应提高的靶特异性核酸酶进行选择的系统,通过使用多重靶标,可有利地将其用于筛选和选择能够同时满足脱靶效应降低和中靶效应提高的具有高特异性和/或高活性的靶特异性核酸酶。
此外,当设计多重靶标时,可根据实验目的对多重靶标中所包含的选择元件进行多样化设计,并可根据选择元件通过使用多种检测方法将其用于选择靶特异性核酸酶。
附图说明
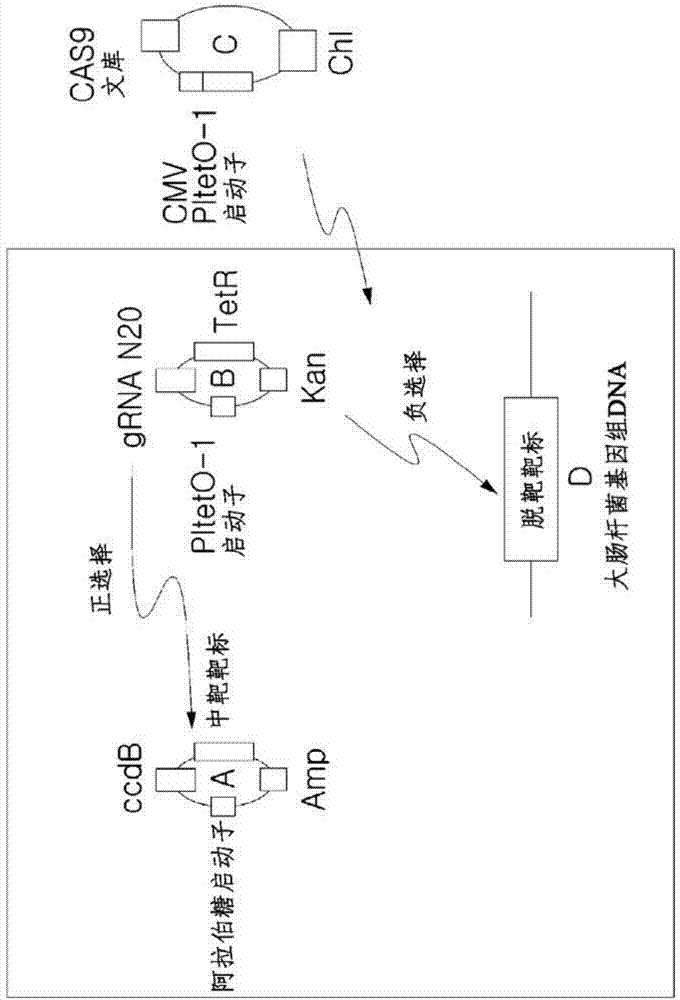
图1示意性地说明了使用多重靶标的crispr-cas系统的筛选方法。
质粒a在阿拉伯糖启动子后包含具有毒性ccdb基因和nggpam的靶位点。质粒b包含plteto-1启动子控制的sgrna,可在cas9的存在下切割质粒a的靶位点。大肠杆菌基因组dna序列与sgrna序列是错配的。质粒c包含cmv-plteto-1双启动子控制的cas9文库序列。
图2为说明根据在多重靶标中设计脱靶核酸序列的crispr-cas9系统的筛选结果的图。
该图是使用插入大肠杆菌基因组dna的emx-1序列和包含两个错配序列的质粒b进行的对照实验的结果。ck是指在包含氯霉素和卡那霉素的lb琼脂培养基上每单位形成的菌落数,cka是指在包含氯霉素、卡那霉素和阿拉伯糖的lb琼脂培养基上每单位形成的菌落数。当两个错配位于种子区(seedregion)附近时(56-wt-cas9),少于0.1%的导入有cas9的大肠杆菌存活。另一方面,当将作为阴性对照的空载体(而不是cas9)导入大肠杆菌时,约0.01%的大肠杆菌存活。将阴性对照的结果视为因质粒a未起作用的影响而产生的背景。
图3是说明根据在多重靶标中设计脱靶核酸序列的crispr-cas9系统的筛选结果的图。
该图是使用插入大肠杆菌基因组dna的emx-1序列和包含一个错配序列的质粒b进行的对照实验的结果。在图中,ck是指在包含氯霉素和卡那霉素的lb琼脂培养基上每单位形成的菌落数,cka是指在包含氯霉素、卡那霉素和阿拉伯糖的lb琼脂培养基上每单位形成的菌落数。当一个错配位于种子区附近时(7-wt-cas9),少于0.1%的导入有cas9的大肠杆菌存活。另一方面,当将作为阴性对照的空载体(而不是cas9)导入大肠杆菌时,约0.01%的大肠杆菌存活。将阴性对照的结果视为因质粒a未起作用的影响而产生的背景。
图4是说明使用多重靶标对crispr-cas9系统的cas9变体进行筛选的结果的图。
对质粒a和质粒b、包含1个错配(7)的bw251414-emx1(7)的文库和3种类型(突变菌株:衍生自agilenttechnologies,inc.制造的xl-1red感受态细胞。安捷伦(agilent):agilenttechnologies,inc.制造的genemorphii易错pcr试剂盒。钛(titanium):clontech,inc.制造的多样化pcr随机诱变试剂盒)进行筛选。1g1s(7)(1代1系列):bw25141-emx1(7)的文库筛选结果。1g2s(7):1g1s(7)筛选的bw25141-emx1(7)的筛选结果。1g3s(7):1g2s(7)筛选的bw25141-emx1(7)的筛选结果。1g4s(17):1g3s(7)筛选的bw25141-emx1(17)的筛选结果。1g5s(17):1g4s(17)筛选的bw25141-emx1(17)的筛选结果。
图5是说明使用多重靶标对crispr-cas9系统的cas9变体进行筛选的结果的图。
对质粒a和质粒b、包含2个错配(56)的bw251414-emx1(56)的文库和3种类型(突变菌株:衍生自agilenttechnologies,inc.制造的xl-1red感受态细胞。agilent:agilenttechnologies,inc.制造的genemorphii易错pcr试剂盒。titanium:clontech,inc.制造的多样化pcr随机诱变试剂盒)进行筛选。1g1s(1718)(1代1系列):bw25141-emx1(1718)的文库筛选结果。1g2s(1718):1g1s(1718)筛选的bw25141-emx1(1718)的筛选结果。1g3s(1718):1g2s(1718)筛选的bw25141-emx1(1718)的筛选结果。2g1s(7):1g3s(17)改组文库(shuffledlibrary)的bw25141-emx1(7)的筛选结果。2g2s(7):2g1s(7)筛选的bw25141-emx1(7)的筛选结果。2g3s(7):2g2s(7)筛选的bw25141-emx1(7)的筛选结果。2g4s(7):2g3s(7)筛选的bw25141-emx1(7)的筛选结果。2g5s(17):2g4s(7)筛选的bw25141-emx1(17)的筛选结果。2g6s(17):2g5s(17)筛选的bw25141-emx1(17)的筛选结果。
图6和图7是说明针对特定基因(emx1和t-dmd)使用多重靶标对crispr-cas9系统的cas9变体的脱靶活性降低进行识别的结果的图,
说明使用由两种方法同时实施而筛选获得的完全文库(full-statelibrary)测定的dmd基因的脱靶活性以及中靶活性的结果(图6);以及
说明使用由两种方法同时实施而筛选获得的完全文库测定的emx1基因的脱靶活性以及中靶活性的结果(图7)。
图8和图9为使用通过筛选选择的三个克隆在哺乳动物细胞中对dmd基因和emx1基因各自进行中靶和脱靶实验获得的结果以及确认特异性改善的结果,
说明在hek293t细胞中靶向人emx-1的三个不同克隆(#1、#20和#35)的中靶活性和脱靶活性(图8);以及
说明在hek293t细胞中靶向人t-dmd的三个不同克隆(#1、#20和#35)的中靶活性和脱靶活性(图9)。
具体实施方式
术语定义
术语“切割(cleave、cleavage和/或cleaving)”是指在特定核酸中产生切割的行为。如本领域技术人员所理解的,切割(断裂)可留下平末端或粘末端(即,5′或3′突出末端)。该术语还包括单链dna切割(“切口(nick)”)和双链dna切割。
术语“重组细胞”是指通过使用基因工程技术(即重组技术)对母细胞进行基因修饰而产生的宿主细胞。重组细胞可包含对母细胞基因组核苷酸序列的添加、删除和/或修饰。
术语“同源性”是指两条以上核酸序列或两条以上氨基酸序列之间的一致性。序列一致性可通过一致性(或相似性或同源性)%来测量,%越高,则序列间一致性越高。当通过使用标准方法对核酸或氨基酸序列的同源物或直系同源物进行比对时,序列一致性较高。对于比较,序列比对方法为本领域所公知。如下文献描述了多种程序和比对算法[参考文献:smith和waterman,adv.appl.math.2:482,1981;needleman和wunsch,j.mol.biol.48:443,1970;pearson和lipman,proc.natl.acad.sci.usa85:2444,1988;higgins和sharp,gene,73:237-44,1988;higgins和sharp,cabios5:151-3,1989;corpet等,nuc.acidsres.16:10881-90,1988;huang等,computerappls.biosc.8,155-65,1992;以及pearson等,meth.mol.bio.24:307-31,1994.,altschul等,j.mol.biol.215:403-10,1990],并具体描述了序列比对方法和同源性计算方法。为了与序列分析程序blastp、blastn、blastx、tblastn和tblastx一起使用,可由多种来源(包括因特网和美国国家生物信息中心(ncbi,国家医学图书馆,38a栋,8n805房间,bethesda,md.20894))获得文档[参考文献:ncbibasiclocalalignmentsearchtool(blast),altschul等,j.mol.biol.215:403-10,1990]。在ncbi网站可找到进一步的信息。
术语“杂交”是指一个或多个多核苷酸反应形成复合物的反应,该复合物通过核苷酸残基的碱基间的氢键而得以稳定。氢键可通过沃森-克里克碱基配对、hoogstein结合或以任何其它序列特异性方式形成。该复合物可包含形成双链结构的两条链、形成多链复合物的三条以上的链、自杂交单链或它们的任意组合。
术语“表达”是指从dna模板转录多核苷酸的过程(例如,转录为mrna或另一rna转录物)和/或转录的mrna翻译为肽、多肽或蛋白的过程。转录物和编码的多肽可统称为“基因产物”。如果多核苷酸衍生自基因组dna,真核细胞中的表达可包括mrna的剪接。
术语“选择元件”或“选择标记”是指作为对本文所述的核酸酶的中靶效应和/或脱靶效应进行识别和选择的向导而发挥功能的基因。选择元件可包括但不限于毒素基因、荧光标记、发光标记和药物选择标记。荧光标记可包括但不限于编码荧光蛋白(例如绿色荧光蛋白(gfp)、青色荧光蛋白(cfp)、黄色荧光蛋白(yfp)、红色荧光蛋白(dsrfp)等)的基因。发光标记可包括但不限于编码发光蛋白(例如萤光素酶)的基因。适用于本文提供的方法和组合物的药物选择标记包括但不限于抗生素(例如氨苄青霉素、链霉素、庆大霉素、卡那霉素、潮霉素、四环素、氯霉素和新霉素)抗性基因。在一些实施方式中,选择可为正选择(positiveselection),也就是说,从群体中分离表达标记的细胞,从而例如产生包含选择标记的富集细胞群。在另一实施方式中,选择可为负选择(negativeselection),也就是说,将群体从细胞中分离,从而例如产生不包含选择标记的富集细胞群。可借助适合所用选择标记的任何便利技术来进行分离。例如,当使用荧光标记时,可借助荧光激活细胞分选来分离细胞;而当其中插入细胞表面标记时,可借助亲和分离技术(例如使用附着于固体基质的亲和剂的“淘选(panning)”、磁分离、亲和层析)或其它便利的技术从异质群体中分离细胞。
除非另有说明,本发明的实施使用免疫学、生物化学、化学、分子生物学、微生物学、细胞生物学、基因组学和重组dna的传统技术。
下文将借助使用本发明原理的示例性实施方式具体描述本发明。
筛选系统
1.筛选系统
本发明涉及使用多重靶标来选择靶特异性核酸酶的筛选系统,所述多重靶标包含一种或多种中靶靶标和一种或多种脱靶靶标。
术语“用于选择靶特异性核酸酶的筛选系统”指的是包括全部如下方面的概念:用于筛选具有高特异性和高活性的靶特异性核酸酶的试剂盒以及组合物、其使用方法以及该过程中衍生的各种中间体。在本说明书中描述为“系统”的发明可解释为组合物或方法以适合相应发明的方面,只要该发明是用于筛选所期望的靶特异性核酸酶。
因此,本发明的一个实施方式为:
用于选择具有高特异性或高活性的靶特异性核酸酶的筛选组合物,所述组合物包含:
i)核酸酶,所述核酸酶包含能够识别靶标的部分和能够对所识别的靶标进行切割或修饰的部分;以及
ii)包含一种或多种选择元件的多重靶标,其中,所述多重靶标包含一种或多种中靶靶标以及一种或多种脱靶靶标。
1-1靶特异性核酸酶:crispr-cas系统
“靶特异性核酸酶”可由能够特异性识别靶标的部分和能够对所识别的靶标进行切割或修饰的部分组成。
能够特异性识别靶标的部分可根据靶基因或核酸序列而改变。
能够对所识别的靶标进行切割或修饰的部分可对所识别的靶标进行切割或修饰。在该情况下,能够特异性识别靶标的部分和能够对所识别的靶标进行切割或修饰的部分各自可独立存在,或者可作为单个结构以功能性划分的形式存在。
靶特异性核酸酶可为成簇规律间隔短回文重复(crispr)-crispr相关蛋白(cas)系统、锌指核酸酶(zfn)、转录激活因子样效应因子核酸酶(talen)、foki、核酸内切酶或它们的组合,并且,可优选为crispr-cas系统,但不限于此。
crispr-cas系统可由引导rna和crispr酶组成。
在该情况下,引导rna可为能够特异性识别靶标的部分,而crispr酶可为能够对所识别的靶标进行切割或修饰的部分。
1-1-1引导rna
引导rna可包含与待靶向的基因或核酸序列互补结合的核酸序列。
引导rna可由crrna和tracrrna组成,crrna包含与待靶向的基因或核酸序列互补的序列,tracrrna结合crispr酶。
在该情况下,crrna包含引导序列,该引导序列是能够与待靶向的基因或核酸序列互补结合的部分。引导序列具有与待靶向的基因或核酸序列互补的序列,其作用可在于识别待靶向的基因或核酸序列。
引导序列的大小可为5bp-50bp、5bp-40bp、5bp-30bp或5bp-20bp,但不限于此。优选地,引导序列可具有5bp-20bp的大小。
引导序列的核酸序列可包含与待靶向的基因或核酸的序列或位置以50%-100%的比例互补结合的核酸序列,但不限于此。
此外,crrna包含其序列与tracrrna的一部分互补的部分,因此crrna可部分地互补结合tracrrna。
引导rna可为双引导rna,其中crrna和tracrrna各自独立存在。或者引导rna可为单引导rna,其中crrna和tracrrna彼此相连。在该情况下,单引导rna可包含接头。
此外,根据crispr酶的类型,引导rna可仅包含crrna。
引导rna可包含化学修饰。在该情况下,化学修饰可包括如下化学修饰:其中,在引导rna所包含的核酸中的一个或两个或更多个核酸中具有硫代磷酸酯键、锁核酸(lna)、2′-o-甲基3′-硫代磷酸酯(ms)或2′-o-甲基3′硫代pace(msp)修饰。
引导rna可为其5′末端的部分序列截短的引导rna。
可根据靶基因或核酸序列设计引导rna的核酸序列。
引导rna可包含于载体中,在该情况下,载体可包含适于引导rna表达的启动子,例如plteto-1、arapbad、rhampbad或t7启动子。
引导rna可为人工合成的引导rna。
1-1-2crispr酶
crispr酶可为具有编码crispr酶的序列的核酸。
具有编码crispr酶的序列的核酸可包含于载体中。在该情况下,该载体可包含适于crispr酶表达的启动子,例如cmv或cag。
crispr酶可为多肽或蛋白。
可对crispr酶进行密码子优化,以适于待导入的对象。
crispr酶可为ii型crispr酶或v型crispr酶。
ii型crispr酶可为cas9。
v型crispr酶可为cpf1酶。
cas9可为酿脓链球菌cas9(spcas9)、金黄色葡萄球菌(staphylococcusaureus)cas9(sacas9)、嗜热链球菌cas9(stcas9)、脑膜炎奈瑟菌cas9(nmcas9)、空肠弯曲杆菌cas9(cjcas9)或它们的直系同源物,但不限于此。优选地,cas9可为spcas9或cjcas9。
cas9可为活性cas9或非活性cas9。
非活性cas9可包括完全非活性的cas9和部分非活性的cas9(例如切口酶)。
就cas9而言,存在于ruvc、hnh、rec和/或pi结构域中的一个或两个或更多个氨基酸可被突变。
cas9可包含由spcas9的氨基酸中的d10、e762、h840、n854、n863和d986所组成的氨基酸组或者与之对应的其它cas9直系同源物中的氨基酸组中的一个或两个或更多个氨基酸的突变。
cas9可包含由spcas9的氨基酸中的r780、k810、k848、k855和h982所组成的氨基酸组或者与之对应的其它cas9直系同源物中的氨基酸组中的一个或两个或更多个氨基酸的突变。
cas9可包含由spcas9的氨基酸中的g1104、s1109、l1111、d1135、s1136、g1218、n1317、r1335和t1337所组成的氨基酸组或者与之对应的其它cas9直系同源物中的氨基酸组中的一个或两个或更多个氨基酸的突变。
cpf1可为francisellanovicidacpf1(fncpf1)、氨基酸球菌属cpf1(ascpf1)、毛螺菌cpf1(lbcpf1)或它们的直系同源物,但不限于此。
cpf1可为活性cpf1或非活性cpf1。
非活性cpf1可包括完全非活性的cpf1和部分非活性的cpf1(例如切口酶)。
就cpf1而言,存在于ruvc、nuc、wed、rec和/或pi结构域中的一个或两个或更多个氨基酸可被突变。
cpf1可包含由fncpf1的氨基酸中的d917、e1006或d1255;ascpf1的氨基酸中的d908、e993或d1263;lbcpf1的氨基酸中的d832、e925、d947或d1180所组成的氨基酸组或者与之对应的其它cpf1直系同源物中的氨基酸组中的一个或两个或更多个氨基酸的突变。
crispr酶可识别基因或核酸序列中的原型间隔区邻近基序(pam)。
pam可根据crispr酶的来源而改变。
例如,当crispr酶是spcas9时,pam可为5′-ngg-3′;当crispr酶是stcas9时,pam可为5′-nnagaaw-3′(w=a或t);当crispr酶是nmcas9时,pam可为5′-nnnngatt-3′;当crispr酶是cjcas9时,pam可为5′-nnnvryac-3′(v=g或c或a,r=a或g,y=c或t),在该情况下,n可为a、t、g或c;或者a、u、g或c。此外,当crispr酶是fncpf1时,pam可为5′-ttn-3′;当crispr酶是ascpf1或lbcpf1时,pam可为5′-tttn-3′,在该情况下,n可为a、t、g或c;或者a、u、g或c。
crispr酶可进一步包含功能性结构域。在该情况下,crispr酶可为活性crispr酶或非活性crispr酶。
所述功能性结构域可为异源功能性结构域(hfd)。
功能性结构域可为选自于由如下结构域所组成的组中的一种:甲基化酶活性、去甲基化酶活性、转录激活活性、转录抑制活性、转录释放因子活性、组蛋白修饰活性、rna切割活性、dna切割活性、核酸结合活性和分子开关(例如光诱导型)。
功能性结构域可为选自于由如下结构域所组成的组中的一种:甲基化酶、去甲基化酶、磷酸酶、胸苷激酶、半胱氨酸脱氨酶和胞苷脱氨酶。
为了将功能性结构域与crispr酶相连,在crispr酶和功能性结构域间可进一步包含接头。
接头可为(a)n、(g)n、gggs、(ggs)n、(ggggs)n、(eaaak)n、sgggs、ggsggsggs、sgsetpgtsesatpes、xten或(xp)n,在该情况下,n可为1、2、3、4、5、6、7或更多。然而,接头和n不限于此。
crispr酶可进一步包含核定位序列(nls)。
1-1-3crispr酶的突变
crispr酶可为活性crispr酶或非活性crispr酶。
非活性crispr酶可包括完全非活性的crispr酶和部分非活性的crispr酶(例如切口酶)。
crispr酶可为突变crispr酶。也就是说,crispr酶可为非天然存在的crispr酶。
在该情况下,突变crispr酶可为天然存在的crispr酶的至少一个或多个氨基酸被突变的crispr酶,突变可为氨基酸的替换、删除、添加等。
突变crispr酶可包含存在于天然存在的crispr酶的ruvc结构域的氨基酸中的一个或两个或更多个氨基酸的突变。
ruvc结构域可为ruvci、ruvcii或ruvciii结构域。
突变crispr酶可包含存在于天然存在的crispr酶的hnh结构域的氨基酸中的一个或两个或更多个氨基酸的突变。
突变crispr酶可包含存在于天然存在的crispr酶的rec结构域的氨基酸中的一个或两个或更多个氨基酸的突变。
突变crispr酶可包含存在于天然存在的crispr酶的pi结构域的氨基酸中的一个或两个或更多个氨基酸的突变。
突变crispr酶可包含存在于天然存在的crispr酶的nuc结构域的氨基酸中的一个或两个或更多个氨基酸的突变。
突变crispr酶可包含存在于天然存在的crispr酶的wed结构域的氨基酸中的一个或两个或更多个氨基酸的突变。
此外,crispr酶可为通过合并各突变crispr酶的一部分而重组得到的crispr酶。
例如,可分别利用crispr酶变体1的ruvc结构域、crispr酶变体2的hnh结构域和crispr酶变体3的pi结构域对天然状态下存在的crispr酶(即野生型crispr酶)的ruvc结构域、hnh结构域和pi结构域进行替换或重组。或者,可通过将crispr酶变体1的氨基酸序列的第1-500个氨基酸(或其编码核酸序列)与crispr酶变体2的氨基酸序列的第501-1000个氨基酸(或其编码核酸序列)和crispr酶变体3的氨基酸序列的第1001个至末端的氨基酸(或其编码核酸序列)进行组合来构建不同于crispr酶变体1、2、3的新crispr变体。
作为另一实例,可利用crispr酶变体2的氨基酸序列的第50-700个氨基酸(或其编码核酸序列)对crispr酶变体1的一部分(例如其氨基酸序列的第50-700个氨基酸(或其编码核酸序列))进行替换或重组。
此外,crispr酶可为由不同的crispr酶组合产生的crispr酶。
例如,可利用cpf1的ruvc结构域对cas9的ruvc结构域进行替换或重组。
此外,crispr酶可为在活性crispr酶或非活性crispr酶中进一步包含功能性结构域的crispr酶变体。
所述功能性结构域可为异源功能性结构域(hfd)。
功能性结构域可为选自于由如下结构域所组成的组中的一种:甲基化酶活性、去甲基化酶活性、转录激活活性、转录抑制活性、转录释放因子活性、组蛋白修饰活性、rna切割活性、dna切割活性、核酸结合活性和分子开关(例如光诱导型)。
功能性结构域可为选自于由如下结构域所组成的组中的一种:甲基化酶、去甲基化酶、磷酸酶、胸苷激酶、半胱氨酸脱氨酶和胞苷脱氨酶。
为了将功能性结构域与crispr酶相连,在crispr酶和功能性结构域间可进一步包含接头。
接头可为(a)n、(g)n、gggs、(ggs)n、(ggggs)n、(eaaak)n、sgggs、ggsggsggs、sgsetpgtsesatpes、xten或(xp)n,在该情况下,n可为1、2、3、4、5、6、7或更多。然而,接头和n不限于此。
例如,crispr酶变体可包含非活性酶中的转录抑制结构域,crispr酶变体可为抑制靶基因或核酸序列表达的变体。此外,crispr酶变体可包含非活性酶中的胞苷脱氨酶,通过改变靶基因或核酸序列的特定碱基序列,crispr酶变体可为能够抑制或提高相应基因或核酸序列表达的变体。
1-1-4crispr酶的突变效果
突变crispr酶可为经突变使得对待靶向的基因或核酸的切割效果(即,中靶)提高的crispr酶。
突变crispr酶可为经突变使得对待靶向的基因或核酸的切割效果(即,中靶)降低的crispr酶。
突变crispr酶可为经突变使得对非靶向的基因或核酸的切割效果(即,脱靶)提高的crispr酶。
突变crispr酶可为经突变使得对非靶向的基因或核酸的切割效果(即,脱靶)降低的crispr酶。
修饰crispr酶可为经修饰使得对基因或核酸的结合能力提高的crispr酶。
修饰crispr酶可为经修饰使得对基因或核酸的结合能力降低的crispr酶。
修饰crispr酶可为经修饰使得对基因或核酸序列中原型间隔区邻近基序(pam)的识别能力提高的crispr酶。
修饰crispr酶可为经修饰使得对基因或核酸序列中pam的识别能力降低的crispr酶。
修饰crispr酶可为其中的解旋酶动力学经修饰的crispr酶。
修饰crispr酶可根据修饰而包含构象重排。
1-2crispr复合物
crispr酶和引导rna可形成crispr复合物。
crispr复合物可在细胞外形成。
crispr复合物可在细胞的细胞质中形成。
crispr复合物可在细胞的细胞核中形成。
在crispr复合物中,crispr酶可识别存在于待靶向的基因或核酸序列中的pam。
在crispr复合物中,引导rna可与待靶向的基因或核酸序列互补结合。
当crispr复合物结合至待靶向的基因或核酸序列时,crispr复合物的crispr酶可对待靶向的基因或核酸序列进行切割或修饰。
在该情况下,可将靶特异性核酸酶导入细胞。
可通过使用病毒载体系统、核糖核蛋白(rnp)、纳米粒子、脂质体等的转染、显微注射、电穿孔等将靶特异性核酸酶导入细胞,但导入方法不限于此。
细胞可为原核细胞或真核细胞。
1-3多重靶标
靶标可为由靶特异性核酸酶靶向的基因或核酸序列。
多重靶标可由待靶向的基因或核酸序列(即,中靶靶标)以及非靶向的基因或核酸序列(即,脱靶靶标)组成。
多重靶标可由一种或多种中靶靶标和一种或多种脱靶靶标组成。作为一个实施方式,多重靶标可由一种中靶靶标和一种或多种脱靶靶标组成。作为另一实施方式,多重靶标可由一种中靶靶标和一种脱靶靶标组成。
多重靶标可存在于细胞中或从外源导入。
当多重靶标存在于细胞中时,该多重靶标可存在于宿主细胞的基因组中。优选地,一种或多种脱靶靶标可存在于宿主细胞的基因组中。
当将多重靶标从外源导入细胞时,可使用载体系统导入多重靶标。
当将多重靶标从外源导入细胞时,可使用载体系统导入多重靶标。
当将多重靶标从外源导入细胞时,可通过对于各靶标使用不同的载体来导入多重靶标。也就是说,当多重靶标由一种中靶靶标和一种脱靶靶标组成时,载体可由包含中靶靶标的载体和包含脱靶靶标的载体组成。
可通过使用病毒载体系统、纳米粒子、脂质体等的转染、显微注射、电穿孔等将多重靶标导入细胞,但导入方法不限于此。
1-3-1中靶靶标
中靶靶标可为靶特异性核酸酶互补结合的靶基因或核酸的序列或位置。
中靶靶标可为与靶特异性核酸酶中能够特异性识别靶标的部分的核酸序列具有序列互补性的基因或核酸的序列或位置。
当靶特异性核酸酶为crispr-cas系统时,中靶靶标可为互补结合至引导rna或引导rna的引导序列的基因或核酸的序列或位置。
在该情况下,互补结合至引导rna或引导rna的引导序列的基因或核酸的序列可为5-50bp;此外,可根据引导rna或引导rna的引导序列的核酸序列的长度来调整其长度。
当靶特异性核酸酶为crispr-cas系统时,中靶靶标可包含crispr酶识别的pam序列。
当靶特异性核酸酶为crispr-cas系统时,中靶靶标可包含互补结合至引导rna或引导rna的引导序列的核酸序列以及crispr酶识别的pam序列。
在该情况下,中靶靶标中互补结合至引导rna或引导rna的引导序列的核酸序列可位于crispr酶识别的pam序列的5′末端。
在该情况下,中靶靶标中互补结合至引导rna或引导rna的引导序列的核酸序列可位于crispr酶识别的pam序列的3′末端。
中靶靶标可为(n)5-50-pam或者pam-(n)5-50;在该情况下,n可为a、t、g或c;或者a、u、g或c。
此外,中靶靶标可位于细胞的基因组中。
细胞可为原核细胞或真核细胞。
在该情况下,中靶靶标可包含选择元件。
选择元件可为毒素基因、抗生素抗性基因、编码荧光蛋白的基因、标签基因、lacz基因或编码萤光素酶的基因,但不限于此。
毒素基因可为hok、fst、tisb、ldrd、flma、ibs、txpa/brnt、syme、xcv1262、ccdb、pare、mazf、yafo、hica、kid、zeta、dart或sxt基因,优选可为ccdb,但不限于此。
毒素基因可根据中靶靶标的来源(即,根据起源)而改变。即,本领域技术人员可根据宿主细胞类型适当地对毒素基因进行选择和使用。
当宿主是大肠杆菌时,可使用毒素基因ccdb。
当宿主细胞是哺乳动物细胞时,可使用毒素基因次黄嘌呤磷酸核糖基转移酶(hprt)。
当宿主是酵母时,可使用毒素基因ura3。
可根据抗生素类型对抗生素抗性基因进行多样化设计。
抗生素可为卡那霉素、壮观霉素、链霉素、氨苄青霉素、羧苄青霉素、博来霉素、红霉素、多粘菌素b、四环素、zeocin、嘌呤霉素或氯霉素,但不限于此。
“荧光蛋白”是表现出荧光的蛋白,可为绿色荧光蛋白(gfp)、红色荧光蛋白(rfp)、黄色荧光蛋白(yfp)、青色荧光蛋白(cfp)、蓝色荧光蛋白(bfp)或橙色荧光蛋白(ofp),但不限于此。
标签可为avitag、钙调蛋白标签、多聚谷氨酸标签、e标签、flag标签、ha标签、his标签、myc标签、ne标签、s标签、sbp标签、softag1、softag3、strep标签、tc标签、v5标签、vsv标签、xpress标签、isopeptag、spytag、snooptag、生物素羧基载体蛋白(bccp)、谷胱甘肽-s-转移酶(gst)标签、halotag、麦芽糖结合蛋白(mbp)标签、nus标签、硫氧还蛋白标签、几丁质结合蛋白(cbp)、硫氧还蛋白(trx)或聚(nanp)。
在该情况下,当包含选择元件的中靶靶标被靶特异性核酸酶切割或修饰时,选择元件可不表达。
1-3-2脱靶靶标
脱靶靶标可为靶特异性核酸酶部分互补结合的非靶基因或核酸的序列或位置。
脱靶靶标可为包含中靶靶标中的一个或多个其它碱基序列的核酸序列。
脱靶靶标可为具有与靶特异性核酸酶中能够特异性识别靶标的部分的核酸序列部分互补的序列的基因或核酸的序列或位置。
当靶特异性核酸酶为crispr-cas系统时,脱靶靶标可为部分互补结合至引导rna或引导rna的引导序列的基因或核酸的序列或位置。
在该情况下,互补结合至引导rna或引导rna的引导序列的基因或核酸的序列可为5-50bp;此外,可根据引导rna或引导rna的引导序列的核酸序列的长度来调整其长度。
当靶特异性核酸酶为crispr-cas系统时,脱靶靶标可包含crispr酶识别的pam序列。
当靶特异性核酸酶为crispr-cas系统时,脱靶靶标可包含互补结合至引导rna或引导rna的引导序列的核酸序列以及crispr酶识别的pam序列。
在该情况下,脱靶靶标中互补结合至引导rna或引导rna的引导序列的核酸序列可位于crispr酶识别的pam序列的5′末端。
在该情况下,脱靶靶标中互补结合至引导rna或引导rna的引导序列的核酸序列可位于crispr酶识别的pam序列的3′末端。
脱靶靶标可为(n)5-50-pam或者pam-(n)5-50;在该情况下,n可为a、t、g或c;或者a、u、g或c。
脱靶靶标可为包含与靶特异性核酸酶中特异性识别靶标的部分的核酸序列的一个或多个非互补结合的基因或核酸的序列或位置。
脱靶靶标可为包含与靶特异性核酸酶中特异性识别靶标的部分的核酸序列少于100%互补的结合的基因或核酸的序列或位置。具有少于100%的序列同源性的核酸序列为与中靶靶标的核酸序列类似的核酸序列,并可为其中包含一个或多个不同的碱基序列或者其中缺失一个或多个碱基序列的核酸序列。
当靶特异性核酸酶为crispr-cas系统时,脱靶靶标可为包含与引导rna或引导rna的引导序列的核酸序列的一个或多个非互补结合的基因或核酸的序列或位置。
当靶特异性核酸酶为crispr-cas系统时,脱靶靶标可为包含与引导rna或引导rna的引导序列的核酸序列少于100%互补的结合的基因或核酸的序列或位置。
当靶特异性核酸酶为crispr-cas系统时,脱靶靶标可在crispr酶识别的pam序列中包含一个或多个错配核酸序列。
在该情况下,脱靶靶标可位于细胞的基因组中。
细胞可为原核细胞或真核细胞。
在该情况下,脱靶靶标可包含选择元件。
选择元件可为毒素基因、抗生素抗性基因、编码荧光蛋白的基因、标签基因、lacz基因或编码萤光素酶的基因,但不限于此。
在该情况下,当包含选择元件的脱靶靶标被靶特异性核酸酶切割或修饰时,选择元件可不表达。
在该情况下,当包含选择元件的脱靶靶标未被靶特异性核酸酶切割或修饰时,选择元件可表达。
1-4选择元件的效果
本发明的术语“选择元件”是指用于检测靶基因或核酸序列是否被靶特异性核酸酶切割或修饰的标记。因此,“选择元件”可与“选择标记”互换使用。
基于选择元件是否表达,能够检测靶基因或核酸序列是否被靶特异性核酸酶切割或修饰。也就是说,能够检测中靶效应是否提高和/或脱靶效应是否降低。
中靶靶标和/或脱靶靶标中包含的选择元件可为确定靶特异性核酸酶的高特异性或高活性的元件。
作为一个实例,当通过使用包含毒素基因作为选择元件的中靶靶标以及包含抗生素抗性基因作为选择元件的脱靶靶标对靶特异性核酸酶进行筛选时,如果将各自包含中靶靶标和脱靶靶标的载体以及包含靶特异性核酸酶的载体导入细胞,可以预期的是,表现出高特异性的靶特异性核酸酶切割中靶靶标(其结果是毒素基因的表达被抑制)而不切割脱靶靶标(其结果是抗生素抗性基因表达)。因此,其中导入有具有高特异性的靶特异性核酸酶并且其中仅中靶靶标被切割而脱靶靶标不被切割的细胞在用抗生素处理时能够存活。因此,能够基于这些选择元件是否表达来筛选具有高特异性或高活性的靶特异性核酸酶。
作为另一实例,当通过使用包含毒素基因作为选择元件的中靶靶标以及存在于细胞基因组中的脱靶靶标对靶特异性核酸酶进行筛选时,如果将包含中靶靶标的载体以及包含靶特异性核酸酶的载体导入细胞,可以预期的是,表现出高特异性的靶特异性核酸酶切割中靶靶标(其结果是毒素基因的表达被抑制)而不切割脱靶靶标(其结果是基因组不被切割)。因此,其中导入有具有高特异性的靶特异性核酸酶并且其中仅中靶靶标被切割而脱靶靶标不被切割的细胞能够存活;而其中中靶靶标和脱靶靶标均被切割的细胞不能存活,因为脱靶靶标的切割造成基因组被切割,由此可将两类细胞彼此区分开。
作为又一实例,当通过使用包含毒素基因作为选择元件的中靶靶标以及包含编码荧光蛋白的基因作为选择元件的脱靶靶标对靶特异性核酸酶进行筛选时,如果将包含中靶靶标的载体以及包含靶特异性核酸酶的载体导入细胞,可以预期的是,表现出高特异性的靶特异性核酸酶切割中靶靶标(其结果是毒素基因的表达被抑制)而不切割脱靶靶标(其结果是表达荧光蛋白)。因此,其中导入有具有高特异性的靶特异性核酸酶并且其中仅中靶靶标被切割而脱靶靶标不被切割的细胞能够存活,并可使用荧光蛋白来进行区分。
如上所述,可根据选择元件对用于筛选靶特异性核酸酶的方法进行多样化设计。
2.筛选方法
可使用筛选系统对具有高特异性或高活性的靶特异性核酸酶进行筛选。
作为一个方面,本发明涉及在多个靶特异性核酸酶测试组中对具有高特异性或高活性的靶特异性核酸酶进行筛选的方法。
在本发明中,术语“筛选靶特异性核酸酶的方法/对靶特异性核酸酶进行筛选的方法”是指对包含具有高特异性或高活性的靶特异性核酸酶的细胞进行分选。即,该方法是指在识别特定核酸酶的步骤前的步骤。
特别地,该方法在从通过改进靶特异性核酸酶和核酸酶文库而制备的多种核酸酶变体中选择具有高特异性或高活性的靶特异性核酸酶方面非常有用。
2-1筛选方法的第一实施方式
作为一个具体实施方式,
所述方法可用作从多种靶特异性核酸酶“变体”中筛选具有高特异性和高活性的靶特异性核酸酶的方法。
所述方法为使用如下组分的方法:
i)多重靶标,所述多重靶标包含一种或多种中靶靶标以及一种或多种脱靶靶标;以及
ii)靶特异性核酸酶变体,
所述方法包括:
a)将组分i)和组分ii)导入细胞;以及
b)对a)中仅中靶靶标被修饰的细胞进行分选。
2-1-1组分
在该情况下,组分i)可使用载体系统,并且在组分i)中,中靶靶标和脱靶靶标可包含于各自的载体中。
组分ii)的靶特异性核酸酶可为crispr-cas系统,并可为zfn、talen、foki或它们的混合物,此外,并不限于此。
crispr-cas系统可由引导rna和crispr酶组成。
组分ii)的靶特异性核酸酶变体可为crispr-cas系统变体,优选可为crispr酶变体,但不限于此。可利用电磁波、uv、辐照、化学物质、外源/内源基因作用等产生核酸酶变体。在一个实例中,利用uv对wtcrispr-cas系统进行辐照来获得变体。
crispr酶可为cas9,crispr酶变体可为cas9变体。
cas9变体可为其中的中靶效应提高或降低的变体。在该情况下,中靶效应意味着中靶位置被cas9切割或修饰。
cas9变体可为其中的脱靶效应提高或降低的变体。在该情况下,脱靶效应意味着脱靶位置被cas9切割或修饰。
优选地,cas9变体可为其中的中靶效应提高和/或脱靶效应降低的变体。
组分ii)可使用载体系统,当组分ii)是crispr-cas系统时,引导rna和crispr酶可包含于相同的载体或不同的载体中。
组分ii)可使用核糖核蛋白(rnp)系统,当组分ii)是crispr-cas系统时,引导rna和crispr酶可为rna-蛋白复合物的形式。
组分ii)可为人工合成的。
当组分ii)为crispr-cas系统时,引导rna可为人工合成的,crispr酶也可为人工合成的蛋白或多肽。
在组分i)中,中靶靶标可为互补结合至组分ii)的引导rna或引导rna的引导序列的基因或核酸的序列或位置。
在组分i)中,脱靶靶标可为部分互补结合至组分ii)的引导rna或引导rna的引导序列的基因或核酸的序列或位置。
在组分i)中,脱靶靶标可为形成与组分ii)的引导rna或引导rna的引导序列的核酸序列的一个或多个非互补结合的基因或核酸的序列或位置。
在组分i)中,中靶靶标和/或脱靶靶标可包含选择元件。
选择元件可为毒素基因、抗生素抗性基因、编码荧光蛋白的基因、标签基因、lacz基因或编码萤光素酶的基因,但不限于此。
2-1-2方法
在该情况下,当在a)中将组分i)和组分ii)导入细胞时,
可通过使用病毒载体系统、核糖核蛋白(rnp)、纳米粒子、脂质体等的转染、显微注射、电穿孔等将组分i)和组分ii)导入细胞,但导入方法不限于此。
细胞可为原核细胞或真核细胞。
此外,脱靶靶标可存在于细胞的基因组中。
当组分i)中的脱靶靶标存在于细胞基因组中时,可将包含组分i)的中靶靶标的载体和组分ii)导入细胞。
此外,中靶靶标可存在于细胞的基因组中。
当组分i)中的中靶靶标存在于细胞基因组中时,可将包含组分i)的脱靶靶标的载体和组分ii)导入细胞。
在b)中,
在已在a)中导入组分i)和组分ii)的细胞中,可对其中仅组分i)中的中靶靶标被组分ii)切割的细胞进行分选。
可通过中靶靶标中包含的选择元件的表达被抑制来选择其中仅中靶靶标被切割的细胞。
例如,当中靶靶标包含毒素基因时,由于中靶靶标被切割使得毒素基因的表达被抑制,细胞能够存活。
此外,可对组分i)中的脱靶靶标未被组分ii)切割的细胞进行分选。
可通过由于脱靶靶标未被切割而使得选择元件表达来对其中的脱靶靶标未被切割的细胞进行选择。
例如,当脱靶靶标包含抗生素抗性基因时,可在抗生素的存在下通过由于脱靶靶标未被切割而使得抗生素抗性基因表达来对具有抗生素抗性的细胞进行分选。
或者,当脱靶靶标位于细胞的基因组中时,由于细胞的基因组未被组分ii)切割,从而细胞的基因组被正常保留,结果是细胞能够存活。
在该情况下,在b)中分选的细胞可为其中组分i)的中靶靶标被组分ii)切割而组分i)的脱靶靶标未被组分ii)切割的细胞。可借助选择元件对这些细胞进行区分。
因此,能够通过使用如上所述的筛选方法在多种靶特异性核酸酶变体中对仅有效切割中靶靶标的具有高特异性和高活性的靶特异性核酸酶进行筛选,在该情况下,可使用多种选择元件借助多种检测方法对筛选方法进行设计。
2-2筛选方法的第二实施方式
作为另一具体实施方式,
所述方法可用作在靶特异性核酸酶“文库”中筛选具有高特异性和高活性的靶特异性核酸酶的方法。
所述方法为使用如下组分的筛选方法:
i)多重靶标,所述多重靶标包含一种或多种中靶靶标以及一种或多种脱靶靶标;以及
ii)靶特异性核酸酶文库,
所述方法包括:
a)将组分i)和组分ii)导入细胞;以及
b)对a)中仅中靶靶标被修饰的细胞进行分选。
2-2-1组分
在该情况下,组分i)可使用载体系统,并且在组分i)中,中靶靶标和脱靶靶标可包含于各自的载体中。
组分ii)的靶特异性核酸酶可为crispr-cas系统,并可为zfn、talen、foki或它们的混合物,此外,并不限于此。
靶特异性核酸酶文库可为crispr-cas系统文库。核酸酶文库可为直接制备的,也可为可商购的,还可由数据库获得。
crispr-cas系统可由引导rna和crispr酶组成。
crispr-cas系统文库可为引导rna文库和/或crispr酶文库。
组分ii)可使用载体系统,当组分ii)是crispr-cas系统时,引导rna和crispr酶可包含于相同的载体或不同的载体中。
组分ii)可使用核糖核蛋白(rnp)系统,当组分ii)是crispr-cas系统时,引导rna和crispr酶可为rna-蛋白复合物的形式。
组分ii)可为人工合成的。
当组分ii)为crispr-cas系统时,引导rna可为人工合成的,crispr酶也可为人工合成的蛋白或多肽。
在组分i)中,中靶靶标可为互补结合至组分ii)的引导rna或引导rna的引导序列的基因或核酸的序列或位置。
在组分i)中,脱靶靶标可为部分互补结合至组分ii)的引导rna或引导rna的引导序列的基因或核酸的序列或位置。
在组分i)中,脱靶靶标可为形成与组分ii)的引导rna或引导rna的引导序列的核酸序列的一个或多个非互补结合的基因或核酸的序列或位置。
在组分i)中,中靶靶标和/或脱靶靶标可包含选择元件。
选择元件可为毒素基因、抗生素抗性基因、编码荧光蛋白的基因、标签基因、lacz基因或编码萤光素酶的基因,但不限于此。
2-2-2方法
在该情况下,当在a)中将组分i)和组分ii)导入细胞时,
可通过使用病毒载体系统、核糖核蛋白(rnp)、纳米粒子、脂质体等的转染、显微注射、电穿孔等将组分i)和组分ii)导入细胞,但导入方法不限于此。
细胞可为原核细胞或真核细胞。
此外,脱靶靶标可存在于细胞的基因组中。
当组分i)中的脱靶靶标存在于细胞基因组中时,可将包含组分i)的中靶靶标的载体和组分ii)导入细胞。
此外,中靶靶标可存在于细胞的基因组中。
当组分i)中的中靶靶标存在于细胞基因组中时,可将包含组分i)的脱靶靶标的载体和组分ii)导入细胞。
在b)中,
在已在a)中导入组分i)和组分ii)的细胞中,可对其中仅组分i)中的中靶靶标被组分ii)切割的细胞进行分选。
可通过中靶靶标中包含的选择元件的表达被抑制来选择其中仅中靶靶标被切割的细胞。
例如,当中靶靶标包含毒素基因时,由于中靶靶标被切割使得毒素基因的表达被抑制,细胞能够存活。
此外,可对组分i)中的脱靶靶标未被组分ii)切割的细胞进行分选。
可通过由于脱靶靶标未被切割而使得选择元件表达来对其中的脱靶靶标未被切割的细胞进行选择。
例如,当脱靶靶标包含抗生素抗性基因时,可在抗生素的存在下通过由于脱靶靶标未被切割而使得抗生素抗性基因表达来对具有抗生素抗性的细胞进行分选。
或者,当脱靶靶标位于细胞的基因组中时,由于细胞的基因组未被组分ii)切割,从而细胞的基因组被正常保留,结果是细胞能够存活。
在该情况下,在b)中分选的细胞可为其中组分i)的中靶靶标被组分ii)切割而组分i)的脱靶靶标未被组分ii)切割的细胞。可借助选择元件对这些细胞进行区分。
因此,能够通过使用如上所述的筛选方法经由选择的细胞在靶特异性核酸酶文库中对具有高特异性或高活性的靶特异性核酸酶进行筛选,在该情况下,可使用多种选择元件借助多种检测方法对筛选方法进行设计。选择系统
3.靶特异性核酸酶的选择系统
通过使用筛选系统从测试核酸酶中分选包含具有高特异性或高活性的靶特异性核酸酶的细胞,进而可从中选择(识别)期望的核酸酶。
本发明的另一方面涉及使用多重靶标的靶特异性核酸酶的选择系统,所述多重靶标包含一种或多种中靶靶标和一种或多种脱靶靶标。
术语“靶特异性核酸酶的选择系统”指的是包括全部如下方面的概念:用于选择具有高特异性和高活性的靶特异性核酸酶以及识别其特定组成的试剂盒以及组合物、其使用方法以及该过程中衍生的各种中间体。在本说明书中描述为“系统”的发明可解释为组合物或方法以适合相应发明的方面,只要该发明是用于选择所期望的靶特异性核酸酶。
选择系统可由多重靶标和靶特异性核酸酶组成。
3-1靶特异性核酸酶(crispr-cas系统)
在该情况下,靶特异性核酸酶可由能够特异性识别靶标的部分和能够对所识别的靶标进行切割或修饰的部分组成。
能够特异性识别靶标的部分可根据靶基因或核酸序列而改变。
能够对所识别的靶标进行切割或修饰的部分可对所识别的靶标进行切割或修饰。在该情况下,能够特异性识别靶标的部分和能够对所识别的靶标进行切割或修饰的部分各自可独立存在,或者可作为单个结构以功能性划分的形式存在。
靶特异性核酸酶可为成簇规律间隔短回文重复(crispr)-crispr相关蛋白(cas)系统、锌指核酸酶(zfn)、转录激活因子样效应因子核酸酶(talen)、foki、核酸内切酶或它们的组合,并且,可优选为crispr-cas系统,但不限于此。
crispr-cas系统可由引导rna和crispr酶组成。
在该情况下,引导rna可为能够特异性识别靶标的部分,而crispr酶可为能够对所识别的靶标进行切割或修饰的部分。
3-1-1引导rna
引导rna可包含与待靶向的基因或核酸序列互补结合的核酸序列。
引导rna可由crrna和tracrrna组成,crrna包含与待靶向的基因或核酸序列互补的序列,tracrrna结合crispr酶。
在该情况下,crrna包含引导序列,该引导序列是能够与待靶向的基因或核酸序列互补结合的部分。引导序列具有与待靶向的基因或核酸序列互补的序列,其作用可在于识别待靶向的基因或核酸序列。
引导序列的大小可为5bp-50bp、5bp-40bp、5bp-30bp或5bp-20bp,但不限于此。优选地,引导序列可具有5bp-20bp的大小。
引导序列的核酸序列可包含与待靶向的基因或核酸的序列或位置以50%-100%的比例互补结合的核酸序列,但不限于此。
此外,crrna包含其序列与tracrrna的一部分互补的部分,因此crrna可部分地互补结合tracrrna。
引导rna可为双引导rna,其中crrna和tracrrna各自独立存在。或者引导rna可为单引导rna,其中crrna和tracrrna彼此相连。在该情况下,单引导rna可包含接头。
此外,根据crispr酶的类型,引导rna可仅包含crrna。
引导rna可包含化学修饰。在该情况下,化学修饰可包括如下化学修饰:其中,在引导rna所包含的核酸中的一个或两个或更多个核酸中具有硫代磷酸酯键、锁核酸(lna)、2′-o-甲基3′-硫代磷酸酯(ms)或2′-o-甲基3′硫代pace(msp)修饰。
引导rna可为其5′末端的部分序列截短的引导rna。
可根据靶基因或核酸序列设计引导rna的核酸序列。
引导rna可包含于载体中,在该情况下,载体可包含适于引导rna表达的启动子,例如plteto-1、arapbad、rhampbad或t7启动子。
引导rna可为人工合成的引导rna。
3-1-2crispr酶
crispr酶可为具有编码crispr酶的序列的核酸。
具有编码crispr酶的序列的核酸可包含于载体中。在该情况下,该载体可包含适于crispr酶表达的启动子,例如cmv或cag。
crispr酶可为多肽或蛋白。
可对crispr酶进行密码子优化,以适于待导入的对象。
crispr酶可为ii型crispr酶或v型crispr酶。
ii型crispr酶可为cas9。
v型crispr酶可为cpf1酶。
cas9可为酿脓链球菌cas9(spcas9)、金黄色葡萄球菌(staphylococcusaureus)cas9(sacas9)、嗜热链球菌cas9(stcas9)、脑膜炎奈瑟菌cas9(nmcas9)、空肠弯曲杆菌cas9(cjcas9)或它们的直系同源物,但不限于此。优选地,cas9可为spcas9或cjcas9。
cas9可为活性cas9或非活性cas9。
非活性cas9可包括完全非活性的cas9和部分非活性的cas9(例如切口酶)。
就cas9而言,存在于ruvc、hnh、rec和/或pi结构域中的一个或两个或更多个氨基酸可被突变。
cas9可包含由spcas9的氨基酸中的d10、e762、h840、n854、n863和d986所组成的氨基酸组或者与之对应的其它cas9直系同源物中的氨基酸组中的一个或两个或更多个氨基酸的突变。
cas9可包含由spcas9的氨基酸中的r780、k810、k848、k855和h982所组成的氨基酸组或者与之对应的其它cas9直系同源物中的氨基酸组中的一个或两个或更多个氨基酸的突变。
cas9可包含由spcas9的氨基酸中的g1104、s1109、l1111、d1135、s1136、g1218、n1317、r1335和t1337所组成的氨基酸组或者与之对应的其它cas9直系同源物中的氨基酸组中的一个或两个或更多个氨基酸的突变。
cpf1可为francisellanovicidacpf1(fncpf1)、氨基酸球菌属cpf1(ascpf1)、毛螺菌cpf1(lbcpf1)或它们的直系同源物,但不限于此。
cpf1可为活性cpf1或非活性cpf1。
非活性cpf1可包括完全非活性的cpf1和部分非活性的cpf1(例如切口酶)。
就cpf1而言,存在于ruvc、nuc、wed、rec和/或pi结构域中的一个或两个或更多个氨基酸可被突变。
cpf1可包含由fncpf1的氨基酸中的d917、e1006或d1255;ascpf1的氨基酸中的d908、e993或d1263;lbcpf1的氨基酸中的d832、e925、d947或d1180所组成的氨基酸组或者与之对应的其它cpf1直系同源物中的氨基酸组中的一个或两个或更多个氨基酸的突变。
crispr酶可识别基因或核酸序列中的原型间隔区邻近基序(pam)。
pam可根据crispr酶的来源而改变。
例如,当crispr酶是spcas9时,pam可为5′-ngg-3′;当crispr酶是stcas9时,pam可为5′-nnagaaw-3′(w=a或t);当crispr酶是nmcas9时,pam可为5′-nnnngatt-3′;当crispr酶是cjcas9时,pam可为5′-nnnvryac-3′(v=g或c或a,r=a或g,y=c或t),在该情况下,n可为a、t、g或c;或者a、u、g或c。此外,当crispr酶是fncpf1时,pam可为5′-ttn-3′;当crispr酶是ascpf1或lbcpf1时,pam可为5′-tttn-3′,在该情况下,n可为a、t、g或c;或者a、u、g或c。
crispr酶可进一步包含功能性结构域。在该情况下,crispr酶可为活性crispr酶或非活性crispr酶。
所述功能性结构域可为异源功能性结构域(hfd)。
功能性结构域可为选自于由如下结构域所组成的组中的一种:甲基化酶活性、去甲基化酶活性、转录激活活性、转录抑制活性、转录释放因子活性、组蛋白修饰活性、rna切割活性、dna切割活性、核酸结合活性和分子开关(例如光诱导型)。
功能性结构域可为选自于由如下结构域所组成的组中的一种:甲基化酶、去甲基化酶、磷酸酶、胸苷激酶、半胱氨酸脱氨酶和胞苷脱氨酶。
为了将功能性结构域与crispr酶相连,在crispr酶和功能性结构域间可进一步包含接头。
接头可为(a)n、(g)n、gggs、(ggs)n、(ggggs)n、(eaaak)n、sgggs、ggsggsggs、sgsetpgtsesatpes、xten或(xp)n,在该情况下,n可为1、2、3、4、5、6、7或更多。然而,接头和n不限于此。
crispr酶可进一步包含核定位序列(nls)。
3-1-3crispr酶的修饰
crispr酶可为活性crispr酶或非活性crispr酶。
非活性crispr酶可包括完全非活性的crispr酶和部分非活性的crispr酶(例如切口酶)。
crispr酶可为突变crispr酶。也就是说,crispr酶可为非天然存在的crispr酶。
在该情况下,突变crispr酶可为天然存在的crispr酶的至少一个或多个氨基酸被突变的crispr酶,突变可为氨基酸的替换、删除、添加等。
突变crispr酶可包含存在于天然存在的crispr酶的ruvc结构域的氨基酸中的一个或两个或更多个氨基酸的突变。
ruvc结构域可为ruvci、ruvcii或ruvciii结构域。
突变crispr酶可包含存在于天然存在的crispr酶的hnh结构域的氨基酸中的一个或两个或更多个氨基酸的突变。
突变crispr酶可包含存在于天然存在的crispr酶的rec结构域的氨基酸中的一个或两个或更多个氨基酸的突变。
突变crispr酶可包含存在于天然存在的crispr酶的pi结构域的氨基酸中的一个或两个或更多个氨基酸的突变。
突变crispr酶可包含存在于天然存在的crispr酶的nuc结构域的氨基酸中的一个或两个或更多个氨基酸的突变。
突变crispr酶可包含存在于天然存在的crispr酶的wed结构域的氨基酸中的一个或两个或更多个氨基酸的突变。
此外,crispr酶可为通过合并各突变crispr酶的一部分而重组得到的crispr酶。
例如,可分别利用crispr酶变体1的ruvc结构域、crispr酶变体2的hnh结构域和crispr酶变体3的pi结构域对天然状态下存在的crispr酶(即野生型crispr酶)的ruvc结构域、hnh结构域和pi结构域进行替换或重组。或者,可通过将crispr酶变体1的氨基酸序列的第1-500个氨基酸(或其编码核酸序列)与crispr酶变体2的氨基酸序列的第501-1000个氨基酸(或其编码核酸序列)和crispr酶变体3的氨基酸序列的第1001个至末端的氨基酸(或其编码核酸序列)进行组合来构建不同于crispr酶变体1、2、3的新crispr变体。
作为另一实例,可利用crispr酶变体2的氨基酸序列的第50-700个氨基酸(或其编码核酸序列)对crispr酶变体1的一部分(例如其氨基酸序列的第50-700个氨基酸(或其编码核酸序列))进行替换或重组。
此外,crispr酶可为由不同的crispr酶组合产生的crispr酶。
例如,可利用cpf1的ruvc结构域对cas9的ruvc结构域进行替换或重组。
此外,crispr酶可为在活性crispr酶或非活性crispr酶中进一步包含功能性结构域的crispr酶变体。
所述功能性结构域可为异源功能性结构域(hfd)。
功能性结构域可为选自于由如下结构域所组成的组中的一种:甲基化酶活性、去甲基化酶活性、转录激活活性、转录抑制活性、转录释放因子活性、组蛋白修饰活性、rna切割活性、dna切割活性、核酸结合活性和分子开关(例如光诱导型)。
功能性结构域可为选自于由如下结构域所组成的组中的一种:甲基化酶、去甲基化酶、磷酸酶、胸苷激酶、半胱氨酸脱氨酶和胞苷脱氨酶。
为了将功能性结构域与crispr酶相连,在crispr酶和功能性结构域间可进一步包含接头。
接头可为(a)n、(g)n、gggs、(ggs)n、(ggggs)n、(eaaak)n、sgggs、ggsggsggs、sgsetpgtsesatpes、xten或(xp)n,在该情况下,n可为1、2、3、4、5、6、7或更多。然而,接头和n不限于此。
例如,crispr酶变体可包含非活性酶中的转录抑制结构域,crispr酶变体可为抑制靶基因或核酸序列表达的变体。此外,crispr酶变体可包含非活性酶中的胞苷脱氨酶,通过改变靶基因或核酸序列的特定碱基序列,crispr酶变体可为能够抑制或提高相应基因或核酸序列表达的变体。
3-1-4crispr酶的突变效果
突变crispr酶可为经突变使得对待靶向的基因或核酸的切割效果(即,中靶)提高的crispr酶。
突变crispr酶可为经突变使得对待靶向的基因或核酸的切割效果(即,中靶)降低的crispr酶。
突变crispr酶可为经突变使得对非靶向的基因或核酸的切割效果(即,脱靶)提高的crispr酶。
突变crispr酶可为经突变使得对非靶向的基因或核酸的切割效果(即,脱靶)降低的crispr酶。
修饰crispr酶可为经修饰使得对基因或核酸的结合能力提高的crispr酶。
修饰crispr酶可为经修饰使得对基因或核酸的结合能力降低的crispr酶。
修饰crispr酶可为经修饰使得对基因或核酸序列中原型间隔区邻近基序(pam)的识别能力提高的crispr酶。
修饰crispr酶可为经修饰使得对基因或核酸序列中pam的识别能力降低的crispr酶。
修饰crispr酶可为其中的解旋酶动力学经修饰的crispr酶。
修饰crispr酶可根据修饰而包含构象重排。
3-2crispr复合物
crispr酶和引导rna可形成crispr复合物。
crispr复合物可在细胞外形成。
crispr复合物可在细胞的细胞质中形成。
crispr复合物可在细胞的细胞核中形成。
在crispr复合物中,crispr酶可识别存在于待靶向的基因或核酸序列中的pam。
在crispr复合物中,引导rna可与待靶向的基因或核酸序列互补结合。
当crispr复合物结合至待靶向的基因或核酸序列时,crispr复合物的crispr酶可对待靶向的基因或核酸序列进行切割或修饰。
在该情况下,可将靶特异性核酸酶导入细胞。
可通过使用病毒载体系统、核糖核蛋白(rnp)、纳米粒子、脂质体等的转染、显微注射、电穿孔等将靶特异性核酸酶导入细胞,但导入方法不限于此。
细胞可为原核细胞或真核细胞。
3-3多重靶标
在该情况下,靶标可为由靶特异性核酸酶靶向的基因或核酸序列。
多重靶标可由待靶向的基因或核酸序列(即,中靶靶标)以及非靶向的基因或核酸序列(即,脱靶靶标)组成。
多重靶标可由一种或多种中靶靶标和一种或多种脱靶靶标组成。作为一个实施方式,多重靶标可由一种中靶靶标和一种或多种脱靶靶标组成。作为另一实施方式,多重靶标可由一种中靶靶标和一种脱靶靶标组成。
多重靶标可存在于细胞中或从外源导入。
当多重靶标存在于细胞中时,该多重靶标可存在于宿主细胞的基因组中。优选地,一种或多种脱靶靶标可存在于宿主细胞的基因组中。
当将多重靶标从外源导入细胞时,可使用载体系统导入多重靶标。
当将多重靶标从外源导入细胞时,可通过对于各靶标使用不同的载体来导入多重靶标。也就是说,当多重靶标由一种中靶靶标和一种脱靶靶标组成时,载体可由包含中靶靶标的载体和包含脱靶靶标的载体组成。
可通过使用病毒载体系统、纳米粒子、脂质体等的转染、显微注射、电穿孔等将多重靶标导入细胞,但导入方法不限于此。
3-3-1中靶靶标
中靶靶标可为靶特异性核酸酶互补结合的靶基因或核酸的序列或位置。
中靶靶标可为与靶特异性核酸酶中能够特异性识别靶标的部分的核酸序列具有序列互补性的基因或核酸的序列或位置。
当靶特异性核酸酶为crispr-cas系统时,中靶靶标可为互补结合至引导rna或引导rna的引导序列的基因或核酸的序列或位置。
在该情况下,互补结合至引导rna或引导rna的引导序列的基因或核酸的序列可为5-50bp;此外,可根据引导rna或引导rna的引导序列的核酸序列的长度来调整其长度。
当靶特异性核酸酶为crispr-cas系统时,中靶靶标可包含crispr酶识别的pam序列。
当靶特异性核酸酶为crispr-cas系统时,中靶靶标可包含互补结合至引导rna或引导rna的引导序列的核酸序列以及crispr酶识别的pam序列。
在该情况下,中靶靶标中互补结合至引导rna或引导rna的引导序列的核酸序列可位于crispr酶识别的pam序列的5′末端。
在该情况下,中靶靶标中互补结合至引导rna或引导rna的引导序列的核酸序列可位于crispr酶识别的pam序列的3′末端。
中靶靶标可为(n)5-50-pam或者pam-(n)5-50;在该情况下,n可为a、t、g或c;或者a、u、g或c。
在该情况下,中靶靶标可位于细胞的基因组中。
细胞可为原核细胞或真核细胞。
在该情况下,中靶靶标可包含选择元件。
选择元件可为毒素基因、抗生素抗性基因、编码荧光蛋白的基因、标签基因、lacz基因或编码萤光素酶的基因,但不限于此。
毒素基因可为hok、fst、tisb、ldrd、flma、ibs、txpa/brnt、syme、xcv1262、ccdb、pare、mazf、yafo、hica、kid、zeta、dart或sxt基因,但不限于此。
毒素基因可根据中靶靶标的来源(即,根据起源)而改变。即,本领域技术人员可根据宿主细胞类型适当地对毒素基因进行选择和使用。
当宿主是大肠杆菌时,可使用毒素基因ccdb。
当宿主细胞是哺乳动物细胞时,可使用毒素基因次黄嘌呤磷酸核糖基转移酶(hprt)。
当宿主是酵母时,可使用毒素基因ura3。
可根据抗生素类型对抗生素抗性基因进行多样化设计。
抗生素可为卡那霉素、壮观霉素、链霉素、氨苄青霉素、羧苄青霉素、博来霉素、红霉素、多粘菌素b、四环素、zeocin、嘌呤霉素或氯霉素,但不限于此。
荧光蛋白可为绿色荧光蛋白(gfp)、红色荧光蛋白(rfp)、黄色荧光蛋白(yfp)、青色荧光蛋白(cfp)、蓝色荧光蛋白(bfp)或橙色荧光蛋白(ofp),但不限于此。
标签可为avitag、钙调蛋白标签、多聚谷氨酸标签、e标签、flag标签、ha标签、his标签、myc标签、ne标签、s标签、sbp标签、softag1、softag3、strep标签、tc标签、v5标签、vsv标签、xpress标签、isopeptag、spytag、snooptag、生物素羧基载体蛋白(bccp)、谷胱甘肽-s-转移酶(gst)标签、halotag、麦芽糖结合蛋白(mbp)标签、nus标签、硫氧还蛋白标签、几丁质结合蛋白(cbp)、硫氧还蛋白(trx)或聚(nanp)。
在该情况下,当包含选择元件的中靶靶标被靶特异性核酸酶切割或修饰时,选择元件可不表达。
3-3-2脱靶靶标
脱靶靶标可为靶特异性核酸酶部分互补结合的非靶基因或核酸的序列或位置。
脱靶靶标可为包含中靶靶标中的一个或多个其它碱基序列的核酸序列。
脱靶靶标可为具有与靶特异性核酸酶中能够特异性识别靶标的部分的核酸序列部分互补的序列的基因或核酸的序列或位置。
当靶特异性核酸酶为crispr-cas系统时,脱靶靶标可为部分互补结合至引导rna或引导rna的引导序列的基因或核酸的序列或位置。
在该情况下,互补结合至引导rna或引导rna的引导序列的基因或核酸的序列可为5-50bp;此外,可根据引导rna或引导rna的引导序列的核酸序列的长度来调整其长度。
当靶特异性核酸酶为crispr-cas系统时,脱靶靶标可包含crispr酶识别的pam序列。
当靶特异性核酸酶为crispr-cas系统时,脱靶靶标可包含互补结合至引导rna或引导rna的引导序列的核酸序列以及crispr酶识别的pam序列。
在该情况下,脱靶靶标中互补结合至引导rna或引导rna的引导序列的核酸序列可位于crispr酶识别的pam序列的5′末端。
在该情况下,脱靶靶标中互补结合至引导rna或引导rna的引导序列的核酸序列可位于crispr酶识别的pam序列的3′末端。
脱靶靶标可为(n)5-50-pam或者pam-(n)5-50;在该情况下,n可为a、t、g或c;或者a、u、g或c。
脱靶靶标可为包含与靶特异性核酸酶中特异性识别靶标的部分的核酸序列的一个或多个非互补结合的基因或核酸的序列或位置。
脱靶靶标可为包含与靶特异性核酸酶中特异性识别靶标的部分的核酸序列少于100%互补的结合的基因或核酸的序列或位置。具有少于100%的序列同源性的核酸序列为与中靶靶标的核酸序列类似的核酸序列,并可为其中包含一个或多个不同的碱基序列或者其中缺失一个或多个碱基序列的核酸序列。
当靶特异性核酸酶为crispr-cas系统时,脱靶靶标可为包含与引导rna或引导rna的引导序列的核酸序列的一个或多个非互补结合的基因或核酸的序列或位置。
当靶特异性核酸酶为crispr-cas系统时,脱靶靶标可为包含与引导rna或引导rna的引导序列的核酸序列少于100%互补的结合的基因或核酸的序列或位置。
当靶特异性核酸酶为crispr-cas系统时,脱靶靶标可在crispr酶识别的pam序列中包含一个或多个错配核酸序列。
在该情况下,脱靶靶标可位于细胞的基因组中。
细胞可为原核细胞或真核细胞。
在该情况下,脱靶靶标可包含选择元件。
选择元件可为毒素基因、抗生素抗性基因、编码荧光蛋白的基因、标签基因、lacz基因或编码萤光素酶的基因,但不限于此。
在该情况下,当包含选择元件的脱靶靶标被靶特异性核酸酶切割或修饰时,选择元件可不表达。
在该情况下,当包含选择元件的脱靶靶标未被靶特异性核酸酶切割或修饰时,选择元件可表达。
3-4选择元件的效果
本发明的术语“选择元件”是指用于检测靶基因或核酸序列是否被靶特异性核酸酶切割或修饰的标记。因此,“选择元件”可与“选择标记”互换使用。
基于选择元件是否表达,能够检测靶基因或核酸序列是否被靶特异性核酸酶切割或修饰。也就是说,能够检测中靶效应是否提高和/或脱靶效应是否降低。
中靶靶标和/或脱靶靶标中包含的选择元件可为确定靶特异性核酸酶的高特异性或高活性的元件。
作为一个实例,当通过使用包含毒素基因作为选择元件的中靶靶标以及包含抗生素抗性基因作为选择元件的脱靶靶标对靶特异性核酸酶进行筛选时,如果将各自包含中靶靶标和脱靶靶标的载体以及包含靶特异性核酸酶的载体导入细胞,可以预期的是,表现出高特异性的靶特异性核酸酶切割中靶靶标(其结果是毒素基因的表达被抑制)而不切割脱靶靶标(其结果是抗生素抗性基因表达)。因此,其中导入有具有高特异性的靶特异性核酸酶并且其中仅中靶靶标被切割而脱靶靶标不被切割的细胞在用抗生素处理时能够存活。因此,能够基于这些选择元件是否表达来筛选具有高特异性或高活性的靶特异性核酸酶。
作为另一实例,当通过使用包含毒素基因作为选择元件的中靶靶标以及存在于细胞基因组中的脱靶靶标对靶特异性核酸酶进行筛选时,如果将包含中靶靶标的载体以及包含靶特异性核酸酶的载体导入细胞,可以预期的是,表现出高特异性的靶特异性核酸酶切割中靶靶标(其结果是毒素基因的表达被抑制)而不切割脱靶靶标(其结果是基因组不被切割)。因此,其中导入有具有高特异性的靶特异性核酸酶并且其中仅中靶靶标被切割而脱靶靶标不被切割的细胞能够存活;而其中中靶靶标和脱靶靶标均被切割的细胞不能存活,因为脱靶靶标的切割造成基因组被切割,由此可将两类细胞彼此区分开。
作为又一实例,当通过使用包含毒素基因作为选择元件的中靶靶标以及包含编码荧光蛋白的基因作为选择元件的脱靶靶标对靶特异性核酸酶进行筛选时,如果将包含中靶靶标的载体以及包含靶特异性核酸酶的载体导入细胞,可以预期的是,表现出高特异性的靶特异性核酸酶切割中靶靶标(其结果是毒素基因的表达被抑制)而不切割脱靶靶标(其结果是表达荧光蛋白)。因此,其中导入有具有高特异性的靶特异性核酸酶并且其中仅中靶靶标被切割而脱靶靶标不被切割的细胞能够存活,并可使用荧光蛋白来进行区分。
因此,中靶靶标和/或脱靶靶标中包含的选择元件可为用于确定和选择靶特异性核酸酶的高特异性或高活性的参照。
4.核酸酶的选择方法
可使用选择系统对具有高特异性或高活性的靶特异性核酸酶进行选择。
作为一个方面,本发明涉及在多个靶特异性核酸酶测试组中对具有高特异性或高活性的靶特异性核酸酶进行选择的方法。
在本发明中,“选择靶特异性核酸酶的方法/对靶特异性核酸酶进行选择的方法”包括选择包含具有高特异性或高活性的靶特异性核酸酶的细胞并随后识别特定核酸酶的组成。例如,可通过本发明获得优异的靶特异性核酸酶的序列信息。
特别地,该方法在从通过改进靶特异性核酸酶和核酸酶文库而制备的多种核酸酶变体中选择具有高特异性或高活性的靶特异性核酸酶方面非常有用。
4-1选择方法的第一具体实施方式
作为一个具体实施方式,
所述方法可用作从多种靶特异性核酸酶“变体”中选择具有高特异性和高活性的靶特异性核酸酶的方法。
所述方法为用于选择具有高特异性或高活性的靶特异性核酸酶的方法,所述方法使用如下组分:
i)多重靶标,所述多重靶标包含一种或多种中靶靶标以及一种或多种脱靶靶标;以及
ii)靶特异性核酸酶变体,
所述方法包括:
a)将组分i)和组分ii)导入细胞;
b)通过基于a)中选择元件是否表达对中靶效应和脱靶效应进行识别来分选所述细胞;以及
c)选择b)中分选的细胞中包含的核酸酶作为具有高特异性或高活性的靶特异性核酸酶。
4-1-1组分
在该情况下,组分i)可使用载体系统,并且在组分i)中,中靶靶标和脱靶靶标可包含于各自的载体中。
组分ii)的靶特异性核酸酶可为crispr-cas系统,并可为zfn、talen、foki等,此外,并不限于此。
crispr-cas系统可由引导rna和crispr酶组成。
组分ii)的靶特异性核酸酶变体可为crispr-cas系统变体,优选可为crispr酶变体,但不限于此。可利用电磁波、uv、辐照、化学物质、外源/内源基因作用等产生核酸酶变体。在一个实例中,利用uv对wtcrispr-cas系统进行辐照来获得变体。
crispr酶可为cas9,crispr酶变体可为cas9变体。
cas9变体可为其中的中靶效应提高或降低的变体。在该情况下,中靶效应意味着中靶位置被cas9切割或修饰。
cas9变体可为其中的脱靶效应提高或降低的变体。在该情况下,脱靶效应意味着脱靶位置被cas9切割或修饰。
优选地,cas9变体可为其中的中靶效应提高和/或脱靶效应降低的变体。
组分ii)可使用载体系统,当组分ii)是crispr-cas系统时,引导rna和crispr酶可包含于相同的载体或不同的载体中。
组分ii)可使用核糖核蛋白(rnp)系统,当组分ii)是crispr-cas系统时,引导rna和crispr酶可为rna-蛋白复合物的形式。
组分ii)可为人工合成的。
当组分ii)为crispr-cas系统时,引导rna可为人工合成的,crispr酶也可为人工合成的蛋白或多肽。
在组分i)中,中靶靶标可为互补结合至组分ii)的引导rna或引导rna的引导序列的基因或核酸的序列或位置。
在组分i)中,脱靶靶标可为部分互补结合至组分ii)的引导rna或引导rna的引导序列的基因或核酸的序列或位置。
在组分i)中,脱靶靶标可为形成与组分ii)的引导rna或引导rna的引导序列的核酸序列的一个或多个非互补结合的基因或核酸的序列或位置。
在组分i)中,中靶靶标和/或脱靶靶标可包含选择元件。
选择元件可为毒素基因、抗生素抗性基因、编码荧光蛋白的基因、标签基因、lacz基因或编码萤光素酶的基因,但不限于此。
4-1-2方法
在该情况下,当在a)中将组分i)和组分ii)导入细胞时,
可通过使用病毒载体系统、核糖核蛋白(rnp)、纳米粒子、脂质体等的转染、显微注射、电穿孔等将组分i)和组分ii)导入细胞,但导入方法不限于此。
细胞可为原核细胞或真核细胞。
此外,脱靶靶标可存在于细胞的基因组中。
当组分i)中的脱靶靶标存在于细胞基因组中时,可将包含组分i)的中靶靶标的载体和组分ii)导入细胞。
此外,中靶靶标可存在于细胞的基因组中。
当组分i)中的中靶靶标存在于细胞基因组中时,可将包含组分i)的脱靶靶标的载体和组分ii)导入细胞。
在该情况下,在b)中,
在已在a)中导入组分i)和组分ii)的细胞中,可对其中仅组分i)中的中靶靶标被组分ii)切割的细胞进行选择。
可通过中靶靶标中包含的选择元件的表达被抑制来选择其中仅中靶靶标被切割的细胞。
例如,当中靶靶标包含毒素基因时,由于中靶靶标被切割使得毒素基因的表达被抑制,细胞能够存活。
此外,可对组分i)中的脱靶靶标未被组分ii)切割的细胞进行选择。
可通过由于脱靶靶标未被切割而使得选择元件表达来对其中的脱靶靶标未被切割的细胞进行选择。
例如,当脱靶靶标包含抗生素抗性基因时,可在抗生素的存在下通过由于脱靶靶标未被切割而使得抗生素抗性基因表达来对具有抗生素抗性的细胞进行选择。
或者,当脱靶靶标位于细胞的基因组中时,由于细胞的基因组未被组分ii)切割,从而细胞的基因组被正常保留,结果是细胞能够存活。
在该情况下,在b)中分选的细胞可为其中组分i)的中靶靶标被组分ii)切割而脱靶靶标未被组分ii)切割的细胞。可借助选择元件对这些细胞进行区分。
在该情况下,在c)中,
可使用b)中分选的细胞来识别导入分选的细胞中的组分ii),即,靶特异性核酸酶。
导入分选的细胞中的组分ii),即靶特异性核酸酶(使用b)中分选的细胞)可为能够仅选择性切割或修饰中靶靶标的靶特异性核酸酶。
可通过对从c)中分选的细胞获得的核酸酶进行测序来获得核酸酶的序列,从而获得具有高特异性或高活性的靶特异性核酸酶。
例如,当通过在30℃下在包含卡那霉素、氯霉素和阿拉伯糖的lb琼脂平板上对经电穿孔的大肠杆菌培养16小时而使菌落生长至大小能够为肉眼所见时,将各菌落接种至10ml包含氯霉素的lb培养基中,随后在摇床中42℃培养12小时。离心获得大肠杆菌沉淀后,使用小提试剂盒从沉淀中提取质粒。可使用例如sanger测序方法对提取的质粒进行测序。对于引物,可使用存在于cas9n端和c端外侧的通用测序引物(例如cmv-f或bgh-r)以及cas9中间部分的测序引物。
作为本发明的一个具体实施方式,当参照图1进行描述时,在识别靶特异性核酸酶的方法中,在包含卡那霉素和氯霉素(它们为质粒b和质粒c的识别标记)和阿拉伯糖(操纵阿拉伯糖启动子)的lb琼脂平板上,借助电穿孔将质粒a、质粒b和质粒c全部导入,当将在包含无水四环素的soc中孵育1小时的大肠杆菌分成小份时,质粒a被质粒c的核酸酶切割,只有基因组dna未被切割的大肠杆菌存活。
因此,可借助通过使用上文所述的方法分选的细胞来选择具有高特异性或高活性的靶特异性核酸酶。
4-2选择方法的第二具体实施方式
作为另一具体实施方式,
所述方法可用作在靶特异性核酸酶“文库”中选择具有高特异性和高活性的靶特异性核酸酶的方法。
所述方法为用于选择具有高特异性或高活性的靶特异性核酸酶的方法,所述方法使用如下组分:
i)多重靶标,所述多重靶标包含一种或多种中靶靶标以及一种或多种脱靶靶标;以及
ii)靶特异性核酸酶文库,
所述方法包括:
a)将组分i)和组分ii)导入细胞;
b)对a)中仅中靶靶标被修饰的细胞进行分选;以及
c)利用b)中选择的细胞来识别组分ii)。
4-2-1组分
在该情况下,组分i)可使用载体系统,并且在组分i)中,中靶靶标和脱靶靶标可包含于各自的载体中。
组分ii)的靶特异性核酸酶可为crispr-cas系统,并可为zfn、talen、foki等,此外,并不限于此。
靶特异性核酸酶文库可为crispr-cas系统文库。核酸酶文库可为直接制备的,也可为可商购的,还可由数据库获得
crispr-cas系统可由引导rna和crispr酶组成。
crispr-cas系统文库可为引导rna文库和/或crispr酶文库。
组分ii)可使用载体系统,当组分ii)是crispr-cas系统时,引导rna和crispr酶可包含于相同的载体或不同的载体中。
组分ii)可使用核糖核蛋白(rnp)系统,当组分ii)是crispr-cas系统时,引导rna和crispr酶可为rna-蛋白复合物的形式。
组分ii)可为人工合成的。
在组分i)中,中靶靶标可为互补结合至组分ii)的引导rna或引导rna的引导序列的基因或核酸的序列或位置。
在组分i)中,脱靶靶标可为部分互补结合至组分ii)的引导rna或引导rna的引导序列的基因或核酸的序列或位置。
在组分i)中,脱靶靶标可为形成与组分ii)的引导rna或引导rna的引导序列的一个或多个非互补结合的基因或核酸的序列或位置。
在组分i)中,中靶靶标和/或脱靶靶标可包含选择元件。
选择元件可为毒素基因、抗生素抗性基因、编码荧光蛋白的基因、标签基因、lacz基因或编码萤光素酶的基因,但不限于此。
4-2-2方法
在该情况下,当在a)中将组分i)和组分ii)导入细胞时,
可通过使用病毒载体系统、核糖核蛋白(rnp)、纳米粒子、脂质体等的转染、显微注射、电穿孔等将组分i)和组分ii)导入细胞,但导入方法不限于此。
细胞可为原核细胞或真核细胞。
此外,脱靶靶标可存在于细胞的基因组中。
当组分i)中的脱靶靶标存在于细胞基因组中时,可将包含组分i)的中靶靶标的载体和组分ii)导入细胞。
此外,中靶靶标可存在于细胞的基因组中。
当组分i)中的中靶靶标存在于细胞基因组中时,可将包含组分i)的脱靶靶标的载体和组分ii)导入细胞。
在b)中,
在已在a)中导入组分i)和组分ii)的细胞中,可对其中仅组分i)中的中靶靶标被组分ii)切割的细胞进行选择。
可通过中靶靶标中包含的选择元件的表达被抑制来选择其中仅中靶靶标被切割的细胞。
例如,当中靶靶标包含毒素基因时,由于中靶靶标被切割使得毒素基因的表达被抑制,细胞能够存活。
此外,可对组分i)中的脱靶靶标未被组分ii)切割的细胞进行选择。
可通过由于脱靶靶标未被切割而使得选择元件表达来对其中的脱靶靶标未被切割的细胞进行选择。
例如,当脱靶靶标包含抗生素抗性基因时,可在抗生素的存在下通过由于脱靶靶标未被切割而使得抗生素抗性基因表达来对具有抗生素抗性的细胞进行选择。
或者,当脱靶靶标位于细胞的基因组中时,由于细胞的基因组未被组分ii)切割,从而细胞的基因组被正常保留,结果是细胞能够存活。
在该情况下,在b)中分选的细胞可为其中组分i)的中靶靶标被组分ii)切割而脱靶靶标未被组分ii)切割的细胞。可借助选择元件对这些细胞进行区分。
在该情况下,在c)中,
可使用b)中分选的细胞来识别导入分选的细胞中的组分ii),即,靶特异性核酸酶。
导入分选的细胞中的组分ii),即靶特异性核酸酶(使用b)中分选的细胞)可为能够仅选择性切割或修饰中靶靶标的靶特异性核酸酶。
可通过对从c)中分选的细胞获得的核酸酶进行测序来获得核酸酶的序列,从而获得具有高特异性或高活性的靶特异性核酸酶。
例如,当通过在30℃下在包含卡那霉素、氯霉素和阿拉伯糖的lb琼脂平板上对经电穿孔的大肠杆菌培养16小时而使菌落生长至大小能够为肉眼所见时,将各菌落接种至10ml包含氯霉素的lb培养基中,随后在摇床中42℃培养12小时。离心获得大肠杆菌沉淀后,使用小提试剂盒从沉淀中提取质粒。可使用例如sanger测序方法对提取的质粒进行测序。对于引物,可使用存在于cas9n端和c端外侧的通用测序引物(例如cmv-f或bgh-r)以及cas9中间部分的测序引物。
作为本发明的一个具体实施方式,当参照图1进行描述时,在识别靶特异性核酸酶的方法中,在包含卡那霉素和氯霉素(它们为质粒b和质粒c的识别标记)和阿拉伯糖(操纵阿拉伯糖启动子)的lb琼脂平板上,借助电穿孔将质粒a、质粒b和质粒c全部导入,当将在包含无水四环素的soc中孵育1小时的大肠杆菌分成小份时,质粒a被质粒c的核酸酶切割,只有基因组dna未被切割的大肠杆菌存活。
因此,可借助通过使用上文所述的方法分选的细胞在靶特异性核酸酶文库中选择具有高特异性或高活性的靶特异性核酸酶。
5.组合物或试剂盒
本发明的另一方面涉及用于对具有高特异性或高活性的靶特异性核酸酶进行选择的筛选试剂盒,所述筛选试剂盒包含:多重靶标,该多重靶标包含一种或多种选择元件。试剂盒可为组合物的形式。
在一个具体实施方式中,组合物或试剂盒可由如下组成:
i)包含一种或多种选择元件的多重靶标;以及
ii)靶特异性核酸酶和/或iii)宿主细胞。
根据本发明的用于对具有高特异性或高活性的靶特异性核酸酶进行选择的筛选试剂盒或组合物包含多重靶标(该多重靶标包含一种或多种选择元件)作为必要组分,并可选地包含靶特异性核酸酶和/或宿主细胞。
如有必要,可以将本发明的试剂盒作为包含含有一种或多种选择元件的多重靶标的1液型试剂盒来提供。
如有必要,可以将本发明的试剂盒作为分别包含含有一种或多种选择元件的多重靶标和宿主细胞的2液型试剂盒来提供。
在该情况下,还可以通过在宿主细胞中包含含有选择元件的多重靶标来将所述试剂盒作为1液型提供。例如,试剂盒可以作为单独的质粒包含在宿主细胞中,也可以通过整合至宿主细胞基因组中来提供。
如有必要,可以将本发明的试剂盒作为分别包含含有一种或多种选择元件的多重靶标、宿主细胞和测试核酸酶的3液型试剂盒来提供。
在该情况下,还可以通过在宿主细胞中包含含有选择元件的多重靶标来将所述试剂盒作为2液型提供。例如,试剂盒可以作为单独的质粒包含在宿主细胞中,也可以通过整合至宿主细胞基因组中来提供。
在该情况下,组分i)可使用载体系统,并且在组分i)中,一种或多种中靶靶标以及一种或多种脱靶靶标可包含于各自的载体中。
组分ii)的靶特异性核酸酶可为crispr-cas系统,并可为zfn、talen、foki等,此外,并不限于此。
crispr-cas系统可由引导rna和crispr酶组成。
组分ii)可使用载体系统,当组分ii)是crispr-cas系统时,引导rna和crispr酶可包含于相同的载体或不同的载体中。
组分ii)可使用核糖核蛋白(rnp)系统,当组分ii)是crispr-cas系统时,引导rna和crispr酶可为rna-蛋白复合物的形式。
组分ii)可为人工合成的。
当组分ii)为crispr-cas系统时,引导rna可为人工合成的,crispr酶也可为人工合成的蛋白或多肽。
在组分i)中,中靶靶标可为互补结合至组分ii)的引导rna或引导rna的引导序列的基因或核酸的序列或位置。
在组分i)中,脱靶靶标可为部分互补结合至组分ii)的引导rna或引导rna的引导序列的基因或核酸的序列或位置。
在组分i)中,脱靶靶标可为形成与组分ii)的引导rna或引导rna的引导序列的核酸序列的一个或多个非互补结合的基因或核酸的序列或位置。
在组分i)中,中靶靶标和/或脱靶靶标可连接至选择元件。
选择元件可为毒素基因、抗生素抗性基因、编码荧光蛋白的基因、标签基因、lacz基因或编码萤光素酶的基因,但不限于此。
组分iii)宿主细胞可为适于选择元件表达的任何细胞。组分iii)宿主细胞可为原核细胞或真核细胞。
例如,当使用毒素基因ccdb时,可使用大肠杆菌作为宿主;当使用次黄嘌呤磷酸核糖基转移酶(hprt)时,可使用衍生自哺乳动物的细胞作为宿主细胞;当使用毒素基因ura3时,可使用酵母作为宿主。
此外,显而易见的是,本发明的领域的技术人员能够任意选择和使用适于核酸酶的筛选和选择的细胞类型。
此外,如有必要,所述组合物或试剂盒可另外包含用于进行选择的缓冲液和多种物质(例如抗生素、x-gal等)或者用于在细胞中进行导入的多种试剂(例如转染剂、脂质体(lipofectamine)等)。
6.细胞(系)或生产细胞的方法
此外,本发明提供了包含用于筛选和/或选择靶特异性核酸酶的多种靶标的细胞和/或生产该细胞的方法。
所述细胞的特征在于包含多重靶标。
在该情况下,所述多重靶标可为存在于细胞基因组中的多重靶标,或者可为从外源导入细胞中的多重靶标。
细胞可为原核细胞或真核细胞。
6-1多重靶标
靶标可为由靶特异性核酸酶靶向的基因或核酸序列。
多重靶标可由待靶向的基因或核酸序列(即,中靶靶标)以及非靶向的基因或核酸序列(即,脱靶靶标)组成。
多重靶标可由一种或多种中靶靶标和一种或多种脱靶靶标组成。
当将多重靶标从外源导入细胞时,可使用载体系统导入多重靶标。
当将多重靶标从外源导入细胞时,可通过对于各靶标使用不同的载体来导入多重靶标。也就是说,当多重靶标由一种中靶靶标和一种脱靶靶标组成时,载体可由包含中靶靶标的载体和包含脱靶靶标的载体组成。
6-1-1中靶靶标
中靶靶标可为靶特异性核酸酶互补结合的靶基因或核酸的序列或位置。
中靶靶标可为与靶特异性核酸酶中能够特异性识别靶标的部分的核酸序列具有序列互补性的基因或核酸的序列或位置。
当靶特异性核酸酶为crispr-cas系统时,中靶靶标可为互补结合至引导rna或引导rna的引导序列的基因或核酸的序列或位置。
在该情况下,互补结合至引导rna或引导rna的引导序列的基因或核酸的序列可为5-50bp;此外,可根据引导rna或引导rna的引导序列的核酸序列的长度来调整其长度。
当靶特异性核酸酶为crispr-cas系统时,中靶靶标可包含crispr酶识别的pam序列。
当靶特异性核酸酶为crispr-cas系统时,中靶靶标可包含互补结合至引导rna或引导rna的引导序列的核酸序列以及crispr酶识别的pam序列。
在该情况下,中靶靶标中互补结合至引导rna或引导rna的引导序列的核酸序列可位于crispr酶识别的pam序列的5′末端。
在该情况下,中靶靶标中互补结合至引导rna或引导rna的引导序列的核酸序列可位于crispr酶识别的pam序列的3′末端。
中靶靶标可为(n)5-50-pam或者pam-(n)5-50;在该情况下,n可为a、t、g或c;或者a、u、g或c。
在该情况下,中靶靶标可位于细胞的基因组中。
在该情况下,中靶靶标可包含选择元件。
选择元件可为毒素基因、抗生素抗性基因、编码荧光蛋白的基因、标签基因、lacz基因或编码萤光素酶的基因,但不限于此。
当包含选择元件的中靶靶标被靶特异性核酸酶切割或修饰时,选择元件可不表达。
6-1-2脱靶靶标
脱靶靶标可为靶特异性核酸酶部分互补结合的非靶基因或核酸的序列或位置。
脱靶靶标可为包含中靶靶标中的一个或多个其它碱基序列的核酸序列。
脱靶靶标可为具有与靶特异性核酸酶中能够特异性识别靶标的部分的核酸序列部分互补的序列的基因或核酸的序列或位置。
当靶特异性核酸酶为crispr-cas系统时,脱靶靶标可为部分互补结合至引导rna或引导rna的引导序列的基因或核酸的序列或位置。
在该情况下,互补结合至引导rna或引导rna的引导序列的基因或核酸的序列可为5-50bp;此外,可根据引导rna或引导rna的引导序列的核酸序列的长度来调整其长度。
当靶特异性核酸酶为crispr-cas系统时,脱靶靶标可包含crispr酶识别的pam序列。
当靶特异性核酸酶为crispr-cas系统时,脱靶靶标可包含互补结合至引导rna或引导rna的引导序列的核酸序列以及crispr酶识别的pam序列。
在该情况下,脱靶靶标中互补结合至引导rna或引导rna的引导序列的核酸序列可位于crispr酶识别的pam序列的5′末端。
在该情况下,脱靶靶标中互补结合至引导rna或引导rna的引导序列的核酸序列可位于crispr酶识别的pam序列的3′末端。
脱靶靶标可为(n)5-50-pam或者pam-(n)5-50;在该情况下,n可为a、t、g或c;或者a、u、g或c。
脱靶靶标可为包含与靶特异性核酸酶中特异性识别靶标的部分的核酸序列的一个或多个非互补结合的基因或核酸的序列或位置。
脱靶靶标可为包含与靶特异性核酸酶中特异性识别靶标的部分的核酸序列少于100%互补的结合的基因或核酸的序列或位置。
当靶特异性核酸酶为crispr-cas系统时,脱靶靶标可为包含与引导rna或引导rna的引导序列的核酸序列的一个或多个非互补结合的基因或核酸的序列或位置。
当靶特异性核酸酶为crispr-cas系统时,脱靶靶标可为包含与引导rna或引导rna的引导序列的核酸序列少于100%互补的结合的基因或核酸的序列或位置。
当靶特异性核酸酶为crispr-cas系统时,脱靶靶标可在crispr酶识别的pam序列中包含一个或多个错配核酸序列。
在该情况下,脱靶靶标可位于细胞的基因组中。
脱靶靶标可额外包含选择元件。
选择元件可为毒素基因、抗生素抗性基因、编码荧光蛋白的基因、标签基因、lacz基因或编码萤光素酶的基因,但不限于此。
在该情况下,当包含选择元件的脱靶靶标被靶特异性核酸酶切割或修饰时,选择元件可不表达。
在该情况下,当包含选择元件的脱靶靶标未被靶特异性核酸酶切割或修饰时,选择元件可表达。
细胞可包含根据靶特异性核酸酶的靶标进行多样化设计的多重靶标。
此外,细胞可仅包含多重靶标中的一些靶标。
也就是说,在多重靶标中,细胞可仅包含中靶靶标或仅包含脱靶靶标。
6-2生产方法
生产细胞的方法可使用将包含多重靶标的载体系统导入细胞的方法。
可通过使用病毒载体系统、纳米粒子、脂质体等的转染、显微注射、电穿孔等将多重靶标导入细胞,但导入方法不限于此。
此外,就将多重靶标导入细胞而言,可同时导入多重靶标。
也就是说,可同时将包含中靶靶标的载体和包含脱靶靶标的载体(这些靶标为所述多重靶标)导入细胞。
就将多重靶标导入细胞而言,可分别导入多重靶标。
也就是说,在多重靶标中,可在先将包含中靶靶标的载体导入细胞后,再将包含脱靶靶标的载体导入细胞。或者,在多重靶标中,可在先将包含脱靶靶标的载体导入细胞后,再将包含中靶靶标的载体导入细胞。
此外,就将多重靶标导入细胞而言,可仅将多重靶标中的一些靶标导入。
也就是说,可仅将包含多重靶标中的中靶靶标的载体导入细胞。或者,可仅将包含多重靶标中的脱靶靶标的载体导入细胞。
本发明的系统可有利地用于从任何核酸酶测试组中选择具有高特异性和高活性的靶特异性核酸酶。此外,当对基因进行修正或操纵时,通过使用本发明的系统选择的核酸酶,可降低脱靶效应和提高中靶效应。
实施例
以下将通过实施例对本发明进行更具体的描述。
这些实施例仅用于举例说明本发明,对于本领域普通技术人员显而易见的是,本发明的范围不应解释为受这些实施例的限制。
实施例1在大肠杆菌中对cas9变体进行筛选
1-1对照试验
catcaacatcgaatacatganag(seqidno.1)是在k12大肠杆菌基因组dna中发现的重复序列。该序列包含与ngg类似的pam序列nag,因此已知其会被crispr-cas9酶以较低效率切割。
将来自上述序列的20-mer引导序列catcaacatcgaatacatga(seqidno.2)在质粒b中作为sgrna使用。将由sgrna靶向的23-mer靶序列catcaacatcgaatacatgatgg(seqidno.3)插入质粒a中作为靶位点。该靶序列具有预期表现出高切割效率的ngg(而非nag)作为pam位点。
使用电穿孔将质粒a和质粒b都导入大肠杆菌bw25141。在37℃的条件下在含有氨苄青霉素和卡那霉素抗生素的lb培养基中对导入质粒a和质粒b的细胞进行培养。在通过细胞培养生长出菌落后,使用标准方法从菌落制备电转感受态细胞(electrocompetentcell)。
将作为阳性对照的包含wtcas9的质粒c或者作为阴性对照的空载体(nullvector)导入含有质粒a和质粒b的电转感受态细胞。在soc培养基中对细胞培养1小时后,将培养的一半细胞在含有氯霉素的lb培养基中进行培养,并将培养的另一半细胞在含有氯霉素、卡那霉素、10mm阿拉伯糖和100ng/ml无水四环素(atc)的lb培养基中进行培养。
其结果是,对于各自导入质粒c和空载体的全部细胞,在含有氯霉素的lb培养基中能识别约10,000个菌落;而在含有氯霉素、卡那霉素、阿拉伯糖和无水四环素的lb培养基中没有发现菌落。下文说明上述结果。
在导入包含wtcas9的质粒c的细胞中,由于表达的wtcas9对代替的pam序列nag具有残余活性,包含nag的大肠杆菌基因组dna序列被切割。另一方面,在导入不含任何物质的质粒c(即空载体)的细胞中,由于缺少切割活性导致含有毒素基因的质粒a不能被切割,因此在含有阿拉伯糖的lb培养基中诱导毒素基因表达,从而显示出凋亡。
对于另一对照,将质粒a′和质粒b′用作阳性对照,其分别包含大肠杆菌基因组dna中不存在的序列ctagatgagaccggatccggtctcctgg(seqidno.4)和ctagatgagaccggatccggtctcc(seqidno.5)。在将含有wtcas9的质粒c导入其中后,在仅含有氯霉素的lb培养基以及含有氯霉素、卡那霉素、阿拉伯糖和无水四环素的lb培养基中各自均观察到约10,000个菌落。这可认为是wtcas9有效切割质粒a而不破坏基因组dna的结果。
1-2突变
在成功的对照实验后,通过使用agilenttechnologies,inc.制造的genemorphii试剂盒,利用低错误率的实验方法通过pcr扩增向wtcas9的序列引入随机突变。将pcr产物连接到双酶切的质粒c的骨架中。通过将连接产生的质粒导入高效电转感受态细胞,构建1,000,000大小的文库。将随机文库导入包含之前制备的质粒a和质粒b的电转感受态细胞。
随后,以与前述实验相同的方式在两种培养基中对细胞进行培养。其结果是,在仅含有氯霉素的lb培养基中识别出约2,500个菌落,而在含有氯霉素、卡那霉素、阿拉伯糖和脱水四环素的lb培养基中显现出180个菌落。在含有氯霉素的lb培养基中培养各菌落,以使得包含随机突变的质粒c表达。确认了由培养的菌落获得的随机突变的全部序列是具有针对通用pam序列ngg的活性、而针对nag(其为类似的但不是通用的pam序列)显示出受抑制的活性的有效突变。
通过该实验,可以发现对引导序列具有特异性的cas9变体。在该情况下,sgrna序列的错配序列可为大肠杆菌内源基因组dna序列或从外源导入和插入大肠杆菌的人工序列。
通过使用上文所述的筛选方法,成功鉴别出具有针对通用pam序列ngg的活性、而且针对nag(其为类似的但不是通用的pam序列)的活性降低的多种cas9变体。
实施例2:核酸酶的选择
确认了相对于在之前研究中使用不带有错配(即完全匹配)的sgrna的情况而言,与wtemx1基因中的靶位置的引导序列相比具有1个错配的20-mersgrna具有降低的活性。wtemx1基因存在于哺乳动物细胞的基因组dna中,通过使用标准方法(mckenziegj等,bmcmicrobiol.2006,6,39)将通过对哺乳动物细胞的基因组dna中的包含wtemx1基因的500-mer碱基序列进行扩增而获得的pcr产物插入大肠杆菌(bw25141)的基因组dna中。其结果是,将所得菌株命名为bw25141-emx1,随后使用。
相对于靶序列gagtccgagcagaagaagaaggg(seqidno.6)而言包含一个或多个错配的20-mer引导序列:
在本发明的实施例中,使用如下序列作为质粒b中的sgrna:
56:gagtccgagcagaaagagaa(seqidno.7);
1718:gaacccgagcagaagaagaa(seqidno.8);
7:gagtccgagcagaggaagaa(seqidno.9);以及
17:gagcccgagcagaagaagaa(seqidno.10)。
将对应于上述sgrna的23-mer靶序列(即56(gagtccgagcagaggaagaaggg)、1718(gaacccgagcagaagaagaaggg)、7(gagtccgagcagaggaagaaggg)、17(gagcccgagcagaagaagaaggg))插入质粒a作为靶位置。
使用电穿孔将如上所述产生的质粒a和质粒b都导入大肠杆菌菌株bw25141-emx1。在37℃的条件下在含有氨苄青霉素和卡那霉素抗生素的lb培养基中对其中导入质粒a和质粒b的细胞进行培养。在菌落培养后,使用标准方案制备电转感受态细胞。在通过细胞培养生长出菌落后,使用标准方法从菌落制备电转感受态细胞。
i)56和1718的对照反应
对于对照反应,将包含wtcas9的质粒c或者作为阴性对照的空载体导入含有质粒a和质粒b的电转感受态细胞。在含有1,000ng/ml无水四环素的soc培养基中对导入质粒c或空载体的细胞培养1小时后,将培养的一半细胞在含有氯霉素的lb培养基中进行培养,并将培养的另一半细胞在含有氯霉素、卡那霉素、10mm阿拉伯糖和1,000ng/ml无水四环素的lb培养基中进行培养。
通过实施与插入大肠杆菌基因组dna中的emx-1序列相比包含两个错配序列的质粒b(即,含有56的质粒b和含有1718的质粒b)的对照反应所获得的结果在于,示出了对在含有氯霉素和卡那霉素的lb琼脂培养基(ck)中每单位形成的菌落数与在含有氯霉素、卡那霉素、阿拉伯糖和1,000ng/ml无水四环素的lb琼脂培养基(cka-1,000ng/mlatc)中每单位形成的菌落数之间进行的比较(图2)。
当两个错配位于种子区附近时(56-wt-cas9),少于0.1%的导入有cas9的大肠杆菌存活。另一方面,当将作为阴性对照的空载体(而不是cas9)导入大肠杆菌时,约0.01%的大肠杆菌存活。将阴性对照的结果视为因质粒a未起作用的影响而产生的背景。
ii)7和17的对照反应
对于对照反应,将包含wtcas9的质粒c或者作为阴性对照的空载体导入含有质粒a和质粒b的电转感受态细胞。在含有10ng/ml无水四环素的soc培养基中对导入质粒c或空载体的细胞培养1小时后,将培养的一半细胞在含有氯霉素的lb培养基中进行培养,并将培养的另一半细胞在含有氯霉素、卡那霉素、10mm阿拉伯糖和10ng/ml无水四环素的lb培养基中进行培养。
通过实施与插入大肠杆菌基因组dna中的emx-1序列相比包含一个错配序列的质粒b(即,含有7的质粒b和含有17的质粒b)的对照反应所获得的结果在于,示出了对在含有氯霉素和卡那霉素的lb琼脂培养基(ck)中每单位形成的菌落数与在含有氯霉素、卡那霉素、阿拉伯糖和10ng/ml无水四环素的lb琼脂培养基(cka-10ng/mlatc)中每单位形成的菌落数之间进行的比较(图3)。
当一个错配位于种子区附近时(7-wt-cas9),少于0.1%的导入有cas9的大肠杆菌存活。另一方面,当将作为阴性对照的空载体(而不是cas9)导入大肠杆菌时,约0.01%的大肠杆菌存活。将阴性对照的结果视为因质粒a未起作用的影响而产生的背景。
iii)56和1718的筛选
在成功的对照实验后,通过三种不同的方式引入随机突变。
1.使用agilenttechnologies,inc.制造的genemorphii试剂盒对wtcas9序列进行的pcr扩增。
2.clontechlaboratories,inc.制造的多样化pcr随机诱变试剂盒。
3.使用具有低错误率的标准实验方法的agilent的生成变体的大肠杆菌菌株(xl1-red)。
将由上述方法获得的各pcr产物连接到双酶切的质粒c的骨架中。通过将连接产生的质粒导入高效电转感受态细胞,各自构建2,000,000大小的文库。将各随机文库导入利用之前制备的包含质粒a(包含56)和质粒b(包含56)的bw25141-emx1所制备的电转感受态细胞中。
在含有氯霉素、卡那霉素和阿拉伯糖的培养基(cka)中对其中导入各随机文库的细胞进行培养并形成菌落,通过计算所形成的菌落数并收集所形成的菌落,形成整合文库(integratedlibrary)。
在42℃的条件下在含有氯霉素的lb培养基中对获得的文库进行培养,从而选择性地去除含有具有温度敏感性起源(origin)的sgrna载体。培养后,使用小提(miniprep)对文库进行纯化,获得文库载体。
对于通过纯化获得的文库载体,以与如上所述相同的方式,利用包含质粒a(包含1718)和质粒b(包含1718)的bw25141-emx1实施相同的实验来进行另一选择。
连续实施文库载体的选择,直至cka/ck菌落数之比达到100%。iv)改组反应(shufflingreaction)
通过使用包括额外修改的标准改组方法,将经由选择获得的文库用于改组反应中。已知通常当pcr产物大于1kb时改组效率显著降低。因此,对于长度为4,300碱基对的cas9载体而言,改组反应不容易发生。
将cas9载体分为5个片段,并使用标准方法对各pcr片段进行改组。随后将改组混合物放在一起,再次实施pcr反应。利用靶向cas9的5′末端和3′末端的引物对由此获得的pcr产物进行扩增,通过借助琼脂糖凝胶识别产物的大小,由扩增的pcr产物确认了改组文库的产生。
v)7和17的筛选
通过以与使用56和1718的筛选反应类似的方式使用包含质粒a(包含7或17)和质粒b(包含7或17)的emx1-bw25141,对使用agilent和clontech试剂盒制备的随机突变文库和改组文库进行重复筛选。重复筛选反应直至达到稳定比例。其结果是,通过利用标准测序方法对获得的菌落进行了分析。
vi)验证
通过使用由同时实施两种方法(通过1-错配(7或17)筛选和2-错配(56或1718)筛选的改组+1-错配(7或17)筛选)获得的完全文库针对dmd基因和emx1基因各自实施中靶和脱靶实验。
其结果是,当从2-错配(56或1718)开始筛选,能够确认与wtcas9相比脱靶效应更明显地降低(图6和图7)。
使用经由筛选选择的3个克隆实施对哺乳动物细胞中特异性改进进行识别的实验。针对dmd基因和emx1基因各自实施中靶和脱靶实验。
通过使用由同时实施两种方法的筛选获得的完全文库确定dmd基因的中靶和脱靶活性的结果是,能够确认当从两个错配开始筛选时,与wtcas9相比脱靶活性更明显地降低(图8)。
通过使用由同时实施两种方法的筛选获得的完全文库确定emx1基因的中靶和脱靶活性的结果是,能够确认当从两个错配开始筛选时,与wtcas9相比脱靶活性更明显地降低(图9)。
根据这些结果,确认了与wt-spcas9相比两个基因的特异性均改进。
实施例3:哺乳动物细胞的筛选
可利用哺乳动物细胞实施实施例1和实施例2所描述的实验。
可类似于毒素基因ccdb使用hprt基因。与hprt具有错配的grna序列结合至胸苷激酶和半胱氨酸脱氨酶的5′末端(在起始密码子后),通过使用标准方法将包含选择标记(例如zeocin或嘌呤霉素)的全序列插入至哺乳动物细胞(例如hela细胞),并可通过使用抗生素对由此获得的细胞进行分选来制备稳定细胞系。
可通过使用转座子(在该情况下包含转座酶,并可为例如piggybac、sleepingbeauty等)或病毒(慢病毒)利用标准方法将包含cas9变体的载体插入至该细胞系的基因组dna中。可将靶向hprt的sgrna载体转染至该细胞系中,并可通过使用6-硫鸟嘌呤以及更昔洛韦或5-氟胞嘧啶对hprt和tk或cd各自进行选择。
由此选择的菌落包含具有改进的特异性的cas9变体。可在无tk或cd的情况下使用所述筛选方法,并可使用显示出可忽略的活性的sgrna来寻找具有提高的活性的cas9。
工业实用性
本发明的系统可有利地用于从任何核酸酶测试组中选择具有高特异性和高活性的靶特异性核酸酶。此外,当对基因进行修正或操纵时,通过使用本发明的系统选择的核酸酶,可降低脱靶效应和提高中靶效应。
<110>株式会社图尔金
<120>使用中靶靶标和脱靶靶标的多重靶标系统筛选靶特异性核酸酶的方法及其用途
<130>opp17-033-pct
<150>pct/us62/350,282
<151>2016-06-15
<160>10
<170>kopatentin3.0
<210>1
<211>23
<212>dna
<213>大肠杆菌(escherichiacoli)
<400>1
catcaacatcgaatacatganag23
<210>2
<211>20
<212>rna
<213>artificialsequence(人工序列)
<220>
<223>singleguidernasequence(单引导rna序列)
<400>2
catcaacatcgaatacatga20
<210>3
<211>23
<212>dna
<213>artificialsequence(人工序列)
<220>
<223>targetsitesequence(靶位点序列)
<400>3
catcaacatcgaatacatgatgg23
<210>4
<211>28
<212>dna
<213>artificialsequence(人工序列)
<220>
<223>dnasequence(dna序列)
<400>4
ctagatgagaccggatccggtctcctgg28
<210>5
<211>25
<212>dna
<213>artificialsequence(人工序列)
<220>
<223>dnasequence(dna序列)
<400>5
ctagatgagaccggatccggtctcc25
<210>6
<211>23
<212>dna
<213>artificialsequence(人工序列)
<220>
<223>targetsitesequence(靶位点序列)
<400>6
gagtccgagcagaagaagaaggg23
<210>7
<211>20
<212>rna
<213>artificialsequence(人工序列)
<220>
<223>singleguidernasequence(单引导rna序列)
<400>7
gagtccgagcagaaagagaa20
<210>8
<211>20
<212>rna
<213>artificialsequence(人工序列)
<220>
<223>singleguidernasequence(单引导rna序列)
<400>8
gaacccgagcagaagaagaa20
<210>9
<211>20
<212>rna
<213>artificialsequence(人工序列)
<220>
<223>singleguidernasequence(单引导rna序列)
<400>9
gagtccgagcagaggaagaa20
<210>10
<211>20
<212>rna
<213>artificialsequence(人工序列)
<220>
<223>singleguidernasequence(单引导rna序列)
<400>10
gagcccgagcagaagaagaa20
- 还没有人留言评论。精彩留言会获得点赞!