多功能重组核苷酸依赖性糖基转移酶蛋白及其糖基化的方法与流程
本发明一般涉及多功能重组核苷酸依赖性糖基转移酶蛋白及其糖基化的方法。特别地,本发明涉及通过使用多功能重组核苷酸依赖性糖基转移酶一步法合成二糖聚糖到受体底物上,从而产生包括新糖肽和糖基化抗微生物肽的o-和/或s-糖基化产物。
背景技术:
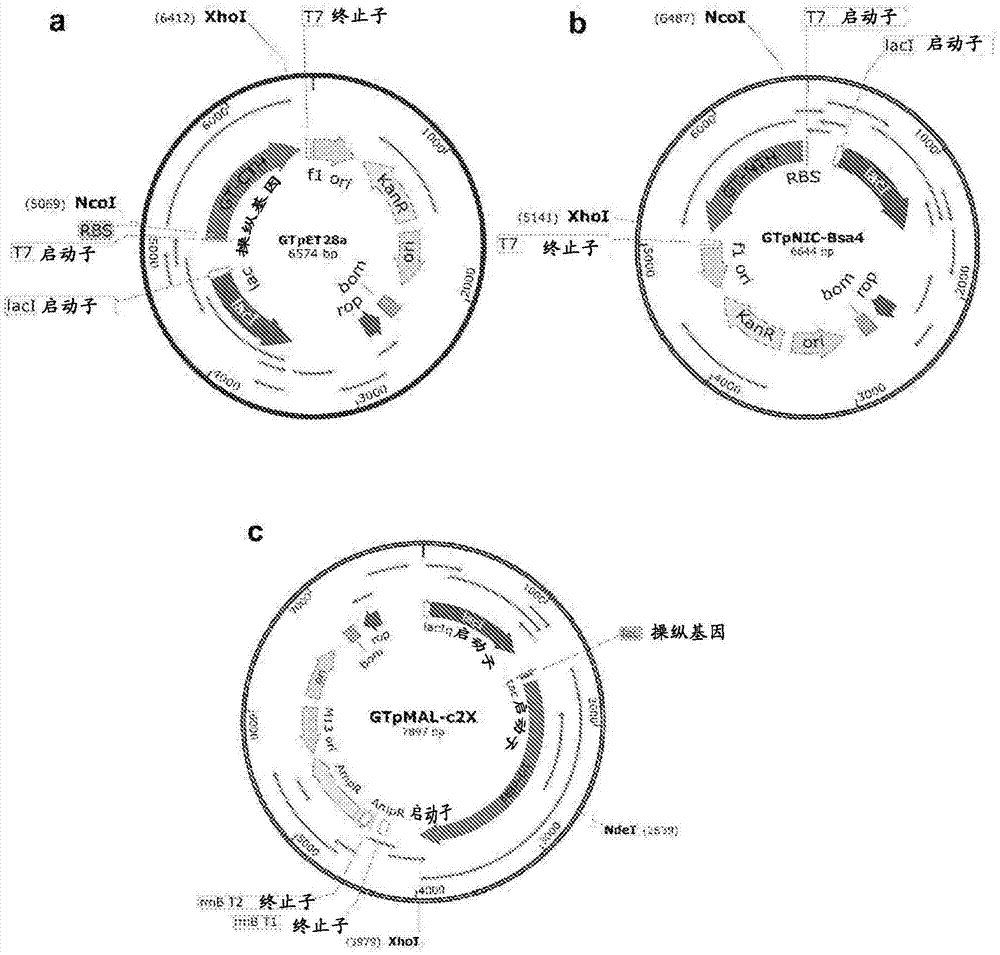
:糖基化是将聚糖连接到蛋白质、脂质或其他有机分子上的酶促过程。糖基化是重要的共翻译或翻译后修饰。许多工业和治疗性蛋白质是携带不同类型聚糖的糖蛋白。因此,这些蛋白质的糖基化对于结构、功能、宿主-病原体相互作用、仿生学等是重要的(sola,r.j.和griebenow,k.(2009).effectsofglycosylationonthestabilityofproteinpharmaceuticals.jpharmsci98,1223-1245,sola,r.j.和griebenow,k.(2010).glycosylationoftherapeuticproteins:aneffectivestrategytooptimizeefficacy.biodrugs24,9-21,shental-bechor,d.和levy,y.(2008).effectofglycosylationonproteinfolding:acloselookatthermodynamicstabilization.procnatlacadsciusa105,8256-8261,vasudevan,d.和haltiwanger,r.s.(2014).novelrolesforo-linkedglycansinproteinfolding.glycoconjugatejournal31,417-426)。在真核生物中,通常,大多数蛋白质在粗面内质网中合成,其经历糖基化,其中糖基化是酶指导的位点特异性过程。糖基化也作为o-glcnac修饰发生在细胞质和细胞核中。因此,非天然的而是在体外糖基化的蛋白质或肽被称为新糖蛋白或新糖肽,并且通常具有更好的生物活性和稳定性。因此,蛋白质或肽糖基化可以通过酶促方法或通过化学方法在体外实现。酶促糖基化由于其特异性、可负担性和工艺简单性而是优选的途径,条件是可获得合适且适用的糖基转移酶。使用糖基转移酶产生糖缀合物的优点在于由这些酶形成的糖苷键是高度立体和区域特异性的(hanson,s.,best,m.,bryan,mc和wong,ch(2004).chemoenzymaticsynthesisofoligosaccharidesandglycoproteins.trendsinbiochemicalsciences29,656-663,katayama,h.,asahina,y.和hojo,h.(2011).chemicalsynthesisofthes-linkedglycopeptide,sublancin.journalofpeptidescience:anofficialpublicationoftheeuropeanpeptidesociety17,818-821,zhang,y.,muthana,s.m.,farnsworth,d.,ludek,o.,adams,k.,barchi,j.j.,jr.,和gildersleeve,j.c.(2012).enhancedepimerizationofglycosylatedaminoacidsduringsolid-phasepeptidesynthesis.journaloftheamericanchemicalsociety134,6316-6325)。通常,糖基转移酶催化特定糖供体残基与其他特定受体分子的特异性连接,所述受体分子包括肽、蛋白质、寡糖或脂质。因此,携带由多于一种糖组成的聚糖的糖-缀合物的合成需要对被转移的每个独立的糖单元使用多于一种糖基转移酶。传统上已知的糖基转移酶是真核蛋白,其中大多数是膜结合的并且难以表达和纯化。因此,这些真核蛋白不太适合体外应用。20世纪的最后十年见证发现了能够进行n-、o-和最近表征的s-糖基化的细菌糖基转移酶。大多数这些蛋白质是较小的、胞质的和特异性上独特的。因此,提供了鉴定和建立用于各种感兴趣的蛋白质或肽中的有用糖基化的新工具的机会。例如ep专利no.2,049,144b1(e.p.专利号ep2049144b17/2014shawndefreesa61k47/48)公开了使用短的酶识别的o-连接的糖基化序列(o-连接的sequon)制备糖基化多肽的方法。标题为“o-linkedglycosylationofpeptides”的美国专利编号us7,338,933(美国专利号us7338933b23/2008shawndefrees等,514/11.4)公开了特异性靶向o-连接糖基化位点和与o-连接的糖基化位点连接的糖基残基(聚糖)的酶促糖-偶联反应。靶向的o-连接糖基化位点可以是野生型肽天然的位点,或者,它们可以通过突变而被引入肽中。该发明的多肽包括糖-缀合物,其中物质,如水溶性聚合物,生物分子的治疗剂通过完整的o-连接的糖基残基共价连接到多肽上。因此,该发明提供了其中包含适合于o-连接糖基化的突变位点的多肽及其药物组合物。此外,该发明提供了制备这种多肽及使用这些多肽和/或其药物组合物用于进行治疗的方法。然而,该发明主要集中于单糖的转移,且从而产生o-连接的糖基化。标题为“methodoftransferringatleasttwosaccharideunitswithapolyglycosyltransferase”的us6,379,933号美国专利(美国专利us6379933b14/2002karlf.johnson等435/97)公开了一种用聚糖基转移酶转移至少两个糖单元的方法、聚糖基转移酶和编码这种聚糖基转移酶的基因。特别地,本发明涉及用聚糖基转移酶转移至少两个糖单元的方法,其中所述聚糖基转移酶将glcnac和galnac两者从相应的糖核苷酸转移至糖受体。然而,该发明特异于并着重于使用聚糖基转移酶的寡糖生物合成。标题为“glycosylationofpeptidesviao-linkedglycosylationsequences”的ep2,049,144号欧洲专利(ep专利号ep2049144b82/2015shawndefreesc12p21/00)公开了一种使用短的酶识别的o-连接糖基化序列制备糖基化多肽的方法。因此,该发明通过产生包含糖基化序列的突变体多肽的突变提供引入亲本多肽(例如,野生型多肽)的靶向糖基化序列,其中该糖基化序列在相应的亲本多肽(外源糖基化序列)中不存在或在相同的位置不存在。此类突变体多肽在本文中称为“序列子多肽”。因此,该发明提供了包括一个或多个根据该发明的o-连接的糖基化序列的序列子多肽。在一个实施方案中,每个糖基化序列是酶的底物,例如糖基转移酶,如galnac-转移酶(例如,galnac-t2)。因此,该发明集中于糖基化或非糖基化序列子多肽与聚合物修饰基团如聚(乙二醇)和甲氧基-聚(乙二醇)(m-peg)之间的o-连接糖基化和偶联。标题为“o-linkedglycosylationusingn-acetylglycosaminyltransferases”的wo/2008/151258号pct申请(美国专利号wo2008151258a32/2009,shawndefrees等,c12n9/10)公开了多肽和修饰基团(例如水溶性聚合物(例如聚乙二醇))之间的共价缀合物。多肽的氨基酸序列包括一个或多个o-连接的糖基化序列,每个序列是glcnac转移酶的底物。修饰基团通过插置在多肽和修饰基团之间并与两者共价连接的糖基连接基团与多肽共价连接。在一个实施方案中,葡糖胺连接基团直接连接于o-连接的糖基化序列的氨基酸残基。因此,每个糖基化序列用作glcnac转移酶的底物,其中该方法包括一次将一个糖转移至给定的残基,从而产生单糖聚糖。标题为“synthesisofglycoproteinsusingbacterialglycosyltransferases”的wo/2004/009793号pct申请(美国专利号wo2004009793a21/2004,danieljamesbezila等,c12p21/02)公开了使用来自幽门螺杆菌(helicobacterpylori)的岩藻糖基转移酶合成寡糖、糖蛋白和糖脂的方法。该方法包括在α-1,3/4-岩藻糖基转移酶蛋白存在下将岩藻糖残基从供体底物转移到受体底物。因此,该发明主要集中于岩藻糖基化寡糖的有效生产。标题为“productionofpolysialicacidcontainingglyconjugatesusingaself-primingpolysialyltransferase”的ep1,981,977号欧洲专利(ep专利号ep1981977a44/2010warren-wakarchuk等,c12n15/63,lindhout,t.,iqbal,u.,willis,l.m.,reid,a.n.,li,j.,liu,x.,moreno,m.和wakarchuk,w.w.(2011).site-specificenzymaticpolysialylationoftherapeuticproteinsusingbacterialenzymes.procnatlacadsciusa108,7397-7402)公开了使用细菌酶的治疗性蛋白质的位点特异性酶促多唾液酸化。该专利描述了可以在与其连接前将至少三个唾液酸残基转移到具有末端半乳糖残基的糖蛋白上的酶。事实上,使用我们的方法得到的产物可以是用于这种酶的有用输入。ncbi文章,编号1002/chem.201405692,标题为“synthesisoftheanti-microbials-linkedglycopeptide,glycocinf(brimble,m.a.,edwards,p.j.,harris,p.w.,norris,g.e.,patchett,m.l.,wright,t.h.,yang,s.h.和carley,s.e.(2015).synthesisoftheantimicrobials-linkedglycopeptide,glycocinf.chemistry21,3556-3561,stepper,j.,shastri,s.,loo,t.s.,preston,j.c.,novak,p.,man,p.,moore,c.h.,havlicek,v.,patchett,m.l.和norris,g.e.(2011).cysteines-glycosylation,anewpost-translationalmodificationfoundinglycopeptidebacteriocins.febslett585,645-650,kerr,a.p.(2013).thebacteriostaticspectrumandinhibitorymechanismofglycocinf,abacteriocinfromlactobacillusplantarumkw30.microbiology(palmerstonnorth,newzealand,masseyuniversity)中公开了使用原始化学连接策略完成glycocinf的首次全合成,glycocinf是一种除o-连接的glcnac外具有罕见的s-连接的n-乙酰葡糖胺(glcnac)部分的独特二糖基化的抗微生物肽。通过rp-hplc、质谱、nmr和cd光谱比较合成的和天然存在的肽,并测量它们对胰凝乳蛋白酶消化的稳定性和抗微生物活性。这是天然存在的glycocin与活性合成类似物的首次全面的结构和功能比较。ncbi文章,编号为1021/ja2075168和1038/nchembio.509,标题为“substrateselectivityofthesublancins-glycosyltransferase”(wang,h.和vanderdonk,w.a.(2011).substrateselectivityofthesublancins-glycosyltransferase.journaloftheamericanchemicalsociety133,16394-16397)和sublancinisnotalantibioticbutans-linkedglycopeptide(oman,t.j.,boettcher,j.m.,wang,h.,okalibe,x.n.和vanderdonk,w.a.(2011).sublancinisnotalantibioticbutans-linkedglycopeptide.natchembiol7,78-80)分别公开了suns,一种涉及抗菌肽sublancin的生物合成的新的s-糖基转移酶。suns选择性地修饰37个氨基酸的肽底物suna中的半胱氨酸22,并且可以接受多种ndp糖。因此,该研究报道了关于肽底物的底物选择性和所得sublancin类似物的抗微生物活性(garciadegonzalo,c.v.,zhu,l.,oman,t.j.和vanderdonk,w.a.(2014).nmrstructureofthes-linkedglycopeptidesublancin168.acschemicalbiology9,796-801,hsieh,y.s.,wilkinson,b.l.,o'connell,m.r.,mackay,j.p.,matthews,j.m.和payne,r.j.(2012).synthesisofthebacteriocinglycopeptidesublancin168ands-glycosylatedvariants.organicletters14,1910-1913)。结果表明,suns识别将被糖基化的半胱氨酸的α-螺旋n-末端,其存在于柔性接头中。有趣的是,当半胱氨酸22突变时,sublancin抗菌活性不需要糖连接。此外,产生sublancin的菌株枯草芽孢杆菌168(bacillussubtilis168)也变得对这种突变体易感。因此,数据表明s-糖基化对于宿主中对其自身产生的细菌素的自身抗性/免疫力可能是重要的。ncbi文章,编号1021/ja411159k,标题为“theglycosyltransferaseinvolvedinthurandacinbiosynthesiscatalyzesbotho-ands-glycosylation”(wang,h.,oman,t.j.,zhang,r.,garciadegonzalo,c.v.,zhang,q.和vanderdonk,w.a.(2014).theglycosyltransferaseinvolvedinthurandacinbiosynthesiscatalyzesbotho-ands-glycosylation.journaloftheamericanchemicalsociety136,84-87)公开了第二s-糖基转移酶,thus的发现并表明thus催化肽底物中半胱氨酸的硫醇基的s-糖基化和丝氨酸的羟基的o-糖基化。thus催化的s-糖基化比o-糖基化更高效,并且酶表现出对于核苷酸糖和肽底物两者的高耐受性。thus基因簇的推定产物的生物合成在体外重建,和所得的s-糖基化肽thurandacina和thurandacinb对苏云金芽孢杆菌(bacillusthuringiensis)表现出高度选择性的抗微生物活性。wiley在线文章编号1002/anie.200503900,标题为“glycosylationofaneo-glycoproteinbyusingglycosynthaseandthioglycoligaseapproaches:thegenerationofathioglycoprotein”(mullegger,j.,chen,h.m.,warren,r.a.和withers,s.g.(2006).glycosylationofaneoglycoproteinbyusingglycosynthaseandthioglycoligaseapproaches:thegenerationofathioglycoprotein.angewandtechemie(internationaledinenglish)45,2585-2588)公开了通过使用糖苷合成酶或thioglycoligase按照定量产率实现新糖蛋白的糖基化。得到的糖蛋白作为糖基转移酶的良好受体发挥功能,并且thioglycoprotein证明对糖苷酶消化具有抗性。因此,已建立的技术将使天然糖蛋白的重建能够使其针对血清中的降解更稳定。(laureguillotin,p.l.,richarddaniellou(2014).enzymaticthioglycosylation:currentknowledgeandchallenges,vol40,laureguillotin,p.l.,richarddaniellou(2015).thioglycoligases:innovativebiocatalytictoolsfors-glycosylatedproteinssynthesis.in11thcarbohydratebioengineeringmeeting(espoo,finland)。鉴于前述内容,一直需要产生新的聚糖如二糖且由此产生o-和/或s-糖基化的新糖肽(包括抗微生物肽)的改进的方法(hassan,m.,kjos,m.,nes,i.f.,diep,d.b.和lotfipour,f.(2012).naturalantimicrobialpeptidesfrombacteria:characteristicsandpotentialapplicationstofightagainstantibioticresistance.journalofappliedmicrobiology113,723-736,cotter,p.d.,ross,r.p.和hill,c.(2013).bacteriocins-aviablealternativetoantibiotics?naturereviewsmicrobiology11,95-105,izquierdo,e.,wagner,c.,marchioni,e.,aoude-werner,d.和ennahar,s.(2009).enterocin96,anovelclassiibacteriocinproducedbyenterococcusfaecaliswhe96,isolatedfrommunstercheese.applenvironmicrobiol75,4273-4276,maky,m.a.,ishibashi,n.,zendo,t.,perez,r.h.,doud,j.r.,karmi,m.和sonomoto,k.(2015).enterocinf4-9,anovelo-linkedglycosylatedbacteriocin.applenvironmicrobiol81,4819-4826,masias,e.,sanches,p.r.,dupuy,f.g.,acuna,l.,bellomio,a.,cilli,e.,saavedra,l.和minahk,c.(2015).28-merfragmentderivedfromenterocincrl35displaysanunexpectedbactericidaleffectonlisteriacells.proteinandpeptideletters22,482-488),其通过使用形成不同糖苷键所必需的最少数量的糖基转移酶(gantt,r.w.,peltier-pain,p.和thorson,j.s.(2011).enzymaticmethodsforglyco(diversification/randomization)ofdrugsandsmallmolecules.naturalproductreports28,1811-1853)。此外,所得的二糖-缀合物提供比相应的单糖连接的缀合物更多的生物活性物质(iwao,y.,hiraike,m.,kragh-hansen,u.,kawai,k.,suenaga,a.,maruyama,t.和otagiri,m.(2009).alteredchain-lengthandglycosylationmodifythepharmacokineticsofhumanserumalbumin.biochimbiophysacta1794,634-641)。技术实现要素:因此,本发明提供了多功能重组核苷酸依赖性糖基转移酶蛋白及其糖基化方法。本发明的一个目的是通过在催化反应的多功能重组核苷酸依赖性糖基转移酶存在下使供体底物与受体底物接触来提供o和/或s-连接的二糖基化的产物。因此,本发明提供了二糖聚糖到受体底物中的丝氨酸或苏氨酸或半胱氨酸残基上的一步法合成。本发明的另一个目的是提供糖-随机化/糖-多样化(glycol-diversification),并在受体上合成至少四种不同的二糖聚糖。该糖-多样化的方法包括产生未修饰的、单-葡糖基化的或单-半乳糖基化的和二-葡糖基化的或二-半乳糖基化的糖型的混合物作为产物,然后是使用rp-hplc的这些各种糖型的分离和纯化,和然后将纯化的单-葡糖基化或单-半乳糖基化的糖型分别与重组核苷酸依赖性糖基转移酶和udp-半乳糖或udp-葡萄糖一起孵育,以获得糖-多样化的(二糖基化的)产物。本发明的另一个目的是提供一种产生这种糖-多样化(二糖基化)产物的方法,该产物表现出不同的生物活性,其中生物活性通过连接于产物的聚糖的性质和大小调节。因此,本发明通过使用单酶反应在单一位点构建二糖而不仅仅是单糖聚糖来提供富含糖的产物。本发明还提供了在原核宿主中体内进行糖基化的组分,并且可用于在受体底物中产生糖基化,其中受体位点在体外不是表面可及的。在本发明的一个实施方案中,提供了多功能重组核苷酸依赖性糖基转移酶蛋白,其具有选自于seqidno.1、seqidno.2、seqidno.3及其变体的氨基酸序列。在本发明的一个实施方案中,提供了多功能重组核苷酸依赖性糖基转移酶蛋白,其中对应于seqidno:1的蛋白质是c-末端6x-his标记的重组糖基转移酶蛋白。在本发明的一个实施方案中,提供了多功能重组核苷酸依赖性糖基转移酶蛋白,其中对应于seqidno:2的蛋白质是n-末端6x-his标记的重组糖基转移酶蛋白。在本发明的一个实施方案中,提供了多功能重组核苷酸依赖性糖基转移酶蛋白,其中对应于seqidno:3的蛋白质是n-末端mbp糖基转移酶融合蛋白。在本发明的一个实施方案中,提供了用于合成o-连接和/或s-连接的二糖基化产物的体外一步方法,其中该方法包括:a.提供比率为20:1的供体底物和受体底物的混合物,其中供体底物是选自于糖-udp、糖-gpd及其相关核苷酸糖的活化核苷酸糖,和受体底物包含具有选自于seqidno.:4、seqidno.:5、seqidno.:6、seqidno.:7、seqidno.:8、seqidno.:9、seqidno.:10、seqidno.:11、seqidno.:12、seqidno.:13、seqidno.:14、seqidno.:15、seqidno.:16和seqidno.:17的氨基酸序列的肽或多肽;b.提供多功能重组核苷酸依赖性糖基转移酶蛋白,其具有选自于seqidno.1、seqidno.2和seqidno.3的氨基酸序列;c.将步骤(b)中获得的多功能重组核苷酸依赖性糖基转移酶蛋白与步骤(a)中获得的混合物接触;d.使供体底物和受体底物在多功能重组核苷酸依赖性糖基转移酶蛋白存在下反应,其中该糖基转移酶蛋白催化多个糖部分从供体底物转移到受体底物中的丝氨酸、苏氨酸或半胱氨酸残基,以获得o-连接和/或s-连接的二糖基化产物。而在本发明的另一个实施方案中,提供了其中供体底物糖-udp糖是udp-葡萄糖或udp-半乳糖,和gdp糖是gdp-葡萄糖或gdp-半乳糖的方法。而在本发明的另一个实施方案中,提供了其中受体底物包含具有对应于seqidno:17及其变体的最小受体序列的氨基酸序列的至少一个外源或内源拷贝的肽或多肽的方法。而在本发明的另一个实施方案中,提供了其中在seqidno:17的最小受体序列的变体中置换的氨基酸残基选自于d11e、s12t、s12c、s13t、s14r和s14a的方法。而在本发明的另一个实施方案中,提供了表达盒,其由编码多功能重组核苷酸依赖性糖基转移酶蛋白的基因组成,具有选自于seqidno.:18、seqidno.:19和seqidno.:20的序列。而在本发明的另一个实施方案中,提供了其中二糖基化产物是抗微生物肽的方法。而在本发明的另一个实施方案中,提供了其中所述抗微生物肽是肠球菌素96(enterocin96)及其糖-变体(glycol-variant)的方法。而在本发明的另一个实施方案中,提供了一种产生受体底物的糖基化产物混合物的方法,其包含具有选自于seqidno.:4、seqidno.:5、seqidno.:6、seqidno.:7、seqidno.:8、seqidno.:9、seqidno.:10、seqidno.:11、seqidno.:12、seqidno.:13、seqidno.:14、seqidno.:15、seqidno.:16、seqidno.:17的氨基酸序列的肽或多肽,其中所述方法中的酶:底物比例经调节以产生未修饰的、单糖基化的和二糖基化的产物的混合物。而在本发明的另一个实施方案中,提供了使用二糖基化产物产生糖-多样化产物的混合物以获得糖-多样化产物的混合物的方法,其中所述混合物包含单糖基化和二糖基化的产物。而在本发明的另一个实施方案中,提供了其中将二糖基化产物与外切糖苷酶一起孵育的方法,其中所述外切糖苷酶催化从二糖基化产物中除去末端糖部分以获得单糖基化产物。而在本发明的另一个实施方案中,提供了其中该外切糖苷酶选自β-葡糖苷酶和β-半乳糖苷酶的方法。而在本发明的另一个实施方案中,提供了其中该方法另外包括使用rp-hplc分离和纯化未修饰的、单糖基化的和二糖基化的产物的方法。表格和附图的简要说明表1显示了包含根据本发明在不同细菌表达载体中克隆和表达多功能重组核苷酸依赖性糖基转移酶的细节的表格。表2显示了包含有关根据本发明的各种氨基酸序列和核苷酸序列的信息的表格。表3包含关于突变体的体外糖基转移酶活性状态的信息。图1说明了表1中描述的编码多功能重组核苷酸依赖性糖基转移酶的蛋白质表达载体的载体图谱,其包括图1a:gtpet28a,其编码与c-末端his标签融合的多功能重组核苷酸依赖性糖基转移酶(gt-cth),图1b:gtpnic28-bsa4,其编码与n-termhis标签融合的多功能重组核苷酸依赖性糖基转移酶(gt-nth),图1c:gtpmal-c2x,其编码根据本发明与n-term的mbp标签融合的多功能重组核苷酸依赖性糖基转移酶(mbp-gt)。图2说明纯化蛋白质(即gt-cth(图a),gt-nth(图b)和mbp-gt(图c))的sds-page图谱、纯化的gt-cth的凝胶过滤图谱(图d)和gt-cth的maldi-tof-ms图谱(图e-单体,图f-二聚体)。图3说明了以下方法的图解:a)用于产生根据本发明的受体底物的二糖基化糖型的优化的gt分析;b)用于通过调节酶:底物比率或者通过将二糖基化产物与β-葡萄糖苷酶一起孵育(3b-左图)(其中β-葡萄糖苷酶催化末端糖部分的去除)来产生受体底物的糖型混合物的受控gt分析;c)根据本发明的rp-hplc分离和纯化的单糖基化糖型的糖-多样化。具体实施方式本发明涉及多功能重组核苷酸依赖性糖基转移酶和体外糖基化受体底物的方法。特别地,本发明涉及来自细菌的核苷酸二磷酸(udp/gdp)依赖性o-和/或s-糖基转移酶蛋白,其催化至少两种单糖顺序转移至受体的丝氨酸或苏氨酸或半胱氨酸残基上,从而产生o-连接和/或s-连接的二糖基化产物。更具体地,本发明涉及重组核苷酸依赖性糖基转移酶在体外催化超过一种类型的糖苷键的能力和在二糖基化产物(包括糖基化抗微生物肽如肠球菌素96)的一步法合成中的用途。此外,本发明可用于单糖基化糖型的糖-多样化。在本发明被公开和描述之前,应理解本发明不限于本文公开的具体工艺步骤和材料,因为这些工艺步骤和材料可在一定程度上变化。还应理解,本文使用的术语仅用于描述特定实施方案的目的,而不是旨在限制性的,因为本发明的范围仅受所附权利要求及其等同物的限制。为了更清楚和简明地描述和指出要求保护的发明的主题,对于特定术语提供以下定义,其在以下书面描述中使用。当涉及细胞使用时,术语“重组”表示细胞复制异源核酸(质粒/载体),或表达由异源核酸(重组载体/重组表达载体)编码的肽或蛋白质。重组细胞还含有在细胞的天然形式中发现的基因,其中该基因被修饰并通过人工方法重新引入细胞中。“重组蛋白质”是由重组细胞产生的蛋白质。术语“糖-随机化”和“糖-多样化”在本文中可互换使用,是指通过糖的连接使生物活性肽、小分子、药物先导化合物和/或批准的药物快速多样化,从而产生其糖-多样化的糖型。术语“细菌素”和“抗微生物肽”在本文中可互换使用,是指由几种细菌分泌的,发挥对抗其他细菌物种的生物活性的天然肽。术语“糖-缀合物”是指与其他化学物质(例如蛋白质、肽、脂质和糖类)共价连接的碳水化合物的一般分类。根据上下文需要,术语“表达”指转录或翻译或两者。术语“核苷酸”是指核糖核苷酸或脱氧核糖核苷酸。“核酸”是指核苷酸的聚合物,且可以是单链或双链的。“多核苷酸”是指长度为12个或更多个核苷酸的核酸。关于糖基转移酶的术语“供体底物”,其是活化的核苷酸糖。这种活化糖通常由糖的尿苷、鸟苷和胞苷一磷酸衍生物(分别为ump,gmp和cmp)或糖的二磷酸衍生物(分别为udp、gdp和cdp)组成,其中核苷一磷酸或二磷酸用作离去基团。例如,岩藻糖基转移酶的供体底物是gdp-岩藻糖。例如,唾液酸转移酶的供体底物是包含所需唾液酸的活化糖核苷酸。例如,在neuac的情况下,活化的糖是cmp-neuac。关于糖基转移酶的术语“受体底物”,其是寡糖、单糖、多肽、肽、脂质、有机小分子和甚至dna。当受体底物与相应的糖基转移酶和糖供体底物以及其它必需的反应混合物组分接触,并将反应混合物孵育足够的时间段时,糖基转移酶将糖残基从糖供体底物转移到受体底物。对于不同类型的特定糖基转移酶,受体底物通常会变化。关于糖基转移酶的术语“产物”,其是受体(寡糖、单糖、多肽、肽、脂质、有机小分子和甚至dna)的糖基化形式。当受体底物与相应的糖基转移酶和糖供体底物以及其它必需的反应混合物组分接触,并将反应混合物孵育足够的时间段时,糖基转移酶将糖残基从糖供体底物转移到受体底物,从而产生糖基化的产物。关于受体或产物的术语“糖型”,其是寡糖、单糖、多肽、肽、脂质、有机小分子和甚至dna的差异糖基化形式。这些形式在所连接的聚糖的性质和/或大小上不同。非糖基化受体的单糖基化和二糖基化形式是产物的糖型。关于产物的术语“糖-变体”,其是受体底物(寡糖、单糖、多肽、肽、脂质、有机小分子和甚至dna)的糖基化和糖-多样化形式。原则上,本发明的反应遵循以下方案:因此,该反应涉及使核苷酸依赖性糖基转移酶与供体底物和受体底物接触,其中糖基转移酶催化多个糖部分从供体底物转移至受体底物中的丝氨酸或苏氨酸或半胱氨酸残基,从而在体外产生o-连接和/或s-连接的二糖基化产物,包括糖基化的抗微生物肽,如肠球菌素96。供体底物包含活化的核苷酸糖,例如udp-葡萄糖、udp-半乳糖、udp-glcnac、udp-葡糖醛酸、gdp-甘露糖、gdp-葡萄糖、gdp-岩藻糖及其其它相关的核苷酸糖。受体底物对应于具有氨基酸序列seqidno:(4-17)的肽或多肽,其中受体携带至少一个拷贝的对应于seqidno:17及其变体的最小序列子(ihsllnrlgg(d/e≠g)(s/t/c≠y/n)(s/t/r/a≠g/d)。本发明的一个方面提供了催化至少两个单糖分子依次转移到受体底物的丝氨酸或苏氨酸或半胱氨酸残基上的能力。因此,本发明提供了在受体底物中的丝氨酸或苏氨酸或半胱氨酸残基上二糖聚糖的一步法合成。本发明的又一方面提供了催化二糖聚糖中两种不同连接(其包括近端连接和末端连接)的能力。在近端连接中,肽/多肽的丝氨酸或苏氨酸或半胱氨酸残基定义为与近端/还原端的单糖的o-连接(丝氨酸-或苏氨酸连接的)或s-连接(半胱氨酸连接的),而连接的异头构型仍不明确。在二糖聚糖的第一单糖(在近端/还原端)和第二单糖(在末端/非还原端)之间的连接/糖苷键的异头构型被确定为β,其对β-葡糖苷酶敏感。因此,本发明能够在聚糖和受体之间产生硫醚键(s-连接),其通常比其它连接更有用和强健。此外,二糖聚糖通过较少的反应步骤提供比单糖聚糖更多的糖富集。这种糖富集可能有利地影响受体的相关生物活性。二糖聚糖还提供更长的臂/接头,其对二次修饰更有用。例如,在立体约束的环境中(特别是对于任何体积更大的修饰),聚糖的聚乙二醇化。除了具有多功能重组核苷酸依赖性糖基转移酶活性的多肽序列外,本发明还提供了编码具有新型糖基转移酶活性的蛋白质的重组dna分子(重组细菌表达载体)、包含此类重组dna分子的杂合载体、适用于重组dna分子增殖和/或表达的重组转化宿主。本发明还包括用于制备蛋白质、dna分子和宿主的方法。根据本发明的一个方面,携带重组表达的核苷酸依赖性糖基转移酶的多肽序列的重组细菌表达载体包含seqidno:1、seqidno:2和seqidno:3。适用于表达多功能重组核苷酸依赖性糖基转移酶的重组细菌表达载体分别包括gtpet28a、gtpnic28-bsa4和gtpmal-c2x(总结于表1和图1)。这里使用的表达宿主是大肠杆菌(escherichiacoli)。因此,多功能重组核苷酸依赖性糖基转移酶的表达在大肠杆菌菌株中优化,所述大肠杆菌菌株分别包括大肠杆菌lemo21(de3)、大肠杆菌bl21(de3)和大肠杆菌rosettatm(de3)。因此,本发明提供了由任何上述重组表达载体转化的分离的宿主细胞,其中所述细胞表达由核酸编码的目的蛋白质、多肽或肽。在一个实施方案中,宿主细胞是原核宿主细胞,例如大肠杆菌或其菌株。在另一个方面,本发明描述了对应于seqidno:4、5、6、7、8、9、10、11、12、13、14、15、16、17的受体底物肽的用途,其用作在对应于seqidno:1、2和3的多功能重组核苷酸依赖性糖基转移酶(表2)存在下单糖或二糖聚糖的受体底物。此外,本发明提供了一种对应于seqidno:17及其变体的最小受体序列子(ihsllnrlgg(d/e≠g)(s/t/c≠y/n)(s/t/r/a≠g/d),其中最小受体序列子是蛋白质中用作聚糖的连接位点(单糖或以各种形式连接的多个单糖)的连续氨基酸的序列。对于糖基化,受体底物含有至少一个外源最小受体序列子,但也可包括一个或多个内源的(例如,天然存在的)最小受体序列子(表2)。本发明还可用于产生如图3所示的糖-多样化(二糖基化)产物。实施例为了更全面地理解本发明,提出了以下制备和测试实施例。这些实施例仅用于说明的目的,不应解释为以任何方式限制本发明的范围。以下实施例描述了多功能重组核苷酸依赖性糖基转移酶的克隆、表达和纯化,用于体外糖基化的优化和受控方法,产物糖型的分离和纯化方法,糖多样化的方法,肠球菌素96肽(已知的抗微生物肽)的糖型差异生物活性的评估。实施例11.1重组核苷酸依赖性糖基转移酶表达载体的构建从ncbi检索下文称为gt基因的核苷酸依赖性糖基转移酶基因(位点nz_gg668924/ents)的dna序列,和该基因定制合成并从genscript获得。该基因使用puc57载体在nco1和xho1限制性位点之间定制合成。将该基因亚克隆到pet28a载体中,以获得c末端6x-his标记的重组蛋白。此外,扩增含有gt基因的puc57质粒和pet28a质粒,并用nco1和xho1双重消化以分别制备插入dna片段和克隆载体。然后使用nucleospinextractii(macherey-nagel,germany)进一步凝胶提取两种消化物。然后使用t4dna连接酶连接纯化的产物。然后使用热休克将连接混合物转化到大肠杆菌top10(invitrogen)细胞中,并将细胞接种在lb-卡那霉素琼脂平板上和在37℃下生长12小时。在37℃孵育12小时后,使用菌落pcr筛选几个菌落,并将阳性菌落接种到lb肉汤中,并使用miniprep试剂盒(qiagen)进行质粒分离。然后通过使用nco1和xho1双重消化分离的称为gtpet28a的重组质粒/载体来确认成功的转化体/克隆,并通过dna测序确认转化体中携带的所得重组质粒/载体的序列。此外,将gt基因亚克隆到pnic28-bsa4载体中nco1和xho1位点之间,以获得n-末端6x-his标记的重组核苷酸依赖性糖基转移酶(gt-nth)。此外,将gt基因亚克隆到pmal-c2x载体中nde1和xho1限制性位点之间,以获得n-末端mbp标记的重组核苷酸依赖性糖基转移酶(mbp-gt)。因此,使用gtpet28a重组质粒作为模板进行上述克隆。图1显示了根据本发明的编码重组核苷酸依赖性糖基转移酶的细菌蛋白质表达载体的载体图谱。1.2his标记的重组核苷酸依赖性糖基转移酶(gt-cth和gt-nth)的过表达和纯化使用热休克用gtpet28a构建体转化大肠杆菌lemo21(de3)(neb)细胞。将单个菌落接种到含有50μg/ml卡那霉素和35μg/ml氯霉素的30mllb肉汤中。将原代培养物在37℃下过夜培养,并用于接种含有50μg/ml卡那霉素、35μg/ml氯霉素和25μml-鼠李糖的3llb肉汤。然后将培养物在37℃下培养至od600≈0.6。此外,使用0.4mmiptg诱导培养物,并在25℃下孵育12小时。然后在4℃下以8000xrpm收获细胞20分钟。将构建体gtpnic-bsa4转化到大肠杆菌bl21(de3)(neb)中用于过表达,其中将单个菌落接种到含有50μg/ml卡那霉素的30mllb肉汤中。将原代培养物在37℃下过夜培养,并用于接种3llb肉汤。然后将培养物在37℃下培养至od600≈0.6。此外,使用0.5mmiptg诱导培养物,并在18℃下孵育16小时。然后在4℃下以8000xrpm收获细胞20分钟。表达后,将细胞沉淀(gt-cth/gt-nth)重悬于150ml起始缓冲液(20mmhepes,ph7.5,500mmnacl,2mmdtt和10%甘油)中,并使用超声处理进行细胞裂解,该超声处理具有10秒开和10秒关脉冲和25%幅度。然后通过在4℃以12000xrpm离心30分钟除去细胞碎片。将上清液进一步进行金属亲和色谱。保留上清液用于与预先洗涤并用起始缓冲液平衡的ni-琼脂糖珠结合。结合时间为15分钟。收集流出物并用洗涤缓冲液(20mmhepes,ph7.5,1mnacl,2mmdtt,30mm咪唑,10%甘油)洗涤结合的珠。将洗涤缓冲液中的盐浓度逐渐降低至200mm,并用半柱体积的洗脱缓冲液(20mmhepes,ph7.5,200mm咪唑,200mmnacl,2mmdtt)进行洗脱。合并含有所需蛋白质的级分,并使用amicon超膜过滤器(30kdamwco,millipore)浓缩。然后将所需蛋白质进一步进行凝胶过滤色谱。将浓缩的蛋白质样品注射到fplc系统(akta,gehealthcarelifesciences)上,该系统配备有预先用20mmhepes,ph7.5,200mmnacl和2mmdtt平衡的superdex-20010/300gl(gehealthcarelifesciences)。洗脱以0.5ml/min的流速进行,并在280nm处监测。然后收集所需的级分,合并并使用amicon超膜过滤器(30kdamwco,millipore)浓缩。使用bradford试剂估算浓度,并将蛋白质储存在-80℃,其中产生的产量为来自3l培养物的约12-15mg蛋白质。1.3mbp标记的重组核苷酸依赖性糖基转移酶(mbp-gt)的过表达和纯化将构建体gtpmal-c2x转化到大肠杆菌rosettatm(de3)细胞中并为了纯化,将单个菌落接种到含有100μg/ml氨苄青霉素和35μg/ml氯霉素的30mllb肉汤中。将原代培养物在37℃下过夜生长,并用于接种含有100μg/ml氨苄青霉素、35μg/ml氯霉素和0.2%d-葡萄糖的3llb肉汤。然后将培养物在37℃下生长至od600≈0.6。此外,使用0.5mmiptg诱导培养物,并在18℃下孵育16小时。在4℃下以8000xrpm收获细胞20分钟。保留细胞裂解物用于与预先洗涤和用裂解缓冲液(20mmhepes,ph7.5,500mmnacl,10mmβ-me和10%甘油)平衡的直链淀粉树脂结合。结合时间为1小时。收集流出物并用洗涤缓冲液(20mmhepes,ph7.5,200mmnacl,1mmdtt)洗涤结合的珠。此外,使用含有逐渐增加浓度的麦芽糖(1mm、2mm、5mm、10mm)的洗脱缓冲液(20mmhepes,ph7.5,200mmnacl,1mmdtt)进行洗脱。合并含有所需蛋白质的级分,并使用amicon超膜过滤器(30kdamwco,millipore)浓缩。然后使用上述方案将所需蛋白质进一步进行凝胶过滤色谱。图2说明了如上所述的重组核苷酸依赖性糖基转移酶的各种融合体的纯化谱。图a、图b和图c显示了gt-cth、gt-nth和mbp-gt的sds-page图谱(在不同浓度的麦芽糖存在下,即1mm、2mm和5mm),相应的蛋白质条带分别在54.1kda、55.6kda和93.8kda处可见;图d显示了gt-cth蛋白的凝胶过滤图谱,其中ve=12.76(ve/vo=1.77),预期mw=54156da,观察的mw=108600da,表明纯化的重组核苷酸依赖性糖基转移酶洗脱物为二聚体;图e和图f分别显示了含单体(观察质量54095.24da,预期质量54156.80da)和二聚体(观察质量108178.34da,预期质量108313.60da)的纯化gt-cth的maldi-tof-ms图谱的结果。表1实施例22.1使用纯化的gt-cth酶对受体底物进行体外糖基化的方法(提供优化的糖基转移酶分析/优化的gt分析条件)将纯化的重组核苷酸依赖性糖基转移酶(0.2μm)与合成受体底物(5μm)和100μmudp-葡萄糖在含有20mmhepes,ph7.5,50mmnacl,1mmtcep和1mmmgcl2的反应缓冲液中孵育。将反应在25℃下孵育12小时。每个分析反应都伴有对照反应(不含酶)。将反应用5%tfa淬灭至ph2,使用ziptipc18脱盐,并真空干燥并使用质谱法分析。2.2使用质谱法检测糖基化产物的方法(提供优化方法)使用基质辅助激光解吸电离飞行时间质谱(maldi-tofms)和液相色谱电喷雾电离质谱(lc/esi-ms)技术,质谱法被用于检测糖基化分析反应产物中的糖基化。maldi-tofms在absciex5800malditof/tof上进行,和lc/esi-ms在6550ifunnelqtoflc/ms(agilenttechnologies)上进行,其使用agilenttechnologies的zorbaxeclipseplusc8柱(3.0x150mm,5μ)。对于maldi-tof分析和lc-esi/ms分析,真空干燥的样品分别在水和0.1%甲酸中重构。2.3maldi-tof谱的采集和分析在样品数据采集之前,使用肽的混合物,血管紧张素、缓激肽、glu-1-纤维蛋白肽、acth片段1-17、acth片段18-39和acth片段7-38(partno:4333604,absciex)对分析仪进行外部校准。对于无盐样品的maldi-tofms分析,将1μl等分试样的分析物与1μl基质(在含有0.1%tfa的50%acn/50%水中的α-氰基-4-羟基-肉桂酸基质)组合,并且将总体积点样在384孔maldi靶平板上,并在分析前在环境条件下干燥。在反射器和正离子模式中采用3000-3400v的激光强度范围进行ms数据采集,保持质量范围400-700da,总射击数2000,箱体尺寸0.5ns,和脉冲频率400hz。在10-4000da的质量范围内收集进一步的msms数据,保持4000-4200v范围的激光强度和0.03的加合物耐受(adducttolerance)。分别具有低于20和200的s/n和分辨率的前体对于msms被排除。采集后,原始数据以t2d文件的格式提取,输入appliedbiosystems的dataexplorer软件,4.9版中,并转换为文本文件格式。具有峰列表的文本文件输入并在origin(originpro2015b.9.2.214)中作图。2.4lc-esi-q/tof谱的采集和分析将5μl体积的样品注射到配备有在40%的b中平衡的c8柱的agilentuplc系统上(溶剂a=0.1%的甲酸水溶液,溶剂b=0.1%的甲酸乙腈溶液)。然后样品通过在12分钟内使用溶剂b的梯度(40%-100%)以0.4ml/min的流速分级分离,并直接进行esi-q/tofms。数据在dualajsesi正离子模式中获得,毛细管电压设置为4.5kv。氮气用作鞘气(11l/min)。将电离源和鞘气分别加热至200℃和300℃。喷嘴和裂解电压分别保持在1000v和280v。使用agilenttechnologies的masshunter工作站软件b.05.00版进行数据采集。采集后,将采集的原始数据(.d文件)输入masshunter定性分析软件b.05.00版中进行进一步处理。在获得的lc色谱图(tic)中,在2.5-3.5分钟保留时间之间观察到肽的多个预期带电离子。对应于预期的多个带电离子的tic进行积分和解卷积以获得ms图谱并在origin(originpro2015b.9.2.214)中作图。根据本发明,在udp-葡萄糖和mgcl2存在下,将具有seqidno:4的受体底物与重组核苷酸依赖性糖基转移酶一起孵育。然后使用lc-esi-q/tof分析反应,其显示观察到的二糖基化产物的平均质量为5503.47da(预期平均质量5503.00da),并且观察到未糖基化产物的平均质量为5179.70da(预期平均质量5179.00da)。根据本发明,在udp-葡萄糖和mgcl2存在下,将具有seqidno:9的受体底物与重组核苷酸依赖性糖基转移酶一起孵育。然后使用maldi-tof分析反应,其显示观察的二糖基化产物的(m+h)+为2424.65da(预期(m+h)+2424.07da),和观察的单糖基化产物的(m+h)+为2262.57da(预期(m+h)+2262.07da),和观察的未糖基化产物的(m+h)+为2100.49da(预期(m+h)+2100.07da)。根据本发明,在udp-葡萄糖和mgcl2存在下,将具有seqidno:5的受体底物与重组核苷酸依赖性糖基转移酶一起孵育。然后使用lc-esi-q/tof分析反应,其显示观察的二糖基化产物的单一同位素质量为5515.53da(预期单一同位素质量5515.41da)且观察的未糖基化产物的单一同位素质量为5190.91da(预期单一同位素质量5191.41da)。2.5使用质谱鉴定糖基化产物中的糖基化残基2.5a受体和产物的胰凝乳蛋白酶消化:为了糖基化位点(glycosite)注释,在100mmtris-cl,ph7.5,10mmcacl2,5mmtcep存在下,使用胰凝乳蛋白酶(sigma)消化糖基化的和它们相应的未糖基化的受体。将反应物在30℃下孵育5小时,并用5%tfa淬灭至ph2。然后使用ziptipc18将反应物脱盐并真空干燥。对于maldi-tof-ms和串联ms分析,将样品在水中重构。此外,对所有感兴趣的峰进行ms/ms。2.5b胰凝乳蛋白酶消化产物的maldi-tof-ms和串联ms谱分析:使用上述采集和分析maldi-tof谱的方法获得胰凝乳蛋白酶消化产物的maldi-tof-ms和串联ms谱。对所有感兴趣的峰进行串联ms,并通过人工从头肽测序鉴定糖基化的残基。根据本发明,具有seqidno:4、seqidno:9和seqidno:5的受体底物使用重组核苷酸依赖性糖基转移酶体外糖基化,胰凝乳蛋白酶消化并在maldi-tof上进行分析。对应于seqidno:4的受体底物的所得2774.39da峰的msms谱鉴定33位的丝氨酸为糖基化位点。对应于seqidno:9的所得2424.65da峰的msms谱鉴定33位的苏氨酸为糖基化位点。对应于seqidno:5的所得2790.39da峰的msms谱鉴定33位的半胱氨酸是糖基化位点。实施例33.1受控gt分析以生成产物糖型混合物的方法gt分析条件被优化以获得未糖基化、单糖基化和二糖基化产物的混合物。在含有20mmhepes,ph7.5,50mmnacl,1mmtcep和0.5mmmgcl2的反应缓冲液的存在下,将100μm受体肽(seqidno:4)与0.25μm重组核苷酸依赖性糖基转移酶(保持[e]:[s]=1:400)和100μm的udp-葡萄糖/udp-半乳糖在25℃下一起孵育1小时。图3b显示通过在受控gt分析条件下孵育受体底物、供体底物和重组核苷酸依赖性糖基转移酶产生未糖基化、单糖基化和二糖基化产物的混合物的示意图。3.2使用外切糖苷酶产生二糖基化产物的糖型混合物的方法。使用合适的外切糖苷酶(β-葡糖苷酶)使二-葡糖基化产物(seqidno:4)去糖基化。首先在上述优化的gt分析条件下使受体底物二葡糖基化,并将该二葡糖基化产物(5μm)与2μg/μl的β-葡萄糖苷酶(目录号:195197,mpbiomedicals)在含有100mm乙酸钠缓冲液,ph5.0和1x纯化的bsa的反应缓冲液中孵育18小时。通过在不存在β-葡糖苷酶的情况下孵育所有反应组分来进行对照反应。β-葡萄糖苷酶处理产物的lc-esi-q-tofms分析显示二-葡糖基化和单-葡糖基化形式的混合物。图3b(左图)显示了根据本发明的二-葡糖基化产物(seqidno:4)的去糖基化的示意图。将二-葡糖基化产物与β-葡糖苷酶一起孵育,然后使用lc-esi-q/tof分析反应,其显示主要部分的二葡糖基化产物群(观察的平均质量5500.12da)被转化为单-葡糖基化的产物(观察的平均质量5337.42da)。3.3产物糖型的分离和纯化方法:在分析型hplc系统(shimadzu)上使用phenomenex的反相柱(jupitor5μmc18柱,250×4.6mm,)分析反应,并且优化rp-hplc方法以分离未糖基化、单-糖基化和二糖基化产物的混合物。将20μl反应混合物注入预先用5%溶剂b平衡的柱上(溶剂a:0.1%的tfa水溶液,溶剂b:0.1%的tfaacn溶液)。通过以1ml/min的流速使用溶剂b的梯度(5-100%)26分钟来分级分离样品,并在220nm的波长下观察。通过maldi-tof-ms进一步检查分离的糖型的质量,其证实二糖基化产物首先洗脱,然后是单糖基化产物和之后的未糖基化产物。将含有单一物质的纯化hplc级分冻干并储存在-80℃下。如进一步所述的,对于通过二糖基化产物的外切糖苷酶处理获得的物质也可以实现类似的分离。3.4产物的纯化的单糖基化形式的糖-多样化方法在受控gt分析条件下,使用udp-半乳糖和重组核苷酸依赖性糖基转移酶对rp-hplc纯化的单-葡糖基化产物进行糖-多样化。类似地,在受控gt分析条件下,使用udp-葡萄糖和重组核苷酸依赖性糖基转移酶使单半乳糖基化产物糖-多样化。所有糖-多样化产物的质量均通过maldi-tof-ms确认。图3c显示了根据本发明用于受体底物糖多样化的方法。实施例4评估肠球菌素(enetrocin)96肽(一种已知的抗微生物肽)的糖型的差异生物活性在受控gt分析条件下制备对应于肠球菌素96(已知的细菌素)肽序列的二糖基化、单糖基化和未糖基化的糖型,并使用基于rp-hplc的方法纯化。将包括糖多样化形式的冻干产物糖型重悬于50mmtris-cl,ph7.5中。单核细胞增多性李司特氏菌(listeriamonocytogenes)egd-e的培养物在bhi培养基中于37℃下生长7-8小时。通过将25μl饱和培养物(a600≈1.5)和100ml熔融bhi琼脂(冷却至40-45℃)混合并将混合物倒入无菌培养皿中来制备琼脂平板。使接种的琼脂平板固化30-45分钟,并使用无菌软木钻孔器制备琼脂孔。将50μm包括糖基多样化形式的所有糖型倒入孔中,并将板在37℃下孵育12小时。由存在和不存在生长抑制区来确定抗微生物活性。根据本发明的对应于seqidno:4的糖型的生物活性针对单核细胞增多性李司特氏菌egd-e进行检查,其中二-葡糖基化产物显示出比单葡糖基化产物更高的抗微生物活性。单-半乳糖基化产物和其中葡萄糖在近端并且半乳糖在末端位置上的糖多样化形式没有显示生物活性,而其中半乳糖在近端和葡萄糖在末端位置上的糖多样化形式显示生物活性。实施例5最小受体序列子的鉴定为了鉴定最小受体序列,使用上述方法分析表2中提到的各种受体底物(seqidno:4-seqidno:17)。发现对应于seqidno:17及其变体的ihsllnrlgg(d/e≠g)(s/t/c≠y/n)(s/t/r/a≠g/d)作为最小受体序列子是最佳的。表2实施例6最佳供体底物的鉴定在ndp糖如udp-葡萄糖、udp-半乳糖、udp-glcnac、udp-galnac和gdp-甘露糖、gdp-葡萄糖、gdp-岩藻糖和udp-葡糖醛酸存在下(以50μm、100μm、250μm和500μm范围的不同浓度)将0.2μm纯化的重组核苷酸依赖性糖基转移酶与5μm受体底物(seqidno:4)在含有20mmhepes,ph7.5,50mmnacl和1mmtcep的反应缓冲液中一起孵育。然后将反应物在25℃下孵育12小时。用5%tfa将反应淬灭至ph2。将样品脱盐并进行ms分析。实施例7鉴定蛋白质序列中对于重组核苷酸依赖性糖基转移酶活性关键的残基使用gtpet28a质粒作为模板,使用定点诱变(quickchangelightningmutagenesis试剂盒,agilent)在重组核苷酸依赖性糖基转移酶(gt-cth)中引入各种突变。通过dna测序验证突变体的序列。将突变的重组质粒转化到大肠杆菌lemo21(de3)和大肠杆菌bl21(de3)细胞中进行表达。使用上述方法进行重组核苷酸依赖性糖基转移酶蛋白突变体的过表达、纯化和功能分析。根据本发明产生的重组核苷酸依赖性糖基转移酶突变体的列表确认了对重组核苷酸依赖性糖基转移酶(gt-cth)活性关键的d102、r136、w147、d152、a153、d154残基。将这些残基替换为丙氨酸导致糖基转移酶活性的消除。表3s.no突变体名称表达状态体外糖基转移酶活性状态1.gt-cthc87a可溶的活性的2.gt-cthe97a可溶的活性的3.gt-cthd102a可溶的非活性的4.gt-cthd130a可溶的活性的5.gt-cthd131a可溶的活性的6.gt-cthf132a可溶的活性的7.gt-cthd130a,可溶的非活性的8.gt-cthd131a,可溶的非活性的9.gt-cthr136a可溶的非活性的10.gt-cthw147a可溶的非活性的11.gt-cthd152a可溶的非活性的12.gt-ctha153r可溶的非活性的13.gt-cthd154a可溶的非活性的14.gt-cthy241a可溶的活性的因此,本发明通过使用单酶反应,在三个化学变体位点(即丝氨酸或苏氨酸或半胱氨酸)之一处构建二糖而不仅仅是单糖聚糖来提供更多的糖富集的产物。此外,本发明还能够进行糖多样化,从而通过使用核苷酸依赖性重组糖基转移酶将至少四种不同的二糖聚糖和两种不同的单糖聚糖合成到受体上。此外,本发明还可用于糖基化和产生细菌素样肽或具有对应于seqidno:17及其变体的最小序列子的至少一个外源或内源拷贝的多肽的多样化糖型。因此,本发明提供了在合适的原核宿主中体内进行糖基化的组分,其可用于在受体底物中产生糖基化,其中受体位点在体外不是表面可及的。此外,本发明还提供了使用适当的试剂在无细胞体外环境中进行糖基化,从而产生有用/重要的新糖肽和/或新细菌素的方法/组分。本发明的优势本发明提供了在受体底物中的丝氨酸或苏氨酸或半胱氨酸残基上一步法合成二糖聚糖。本发明用于在聚糖和受体之间产生硫醚键(s-连接),它们比醚键更有用,更稳定。本发明通过使用单酶反应在单一位点构建二糖而不仅仅是单糖聚糖来提供更多的富含糖的产物,其中二糖聚糖或二聚糖在糖基化肽如肠球菌素96中赋予比单糖聚糖或单聚糖更好的生物活性。然而,聚糖的作用不仅限于影响生物活性。本发明能够进行糖多样化,并且可以在受体底物中的三个不同的接受残基(即丝氨酸或苏氨酸或半胱氨酸)上合成至少四种不同的二糖聚糖和两种单糖,其中连接的聚糖的性质和大小影响糖基化产物的生物活性,但不限于仅影响生物活性。本发明可用于糖基化并产生细菌素样肽的多样化糖型,其携带对应于seqidno:17及其变体的最小序列子的至少一个外源或内源拷贝。本发明提供了用于定向进化和改善所描述的本发明特异性的有用组分。本发明还提供了开发在原核宿主中体内进行糖基化的系统的组分,并且其可用于在受体底物中产生糖基化,其中受体位点在体外不是表面可及的。本发明还提供了使用适当的试剂在无细胞体外环境中进行糖基化的方法/组分,从而产生有用/重要的新糖肽和新细菌素。其他参考文献(main,pj(2014).investigatingthebacteriocinlibrarylactobacillusplantaruma-1.inmicrobiology(palmerstonnorth,newzealand,masseyuniversity,manuwatūcampus,nantkaythwemoe,s.m.t.,kousukesuzuki,ryosukenakai,takeshiterahara,chiakiimada,takeshikobayashi(2015).productionofanantibacterialsubstancebybacillusmojavensisstrainf412isolatedfromamyanmarshrimpproductfermentedwithboiledrice.fisheriesscience81,795-802,tiwari,s.k.,sutyaknoll,k.,cavera,v.l.和chikindas,m.l.(2015).improvedantimicrobialactivitiesofsynthetic-hybridbacteriocinsdesignedfromenterocine50-52andpediocinpa-1.applenvironmicrobiol81,1661-1667,wang,q.,zeng,x.,wang,s.,hou,c.,yang,f.,ma,x.,thacker,p.和qiao,s.(2014).thebacteriocinsublancinattenuatesintestinalinjuryinyoungmiceinfectedwithstaphylococcusaureus.anatomicalrecord(hoboken,nj:2007)297,1454-1461。epo专利号cn102389030b12/2013liyea01n43/90,美国专利号5641668a6/1997ericg.berger等435/193,美国专利no.wo2000017226a13/2000carolynbertozzi等c12n5/02,美国专利号wo2008151258a212/2008shawndefrees等g01n33/53,美国专利号us8895014b211/2014fabianafernandez等424/183.1,e.p.专利号wo2011073438a37/2012roxannegavillon等a61k8/64,专利号wo2002000851a21/2002kojihiratsuka等c12n9/10,美国专利号wo2013088194a16/2013sylvianemuller等a61k38/04,美国专利号us20140033369a11/2014yoshikazutanak等800/298,美国专利号us8257949b29/2012warrenwakarchuk等435/84,美国专利号us6743606b16/2004frankp.wolter等435/97。权利要求书(按照条约第19条的修改)1.一种多功能重组核苷酸依赖性二糖基转移酶蛋白,其具有选自于seqidno.1、seqidno.2、seqidno.3及其变体的氨基酸序列。2.如权利要求1所述的多功能重组核苷酸依赖性二糖基转移酶蛋白,其中对应于seqidno:1的所述蛋白质是c-末端6x-his标记的重组二糖基转移酶蛋白。3.如权利要求1所述的多功能重组核苷酸依赖性二糖基转移酶蛋白,其中对应于seqidno:2的所述蛋白质是n-末端6x-his标记的重组二糖基转移酶蛋白。4.如权利要求1所述的多功能重组核苷酸依赖性二糖基转移酶蛋白,其中对应于seqidno:3的所述蛋白质是n-末端mbp二糖基转移酶融合蛋白。5.一种用于合成o-连接和/或s-连接的二糖基化产物的体外一步方法,其中该方法包括:a.提供比率为20:1的供体底物和受体底物的混合物,其中所述供体底物是选自于糖-udp、糖-gpd及其相关核苷酸糖的活化核苷酸糖,和所述受体底物包含具有选自于seqidno.:4、seqidno.:5、seqidno.:6、seqidno.:7、seqidno.:8、seqidno.:9、seqidno.:10、seqidno.:11、seqidno.:12、seqidno.:13、seqidno.:14、seqidno.:15、seqidno.:16和seqidno.:17的氨基酸序列的肽或多肽;b.提供多功能重组核苷酸依赖性二糖基转移酶蛋白,其具有选自于seqidno.1、seqidno.2和seqidno.3的氨基酸序列;c.将步骤(b)中获得的多功能重组核苷酸依赖性二糖基转移酶蛋白与步骤(a)中获得的所述混合物接触;d.使所述供体底物和所述受体底物在所述多功能重组核苷酸依赖性二糖基转移酶蛋白存在下反应,其中该糖基转移酶蛋白催化多个糖部分从所述供体底物转移到所述受体底物中的丝氨酸、苏氨酸或半胱氨酸残基上,以获得所述o-连接和/或s-连接的二糖基化产物。6.如权利要求5所述的方法,其中步骤(a)中的所述供体底物糖-udp糖是udp-葡萄糖或udp-半乳糖,和所述gdp糖是gdp-葡萄糖或gdp-半乳糖。7.如权利要求5所述的方法,其中步骤(a)中的所述受体底物包含具有对应于seqidno:17的最小受体序列及其变体的氨基酸序列的至少一个外源或内源拷贝的肽或多肽。8.如权利要求5所述的方法,其中在seqidno:17的最小受体序列的所述变体中置换的氨基酸残基选自于d11e、s12t、s12c、s13t、s14r和s14a。9.一种表达盒,其由编码多功能重组核苷酸依赖性二糖基转移酶蛋白的基因组成,具有选自于seqidno.:18、seqidno.:19和seqidno.:20的序列。10.如权利要求5所述的方法,其中所述二糖基化产物是抗微生物肽。11.如权利要求10所述的方法,其中所述抗微生物肽是肠球菌素96及其糖-变体。12.如权利要求5所述的方法,其中所述方法可用于产生受体底物的糖基化产物混合物,所述受体底物包含具有选自于seqidno.:4、seqidno.:5、seqidno.:6、seqidno.:7、seqidno.:8、seqidno.:9、seqidno.:10、seqidno.:11、seqidno.:12、seqidno.:13、seqidno.:14、seqidno.:15、seqidno.:16、seqidno.:17的氨基酸序列的肽或多肽,且其中权利要求5中所述的方法中的酶:底物比率在1:20-1:400的范围内调节以产生未修饰的、单糖基化的和二糖基化的产物的混合物。13.如权利要求12所述的方法,用于使用所述二糖基化产物产生糖多样化产物的混合物以获得糖多样化产物的混合物,其中所述混合物包含单糖基化的和二糖基化的产物。14.如权利要求5所述的方法,其中所述二糖基化产物与外切糖苷酶一起孵育,所述外切糖苷酶催化从所述二糖基化产物除去末端糖部分以获得单糖基化的产物。15.如权利要求14所述的方法,其中所述外切糖苷酶选自β-葡糖苷酶和β-半乳糖苷酶。16.如权利要求5、12和14所述的方法,其中所述方法另外包括使用rp-hplc分离和纯化所述未修饰的、单糖基化的和二糖基化的产物。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1