用于产生羟基酪醇的宿主细胞和方法与流程
本申请要求于2016年6月24日提交的美国临时专利申请第62/354,657号的优先权,其通过引用整体并入本文。
政府支持的声明
本文描述和请求保护的发明是利用美国能源部(u.s.departmentofenergy)根据合同号de-ac02-05ch11231提供的资金进行的。政府对本发明享有一定的权利。
发明领域
本发明属于羟基酪醇生产领域。
发明背景
芳环的羟基化是用于制备许多有价值的化合物的重要反应,包括用于治疗帕金森氏病的l-3,4-二羟基苯基丙氨酸(l-dopa)、苄基异喹啉生物碱和褪黑素。与在有机溶剂中经常使用金属氧化剂的化学反应相比,微生物体对芳环的羟基化是一种令人关注且有前景的方法,其以高区域选择性在单步且温和的条件下合成所需产物。微生物芳环羟基化参与芳香族化合物的有氧代谢,并且在降解过程中主要通过加氧酶和酪氨酸酶完成,以减轻毒性或将其代谢成用作碳源的有机酸。
酪氨酸酶是属于3型铜蛋白的氧化还原酶,其包括血蓝蛋白作为氧载体(olivares,2009;robb,1984)。该酶涉及使用分子氧作为氧化剂的l-酪氨酸的多重氧化反应;第一氧化步骤是l-酪氨酸到l-dopa的邻-羟基化,并且已知是最慢的步骤,以及第二氧化步骤是由邻二酚快速生成邻醌,随后是非酶促反应为多巴色素(一种黑色素途径的有色中间体)。酪氨酸向l-dopa的微生物转化是缓慢的过程,并且使用酪氨酸酶时难以避免过度氧化成正醌。还原剂诸如抗坏血酸的使用增加了从发酵液中纯化产物的更多步骤。
l-dopa是活细胞的重要化合物,特别是在动物中,因为它被用作许多神经递质的前体,并且在动物脑中,l-dopa由酪氨酸羟化酶(th)用四氢生物蝶呤(bh4)作为辅助因子合成(kappock,chem.rev.1996;fitzpatrick,annrevbiochem1999;daubner,archbiochembiophys2011)。在氧化步骤期间使用蝶呤辅助因子是th及相关酶诸如苯丙氨酸羟化酶(pah)和色氨酸羟化酶(tph)的独特特征(pribat,j.bacteriol.2010),并且这有助于防止l-酪氨酸至邻醌产物的过度氧化,这是微生物中通过酪氨酸酶产生l-dopa的一个问题(maass,2003)。然而,由于微生物中辅酶bh4的无效性,尚未有将th酶应用于微生物代谢工程的报道。bh4是动物中存在的特有辅助因子,并且尚无细菌系统利用bh4生物合成l-dopa或相关代谢物的报道。
羟基酪醇(hty)是高价值的化合物,对稳定且可持续生产高纯度hty的需求日益增加。hty是最强效的抗氧化剂之一,具有作为抗肿瘤剂、抗动脉粥样硬化剂、抗炎剂和/或抗血小板聚集剂的潜在的生物功能。它在诸如功能性食物、膳食补充剂、化妆品和动物饲料的产业中具有广泛的潜在应用。
目前,hty由富集的橄榄提取物在化学或酶促水解后产生。然而,该方法难以应用于高纯度产物,因为提取物是具有类似结构的化合物的复杂混合物。
发明概述
本发明提供了组合物,其包含:(a)第一宿主细胞,其能够产生l-dopa;和(b)第二宿主细胞,其能够将l-dopa转化为羟基酪醇(hty);其中第一宿主细胞和第二宿主细胞中的任一者或两者是经遗传修饰的宿主细胞。在一些实施方案中,第一宿主细胞是第一经遗传修饰的宿主细胞,并且第二宿主细胞是第二经遗传修饰的宿主细胞。
在一些实施方案中,第一宿主细胞包含二氢蝶啶还原酶(dhpr)、蝶呤-4-α-甲醇胺脱水酶(pcd)和酪氨酸羟化酶(th)或其任何同源酶。在一些实施方案中,dhpr、pcd和th中的一种或多种是第一宿主细胞异源的。
在一些实施方案中,第一宿主细胞经工程化以与未经工程化的细胞相比过量产生酪氨酸,并且第一宿主细胞包含酪氨酸羟化酶(th)或其同源酶。在一些实施方案中,第一宿主细胞是反馈抗性突变体,其包含过表达arog或其任何同源酶的手段,以及过表达tyra或其同源酶的手段。在一些实施方案中,过表达arog的手段是引入宿主细胞中整合在宿主细胞的染色体或质粒上的arog基因的一个或多个拷贝。在一些实施方案中,过表达tyra的手段是引入宿主细胞中整合在宿主细胞的染色体或质粒上的tyra基因的一个或多个拷贝。在一些实施方案中,arog和/或tyra基因由强组成型启动子转录。在一些实施方案中,第一宿主细胞包含用于合成l-酪氨酸的以下酶中的一种或多种或全部,或其相应的同源酶:磷酸烯醇丙酮酸合酶(ppsa)、转酮醇酶a(tkta)、dahp合酶(arog)、dhq合酶(arob)、dhq脱水酶(arod)、奎尼酸/莽草酸脱氢酶(ydib)、莽草酸脱氢酶(aroe)、莽草酸激酶i/ii(arok/l)、epsp合酶(aroa)、分支酸合酶(aroc)、分支酸变位酶/预苯酸脱氢酶(tyra)和酪氨酸氨基转移酶(tyrb)。在一些实施方案中,当第一宿主细胞在m9y确定成分培养基(1%葡萄糖)中生长或培养时,经工程化以过量产生酪氨酸的第一宿主细胞能够产生2.0、2.1、2.2、2.3、2.4、2.5或2.6或更多mm的l-酪氨酸。
在一些实施方案中,第二宿主细胞包含l-dopa脱羧酶(ddc)、酪胺氧化酶(tyo)和醇脱氢酶(adh)或其任何同源酶。在一些实施方案中,ddc、tyo和adh中的一种或多种是第二宿主细胞异源的。
本发明提供了产生hty的方法,其包括:(a)提供第一宿主细胞,(b)培养第一宿主细胞以产生第一培养物,(c)提供第二宿主细胞,(d)任选地培养第二宿主细胞以产生第二培养物,(e)将第一培养物和第二培养物合并或混合以产生包含本发明的组合物的共培养物,和(f)在组合物中培养第一宿主细胞和第二宿主细胞,使得产生hty,以及(g)任选地从共培养物中提取或分离hty。
本发明提供了产生hty的生产方法,所产生hty的浓度与之前报道的(satoh等人metabolicengineering14(2012)603–610)相比显著提高。在一些实施方案中,有四种代谢和过程工程化方法来提高合成的hty途径的效率(图1)。
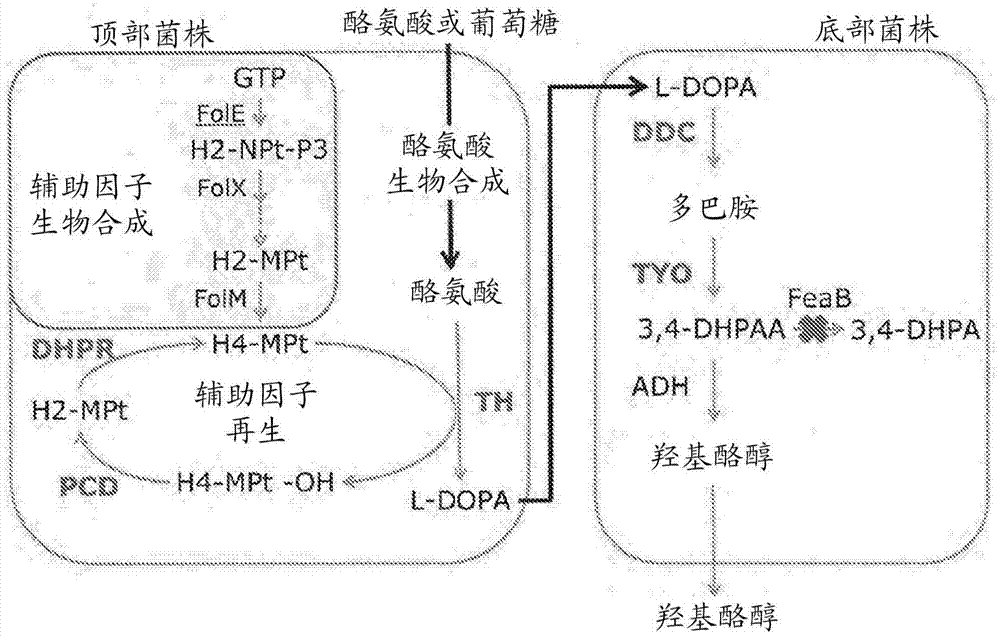
hty途径包括用于酪氨酸羟基化和l-dopa至hty的下游转化的五种异源酶(即彼此是异源的)(图2)。
本发明还提供了用于包括本发明的组合物的工业应用的生物反应器设计。
本发明还提供了用于本发明的方法中的经遗传修饰的宿主细胞。
附图简述
与附图一起阅读时,本领域技术人员将从以下说明性实施方案的描述中容易地理解前述方面和其它方面。
图1.羟基酪醇产生者工程化的概述。
图2.羟基酪醇产生途径。th:合成的来自小鼠的酪氨酸羟化酶。ddc:合成的来自猪的l-dopa脱羧酶。mao:克隆的来自藤黄微球菌(micrococcusluteus)的单胺氧化酶。
图3.jw1380(feab敲除),pbbe1k-th-dhpr-pcd(顶部部分),pbbs2c-(辅助因子基因)。培养基m9y(1mml-酪氨酸,抗坏血酸),37ml摇瓶培养,诱导od0.5。ptrc(iptg)下的顶部部分:500μm。ptet(atc)下的辅助因子基因:40nm。诱导时补充酪氨酸和抗坏血酸。在诱导后6、18、32或39、53小时时通过lc-ms分析上清液。误差线表示来自一式三份生物重复的标准差。
图4.顶部:jw1380,pbbe1k-th-reg,pbbs1a(空载体)。培养基m9y(1mml-酪氨酸),5ml试管培养,诱导od0.4。ptrc(iptg)下的顶部部分:500μm。诱导时补充酪氨酸或下游化学物质。在诱导后25、42、76小时时通过lc-ms分析上清液。误差线表示来自一式三份生物重复的标准差。
图5a.由酪氨酸共培养的方案第1版。
图5b.由1mm酪氨酸共培养的产物概况。共培养:顶部-fole:jw1390,pbbe1k-th-reg-fole,pbbs1a(空载体)。底部:jw1380,pbbe2k-tyo,pbba1a-ddc-rfp。在诱导后4小时收集底部细胞,用顶部菌株悬浮并再培养40小时(总共65小时)。单菌株:顶部-fole+ddc-tyo:jw1380,pbbe1k-th-reg-fole,pbbs1a-ddc-tyo。在诱导后40小时时通过lc-ms分析上清液。
图6a.由葡萄糖共培养的方案第2版。
图6b.由5g/l葡萄糖共培养的产物概况。顶部:dk176,pbbe1k-th-reg-fole,pbbs1a(空载体)。底部:jw1380,pbbe2k-tyo,pbba1a-ddc-rfp。培养基m9y(5g/l葡萄糖),10ml摇瓶培养,诱导od0.4。
图7a.(从酪氨酸)产生hty的共培养方案。
图7b.产物概况(单菌株培养相对于共培养)。顶部+底部(单菌株):jw1380,pbbe1k-th-reg,pbbs1a-ddc-tyo。顶部-fole+底部(单菌株):jw1380,pbbe1k-th-reg-fole,pbbs1a-ddc-tyo。顶部:jw1380,pbbe1k-th-reg,pbbs1a(空载体)。顶部:jw1380,pbbe1k-th-reg-fole,pbbs1a(空载体)。底部a:jw1380,pbbe2k-tyo,pbba1a-ddc-rfp。底部b:jw1380,pbbs1a-ddc-tyo,pbbe1k(空载体)。培养基m9y(1mml-酪氨酸),5ml试管培养,诱导od0.4。ptrc(iptg)下的顶部部分:500μm。诱导时补充酪氨酸。在诱导后73小时时通过lc-ms分析上清液。误差线表示来自一式三份生物重复的标准差。
图8a.(由葡萄糖)共培养的方案。
图8b.由葡萄糖共培养中产生hty。顶部:dk176,pbbe1k-th-reg-fole,pbbs1a(空载体)。底部a:jw1380,pbbe2k-tyo,pbba1a-ddc-rfp。培养基m9y(5g/l葡萄糖)。误差线表示来自一式三份生物重复的标准差。
图8c.通过乙酸乙酯提取的简化的产物概况。每个时间点的上清液用乙酸乙酯提取纯化。
图9.工业生产的示意图。
发明详述
在详细描述本发明之前,应理解的是,除非另有说明,否则本发明不限于特定的序列、表达载体、酶、宿主微生物体或过程,因此可以变化。还应理解的是,本文使用的术语仅用于描述特定实施方案的目的,而不是限制性的。
如说明书和所附权利要求中所使用的,单数形式"一个/种"和"所述"包括复数指示物,除非上下文另有明确说明。因此,例如,提及"表达载体"包括单个表达载体以及多个相同(如相同操纵子)或不同的表达载体;提及"细胞"包括单细胞以及多个细胞等。
在本说明书和随后的权利要求中,将提及一些术语,其定义具有以下含义:
如本文所用的术语"任选的"或"任选地"意指随后描述的特征或结构可能存在或不存在,或者随后描述的事件或情况可能发生或不发生,并且该描述包括特定特征或结构存在的情形和缺少特征或结构的情形,或者事件或情况发生的情形和其不发生的情形。
术语"宿主细胞"和"宿主微生物体"在本文中可互换使用,指的是可以经由插入表达载体而被转化的活生物细胞,诸如微生物。因此,如本文所述的宿主生物体或细胞可以是原核生物体(如,真细菌界的生物体)或真核细胞。如本领域普通技术人员所理解的,原核细胞没有膜结合的细胞核,而真核细胞具有膜结合的细胞核。
如本文所用的术语"异源dna"是指核酸的聚合物,其中以下中至少一者是真实的:(a)核酸的序列对于给定的宿主微生物体而言是外来的(即,不是天然存在的);(b)序列可以天然地存在于给定的宿主微生物体中,但是以非天然的(如,大于预期的)量存在;或(c)核酸的序列包括事实上彼此不存在相同关系的两条或多条子序列。例如,关于情况(c),重组产生的异源核酸序列将具有来自不相关基因的两条或多条序列,其经排列以产生新的功能性核酸。具体地,本发明描述了引入表达载体至宿主微生物体中,其中表达载体含有编码通常不存在于宿主微生物体中的酶的核酸序列。于是相对于宿主微生物体的基因组,编码该酶的核酸序列是异源的。
术语"表达载体"或"载体"是指化合物和/或组合物,其转导、转化或感染宿主微生物体,从而使细胞表达除了细胞天然存在的那些之外的核酸和/或蛋白质,或者以细胞非固有的方式表达。"表达载体"含有由宿主微生物体表达的核酸序列(通常为rna或dna)。任选地,表达载体还包含有助于实现核酸进入宿主微生物体的物质,诸如病毒、脂质体、蛋白涂层等。预期用于本发明中的表达载体包括核酸序列可插入其中的那些,以及任何优选或必需的操作元件。此外,表达载体必须是可以转移到宿主微生物体中并在其中复制的载体。优选的表达载体是质粒,特别是具有限制性位点的那些,其已被充分记载并且含有核酸序列转录优选或必需的操作元件。此类质粒以及其他表达载体是本领域普通技术人员所熟知的。
如本文所用的术语"转导"是指将核酸序列转移到宿主微生物体或细胞中。只有当核酸的序列被细胞稳定复制时,宿主微生物体或细胞才会"被转化"。如本领域普通技术人员所理解的,"转化"可以通过将核酸序列掺入细胞基因组中(即染色体整合)或通过染色体外整合而发生。相比之下,表达载体如病毒,当转导宿主微生物体、复制并且(没有利用任何互补病毒或载体)扩散与原始转导表达载体相同类型的子代表达载体(如病毒)至其他微生物体时,是"有传染性的",其中子代表达载体具有相同的复制能力。
如本文所用,术语"核酸序列"、"核酸的序列"及其变型对于多脱氧核糖核苷酸(包含2-脱氧-d-核糖)、多核糖核苷酸(包含d-核糖)、嘌呤或嘧啶碱基的n-糖苷的任何其他类型的多核苷酸、以及包含非核苷酸主链的其他聚合物应当是通用的,前提是聚合物在允许碱基配对和碱基堆积的构型中包含核酸碱基,如dna和rna中所存在的。因此,这些术语包括已知类型的核酸序列修饰,例如,用类似物取代一种或多种天然存在的核苷酸;核苷酸间修饰,诸如,例如,具有不带电的键(如,膦酸甲酯、磷酸三酯、氨基磷酸酯、氨基甲酸酯等)、带负电的键(如,硫代磷酸酯、二硫代磷酸酯等)和带正电的键(如,氨基烷基磷酰胺酯、氨基烷基磷酸三酯)的那些;包含悬垂部分的那些,诸如,例如蛋白质(包括核酸酶、毒素、抗体、信号肽、聚-l-赖氨酸等);具有嵌入剂(如,吖啶,补骨脂素等)的那些;和包含螯合剂(如,金属、放射性金属、硼、氧化金属等)的那些。如本文所用,核苷酸和多核苷酸的符号是iupac-iub生物化学命名委员会推荐的那些(biochem.9:4022,1970)。
术语"可操作地连接"是指核酸表达控制序列(诸如启动子)和第二核酸序列之间的功能键,其中表达控制序列指导对应于第二序列的核酸的转录。
在一些实施方案中,该方法包括将经遗传修饰的宿主细胞与外源提供的酪氨酸或适合的碳源一起培养。当该方法包括用适合的碳源培养经遗传修饰的宿主细胞时,经遗传修饰的宿主细胞能够使用天然生物合成途径或异源生物合成途径(存在于宿主细胞中的一个或多个核酸上)合成酪氨酸,其中一个或多个核酸位于一个或多个载体上或稳定整合到宿主细胞染色体中。宿主细胞能够吸收和代谢适合的碳源。此类碳源包括但不限于糖,如单糖,例如葡萄糖。
在该一些实施方案中,所述方法包括:(a)将编码能够催化芳香族氨基酸氧化的酶的核酸构建体引入经遗传修饰的宿主细胞;和(b)在适合条件下培养经遗传修饰的宿主细胞,使酶在宿主细胞中表达;从而培养得到产生期望产物的经遗传修饰的宿主细胞。
在一些实施方案中,一种或多种酶能够催化酪氨酸氧化成l-dopa、多巴胺、3,4-二羟基苯基乙醛、3,4-二羟基苯乙醇(羟基酪醇)、牛心果碱、蒂巴因(thebaine)和/或吗啡,这样培养宿主细胞导致宿主细胞产生l-dopa、多巴胺、3,4-二羟基苯基乙醛、3,4-二羟基苯乙醇(羟基酪醇)、牛心果碱、蒂巴因和/或吗啡。
在一些实施方案中,宿主细胞能够通过酪氨酸生物合成途径的天然酶或引入宿主细胞中的异源酪氨酸生物合成途径来内源产生酪氨酸。在一些实施方案中,该酪氨酸生物合成途径包括以下酶中的一种或多种,或其任何相应的同源酶:ppsa、tkta、arog、arob、arod、ydib、aroe、arok/l、aroa、aroc、tyra和tyrb。在一些实施方案中,宿主细胞过量产生arob和/或tyra,或其任何相应的同源酶。
在一些实施方案中,宿主细胞包含或能够表达th、ddc、mao和/或醇脱氢酶或其同源酶,其中与未经修饰的宿主细胞相比过量产生一种或多种酶,或者一种或多种酶是宿主细胞异源的。在一些实施方案中,宿主细胞能够通过酪氨酸生物合成途径的天然酶或引入宿主细胞中的异源酪氨酸生物合成途径来内源产生酪氨酸。
在一些实施方案中,宿主细胞包含或能够表达异源th(诸如小鼠th)、异源ddc(诸如猪ddc)和/或异源mao(诸如藤黄微球菌mao),或其同源酶。
在一些实施方案中,宿主细胞本身包含编码酶的核酸,所述酶能够将苯乙醛脱氢酶催化成3,4-二羟苯基乙酸酯(3,4-dhpa),诸如酶苯乙醛脱氢酶,其中宿主细胞降低酶的表达。当宿主细胞是大肠埃希氏菌时,该酶是由feab基因编码的苯乙醛脱氢酶。降低的表达可以是降低酶表达或降低酶的酶促活性的突变的结果。此类突变的实例是截短或删除基因,诸如敲除突变。
使宿主细胞合成mh4的一种方法是使宿主细胞包含酶gtp环化水解酶i(fole)、folx、p-ase和folm,或其同源酶。
酪氨酸羟化酶是一种分别利用四氢生物蝶呤(bh4)或mh4将酪氨酸和色氨酸催化为l-dopa和5-羟基-色氨酸的酶。蝶呤-4-α-甲醇胺脱水酶(pcd)和二氢蝶啶还原酶(dhpr)能够催化bh4再生的反应。在一些实施方案中,当经遗传修饰的宿主细胞包含酪氨酸羟化酶(th)时,宿主细胞还包含蝶呤-4-α-甲醇胺脱水酶(pcd)或其同源酶和二氢蝶啶还原酶(dhpr)或其同源酶。在一些实施方案中,当经遗传修饰的宿主细胞不能自然合成bh4时,宿主细胞还包含gtp环化水解酶i(fole)、6-丙酮酰-四氢蝶呤合酶(ptps)和墨蝶呤还原酶(sr)或其一种或多种同源酶。
在本发明的一些实施方案中,所述方法还包括回收产生的一种或多种氧化产物的步骤,其中回收步骤与培养步骤同时或在其之后。
酶和其编码核酸
同源酶是一种具有多肽序列的酶,其与本说明书或引入的参考文献中描述的任何一种酶具有至少70%、75%、80%、85%、90%、95%或99%的同一性。同源酶保留了被认为是酶保守的氨基酸残基。同源酶可能具有非保守的氨基酸残基被取代或存在具有不同的氨基酸,或者插入或缺失一种或多种氨基酸,但其对同源酶的酶促活性没有影响或具有不显著的影响。同源酶具有与在说明书或引入的参考文献中描述的任何一种酶的酶促活性相同或基本相同的酶促活性。同源酶可以在自然界中找到或者是其经工程化的突变体。
适合的酪氨酸羟化酶或酪氨酸3-单加氧酶是小鼠酪氨酸羟化酶(np_033403)或其同源酶,其具有以下氨基酸序列:
1mptpsasspqpkgfrravseqdtkqaeavtsprfigrrqsliedarkereaaaaaaaaav
61asaepgnpleavvfeerdgnavlnllfslrgtkpsslsralkvfetfeakihhletrpaq
121rplagsphleyfvrfevpsgdlaallssvrrvsddvrsaredkvpwfprkvseldkchhl
181vtkfdpdldldhpgfsdqayrqrrkliaeiafqykqgepiphveytkeeiatwkevyatl
241kglyathacrehleafqllerycgyredsipqledvshflkertgfqlrpvagllsardf
301laslafrvfqctqyirhasspmhspepdcchellghvpmladrtfaqfsqdiglaslgas
361deeieklstvywftvefglckqngelkaygagllssygellhslseepevrafdpdtaav
421qpyqdqtyqpvyfvsesfsdakdklrnyasriqrpfsvkfdpytlaidvldsphtirrsl
481egvqdelhtltqalsais(seqidno:1)
适合的蝶呤-4-α-甲醇胺脱水酶(pcd)是人pcd(np_000272)或其同源酶,其具有以下氨基酸序列:
1magkahrlsaeerdqllpnlravgwnelegrdaifkqfhfkdfnrafgfmtrvalqaekl
61dhhpewfnvynkvhitlsthecaglserdinlasfieqvavsmt(seqidno:2)
适合的二氢蝶啶还原酶(dhpr)是人dhpr(p09417)或其同源酶,其具有以下氨基酸序列:
1maaaaaagearrvlvyggrgalgsrcvqafrarnwwvasvdvveneeasasiivkmtdsf
61teqadqvtaevgkllgeekvdailcvaggwaggnakskslfkncdlmwkqsiwtstissh
121latkhlkegglltlagakaaldgtpgmigygmakgavhqlcqslagknsgmppgaaaiav
181lpvtldtpmnrksmpeadfsswtpleflvetfhdwitgknrpssgsliqvvttegrtelt
241payf(seqidno:3)
适合的l-dopa脱羧酶(ddc)是猪ddc或其同源酶,其具有以下核苷酸(seqidno:4)和氨基酸(seqidno:5)序列:
适合的单胺氧化酶(mao)是藤黄微球菌mao(acs30544.1)或其同源酶,其具有以下氨基酸序列:
1mttapatagrerrtsdvvvigagpaglmaartakaqglsvtvlearrrvggrtwnglveg
61adgkdhfieiggqwispdqtrlislveelglptfsrfrdgrnvyvdprgerhvydgldfp
121vaektdremdrliakideltaeidaaapwehpraaeldtisfrhwleqesddpeaidnvs
181iyiasgmltkpshtfsmlqallmaasagsfrnlvdedfildkrveggmqsvsltmaaelg
241ddvvlgqpvrtlrwaepdpstadekngvaadvrngvahdgaagdvvaltddyevharyav
301lavppnlysrisfeppmpreqqiahqhismglvikvhavyetpfwreeglsgtcfgggrl
361vqeiydntnrgenlaggapgeedphgtlvgfvsdvyaeqmwalpeeerkaailgamaeyl
421gprtlepiafflsdmaaeewtrgayatsydlgglsrwghlqnrptgpihyacsdiaaegy
481qhvdgairmgeaaalaiaereatdagqptg(seqidno:6)
适合的arog是大肠埃希氏菌arog或其同源酶,其具有以下氨基酸序列:
mnyqnddlrikeikellppvallekfpatenaantvaharkaihkilkgnddrllvvigp
csihdpvaakeyatrllalreelkdeleivmrvyfekprttvgwkglindphmdnsfqin
dglriarkllldindsglpaagefldmitpqyladlmswgaigarttesqvhrelasgls
cpvgfkngtdgtikvaidainaagaphcflsvtkwghsaivntsgngdchiilrggkepn
ysakhvaevkeglnkaglpaqvmidfshansskqfkkqmdvcadvcqqiaggekaiigvm
veshlvegnqslesgeplaygksitdacigwedtdallrqlanavkarrg(seqidno:7)
适合的tyra是大肠埃希氏菌tyra或其同源酶,其具有以下氨基酸序列:
mvaeltalrdqidevdkallnllakrlelvaevgevksrfglpiyvpereasmlasrrae
aealgvppdliedvlrrvmresyssendkgfktlcpslrpvvivggggqmgrlfekmltl
sgyqvrileqhdwdraadivadagmvivsvpihvteqvigklpplpkdcilvdlasvkng
plqamlvahdgpvlglhpmfgpdsgslakqvvvwcdgrkpeayqwfleqiqvwgarlhri
savehdqnmafiqalrhfatfayglhlaeenvqleqllalsspiyrlelamvgrlfaqdp
qlyadiimssernlalikryykrfgeaielleqgdkqafidsfrkvehwfgdyaqrfqsesrvllrqandnrq(seqidno:8)
本发明的核酸构建体包含编码一种或多种目标酶的核酸序列。目标酶的核酸与启动子和任选的控制序列可操作地连接,使得目标酶在适合条件下培养的宿主细胞中表达。启动子和控制序列对每种宿主细胞物种都是特异性的。在一些实施方案中,表达载体包括核酸构建体。用于设计和制造核酸构建体和表达载体的方法是本领域技术人员公知的。
编码目标酶的核酸序列通过本领域普通技术人员已知的任何适合方法制备,包括例如直接化学合成或克隆。对于直接化学合成,核酸聚合物的形成通常包括将3'-封闭和5'-封闭的核苷酸单体依序添加到生长中的核苷酸链的末端5'-羟基基团,其中每次添加都通过生长链的末端5'-羟基基团对所添加单体的3'-位置的亲核攻击来实现,所述单体通常是磷衍生物,诸如磷酸三酯、亚磷酰胺等。此类方法是本领域普通技术人员已知的并且在相关文章和文献中有描述(例如,在matteuci等人(1980)tet.lett.521:719;美国专利号4,500,707;5,436,327;和5,700,637)中。此外,所需序列可以通过以下步骤从天然来源分离:使用适当的限制酶断裂dna、使用凝胶电泳分离片段、然后通过本领域普通技术人员已知的技术诸如利用聚合酶链式反应(pcr;如,美国专利no.4,683,195)从凝胶中回收所需的核酸序列。
编码所需目标酶的各核酸序列可以掺入表达载体中。单个核酸序列的掺入可以通过已知方法完成,包括例如使用限制酶(诸如bamhi、ecori、hhai、xhol、xmai等)来切割表达载体如质粒中的特定位点。限制酶产生可以与核酸序列退火的单链末端,所述核酸序列具有或经合成以具有与切割的表达载体的末端互补的序列的末端。使用合适的酶如dna连接酶进行退火。如本领域普通技术人员所理解的,表达载体和所需的核酸序列通常用相同的限制酶切割,从而确保表达载体的末端和核酸序列的末端彼此是互补的。此外,可使用dna接头来促进核酸序列连接至表达载体中。
还可以通过利用本领域普通技术人员已知的方法组合一系列的单个核酸序列(如,美国专利no.4,683,195)。
例如,所需核酸序列中的每一种最初可以在单独的pcr中产生。此后,设计特异性引物使得pcr产物的末端含有互补序列。当pcr产物混合、变性和再退火时,在其3'末端具有匹配序列的链重叠并且可以作为彼此的引物。通过dna聚合酶延伸该重叠产生其中原始序列"被剪接"在一起的分子。以这种方式,一系列的单个核酸序列可以"被剪接"在一起并随后同时转导到宿主微生物体中。因此,实现多条核酸序列中的每一条的表达。
然后将单个核酸序列或"剪接的"核酸序列掺入表达载体。本发明并不限制核酸序列掺入表达载体的方法。本领域普通技术人员熟悉将核酸序列掺入表达载体的必要步骤。典型的表达载体含有所需的核酸序列,其前面有一个或多个调节区,以及核糖体结合位点,如长度为3-9个核苷酸并且位于大肠埃希氏菌中的起始密码子上游的3-11个核苷酸处的核苷酸序列。参见shine等人(1975)nature254:34和steitz,biologicalregulationanddevelopment:geneexpression(r.f.goldberger编辑),第1卷,第349页,1979,plenumpublishing,n.y。
调节区域包括例如,含有启动子和操纵子的那些区域。启动子可操作地连接至所需的核酸序列,从而通过rna聚合酶启动核酸序列的转录。操纵子是与启动子相邻的核酸序列,其含有蛋白质-结合结构域,可以结合阻遏蛋白。在没有阻遏蛋白的情况下,转录通过启动子起始。当阻遏蛋白存在时,对操纵子的蛋白质-结合结构域特异的阻遏蛋白与操纵子结合,从而抑制转录。以这种方式,基于所使用的特定调节区和相应阻遏蛋白的存在或不存在,完成转录的控制。一个实例包括乳糖启动子(当与乳糖接触时,laci阻遏蛋白改变构象,从而防止laci阻遏蛋白与操纵子结合)。另一个例子是tac启动子(参见deboer等人(1983)proc.natl.acad.sci.usa,80:21-25.)。如本领域普通技术人员所理解的,这些和其他表达载体可用于本发明,并且本发明在这方面不受限制。
尽管可以使用任何适合的表达载体来掺入所需的序列,但是容易获得的表达载体包括但不限于:质粒,诸如psc101、pbr322、pbbr1mcs-3、pur、pex、pmr100、pcr4、pbad24、puc19;细菌噬菌体,诸如m13噬菌体和λ噬菌体。当然,此类表达载体可能仅适合特定的宿主细胞。然而,本领域普通技术人员可以通过常规实验容易地确定任何特定的表达载体是否适用于任何给定的宿主细胞。例如,可以将表达载体引入宿主细胞,然后监测载体中所含序列的存活力和表达。此外,可以参考描述了表达载体及其对任何特定宿主细胞的适应性的相关文章和文献。
必须将本发明的表达载体引入或转移到宿主细胞中。用于将表达载体转移到宿主细胞中的此类方法是本领域普通技术人员所熟知的。例如,用表达载体转化大肠埃希氏菌的一种方法涉及氯化钙处理,其中表达载体经由钙沉淀引入。在类似的步骤之后也可以使用其他盐,如磷酸钙。此外,电穿孔(即,施加电流以增加细胞对核酸序列的渗透性)可用于转染宿主微生物体。此外,核酸测序仪的微注射提供了转染宿主微生物体的能力。还可以使用其他方法,诸如脂质复合物、脂质体和树枝状大分子。本领域普通技术人员可以使用这些或其他方法用所需序列转染宿主细胞。
为了鉴定转染的宿主细胞,可以使用多种方法。例如,可以通过适当稀释将潜在转染的宿主细胞的培养物分离成单个细胞,然后单独培养并测试所需核酸序列的表达。此外,使用质粒时,常用的做法涉及基于由特意包含在表达载体内的基因(诸如amp、gpt、neo和hyg基因)赋予的抗微生物抗性来选择细胞。
宿主细胞用至少一种表达载体转化。当仅使用单一表达载体时(没有中间体的添加),载体将含有所必需的所有核酸序列。
一旦宿主细胞用表达载体转化,就使宿主细胞生长。对于微生物宿主,该过程需要在合适的培养基中培养细胞。重要的是,当不引入中间体时,培养基含有过量的碳源,诸如糖(如葡萄糖)。以这种方式,确保了芳香族氨基酸的细胞生产。当添加中间体时,其在培养基中过量存在。
随着宿主细胞生长和/或繁殖,产生氧化产物所必需的酶的表达受到影响。一旦表达,酶催化进行任选芳香族氨基酸产生、bh4产生和氧化产物产生步骤所必需的步骤。如果已引入中间体,所表达的酶催化将中间体转化为相应氧化产物所必需的那些步骤。可以使用任何从宿主细胞中回收氧化产物的方法。例如,可以收获宿主细胞并使其经受低渗条件而裂解细胞。然后可以将裂解物离心并对上清液进行高效液相色谱(hplc)或气相色谱(gc)。一旦回收氧化产物,可根据需要对氧化产物进行修饰。
宿主细胞
本发明的宿主细胞是经遗传修饰的,因为异源核酸已被引入宿主细胞,这样经遗传修饰的宿主细胞在自然界中不存在。适合的宿主细胞是能够表达编码本文所述的一种或多种酶的核酸构建体的细胞。编码一种或多种酶的一种或多种基因可以是宿主细胞异源的,或者该基因可以是宿主细胞固有的,但是可操作地连接至异源启动子和一个或多个控制区域,这导致基因在宿主细胞中的表达更高。
该酶可以是宿主细胞固有的或异源的。当酶是宿主细胞固有的时,宿主细胞经遗传修饰以调节酶的表达。该修饰可涉及修饰宿主细胞中编码酶的染色体基因,或将编码酶基因的核酸构建体引入宿主细胞。该修饰的作用之一是酶的表达在宿主细胞中被调控,例如,与未修饰的宿主细胞中酶的表达相比,宿主细胞中酶的表达增加。
在一些实施方案中,宿主细胞天然地包含编码酶的核酸,所述酶能够将苯乙醛脱氢酶转化为3,4-二羟苯基乙酸酯(3,4-dhpa),诸如酶苯乙醛脱氢酶,其中宿主细胞降低酶的表达。当宿主细胞是大肠埃希氏菌时,该酶是由feab基因编码的苯乙醛脱氢酶。降低的表达可以是降低酶表达或降低酶的酶促活性的突变的结果。此类突变的实例是截短或删除基因,诸如敲除突变。
任何原核或真核宿主细胞都可以用于本方法,只要它在用核酸序列转化后仍然存活。通常,但是非必须的,宿主微生物体是细菌。在一些实施方案中,宿主细胞是革兰氏阴性细菌。在一些实施方案中,宿主细胞属于变形菌门。在一些实施方案中,宿主细胞属于丙型变形菌纲。在一些实施方案中,宿主细胞属于肠杆菌目。在一些实施方案中,宿主细胞属于肠杆菌科。细菌宿主细胞的实例包括但不限于归类至埃希氏菌属(escherichia)、肠杆菌属(enterobacter)、固氮菌属(azotobacter)、欧文氏菌属(erwinia)、芽孢杆菌属(bacillus)、假单胞菌属(pseudomonas)、克雷伯氏菌属(klebsielia)、变形杆菌属(proteus)、沙门氏菌属(salmonella)、沙雷氏菌属(serratia)、志贺氏菌属(shigella)、根瘤菌属(rhizobia)、透明颤菌属(vitreoscilla)和副球菌属(paracoccus)分类学类别的那些物种。优选地,宿主细胞不受必需的核酸序列的转导、蛋白质(即酶)的后续表达或进行与甲羟戊酸途径相关的步骤所需的所得中间体的不利影响。例如,优选在宿主细胞自身的代谢过程与涉及甲羟戊酸途径的那些过程之间存在最低限度的"串扰"(即干扰)。适合的真核细胞包括但不限于,真菌、昆虫或哺乳动物细胞。适合的真菌细胞是酵母细胞,诸如酵母属(saccharomyces)的酵母细胞。
应该理解,虽然已经结合其优选的具体实施方案描述了本发明,但是前面的描述旨在说明而不是限制本发明的范围。对于本发明所属领域的技术人员来说,在本发明范围内的其他方面、优势和修改是显而易见的。
本文提及的所有专利、专利申请和出版物均通过引用整体并入本文。
已经描述了本发明,提供以下实施例以通过说明而非限制的方式说明本发明。
实施例1
大肠埃希氏菌中羟基酪醇产生的工程化
羟基酪醇(hty)是最强的抗氧化剂之一,在诸如功能性食物、膳食补充剂、化妆品和动物饲料的产业中具有潜在应用。先前已经报道了由五个异源基因组成的能够用合成途径产生ht的经工程化的大肠埃希氏菌。本文描述了三种代谢工程化努力以提高合成的hty途径的效率。
首先,用于酪氨酸羟基化的辅助因子生物合成途径经工程化。接下来,鉴定下游化学物质对酪氨酸羟基化的抑制,并且应用设计用来克服它的共培养策略。通过这些工程化,酪氨酸的产物产量提高约3倍。
最后,宿主菌株经工程化以过量产生酪氨酸。证实了由葡萄糖产生l-dopa而没有任何外部补充酪氨酸,并且通过共培养策略将所得l-dopa进一步转化为hty,与先前结果相比提高了25倍。
微生物hty产生过程经工程化,具有工业化的潜力。目前,hty由富含橄榄的提取物在化学或酶促水解后产生。对稳定且可持续生产的需求不断增加,并且我们认为微生物发酵是有前景的解决方案。
图3显示了经工程化的用于酪氨酸羟基化的辅助因子生物合成途径。图3显示了fole引入使由酪氨酸产生的l-dopa增加2倍。鉴定了下游化合物对酪氨酸羟基化的抑制(图4)。图4显示了th被羟基酪醇和多巴胺抑制。通过应用共培养策略,克服了下游化合物对酪氨酸羟基化的抑制,并且来自酪氨酸的产物产量提高超过约3倍(图5)。使用代谢组学和蛋白质组学数据优化途径酶的基因表达。宿主菌株经工程化以过量产生酪氨酸。通过这些修饰,使用共培养策略将来自葡萄糖的产物提高超过约10倍(图6)。使用图7a和图7b中所示的共培养策略,hty产量增加超过3倍。图8a至图8c显示了可从葡萄糖获得高纯度hty。
这项工作证明了微生物hty生产的潜在工业应用,并提供了用于生产涉及芳香族氨基酸的羟基化的各种化学物质的良好的可再生微生物平台。表1比较了先前报道的羟基酪醇产量(satoh等人metabolicengineering14(2012)603–610)和本文报道的羟基酪醇产量。
表1.先前报道的羟基酪醇产量和本文报道的羟基酪醇产量的比较
实施例2
大肠埃希氏菌l-酪氨酸过量产生者的工程化
对于一些羟基酪醇产生菌株,需要l-酪氨酸过量产生者。可获得用于酪氨酸产生者的模块化系统(juminaga等人,2012),然而,该系统已经使用了两种质粒,因此难以与其他模块组合。l-酪氨酸过量产生者通过在大肠埃希氏菌mg1655(de3)的pykf基因座处整合反馈抗性突变的tyra和arog构建,而不是整合酪氨酸生物合成的完整途径。arog位于莽草酸途径的入口处,而tyra位于酪氨酸合成的莽草酸途径的最后一个反应处。已知这两个基因是酪氨酸合成的第一和第二限制反应,因此增强这两个基因是用于制备酪氨酸过量产生菌株的良好策略。通过将arog和tyra基因导入亲本菌株来构建命名为dk176的菌株。当dk176菌株在m9y培养基(1%葡萄糖)中培养时,获得2.68mm的l-酪氨酸产量,这显著提高了l-酪氨酸产生。
虽然已经参考本发明的特定实施方案描述了本发明,但是本领域技术人员应该理解,在不脱离本发明的真实精神和范围的情况下,可以进行各种改变并且可以替换等同物。此外,可以进行许多修改以使特定情况、材料、物质的组成、过程、一个或多个过程步骤适应本发明的目的、精神和范围。所有此类修改都在本文所附权利要求的范围内。
- 还没有人留言评论。精彩留言会获得点赞!