1,3-二噁烷-5-酮类的制造方法与流程
本发明涉及一种1,3-二噁烷-5-酮类的制造方法。
背景技术:
1,3-二噁烷-5-酮类(1,3-dioxan-5-ones)作为各种有用化合物的合成中间体是有用的。
例如,在工业与工程化学研究(industrial&engineeringchemistryresearch)、第51卷、3715-3721页、2012年(非专利文献1)中公开有通过2-苯基-1,3-二噁烷-5-酮的脱保护反应(脱缩醛化反应)而制造二羟基丙酮(以下,也称为“dha”。)的方法。
另外,在合成通讯(syntheticcommunications)、第27卷、第16号、2813-2816页、1997年(非专利文献2)中公开有由2-苯基-1,3-二噁烷-5-酮、制造作为x射线造影剂的原料有用的2-氨基-1,3-丙二醇(以下,也称为“丝氨醇”。)的缩醛体的方法。另外,在美国专利第7851639号说明书(专利文献1)中也公开有通过1,3-二噁烷-5-酮类和醛类的不对称醇醛缩合反应形成的多种多样的碳骨架构造例。
作为1,3-二噁烷-5-酮类的制造方法,例如在美国化学学会杂志(journaloftheamericanchemicalsociety)、第111卷、5902-5915页、1989年(非专利文献3)中公开有以可由能够以工业规模供应的硝基甲烷衍生的三羟基甲基硝基甲烷或三羟基甲基氨基甲烷为原料的制造方法。
另外,在非专利文献1中公开有将通过由顺式及反式-2-苯基-1,3-二噁烷-5-醇和顺式及反式-4-羟基甲基-2-苯基-1,3-二氧戊环构成的4种异构体混合物的低温再结晶得到的高纯度的2-苯基-1,3-二噁烷-5-醇进行氧化的2-苯基-1,3-二噁烷-5-酮的制造方法。
另外,在德国专利申请公开第3900479号说明书(专利文献2)中公开有通过精密蒸馏分离将能够由可廉价地供应的甘油(甘油)和甲醛制造的甘油缩甲醛进行氧化而得到的1,3-二噁烷-5-酮和1,3-二氧戊环-4-羧醛(4-甲酰基-1,3-二氧戊环)的混合物的1,3-二噁烷-5-酮的制造方法。
技术实现要素:
本发明涉及一种1,3-二噁烷-5-酮类的制造方法,其为以下述式(i)表示的化合物及下述式(ii)表示的化合物的混合物为原料的1,3-二噁烷-5-酮类的制造方法,其中,具有将所述混合物在氧化酯化条件下进行氧化的工序(工序2)。在此,工序2为相对于所述混合物、在式(ii)表示的化合物进行氧化酯化的条件下将式(i)表示的化合物进行氧化的工序。
进而,本发明涉及一种将得到的1,3-二噁烷-5-酮类进行脱缩醛化的1,3-二羟基丙酮的制造方法。另外,涉及一种将得到的1,3-二噁烷-5-酮类进行还原氨基化、进一步进行脱缩醛化的2-氨基-1,3-丙二醇的制造方法。
(式(i)及式(ii)中,r1及r2分别独立地表示氢原子或一价的烃基,或者r1及r2表示相互键合而形成环结构的二价的烃基。)
附图说明
[图1]实施例1-1中得到的反应液的gc图表
[图2]实施例2-1中得到的反应液的gc图表
[图3]实施例3-3中得到的反应液的gc图表
[图4]实施例4中得到的反应液的gc图表
具体实施方式
1,3-二噁烷-5-酮类作为各种有用化合物的合成中间体有用,但从容易获得的原料用工业上有利的方法廉价地制造高品质的1,3-二噁烷-5-酮类的技术没有确立。
例如,非专利文献3的制造方法为具有爆炸的危险性、或者来自高价的原材料的多阶段合成法,进而有必要在氧化裂解工序中使用化学计量的量以上的高价的氧化剂等,不适于工业规模的制造。
另外,在非专利文献1的制造方法中,再结晶后的2-苯基-1,3-二噁烷-5-醇的收率非常低,为25%,虽然提示将再结晶母液在以下的缩醛化反应中进行再利用导致的原材料的损失量减少策略,但是,没有解决从反应至精制的生产率显著低的课题,难以说是适于工业规模的制造。
另外,在专利文献2的制造方法中,为了从以分子量完全相同且沸点非常接近的1,3-二噁烷-5-酮和4-甲酰基-1,3-二氧戊环为主成分的氧化混合物而将1,3-二噁烷-5-酮进行分离,需要使用理论塔板数相当于60塔板的多塔板精馏塔的精密蒸馏,难以说是适于工业规模的制造。
本发明涉及一种从将与1,3-二氧戊环类(下述式(ii)表示的化合物)的混合物即1,3-二噁烷类(下述式(i)表示的化合物)作为原料可容易且廉价地供应的原料、通过短工序且简便的方法制造1,3-二噁烷-5-酮类的方法,进而涉及提供一种可以制造dha或丝氨醇的工业上有利的制造方法。
本发明人发现:通过具有特定的工序的制造方法,可解决所述课题。
根据本发明,可以从将与1,3-二氧戊环类的混合物即1,3-二噁烷类作为原料可容易且廉价地供应的原料,通过短工序且简便的方法而制造1,3-二噁烷-5-酮类。另外,可以从得到的1,3-二噁烷-5-酮类制造dha或丝氨醇。
[原料]
本发明的1,3-二噁烷-5-酮类的制造方法以下述式(i)表示的化合物及下述式(ii)表示的化合物的混合物为原料。
(式(i)及式(ii)中,r1及r2分别独立地表示氢原子或一价的烃基、或者r1及r2表示相互键合而形成环结构的二价的烃基。)
式(i)及式(ii)中的r1及r2分别独立地为氢原子或一价的烃基,或者r1及r2为相互键合而形成环结构的二价的烃基。
作为r1及r2的优选的一个方式,从二噁烷的异构体比率高的观点出发,r1优选为氢原子,从原料的获得性、二噁烷酮(dioxanone)的稳定性、及分离容易性的观点出发,r2优选为氢原子或碳原子数1以上20以下的一价的烃基。作为r2的烃基,优选为烷基或芳基。该烷基的碳原子数优选为1以上,优选为20以下,更优选为18以下,进一步优选为16以下,更进一步优选为14以下,更进一步优选为12以下,更进一步优选为10以下,更进一步优选为8以下,更进一步优选为6以下,更进一步优选为4以下,更进一步优选为2以下。这些烷基可以为直链,也可以为支链。另外,r2的芳基的碳原子数优选为6以上,优选为20以下,更优选为18以下,进一步优选为16以下,更进一步优选为14以下,更进一步优选为12以下,更进一步优选为10以下,更进一步优选为8以下,更进一步优选为6以下。从所述的观点出发,所述r2优选为氢原子或碳原子数1以上20以下的一价的烃基,更优选为氢原子、碳原子数1以上8以下的直链烷基、碳原子数1以上8以下的支链烷基或碳原子数6以上20以下的芳基,进一步优选为氢原子、甲基或苯基,更进一步优选为氢原子。
作为r1及r2的其它优选的一个方式,从原料的获得性和反应性的观点出发,优选r1为碳原子数1以上8以下的一价的烃基且r2为碳原子数1以上8以下的一价的烃基,更优选r1为碳原子数1以上8以下的烷基且r2为碳原子数1以上8以下的烷基,进一步优选r1为碳原子数1或2的烷基、且r2为碳原子数1以上6以下的烷基,更进一步优选r1为碳原子数1或2的烷基且r2为碳原子数1以上4以下的烷基,更进一步优选r1为甲基且r2为甲基或乙基,更进一步优选r1为甲基且r2为甲基。
作为r1及r2的其它优选的一个方式,r1及r2为相互键合而形成环结构的二价的烃基,从原料的获得性和反应性的观点出发,优选为碳原子数2以上7以下的二价的烃基,更优选为碳原子数3以上6以下的二价的烃基,进一步优选为碳原子数4以上5以下的二价的烃基,更进一步优选为碳原子数5的二价的烃基。即,含有r1及r2的环结构优选为3~8元环,更优选为4~7元环,进一步优选为5~6元环,更进一步优选为6元环。含有r1及r2的环结构优选为环烷烃结构,更优选为碳原子数5或6的环结构(环戊烷环或环己烷环),进一步优选为环己烷环。
予以说明,式(i)中,r1及r2相互键合而形成环结构的情况下,式(i)成为下述式(i’)。同样地,式(ii)中,r1及r2相互键合而形成环结构的情况下,式(ii)成为下述式(ii’)。
(式(i’)及式(ii’)中,ra分别是指形成环结构的二价的烃基。)
式(i’)及式(ii’)中,含有ra的环结构优选为3~8元环,更优选为4~7元环,进一步优选为5~6元环,更进一步优选为6元环。含有ra的环结构优选为环烷烃结构,如上所述,优选形成环戊烷环或环己烷环,进一步优选形成环己烷环。
即,ra优选为亚乙基(-(ch2)2-)、三亚甲基(-(ch2)3-)、四亚甲基(-(ch2)4-)、五亚甲基(-(ch2)5-)、六亚甲基(-(ch2)6-)或七亚甲基(-(ch2)7-)、更优选三亚甲基、四亚甲基、五亚甲基或六亚甲基,进一步优选为四亚甲基或五亚甲基,更进一步优选为五亚甲基。
予以说明,在式(i)表示的化合物中,在r1和r2不相同的情况下,存在顺式-反式异构体。
另外,在式(ii)表示的化合物中存在1个以上的不对称碳。因此,只要不实施对映选择性反应或立体异构体分离,则式(ii)表示的化合物作为外消旋体、或立体异构体混合物存在。
予以说明,作为本发明的原料,式(i)表示的化合物的立体异构体比率及式(ii)表示的化合物的立体异构体比率没有特别限定。
上述式(i)表示的化合物和上述式(ii)表示的化合物的混合物既可以使用作为混合物被市售的制品,也可以如后所述,制造式(i)表示的化合物(二噁烷)和式(ii)表示的化合物(二氧戊环)的混合物而使用,没有特别限定,从廉价地制造的观点出发,本发明优选具有制造二噁烷和二氧戊环的混合物的工序(工序1)。
<工序1:二噁烷和二氧戊环的混合物的制造>
对本发明中使用的式(i)表示的化合物(二噁烷)及下述式(ii)表示的化合物(二氧戊环)的混合物的制造方法没有限制,从原料的获得性、收率、及反应操作的容易性的观点出发,优选通过一般而言为众所周知的方法的、将甘油和下述式(v)表示的化合物或其多聚物在酸催化剂存在下进行缩醛化的方法(方法1)、或将甘油和下述式(vi)表示的化合物在酸催化剂存在下进行缩醛交换的方法(方法2)来制造。得到的混合物可以直接或在精制之后用作以下的工序2的原料,但从工序2中的收率的观点出发,优选将混合物进行精制并除去未反应原料等,从精制的容易性的观点出发,更优选进行蒸馏精制。
甘油、下述式(v)表示的化合物、及下述式(vi)表示的化合物可以容易且廉价地获得,通过使用方法1或方法2,可以容易且廉价地制造本发明的原料。
以下示出方法1及方法2的反应式。
(式(v)及式(vi)中,r1及r2与式(i)或式(ii)中的r1及r2同义,式(vi)中,r3分别独立地表示一价的烃基。)
用于本发明的二噁烷和二氧戊环的混合物可以使用二噁烷的异构体比率为20%以上的任一种混合物,但从生产率及经济性的观点出发,二噁烷的异构体比率越高越优选。二噁烷的异构体比率优选为30%以上,更优选为40%以上,进一步优选为50%以上。
式(vi)中的r3为一价的烃基,从原料的获得性的观点出发,优选碳原子数1以上8以下的烃基,从将缩醛交换反应中副生的醇馏去至反应体系外而促进反应的观点出发,更优选为碳原子数1以上3以下的一价的烃基,进一步优选为碳原子数1以上3以下的一价的烷基,更进一步优选为甲基。
予以说明,作为上述式(v)表示的化合物的多聚物,可例示作为甲醛的多聚物的多聚甲醛、作为乙醛的环状三聚物的三聚乙醛(别名:2,4,6-三甲基-1,3,5-三噁烷)。考虑操作的容易性等,适当选择式(v)表示的化合物或其多聚物而使用即可。
[1,3-二噁烷-5-酮类的制造方法]
本发明的1,3-二噁烷-5-酮类的制造方法为以上述式(i)表示的化合物及上述式(ii)表示的化合物的混合物为原料的1,3-二噁烷-5-酮类的制造方法,具有将所述混合物在氧化酯化条件下进行氧化的工序(工序2)。
通过工序2,上述式(i)表示的化合物进行氧化,在下述式(iii)表示的1,3-二噁烷-5-酮类(以下,也称为“二噁烷酮”。)中,另外,上述式(ii)表示的化合物进行氧化酯化,成为下述式(iv)表示的化合物(以下,也称为“酯二聚物”。)。
(式(iii)及式(iv)中,r1及r2与式(i)或式(ii)中的r1及r2同义。)
予以说明,在式(ii)的二氧戊环中存在1个以上的不对称碳,因此,只要不使用镜像异构体过剩率100%的二氧戊环,则式(iv)的酯二聚物可作为立体异构体混合物得到。
甘油缩醛中的6元环二噁烷(上述式(i)表示的化合物)和5元环二氧戊环(上述式(ii)表示的化合物)其沸点或溶解性等物性接近,分离非常困难。另外,其氧化混合物或脱保护混合物也具有同样的课题。在本发明中,在甘油缩醛混合物的氧化条件中采用氧化酯化,通过设为沸点或溶解性等物性的差大的氧化混合物(上述式(iii)表示的化合物(二噁烷酮)和上述式(iv)表示的化合物(酯二聚物)的混合物),比二噁烷酮分子量约大2倍的酯二聚物成为分离对象副产物,因此,可以容易地将酯二聚物进行分离而得到二噁烷酮。例如,可以通过利用了沸点差大的蒸馏精制等而容易地得到高纯度的二噁烷酮。
即,本发明中,工序2为通过相对于甘油缩醛的混合物(上述式(i)表示的化合物及上述式(ii)表示的化合物的混合物)、在二氧戊环(上述式(ii)表示的化合物)进行氧化酯化的条件下将二噁烷(式(i)表示的化合物)进行氧化而生成物性差大的二噁烷酮(上述式(iii)表示的化合物)和酯二聚物(上述式(iv)表示的化合物)的工序。
<工序2:在氧化酯化条件下的氧化反应>
本发明中,工序2为将下述式(i)表示的化合物及下述式(ii)表示的化合物的混合物在氧化酯化条件下进行氧化的工序。
予以说明,工序2中,将下述式(i)表示的化合物及下述式(ii)表示的化合物的混合物在氧化酯化条件下进行氧化时,产生如下的反应。
(式中,r1及r2如上所述。)
氧化酯化广义而言为由伯醇和醇得到酯的氧化反应的1种,更一般而言,为由相同的伯醇2分子得到酯二聚物1分子的反应,也有氧化的二聚化等的别称。在本发明中,是指由二氧戊环(式(ii)表示的化合物)得到酯二聚物(式(iv)表示的化合物)的反应。
作为氧化酯化的方法,例如有使用均一系或不均一系金属催化剂的方法、使用参考文献1(有机化学杂志(thejournaloforganicchemistry)、第69卷、5116-5119页、2004年)中记载的4-乙酰胺-2,2,6,6-四甲基-1-氧代哌啶鎓四氟硼酸盐和吡啶的方法、使用参考文献2(合成有机化学快报(synlett)、第23卷、2261-2265页、2012年)中记载的催化剂量的2,2,6,6-四甲基哌啶-1-氧基(以下,也称为“tempo”。)、氧化剂及吡啶的方法等。
本发明的目的是将二噁烷(式(i)表示的化合物)进行氧化,得到二噁烷酮(式(iii)表示的化合物)。另外,为了将反应中生成的二噁烷酮容易地与其它成分进行分离,有必要抑制可通过二氧戊环(式(ii)表示的化合物)的氧化而生成的上述式(vii)表示的化合物(以下,也称为“甲酰基二氧戊环”。)的生成量。
因此,在本发明中,在氧化酯化条件下进行氧化定义为满足下述3条件的氧化方法。
条件1:由二噁烷生成二噁烷酮
条件2:由二氧戊环生成酯二聚物
条件3:由二氧戊环生成的甲酰基二氧戊环的收率为10%以下0%以上
在本发明中,满足上述定义的任一种氧化方法均可以使用,但从得到高的反应活性的观点出发,优选选自使用含有参考文献1那样的有机硝酰自由基的氧合铵阳离子的盐和碱的氧化法、以及参考文献2那样的使用选自有机硝酰自由基、其n-羟基体及含有它们的氧合铵阳离子的盐中的化合物、氧化剂和碱的氧化法(以下,也称为“硝酰自由基法”。)中的氧化法,从二噁烷酮和酯二聚物的收率高、甲酰基二氧戊环的收率低的观点出发,优选硝酰自由基法,其中,更优选使用有机硝酰自由基和/或其n-羟基体、氧化剂和碱的氧化法。
(硝酰自由基法)
[硝酰自由基种]
在本反应中,作为硝酰自由基种,可以使用选自通过与氧化剂组合而具有对二噁烷及二氧戊环的氧化活性的任一种有机硝酰自由基、其n-羟基体及含有它们的氧合铵阳离子的盐中的化合物。
即,作为硝酰自由基种,优选使用选自有机硝酰自由基、其n-羟基体、及含有它们的氧合铵阳离子的盐中的至少1种化合物。
从得到高的氧化活性的观点出发,有机硝酰自由基优选为下述式(viii)表示的化合物、下述式(ix)表示的化合物或下述式(x)表示的化合物。即,硝酰自由基种优选为选自下述式(viii)表示的化合物、式(ix)表示的化合物或式(x)表示的化合物、它们的n-羟基体、及含有它们的氧合铵阳离子的盐中的化合物。
(式(viii)中,r4表示氢原子、卤素原子、羟基、烷氧基、酰氧基、烷氧基羰基、氨基、酰基氨基、磺酰氧基、n-烷基氨基甲酰氧基、羧基、氰基、异氰酸基、异硫代氰酸基、或氧代基。式(ix)中,r5及r6分别独立地表示氢原子或甲基;式(x)中,r7及r8分别独立地表示氢原子或甲基。)
式(viii)中,r4表示氢原子、卤素原子、羟基(-oh)、烷氧基、酰氧基、烷氧基羰基、氨基、酰基氨基、磺酰氧基、n-烷基氨基甲酰氧基、羧基(-c(=o)-oh)、氰基(-c≡n)、异氰酸基(-n=c=o)、异硫代氰酸基(-n=c=s)、或氧代(=o)基。式(viii)中,从获得性及以高收率得到本发明的酯二聚物的观点出发,r4优选为烷氧基、酰氧基、或酰基氨基。
所述卤素原子可列举氟原子、氯原子、溴原子、碘原子,从获得或制备容易且为低分子量的观点出发,优选氟原子、氯原子或溴原子。
所述烷氧基用-or9表示,r9表示一价的烃基,从获得或制备容易且为低分子量的观点出发,优选为碳原子数1~12的烷基、碳原子数2~12的烯基、碳原子数2~12的炔基、或碳原子数6~20的芳基,更优选为碳原子数1~6的烷基、碳原子数2~6的烯基、碳原子数2~6的炔基、或碳原子数6~14的芳基,进一步优选为碳原子数1~4的烷基、碳原子数2~4的烯基、碳原子数2~4的炔基、或碳原子数6~10的芳基,更进一步优选为甲基。所述r9可以用卤素原子取代氢原子的一部分。
所述酰氧基用-o(c=o)-r10表示,从获得或制备容易且为低分子量的观点出发,r10优选为氢原子、碳原子数1~12的烷基、碳原子数1~12的烯基、或碳原子数6~20的芳基,更优选为氢原子、碳原子数1~8的烷基、或碳原子数6~14的芳基,进一步优选为氢原子、碳原子数1~4的烷基、或碳原子数6~10的芳基,更进一步优选为甲基、乙基、或苯基,更进一步优选为苯基。
所述酰基氨基用-nh(c=o)-r11表示,从获得或制备容易且为低分子量的观点出发,r11优选为氢原子、碳原子数1~12的烷基、或碳原子数6~20的芳基,更优选为氢原子、碳原子数1~8的烷基、或碳原子数6~14的芳基,进一步优选为氢原子、碳原子数1~4的烷基、或碳原子数6~10的芳基,更进一步优选为甲基、乙基、或苯基,更进一步优选为甲基。
所述磺酰氧基用-o(o=s=o)-r12表示,从获得或制备容易且为低分子量的观点出发,r12优选为碳原子数1~12的烷基、或碳原子数6~20的芳基,更优选为碳原子数1~8的烷基、或碳原子数6~14的芳基,进一步优选为碳原子数1~4的烷基、或碳原子数6~10的芳基,更进一步优选为甲基、乙基、或对甲苯基,更进一步优选为甲基或对甲苯基。
作为硝酰自由基种,具体而言,可例示:tempo、4-羟基tempo、4-氨基-tempo、4-甲氧基-tempo(以下,也称为“4-ome-tempo”。)、4-乙氧基-tempo、4-苯氧基-tempo、4-乙酰氧基-tempo、4-苯并酰氧基-tempo(以下,也称为“4-obz-tempo”。)、4-甲基丙烯酸酯-tempo、4-乙酰胺-tempo(以下,也称为“4-nhac-tempo”。)、4-甲基磺酰氧基-tempo(以下,也称为“4-oms-tempo”。)、4-对甲苯磺酰氧基-tempo、4-氧代-tempo、2-氮杂金刚烷-n-羟基(以下,也称为“azadol”(日产化学工业株式会社制、商标)。)、2-氮杂金刚烷-n-氧基(以下,也称为“azado”。)、1-甲基-2-氮杂金刚烷-n-氧基(以下,也称为“1-me-azado”。)、9-氮杂降金刚烷-n-氧基(以下,也称为“nor-azado”。)、1,5-二甲基-9-氮杂降金刚烷-n-氧基(以下,也称为“dmm-azado”。)等。
从获得性及以高收率得到二噁烷酮的观点出发,作为硝酰自由基种,优选为选自4-甲氧基-tempo、4-苯并酰氧基-tempo、4-乙酰胺-tempo、4-甲基磺酰氧基-tempo、及azadol中的化合物,更优选为选自4-苯并酰氧基-tempo、4-乙酰胺-tempo、4-甲基磺酰氧基-tempo、及azadol中的化合物。
以下例示优选的化合物,但在本发明中,硝酰自由基种并不限定于这些化合物。
就选自有机硝酰自由基、其n-羟基体及含有它们的氧合铵阳离子的盐中的化合物的使用量而言,从确保充分的氧化活性的观点出发,相对于二噁烷和二氧戊环的混合物,优选摩尔比为0.0001以上,更优选摩尔比为0.0002以上,进一步优选摩尔比为0.0005以上。另外,从经济性的观点出发,优选摩尔比为0.1以下,更优选摩尔比为0.05以下,进一步优选摩尔比为0.02以下。
[氧化剂]
在本反应中,从反应性的观点出发,优选与上述的硝酰自由基种一起使用氧化剂。作为该氧化剂,能够将有机硝酰自由基或其n-羟基体氧化成氧合铵阳离子的任一种氧化剂都可以使用,但从抑制二噁烷酮或酯二聚物的水合或水解导致的收率降低的观点出发,优选由可以在有机溶剂中使用的含有卤素的化合物构成的氧化剂(以下,也称为“含卤素氧化剂”。)。作为含卤素氧化剂,可例示:由次氯酸钠五水合物、间氯过苯甲酸、三氯异氰脲酸(以下,也称为“tcca”。)、次氯酸叔丁酯(以下,也称为“tbuocl”。)、n-氯琥珀酸酰亚胺等含有氯的化合物构成的氧化剂(以下,也称为“含氯氧化剂”。)、由n-溴琥珀酸酰亚胺等含有溴的化合物构成的氧化剂(以下,也称为“含溴氧化剂”。)、(二氯碘)苯等具有多种卤素元素的含卤素氧化剂。就含卤素氧化剂而言,从以高收率得到本发明的酯二聚物的观点、以及氧化剂的稳定性、安全性及使用容易性的观点出发,优选为含氯氧化剂,更优选为选自tcca及tbuocl中的氧化剂,从获得性的观点出发,进一步优选为tcca。
予以说明,作为本发明的氧化剂,不包括以式(viii)表示的化合物、式(ix)表示的化合物或式(x)表示的化合物进行了单电子氧化的氧合铵阳离子为首的有机硝酰自由基或其n-羟基体的氧合铵阳离子。
从兼备二噁烷和二氧戊环的混合物的高的反应转化率和抑制甲酰基二氧戊环的生成量的观点出发,相对于二噁烷和二氧戊环的混合物的氧化活性种的摩尔比优选为1.0以上,更优选为1.1以上。另外,从经济性及废弃物量减少的观点出发,所述摩尔比优选为2.0以下,更优选为1.5以下。
予以说明,氧化活性种在含氯氧化剂的情况下是指氯原子,在tcca的情况下,在1摩尔分子中存在3摩尔的氧化活性种。
[碱]
在本反应中,以通过氧化剂的消耗而将副生的酸进行中和等的目的使用碱。就碱而言,只要与二噁烷和二氧戊环的混合物、催化剂或氧化剂直接引起副反应、不阻碍目的的氧化反应,则任一种碱都可以使用,从以弱碱性抑制副反应的观点出发,优选具有吡啶骨架的杂环式芳香族胺。为了抑制其使用量,所述具有吡啶骨架的杂环式芳香族胺可以与无机碱并用,从以高收率得到二噁烷酮的观点出发,更优选单独使用具有吡啶骨架的杂环式芳香族胺。
作为具有吡啶骨架的杂环式芳香族胺,可例示吡啶、烷基取代吡啶、多环式的喹啉类、作为吡啶二聚物的联吡啶类等。具体而言,可列举:吡啶、2-甲基吡啶、3-甲基吡啶、4-甲基吡啶、2-乙基吡啶、3-乙基吡啶、4-乙基吡啶、2,6-二甲吡啶、3,5-二甲吡啶、2,3,5-可力丁、2,4,6-可力丁、5-乙基-2-甲基吡啶、3,5-二乙基吡啶、2,2’-联吡啶、2,4’-联吡啶、4,4’-联吡啶、喹啉等。
在具有吡啶骨架的杂环式芳香族胺中,优选选择与二噁烷酮的沸点差大且通过蒸馏的分离容易的具有吡啶骨架的杂环式芳香族胺而使用,从获得性的观点出发,优选选自吡啶及5-乙基-2-甲基吡啶中的胺,从在反应结束后由胺盐再生胺时的回收容易性的观点出发,优选非水溶性的具有吡啶骨架的杂环式芳香族胺,从收率的观点出发,优选选自吡啶、3,5-二甲吡啶、2,6-二甲吡啶、3-乙基吡啶、4-乙基吡啶及5-乙基-2-甲基吡啶中的胺,更优选选自吡啶、3,5-二甲吡啶、3-乙基吡啶、4-乙基吡啶及5-乙基-2-甲基吡啶中的胺。
从将源自氧化剂的酸完全中和并抑制二噁烷及二氧戊环的缩醛基的分解的观点出发,相对于二噁烷和二氧戊环的混合物的碱的摩尔比优选为1.0以上,更优选为1.1以上,进一步优选为1.2以上,更进一步优选为1.3以上。另外,从经济性及剩余碱的回收容易性的观点出发,所述摩尔比优选为2.5以下,更优选为2.0以下,进一步优选为1.7以下。
[溶剂]
在本反应中,能够以无溶剂或溶剂使用条件的任一种实施,但从在源自使用的氧化剂或在反应时副生的氧化剂的还原物或盐为固体的情况下使这些物质溶解的观点、及降低反应液的粘度且容易搅拌的观点出发,优选溶剂使用条件。只要相对于二噁烷和二氧戊环的混合物、氧化剂及碱为惰性,则任一种溶剂都可以使用,例如,使用tcca作为氧化剂的情况下,从tcca的溶解性及获得性的观点出发,优选选自丙酮、2-丁酮、环戊酮、乙腈及二氯甲烷中的溶剂,更优选选自丙酮、2-丁酮、乙腈及二氯甲烷中的溶剂,进一步优选为选自丙酮及2-丁酮中的溶剂。另外,从本发明的二噁烷酮的生产率的观点出发,进一步优选乙腈。
溶剂可以单独使用1种,也可以并用2种以上。
溶剂的使用量没有特别限定,从操作性的观点及以高收率得到二噁烷酮的观点出发,相对于反应体系整体的溶剂的使用量优选为20质量%以上,更优选为30质量%以上,进一步优选为40质量%以上,更进一步优选为50质量%以上,更进一步优选为60质量%以上,从生产率的观点出发,相对于反应体系整体的溶剂的使用量优选为90质量%以下,更优选为85质量%以下,进一步优选为80质量%以下。
[反应过程]
在本反应中,对各原料的进料顺序等没有限制,由于为发热的氧化反应,因此,从反应液的温度控制的容易性及安全性的观点出发,优选在氧化剂以外的原料的混合物或混合溶液中滴加氧化剂或氧化剂溶液的方法。
从抑制设备负荷及反应液的粘度上升的观点出发,氧化剂或氧化剂溶液滴加中的反应液的温度优选为-15℃以上,更优选为-10℃以上。另外,从抑制高温下的分解等的副反应、以高收率得到二噁烷酮的观点出发,优选为25℃以下,更优选为10℃以下。氧化剂或氧化剂溶液滴加结束后,继续反应至二噁烷及二氧戊环总量进行反应、或残存量的降低停止,就反应液的温度而言,从促进二噁烷的反应的观点出发,优选为-10℃以上,更优选为-5℃以上,从抑制副反应的观点出发,优选为50℃以下,更优选为30℃以下。
在反应结束时,从抑制副反应及安全性的观点出发,优选添加将残留氧化剂完全消耗的反应终止剂。反应终止剂只要不易与二噁烷酮等氧化产物反应、且与氧化剂反应,则任一种化合物都可以使用,但从获得性及容易进行二噁烷酮的精制的观点出发,优选醇。所述醇优选为伯醇或仲醇,从抑制与酯二聚物的酯交换的观点出发,更优选为仲醇。另外,优选碳原子数1以上12以下的醇。
反应停止剂的添加量没有特别限定。
<工序3:二噁烷酮的分离、精制>
本发明中,优选在工序2之后,具有将1,3-二噁烷-5-酮类(二噁烷酮、式(iii)表示的化合物)进行分离的工序(工序3)。通过工序3,二噁烷酮被精制。
在工序3中,从效率性的观点出发,优选盐或氧化剂的还原物等的固体物质通过过滤或油水提取而进行分离,酯二聚物、甲酰基二氧戊环及残留碱通过蒸馏或柱色谱法而进行分离。
在二噁烷酮和酯二聚物的分离中,从可利用大的沸点差容易地进行分离的观点出发,更优选通过蒸馏的分离。
通过蒸馏的分离无论在单蒸馏条件下还是在精馏条件下都可以实施,但从以高的蒸馏收率得到高纯度的二噁烷酮的观点出发,优选在精馏条件下进行。作为精馏条件,从二噁烷酮的高纯度化的观点出发,精馏塔的理论塔板数优选为2塔板以上,更优选为5塔板以上,回流比优选为0.1以上,更优选为0.5以上。另外,从二噁烷酮精制的生产率的观点出发,精馏塔的理论塔板数优选为20塔板以下,更优选为10塔板以下,回流比优选为20以下,更优选为10以下。
[二羟基丙酮的制造方法]
如上述那样得到的二噁烷酮作为各种有用化合物的合成中间体是重要的,例如,通过将由工序3分离的二噁烷酮进行脱缩醛化,可以制造二羟基丙酮。
予以说明,二噁烷酮的脱缩醛化可以通过水解而进行,
具体而言,如非专利文献1及参考文献3(化学工程杂志(chemicalengineeringjournal)、第229卷、234-238页、2013年)中所记载的那样,可例示将二噁烷酮在水及酸(例如、盐酸或强酸性阳离子交换树脂等)的存在下进行水解的方法。
二羟基丙酮可以不精制而使用,也可以进行精制而使用。进行精制而使用的情况下,按照常规方法进行精制即可,可例示例如非专利文献1中所记载的、将醛或酮通过有机溶剂提取等而除去之后、由水-乙醇混合溶液进行再结晶的方法等。
[5-氨基-1,3-二噁烷类(丝氨醇保护体)的制造方法]
通过将如上述那样得到的二噁烷酮进行还原氨基化,可以制造下述式(xi)表示的5-氨基-1,3-二噁烷类(丝氨醇保护体)。
(式(xi)中,r1及r2与式(i)或式(ii)中的r1及r2同义。)
作为将二噁烷酮进行还原氨基化的方法,可例示例如非专利文献2中记载的方法,具体而言,可例示在无水氨-乙醇溶液中加入二噁烷酮,加入钯担载碳作为催化剂,在氢气氛下进行反应的方法。另外,也可例示使用甲酸铵作为氢源及氨源的方法、或使用苄胺作为胺进行还原氨基化之后除去苄基的方法等。
对由所述工序2得到的二噁烷酮,在不将二噁烷酮和酯二聚物进行分离并进行还原氨基化而制造丝氨醇保护体的情况下,可以通过与所述工序3同样的方法将丝氨醇保护体进行分离、精制。
[2-氨基-1,3-丙二醇(丝氨醇)的制造方法]
将如上述那样得到的二噁烷酮进行还原氨基化而制造5-氨基-1,3-二噁烷类,进一步进行脱缩醛化,由此可以制造丝氨醇。
作为将二噁烷酮进行还原氨基化的方法,可例示前述的方法。
另外,脱缩醛化例如如参考文献4(欧州专利第0643055号说明书)中所记载的那样,可例示在水及酸(例如、盐酸)的存在下将5-氨基-1,3-二噁烷类进行水解的方法。
将2-氨基-1,3-丙二醇进行精制而使用的情况下,按照常规方法进行即可,可例示例如参考文献4中所记载的在水解后馏去水、通过将残留物从丙酮中进行再结晶而得到2-氨基-1,3-丙二醇的盐酸盐的方法。
由本发明得到的1,3-二噁烷-5-酮类作为各种有用化合物的合成中间体是重要的,优选用于医药品、化学品等的制造。
本发明进而公开以下的[1]~[39]。
[1]一种1,3-二噁烷-5-酮类的制造方法,其中,以下述式(i)表示的化合物和下述式(ii)表示的化合物的混合物为原料,并且,具有将所述混合物在氧化酯化条件下进行氧化的工序(工序2)。
(式(i)及式(ii)中,r1及r2分别独立地表示氢原子或一价的烃基,或者r1及r2表示相互键合而形成环结构的二价的烃基。)
[2]根据[1]所述的1,3-二噁烷-5-酮类的制造方法,其中,式(i)及式(ii)中,r1为氢原子。
[3]根据[1]所述的1,3-二噁烷-5-酮类的制造方法,其中,式(i)及式(ii)中,r1优选为氢原子,r2优选为氢原子或碳原子数1以上20以下的一价的烃基,作为r2的烃基,优选为烷基或芳基,该烷基的碳原子数优选为1以上,优选为20以下,更优选为18以下,进一步优选为16以下,更进一步优选为14以下,更进一步优选为12以下,更进一步优选为10以下,更进一步优选为8以下,更进一步优选为6以下,更进一步优选为4以下,更进一步优选为2以下,这些烷基可以为直链,也可以为支链,另外,r2的芳基的碳原子数优选为6以上,优选为20以下,更优选为18以下,进一步优选为16以下,更进一步优选为14以下,更进一步优选为12以下,更进一步优选为10以下,更进一步优选为8以下,更进一步优选为6以下,所述r2优选为氢原子或碳原子数1以上20以下的一价的烃基,更优选为氢原子、碳原子数1以上8以下的直链烷基、碳原子数1以上8以下的支链烷基或碳原子数6以上20以下的芳基,进一步优选为氢原子、甲基或苯基,更进一步优选为氢原子。
[4]根据[1]所述的1,3-二噁烷-5-酮类的制造方法,其中,式(i)及式(ii)中,优选r1为碳原子数1以上8以下的一价的烃基且r2为碳原子数1以上8以下的一价的烃基,更优选r1为碳原子数1以上8以下的烷基且r2为碳原子数1以上8以下的烷基,进一步优选r1为碳原子数1或2的烷基且r2为碳原子数1以上6以下的烷基,更进一步优选r1为碳原子数1或2的烷基且r2为碳原子数1以上4以下的烷基,更进一步优选r1为甲基且r2为甲基或乙基,更进一步优选r1为甲基且r2为甲基。
[5]根据[1]所述的1,3-二噁烷-5-酮类的制造方法,其中,式(i)及式(ii)中,r1及r2为相互键合而形成环结构的二价的烃基,优选为碳原子数2以上7以下的二价的烃基,更优选为碳原子数3以上6以下的二价的烃基,进一步优选为碳原子数4以上5以下的二价的烃基,更进一步优选为碳原子数5的二价的烃基,含有r1及r2的环结构优选为3~8元环,更优选为4~7元环,进一步优选为5~6元环,更进一步优选为6元环,含有r1及r2的环结构优选为环烷烃结构,更优选为碳原子数5或6的环结构(环戊烷环或环己烷环),进一步优选为环己烷环。
[6]根据[1]~[5]中任一项所述的1,3-二噁烷-5-酮类的制造方法,其中,式(i)表示的化合物和下述式(ii)表示的化合物的混合物通过将甘油和下述式(v)表示的化合物、或其多聚物在酸催化剂存在下进行缩醛化的方法(方法1)、或将甘油和下述式(vi)表示的化合物在酸催化剂存在下进行缩醛交换的方法(方法2)而制造。
(式(v)及式(vi)中,r1及r2分别独立地表示氢原子或一价的烃基,或者r1及r2表示相互键合而形成环结构的二价的烃基。另外,式(vi)中,r3分别独立地表示一价的烃基、优选选自碳原子数1以上8以下的烃基中的基团、更优选碳原子数1以上3以下的一价的烃基、进一步优选碳原子数1以上3以下的一价的烷基、更进一步优选甲基。)
[7]根据[6]所述的1,3-二噁烷-5-酮类的制造方法,其中,式(v)及式(vi)中,r1为氢原子。
[8]根据[6]所述的1,3-二噁烷-5-酮类的制造方法,其中,式(v)及式(vi)中,r1优选为氢原子,r2优选为氢原子或碳原子数1以上20以下的一价的烃基,作为r2的烃基,优选为烷基或芳基,该烷基的碳原子数优选为1以上,优选为20以下,更优选为18以下,进一步优选为16以下,更进一步优选为14以下,更进一步优选为12以下,更进一步优选为10以下,更进一步优选为8以下,更进一步优选为6以下,更进一步优选为4以下,更进一步优选为2以下,这些烷基可以为直链,也可以为支链,另外,r2的芳基的碳原子数优选为6以上,优选为20以下,更优选为18以下,进一步优选为16以下,更进一步优选为14以下,更进一步优选为12以下,更进一步优选为10以下,更进一步优选为8以下,更进一步优选为6以下,所述r2优选为氢原子或碳原子数1以上20以下的一价的烃基,更优选为氢原子、碳原子数1以上8以下的直链烷基、碳原子数1以上8以下的支链烷基或碳原子数6以上20以下的芳基,进一步优选为氢原子、甲基或苯基,更进一步优选为氢原子。
[9]根据[6]所述的1,3-二噁烷-5-酮类的制造方法,其中,式(v)及式(vi)中,优选r1为碳原子数1以上8以下的一价的烃基且r2为碳原子数1以上8以下的一价的烃基,更优选r1为碳原子数1以上8以下的烷基且r2为碳原子数1以上8以下的烷基,进一步优选r1为碳原子数1或2的烷基且r2为碳原子数1以上6以下的烷基,更进一步优选r1为碳原子数1或2的烷基且r2为碳原子数1以上4以下的烷基,更进一步优选r1为甲基且r2为甲基或乙基,更进一步优选r1为甲基且r2为甲基。
[10]根据[6]所述的1,3-二噁烷-5-酮类的制造方法,其中,式(v)及式(vi)中,r1及r2为相互键合而形成环结构的二价的烃基,优选为碳原子数2以上7以下的二价的烃基,更优选为碳原子数3以上6以下的二价的烃基,进一步优选为碳原子数4以上5以下的二价的烃基,更进一步优选为碳原子数5的二价的烃基,含有r1及r2的环结构优选为3~8元环,更优选为4~7元环,进一步优选为5~6元环,更进一步优选为6元环,含有r1及r2的环结构优选为环烷烃结构,更优选为碳原子数5或6的环结构(环戊烷环或环己烷环),进一步优选为环己烷环。
[11]根据[1]~[10]所述的1,3-二噁烷-5-酮类的制造方法,其中,在工序2中,优选采用选自使用含有有机硝酰自由基的氧合铵阳离子的盐和碱的氧化法、以及使用选自有机硝酰自由基、其n-羟基体及含有它们的氧合铵阳离子的盐中的化合物、氧化剂和碱的氧化法(以下,「硝酰自由基法」也称为。)中的氧化法。
[12]根据[1]~[11]所述的1,3-二噁烷-5-酮类的制造方法,其中,在工序2中,采用使用选自有机硝酰自由基、其n-羟基体、及含有它们的氧合铵阳离子的盐中的1种以上的化合物、氧化剂和碱的氧化法(硝酰自由基法)。
[13]根据[11]或[12]所述的1,3-二噁烷-5-酮类的制造方法,其中,所述有机硝酰自由基为下述式(viii)表示的化合物、下述式(ix)表示的化合物、或下述式(x)表示的化合物。
(式(viii)中,r4表示氢原子、卤素原子、羟基、烷氧基、酰氧基、烷氧基羰基、氨基、酰基氨基、磺酰氧基、n-烷基氨基甲酰氧基、羧基、氰基、异氰酸基、异硫代氰酸基、或氧代基,优选表示烷氧基、酰氧基、或酰基氨基。式(ix)中,r5及r6分别独立地表示氢原子或甲基。式(x)中,r7及r8分别独立地表示氢原子或甲基。)
[14]根据[11]~[13]中任一项所述的1,3-二噁烷-5-酮类的制造方法,其中,所述选自有机硝酰自由基、其n-羟基体、及含有它们的氧合铵阳离子的盐中的1种以上的化合物优选为tempo、4-羟基tempo、4-氨基-tempo、4-甲氧基-tempo(以下,也称为“4-ome-tempo”。)、4-乙氧基-tempo、4-苯氧基-tempo、4-乙酰氧基-tempo、4-苯并酰氧基-tempo(以下,也称为“4-obz-tempo”。)、4-甲基丙烯酸酯-tempo、4-乙酰胺-tempo(以下,也称为“4-nhac-tempo”。)、4-甲基磺酰氧基-tempo(以下,也称为“4-oms-tempo”。)、4-对甲苯磺酰氧基-tempo、4-氧代-tempo、2-氮杂金刚烷-n-羟基(以下,也称为“azadol”。)、2-氮杂金刚烷-n-氧基(以下,也称为“azado”。)、1-甲基-2-氮杂金刚烷-n-氧基(以下,也称为“1-me-azado”。)、9-氮杂降金刚烷-n-氧基(以下,也称为“nor-azado”。)、1,5-二甲基-9-氮杂降金刚烷-n-氧基(以下,也称为“dmm-azado”。),更优选为选自4-甲氧基-tempo、4-苯并酰氧基-tempo、4-乙酰胺-tempo、4-甲基磺酰氧基-tempo、及azadol中的化合物,进一步优选为选自4-苯并酰氧基-tempo、4-乙酰胺-tempo、4-甲基磺酰氧基-tempo、及azadol中的化合物。
[15]根据[12]~[14]中任一项所述的1,3-二噁烷-5-酮类的制造方法,其中,所述选自有机硝酰自由基、其n-羟基体及含有它们的氧合铵阳离子的盐中的化合物的使用量相对于式(i)表示的化合物和下述式(ii)表示的化合物的混合物,优选摩尔比为0.0001以上,更优选摩尔比为0.0002以上,进一步优选摩尔比为0.0005以上,优选摩尔比为0.1以下,更优选摩尔比为0.05以下,进一步优选摩尔比为0.02以下。
[16]根据[11]~[15]中任一项所述的1,3-二噁烷-5-酮类的制造方法,其中,所述氧化剂优选为由含有卤素的化合物构成的氧化剂(含卤素氧化剂),更优选为由含有氯的化合物构成的氧化剂(含氯氧化剂),进一步优选为选自三氯异氰脲酸及次氯酸叔丁酯中的氧化剂,更进一步优选为三氯异氰脲酸。
[17]根据[11]~[16]中任一项所述的1,3-二噁烷-5-酮类的制造方法,其中,相对于所述式(i)表示的化合物和所述式(ii)表示的化合物的混合物,氧化剂的氧化活性种的摩尔比优选为1.0以上,更优选为1.1以上,优选为2.0以下,更优选为1.5以下。
[18]根据[11]~[17]中任一项所述的1,3-二噁烷-5-酮类的制造方法,其中,所述碱优选为具有吡啶骨架的杂环式芳香族胺。
[19]根据[18]所述的1,3-二噁烷-5-酮类的制造方法,其中,所述具有吡啶骨架的杂环式芳香族胺优选为选自吡啶、3,5-二甲吡啶、2,6-二甲吡啶、3-乙基吡啶、4-乙基吡啶及5-乙基-2-甲基吡啶中的至少1个,更优选为选自吡啶、3,5-二甲吡啶、3-乙基吡啶、4-乙基吡啶及5-乙基-2-甲基吡啶中的至少1个。
[20]根据[11]~[19]中任一项所述的1,3-二噁烷-5-酮类的制造方法,其中,相对于所述式(i)表示的化合物和所述式(ii)表示的化合物的混合物,所述碱的摩尔比优选为1.0以上,更优选为1.1以上,进一步优选为1.2以上,更进一步优选为1.3以上,优选为2.5以下,更优选为2.0以下,进一步优选为1.7以下。
[21]根据[1]~[20]中任一项所述的1,3-二噁烷-5-酮类的制造方法,其中,在所述工序2中优选使用溶剂,该溶剂优选为选自丙酮、2-丁酮、环戊酮、乙腈及二氯甲烷中的溶剂,更优选为选自丙酮、2-丁酮及乙腈中的溶剂,进一步优选为选自丙酮及2-丁酮中的溶剂。
[22]根据[21]所述的1,3-二噁烷-5-酮类的制造方法,其中,相对于反应体系整体的所述溶剂的使用量优选为20质量%以上,更优选为30质量%以上,进一步优选为40质量%以上,更进一步优选为50质量%以上,更进一步优选为60质量%以上,优选为90质量%以下,更优选为85质量%以下,进一步优选为80质量%以下。
[23]根据[1]~[22]中任一项所述的1,3-二噁烷-5-酮类的制造方法,其中,在所述工序2中,优选在氧化剂以外的原料的混合物或混合溶液中滴加氧化剂或氧化剂溶液。
[24]根据[23]所述的1,3-二噁烷-5-酮类的制造方法,其中,所述氧化剂或氧化剂溶液滴加中的反应液的温度优选为-15℃以上,更优选为-10℃以上,优选为25℃以下,更优选为10℃以下。
[25]根据[23]或[24]所述的1,3-二噁烷-5-酮类的制造方法,其中,在所述氧化剂或氧化剂溶液滴加结束后,继续反应至二噁烷及二氧戊环总量进行反应、或残存量的降低停止。
[26]根据[25]所述的1,3-二噁烷-5-酮类的制造方法,其中,所述反应液的温度优选为-10℃以上,更优选为-5℃以上,优选为50℃以下,更优选为30℃以下。
[27]根据[1]~[26]中任一项所述的1,3-二噁烷-5-酮类的制造方法,其中,优选将醇用作工序2中的反应终止剂。
[28]根据[27]所述的1,3-二噁烷-5-酮类的制造方法,其中,所述反应终止剂优选为伯醇或仲醇,更优选为仲醇。
[29]根据[27]或[28]所述的1,3-二噁烷-5-酮类的制造方法,其中,所述反应停止剂优选为碳原子数1以上12以下的醇。
[30]根据[1]~[29]中任一项所述的1,3-二噁烷-5-酮类的制造方法,其中,在所述氧化酯化条件下进行氧化的工序(工序2)满足下述条件1~3。
条件1:由二噁烷生成二噁烷酮
条件2:由二氧戊环生成酯二聚物
条件3:由二氧戊环生成的甲酰基二氧戊环的收率为10%以下0%以上
[31]根据[1]~[30]中任一项所述的1,3-二噁烷-5-酮类的制造方法,其中,具有在所述工序2之后将1,3-二噁烷-5-酮类进行分离的工序(工序3)。
[32]根据[31]所述的1,3-二噁烷-5-酮类的制造方法,其中,所述工序3中的分离为通过蒸馏的分离。
[33]根据[32]所述的1,3-二噁烷-5-酮类的制造方法,其中,所述通过蒸馏的分离优选在精馏条件下进行。
[34]根据[33]所述的1,3-二噁烷-5-酮类的制造方法,其中,就精馏条件而言,精馏塔的理论塔板数优选为2塔板以上,更优选为5塔板以上,回流比优选为0.1以上,更优选为0.5以上,精馏塔的理论塔板优选为20塔板以下,更优选为10塔板以下,回流比优选为20以下,更优选为10以下。
[35]一种二羟基丙酮的制造方法,其中,将在[31]~[34]中任一项中分离的1,3-二噁烷-5-酮类进行脱缩醛化。
[36]一种2-氨基-1,3-丙二醇的制造方法,其中,将在[31]~[34]中任一项中分离的1,3-二噁烷-5-酮类进行还原氨基化,进一步进行脱缩醛化。
[37]一种二羟基丙酮的制造方法,其中,具有用[1]~[34]中任一项的制造方法制造1,3-二噁烷-5-酮类的工序、及将该工序中制造的1,3-二噁烷-5-酮类进行脱缩醛化的工序。
[38]一种2-氨基-1,3-丙二醇的制造方法,其中,具有用[1]~[34]中任一项的制造方法制造1,3-二噁烷-5-酮类的工序、及将该工序中制造的1,3-二噁烷-5-酮类进行还原氨基化,进一步进行脱缩醛化的工序。
[39]一种5-氨基-1,3-二噁烷类的制造方法,其中,具有用[1]~[34]中任一项的制造方法制造1,3-二噁烷-5-酮类的工序、及将该工序中制造的1,3-二噁烷-5-酮类进行还原氨基化的工序。
实施例
[化合物的鉴定]
以下的制造例、实施例或比较例(以下,也记载为“实施例等”。)中得到的各化合物使用核磁共振装置(nmr、agilenttechnologies,inc.制、型号:agilent400-mrdd2)、红外分光光度计(ir、株式会社堀场制作所制、型号:ft-710)、气相色谱质谱仪(gc-ms、agilenttechnologies,inc.制、型号:agilent5975c),通过光谱分析进行鉴定。
[制造或精制的化合物的纯度]
在以下的实施例等中,制造或精制的化合物的纯度通过使用有气相色谱(agilenttechnologies,inc.制、型号:agilent6850)的分析(gc分析)而求出。予以说明,与纯度有关的“%”是指“gc%”,在反应原料或高纯度标准产品的纯成分量换算时,使用该数值。
[单位、转化率及收率]
以下的实施例等所示的反应原料的转化率及产物的收率通过内部标准法定量gc分析而求出。定量分析中需要的标准曲线使用由市售标准产品或反应混合物通过蒸馏或硅胶柱色谱法精制的高纯度标准产品而制作。其中,甲酰基二氧戊环的收率代用对应的二噁烷酮的标准曲线而算出。
[gc及gc-ms的测定条件]
柱:ultraalloy-1(ms/ht)(frontierlaboratoriesltd.、商标、内径0.25mm、膜厚0.15μm、长度30m)
[gc及gc-ms的测定条件]
载气:氦气、1.0ml/min
注入条件:250℃、分流比1/50
检测条件:fid方式、220℃
柱温度条件:在40℃下保持5分钟后,以10℃/分钟升温至350℃
内部标准化合物:正十二烷
电离方式:ei
离子源温度:230℃
接口温度:350℃
制造例1:作为原料的2-苯基-1,3-二噁烷-5-醇和4-羟基甲基-2-苯基-1,3-二氧戊环的混合物的制造
在制造例1中进行的反应如下所述。
在安装有迪安-斯塔克装置的1l烧瓶中装入甘油184g(纯度100%、2.00摩尔)、苯甲醛238g(纯度98.0%、2.20摩尔)、amberlyst15dry18g(强酸性阳离子交换树脂、dowchemicalcompany、商标)、正己烷50g,一边将反应中副生的水除去至反应体系外,一边使其回流6小时。冷却后,将离子交换树脂进行过滤分离,将滤液进行gc分析,结果:由顺式及反式-2-苯基-1,3-二噁烷-5-醇和顺式及反式-4-羟基甲基-2-苯基-1,3-二氧戊环构成的4种异构体混合物的反应收率为91%。
接着,将滤液转移至安装有克氏蒸馏头的500ml烧瓶,加热至50℃之后,缓慢地进行减压而馏去正己烷,进一步在0.13kpa(绝对压力)的减压下进行单蒸馏,得到在馏分温度110~120℃下作为无色液体馏出的异构体混合物317g。纯度为100%,蒸馏收率为97%。
在参考文献5(催化杂志(journalofcatalysis)、第245卷、428-435页、2007年)中记载有各异构体的2位的质子的1h-nmr信号归属。由该信息和1h-nmr分析求出的2-苯基-1,3-二噁烷-5-醇和4-羟基甲基-2-苯基-1,3-二氧戊环的异构体比率为49对51。
<异构体混合物的光谱数据>
·ir(neat、cm-1):3429(br)、2991、2937、2856、1408、1151、1082、1039。
制造例2:作为原料的2-苯基-1,3-二噁烷-5-醇和4-羟基甲基-2-苯基-1,3-二氧戊环的混合物的制造
在制造例2中进行的反应如下所述。
在100ml烧瓶中装入甘油9.21g(纯度100%、100毫摩尔)、苯甲醛二甲基缩醛17.1g(纯度98.0%、110毫摩尔)、amberlyst360.50g(强酸性阳离子交换树脂、dowchemicalcompany、商标)、二氯甲烷23g,在氮气氛下、在25℃下搅拌6小时。将离子交换树脂进行过滤分离,从滤液中馏去二氯甲烷之后,进行gc分析,结果:由顺式及反式-2-苯基-1,3-二噁烷-5-醇和顺式及反式-4-羟基甲基-2-苯基-1,3-二氧戊环构成的4种异构体混合物的反应收率为77%。另外,由参考文献5的信息和1h-nmr分析求出的2-苯基-1,3-二噁烷-5-醇和4-羟基甲基-2-苯基-1,3-二氧戊环的异构体比率为55对45。
制造例3:作为原料的2-甲基-1,3-二噁烷-5-醇和4-羟基甲基-2-甲基-1,3-二氧戊环的混合物的制造
在制造例3中进行的反应如下所述。
在安装有迪安-斯塔克装置的500ml烧瓶中装入甘油184g(纯度100%、2.00摩尔)、三聚乙醛117g(纯度98.0%、868毫摩尔)、甲磺酸981mg(纯度98.0%、10.0毫摩尔)、正己烷40g,一边将反应中副生的水除去至反应体系外,一边使其回流5小时。冷却后,用乙醇钠的20%乙醇溶液3.50g(作为乙醇钠,为700mg、10.3毫摩尔)进行中和。将反应液进行分析,结果:由顺式及反式-2-甲基-1,3-二噁烷-5-醇和顺式及反式-4-羟基甲基-2-甲基-1,3-二氧戊环构成的4种异构体混合物的反应收率为71%。
接着,将反应液转移至安装有克氏蒸馏头的500ml烧瓶,加热至50℃之后,缓慢地进行减压而馏去正己烷和乙醇,进一步在0.67kpa(绝对压力)的减压下进行单蒸馏,得到在馏分温度62~70℃下作为无色液体馏出的由顺式及反式-2-甲基-1,3-二噁烷-5-醇和顺式及反式-4-羟基甲基-2-甲基-1,3-二氧戊环构成的4种异构体混合物160g。纯度为100%,蒸馏收率为96%。
在参考文献6(四面体(tetrahedron)、第71卷、第20号、3032-3038页、2015年)中记载有各异构体的2位的质子的1h-nmr信号归属。由该信息和1h-nmr分析求出的2-甲基-1,3-二噁烷-5-醇和4-羟基甲基-2-甲基-1,3-二氧戊环的异构体比率为70对30。
<异构体混合物的光谱数据>
·ir(neat、cm-1):3415(br)、2856、1456、1394、1149、1086。
制造例4:作为原料的2-正庚基-1,3-二噁烷-5-醇和4-羟基甲基-2-正庚基-1,3-二氧戊环的混合物的制造
在制造例4中进行的反应如下所述。
在安装有迪安-斯塔克装置的300ml烧瓶中装入甘油69.1g(纯度100%、750毫摩尔)、正辛醛98.1g(纯度98.0%、750毫摩尔)、甲磺酸368mg(纯度98.0%、3.75毫摩尔)、正己烷18g,一边将反应中副生的水除去至反应体系外,一边使其回流3小时。冷却后,用乙醇钠的20%乙醇溶液1.30g(作为乙醇钠,为260mg、3.82毫摩尔)进行中和。将反应液进行分析,结果:由顺式及反式-2-正庚基-1,3-二噁烷-5-醇和顺式及反式-4-羟基甲基-2-正庚基-1,3-二氧戊环构成的4种异构体混合物的反应收率为100%。
接着,将反应液转移至安装有克氏蒸馏头的200ml烧瓶,加热至50℃之后,缓慢地进行减压而馏去正己烷和乙醇,进一步在67pa(绝对压力)的减压下进行单蒸馏,得到在馏分温度95~102℃下作为无色液体馏出的由顺式及反式-2-正庚基-1,3-二噁烷-5-醇和顺式及反式-4-羟基甲基-2-正庚基-1,3-二氧戊环构成的4种异构体混合物135g。纯度为99%,蒸馏收率为89%。
在参考文献7(绿色化学(greenchemistry)、第12卷、2225-2231页、2010年)中记载有各异构体的2位的质子的1h-nmr信号归属。由该信息和1h-nmr分析求出的2-庚基-1,3-二噁烷-5-醇和4-羟基甲基-2-庚基-1,3-二氧戊环的异构体比率为57对43。
<异构体混合物的光谱数据>
·ir(neat、cm-1):3479(br)、2954、2854、1462、1394、1146、1043。
实施例1:1,3-二噁烷-5-酮的制造
在实施例1中进行的反应如下所述。
实施例1-1
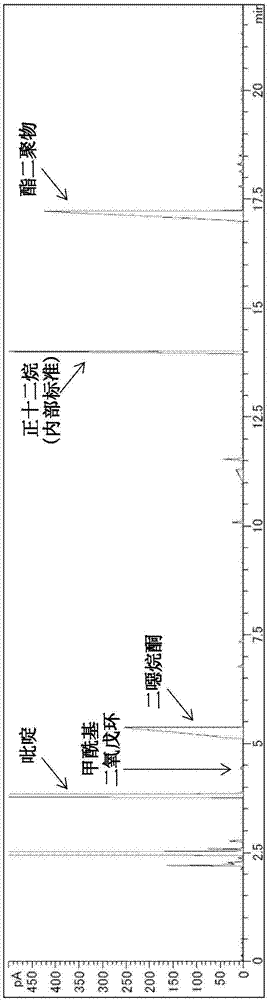
在安装有100ml滴液漏斗的1l烧瓶中装入1,3-二噁烷-5-醇和4-羟基甲基-1,3-二氧戊环的混合物63.7g(东京化成工业株式会社商品、商品名甘油缩甲醛(glycerolformal)、纯度98.0%、600毫摩尔、由参考文献5的信息和1h-nmr分析求出的1,3-二噁烷-5-醇和4-羟基甲基-1,3-二氧戊环的异构体比率58对42)、2-羟基-2-氮杂金刚烷93.8mg(azadol、日产化学工业株式会社、商标、纯度98.0%、0.60毫摩尔)、吡啶71.5g(纯度99.5%、900毫摩尔)、乙腈150g,一边进行冷却,一边在氮气氛下进行搅拌。分成3次在滴液漏斗中装入将三氯异氰脲酸58.7g(tcca、纯度95.0%、240毫摩尔)溶解于乙腈150g而形成的溶液,一边以烧瓶内的反应液温度控制在-2℃~2℃的范围的方式调节滴加速度,一边用3.5小时滴加。一边停止冷却而将反应液温度升温至20℃左右,一边进一步继续搅拌4小时,最后添加2-丙醇7.23g(纯度99.7%、120毫摩尔),进一步搅拌20分钟而完成反应。过滤分离副生的粉末状固体之后,在馏去了乙腈的反应液中添加叔丁基甲醚100g,重复2次析出的粉末状固体的过滤分离和溶剂馏去,得到橙色油状粗产物70.5g。将粗产物进行gc分析,结果:1,3-二噁烷-5-醇的转化率为100%,1,3-二噁烷-5-酮的收率为90%,4-羟基甲基-1,3-二氧戊环的转化率为100%,1,3-二氧戊环-4-羧酸(1,3-二氧戊环-4-基)甲酯的收率为95%,4-甲酰基-1,3-二氧戊环的收率为1%。
在安装有理论塔板6塔板的填充式蒸馏塔(填充物:海利-帕克填料no.2)的200ml梨形烧瓶中装入粗产物65.0g,一边馏去残留溶剂和吡啶,一边减压至0.67kpa(绝对压力)之后,将回流比设定为3,得到在馏分温度42~43℃下作为无色液体馏出的1,3-二噁烷-5-酮27.4g。纯度为99.2%,蒸馏收率为92%。进而,将压力变更为0.13kpa(绝对压力),将回流比变更为0.1,得到在馏分温度89~91℃下作为淡黄色液体馏出的1,3-二氧戊环-4-羧酸(1,3-二氧戊环-4-基)甲酯21.9g。纯度为98.8%,蒸馏收率为96%。由13c-nmr分析暗示:该酯二聚物为由2组外消旋体构成的4种立体异构体混合物。
图1中示出实施例1-1中得到的反应液的gc图表。
<1,3-二噁烷-5-酮的光谱数据>
·1h-nmr(400mhz、cdcl3、δppm):4.36(4h、s)、5.02(2h、s)。
·13c-nmr(100mhz、cdcl3、δppm):73.4、91.4、203.7。
·ir(neat、cm-1):2864、1736、1425、1240、1178、1122、1043、930。
·ms(m/z):102(m+)、73、44。
<1,3-二氧戊环-4-羧酸(1,3-二氧戊环-4-基)甲酯(立体异构体混合物)的光谱数据>
·ir(neat、cm-1):2956、2856、1751、1284、1151、1082、1016、916。
·ms(m/z):204(m+)、159、129、86、73、57、45。
<4-甲酰基-1,3-二氧戊环的光谱数据>
·ms(m/z):102(m+)、73、56、45。
实施例1-2
在安装有20ml滴液漏斗的50ml烧瓶中装入与实施例1-1相同的甘油缩甲醛3.19g(纯度98.0%、30.0毫摩尔)、azadol4.7mg(纯度98.0%、30微摩尔)、吡啶4.77g(纯度99.5%、60.0毫摩尔)、乙腈10g,一边进行冷却,一边在氮气氛下进行搅拌。在滴液漏斗中装入将tcca2.94g(纯度95.0%、12.0毫摩尔)溶解于乙腈10g而形成的溶液,一边以烧瓶内的反应液温度控制在-10℃~10℃的范围的方式调节滴加速度,一边用1小时滴加。一边停止冷却而将反应液温度升温至25℃左右,一边进一步继续搅拌2小时,最后添加2-丙醇0.20g(纯度99.7%、3.3毫摩尔),进一步搅拌10分钟而完成反应。过滤分离副生的粉末状固体之后,将滤液进行gc分析,结果:1,3-二噁烷-5-醇的转化率为100%,1,3-二噁烷-5-酮的收率为98%,4-羟基甲基-1,3-二氧戊环的转化率为100%,1,3-二氧戊环-4-羧酸(1,3-二氧戊环-4-基)甲酯的收率为99%,4-甲酰基-1,3-二氧戊环的收率为1%。
实施例1-3~1-15
变更催化剂的种类或使用量、碱的种类或使用量、或溶剂种类,除此之外,进行与实施例1-2同样的操作。表1中示出实施例1-2~1-15的反应条件和结果。
[表1]
表1
1)相对于1,3-二噁烷-5-醇和4-羟基甲基-1,3-二氧戊环的混合物的摩尔比
2)从滴加开始至反应结束的时间
实施例2:2-苯基-1,3-二噁烷-5-酮的制造
在实施例2中进行的反应如下所述。
实施例2-1及2-2
将制造例1中得到的2-苯基-1,3-二噁烷-5-醇和4-羟基甲基-2-苯基-1,3-二氧戊环的混合物3.60g(纯度100%、20.0毫摩尔)用作反应原料,进行与实施例1-2同样的操作,得到以2-苯基-1,3-二噁烷-5-酮和2-苯基-1,3-二氧戊环-4-羧酸(2-苯基-1,3-二氧戊环-4-基)甲酯为主产物的反应液。表2中示出实施例2-1及2-2的反应条件和结果。
将实施例2-1及2-2中得到的反应液进行混合,在0.13kpa(绝对压力)的减压下进行单蒸馏。将在馏分温度94~96℃下馏出的淡黄色液体由叔丁基甲醚进行再结晶,得到2-苯基-1,3-二噁烷-5-酮的无色薄板状结晶1.28g。纯度为100%,精制收率为43%。进而,利用浓褐色油状的单蒸馏残渣的硅胶柱色谱法(展开溶剂正己烷/醋酸乙酯=3)将rf值0.24的成分进行分离,得到溶剂馏去及真空干燥后橙色液体状的2-苯基-1,3-二氧戊环-4-羧酸(2-苯基-1,3-二氧戊环-4-基)甲酯2.58g。纯度为90.6%,精制收率为78%。由gc-ms分析确认:该酯二聚物为至少由6组的外消旋体构成的立体异构体混合物。予以说明,关于其它2组的外消旋体,峰重叠,推定为不能检测的物质。
图2中示出实施例2-1中得到的反应液的gc图表。
<2-苯基-1,3-二噁烷-5-酮的光谱数据>
·1h-nmr(400mhz、cdcl3、δppm):4.46(2h、d、j=17.2hz)、4.52(2h、d、j=17.2hz)、5.89(1h、s)、7.25-7.55(5h、m)。
·13c-nmr(100mhz、cdcl3、δppm):72.4、99.0、126.1、128.5、129.4、133.8、204.4。
·ir(neat、cm-1):3070、2860、1718、1394、1094、975。
·ms(m/z):178(m+)、148、119、105、91、77、51。
<2-苯基-1,3-二氧戊环-4-羧酸(2-苯基-1,3-二氧戊环-4-基)甲酯(立体异构体混合物)的光谱数据>
·ir(neat、cm-1):2881、1751、1734、1458、1394、1200、1080、648。
·ms(m/z、gc上的6峰共同):356(m+)、250、233、149、129、105、91、77、55。
<4-甲酰基-2-苯基-1,3-二氧戊环(立体异构体混合物)的光谱数据>
·ms(m/z、gc上的2峰共同):178(m+)、177、149、105、91、77、51。
实施例2-3
将制造例1中得到的2-苯基-1,3-二噁烷-5-醇和4-羟基甲基-2-苯基-1,3-二氧戊环的混合物451mg(纯度100%、2.50毫摩尔)、4-乙酰胺-2,2,6,6-四甲基-1-氧代哌啶鎓四氟硼酸盐1.98g(纯度95.0%、6.26毫摩尔)、预先在真空加热条件下进行了干燥的分子筛4a1.0g、及二氯甲烷10g装入于安装有滴液漏斗的50ml烧瓶,在氮气氛下于室温下进行搅拌。将由吡啶0.457g(纯度99.5%、5.75毫摩尔)和二氯甲烷5g构成的溶液装入于20ml滴液漏斗,用10分钟滴加。进一步在室温下继续搅拌2小时后,最后添加甲醇0.10g(纯度99.8%、3.1毫摩尔),进一步搅拌10分钟而完成反应。过滤分离分子筛4a和副生的粉末状固体之后,将滤液进行gc分析,结果:2-苯基-1,3-二噁烷-5-醇的转化率为56%,2-苯基-1,3-二噁烷-5-酮的收率为13%,4-羟基甲基-2-苯基-1,3-二氧戊环的转化率为60%,2-苯基-1,3-二氧戊环-4-羧酸(2-苯基-1,3-二氧戊环-4-基)甲酯的收率为51%,4-甲酰基-2-苯基-1,3-二氧戊环的收率为4%。
[表2]
表2
1)相对于2-苯基-1,3-二噁烷-5-醇和4-羟基甲基-2-苯基-1,3-
二氧戊环的混合物的摩尔比
2)从滴加开始至反应结束的时间
3)4-乙酰胺-2,2,6,6-四甲基-1-氧代哌啶鎓四氟硼酸酯
实施例3:2-甲基-1,3-二噁烷-5-酮的制造
在实施例3中进行的反应如下所述。
实施例3-1
将制造例3中得到的2-甲基-1,3-二噁烷-5-醇和4-羟基甲基-2-甲基-1,3-二氧戊环的混合物70.9g(纯度100%、600毫摩尔)用作反应原料,进行与实施例1-1同样的操作,得到黄色油状粗产物66.2g。将粗产物进行gc分析,结果:2-甲基-1,3-二噁烷-5-醇的转化率为100%,2-甲基-1,3-二噁烷-5-酮的收率为74%,2-甲基-4-羟基甲基-1,3-二氧戊环的转化率为100%,2-甲基-1,3-二氧戊环-4-羧酸(2-甲基-1,3-二氧戊环-4-基)甲酯的收率为88%,4-甲酰基-1,3-二氧戊环的收率为0%。
在安装有理论塔板6塔板的填充式蒸馏塔(填充物:海利-帕克填料no.2)的100ml梨形烧瓶中装入粗产物60.0g,一边馏去残留溶剂和吡啶,一边减压至1.3kpa(绝对压力)之后,将回流比设定为3,得到在馏分温度52~53℃下作为无色液体馏出的2-甲基-1,3-二噁烷-5-酮31.4g。纯度为100%,蒸馏收率为96%。进而,减压至0.13kpa(绝对压力),然后将回流比设定为0.5,得到在馏分温度110~113℃下作为淡黄色液体馏出的2-甲基-1,3-二氧戊环-4-羧酸(2-甲基-1,3-二氧戊环-4-基)甲酯16.1g。纯度为98.6%,蒸馏收率为95%。由13c-nmr及gc-ms分析确认:该酯二聚物为至少由2组外消旋体构成的4种立体异构体混合物。予以说明,关于其它6组的外消旋体,峰重叠,推定为不能检测的物质。
<2-甲基-1,3-二噁烷-5-酮的光谱数据>
·1h-nmr(400mhz、cdcl3、δppm):1.44(3h、d、j=5.2hz)、4.29(2h、d、j=17.6hz)、4.39(2h、d、j=17.6hz)、5.06(1h、q、j=5.2hz)。
·13c-nmr(100mhz、cdcl3、δppm):20.2、72.6、97.4、204.4。
·ir(neat、cm-1):2994、2875、1739、1408、1130、1097、1051、872。
·ms(m/z):116(m+)、101、86、58、43。
<2-甲基-1,3-二氧戊环-4-羧酸(2-甲基-1,3-二氧戊环-4-基)甲酯(立体异构体混合物)的光谱数据>
·ir(neat、cm-1):2991、2864、1751、1408、1201、1146、1088、1076、858。
·ms(m/z、gc上的2峰共同):232(m+)、217、173、129、101、87、59、43。
实施例3-2~3-4
将制造例3中得到的2-甲基-1,3-二噁烷-5-醇和4-羟基甲基-2-甲基-1,3-二氧戊环的混合物3.54g(纯度100%、30.0毫摩尔)用作反应原料,进行与实施例1-2同样的操作,得到以2-甲基-1,3-二噁烷-5-酮和2-甲基-1,3-二氧戊环-4-羧酸(2-甲基-1,3-二氧戊环-4-基)甲酯为主产物的反应液。表3中示出实施例3-2~3-4的反应条件和结果。
[表3]
表3
1)相对于2-甲基-1,3-二噁烷-5-醇和4-羟基甲基-2-甲基-1,3-
二氧戊环的混合物的摩尔比
2)从滴加开始至反应结束的时间
<2-甲基-4-甲酰基-1,3-二氧戊环(立体异构体混合物)的光谱数据>
·ms(m/z、gc上的2峰共同):115、101、87、71、59、43。
图3中示出实施例3-3中得到的反应液的gc图表。
实施例4:2-正庚基-1,3-二噁烷-5-酮的制造
在实施例4中进行的反应如下所述。
将制造例4中得到的2-正庚基-1,3-二噁烷-5-醇和4-羟基甲基-2-正庚基-1,3-二氧戊环的混合物4.34g(纯度99.2%、21.3毫摩尔)用作反应原料,进行与实施例1-1同样的反应操作。为了除去在粉末状固体的过滤和乙腈的馏去后再析出的粉末状固体,加入叔丁基甲醚20g和离子交换水10g,进一步加入饱和碳酸氢钠水溶液至水层的ph达到8之后进行提取。在静置分层后抽出下层水,加入饱和氯化钠水溶液20g,重复从提取至抽出下层水。将得到的有机层用无水硫酸钠10g进行干燥,在过滤后馏去叔丁基甲醚,得到淡黄色油状粗产物5.40g。将粗产物进行gc分析,结果:2-正庚基-1,3-二噁烷-5-醇的转化率为93%,2-正庚基-1,3-二噁烷-5-酮的收率为74%,2-正庚基-4-羟基甲基-1,3-二氧戊环的转化率为100%,2-正庚基-1,3-二氧戊环-4-羧酸(2-正庚基-1,3-二氧戊环-4-基)甲酯的收率为98%,4-甲酰基-正庚基-1,3-二氧戊环的收率为2%。
接着,使用kugelrohr蒸馏装置,在40pa(绝对压力)的减压下进行粗产物5.00g的蒸馏,得到在装置温度140~160℃下作为无色液体馏出的2-正庚基-1,3-二噁烷-5-酮1.35g。纯度为97%,蒸馏收率为78%。另外,黄色凝胶状的蒸馏残渣1.86中的2-正庚基-1,3-二氧戊环-4-羧酸(2-正庚基-1,3-二氧戊环-4-基)甲酯纯度为87%,蒸馏回收率为95%。通过13c-nmr及gc-ms分析确认:该酯二聚物为由8组外消旋体构成的16种立体异构体混合物。
<2-正庚基-1,3-二噁烷-5-酮的光谱数据>
·1h-nmr(400mhz、cdcl3、δppm):0.88(3h、t、j=6.8hz)、1.23-1.37(8h、m)、1.40-1.47(2h、m)、1.69-1.74(2h、m)、4.28(2h、d、j=18.2hz)4.40(2h、d、j=18.2hz)、4.86(1h、t、j=5.0hz)。
·13c-nmr(100mhz、cdcl3、δppm):14.0、22.6、24.0、29.1、29.3、31.7、34.0、72.2、100.4、204.5。
·ir(neat、cm-1):2956、2858、1741、1134、1053、957。
·ms(m/z):200(m+)、101、71、55、43。
<2-正庚基-1,3-二氧戊环-4-羧酸(2-正庚基-1,3-二氧戊环-4-基)甲酯(立体异构体混合物)的光谱数据>
·ir(neat、cm-1):2925、2854、1747、1458、1198、1147、949。
·ms(m/z、gc上的8峰共同):400(m+)、301、173、157、101、69、57、43。
<4-甲酰基-正庚基-1,3-二氧戊环(立体异构体混合物)的光谱数据>
·ms(m/z、gc上的2峰共同):200(m+)、171、101、69、55、41。
图4中示出实施例4中得到的反应液的gc图表。
实施例5:二羟基丙酮的制造
在实施例5中进行的反应如下所述。
将实施例2-1及2-2中得到的2-苯基-1,3-二噁烷-5-酮1.00g(纯度100%、5.61毫摩尔)、dowex50wx81.0g(强酸性阳离子交换树脂、dowchemicalcompany、商标)40mg、离子交换水10g装入于20ml烧瓶,在40℃下搅拌2小时。冷却后将离子交换树脂进行了过滤分离的反应液用叔丁基甲醚10g提取3次而除去苯甲醛。在水溶液中添加乙腈100g,在40℃下馏去溶剂之后,进行真空干燥。将得到的淡黄色树脂状粗产物500mg进行三甲基甲硅烷(tms)化之后,进行gc分析,结果:主产物为dha及dha的环状半缩醛二聚物。在参考文献8(催化杂志(journalofcatalysis)、第245卷、428-435页、2007年)中记载有重水中的dha的1h-nmr信号归属。在同条件下将粗产物进行1h-nmr分析,结果:文献同样地dha和dha的水合物(摩尔比1.0对0.26)为主构成物质,此外存在少量的半缩醛二聚物。将二甲基砜作为内部标准物质添加的粗产物的1h-nmr分析的结果:将dha和dha的水合物进行定量而求出的粗产物中的dha骨架的纯度为63.3%,收率为63%。
实施例6:2-氨基-1,3-丙二醇(丝氨醇)的制造
在实施例6中进行的反应如下所述。
在安装有20ml滴液漏斗的200ml烧瓶中装入甲酸铵14.2g(纯度100%、224毫摩尔)、10%-钯碳0.50g(川研精密化学株式会社制、ma型、52%含水品)、甲醇60g,开始搅拌。之后,从滴液漏斗用30分钟滴加将与实施例2-1及2-2中记载的方法同样地操作得到的2-苯基-1,3-二噁烷-5-酮4.00g(纯度100%、22.4毫摩尔)溶解于甲醇15g而形成的溶液(期间,烧瓶中的液体的温度从17℃上升至20℃),进一步搅拌2小时。在钯碳的过滤分离和甲醇的馏去后,加入2摩尔/l氢氧化钠溶液,至ph达到12,用叔丁基甲醚50g提取3次。从合并的有机层中馏去叔丁基甲醚之后,使用kugelrohr蒸馏装置,得到在130pa(绝对压力)的减压下于装置温度170~180℃下作为无色液体馏出的5-氨基-2-苯基-1,3-二噁烷2.04g。在该5-氨基-2-苯基-1,3-二噁烷中加入2摩尔/l盐酸40ml,在20℃左右搅拌2小时。用叔丁基甲醚50ml提取3次而除去苯甲醛之后,加入1摩尔/l氢氧化钠溶液,至ph成为10。馏去水之后,加入2-丙醇10ml,过滤分离不溶物,进一步馏去2-丙醇之后,进行真空干燥,得到无色油状粗产物1.10g。在重水中将二甲基砜作为内部标准物质添加的粗产物的1h-nmr分析的结果:丝氨醇的纯度为90.8%,收率为49%。
工业上的可利用性
根据本发明的1,3-二噁烷-5-酮类的制造方法,提供一种由可容易且廉价地供应的原料、通过短工序且简便的方法制造1,3-二噁烷-5-酮类的方法。由本发明得到的1,3-二噁烷-5-酮类作为各种有用化合物的中间体是重要的,作为dha或丝氨醇的合成原料也是有用的,作为医药品、化学品的原料优选使用。
- 还没有人留言评论。精彩留言会获得点赞!