修饰的杀真菌素链霉菌分离物及其用途的制作方法
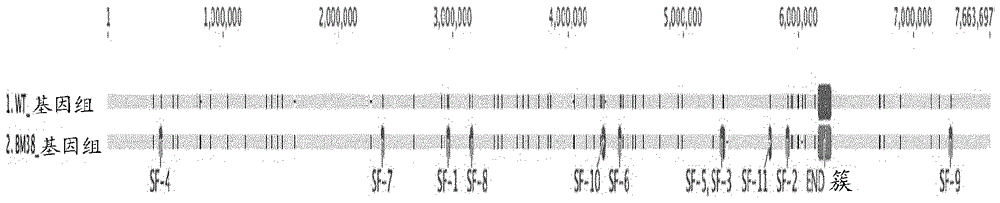
本申请根据35u.s.c.§119(c)要求于2016年12月6日提交的美国临时申请序列号62/430,455的优先权,所述临时申请的内容在此以其整体通过引用并入。发明领域本发明涉及修饰的杀真菌素链霉菌(streptomycesfungicidicus)分离物,包含这些分离物的组合物,以及使用此类分离物和组合物以生物合成持久杀菌素(enduracidin;持久霉素(enramycin))的方法。本发明进一步涉及修饰的杀真菌素链霉菌分离物,其以更有效的方式生物合成持久杀菌素并促进持久霉素的产生。发明背景持久杀菌素(也称为持久霉素,并且作为enradin®由msdanimalhealth出售)是由细菌杀真菌素链霉菌(用于产生持久杀菌素的天然制造者)生物合成并分泌的天然存在的17个氨基酸的脂酯肽(lipodepsipeptide)抗生素。持久杀菌素是持久杀菌素类似物的通称,且包括持久杀菌素a、b、c和d。所述肽可以从发酵液和菌丝体中分离,其主要作为持久杀菌素a和b(其所连接的脂质链的长度相差一个碳)的混合物。在结构上,持久杀菌素的区别在于通过酰胺键与天冬氨酸残基连接的c12或c132z,4e支链脂肪酸部分,以及许多非蛋白原性的氨基酸残基(如持久双杀霉素(enduracididine),4-羟基苯基甘氨酸,3,5-二氯-4-羟基苯基甘氨酸,瓜氨酸和鸟氨酸)的存在。持久杀菌素针对广谱的革兰氏阳性生物体展示有效的体外和体内抗细菌活性,所述革兰氏阳性生物体包括产气荚膜梭菌(clostridiumperfringens),耐甲氧西林金黄色葡萄球菌(methicillin-resistantstaphylococcusaureus,mrsa)和耐万古霉素肠球菌(vancomycin-resistantenterococcus,vre)。持久杀菌素通过与细胞外脂质ii(细菌细胞壁的前体)复合而抑制细菌肽聚糖细胞壁的生物合成。脂质ii与持久杀菌素复合的位点不同于万古霉素识别的位点,并且是持久杀菌素针对万古霉素抗性生物体的作用的原因。迄今为止,没有证实的持久杀菌素与任何临床使用的抗生素的交叉抗性,并且没有发展,获得或可转移的抗性的证据。没有任何已知形式的可转移抗性机制,缺乏口服生物利用度,其低毒性,以及对梭菌属种(clostridiumspp.)的显著抗细菌活性,已使持久杀菌素成为控制家禽中梭菌性肠炎的关键抗生素。因此,当在家禽饲料中施用时,持久杀菌素抑制在家禽中引起坏死性肠炎和生长抑制的细菌的生长。持久杀菌素还具有零时间停药期。此外,持久杀菌素在饲料和颗粒中稳定,能够以非常低的剂量向鸡施用,并且不导致在来自处理过的鸡的肉和蛋中发现残留物。多年来,已经获得许多杀真菌素链霉菌菌株,其已经过修饰以改进这些产生持久杀菌素的微生物的效率,所述微生物例如杀真菌素链霉菌b-5477(ifo-12439,atcc-21013)和杀真菌素链霉菌b-5477-m(ifo-12440,atcc-21014)[参见例如u.s.3,577,530,u.s.3,786,142和u.s.4,465,771]。然而,仍有进一步改进此类修饰的杀真菌素链霉菌分离物以产生甚至更有效的产生持久杀菌素的微生物的显著需求。本文引用任何参考文献不应被解释为承认这样的参考文献可作为本申请的“现有技术”获得。发明概述因此,本发明提供了更有效地产生持久杀菌素的新的修饰的杀真菌素链霉菌分离物。在某些实施方案中,所述修饰的杀真菌素链霉菌分离物编码以下的一种或多种或全部:orf2798,其与seqidno:2的氨基酸序列具有95%或更高的同一性,并且在氨基酸位置2保留丝氨酸残基;orf3866,其与seqidno:4的氨基酸序列具有95%或更高的同一性,并且在氨基酸位置124保留苏氨酸残基;orf5175,其与seqidno:6的氨基酸序列具有95%或更高的同一性,并且在氨基酸位置91保留丝氨酸残基;和orf5387,其与seqidno:8的氨基酸序列具有95%或更高的同一性,并且在氨基酸位置164保留丝氨酸残基。在某些实施方案中,所述修饰的杀真菌素链霉菌分离物进一步:(i)包含编码orf4755的核酸,其包含seqidno:9的核苷酸序列,代替seqidno:23的核苷酸序列;和/或(ii)缺乏功能性orf682蛋白;和/或(iii)缺乏功能性orf4868蛋白。在这种类型的具体实施方案中,缺乏功能性orf682蛋白和/或缺乏功能性orf4868蛋白是由于编码orf682蛋白和/或orf4868蛋白的基因中的移码突变。在具体实施方案中,所述修饰的杀真菌素链霉菌分离物编码以下的一种或多种或全部:orf2798,其与seqidno:2的氨基酸序列具有98%或更高的同一性,并且在氨基酸位置2保留丝氨酸残基;orf3866,其与seqidno:4的氨基酸序列具有98%或更高的同一性,并且在氨基酸位置124保留苏氨酸残基;orf5175,其与seqidno:6的氨基酸序列具有98%或更高的同一性,并且在氨基酸位置91保留丝氨酸残基;和orf5387,其与seqidno:8的氨基酸序列具有98%或更高的同一性,并且在氨基酸位置164保留丝氨酸残基。在某些实施方案中,所述修饰的杀真菌素链霉菌分离物进一步:(i)包含编码orf4755的核酸,其包含seqidno:9的核苷酸序列,代替seqidno:23的核苷酸序列;和/或(ii)缺乏功能性orf682蛋白;和/或(iii)缺乏功能性orf4868蛋白。在这种类型的具体实施方案中,缺乏功能性orf682蛋白和/或缺乏功能性orf4868蛋白是由于编码orf682蛋白和/或orf4868蛋白的基因中的移码突变。在又另外的实施方案中,所述修饰的杀真菌素链霉菌分离物编码以下的一种或多种或全部:orf2798,其与seqidno:2的氨基酸序列具有99%或更高的同一性,并且在氨基酸位置2保留丝氨酸残基;orf3866,其与seqidno:4的氨基酸序列具有99%或更高的同一性,并且在氨基酸位置124保留苏氨酸残基;orf5175,其与seqidno:6的氨基酸序列具有99%或更高的同一性,并且在氨基酸位置91保留丝氨酸残基;和orf5387,其与seqidno:8的氨基酸序列具有99%或更高的同一性,并且在氨基酸位置164保留丝氨酸残基。在某些实施方案中,所述修饰的杀真菌素链霉菌分离物进一步:(i)包含编码orf4755的核酸,其包含seqidno:9的核苷酸序列,代替seqidno:23的核苷酸序列;和/或(ii)缺乏功能性orf682蛋白;和/或(iii)缺乏功能性orf4868蛋白。在这种类型的具体实施方案中,缺乏功能性orf682蛋白和/或缺乏功能性orf4868蛋白是由于编码orf682蛋白和/或orf4868蛋白的基因中的移码突变。在仍另外的实施方案中,所述修饰的杀真菌素链霉菌分离物编码以下的一种或多种或全部:orf2798,其包含seqidno:2的氨基酸序列;orf3866,其包含seqidno:4的氨基酸序列;orf5175,其包含seqidno:6的氨基酸序列;和orf5387,其包含seqidno:8的氨基酸序列。在某些实施方案中,所述修饰的杀真菌素链霉菌分离物进一步:(i)包含编码orf4755的核酸,其包含seqidno:9的核苷酸序列,代替seqidno:23的核苷酸序列;和/或(ii)缺乏功能性orf682蛋白;和/或(iii)缺乏功能性orf4868蛋白。在这种类型的具体实施方案中,缺乏功能性orf682蛋白和/或缺乏功能性orf4868蛋白是由于编码orf682蛋白和/或orf4868蛋白的基因中的移码突变。在相关的实施方案中,所述修饰的杀真菌素链霉菌:(i)包含编码orf4755的核酸,其包含seqidno:9的核苷酸序列,代替seqidno:23的核苷酸序列;和/或(ii)缺乏功能性orf682蛋白;和/或(iii)缺乏功能性orf4868蛋白。在这种类型的具体实施方案中,缺乏功能性orf682蛋白和/或缺乏功能性orf4868蛋白是由于编码orf682蛋白和/或orf4868蛋白的基因中的移码突变。在具体的实施方案中,所述修饰的杀真菌素链霉菌分离物包含具有atcc保藏号pta-122342的修饰的杀真菌素链霉菌分离物的免疫原性和/或物理和/或遗传特征。在更具体的实施方案中,所述修饰的杀真菌素链霉菌是具有atcc保藏号pta-122342的分离物,或具有atcc保藏号pta-122342的分离物的后代和/或衍生物。在相关方面,本发明所有的修饰的杀真菌素链霉菌也作为分离的修饰的杀真菌素链霉菌分离物提供。本发明中还包括具有以下核苷酸序列的引物组:seqidno:29和30;seqidno:31和32;seqidno:33和34;seqidno:35和36;seqidno:37和38;seqidno:39和40;seqidno:41和42;seqidno:43和44;seqidno:45和46;seqidno:47和48;seqidno:49和50;和/或其任何组合。另外,包含此类引物组中的一组或多组的试剂盒也是本发明的一部分。此外,本发明中还包括在测定中使用这些引物来鉴定本发明的杀真菌素链霉菌基因组。通过参考附图、详述和实施例将更好地理解本发明的这些和其他方面。附图简述图1描绘了杀真菌素链霉菌bm38基因组上的11种多态性的定位,其用作下文实施例中描述的基于pcr的筛选的突变标记。发明详述开发用于商业应用(例如人类医学或农业应用)的细菌次级代谢物或天然产物提出了诸如克服来自亲本/野生型生物体的所需化合物的低产率的挑战。在过去几十年中,我们对天然产物生物合成的理解的进展已揭示,次级代谢物的产生可以通过几种方式调节和控制。在大多数情况下,用于细菌天然产物生物合成的基因,包括负责前体形成、结构组装、组装后修饰、自身抗性和调节的基因在细菌染色体上簇集在一起。天然产物的生物合成可以由细胞外和细胞内信号转导分子引发,所述信号转导分子与途径特异性调节因子或控制多于一种产物的产生的多效性调节因子相互作用。发生在这些调节基因或系统的任一种中的突变可以增加,减少或消除抗生素的产生。菌株改进可以在抗生素或其他微生物次级代谢物的具有成本效益的工业规模生产中发挥作用。可以通过随机突变,通过特定基因的靶向破坏,或通过引入消除生物合成途径中的瓶颈的基因,来产生能够以增加的产率产生特定代谢物的突变菌株。已经证明,对调节基因以及生物合成基因进行遗传操作以引起特定次级代谢物的过量产生是放线菌菌株改进的有力且成功的策略。在本发明的具体方面,已经鉴定了杀真菌素链霉菌的关键编码序列,其在被修饰和/或消除时,产生对于生物合成和/或产生用于商业目的的持久杀菌素具有改进性质的分离物。此前已报道了来自野生型杀真菌素链霉菌atcc21013的116千碱基对的dna序列,其含有持久杀菌素生物合成基因簇及其侧接区域[us.8,188,245,其在此以其整体通过引用并入],并且可以在genbank[登记号dq403252]中获得。如下所示,已经确定了bm38-2(atccno.pta-122342)的总基因组序列并与野生型基因组进行比较。该比较分析允许鉴定出基因组之间的至少77种多态性或突变差异,并且选择出与atccno.pta-122342的改进性质相关的七(7)个关键开放阅读框,如下所示。然而,出乎意料地,这七个关键的开放阅读框中无一与所述杀真菌素链霉菌染色体的持久杀菌素生物合成基因簇及其侧接区域相关。然而,无论如何,这七个关键的开放阅读框的修饰允许通过标准重组技术容易地构建新的修饰的杀真菌素链霉菌分离物,其具有与先前报道的分离物相当或甚至优越的性质。出于方便在说明书中使用的单数术语决无意是限制性的。因此,例如,除非另有说明,否则提及“分离物”包括提及一种或多种此类分离物。除非另有说明,否则复数术语的使用也无意是限制性的。如本文所用,术语“大约”与术语“约”可互换地使用,并且通常表示值在指示值的25%以内,除非另有说明,例如,持久杀菌素产量增加“约”4倍可以是增加3至5倍。如本文所用,当两个序列的氨基酸残基相同时,一个氨基酸序列与第二个氨基酸序列100%“相同”。因此,当两个氨基酸序列的50%氨基酸残基相同时,一个氨基酸序列与第二个氨基酸序列50%“相同”。序列比较在给定蛋白质(例如蛋白质或所比较的多肽的部分)所包含的连续氨基酸残基区段上进行。在具体的实施方案中,考虑了否则会改变两个氨基酸序列之间的对应关系的选择的缺失或插入。如本文所用,核苷酸和氨基酸序列同一性百分比可以使用c,macvector(macvector,inc.cary,nc27519)、vectornti(informax,inc.md)、oxfordmoleculargroupplc(1996)和clustalw算法,使用比对默认参数和同一性默认参数确定。这些商业可得的程序也可用于使用相同或类似的默认参数确定序列相似性。或者,可以使用默认过滤条件下的advancedblast搜索,例如,使用gcg(geneticscomputergroup,gcg软件包的程序手册,第7版,madison,wisconsin)pileup程序,使用默认参数。如本文所用,包含“缺乏功能性”多肽或“缺乏功能性”多肽(例如,orf682)的生物体是不表达该多肽和/或表达修饰多肽的生物体,所述修饰多肽具有相应野生型多肽的至多10%的天然生物功能,例如,具有对其天然底物的酶促活性(例如,酶促效率,即vmax/km)的截短的酶,所述酶促活性是在相同标准测定条件下对相应野生型酶测定的酶促活性的至多10%。在具体实施方案中,生物体中“缺乏功能性”多肽等同于不存在该多肽的特定生物学功能。如本文所用,已被“无效”的开放阅读框已经通过例如框内缺失,移码,插入和/或点突变进行修饰,使得包含已被“无效”的开放阅读框的生物体完全不表达由相应野生型开放阅读框编码的多肽和/或表达具有相应野生型多肽的至多10%的天然生物学功能的修饰多肽。在具体实施方案中,在包含已被“无效”的开放阅读框的生物体中,不存在由相应野生型开放阅读框编码的多肽的特定生物学功能。如本文所用,“基因簇”是在染色体上聚集在一起的一组遗传元件,其蛋白质产物具有相关的功能,例如形成天然产物生物合成途径。保守取代是氨基酸取代,其通常不显著改变分子的活性(特异性或结合亲和力)。通常,保守氨基酸取代涉及用一个氨基酸取代另一个具有相似化学性质(例如电荷或疏水性)的氨基酸。下表显示了示例性保守氨基酸取代:原始残基保守取代原始残基保守取代alaserleuile;valarglyslysarg;gln;gluasngln;hismetleu;ileaspgluphemet;leu;tyrcysserserthrglnasnthrsergluasptrptyrglyprotyrtrp;phehisasn;glnvalile;leu修饰的杀真菌素链霉菌的制备下文描述了用于实施所公开的实施方案的合适的方法和材料。此外,普通技术人员熟知的任何适当的方法或技术可用于实施所公开的实施方案。适用于本公开的一些常规方法和技术描述于例如sambrook等人,molecularcloning:alaboratorymanual,第2版,coldspringharborlaboratorypress,1989;sambrook等人,molecularcloning:alaboratorymanual,第3版,coldspringharborpress,2001;ausubel等人,currentprotocolsinmolecularbiology,greenepublishingassociates,1992(以及至2000年的增订);ausubel等人,shortprotocolsinmolecularbiology:acompendiumofmethodsfromcurrentprotocolsinmolecularbiology,第4版,wiley&sons,1999;harlow和lane,antibodies:alaboratorymanual,coldspringharborlaboratorypress,1990;harlow和lane,usingantibodies:alaboratorymanual,coldspringharborlaboratorypress,1999;和kieser,t.,bibb,m.j.,buttner,m.j.,chater,k.f.,和hopwood,d.a.:practicalstreptomycesgenetics,johninnescentre,norwichresearchpark,colney,norwichnr4&uh,england,2000。可以制备重组杀真菌素链霉菌表达质粒载体,用于制备本发明的修饰的杀真菌素链霉菌分离物。在一些实施方案中,工程化的重组杀真菌素链霉菌载体包含杀真菌素链霉菌的至少一个选定开放阅读框。在某些实施方案中,工程化的重组杀真菌素链霉菌载体包含在启动子控制下表达的杀真菌素链霉菌的至少一个选定开放阅读框。在其他实施方案中,所述启动子是强组成型链霉菌启动子,当所述载体在杀真菌素链霉菌的菌株中表达时,所述启动子导致持久杀菌素的产量增加。在一些实施方案中,所述开放阅读框可操作地连接到代替其自身的天然启动子的异源启动子。例如,它可以可操作地连接到组成型启动子,例如强组成型表达启动子或诱导型启动子。在具体实施方案中,所述强组成型启动子是来自红霉素制造者红色糖多孢菌(saccharopolysporaerythraea)的erme*p。在其他实施方案中,所述诱导型启动子是硫链丝菌肽诱导型启动子tipa。在又另外的实施方案中,使用p(nita)-nitr系统[herai等人,procnatlacadsciusa.,101(39):14031-14035(2004)]或链霉菌启动子sf14。在仍另外的实施方案中,使用安普霉素抗性基因的天然启动子amrp。在又另外的实施方案中,使用phrdb,ptcp830和/或pneos。在某些实施方案中,所述工程化的重组载体包含:包含seqidno:1的核苷酸序列的开放阅读框orf2798,和/或已被无效的开放阅读框orf682。因此,可以构建重组杀真菌素链霉菌菌株,其与野生型杀真菌素链霉菌菌株相比,能够产生增加的持久杀菌素产率。在某些实施方案中,工程化的重组杀真菌素链霉菌菌株包含来自杀真菌素链霉菌的至少一个选定开放阅读框,其被引入染色体上并在启动子的控制下表达,所述启动子例如强组成型链霉菌启动子,这导致工程化菌株中持久杀菌素的产量增加。在其他实施方案中,引入的开放阅读框在杀真菌素链霉菌中的表达由代替其自身的天然启动子的异源启动子驱动。例如,它可以可操作地连接到组成型启动子,例如强组成型表达启动子或诱导型启动子。在一些实施方案中,所述强组成型启动子是erme*p。在其他实施方案中,所述诱导型启动子是tipa。在一些实例中,使用p(nita)-nitr系统[参见上文]或sf14启动子。在仍另外的实施方案中,所述组成型表达启动子是amrp。在又另外的实施方案中,使用phrdb、ptcp830和/或pneos启动子。在一些实施方案中,所述工程化菌株包含来自杀真菌素链霉菌的开放阅读框orf3866。在这种类型的具体实施方案中,所述开放阅读框orf3866可操作地连接到异源启动子。例如,它可以连接到强组成型启动子,例如erme*p。在其他实例中,所述开放阅读框orf3866可操作地连接到启动子tipa、sf14、amrp、phrdb、ptcp830和/或pneos。在其他实施方案中,所述工程化菌株编码改变的开放阅读框orf4868。开放阅读框orf4868可以通过插入破坏、框内缺失、移码和/或点突变而被无效。在一些实例中,开放阅读框orf4868通过框内缺失而被无效。通常,orf4868上的任何内部框内缺失都应导致orf4868由于其不完整性的无效功能。在相关的实施方案中,工程化菌株涉及杀真菌素链霉菌的两个,三个,四个,五个,六个,七个或更多个开放阅读框。在某些实施方案中,所述修饰的杀真菌素链霉菌分离物源自野生型亲本菌株,例如但不限于杀真菌素链霉菌,美国典型培养物保藏中心(americantissueculturecompany,atcc)编号21013。在其他实施方案中,杀真菌素链霉菌的工程化菌株源自常规突变菌株,例如但不限于杀真菌素链霉菌atcc31729,杀真菌素链霉菌atcc31730和杀真菌素链霉菌atcc31731。在某些实施方案中,持久杀菌素的产量增加是与野生型杀真菌素链霉菌菌株相比,持久杀菌素的产量增加至少1.2倍,例如增加至少1.5倍,至少2倍,至少2.5倍,至少3倍,至少3.5倍,至少4倍,至少4.5倍,包括但不限于增加1.2至10倍,增加1.2至4.6倍,以及增加约2至5倍。在某些实施方案中,可以通过将包含至少一个增加持久杀菌素产量的开放阅读框的重组质粒整合到杀真菌素链霉菌的亲本菌株的染色体中,来构建修饰的杀真菌素链霉菌。整合的接合载体可以具有,或可以经工程化而具有,强组成型链霉菌启动子。在一些实施方案中,质粒可以缺少链霉菌复制子,并且可以通过位点特异性单交换同源重组整合到染色体中。在其他实施方案中,质粒可以作为游离质粒存在。在一些实施方案中,可以将接合载体工程化,其中质粒插入物携带部分或完全缺失的目的基因及其侧接区域,其可以在双交换同源重组后整合到染色体中以产生框内缺失突变体。从重组杀真菌素链霉菌菌株生产持久杀菌素本公开提供的重组杀真菌素链霉菌菌株提供了产生增加水平的持久杀菌素的方法。本领域的这种技术进步允许与持久杀菌素产量相关的显著成本节约。在某些实施方案中,生产持久杀菌素的方法包括在足以产生持久杀菌素的条件下培养所公开的重组杀真菌素链霉菌菌株。在其他实施方案中,所述方法还包括在培养后从培养基中分离持久杀菌素。在仍另外的实施方案中,所述方法还包括确定所产生的持久杀菌素的抗细菌活性,例如通过hplc分析或使用金黄色葡萄球菌atcc29213或枯草芽孢杆菌atcc6633作为指示微生物的生物测定。在一些实施方案中,通过利用如前所述用于产生持久杀菌素的发酵条件,由公开的杀真菌素链霉菌菌株产生持久杀菌素[higashide等人,j.antibiot.21:126-137(1968)]。在产生之后,可以纯化和/或分析化合物,包括hplc分析。产生持久杀菌素并从生长培养基收获这种化合物的方法可以见于u.s.4,465,771中,其在此以其整体通过引用并入。在具体实施方案中,本发明公开的杀真菌素链霉菌分离物在胰蛋白酶大豆液体培养基(tsb)中在振荡器上培养(例如在225rpm和30℃下培养48小时),且随后转移至持久杀菌素产生培养基(epm,下表1),持续一段时间用于连续发酵,例如至少5天并且多至11天,包括5、6、7、8、9、10或11天的连续发酵。在更具体的实施方案中,在自动发酵罐中进行野生型和衍生菌株的持久杀菌素产生。表1持久杀菌素产生培养基(epm)的组成(ph6.7)成分浓度(%)成分浓度(%)可溶淀粉1.5kh2po40.05葡萄糖1.0(nh4)2so40.15玉米粉2.5caco30.5玉米蛋白粉2.0乳糖0.5玉米浸出液0.25zncl20.005氯化钠0.25鸡油0.7nah2po41.3表2:序列表seqidno:开放阅读框类型seqidno:开放阅读框类型atccno.pta-122342wtb-54771orf2798na15orf2798na2orf2798aa16orf2798aa3orf3866na17orf3866na4orf3866aa18orf3866aa5orf5175na19orf5175na6orf5175aa20orf5175aa7orf5387na21orf5387na8orf5387aa22orf5387aa9orf4755na23orf4755na10orf4755aa24orf4755aa11orf682na25orf682na12orf682aa26orf682aa13orf4868na27orf4868na14orf4868aa28orf4868aaaa是氨基酸序列;na是核酸序列。生物保藏以下生物材料的培养物已经在满足布达佩斯条约要求的条件下保藏在以下国际保藏机构:美国典型培养物保藏中心(atcc)10801universityboulevard,manassas,va.20110-2209,u.s.a。通过参考下述非限制性实施例可以更好地理解本发明,提供所述实施例作为本发明的示例。呈现以下实施例以更充分地说明本发明的优选实施方案。然而,它们决不应被解释为限制本发明的广泛范围。实施例实施例1修饰的杀真菌素链霉菌分离物用于持久杀菌素生物合成的杀真菌素链霉菌生物质的生产杀真菌素链霉菌的发酵可以在深槽卫生设计工业发酵罐中完成,所述发酵罐具有监测和控制ph、温度、氧气、通气和搅拌的系统。杀真菌素链霉菌的每个发酵批次起始于储存在安全位置并保持在低温环境中的生产种子的表征且受控的工作种子储备物。发酵过程分三个阶段进行,随后为进一步下游加工:第一阶段:可以使用含有107-1010个孢子/ml的工作种子培养物以开始发酵批次。从低温储存中取出一至五小瓶冷冻种子并在工作台上自然解冻,或置于28-32℃的水浴中直至内容物解冻。将解冻的培养物无菌转移到在室温下保持的800-1000ml无菌水中,并轻轻混合以重悬培养物。第二阶段:将重悬的培养物无菌转移到种子培养基中。种子培养基由以下构成:葡萄糖(0.5g/l),糊精(2.5g/l),玉米浸出液(1.0-4.0ml/l),大豆粉(3.0g/l),硫酸铵(0.25g/l),磷酸一钾(0.13-0.54g/l),硫酸亚铁(0.00-0.5g/l),氢氧化钾(0.13ml/l),沉淀碳酸钙(1.5g/l),基于硅酮的消泡剂(0.1ml/l)和适量的水。将培养基在125℃下灭菌45分钟,且然后冷却至28℃。使用无菌水将培养基的体积调节至所需的工作体积。将ph调节至6.6-6.8。种子扩增周期的操作参数包括:28℃±2℃的培养温度,0.5-1.5kg/cm2的内部压力,2-4nm3/min的通气速率,和大约80rpm的搅拌速率,其取决于容器的尺寸和构造。监测ph,氧气消耗和粘度,但不进行控制。使培养物生长50-60小时,然后转移到主要生产发酵罐中。转移时的粘度应范围为350-600cps,且ph应≤6.0,并且应存在氧气消耗增加。将种子培养物无菌转移到主发酵培养基中以完成发酵周期。第三阶段:主要生产发酵罐的培养基组合物包括:玉米粉(13.0-15.0w/v%),玉米蛋白粉(3.0-6.0w/v%),棉籽粉(0.3w/v%),玉米浸出液(0-0.6v/v%),氯化钠(0.3w/v%),硫酸铵(0.25-0.6w/v%),乳酸(0-0.5v/v%),氯化锌(0.01w/v%),硫酸亚铁(0.0-0.02w/v%),氢氧化钾(0.20-0.5v/v%),硫酸钙(0.0-0.5w/v%),沉淀碳酸钙(0.5w/v%),α淀粉酶(0.056w/v%),氢氧化钾(0.05v/v%),大豆油(0.5-2.0v/v%),消泡剂和适量的水。所述成分按所列顺序添加。将水添加到所述成分,直至α淀粉酶,然后将所得的组合物加热至80℃,持续15分钟以允许酶分解复杂的碳水化合物。然后,添加剩余的成分,将ph调节至ph6.6-6.8,并添加适量的水。将培养基在125℃下灭菌45分钟,冷却至28℃,并加入适量的水至期望的工作体积。将来自种子发酵罐的内容物转移到主发酵培养基中,并将发酵罐设定为以下条件:温度28℃,通气速率40nm3/min,内部压力0.5kg/cm2,且搅拌速率当量为设定为约1.85kw/m3。从发酵周期开始起2小时后,通过将溶解氧设定为12.75ppm,将通气增加至50nm3/min,并将内部压力增加至0.7kg/cm2,而改变操作条件。随后,调节通气速率,内部压力和搅拌速率以确保溶解氧不是速率限制的决定因素。当粘度增加到溶解氧受限的点时,向培养物添加无菌水。在整个周期过程中,小心控制泡沫以防止污染或流出。在需氧量增加后大约3小时,开始控制ph。在整个发酵周期中控制和/或监测以下参数:ph,通气,溶解氧,co2,粘度,纯度,搅拌速度,内部压力和残余糖。直至细菌生长停止,ph保持在6.8,但然后允许其自然变化直至收获。典型的发酵周期为220-300小时。当生物测定效力大于5,000μg/l,ph升至ph7.5或更高,粘度降低,需氧量停止时,即可收获培养物。通过将培养物加热至70℃,持续30分钟使细菌失活来收获发酵物,且然后将收获液冷却至25-28℃。下游加工:从生物质中除去水,将生物质干燥,然后配制成预混物。实施例2优化杀真菌素链霉菌的持久杀菌素产生的效果多年来,通过亲本菌株的处理获得了产率改善(如表3中所列出)。菌株bm38-2(pta-122342)产生最高的持久杀菌素产率。通过使用一系列培养和物理处理,对gab-453(atcc31729)进行处理而优化菌株。表3:杀真菌素链霉菌b-54577的产率改进atcc号菌株处理产率µg/mlatcc21013(此前公开)b-5477亲本菌株,野生型730atcc21014(此前公开)b-5477mɣ-辐射-atcc31729(此前公开)gab-453uv-辐射1290atcc31730(此前公开)emt36-3m-氟-dl-酪氨酸2560atcc31731(此前公开)emt2-140n-甲基-n'-硝基-n-亚硝基胍和m-氟-dl-酪氨酸4360pta-122342(此前未公开)bm38-2多次培养和物理处理9690参考文献:专利4,465,771;1984年4月14日,nogami等人,takedachemicalindustries,ltd.,osaka,japan;参考文献:专利3,577,530;1971年5月4日,对于atcc21388。1.atcc21013:杀真菌素链霉菌原始野生菌株b-5477,由takeda保藏;2.atcc21014:通过b-5477的ɣ-辐射衍生出的突变体,命名为b-5477m的菌株,由takeda保藏;3.atcc31729:通过b-5477的uv-辐射衍生出的突变体,命名为gab-453的菌株,由takeda保藏;4.atcc31730:通过使b-5477在含有m-氟-dl-酪氨酸(mft)的琼脂平板上生长而获得的突变体;命名为emt-36-3的突变体,由takeda保藏;5.atcc31731:通过使gab-453先后接受n-甲基-n'-硝基-n-亚硝基胍,m-氟-dl-酪氨酸(mft)处理而获得的双突变体,产生命名为emt2-140的突变株,由takeda保藏;6.atcc21388:与杀真菌素链霉菌密切相关的菌株(大孢子链霉菌(s.macrosporeus)),由squibb和sons保藏。就最高至最低的持久霉素生物合成而言:atcc编号:pta-122342>atcc31731>atcc31730>atcc31729>atcc21013和atcc21014。值得注意的是,在将atccpta-122342与产量第二高的分离物进行比较时,获得的持久杀菌素存在大于2倍的增加,和在将atccpta-122342与野生型亲本菌株进行比较时,获得的持久杀菌素存在大于12倍的增加。实施例3:杀真菌素链霉菌分离物的基因组分析在杀真菌素链霉菌野生型菌株atcc21013(b-5477)和本发明的衍生菌株bm38-2之间进行的比较基因组分析,其包括持久杀菌素(持久霉素)生物合成基因簇周围的区域。鉴定了总共77种dna序列变异,辨别出亲本菌株b-5477的物理和培养操作的影响。通过选择位于bm38-2基因组上的11个代表性变异作为突变标记,从基因组分析获得的信息允许快速和确定的菌株比较(参见图1)。对每个突变标记设计pcr引物,其将扩增含有突变位点的dna片段,用于随后的测序和比较(参见表4)。使用靶向标记区域的pcr引物,分析通过atcc可得的五(5)种产生持久霉素的菌株,和一(1)种密切相关的菌株,包括由takeda保藏的野生型和突变体,并与bm38-2菌株进行比较。表5总结了研究结果,并显示了11个突变标记处的dna特征。表4用于扩增定位于杀真菌素链霉菌bm38基因组上的11个突变标记的pcr引物组(和相应的seqidno:)突变标记编号#seqidno:wt†序列bm38-2序列引物引物seq预期大小*(bp)129gasf1fggacgatgccatcaaaaccg73730sf1ractgcttgatcaccgaggtg231acttsf2fctgttcaacctgaccgggaa95432sf2rgaagaccacgacctcgatgg333gasf3fgggcaggagttcttgaggac86434sf3rccacgtcaagaacctggtga435gaatsf4fggcaagtcgaccctcatcaa42836sf4ratgaccgagaacagcgtctc537agsf5fcgcatctgttccaggcaatg45938sf5rtcatcgtggcgcataggtac639gasf6ftgtggggatgtccttcggaa17340sf6rcgacgatgccaagagactgt741agggcgcgggccsf7fggacgatgccatcaaaaccg68542sf7ractgcttgatcaccgaggtg843atgasf8ftgctgctgtcgatcatggag68644sf8raggaagggctggtaggtcat945gcsf9fcgagtccgaagcagaaggag74546sf9rgggtcggcaacatcttcctc1047ctsf10fgagcacacgaggactgagag97648sf10rgtaccccctcatagcgcttc1149ctsf11fagaagtacgggattcgggga100050sf11ractgcttgatcaccgaggtg#突变标记编号;*预期的pcr产物大小;†野生型菌株(wt):atcc21013。表5a与atcc编号pta-122342相比,保藏的杀真菌素链霉菌菌株的突变标记分析突变标记编号atcc21013b-5477亲本atcc21014b-5477matcc21388*atcc31729atcc31730atcc31731pta-1223421wtwtwtwtwtwtm2wtwtwtwtwtwtm3wtwtwtmwtmm4wtwtwtwtwtwtm5wtwtwtmmmm6wtwtwtmmmm7wtwtwtwtwtwtm8wtwtwtwtwtwtm9wtwtwtwtwtwtm10wtmmmmwtm11wtwtwtwtwtwtmwt=匹配亲本野生型。m=匹配pta-122342突变序列;*与杀真菌素链霉菌密切相关的大孢子链霉菌菌株。表5b与bm38-2共有或作为标记用于pcr比较的突变核苷酸编号21013317293173031731bm38-2突变标记编号565,966wtmwtmm4607,443wtmmmm608,938wtmmmm890,965wtmwtmm2,285,216wtwtwtwtm2,387,796wtwtwtwtm72,387,801wtwtwtwtm72,659,327wtmmmm2,900,485wtmmmm2,963,171wtwtwtwtm13,147,522wtmmmm3,164,639wtwtwtwtm83,358,400wtmmmm3,391,492wtmmmm3,428,632wtwtwtmm3,556,837wtmmmm3,607,398wtmmmm3,651,914wtmmmm3,743,503wtmmmm3,823,662wtmmmm4,046,322wtwtwtmm4,158,534wtmmmm4,225,769wtmmmm4,281,871wtmmmm4,294,357wtmmmm4,310,521wtmmmm104,449,891wtwtwtwtm64,450,937wtmmmm4,458,773wtmmmm4,462,128wtmmmm4,478,416wtmmmm4,954,366wtwtwtmm4,989,329wtmmmm5,259,346wtwtwtwtm5,340,994wtmmmm55,349,716wtmwtmm35,757,177wtwtwtwtm115,906,501wtwtwtwtm25,947,737wtmmmm6,140,913wtmmmm6,260,317wtmmmm6,703,003wtmmmm6,706,989wtmmmm7,321,611wtwtwtwtm9wt=匹配亲本野生型。m=匹配pta-122342突变序列。表5a-5b鉴定了亲本菌株(atcc21013b-5477)和早期报道的菌株之间的遗传差异。这些早期报道的菌株中的大多数是通过培养和/或物理操作获得的atcc21013b-5477的衍生菌株。对于bm38-2(atcc编号pta-122342),发现最显著的遗传差异。显而易见的是,表4的引物也可用于明确地从其他杀真菌素链霉菌菌株和/或密切相关的链霉菌属种,鉴定出bm38-2(pta-122342)。实施例4杀真菌素链霉菌bm38-2中选定突变的分析通过反复轮次的诱变,然后选择持久霉素高产突变株,而开发出杀真菌素链霉菌atcc编号pta-122342工业菌株。为了深入了解引入atcc编号pta-122342中的可能促成持久霉素产率提高的突变,确定了atcc编号pta-122342的总基因组序列,并与其野生型杀真菌素链霉菌前身的总基因组序列进行比较。该比较分析鉴定了两个基因组之间至少77种多态性或突变差异。令人惊讶地,在含有持久霉素生物合成基因簇的染色体区域中仅检测到一个差异。这种差异是endc基因中的单个核苷酸变化。endc基因中的核苷酸6,260,317从c到t的突变,导致ctc密码子变为ctt密码子,这是一种沉默突变,因为二者都是亮氨酸的密码子。因此,这种突变不太可能在观察到的bm38-2中持久霉素产率的增加中发挥显著作用。在持久霉素基因簇内不存在其他突变表明,导致bm38-2中持久霉素产率增加的染色体变化可能存在于位于基因组中其他位置的多效性(非途径特异性)调节元件或全局调节基因中。放线菌中的多种响应调节因子已显示在多于一种途径中影响天然产物的生物合成。一个关键实例是在天蓝色链霉菌(s.coelicolor)的cda基因簇中发现的absa1a2基因座,其编码类似于在杀真菌素链霉菌的持久霉素生物合成基因簇中发现的双组分信号转导系统。已显示,磷酸化形式的absa2通过直接干扰cda、放线紫红素和十一烷基灵菌红素生物合成基因簇的途径特异性调节因子的表达,而抑制抗生素的产生。抑制absa2激酶活性的突变从而增强抗生素的产生。多效性调节的另一实例发现于带小棒链霉菌(s.clavuligerus)中,其中在头霉素c簇内发现的基因ccar编码控制头霉素c和克拉维酸二者产生的调节蛋白。atcc编号pta-122342基因组中可能具有与持久霉素产率增加相关的最大可能性的突变可以是通过生物信息学分析预测的编码调节产物(包括可能具有多效性调节特性的那些)的基因中发生的那些突变。下文提供了在杀真菌素链霉菌bm38-2基因组中鉴定的推定调节基因的实例,其与野生型杀真菌素链霉菌菌株相比具有突变差异。[以下实例中每一个中,通过缺失星号突出显示突变差异,并且不同/缺失/插入的核苷酸以粗体突出显示]。序列比较orf682:预测编码tetr家族中的调节蛋白,其含有螺旋-转角-螺旋(hth)dna结合结构域。额外的g插入到同聚轨道(homopolymerictrack)中,诱导移码。>wt_682翻译的基因产物>bm38.2_682翻译的基因产物。orf2798:预测编码murr/rpir家族中的dna结合转录调节因子。它包含螺旋-转角-螺旋(hth)和糖异构酶(sis)结构域。g至a的突变导致gly变为ser。>wt_2798翻译的基因产物>bm38.2_2798翻译的基因产物。orf3866:预测编码ompr家族中的dna结合响应调节因子。它包含rec结构域(其接收来自双组分系统中的传感器配偶体的信号),和链霉菌抗生素调节蛋白(sarp)特征性的翼状螺旋(whth)结构域。g至a的突变导致ala变为thr。>wt_3866翻译的基因产物>bm38.2_3866翻译的基因产物。orf4755:预测编码rna聚合酶σ-70因子,σ-e家族。arg密码子中t至g的突变(cgt->cgg)是沉默突变。>wt_4755翻译的基因产物>bm38.2_4755翻译的基因产物。orf4868:预测编码转录调节蛋白。它包含rec信号接收结构域,其接收来自双组分系统中的传感器配偶体的信号。串联重复序列中的缺失(c的缺失)导致移码突变。>wt_4868翻译的基因产物>bm38.2_4868翻译的基因产物。orf5175:预测编码组氨酸激酶转录调节蛋白。它具有rec信号接收结构域,其接收来自双组分系统中的传感器配偶体的信号。c至t的突变导致pro变为ser。>wt_5175翻译的基因产物>bm38.2_5175翻译的基因产物。orf5387:预测编码merr家族中的转录调节因子。它具有hthdna结合结构域和rec结构域,所述rec结构域接收来自双组分系统中的传感器配偶体的信号。a至c的突变导致tyr变为ser。>wt_5387翻译的基因产物>bm38.2_5387翻译的基因产物。应理解,提供用于描述根据本发明的核酸和多肽的所有碱基大小或氨基酸大小以及所有分子量或分子质量值在常规测量变化内是近似的。pct/ro/134表当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1