使用连接扩增的分子检测的制作方法
本申请要求于2016年12月16日提交的美国临时申请号62/435,424、于2017年3月31日提交的美国临时申请号62/480,107和于2017年5月23日提交的美国临时申请号62/509,995的权益,所述临时申请中的每一个通过引用以其全文并入本文。
关于联邦政府资助研究的声明
本发明是基于国立卫生研究授予的ninds基金sbir1r43ns092180-01在政府支持下完成的。政府对本发明享有一定的权利。
背景技术:
传统第二抗体染色产生平均每个第一抗体大致约15个荧光团的信号,而获得与之相当的信号水平可能具有挑战性。多重标记的反义寡聚体可以提供每个第一抗体大致几个荧光团的信号,但是反义寡聚体的密集标记可能导致荧光团之间的猝灭。本文公开了连接扩增方法以提供与第二抗体扩增相当的更高的信号强度。
技术实现要素:
本文公开了用于检测样品中的靶分子的组合物、试剂盒、方法和系统。在一个方面,本文公开了方法,其包括使样品中的靶分子与检测偶联体接触,其中所述检测偶联体包含第一核酸和第二核酸,其中每个核酸具有靶识别区和自身杂交区,其中所述第一核酸的所述靶识别区与所述靶分子的第一区域结合,其中所述第二核酸的所述靶识别区与所述靶分子的第二区域结合,并且其中所述第一核酸的所述自身杂交区和所述第二核酸的所述自身杂交区进行杂交以形成双链核酸标记。
在一些情况下,所述双链核酸标记具有至少两个连续碱基对,例如,至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少11、至少12、至少13、至少14、至少15、至少20、至少25、至少30、至少35、至少40、至少45、至少50、至少100、至少150、至少200或至少250个连续碱基对。
在一些情况下,所述双链核酸标记具有突出端。在一些情况下,所述突出端具有至少1个未配对核苷酸,例如,至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少11、至少12、至少13、至少14、至少15、至少20、至少25、至少30、至少35、至少40、至少45、至少50、至少100、至少150、至少200或至少250个未配对核苷酸。
在一些情况下,所述靶分子是rna分子。在一些情况下,所述靶分子是mrna分子。在一些情况下,所述第一核酸和所述第二核酸是单链dna。在一些情况下,所述靶分子的所述第一区域和所述第二区域被2至15个核苷酸间隔开。在一些情况下,所述靶分子的所述第一区域和所述第二区域被2至5个核苷酸间隔开。在一些情况下,所述靶分子的所述第一区域和所述第二区域被5至10个核苷酸间隔开。在一些情况下,所述靶分子的所述第一区域和所述第二区域被10至15个核苷酸间隔开。在一些情况下,所述靶分子的所述第一区域和所述第二区域被15至20个核苷酸间隔开。
在一些情况下,所述方法进一步包括使用交联剂将所述检测偶联体固定至所述样品。在一些情况下,所述第一核酸或所述第二核酸具有游离胺(-nh2)修饰。在一些情况下,固定所述检测偶联体包括使所述检测偶联体与胺特异性交联剂接触。
在一些情况下,所述突出端包含一个核苷酸。在一些情况下,所述突出端包含多个核苷酸。在一些情况下,所述突出端包含至少约2、3、4、5、10、15、20、25、30、40、50、60、70、80、90、100、150、200、250、300、350、400、450或500个核苷酸。在一些情况下,所述方法进一步包括使所述双链核酸标记与dna连接酶接触。在一些情况下,所述方法进一步包括使所述双链核酸标记与至少一个检测标记接触。在一些情况下,所述至少一个检测标记是具有与所述双链核酸标记的所述突出端互补的突出端的双链核酸。在一些情况下,所述至少一个检测标记是与所述双链核酸标记的所述突出端互补的单链核酸。在一些情况下,所述至少一个检测标记包括多个检测标记。在一些情况下,使用dna连接酶将所述双链核酸标记和所述至少一个检测标记连接。在一些情况下,所述至少一个检测标记包括至少5、10、15、20、25或30个检测标记。在一些情况下,所述至少一个检测标记包含可切割接头。在一些情况下,所述至少一个检测标记不包含可切割接头。
在一些情况下,所述至少一个检测标记包含检测标签。在一些情况下,所述至少一个检测标记包含多个检测标签。在一些情况下,所述检测标签包括量子点。在一些情况下,所述检测标签包括荧光团。在一些情况下,所述荧光团包括香豆素、罗丹明、呫吨、荧光素或花菁。在一些情况下,所述方法包括检测所述检测标签,从而检测所述样品中所述靶分子的存在。在一些情况下,所述方法包括使所述样品与多个检测偶联体接触。在一些情况下,所述多个检测偶联体中的每一个与不同的靶分子结合。
在一些情况下,所述样品是完整的组织样品。在一些情况下,所述方法包括将所述完整的组织样品包埋到树脂中,使得所述完整的组织样品可以切成厚度在20至1000nm之间的切片。在一些情况下,所述完整的组织样品是骨髓组织样品、胃肠道组织样品、肺组织样品、肝组织样品、前列腺组织样品、神经系统组织样品、泌尿生殖系统组织样品、脑组织样品、乳腺组织样品、肌肉组织样品或皮肤组织样品。在一些情况下,所述方法包括所述完整的组织样品的脱水。在一些情况下,所述方法不包括所述完整的组织样品的脱水。在一些情况下,所述方法包括诊断与所述样品中的所述靶分子的存在相关的病况或疾病。在一些情况下,所述病况或疾病是肾病、感染性疾病、代谢疾病、癌前病况、癌性病况或脑病症。在一些情况下,所述样品是石蜡包埋的组织样品。在一些情况下,所述样品是福尔马林固定石蜡包埋的(ffpe)组织样品。
在一些情况下,所述方法进一步包括使所述双链核酸标记与第三核酸接触,其中所述第三核酸包含与所述第一核酸的序列、所述第二核酸的序列或两者互补的序列。在一个实例中,所述第三核酸包含与所述第一核酸的序列互补的序列。在一个实例中,所述第三核酸包含与所述第二核酸的序列互补的序列。在一个实例中,所述第三核酸包含与所述第一核酸的序列和所述第二核酸的序列互补的序列。在一些情况下,所述第三核酸与所述第一核酸的所述序列、所述第二核酸的所述序列或两者结合。在一个实例中,所述第三核酸与所述第一核酸的所述序列结合。在一个实例中,所述第三核酸与所述第二核酸的所述序列结合。在一个实例中,所述第三核酸与所述第一核酸的所述序列和所述第二核酸的所述序列结合。
在一些情况下,所述双链核酸标记中的所述第一核酸和所述第二核酸各自具有至少一个未配对核苷酸。在一些情况下,所述双链核酸标记中的所述第一核酸和所述第二核酸各自具有至少1个未配对核苷酸,例如,至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少11、至少12、至少13、至少14、至少15、至少20、至少25、至少30、至少35、至少40、至少45、至少50、至少100、至少150、至少200或至少250个未配对核苷酸。在一些情况下,所述第三核酸包含与所述第一核酸的未配对序列、所述第二核酸的未配对序列或两者互补的序列。在一些情况下,所述第三核酸包含与所述第一核酸的全部未配对序列互补的序列。在一些情况下,所述第三核酸包含与所述第二核酸的全部未配对序列互补的序列。在一些情况下,所述第三核酸包含与所述第一核酸的全部未配对序列互补的第一序列以及与所述第二核酸的全部未配对序列互补的第二序列。
在一些情况下,所述第三核酸与所述第一核酸的所述序列和所述第二核酸的所述序列结合,从而产生多路分支。在一些情况下,所述多路分支是n路分支,其中所述n路分支包含n个单链核酸,其连接在一起以形成核酸结构。所述核酸结构可具有n个末端和/或n个突出端。例如,所述多路分支可以是三路分支,其中所述三路分支包含三个单链核酸,其连接在一起以形成具有三个末端和/或三个突出端的核酸结构(参见例如,图17a-图17c和图16c)。在一些情况下,所述三路分支包含至少两个突出端。在一些情况下,所述至少两个突出端中的至少两个包含相同序列或独特序列。在一些情况下,所述至少两个突出端中的至少两个包含互补序列。
在一些情况下,所述方法进一步包括使所述第三核酸与第四核酸接触,其中所述第四核酸包含与所述第一核酸的序列、所述第二核酸的序列、所述第三核酸的序列或其任何组合互补的序列。在一些情况下,所述第四核酸与所述第三核酸的所述序列以及所述第一或第二核酸的所述序列结合,从而产生四路分支(参见例如,图16c)。在一些情况下,所述四路分支包含四个单链核酸,其连接在一起以形成具有四个末端和/或四个突出端的核酸结构。在一些情况下,所述四路分支包含至少三个突出端。在一些情况下,所述至少三个突出端中的至少两个包含相同序列或独特序列。在一些情况下,所述至少三个突出端中的至少两个包含互补序列。
在一些情况下,所述方法进一步包括使所述突出端中的至少一个与检测标记接触。在一些情况下,所述方法进一步包括使所述第三核酸与检测标记接触。在一些情况下,所述方法进一步包括使所述第四核酸与检测标记接触。在一些情况下,所述检测标记包含多路分支。在一些情况下,所述多路分支是三路分支或四路分支。在一些情况下,所述检测标记包含与所述突出端中的至少一个互补的突出端。在一些情况下,所述检测标记通过直接杂交、酶促连接或化学连接与所述突出端中的至少一个连接。
在另一个方面,本文公开了方法,包括使样品中的靶分子与检测分子和反义寡聚体接触,其中所述检测分子包含与所述靶分子结合的至少一个配体,其中所述至少一个配体与单链核酸连接,并且其中所述单链核酸与所述反义寡聚体杂交以形成具有突出端的双链核酸标记。在一些情况下,所述检测分子或反义物包含至少3个核苷酸,例如至少5、至少10、至少15、至少20、至少25、至少30、至少35、至少40、至少45、至少50、至少60、至少70、至少80、至少90、至少100、至少150、至少200、至少250、至少300、至少350、至少400、至少450或至少500个核苷酸。在一些情况下,所述检测分子或所述反义物包含不超过500个核苷酸,例如不超过5、不超过10、不超过15、不超过20、不超过25、不超过30、不超过35、不超过40、不超过45、不超过50、不超过60、不超过70、不超过80、不超过90、不超过100、不超过150、不超过200、不超过250、不超过300、不超过350、不超过400、不超过450或不超过500个核苷酸。在一些情况下,所述检测分子或所述反义物包含约3-500个核苷酸,例如,约3-500、约3-400、约3-300、约3-200、约3-100、约3-50、约3-20、约3-10、约10-500、约10-400、约10-300、约10-200、约10-100、约10-50、约10-20、约20-500、约20-400、约20-300、约20-200、约20-100、约20-50、约50-500、约50-400、约50-300、约50-200、约50-100、约100-500、约100-400、约100-300、约100-200、约200-500、约200-400、约200-300、约300-500、约300-400或约400-500个核苷酸。例如,所述检测分子或反义物可包含约3-150个核苷酸。
在一些情况下,所述配体是抗体。在一些情况下,所述靶分子是蛋白质。在一些情况下,所述突出端包含一个核苷酸。在一些情况下,所述突出端包含多个核苷酸。在一些情况下,所述方法进一步包括使所述双链核酸标记与dna连接酶接触。在一些情况下,所述方法进一步包括使所述双链核酸标记与至少一个检测标记接触。在一些情况下,所述至少一个检测标记是具有与所述双链核酸标记的所述突出端互补的突出端的双链核酸。在一些情况下,所述至少一个检测标记是多个检测标记。在一些情况下,所述至少一个检测标记是与所述双链核酸标记的所述突出端互补的单链核酸。在一些情况下,所述至少一个检测标记包括多个检测标记。在一些情况下,所述至少一个检测标记包括至少5、10、15、20、25或30个检测标记。在一些情况下,所述至少一个检测标记包含可切割接头。在一些情况下,所述至少一个检测标记不包含可切割接头。
在一些情况下,所述至少一个检测标记包含检测标签。在一些情况下,所述至少一个检测标记包含多个检测标签。在一些情况下,所述检测标签包括量子点。在一些情况下,所述检测标签包括荧光团。在一些情况下,所述荧光团包括香豆素、罗丹明、呫吨、荧光素或花菁。在一些情况下,所述方法包括检测所述检测标签,从而检测所述样品中靶分子的存在。在一些情况下,所述方法包括使所述样品与多个检测分子接触。在一些情况下,所述多个检测分子中的每一个与不同的靶分子结合。
在一些情况下,所述检测标记包含至少3个核苷酸,例如至少5、至少10、至少15、至少20、至少25、至少30、至少35、至少40、至少45、至少50、至少60、至少70、至少80、至少90、至少100、至少150、至少200、至少250、至少300、至少350、至少400、至少450或至少500个核苷酸。在一些情况下,所述检测标记包含不超过500个核苷酸,例如不超过5、不超过10、不超过15、不超过20、不超过25、不超过30、不超过35、不超过40、不超过45、不超过50、不超过60、不超过70、不超过80、不超过90、不超过100、不超过150、不超过200、不超过250、不超过300、不超过350、不超过400、不超过450或不超过500个核苷酸。在一些情况下,所述检测标记包含约3-500个核苷酸,例如,约3-500、约3-400、约3-300、约3-200、约3-100、约3-50、约3-20、约3-10、约10-500、约10-400、约10-300、约10-200、约10-100、约10-50、约10-20、约20-500、约20-400、约20-300、约20-200、约20-100、约20-50、约50-500、约50-400、约50-300、约50-200、约50-100、约100-500、约100-400、约100-300、约100-200、约200-500、约200-400、约200-300、约300-500、约300-400或约400-500个核苷酸。例如,所述检测标记可包含约3-150个核苷酸。
在一些情况下,所述样品是完整的组织样品。在一些情况下,所述方法包括将所述完整的组织样品包埋到树脂中,使得所述完整的组织样品可以切成厚度在20至1000nm之间的切片。在一些情况下,所述完整的组织样品是骨髓组织样品、胃肠道组织样品、肺组织样品、肝组织样品、前列腺组织样品、神经系统组织样品、泌尿生殖系统组织样品、脑组织样品、乳腺组织样品、肌肉组织样品或皮肤组织样品。在一些情况下,所述方法包括所述完整的组织样品的脱水。在一些情况下,所述方法不包括所述完整的组织样品的脱水。在一些情况下,所述方法包括诊断与所述样品中靶分子的存在相关的病况或疾病。在一些情况下,所述病况或疾病是肾病、感染性疾病、代谢疾病、癌前病况、癌性病况或脑病症。
在一些情况下,所述靶分子包括基因编辑测定中的组分。在一些情况下,所述基因编辑测定是crispr测定。在一些情况下,所述基因编辑测定是crispr/cas测定。在一些情况下,所述基因编辑测定是ngago测定。在一些情况下,所述组分包括cas核酸酶、靶dna、靶向dna的rna、反式激活crrna(tracrrna)、供体修复模板或其任何组合。在一些情况下,所述组分包括cas核酸酶。在一些情况下,所述组分包括cas9核酸酶。在一些情况下,所述靶分子包括细胞分子。在一些情况下,所述靶分子包括细胞表面分子。在一些情况下,所述靶分子包括碳水化合物、脂质、蛋白质或核酸。在一些情况下,所述靶分子包括蛋白质。在一些情况下,所述蛋白质包括细胞骨架蛋白、细胞外基质蛋白、血浆蛋白、凝血因子、急性期蛋白、血红素蛋白、细胞粘附、跨膜转运蛋白、离子通道、同向转运/反向转运蛋白、激素、生长因子、受体、dna结合蛋白、rna结合蛋白、转录调节蛋白、免疫系统蛋白、营养储存或转运蛋白、伴侣蛋白、酶或其任何组合。在一些情况下,所述靶分子包括核酸。在一些情况下,所述核酸包括mrna、trna、rrna、snrna、非编码rna分子或其任何组合。
在一些情况下,所述方法进一步包括使所述双链核酸标记与检测标记接触。在一些情况下,所述检测标记包含多路分支。在一些情况下,所述多路分支是三路分支或四路分支。在一些情况下,所述检测标记包含与所述双链核酸标记的所述突出端互补的突出端。在一些情况下,所述检测标记通过直接杂交、酶促连接或化学连接与所述双链核酸标记的所述突出端连接。
在一些情况下,所述方法进一步包括使所述检测标记与第二检测标记接触。在一些情况下,所述第二检测标记包含多路分支。在一些情况下,所述多路分支是三路分支或四路分支。在一些情况下,所述第二检测标记包含与所述检测标记的所述突出端互补的突出端。
在另一个方面,本文公开了组合物,其包含:检测偶联体,其中所述检测偶联体包含第一核酸和第二核酸,其中每个核酸具有靶识别区和自身杂交区,其中所述第一核酸的所述靶识别区与靶分子的第一区域结合,其中所述第二核酸的所述靶识别区与所述靶分子的第二区域结合,并且其中所述第一核酸的所述自身杂交区和所述第二核酸的所述自身杂交区进行杂交以形成双链核酸标记。在一些情况下,所述双链核酸标记具有至少两个连续碱基对,例如,至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少11、至少12、至少13、至少14或至少15个连续碱基对。在一些情况下,所述双链核酸标记具有突出端。在一些情况下,所述突出端包含一个核苷酸。在一些情况下,所述突出端包含多个核苷酸。在一些情况下,所述突出端包含至少5、10、15、20、25或30个核苷酸。在一些情况下,所述突出端具有至少1个未配对核苷酸,例如,至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少11、至少12、至少13、至少14或至少15个未配对核苷酸。在一些情况下,所述靶分子是mrna分子。在一些情况下,所述第一核酸和所述第二核酸是单链dna。在一些情况下,所述第一核酸和所述第二核酸中的每一个具有游离胺(-nh2)修饰。在一些情况下,所述组合物进一步包含dna连接酶。在一些情况下,所述组合物进一步包含至少一个检测标记。在一些情况下,所述至少一个检测标记是具有与所述双链核酸标记的所述突出端互补的突出端的双链核酸。在一些情况下,所述至少一个检测标记是与所述双链核酸标记的所述突出端互补的单链核酸。在一些情况下,所述至少一个检测标记包括多个检测标记。在一些情况下,所述至少一个检测标记包括至少5、10、15、20、25或30个检测标记。在一些情况下,所述至少一个检测标记不包含可切割接头。在一些情况下,所述至少一个检测标记包含可切割接头。在一些情况下,所述至少一个检测标记包含检测标签。在一些情况下,所述至少一个检测标记包含多个检测标签。在一些情况下,所述检测标签包括量子点。在一些情况下,所述检测标签包括荧光团。在一些情况下,所述荧光团包括香豆素、罗丹明、呫吨、荧光素或花菁。在一些情况下,所述组合物包含多个检测偶联体。在一些情况下,所述多个检测偶联体中的每一个与不同的靶分子结合。
在另一个方面,所述组合物进一步包含第三核酸,其中所述第三核酸包含与所述第一核酸的序列、所述第二核酸的序列或两者互补的序列。在一些情况下,所述第三核酸包含与所述第一核酸的序列互补的序列。在一些情况下,所述第三核酸包含与所述第二核酸的序列互补的序列。在一些情况下,所述第三核酸包含与所述第一核酸的序列和所述第二核酸的序列互补的序列。在一些情况下,所述第三核酸与所述第一核酸的所述序列和所述第二核酸的所述序列结合,从而产生多路分支。在一些情况下,所述多路分支是三路分支。在一些情况下,所述三路分支包含至少两个突出端。
在一些情况下,所述组合物进一步包含第四核酸,其中所述第四核酸包含与所述第一核酸的序列、所述第二核酸的序列、所述第三核酸的序列或其任何组合互补的序列。在一些情况下,所述第四核酸与所述第三核酸的所述序列以及所述第一或第二核酸的所述序列结合,从而产生四路分支。在一些情况下,所述四路分支包含至少三个突出端。在一些情况下,所述突出端中的至少两个包含相同序列或独特序列。在一些情况下,所述突出端中的至少两个包含互补序列。
在一些情况下,所述组合物进一步包含检测标记。在一些情况下,所述检测标记包含多路分支。在一些情况下,所述多路分支是三路分支或四路分支。在一些情况下,所述检测标记包含与所述突出端中的至少一个互补的突出端。
在另一个方面,本文公开了组合物,其包含:检测分子和反义寡聚体,其中所述检测分子包含与靶分子结合的至少一个配体,其中所述至少一个配体与单链核酸连接,并且其中所述单链核酸与所述反义寡聚体杂交以形成具有突出端的双链核酸标记。在一些情况下,所述配体是抗体。在一些情况下,所述靶分子是蛋白质。在一些情况下,所述突出端包含一个核苷酸。在一些情况下,所述突出端包含多个核苷酸。在一些情况下,所述突出端包含至少5、10、15、20、25或30个核苷酸。在一些情况下,所述组合物进一步包含dna连接酶。在一些情况下,所述组合物进一步包含至少一个检测标记。在一些情况下,所述至少一个检测标记是具有与所述双链核酸标记的所述突出端互补的突出端的双链核酸。在一些情况下,所述至少一个检测标记是与所述双链核酸标记的所述突出端互补的单链核酸。在一些情况下,所述至少一个检测标记包括至少5、10、15、20、25或30个检测标记。在一些情况下,所述至少一个检测标记包含可切割接头。在一些情况下,所述至少一个检测标记不包含可切割接头。在一些情况下,所述至少一个检测标记包含检测标签。在一些情况下,所述至少一个检测标记包含多个检测标签。在一些情况下,所述检测标签包括量子点。在一些情况下,所述检测标签包括荧光团。在一些情况下,所述荧光团包括香豆素、罗丹明、呫吨、荧光素或花菁。在一些情况下,所述组合物包含多个检测分子。在一些情况下,所述多个检测分子中的每一个与不同的靶分子结合。
在一些情况下,所述靶分子包括基因编辑测定中的组分。在一些情况下,所述基因编辑测定是crispr测定。在一些情况下,所述基因编辑测定是crispr/cas测定。在一些情况下,所述基因编辑测定是ngago测定。在一些情况下,所述组分包括cas核酸酶、靶dna、靶向dna的rna、反式激活crrna(tracrrna)、供体修复模板或其任何组合。在一些情况下,所述组分包括cas核酸酶。在一些情况下,所述组分包括cas9核酸酶。在一些情况下,所述靶分子包括细胞分子。在一些情况下,所述靶分子包括细胞表面分子。在一些情况下,所述靶分子包括碳水化合物、脂质、蛋白质或核酸。在一些情况下,所述靶分子包括蛋白质。在一些情况下,所述蛋白质包括细胞骨架蛋白、细胞外基质蛋白、血浆蛋白、凝血因子、急性期蛋白、血红素蛋白、细胞粘附、跨膜转运蛋白、离子通道、同向转运/反向转运蛋白、激素、生长因子、受体、dna结合蛋白、rna结合蛋白、转录调节蛋白、免疫系统蛋白、营养储存或转运蛋白、伴侣蛋白、酶或其任何组合。在一些情况下,所述靶分子包括核酸。在一些情况下,所述核酸包括mrna、trna、rrna、snrna、非编码rna分子或其任何组合。
在一些情况下,所述至少一个检测标记包含与所述双链核酸标记的所述突出端互补的突出端。在一些情况下,所述至少一个检测标记包含多路分支。在一些情况下,所述多路分支是三路分支或四路分支。在一些情况下,所述至少一个检测标记通过直接杂交、酶促连接或化学连接与所述双链核酸标记的所述突出端连接。
在一些情况下,所述组合物进一步包含第二检测标记。在一些情况下,所述第二检测标记包含与所述至少一个检测标记的所述突出端互补的突出端。在一些情况下,所述第二检测标记包含多路分支。在一些情况下,所述多路分支是三路分支或四路分支。
在另一个方面,本文公开了可用于上述方法的试剂盒,其包含:检测偶联体,其中所述检测偶联体包含第一核酸和第二核酸,其中每个核酸具有靶识别区和自身杂交区,其中所述第一核酸的所述靶识别区与靶分子的第一区域结合,其中所述第二核酸的所述靶识别区与所述靶分子的第二区域结合,并且其中所述第一核酸的所述自身杂交区和所述第二核酸的所述自身杂交区进行杂交以形成双链核酸标记;以及用于当使所述检测偶联体与所述靶分子接触时使用的第一试剂。在一些情况下,所述双链核酸标记具有突出端。在一些情况下,所述试剂盒包含一种或多种上述组合物。
在另一个方面,本文公开了可用于上述方法的试剂盒,其包含:检测分子和反义寡聚体,其中所述检测分子包含与靶分子结合的至少一个配体,其中所述至少一个配体与单链核酸连接,并且其中所述单链核酸与所述反义寡聚体杂交以形成具有突出端的双链核酸标记;以及用于当使所述检测偶联体与所述靶分子接触时使用的第一试剂。
在一些情况下,所述试剂盒进一步包含用于检测所述靶分子的第二试剂。
在一些情况下,所述靶分子包括基因编辑测定中的组分。在一些情况下,所述基因编辑测定是crispr测定。在一些情况下,所述基因编辑测定是crispr/cas测定。在一些情况下,所述基因编辑测定是ngago测定。在一些情况下,所述组分包括cas核酸酶、靶dna、靶向dna的rna、反式激活crrna(tracrrna)、供体修复模板或其任何组合。在一些情况下,所述组分包括cas核酸酶。在一些情况下,所述组分包括cas9核酸酶。在一些情况下,所述靶分子包括细胞分子。在一些情况下,所述靶分子包括细胞表面分子。在一些情况下,所述靶分子包括碳水化合物、脂质、蛋白质或核酸。在一些情况下,所述靶分子包括蛋白质。在一些情况下,所述蛋白质包括细胞骨架蛋白、细胞外基质蛋白、血浆蛋白、凝血因子、急性期蛋白、血红素蛋白、细胞粘附、跨膜转运蛋白、离子通道、同向转运/反向转运蛋白、激素、生长因子、受体、dna结合蛋白、rna结合蛋白、转录调节蛋白、免疫系统蛋白、营养储存或转运蛋白、伴侣蛋白、酶或其任何组合。在一些情况下,所述靶分子包括核酸。在一些情况下,所述核酸包括mrna、trna、rrna、snrna、非编码rna分子或其任何组合。
在一些情况下,所述试剂盒包含任何本文公开的组合物。
根据以下在其中仅示出和描述了本公开内容的说明性实施方案的详细描述,本公开内容的另外的方面和优点对于本领域技术人员将变得显而易见。如将认识到的,本公开内容能够具有其他和不同的实施方案,并且其若干细节能够在各种明显的方面进行修改,所有这些都不脱离本公开内容。因此,附图和描述本质上将被认为是说明性而非限制性的。
援引并入
本说明书中提及的所有出版物、专利和专利申请均通过引用并入,其程度如同特别地且单独地指出每个单独的出版物、专利或专利申请通过引用而并入。
附图说明
本发明的新颖特征在所附权利要求中具体阐述。通过参考以下对利用本发明的原理的说明性实施方案加以阐述的详细描述以及附图(本文也称为“图”),将获得对本发明的特征和优点的更好理解,在这些附图中:
图1图示了使用本文所述的组合物、试剂盒、方法和系统的示例性过程。
图2a图示了用于检测组织样品中的靶分子的示例性连接寡聚化方法。
图2b图示了用于检测组织样品中的靶分子的示例性模板化寡聚化方法。
图3图示了与具有单个鸟嘌呤(g)突出端的双链核酸(例如,dna)标记连接的抗体。
图4a图示了检测偶联体,包括第一核酸和第二核酸,其中每个核酸可具有识别区(例如,rna识别区)、自身杂交区和可固定末端。图4b图示,第一核酸和第二核酸的自身杂交区可以杂交以形成具有突出端的双链核酸标记。
图5图示,检测分子的双链核酸标记可以用具有相同序列的四个双链检测标记通过连接反应进行扩增。
图6示意性地图示了实施本公开内容的方法的示例性控制系统。
图7a-图7j图示了来自10个(70nm)切片的dna标记的乙酰化微管蛋白的最大投影。图7a图示了经由连接寡聚化可视化的dna标记的第一抗体。图7b图示了在相同组织切片中通过传统的荧光第二抗体可视化的相同dna-第一抗体。图7c图示了在与图4a和图4b相同的组织中用荧光标记的反义寡聚体可视化的dna标记的第一抗体。图7d-图7f图示了图7a-图7c的特写视图(由黄色框突出显示)。图7d图示了细胞核的脱靶连接可视化的点,其在图7e(白色箭头)中不存在。图7f图示了同样引起脱靶信号的反义检测,尽管细胞核具有较少的标记。图7g-图7i图示在不同组织中,dna标记的突触蛋白抗体可在磷酸酶和超声处理dna封闭物后可视化。图7g图示了细胞核标记的显著减少,使得脱靶标记(白色箭头)与第二抗体检测图7h(白色箭头)具有同等水平。图7i图示,超声处理的dna封闭物也改善了反义检测噪声。图7j图示了每种方法在对数刻度下的叠加的强度直方图。
图8图示了包含27个皮质切片的投影的组。
图9图示了使用9种抗体对相同结构(皮质突触)的同时靶向。
图10a-图10d图示了使用标签测序快速检测多重抗原的实例。图10a图示了寡聚体模块的顺序检测的循环1,然后通过限制性内切核酸酶切割来去除荧光标记的寡聚体。图10b图示了寡聚体模块的顺序检测的循环2,然后通过限制性内切核酸酶切割来去除荧光标记的寡聚体。图10c图示了寡聚体模块的顺序检测的循环3,然后通过限制性内切核酸酶切割来去除荧光标记的寡聚体。图10d图示,使用在成像循环中生成的颜色组合,可以重建每种抗原的最终图像。
图11a图示了围绕gfp标记的神经元的突触蛋白标记。图11b图示了使用荧光dna寡聚体进行的突触蛋白的通道一检测。图11c图示了使用荧光dna寡聚体进行的突触蛋白的通道二检测。图11d图示了使用第二抗体进行的突触蛋白的通道三检测。图11e图示了所有三个通道的合成。
图12a图示了使用在10um石蜡切片(例如,福尔马林固定石蜡包埋的(ffpe)组织)上获得的dna缀合的抗ac微管蛋白抗体可视化的乙酰化微管蛋白。图12b图示了在内切核酸酶溶液中处理30分钟去除乙酰化微管蛋白信号后的相同切片。图12c图示了使用第二抗体复染的相同的组织。图12d图示了来自图12a和图12c的黄色框中的乙酰化微管蛋白结构的特写视图。图12e图示了具有神经胶质瘤的皮质组织中的乙酰化微管蛋白染色。
图13a-图13b比较了两种连接影响方法。图13a图示了通过连接寡聚化方法的荧光扩增。通过特异性识别粘性末端,将具有荧光团的小dna双链体依次连接到生长的链上,导致荧光信号的扩增。图13b图示了通过模板寡聚化的荧光扩增。通过顺序杂交和单链小dna与荧光团的连接产生荧光扩增,导致荧光信号的扩增。
图14a-图14f图示了用于档案成像的dna-抗体档案免疫组织化学。图14a图示了抗原上的dna缀合的第一抗体。图14b图示了缀合物的反义检测。图14c图示了组织的模板化连接检测和成像。图14d图示了使用内切核酸酶去除所有检测dna。图14e-图14f图示,组织可以脱水并以双链(图14e)或单链形式(图14f)储存。图14e图示,组织可以脱水并以双链或单链形式储存。可以通过变性或酶消化去除反义物。图14f图示在去除反义物后,具有dna缀合的第一抗体的染色组织恢复到原始抗体染色状态,从而准备进行新鲜荧光检测。
图15a-图15f图示了信号扩增和检测的实例。图15a示出,标记的靶标可以被单个探针识别,该探针与标签上的互补区碱基配对。图15b示出,长探针可以对接n个检测标记(例如检测物……第n个检测物)。图15c示出,长的第一检测物标记(例如,第一检测物)可以与短探针杂交。图15d示出,可以使用单标记或多标记的双链体检测物代替单链寡核苷酸的添加。图15e示出,可以使用n分支检测物代替线性双链体检测物来构建延伸的标记结构。图15f示出,在n分支结构的延伸中,线性和分支检测物可以混合。
图16a-图16e图示了线性和分支双链体连接寡聚化的实例。图16a示出了具有独特互补末端[α和α’]及[β和β’]的标记双链体核酸单元。图16b示出了使用交替的α/β和α’/β’标记的双链体单元的线性扩增。图16c示出了示例性的3路和4路分支结构。图16d示出了通过3路分支的循环生成的结构。图16d示出了通过4路分支的循环生成的结构。
图17a-图17c图示了原位核酸检测中的分支扩增的实例。图17a示出,两个相邻的核酸探针可以生成茎发夹结构,第二探针可与之杂交。图17b示出,两个核酸邻接探针可以生成3路分支结构。图17c示出,探针的杂交生成3路分支结构,其可直接用于分支扩增。
图18a-图18i图示,分支寡聚化极大地放大了福尔马林固定石蜡包埋的(ffpe)组织中的信号。图18a示出了具有alexa-594标记的第二抗体的图像。图18b示出了使用分支“t”和alexa-594标记的线性检测物经过两个循环的图像。图18c示出了使用分支“t”和alexa-594标记的线性检测物经过四个循环的图像。图18d示出了使用分支“t”和alexa-594标记的线性检测物经过六个循环的图像。图18e示出了使用分支“t”和alexa-594标记的线性检测物经过八个循环的图像。图18f示出了使用分支“t”和alexa-594标记的线性检测物经过十个循环的图像。图18g示出了叠加有细胞体掩模的6个循环的扩增的实例。图18h示出了图18g中使用的细胞体掩模。图18i示出了第二抗体(菱形)和2-10个循环的分支寡聚化(圆形)的细胞体掩模内的像素的平均像素强度。
图19a-图19f图示了用dna标记的抗乙酰化微管蛋白第一抗体标记的小鼠大脑皮质切片的70nm厚的示例性图像,在油浸下以63x/1.4na成像。图19a示出了具有alexa-594标记的第二抗体的图像。图19b示出了使用分支“t”和alexa-594标记的线性检测物经过两个循环的图像。图19c示出了使用分支“t”和alexa-594标记的线性检测物经过四个循环的图像。图19d示出了使用分支“t”和alexa-594标记的线性检测物经过六个循环的图像。图19e示出了使用分支“t”和alexa-594标记的线性检测物经过八个循环的图像。图19f示出了第二抗体(菱形)和2-8个循环的分支寡聚化(圆形)的平均图像强度(来自16位图像的灰度值)。
具体实施方式
除非另有定义,否则本文使用的所有技术和科学术语具有与本公开内容所属领域的普通技术人员通常理解的含义相同的含义。尽管与本文描述的那些方法和材料类似或等同的任何方法和材料都可用于本文的制剂或单位剂量的实践或测试,但现在描述一些方法和材料。除非另有说明,否则本文采用或考虑的技术是标准方法。材料、方法和实例仅是说明性而非限制性的。
在本文的附图、权利要求和说明书中阐述了一个或多个发明实施方案的细节。除非明确排除,否则本文公开和考虑的发明实施方案的其他特征、目的和优点可以与任何其他实施方案组合。
如本文所用,除非另有说明,否则诸如“含有”、“包括”等术语意指“包含”。
如本文所用,除非另有说明,否则任何实施方案均可与任何其他实施方案组合。
如本文所用,除非另有说明,否则本文的一些发明实施方案考虑了数值范围。当存在范围时,范围包括该范围端点。此外,范围内的每个子范围和值均如同明确写出一样存在。
与参考数值相关的术语“约”可包括该值加上或减去10%的值的范围。例如,“约10”的量包括9至11的量,其包括参考数目9、10和11。与参考数值相关的术语“约”还可以包括该值加上或减去10%、9%、8%、7%、6%、5%、4%、3%、2%或1%的值的范围。
除非上下文另有明确规定,否则本文使用的单数形式“一个”、“一种”和“该”包括复数指代物。
替代物(例如,“或”)的使用应理解为意指替代物的一个、两个或其任何组合。
如本文所用的术语“核酸”通常是指任何长度的聚合形式的核苷酸。核酸可包括核糖核苷酸、脱氧核糖核苷酸或肽核酸(pna),其包含嘌呤和嘧啶碱基,或其他天然的、化学或生物化学修饰的、非天然的或衍生的核苷酸碱基。核酸可以是单链或双链的。多核苷酸的骨架可包含糖和磷酸基团,如通常可见于rna或dna的,或经修饰或取代的糖或磷酸基团。多核苷酸可包含修饰核苷酸,如甲基化核苷酸和核苷酸类似物。核苷酸序列可被非核苷酸组分中断。因此,术语核苷、核苷酸、脱氧核糖核苷和脱氧核糖核苷酸通常包括诸如本文所述的那些类似物。这些类似物是具有与天然存在的核苷或核苷酸相同的一些结构特征的那些分子,使得当这些类似物掺入核酸或寡核苷酸序列时,它们允许与溶液中的天然存在的核酸序列杂交。通常,这些类似物通过替代和/或修饰碱基、核糖或磷酸二酯部分而衍生自天然存在的核苷和核苷酸。可根据需要调整变化以稳定或破坏杂交体形成或者增强与互补核酸序列的杂交的特异性。核酸分子可以是dna分子。核酸分子可以是rna分子。核酸分子可以是合成分子。核酸分子可以是与dna或rna配对的合成分子。
如本文所用,术语“ihc”或“免疫组织化学”是指在组织切片的细胞中选择性地对抗原(例如,蛋白质或核酸)成像的过程。该方法可以使用与生物组织中的特定抗原结合的抗体。检测信号(例如,荧光)可以通过如本文提供的连接扩增方法进行扩增。在一些实施方案中,经由连接寡聚化扩增检测信号。在一些实施方案中,经由模板化寡聚化扩增检测信号。
实施本发明利用了分子生物学领域的常规技术。公开用于本发明的一般方法的基本文献包括sambrook和russell,molecularcloning,alaboratorymanual(第3版,2001);kriegler,genetransferandexpression:alaboratorymanual(1990);以及currentprotocolsinmolecularbiology(ausubel等人编著,1994)。
概述
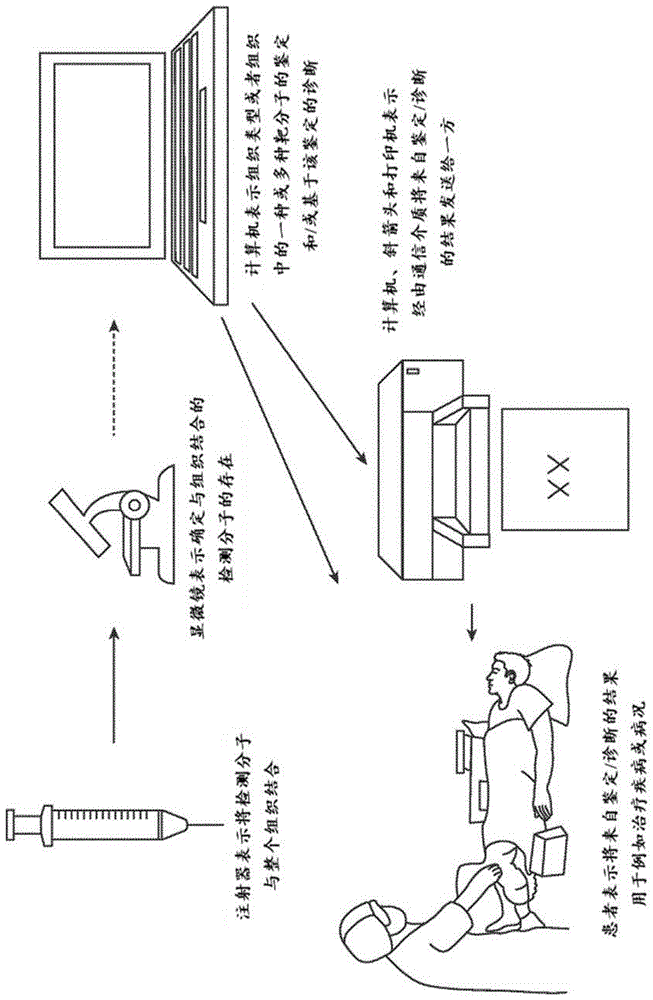
本文公开了用于检测样品中的靶分子的组合物、试剂盒、方法和系统。图1图示了使用本文所述的组合物、试剂盒、方法和系统的示例性过程。首先,检测分子可用于接触样品(例如,整个组织样品)。可以通过成像指令(例如,显微镜)检测检测分子的存在。然后,计算机系统可用于鉴定一种或多种组织类型、样品中的一种或多种靶分子和/或一种或多种情况。结果可以传达给医生或医师,以鉴定或诊断疾病或病况。
在一些实施方案中,本文提供的连接扩增方法可包括:使样品中的靶分子与具有突出端的检测分子(例如,检测偶联体)接触;使检测分子与具有互补突出端的一个或多个双链核酸接触;以及使用dna连接酶将一个或多个双链核酸连接到检测分子上(例如,以扩增检测信号)。该方法在本文中也可称为连接寡聚化。
在另一个实施方案中,本文提供的连接扩增方法可包括:使样品中的靶分子与具有突出端的检测分子(例如,检测偶联体)接触;使检测分子和与该检测分子的突出端序列互补的一个或多个单链核酸接触;以及使用dna连接酶将一种或多种单链核酸连接到检测分子上(例如,以扩增检测信号)。该方法在本文中也可称为模板化寡聚化。术语“模板化寡聚化”和“受控寡聚化”在本文中可互换使用,是指这样的连接扩增方法,其包括和与检测偶联体突出端互补的至少一个单链检测标记接触。包括连接寡聚化或模板化寡聚化以检测组织样品201中的靶分子的示例性方法图示于图2a、图2b和图13中。图2a图示了用于检测组织样品201中的靶分子的示例性连接寡聚化方法。在一些情况下,靶分子可以是mrna分子202。该方法可包括使靶分子与检测偶联体接触,其中所述检测偶联体包含第一核酸203和第二核酸204。第一核酸203和第二核酸204可各自具有靶识别区205a和205b,以及自身杂交区206a和206b。第一核酸的靶识别区205a可与靶分子的第一区域结合,第二核酸的靶识别区205b可与靶分子的第二区域结合。可使第一核酸的自身杂交区206a和第二核酸的自身杂交区206b杂交以形成双链核酸标记206a和206b。双链核酸标记206a和206b可具有至少三个连续碱基对。双链核酸标记206a和206b可具有突出端207。该方法可进一步包括使双链核酸标记206a和206b与检测标记208接触,其中所述检测标记208是具有与双链核酸标记206的突出端207互补的突出端209的双链核酸。检测标记208可包含检测标签(例如,荧光团)。该方法可进一步包括使检测标记与dna连接酶210接触,其中所述dna连接酶210可使检测标记208与双链核酸标记206a和206b连接。
本文提供的连接寡聚化方法可进一步包括dna连接酶210多次重复连接过程,并将多个双链检测标记208添加至双链核酸标记206a和206b,从而扩增检测信号以供成像应用。
图2b图示了用于检测组织样品201中的靶分子的示例性模板化寡聚化方法。例如,本文提供的模板化寡聚化方法可进一步包括检测偶联体,其中所述检测偶联体包含第一核酸203和第二核酸204。第一核酸203和第二核酸204可各自具有靶识别区205a和205b,以及自身杂交区206a和205b。在模板化寡聚化的一些实施方案中,该方法可进一步包括使双链核酸标记206a和206b与检测标记208接触,其中所述检测标记208是具有与双链核酸标记206的突出端207互补的突出端209的双链核酸。检测标记208可包含检测标签(例如,荧光团)。该方法可进一步包括使检测标记与dna连接酶210接触,其中所述dna连接酶210可使检测标记208与双链核酸标记206a和206b连接。该方法可进一步包括将突出端211合成到链213上。在模板化寡聚化的另一个实施方案中,检测偶联体可进一步包括包含多个核苷酸的突出端211,例如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个核苷酸,其中所述突出端与多个单链核酸检测标记212互补。检测标记212可包含检测标签(例如,荧光团)。模板化寡聚化方法可进一步包括使多个检测标记212与dna连接酶210接触,其中所述dna连接酶210可使多个检测标记212与突出端211连接。在一些情况下,至少两个检测标记的序列是相同的,例如,至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少11、至少12、至少13、至少14、或至少15、或至少16、或至少17、或至少18、或至少19、或至少20个检测标记的序列是相同的。在一些实施方案中,至少第一检测标记的序列与至少第二检测标记的序列不同。在一些实施方案中,多个检测标记可包含至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个检测标记212,其中第一检测标记的序列与突出端211的至少前两个连续核苷酸互补,第二检测标记的序列与突出端211的至少第3-4个连续核苷酸互补,第三检测标记的序列与突出端211的至少第5-6个连续核苷酸互补,等等。本文提供的方法可扩增检测信号以供成像应用。
在一些实施方案中,荧光检测信号通过连接寡聚化扩增,如图13a中所示。在一些实施方案中,荧光检测信号通过模板寡聚化扩增,其中通过单链小dna与荧光团的顺序杂交和连接产生荧光扩增,如图13b中所示。
本文公开的方法可包括使样品或检测分子与至少一个检测标记(例如,双链dna)接触,其中所述至少一个检测标记具有与双链核酸标记的突出端互补的突出端。本文公开的方法可包括使样品或检测分子与至少一个检测标记(例如,单链dna)接触,其中所述至少一个检测标记与检测偶联体的第一链或第二链的突出端互补。至少一个检测标记可以是核酸分子,如单链dna、单链rna或双链dna。例如,如果双链核酸标记具有突出端序列:5’-tag-3’,则检测标记可具有互补的突出端序列:3’-atc-5’。例如,如果单链核酸标记的序列是5’-ggta-3’,则突出端序列包含3’-ccat-5’。检测标记的突出端序列可与特定双链核酸标记的突出端独特地互补。检测标记的突出端序列可与多个双链核酸标记,例如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19至20个双链核酸标记的突出端互补。类似地,双链核酸标记的突出端序列可与特定检测标记的突出端独特地互补。双链核酸标记的突出端序列可与多个检测标记,例如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19至20个检测标记的突出端互补。
本文公开的方法可包括使样品或检测分子与至少一种dna连接酶接触。dna连接酶可通过催化磷酸二酯键的形成来促进dna链连接在一起。例如,dna连接酶可包括大肠杆菌(e.coli)dna连接酶、t4dna连接酶或者哺乳动物dna连接酶i、ii、iii或iv。
可将双链核酸标记连接至第一检测标记以形成扩增的双链核酸标记,例如,使用dna连接酶。扩增的双链核酸标记可连接至第二检测标记以形成另一个扩增的双链核酸标记。该过程可重复多次以形成包含多个检测标记的扩增的双链核酸标记。在一些情况下,第一检测标记可具有与第二检测标记相同的序列。如图5中所示,检测分子520的双链核酸标记510可以用具有相同序列的四个双链检测标记530通过连接反应进行扩增。在一些情况下,第一检测标记可具有与第二检测标记不同的序列。在一些情况下,检测分子520可以用具有相同序列的四个单链检测标记通过如图2b中所示的模板化寡聚化连接反应进行扩增。在一些情况下,检测分子520可以用一个双链核酸分子510和具有相同序列的三个单链检测标记通过如图2b中所示的模板化寡聚化连接反应进行扩增。
使用检测分子检测靶分子
本文公开了用于检测样品中的靶分子的组合物、试剂盒、方法和系统。靶分子可以是样品中任何感兴趣的分子。靶分子可以是碳水化合物、脂质、蛋白质或核酸(例如,dna或rna)。靶分子可以是rna分子,例如mrna、trna、rrna、snrna或非编码rna分子。
本方法可包括使样品和与靶分子结合的检测分子接触。检测分子可包含至少一种配体(例如,抗体)、珠子或核酸。配体可以是与单链核酸连接的抗体。单链核酸可以与反义寡聚体杂交,该反义寡聚体具有与该单链核酸互补的序列,以形成双链核酸标记,其中所述双链核酸标记具有突出端。可以在配体与靶分子结合后进行单链核酸和反义寡聚体的杂交。可以在配体与靶分子结合之前进行单链核酸和反义寡聚体的杂交。在一些情况下,配体可以是与双链核酸标记连接的抗体,其中该双链核酸标记具有突出端。
突出端
如本文所用,术语“突出端”是指核酸(例如,dna)分子末端的一段未配对核苷酸。这些未配对核苷酸可以在任一链中,产生3’或5’突出端。突出端可包含单个核苷酸。例如,在图3中,检测分子是与具有单个鸟嘌呤(g)突出端320的双链核酸(例如,dna)标记连接的抗体310。在另一个实例中,具有以下序列的双链dna分子可以形成单个核苷酸突出端:
5’-atctgacta-3’
3’-tagactga-5’
突出端可包含单个核苷酸或多个核苷酸,例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个核苷酸。在一些情况下,突出端可包含至少约1、至少约2、至少约3、至少约4、至少约5、至少约6、至少约7、至少约8、至少约9、至少约10、至少约11、至少约12、至少约13、至少约14、至少约15、至少约16、至少约17、至少约18、至少约19或至少约20个核苷酸。在一些情况下,突出端可包含约1至约20个核苷酸,例如,约1至约2、约1至约3、约1至约4、约1至约5、约1至约10、约1至约15、约1至约20、约2至约3、约2至约4、约2至约5、约2至约10、约2至约15、约2至约20、约3至约4、约3至约5、约3至约10、约3至约15、约3至约20、约4至约5、约4至约10、约4至约15、约4至约20、约5至约10、约5至约15、约5至约20、约10至约15、约10至约20或约15至约20个核苷酸。例如,突出端序列可以是tag、cat、aca、cat或aat。在另一个实例中,具有以下序列的双链dna分子可以形成三核苷酸突出端:
5’-atctgactaca-3’
3’-tagactga-5’
检测偶联体
检测分子可包含与靶分子结合的多个核苷酸。例如,检测分子可以是检测偶联体,其包含第一核酸和第二核酸。该第一和第二核酸可以是单链dna。
第一和/或第二核酸的长度可包含多个核苷酸,例如,至少约10、至少约15、至少约20、至少约25、至少约30、至少约35、至少约40、至少约45、至少约50、至少约55、至少约60、至少约65、至少约70、至少约75、至少约80、至少约85、至少约90、至少约95或至少约100个核苷酸。第一和/或第二核酸的长度可包含约5-150个核苷酸,例如,约5-150、约5-130、约5-110、约5-90、约5-70、约5-50、约5-30、约5-10、约10-150、约10-130、约10-110、约10-90、约10-70、约10-50、约10-30、约30-150、约30-130、约30-110、约30-90、约30-70、约30-50、约50-150、约50-130、约50-110、约50-90、约50-70、约70-150、约70-130、约70-110、约70-90、约90-150、约90-130、约90-110、约110-150、约110-130或约130-150个核苷酸。
识别区
如图4a的实例中所示,第一核酸具有与第一靶分子(例如,mrna)结合的第一识别区205a(例如,rna识别区)。类似地,第二核酸具有与第二靶分子(例如,mrna)结合的第二识别区205a(例如,rna识别区)。在一些情况下,第一和第二靶分子可以是相同的分子。在一些情况下,第一靶分子和第二靶分子可以是不同的分子。第一和/或第二核酸的识别区通过和与识别区的序列互补的靶分子序列杂交而与靶分子结合。
识别区可包含单个核苷酸或多个核苷酸,例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个核苷酸。在一些情况下,识别区可包含至少约1、至少约2、至少约3、至少约4、至少约5、至少约6、至少约7、至少约8、至少约9、至少约10、至少约11、至少约12、至少约13、至少约14、至少约15、至少约16、至少约17、至少约18、至少约19或至少约20个核苷酸。在一些情况下,识别区可包含约1至约20个核苷酸,例如,约1至约2、约1至约3、约1至约4、约1至约5、约1至约10、约1至约15、约1至约20、约2至约3、约2至约4、约2至约5、约2至约10、约2至约15、约2至约20、约3至约4、约3至约5、约3至约10、约3至约15、约3至约20、约4至约5、约4至约10、约4至约15、约4至约20、约5至约10、约5至约15、约5至约20、约10至约15、约10至约20或约15至约20个核苷酸。
第一识别区和第二识别区可识别被至少约1、至少约2、至少约3、至少约4、至少约5、至少约6、至少约7、至少约8、至少约9、至少约10、至少约11、至少约12、至少约13、至少约14、至少约15、至少约16、至少约17、至少约18、至少约19或至少约20个核苷酸间隔开的靶分子的两个序列。第一识别区和第二识别区可识别被约1至约20个核苷酸间隔开的靶分子的两个序列,例如,约1至约2、约1至约3、约1至约4、约1至约5、约1至约10、约1至约15、约1至约20、约2至约3、约2至约4、约2至约5、约2至约10、约2至约15、约2至约20、约3至约4、约3至约5、约3至约10、约3至约15、约3至约20、约4至约5、约4至约10、约4至约15、约4至约20、约5至约10、约5至约15、约5至约20、约10至约15、约10至约20或约15至约20个核苷酸。例如,在图4b中,第一识别区和第二识别区可以识别被3个核苷酸(图4b上的“uca”和“ccu”)间隔开的靶mrna分子的两个序列。
自身杂交区
第一核酸可包含第一自身杂交区206a(图4a)。类似地,第二核酸可包含第二自身杂交区206b。第一和第二自身杂交区的序列可以是互补的。第一和第二自身杂交区可以通过有义-反义杂交进行杂交以形成双链核酸标记。双链核酸标记可以是部分双链的和部分单链的。
自身杂交区可包含单个核苷酸或多个核苷酸,例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个核苷酸。在一些情况下,自身杂交区可包含至少约1、至少约2、至少约3、至少约4、至少约5、至少约6、至少约7、至少约8、至少约9、至少约10、至少约11、至少约12、至少约13、至少约14、至少约15、至少约16、至少约17、至少约18、至少约19或至少约20个核苷酸。在一些情况下,自身杂交区可包含约1至约20个核苷酸,例如,约1至约2、约1至约3、约1至约4、约1至约5、约1至约10、约1至约15、约1至约20、约2至约3、约2至约4、约2至约5、约2至约10、约2至约15、约2至约20、约3至约4、约3至约5、约3至约10、约3至约15、约3至约20、约4至约5、约4至约10、约4至约15、约4至约20、约5至约10、约5至约15、约5至约20、约10至约15、约10至约20或约15至约20个核苷酸。
本文的方法可包括使第一核酸和第二核酸的自身杂交区杂交以形成具有本文所述的突出端207的双链核酸标记(实例在图4a和图4b中示出)。
将检测分子固定至样品
检测偶联体可包含3’和/或5’修饰,其可以用于将检测偶联体固定至样品(例如,组织)。将检测偶联体固定至组织可以允许各种处理而不会不利地影响靶分子(例如,mrna)的可检测性。
包括第一和第二核酸的检测偶联体可具有3’或5’修饰,诸如游离胺(-nh2)修饰(在图4a中示出)。本文公开的方法可包括接触胺反应性交联剂,诸如nhs酯交联剂、亚氨酸酯交联剂或二氟交联剂。nhs酯交联剂可以是二琥珀酰亚胺戊二酸酯(dsg)、二琥珀酰亚胺辛二酸酯(dss)、双(磺基琥珀酰亚胺基)辛二酸酯(bs3)、三-(琥珀酰亚胺基)氨基三乙酸酯(tsat)、聚乙二醇化双(磺基琥珀酰亚胺基)辛二酸酯(bs(peg)5、bs(peg)9)、二硫双(琥珀酰亚胺丙酸酯)(dsp)、3,3'-二硫双(磺基琥珀酰亚胺丙酸酯)(dtssp)、二琥珀酰亚胺酒石酸酯(dst)、双(2-(琥珀酰亚胺氧基羰基氧基)乙基)砜(bsocoes)、乙二醇双(琥珀酰亚胺琥珀酸酯)(egs)或磺基-egs。亚氨酸酯交联剂可以是己二亚氨酸二甲酯(dma)、庚二亚氨酸二甲酯(dmp)、辛二亚氨酸二甲酯(dms)或wangandrichard's试剂(dtbp)。二氟交联剂可以是1,5-二氟-2,4-二硝基苯(dfdnb)。检测标记和连接扩增
本文公开的方法可以包括使样品或检测分子与至少一个检测标记(例如,双链dna)接触,其中所述至少一个检测标记具有与双链核酸标记的突出端互补的突出端。该至少一个检测标记可以是核酸分子,诸如单链dna、单链rna或双链dna。例如,如果双链核酸标记具有突出端序列:5’-tag-3’,则检测标记可具有互补的突出端序列:3’-atc-5’。检测标记的突出端序列可以与特定双链核酸标记的突出端唯一互补。检测标记的突出端序列可以与多个双链核酸标记的突出端互补,例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19至20个双链核酸标记。类似地,双链核酸标记的突出端序列可以与特定检测标记的突出端唯一互补。双链核酸标记的突出端序列可以与多个检测标记的突出端互补,例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19至20个检测标记。检测标记可包含一个或多个检测标签。检测标签可具有至少一个突出端,其可适于手动组装和/或自组装。在一些情况下,检测标记可适于手动组装,并且可以连续应用单个单元以构建较大复合物(例如,信号传导复合物)。在一些情况下,检测标记可适于自组装,并且可以同时应用所有组分以构建较大复合物(例如,信号传导复合物)。
本文公开的方法可包括使样品或检测分子与至少一种dna连接酶接触。dna连接酶可以通过催化磷酸二酯键的形成来促进dna链连接在一起。例如,dna连接酶可包括大肠杆菌dna连接酶、t4dna连接酶或者哺乳动物dna连接酶i、ii、iii或iv。
可将双链核酸标记连接至第一检测标记以形成扩增的双链核酸标记,例如,使用dna连接酶。扩增的双链核酸标记可连接至第二检测标记以形成另一个扩增的双链核酸标记。该过程可重复多次以形成包含多个检测标记的扩增的双链核酸标记。在一些情况下,第一检测标记可具有与第二检测标记相同的序列。如图5中所示,检测分子520的双链核酸标记510可以用具有相同序列的四个双链检测标记530通过连接反应进行扩增。在一些情况下,第一检测标记可具有与第二检测标记不同的序列。在一些情况下,检测分子520可以用具有相同序列的四个单链检测标记通过如图2b中所示的模板化寡聚化连接反应进行扩增。在一些情况下,检测分子520可以用一个双链核酸分子510和具有相同序列的三个单链检测标记通过如图2b中所示的模板化寡聚化连接反应进行扩增。
天然和合成的核酸可以通过直接杂交、酶促连接或化学连接来进行连接。在一些情况下,直接杂交包括仅通过碱基配对连接核酸。直接杂交可以是非共价的,并且连接的结构的稳定性可以是对环境因素如盐浓度和温度敏感的。酶促连接可提供核酸的直接共价连接,但可能需要蛋白质连接酶。化学连接可提供共价连接两个核酸的便利方法。化学连接形式可包括:使用醛将具有3’和5’氨基基团的核酸交联以直接连接到链;氧化3’和5’巯基基团以产生二硫连接的核酸链;以及可以共价连接相邻核酸链的3’和5’末端的生物正交“点击”化学,例如,3’标记的叠氮化物和5’标记的炔烃可以经由cu(i)催化的环加成作用进行连接以形成三唑共价键而不是正常的磷酸键(el-sagheer,a.h.和brown,t.clicknucleicacidligation:applicationsinbiologyandnanotechnology.acc.chem.res.45,1258–1267(2012))。连接可以通过酶促连接、化学交联(例如醛或巯基交联)或生物正交“点击”化学(如炔-叠氮化物环加成作用)。
分支寡聚化
用于生成较大复合物的检测标记可以是线性的或分支的。仅由线性检测标记构成的结构可以将信号线性扩增至线性模块的数目。由分支的检测标记或线性和分支的检测标记的组合构成的结构可提供可以指数扩增至分支检测标记的数目的信号。分支寡聚化的结构和效果在实施例11至14中示出。
在一些情况下,多路分支是n路分支,其中所述n路分支包含n个单链核酸,其连接在一起以形成核酸结构。核酸结构可具有n个末端和/或n个突出端。例如,多路分支可以是三路分支,其中所述三路分支包含三个单链核酸,其连接在一起以形成具有三个末端和/或三个突出端的核酸结构(参见例如,图17a-图17c和图16c)。在另一个实例中,多路分支可以是四路分支。四路分支可包含四个单链核酸,其连接在一起以形成具有四个末端和/或四个突出端的核酸结构。
检测标签
检测标记可包含至少一个检测标签。在一些情况下,检测标记还可包含多个检测标签。在一些情况下,检测标记可包含1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19至20个检测标签。在一些情况下,多个检测标签可以是相同类型的检测标签。在一些情况下,多个检测标签可包含多于一种类型的检测标签。在一些情况下,多个检测标签可包含多于一种类型的具有相同颜色的检测标签。在一些情况下,多个检测标签可包含多于一种类型的具有不同颜色的检测标签。在一些情况下,多个检测标签可包含多于一种颜色。
至少一个检测标签可以通过接头附接至检测标记,例如,可切割或不可切割的接头。在一些情况下,多个检测标签附接至检测标记,各个检测标签彼此间隔7至10个碱基。在一些情况下,附接多个检测标签,使得各个标签间隔2、3、4、5、6、7、8、9、10、11、12、13、14至15个碱基。在一些情况下,多个检测标签可包括2至10个检测标签。在一些情况下,多个检测标签可包括1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19至20个检测标签。
在一些情况下,检测标签可以是量子点(qd)。在一些情况下,检测标签可以是荧光团。本领域技术人员已知的任何荧光团和/或qd可用于本文所述的方法和系统中。在一些示例性实例中,荧光团可包括香豆素、罗丹明、呫吨、荧光素或花菁。在一些情况下,可以优化检测标签的放置和数目以增强检测的空间分辨率。
在一些情况下,检测标签可以是半抗原。半抗原可包括苯胺、苯胺衍生物(邻-、间-或对-氨基苯甲酸)、漆酚、肼屈嗪(hydralazine)、荧光素、生物素、洋地黄毒苷或二硝基苯酚。例如,半抗原可以是洋地黄毒苷。半抗原(例如,洋地黄毒苷)可以被酶标记的抗体(例如,hrp、ap)识别,其可以催化吸收或荧光分子的生成。
检测标签与核酸标记的杂交可以包括施加电场。在一些情况下,电场可以施加约1、2、3、4、5、6、7、8、9、10、12、15、20、25、30、35、40、45、50、55或60秒。在一些情况下,电场可以施加0.5、1、1.5、2、2.5、3、3.5、4、4.5至5分钟。在一些情况下,电场可以施加至多5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85或90分钟。在一些情况下,电场可以施加1至60分钟。
本文公开的方法可包括使样品和/或检测分子与磷酸酶和/或另一种双链dna接触,诸如超声处理的鲑精。由于dna(染色质)和dna结合蛋白的存在,磷酸酶和/或另一种双链dna(例如,超声处理的鲑精)可用于减少细胞核和/或细胞质中不期望的信号。
还提供了适合于实施本文所述方法的系统,以及用于与这样的系统一起使用的试剂盒。
通过测序的检测
本文所述的方法可以包括检测步骤,其包括确定每个核酸标记的序列。通常,可以原位进行的任何测序方法可用于对本文的核酸标记进行测序。这些包括例如本领域技术人员已知的其他方法中的通过合成的测序、通过连接的测序、通过杂交的测序。可以优化可商购的核酸测序试剂盒,以供与本文描述的方法和系统一起使用。
在一些情况下,每个核酸标记的序列可借助通过合成的测序来确定。在一些情况下,每个核酸标记的序列可借助通过杂交的测序来确定。通过杂交的测序可涉及使用以下实例中所述的标签杂交方法。
标签测序是使用标签的直接测序的变体,该标签是由4个约15聚体的单元组成的约60个碱基对(bp),如以下实例中所述。在一些情况下,每个寡聚体的长度为9、10、11、12、13、14、15、16、17、18、19或20个核酸。在一些情况下,通过杂交的标签“测序”与qd标记的寡聚体一起使用。使用qd可以实现合理的高速storm样成像。此外,量子点不需要光活化,耐光漂白,并且需要单色进行激发。在一些情况下,标签测序与可切割的荧光标记一起使用。
还提供了适合于实施本文所述的方法的系统,以及用于与这样的系统一起使用的试剂盒。
阵列断层成像
本文还公开了用于对完整组织进行阵列断层成像(at)以促进组织中多种蛋白质的空间分辨识别的组合物、试剂盒、方法和系统。在一些情况下,方法可以对神经回路结构如脑组织进行成像。
可以注意到,当前实践的at过程的一种形式包括类似于用于电子显微镜术的组织处理,包括化学固定、脱水和包埋在树脂中。使用金刚石刀在超薄切片机上切割组织块。接触胶结剂,施加至块侧面,确保连续的切片粘在一起形成长带。这些被收集在涂覆的盖玻片上,涂层被工程化以紧密粘附至包埋的组织切片,使它们保持平坦以便可靠地自动对焦并保持它们通过多次染色循环。使用抗体、凝集素或其他试剂对阵列进行染色,并通过自动荧光显微术检测,通常在衍射极限下进行检测。可以剥离抗体,并且将染色和成像重复多次以从给定的组织体积建立高维数据集。阵列还可以用重金属染色并通过场发射扫描电子显微术(sem)成像。对图像进行拼接、对齐,并且每个光(和sem)循环合并到包括所有通道的3d体积中。例如,可以分析体积以评估各种标志物之间的空间关系,提供突触、细胞类型和其他感兴趣特征的鉴定和表征。
完整组织
本文所述的方法和系统可用于对完整组织样品进行阵列断层成像。如本文所述的完整组织包括在一个维度上切片并在另外两个维度上连续的组织。这些组织的特征在于最小的解离。完整组织样品是在切片后,样品保留组织结构和通常在整个组织中发现的其他细胞的组织样品。固定用于本文所述的方法和系统的完整组织的示例性方法在以下实施例1中提供。另外,本领域技术人员已知的分离和固定完整组织样品的方法可用于本文所述的方法和系统。在本文所述的一些方法中,将完整组织可包埋到树脂中,使得该组织可以切成厚度在20至1000nm之间的切片。在一些情况下,样品是石蜡包埋的组织样品。在一些情况下,样品是福尔马林固定石蜡包埋的(ffpe)组织样品。在一些方法中,切片的厚度可为25、30、35、40、45、50、55、60、70、80、90、100、150、200、250、300、350、400、450、500、550、600、650、700、750、800、850、900、950或1000nm。在一些方法中,切片的厚度可为约100、150、200、250、300、350、400、450、500、600、700、800、900或1000nm。在一些情况下,该方法可以不包括完整组织的脱水。在一些情况下,组织不进行脱水和树脂包埋。在一些情况下,使用切片收集器自动收集在超薄切片机上产生的带并将它们放置在涂覆的精密盖玻片的预定区域上,该盖玻片的大小范围为显微镜载玻片到微量滴定板。可通过该方法研究的完整组织样品可以包括例如用于检测一种或多种病况的活检组织。
组织中脱靶背景信号的封闭和洗涤
组织异质性可以呈现复杂的化学环境,其可以导致掩盖特定生物信号的非特异性背景信号。为了减少不需要的脱靶信号,可以使用封闭溶液,其包含未标记的单链或双链核酸的混合物,酶如碱性磷酸酶、聚合酶、连接酶和核酸酶,带电聚合物如peg,带电多糖如肝素,以及蛋白质如bsa和酪蛋白。可以在程序期间将封闭液添加至用于标记、染色、检测或洗涤组织的任何溶液。盐和ph水平也可用于减少或去除不期望的脱靶背景。溶液中的盐和ph水平可用于改善特异性和/或信号强度。盐和ph水平也可用于去除不需要的背景;例如,使用离液序列高的盐如高氯酸盐、胍盐、脲盐或在hofmeister序列中较高的离子盐,以破坏蛋白质的稳定性。在标记、染色、检测或洗涤过程中还可以使用能使核酸杂交不稳定的化学物质,诸如甲酰胺、尿素或甲醛,以防止或去除脱靶信号。
完整组织的阵列断层成像
本文提供了这样的方法,其包括:使完整组织样品与至少一种与特定蛋白质结合的抗体接触,其中所述抗体与核酸连接;以及检测所述核酸,从而检测组织样品中所述蛋白质的存在。在一个方面,所述方法可包括使完整组织与多种抗体接触,其中与特定蛋白质结合的每种抗体与独特的核酸连接。在一些情况下,多种抗体中的每种抗体可与不同的蛋白质结合。抗体可以是相同或不同的同种型,并且核酸可包括dna和/或rna。在一些情况下,与不同蛋白质结合的抗体可以是相同或不同的同种型。在一些方法中,至少一种抗体可以与组织交联。在一些情况下,本文所述的方法可包括使完整组织与多种抗体接触,其中与特定蛋白质结合的每种抗体与独特的核酸连接。
本文还提供了这样的方法,其包括使样品中的靶分子与检测偶联体接触,其中所述检测偶联体包含第一核酸和第二核酸,其中每个核酸具有靶识别区和自身杂交区,其中所述第一核酸的靶识别区与靶分子的第一区结合,其中所述第二核酸的靶识别区与靶分子的第二区结合,并且其中所述第一核酸的自身杂交区和所述第二核酸的自身杂交区进行杂交以形成双链核酸标记。在一些情况下,双链核酸标记具有突出端。在一些情况下,所述方法进一步包括使双链核酸标记与dna连接酶接触。在一些情况下,所述方法进一步包括使双链核酸标记与至少一个检测标记接触。在一些情况下,至少一个检测标记是具有与双链核酸标记的突出端互补的突出端的双链核酸。在一些情况下,使用dna连接酶将双链核酸标记和至少一个检测标记连接。
在本文所述的一些方法中,可以空间分辨多种抗体的检测。本文所述的一些方法和系统包括使用微流体室。一些方法可以完全自动化。
本文所述的一些方法可用于鉴定组织样品的蛋白质组成,和/或诊断生理状况或疾病,如上文所述。一些方法可用于鉴定特定完整组织的组织类别。
在本文所述的一些方法中,使组织与抗体接触可包括施加电场。在一些情况下,电场可以施加约1、2、3、4、5、6、7、8、9、10、12、15、20、25、30、35、40、45、50、55或60秒。在一些情况下,电场可以施加0.5、1、1.5、2、2.5、3、3.5、4、4.5或5分钟。在一些情况下,电场可以施加至多5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85或90分钟。在一些情况下,电场可以施加1至60分钟。
还提供了适合于实施本文所述方法的系统,以及用于与这样的系统一起使用的试剂盒。
多重检测测定
本文公开的组合物、试剂盒、方法和系统也可用于检测测定(例如,多重检测测定)。在一些情况下,检测测定可用于dna微阵列(例如,用于基因表达或snp检测)。在一些情况下,检测测定可用于基因表达的系列分析(sage)(例如,用于基因表达)。在一些情况下,检测测定可用于高通量测序(例如,平行产生数百万个短dna序列)。在一些情况下,检测测定可用于多重聚合酶链反应(pcr)(例如,用于需要dna或rna的扩增或测序的应用)。在一些情况下,检测测定可用于多重连接依赖性探针扩增(mlpa)。在一些情况下,检测测定可用于通过连接进行dna测序。在一些情况下,检测测定可用于荧光微珠阵列。
在一些情况下,检测测定可用于蛋白质微阵列(例如,用于测量蛋白质-蛋白质相互作用或小分子结合)。在一些情况下,检测测定可用于抗体微阵列(例如,其中抗体被阵列化的蛋白质阵列类型)。在一些情况下,检测测定可用于噬菌体展示(例如,用于筛选针对相互作用的蛋白质或其他分子的大型蛋白质文库)。在一些情况下,检测测定可用于抗体谱分析(例如,针对一组器官供体群体的多重hla抗体鉴定或反应性预测)。在一些情况下,检测测定可用于基于luminex/xmap原理的多重化。在一些情况下,检测测定可用于结合抗体多重测定(bama)(例如,用于多种抗体同种型和/或亚类的谱分析)。
在一些情况下,检测测定可用于组织微阵列(例如,用于分析多个组织样品)。在一些情况下,检测测定可用于细胞微阵列(例如,用于观察针对一组物质的细胞应答)。在一些情况下,检测测定可用于化学化合物微阵列(例如,用于测定多种化学化合物的特定活性)。在一些情况下,检测测定可用于蛋白质印迹的多重检测(例如,用于在蛋白质印迹上同时检测两个或更多个靶标)。在一些情况下,检测测定可用于多重生物标志物分析(例如,用于分析尿液)。在一些情况下,检测测定可用于酶联免疫吸附测定(elisa)(例如,用于使用微量滴定板的平行处理)。在一些情况下,检测测定可用于流式细胞术。
在一些情况下,检测测定可以使用检测测定同时检测样品中的多个靶标。在一些情况下,检测测定可以同时检测样品中的至少两个靶标,例如,至少1、至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少15、至少20、至少25、至少30、至少35、至少40、至少45、至少50、至少55、至少60、至少65、至少70、至少75、至少80、至少85、至少90、至少95、至少100、至少150、至少200、至少250、至少300、至少350、至少400、至少450或至少500个靶标。在一些情况下,检测测定可以同时检测样品中的2至500个靶标,例如,2至5、2至10、2至100、2至500、5至10、5至100、5至500、10至100、10至500或100至50个靶标。
在一些情况下,检测测定可检测细胞。在一些情况下,细胞可以是特定类型的细胞。在一些情况下,细胞可具有特定起源(例如,来自特定器官)。在一些情况下,细胞可具有特定状态(例如,健康细胞、癌细胞)。在一些情况下,检测测定可检测样品中的多个靶标。在一些情况下,多个靶标是多个细胞。在一些情况下,多种细胞是不同类型的细胞。在一些情况下,多个细胞具有不同起源(例如,来自不同器官)。在一些情况下,多个细胞具有不同状态(例如,健康细胞、癌细胞)。
在一些情况下,检测测定可检测靶分子。靶分子可以是样品中任何感兴趣的分子。靶分子可以是碳水化合物、脂质、蛋白质或核酸(例如,dna或rna)。靶分子可以是rna分子,例如mrna、trna、rrna、snrna或非编码rna分子。
在一些情况下,靶分子可以是细胞分子。在一些情况下,细胞分子可以是细胞膜内的分子,细胞膜将所有细胞的内部与外部环境分隔开。在一些情况下,细胞分子可以是碳水化合物、脂质、蛋白质或核酸(例如,dna或rna)。
在一些情况下,靶分子可以是细胞表面分子。在一些情况下,细胞表面分子可以是细胞膜上的分子,细胞膜将所有细胞的内部与外部环境分隔开。在一些情况下,细胞表面分子可以是碳水化合物、脂质、蛋白质或核酸(例如,dna或rna)。
在一些情况下,检测测定可以检测蛋白质。在一些情况下,检测测定可以检测多种蛋白质。在一些情况下,蛋白质可以是细胞骨架蛋白,诸如肌动蛋白、arp2/3、成蛋白、冠蛋白、肌养蛋白、ftsz、角蛋白、肌球蛋白和微管蛋白。在一些情况下,蛋白质可以是细胞外基质蛋白,诸如胶原蛋白、弹性蛋白、底板反应蛋白、皮卡丘素(pikachurin)和纤连蛋白。在一些情况下,蛋白质可以是血浆蛋白质,诸如血清淀粉样p成分和血清白蛋白。在一些情况下,蛋白质可以是凝血因子,诸如补体蛋白(例如,c1-抑制剂、c3-转化酶)、因子viii、因子xiii、蛋白c、蛋白s、蛋白z、蛋白z相关的蛋白酶抑制剂、凝血酶和vonwillebrand因子。在一些情况下,蛋白质可以是急性期蛋白质(例如,c反应蛋白质)。在一些情况下,蛋白质可以是血红素蛋白,诸如血红蛋白(例如,氧合血红蛋白、脱氧血红蛋白)。在一些情况下,蛋白质可以是细胞粘附,诸如钙粘着蛋白、室管膜蛋白、整联蛋白、ncam和选择蛋白。在一些情况下,蛋白质可以是跨膜转运蛋白,诸如cftr、血型糖蛋白d和混杂酶(scramblase)。在一些情况下,蛋白质可以是离子通道。在一些情况下,蛋白质可以是配体门控离子通道,诸如烟碱性乙酰胆碱受体和gabaa受体。在一些情况下,蛋白质可以是电压门控离子通道,诸如钾通道、钙通道和钠通道。在一些情况下,蛋白质可以是同向转运/反向转运蛋白,诸如葡萄糖转运蛋白。在一些情况下,蛋白质可以是激素或生长因子。在一些情况下,蛋白质可以是生长因子,诸如集落刺激因子(csf)、表皮生长因子(egf)、成纤维细胞生长因子(fgf)、血小板衍生生长因子(pdgf)、转化生长因子(tgf)和血管内皮生长因子(vegf)。在一些情况下,蛋白质可以是肽类激素,诸如胰岛素、胰岛素样生长因子(igf)和催产素。在一些情况下,蛋白质可以是受体。在一些情况下,蛋白质可以是跨膜受体,诸如g蛋白偶联受体(例如,视紫红质)。在一些情况下,蛋白质可以是细胞内受体,诸如雌激素受体。在一些情况下,蛋白质可以是dna结合蛋白,诸如组蛋白和鱼精蛋白。在一些情况下,蛋白质可以是转录调节蛋白,诸如c-myc、foxp2、foxp3、myod和p53。在一些情况下,蛋白质可以是rna结合蛋白,诸如srrt。在一些情况下,蛋白质可以是免疫系统蛋白质,诸如免疫球蛋白、主要组织相容性抗原和t细胞受体。在一些情况下,蛋白质可以是营养储存或转运蛋白,诸如铁蛋白。在一些情况下,蛋白质可以是伴侣蛋白,诸如groel。在一些情况下,蛋白质可以是酶。
基因组编辑应用
本文公开的组合物、试剂盒、方法和系统也还用于基因组编辑测定。基因组编辑测定可以是crispr(成簇的规律间隔短回文重复)测定。基因组编辑测定可以是crispr/cas(crispr相关蛋白质)核酸酶测定。基因组编辑测定可以是锌指核酸酶(zfn)测定。基因组编辑测定可以是tal效应物核酸酶(talen)测定。基因组编辑测定可以是大范围核酸酶测定。https://en.wikipedia.org/wiki/natronobacterium_gregoryi基因组编辑测定可以是ngago(格氏嗜盐碱杆菌(natronobacteriumgregoryi)argonaute)测定。
本文公开的组合物、试剂盒、方法和系统可以检测crispr(例如,crispr/cas)测定中的组分。在一些情况下,组分可以是cas核酸酶或其变体。cas核酸酶可以引导在靶dna序列中位置处的一条或两条链的切割。例如,cas核酸酶可以是具有一个或多个灭活催化结构域的切口酶,其切割靶dna序列的单链。cas核酸酶的非限制性实例包括cas1、cas1b、cas2、cas3、cas4、cas5、cas6、cas7、cas8、cas9(也称为csn1和csx12)、cas10、csy1、csy2、csy3、cse1、cse2、csc1、csc2、csa5、csn2、csm2、csm3、csm4、csm5、csm6、cmr1、cmr3、cmr4、cmr5、cmr6、cpf1、csb1、csb2、csb3、csx17、csx14、csx10、csx16、csax、csx3、csx1、csx15、csf1、csf2、csf3、csf4、其同源物、其变体、其突变体及其衍生物。
在一些情况下,组分可以是靶dna。在一些情况下,组分可以是靶向dna的rna(例如,单指导rna或sgrna),其含有将cas9靶向至靶基因组dna的指导序列。在一些情况下,组分可以是与cas9相互作用的支架序列,诸如反式激活crrna(tracrrna)。在一些情况下,组分可以是供体修复模板。可以将编码靶向dna的rna的核苷酸序列克隆到表达盒或表达载体中。在一些实施方案中,核苷酸序列通过pcr产生并包含在表达盒中。例如,可以pcr扩增编码靶向dna的rna的核苷酸序列并将其添加到启动子序列,例如,u6rna聚合酶iii启动子序列。在其他实施方案中,将编码靶向dna的rna的核苷酸序列克隆到表达载体中,所述表达载体含有启动子(例如,u6rna聚合酶iii启动子)以及转录控制元件、增强子、u6终止序列、一个或多个核定位信号等。在一些实施方案中,表达载体是多顺反子或双顺反子,并且还可以包括编码荧光蛋白、表位标签和/或抗生素抗性标记的核苷酸序列。在双顺反子表达载体的某些情况下,使用编码自切割肽如病毒2a肽的序列将编码例如荧光蛋白的第一核苷酸序列和编码例如抗生素抗性标记的第二核苷酸序列连接起来。包括口蹄疫病毒2a(f2a);马鼻炎a病毒2a(e2a);猪捷申病毒-12a(p2a)和thoseaasigna病毒2a(t2a)在内的2a肽具有高切割效率,使得两种蛋白质可以同时表达,但是与相同的rna转录物分开表达。
本文公开的组合物、试剂盒、方法和系统可以检测ngago测定中的组分。在一些情况下,组分可以是内切核酸酶。在一些情况下,组分可以是argonaute内切核酸酶。在一些情况下,组分可以是单链dna(ssdna)。在一些情况下,组分可以是指导ssdna。在一些情况下,组分可以是5′磷酸化ssdna(gdna)。在一些情况下,gnda可为约10至约100个核苷酸,例如,约10至约20个核苷酸、约10至约40个核苷酸、约10至约60个核苷酸、约10至约80个核苷酸、约10至约100个核苷酸、约20至约40个核苷酸、约20至约60个核苷酸、约20至约80个核苷酸、约20至约100个核苷酸、约40至约60个核苷酸、约40至约80个核苷酸、约40至约100个核苷酸、约60至约80个核苷酸、约60至约100个核苷酸或约80至约100个核苷酸。在一些情况下,gnda可为约20个核苷酸。在一些情况下,gnda可为约24个核苷酸。在一些情况下,gnda可为约30个核苷酸。
病况或疾病
可以通过鉴定与这样的病况或疾病相关的靶分子(例如,蛋白质、mrna),通过本文提供的方法来诊断生理状况或疾病。在一些情况下,可以在完整组织样品中找到靶分子。病况或疾病可包括例如肾脏疾病(如新月体性肾小球肾炎)、可通过研究活检的淋巴结组织进行诊断的感染性疾病、代谢疾病(包括淀粉样变性)以及可从睾丸活检检测的生育水平。可以通过将本文所述的方法应用于活检的完整肿瘤组织来鉴定癌前和癌性病况。通常通过活检研究的其他组织可以通过本文所述的方法和系统进行分析,例如,骨髓、胃肠道、肺、肝、前列腺、神经系统、泌尿生殖系统、脑、乳腺、肌肉和皮肤。
在一些情况下,病况或疾病还可包括脑部病症,例如,听神经瘤、获得性脑损伤、胼胝体发育不全、阿尔茨海默病、肌萎缩性侧索硬化症、动脉瘤、失语症、动静脉畸形、注意力缺陷多动障碍(adhd)、自闭症、巴腾病(battendisease)、白塞氏病(behcet’sdisease)、睑痉挛、脑肿瘤和/或脑癌、脑狼疮、大脑麻痹、颈肌张力障碍、charcot-marie-tooth症、基亚里畸形(chiarimalformation)、慢性炎症性脱髓鞘性多发性神经病、昏迷、脑震荡、克-雅病(creutzfeldt-jakobdisease)、痴呆(非阿尔茨海默型)、唐氏综合征、家族性自主神经机能异常、诵读困难、运用障碍、张力障碍、脑炎、癫痫、特发性震颤、弗里赖德希共济失调(friedreich’sataxia)、戈谢病、吉兰-巴雷综合征(guillain-barresyndrome)、亨廷顿病、脑积水、颅内高压、脑白质营养不良、闭锁综合症(lis)、梅尼埃病、脑膜炎、脑膜炎球菌病、偏头痛、最小意识状态、运动神经元病、多发性硬化、多系统萎缩、肌肉萎缩、重症肌无力、发作性睡病、帕金森病、周围神经病变、普拉德-威利综合征(prader-willisyndrome)、进行性核上性麻痹、不宁腿综合征、雷特综合征、夏伊-德雷格综合征(shydragersyndrome)、睡眠障碍、痉挛性发声困难、卒中、蛛网膜下腔出血、西登哈姆氏舞蹈病(sydenham’schorea)、泰-萨克斯病(tay-sachsdisease)、图雷特综合征、短暂性脑缺血发作、横贯性脊髓炎、创伤性脑损伤、三叉神经痛、结节性硬化症、植物状态和冯希佩尔-林道综合征(vonhippel-lindausyndrome)。
在一些情况下,病况或疾病还可包括癌症。癌症可以是复发性和/或难治性癌症。癌症的实例包括但不限于肉瘤、癌、淋巴瘤或白血病。
在一些情况下,肉瘤是骨、软骨、脂肪、肌肉、血管或者其他结缔组织或支持组织的癌症。肉瘤可包括但不限于骨癌、纤维肉瘤、软骨肉瘤、尤因肉瘤、恶性血管内皮瘤、恶性施旺细胞瘤、双侧前庭施旺细胞瘤、骨肉瘤、软组织肉瘤(例如,软组织腺泡状肉瘤、血管肉瘤、叶状囊肉瘤、皮肤纤维肉瘤、带形纤维瘤、上皮样肉瘤、骨外骨肉瘤、纤维肉瘤、血管外皮肉瘤、血管肉瘤、卡波西肉瘤、平滑肌肉瘤、脂肪肉瘤、淋巴管肉瘤、淋巴肉瘤、恶性纤维组织细胞瘤、神经纤维肉瘤、横纹肌肉瘤和滑膜肉瘤)。
在一些情况下,癌是起始于上皮细胞的癌症,上皮细胞是覆盖身体表面、产生激素和组成腺体的细胞。癌可包括但不限于乳腺癌、胰腺癌、肺癌、结肠癌、结直肠癌、直肠癌、肾癌、膀胱癌、胃癌、前列腺癌、肝癌、卵巢癌、脑癌、阴道癌、外阴癌、子宫癌、口腔癌、阴茎癌、睾丸癌、食管癌、皮肤癌、输卵管癌、头颈癌、胃肠间质癌、腺癌、皮肤或眼内黑素瘤、肛门区癌症、小肠癌症、内分泌系统癌症、甲状腺癌症、甲状旁腺癌症、肾上腺癌症、尿道症癌、肾盂癌症、输尿管癌症、子宫内膜癌症、宫颈癌症、脑垂体癌症、中枢神经系统(cns)肿瘤、原发性cns淋巴瘤、脑干胶质瘤和脊髓轴肿瘤。癌症可以是皮肤癌,诸如基底细胞癌、鳞状细胞瘤、黑素瘤、非黑素瘤或光化性(日光性)角化病。
癌症可以是肺癌。肺癌可起始于分支气管以供应肺(支气管)或肺的小气囊(肺泡)的气道。肺癌可包括非小细胞肺癌(nsclc)、小细胞肺癌和间皮瘤。nsclc的实例可包括鳞状细胞癌、腺癌和大细胞癌。间皮瘤可以是肺和胸腔的内层(胸膜)或腹部内层(腹膜)的癌性肿瘤。间皮瘤可以由石棉暴露引起。癌症可以是脑癌,诸如成胶质细胞瘤。
癌症可以是中枢神经系统(cns)肿瘤。cns肿瘤可分为神经胶质瘤或非神经胶质瘤。胶质瘤可以是恶性胶质瘤、高级别胶质瘤、弥漫性内生性脑桥胶质瘤。神经胶质瘤的实例可包括星形细胞瘤、少突神经胶质瘤(或少突神经胶质瘤和星形细胞瘤元素的混合物)和室管膜细胞瘤。星形细胞瘤可包括但不限于低级别星形细胞瘤、间变性星形细胞瘤、多形性成胶质细胞瘤、纤维性星形细胞瘤、多形性黄色星形细胞瘤和室管膜下巨细胞星形细胞瘤。少突神经胶质瘤可包括低级别少突神经胶质瘤(或少突星形细胞瘤)和间变性少突神经胶质瘤。非神经胶质瘤可包括脑膜瘤、垂体腺瘤、原发性cns淋巴瘤和成神经管细胞瘤。癌症可以是脑膜瘤。
淋巴瘤可以是淋巴细胞的癌症,并且可以从b淋巴细胞或t淋巴细胞发展而来。两种主要类型的淋巴瘤可以是霍奇金淋巴瘤(以前称为霍奇金病)和非霍奇金淋巴瘤。霍奇金淋巴瘤可以以reed-sternberg细胞的存在为标志。非霍奇金淋巴瘤可以是所有不是霍奇金淋巴瘤的淋巴瘤。非霍奇金淋巴瘤可以是惰性淋巴瘤和侵袭性淋巴瘤。非霍奇金淋巴瘤可包括但不限于弥漫性大b细胞淋巴瘤、滤泡性淋巴瘤、粘膜相关淋巴组织淋巴瘤(malt)、小细胞淋巴细胞性淋巴瘤、套细胞淋巴瘤、伯基特淋巴瘤(burkitt’slymphoma)、纵隔大b细胞淋巴瘤、瓦尔登斯特伦巨球蛋白血症、结边缘区b细胞淋巴瘤(nmzl)、脾边缘区淋巴瘤(smzl)、结外边缘区b细胞淋巴瘤、血管内大b细胞淋巴瘤、原发性渗出性淋巴瘤和淋巴瘤样肉芽肿。
白血病可以是急性淋巴细胞白血病、急性髓细胞白血病、慢性淋巴细胞白血病或慢性髓细胞白血病。其他类型的白血病可包括毛细胞白血病、慢性粒单核细胞白血病和幼年型粒单核细胞白血病。
疾病和/或病况可包括但不限于动脉粥样硬化、炎性疾病、自身免疫病、风湿性心脏病。炎性疾病包括但不限于寻常痤疮、阿尔茨海默病、强直性脊柱炎、关节炎(骨关节炎、类风湿性关节炎(ra)、银屑病性关节炎)、哮喘、动脉粥样硬化、乳糜泻、慢性前列腺炎、克罗恩病、结肠炎、皮炎、憩室炎、纤维肌痛、肾小球肾炎、肝炎、肠易激综合征(ibs)、系统性红斑狼疮(sle)、肾炎、帕金森病、盆腔炎性疾病、结节病、溃疡性结肠炎和血管炎。
在一些情况下,病况或疾病可以是自身免疫病,包括但不限于急性播散性脑脊髓炎(adem)、艾迪生病(addison'sdisease)、无丙种球蛋白血症、斑秃、肌萎缩性侧索硬化症、强直性脊柱炎、抗磷脂综合征、抗合成酶综合征、特应性变态反应、特应性皮炎、自身免疫性再生障碍性贫血、自身免疫性心肌病、自身免疫性肠病、自身免疫性溶血性贫血、自身免疫性肝炎、自身免疫性内耳疾病、自身免疫性淋巴组织增生综合征、自身免疫性周围神经病变、自身免疫性胰腺炎、自身免疫性多内分泌腺综合征、自身免疫性黄体酮性皮炎、自身免疫性血小板减少性紫癜、自身免疫性荨麻疹、自身免疫性葡萄膜炎、巴洛病(balodisease)/巴洛同心性硬化症、白塞病(behcet'sdisease)、贝惹病(berger'sdisease)、bickerstaff脑炎、blau综合征、大疱性类天疱疮、castleman病、乳糜泻、查加斯病(chagasdisease)、慢性炎性脱髓鞘性多神经病、慢性复发性多病灶性骨髓炎、慢性阻塞性肺疾病、丘-施综合征(churg-strausssyndrome)、瘢痕性类天疱疮、科根综合征(cogansyndrome)、冷凝集素病、补体成分2缺乏、接触性皮炎、颅动脉炎、crest综合征、克罗恩病、库欣综合征(cushing'ssyndrome)、皮肤白细胞分裂性脉管炎、dego病、dercum病、疱疹样皮炎、皮肌炎、1型糖尿病、弥漫性皮肤系统性硬化症、德雷斯勒综合征(dressler'ssyndrome)、药物性狼疮、盘状红斑狼疮、湿疹、子宫内膜异位症、肌腱骨止点炎相关性关节炎、嗜酸细胞性筋膜炎、嗜酸细胞性胃肠炎、获得性大疱性表皮松解症、结节性红斑、胎儿幼红细胞增多症、特发性混合性冷球蛋白血症、evan综合征、进行性骨化性纤维发育不全、纤维化肺泡炎(或特发性肺纤维化)、胃炎、胃肠类天疱疮、巨细胞动脉炎、肾小球肾炎、古德帕斯丘综合征(goodpasture'ssyndrome)、格雷夫斯病(graves'disease)、格林-巴利综合征(guillain-barrésyndrome)、桥本脑病(hashimoto'sencephalopathy)、桥本甲状腺炎(hashimoto'sthyroiditis)、henoch-schonlein紫癜、妊娠疱疹(又名妊娠期类天疱疮)、化脓性汗腺炎、hughes-stovin综合征、低丙种球蛋白血症、特发性炎症性脱髓鞘病、特发性肺纤维化、iga肾病、包涵体肌炎、慢性炎症性脱髓鞘性多发性神经病、间质性膀胱炎、幼年型特发性关节炎(又名幼年型类风湿性关节炎)、川崎病(kawasaki'sdisease)、兰伯特-伊顿肌无力综合征(lambert-eatonmyasthenicsyndrome)、白细胞分裂性脉管炎、扁平苔藓、硬化性苔藓、线性iga病(lad)、lougehrig病(又称肌萎缩性侧索硬化症)、类狼疮性肝炎(又名自身免疫性肝炎)、红斑狼疮、majeed综合征、梅尼埃病(ménière'sdisease)、显微镜下多血管炎、混合性结缔组织病、硬斑病、mucha-habermann病、多发性硬化、重症肌无力、肌炎、视神经脊髓炎(又称devic病)、神经性肌强直、眼瘢痕类天疱疮、斜视眼阵挛肌阵挛综合征、奥德甲状腺炎(ord'sthyroiditis)、复发性风湿病、pandas(链球菌相关的小儿自身免疫性神经精神病)、副肿瘤性小脑变性、阵发性睡眠性血红蛋白尿症(pnh)、parryromberg综合征、parsonage-turner综合征、睫状体扁平部炎、寻常型天疱疮、恶性贫血、静脉周脑脊髓炎、poems综合征、结节性多动脉炎、风湿性多肌痛、多肌炎、原发性胆汁性肝硬化、原发性硬化性胆管炎、进行性炎症性神经病、银屑病、银屑病关节炎、坏疽性脓皮病、单纯红细胞再生障碍、rasmussen脑炎、雷诺现象、复发性多软骨炎、莱特尔综合征(reiter'ssyndrome)、不宁腿综合征、腹膜后纤维化、类风湿性关节炎、风湿热、结节病、施密特综合征(schmidtsyndrome)(另一种形式的aps)、schnitzler综合征、巩膜炎、硬皮病、血清病、舍格伦综合征(
本文公开的组合物、试剂盒、方法和系统还可用于检测、监测、诊断和/或预测受试者对植入装置的反应。示例性医疗装置可包括但不限于支架、置换心脏瓣膜、植入式小脑刺激器、髋关节置换关节、乳房植入物和膝关节植入物。
本文公开的组合物、试剂盒、方法和系统还可用于检测、监测、定量或评价一种或多种病原体衍生的核酸分子或者由一种或多种病原体引起的一种或多种疾病或病况。示例性病原体可包括但不限于博德特氏菌属(bordetella)、疏螺旋体属(borrelia)、布鲁氏菌属(brucella)、弯曲杆菌属(campylobacter)、衣原体属(chlamydia)、嗜性衣原体属(chlamydophila)、梭菌属(clostridium)、棒状杆菌属(corynebacterium)、肠球菌属(enterococcus)、埃希氏菌属(escherichia)、弗朗西丝氏菌属(francisella)、嗜血菌属(haemophilus)、螺杆菌属(helicobacter)、军团菌属(legionella)、钩端螺旋体属(leptospira)、李斯特氏菌属(listeria)、分枝杆菌属(mycobacterium)、枝原体属(mycoplasma)、奈瑟氏球菌属(neisseria)、假单胞菌属(pseudomonas)、立克次氏体属(rickettsia)、沙门氏菌属(salmonella)、志贺氏菌属(shigella)、葡萄球菌属(staphylococcus)、链球菌属(streptococcus)、密螺旋体属(treponema)、弧菌属(vibrio)或耶尔森氏菌属(yersinia)。另外的病原体可包括但不限于结核分枝杆菌(mycobacteriumtuberculosis)、链球菌属、假单胞菌属、志贺氏菌属、弯曲杆菌属和沙门氏菌属。
由一种或多种病原体引起的疾病或病况可包括结核病、肺炎、食源性疾病、破伤风、伤寒、白喉、梅毒、麻风病、细菌性阴道病、细菌性脑膜炎、细菌性肺炎、尿道感染、细菌性胃肠炎和细菌性皮肤感染。细菌性皮肤感染的实例可包括但不限于可由金黄色葡萄球菌(staphylococcusaureus)或酿脓链球菌(streptococcuspyogenes)引起的脓疱病;可由深层表皮的链球菌细菌感染引起的具有淋巴扩散性的丹毒;以及可由正常皮肤菌群或由外源细菌引起的蜂窝织炎。
病原体可以是真菌,诸如假丝酵母属(candida)、曲霉属(aspergillus)、隐球酵母属(cryptococcus)、组织胞浆菌属(histoplasma)、肺囊虫属(pneumocystis)和葡萄穗霉属(stachybotrys)。由真菌引起的疾病或病况的实例可包括但不限于股癣、酵母菌感染、癣和脚癣。
病原体可以是病毒。病毒的实例可包括但不限于腺病毒、柯萨奇病毒、eb病毒、肝炎病毒(例如,甲型、乙型和丙型肝炎)、单纯疱疹病毒(1型和2型)、巨细胞病毒、疱疹病毒、hiv、流感病毒、麻疹病毒、腮腺炎病毒、乳头瘤病毒、副流感病毒、脊髓灰质炎病毒、呼吸道合胞病毒、风疹病毒和水痘-带状疱疹病毒。由病毒引起的疾病或病况的实例可包括但不限于感冒、流感、肝炎、aids、水痘、风疹、流行性腮腺炎、麻疹、疣和脊髓灰质炎。
病原体可以是原生动物,诸如棘阿米巴属(例如,a.astronyxis、a.castellanii、a.culbertsoni、a.hatchetti、a.polyphaga、a.rhysodes、a.healyi、a.divionensis)、小孢子虫属(brachiola)(例如,bconnori、b.vesicularum)、隐孢子虫属(cryptosporidium)(例如,c.parvum)、环孢子虫属(cyclospora)(例如,c.cayetanensis)、脑炎微孢子虫属(encephalitozoon)(例如,e.cuniculi、e.hellem、e.intestinalis)、内阿米巴属(entamoeba)(例如,e.histolytica)、肠孢子虫属(enterocytozoon)(例如,e.bieneusi)、贾第鞭毛虫属(giardia)(例如,g.lamblia)、等孢子球虫属(isospora)(例如,i.belli)、微孢子虫属(microsporidium)(例如,m.africanum、m.ceylonensis)、耐格里虫属(naegleria)(例如,n.fowleri)、微粒子虫属(nosema)(例如,n.algerae、n.ocularum)、匹里虫属(pleistophora)、气管普孢子虫属(trachipleistophora)(例如,t.anthropophthera、t.hominis)和条纹微孢子虫属(vittaforma)(例如,v.corneae)。
计算机控制系统
本公开内容提供了被编程用于实现本公开内容的方法的计算机控制系统。图6示出了计算机系统601,其被编程或以其他方式配置用于根据本公开内容的方法分析基因型数据。计算机系统601可以调节本公开内容的基因型分析的各个方面,例如,通过遗传模式评分的分析,和/或通过关联模式评分的分析。
计算机系统601包括中央处理单元(cpu,本文也称为“处理器”和“计算机处理器”)605,其可以是单核或多核处理器,或者是用于并行处理的多个处理器。计算机系统601还包括存储器或存储位置610(例如,随机存取存储器、只读存储器、闪速存储器)、电子存储单元615(例如,硬盘)、用于与一个或多个其他系统通信的通信接口620(例如,网络适配器),以及外围设备625,如高速缓存、其他存储器、数据存储和/或电子显示适配器。存储器610、存储单元615、接口620和外围设备625通过诸如主板的通信总线(实线)与cpu605通信。存储单元615可以是用于存储数据的数据存储单元(或数据存储库)。计算机系统601可借助于通信接口620可操作地耦合到计算机网络(“网络”)630。网络630可以是因特网、内联网和/或外联网,或者与因特网通信的内联网和/或外联网。在一些情况下,网络630是电信和/或数据网络。网络630可以包括一个或多个计算机服务器,其能够实现分布式计算,如云计算。在一些情况下,网络630可借助于计算机系统601实现对等网络,其可以使耦合到计算机系统601的设备能够充当客户端或服务器。
cpu605可以执行可体现在程序或软件中的一系列机器可读指令。指令可以存储在存储位置如存储器610中。由cpu605执行的操作的实例可包括读取、解码、执行和回写。cpu605可以是被编程用于执行基于特征的基因排序(frog)、变体遗传模式排序(vipr)的方法、确定分离模式、确定遗传模式、确定关联评分以及排列表型、基因型和与本公开内容的方法相关的任何数据的处理器。
存储单元615可存储文件,诸如驱动程序、库和保存的程序。存储单元615可以存储由用户和记录的会话生成的程序,以及与程序相关的输出。存储单元615可以存储用户数据,例如,用户偏好和用户程序。在一些情况下,计算机系统601可包括在计算机系统601外部,诸如位于通过内联网或因特网与计算机系统601通信的远程服务器上的一个或多个附加数据存储单元。
计算机系统601可以通过网络630与一个或多个远程计算机系统通信。例如,计算机系统601可以与用户(例如,操作者)的远程计算机系统通信。远程计算机系统的实例包括个人计算机(例如,便携式pc)、平板或平板型pc(例如,
如本文所述的方法可以通过存储在计算机系统401的电子存储位置上(例如,在存储器610或电子存储单元615上)的机器(例如,计算机处理器)可执行代码来实现。机器可执行代码或机器可读代码可以以软件的形式提供。在使用期间,代码可以由处理器605执行。在一些情况下,可以从存储单元615检索代码并将其存储在存储器610上以供处理器605迅速存取。在一些情况下,可排除电子存储单元615,并将机器可执行指令存储在存储器610中。
可将代码进行预编译并配置以供由具有适合于执行该代码的处理器的机器使用,或者代码可以在运行时期间编译。代码可以以编程语言提供,可选择该编程语言以使代码能够以预编译或即时编译的方式执行。
本文提供的系统和方法的各方面如计算机系统601可以在编程中得以体现。技术的各个方面可以被认为是“产品”或“制品”,通常是在一类机器可读介质中执行或体现的机器(或处理器)可执行代码和/或相关数据的形式。机器可执行代码可存储在电子存储单元如存储器(例如,只读存储器、随机存取存储器、闪速存储器)或硬盘上。“存储”型介质可包括计算机、处理器等的有形存储器中的任一种或全部,或其相关模块如各种半导体存储器、磁带驱动器、磁盘驱动器等,所述“存储”型介质可以在任何时间为软件编程提供非暂时性存储。软件的全部或部分有时可以通过因特网或各种其他电信网络进行通信。例如,这样的通信可以使软件从一个计算机或处理器加载到另一个计算机或处理器,例如,从管理服务器或主计算机加载到应用服务器的计算机平台。因此,可以承载软件元件的另一类型的介质包括光波、电波和电磁波,如通过本地设备之间的物理接口、经由有线和光学陆线网络以及经过各种空中链路使用的介质。携带这样的波的物理元件如有线或无线链路、光学链路等也可以被视为承载软件的介质。如本文所用,除非限于非暂时性有形“存储”介质,否则诸如计算机或机器“可读介质”等的术语是指参与向处理器提供指令以供执行的任何介质。
因此,诸如计算机可执行代码等机器可读介质可采取许多形式,包括但不限于有形存储介质、载波介质或物理传输介质。非易失性存储介质包括例如光盘或磁盘,诸如任何计算机等中的任何存储设备等,诸如可用于实现附图中所示的数据库等。易失性存储介质包括动态存储器,诸如这样的计算机平台的主存储器。有形传输介质包括同轴缆线;铜线和光纤,其包括构成计算机系统的总线的线。载波传输介质可以采取电信号或电磁信号的形式,或者声波或光波的形式,如在射频(rf)和红外(ir)数据通信期间产生的那些。因此,计算机可读介质的常见形式包括例如:软盘、柔性盘、硬盘、磁带、任何其他磁介质、cd-rom、dvd或dvd-rom、任何其他光学介质、穿孔卡片纸带、具有孔图案的任何其他物理存储介质、ram、rom、prom和eprom、flash-eprom、任何其他存储芯片或匣盒、传输数据或指令的载波、传输这样的载波的电缆或链路,或计算机可以从中读取编程代码和/或数据的任何其他介质。许多这些形式的计算机可读介质可以涉及将一个或多个指令的一个或多个序列携带至处理器以供执行。
计算机系统601可以包括电子显示器或者与电子显示器通信,该电子显示器包括用户界面(ui),用于提供例如根据本公开内容的方法的图形和/或数字形式的基因型分析的显示、曲线图、图表和/或列表,所述方法可包括遗传分析、致病变体发现分析和诊断。ui的实例包括但不限于图形用户界面(gui)和基于网络的用户界面。
可以显示(例如,在计算机上)通过排列生成的数据。数据可以以数字和/或图形形式显示。例如,数据可作为列表、作为统计信息(例如,p值、标准偏差)、作为图表(例如,饼图)、作为曲线图(例如,线图、条形图)、作为直方图、作为映射图、作为热图、作为时间轴、作为树图、作为流程图、作为统计图、作为气泡图、极区图、作为示意图、作为流动图、作为甘特图、作为诺兰图、作为史密斯图、作为v形图、作为标绘图、作为箱形图、作为点图、作为概率图、作为散点图、作为双标图或其任何组合进行显示。
受试者
通常,方法用于受试者,优选人。受试者可以是男性或女性。受试者可以是胎儿、婴儿、儿童、青春期少年、青少年或成人。受试者可以是任何年龄的患者。例如,受试者可以是小于约10岁的患者。例如,受试者可以是至少约0、5、10、20、30、40、50、60、70、80、90或100岁的患者。受试者可以在子宫内。通常,受试者是经历治疗方案或者评估其治疗方案(例如,免疫抑制治疗)的患者或其他个体。然而,在一些情况下,受试者未经历治疗方案。例如,受试者可以是健康受试者。
在一些情况下,受试者可以是哺乳动物或非哺乳动物。优选地,受试者是哺乳动物,诸如人、非人灵长类动物(例如,猿、猴子、黑猩猩)、猫、狗、兔、山羊、马、牛、猪、啮齿类动物、小鼠、scid小鼠、大鼠、豚鼠或绵羊。在一些方法中,这些基因的物种变体或同源物可用于非人动物模型。物种变体可以是彼此具有最大序列同一性和功能特性相似性的不同物种中的基因。许多这样的物种变体人基因可列于swiss-prot数据库中。
本文公开的方法可用于移植接受者,其是实体器官或实体器官的片段的接受者。实体器官可以是肺、肾、心、肝、胰腺、大肠、小肠、胆囊、生殖器官或其组合。在一些情况下,移植接受者可以是组织或细胞的接受者。组织或细胞可以是羊膜、皮肤、骨、血液、骨髓、血干细胞、血小板、脐带血、角膜、中耳、心脏瓣膜、静脉、软骨、腱、韧带、神经组织、胚胎干(es)细胞、诱导多能干细胞(ipsc)、干细胞、成体干细胞、造血干细胞或其组合。
应当理解,本文描述的实施例和实施方案仅为了说明性目的,并且本领域技术人员将对此提出各种修改或改变,并且这些修改和改变将被包括在本申请的精神和权限内以及所附权利要求的范围内。
实施例
应当理解,本文描述的实施例和实施方案仅为了说明性目的,并且本领域技术人员将对此提出各种修改或改变,并且这些修改和改变将被包括在本申请的精神和权限内以及所附权利要求的范围内。
实施例中使用的试剂是可商购的,或者可使用本领域已知的可商购的仪器、方法或试剂进行制备。前述实施例说明了本发明的各个方面和本发明方法的实践。实施例不旨在提供本发明的许多不同实施方案的详尽描述。因此,尽管为了清楚理解的目的已经通过说明和实例相当详细地描述了前述发明,但是本领域普通技术人员将容易地认识到,在不脱离所附权利要求的精神和范围的情况下可以对其进行许多修改或改变。
实施例1.组织制备
通常使用在micheva,k.d.、o’rourke,n.、busse,b.和smith,s.j.(2010).arraytomography:rodentbrainfixationandembedding.coldspringharborprotocols,2010(11)中概述的组织制备方法(通过调整和优化组织类型和组织从其获得的生物体的差异)。
如下解剖并固定小鼠脑:
设置解剖工具并制备pbs和过滤的固定剂,使之准备流动,没有气泡。将2%戊二醛和2%解聚的多聚甲醛溶解在0.1m磷酸盐缓冲液中,ph在6.8和7.2之间。
将啮齿类动物麻醉而不杀死,暴露心脏,切开右心房,将套管插入左心室。使用钝的缩短至约1cm的~20g针。在一些情况下,对于主动脉不脆弱或不容易被破坏的生物体,向主动脉插管是最佳的。然后通过使用重力流动允许固定剂流动约10分钟;或者在一些情况下使用灌注泵。然后用至多5ml的pbs灌注。
随后将约5cc的肝素化盐水放入管中,以帮助冲洗血液。使用固定剂的灌注进行10分钟。在固定20分钟以内移取脑。将整个脑在相同的固定剂中在冰箱中后固定过夜。在0.1m磷酸盐缓冲液中冲洗2次后,将组织在4℃下储存多达一周。
在某些情况下,分析厚组织切片,对于树脂包埋的组织为约200nm-1μm。值得注意的是,厚切片允许每单位时间对更大的体积成像。成像可以在高放大倍数下或用相对较低放大倍数的物镜(10-20x)进行。例如,在分析活检的组织如肿瘤时,可以优选在较低放大倍数下进行厚切片的分析。较低的放大倍数允许用亚细胞分辨率分析大的组织区域。
在一些情况下,组织不进行脱水和树脂包埋,而是将如下所述的标记方法应用于已被确认用于固定的水合组织的染色的抗体。
在一些情况下,使用切片收集器自动收集在超薄切片机上产生的带并将它们放置在涂覆的精密盖玻片的预定区域上,该盖玻片的大小范围为显微镜载玻片到微量滴定板。
实施例2.连接扩增的多重化检测抗原(lamda)
试剂:
1.dna缀合的抗体
2.具有粘性突出端(例如,ggg)的反义检测寡聚体
3.具有5’磷酸、内部荧光团(例如,alexa594)和末端粘性末端(例如,5’ccc和3’ggg)的双链寡聚体(dso)
4.t4dna连接酶——具有peg的连接酶溶液
5.限制性内切核酸酶——用于去除荧光团。设计dso使得独特的内切核酸酶可以去除特定颜色(例如,cccggg=sma1)。使用在室温下具有100%活性的内切核酸酶(例如,sma1、bamh1和sac1)
6.tris缓冲液——含有0.1%吐温和50mm甘氨酸的0.05mtris——在不含核酸酶的水中制备,然后高压灭菌
7.roche封闭试剂,用于核酸杂交和检测(sigma11096176001)——10%(w/v)储存液[10x]
8.戊二醛
9.硼氢化钠
10.不含核酸酶的水
程序:
1.预封闭——将组织在1%(w/v)[1x]封闭试剂中的tris缓冲液中放置1min。
2.抗体染色——将dna-抗体在1%(w/v)[1x]封闭试剂中的tris缓冲液中稀释过夜。以抗体对抗体为基础确定抗体浓度。
3.初次洗涤——在tris缓冲液中洗涤组织,每次洗涤1min,进行3次。最后用不含核酸酶的水洗涤1次(不需要温育)。如果使用>3种dna-抗体,即预期进行多轮检测,则用水中的1%戊二醛固定1min。用水洗涤1min,然后用tris(不含吐温和甘氨酸)中的1%硼氢化钠将组织处理1min(以去除自身荧光)。用水洗涤1min。
4.dna杂交(所有步骤在室温下进行)——将反义检测寡聚体在连接酶缓冲液中稀释至终浓度为100nm。将连接酶缓冲液置于组织上。同时,在与组织上的检测寡聚体溶液的体积相同的连接酶缓冲液中制备2x浓度的200nmdso。
5.连接反应——每20ul具有组织寡聚体混合物的溶液放置1ult4dna连接酶,然后添加dso连接酶缓冲液混合物并混合。使其维持5min。
6.第二次洗涤——用不含核酸酶的水洗涤组织,然后用tris缓冲液洗涤3次,每次1min。
7.安装和成像——再次用水洗涤,然后将样品安装并成像。
8.洗涤和脱色——用不含核酸酶的水洗涤,将消化缓冲液中的限制性内切核酸酶放置在组织上并温育5min。然后用水洗涤。
9.复染——如果还有其他dna-抗体待成像,重新开始dna杂交。
可切割接头
1.在磷酸盐缓冲液中的2%肼中切割:30-120min,rt:dde。
2.在10mm高碘酸钠(naio4)磷酸盐缓冲液中切割:20min,rt,黑暗;二醇。
3.在50mm连二亚硫酸钠(na2s2o4)中切割;重氮基。
实施例3.使用磷酸酶和超声处理dna封闭物的连接扩增
在本实施例中使用与实施例1和2中所述的类似的试剂和方案。
如图7a至图7j所示,用磷酸酶和超声处理dna封闭物进行的连接扩增改善了信噪比。图7a示出了来自10个(70nm)切片的dna标记的乙酰化微管蛋白的最大投影。图7a示出了经由连接寡聚化可视化的dna标记的第一抗体。图7b示出了在相同组织切片中通过传统的荧光第二抗体可视化的相同dna-第一抗体。图7c示出了在与图7a和图7b相同的组织中用荧光标记的反义寡聚体可视化的dna标记的第一抗体。图7d-图7f示出了图7a-图7c的特写视图(由黄色框突出显示)。图7d中的白色箭头示出了细胞核的脱靶连接可视化的点,其在图7e中不存在(白色箭头)。图7f示出了同样引起脱靶信号的反义检测,尽管细胞核具有较少的标记。图7g-图7i示出在不同组织中,dna标记的突触蛋白抗体在磷酸酶和超声处理dna封闭物之后可视化。图7g示出了细胞核标记的显著减少,使得脱靶标记(白色箭头)与第二抗体检测图7h(白色箭头)处于同等水平。图7i示出,超声处理dna封闭物还改善了反义检测噪声。图7j示出了每种方法在对数刻度下的叠加的强度直方图。
实施例4.使用dna缀合抗体的深度多重化
在本实施例中使用与实施例1和2中所述的类似的试剂和方案。
图8示出了包含27个皮质切片的投影的组。使用荧光标记的dna寡聚体检测所有标记(dna)的蛋白质。首先使用第二抗体检测glur1(兔)和nr1(小鼠),该第一抗体已被施加至组织并用戊二醛固定。同时温育所有其他抗体,然后使用戊二醛固定到组织。使用合适的物种间特异性抗体检测vglut1(豚鼠)和mbp(鸡)。每种抗体单独地在密集标记条件下呈现相似的模式。小鼠和兔抗体的最终应用显示该组中所有抗体对组织的密集标记。
实施例5.靶向9种抗体的深度多重化
在本实施例中使用与实施例1和2中所述的类似的试剂和方案。
本实施例(在图9中示出)证明使用9种抗体同时靶向相同结构(皮质突触)不影响抗体标记并且不破坏突触周围的紧密蛋白质检测。这9种抗体是:2种突触前支架蛋白(bassoon、突触蛋白)、3种突触前小泡蛋白(突触小泡蛋白质2、突触小泡蛋白、小泡谷氨酸转运蛋白1)、2种突触后支架蛋白(homer、突触后密度蛋白95)和2种突触后受体蛋白(谷氨酸受体1、nmda受体1)。
限定突触前和突触后结构的蛋白质标志物在密集条件下(9种同时靶向相同的结构)如同作为单个标记一样进行标记。此外,使用我们当前的方法获得这18种蛋白质通道数据借助多重成像会话仅需要一天,而使用传统阵列断层成像方法(micheva等人)将花费一周。
实施例6.使用标签测序快速检测多重化抗原
在本实施例中使用与实施例1和2中所述的类似的试剂和方案。
在一些情况下,采用通过杂交的标签测序。这是直接测序的变体,其使用由4个约15聚体的单元组成的约60个碱基对(bp)的标签。使用该方法,独特组合的数目是4n,或者对于n=4是256。为了检测例如组织样品中的100种蛋白质,100种抗体中的每一种在每个位置具有由4个独特的15聚体(对应于a、t、c或g)组成的标签,总共需要16种独特的寡聚体。“测序”可以从任一端开始。所需要的就是当对位置m测序时,引入与位置m的标签寡聚体互补的4个寡聚体。例如,引入并读出与标签远端上的4个独特序列互补的寡聚体,其各自用可辨别的荧光团标记;然后通过切割接头或通过酶促切割dsdna以释放荧光团来去除荧光团。后一种方法需要从远端进行测序。因为这种标签测序方法允许在各轮中使用各自的荧光团,所以独特标签的数目的公式是pn(p=荧光通道数目,n=读取数目)(以上我们假设p=4,如图10中所示)。
例如在图10a-图10d中,示出了使用标签测序快速检测多重化抗原的实例。图10a-图10c示出了顺序检测寡聚体模块,然后通过限制性内切核酸酶切割去除荧光标记的寡聚体。图10d示出使用在成像循环中产生的颜色组合,重建每种抗原的最终图像。独特抗原的潜在数目是pn(p=荧光通道的数目,例如,独特的检测寡聚体;n=模块的数目)。在图10中,有3个模块和3个荧光通道,因此33=27个潜在抗原。通过增加模块数目或荧光通道数目,我们可以在短时间内容易地对数百种抗原成像,例如,4个模块组和4个荧光通道=256种潜在抗原。
通过杂交的标签“测序”与qd标记的寡聚体一起效果良好。使用qd允许将p从4增加至6或更多。假设p=6,并且n=3,可以仅使用6x3=18种独特的寡聚体和3个读取来独特地标记216种抗体。使用qd可以实现合理的高速storm样成像。已经证明,可以利用量子点闪烁来获得在平面中具有~15nm的三维超分辨成像。此外,量子点不需要光活化,耐光漂白,并且需要单色进行激发。
实施例7.单个抗体的多轮测序
在本实施例中使用与实施例1和2中所述的类似的试剂和方案。
使用实施例6中的方法生成具有长dna标签的抗体,通过顺序读取进行成像,并获得单个标签之间良好的读取间一致性。合并图像允许我们唯一地鉴定单个抗原(在图11a-图11e中示出)。
图11a示出了围绕gfp标记的神经元的突触蛋白标记。使用gfp标记的扩张形式作为掩模将围绕gfp树状突和细胞体的突触蛋白标记在计算上突出显示,以从总体积中提取突触蛋白点。图11b示出了使用荧光dna寡聚体对突触蛋白进行的通道一检测。使用与基准相同的突触蛋白染色的第二抗体检测,确定使用dna检测到111970个第二抗体标记的突触蛋白点中的103761个(或7.3%假阴性率)。还存在3.9%的假阳性率,其中dna标记的点不对应于第二抗体标记的斑点(在图11d中示出)。图11c示出了使用荧光dna寡聚体对突触蛋白进行的通道二检测。与第二抗体(在图11d中示出)相比,通道二的假阴性率为9.5%,假阳性率为3.5%。与通道一相比,通道二的假阴性率为5%,假阳性率为2.4%。图11e示出了所有三个通道的合成。
本实施例证明即使没有一一对应的dna抗体缀合和超分辨成像,“标签测序”也确实是可能的,并且该方法可用于对高度多重化的抗原进行成像,而不使用困难和低效的化学过程或复杂的成像方法。
实施例8.使用dna缀合抗体对肿瘤组织的厚石蜡切片中的抗原进行可视化
在本实施例中使用与实施例1和2中所述的类似的试剂和方案。
本实施例证明,本文公开的方法可用于超过薄(50-100nm)树脂包埋的组织的范围。本实施例中的样品在较厚的石蜡包埋的组织切片(5-20um)(例如,福尔马林固定石蜡包埋的(ffpe)组织)上获得,其通常用于癌症研究和诊断应用。使用抗乙酰化微管蛋白的抗体,证明了检测方法显示细胞分化的正常脑组织中乙酰化微管蛋白的密度,而分化程度较低的癌细胞不表达这种稳定形式的微管蛋白。
如图12a-图12e中所示,所有样品均在10um石蜡切片上获得。图12a示出了使用dna缀合的抗ac微管蛋白抗体可视化的乙酰化微管蛋白。在磷酸酶和超声处理dna封闭后使用连接扩增进行检测。图12b示出了在内切核酸酶溶液中处理30分钟去除乙酰化微管蛋白信号后的相同切片。残留的荧光由于血管自发荧光和较长的暴露时间而产生。图12c示出,使用第二抗体复染相同的组织。图12d示出了来自图12a和图12c的黄色框中的乙酰化微管蛋白结构的特写视图。图12e示出了具有神经胶质瘤的皮质组织中的乙酰化微管蛋白染色。轴突的强染色追踪稳定的乙酰化微管蛋白最密集的位置,而未分化的肿瘤不表达这种稳定形式的微管蛋白。
实施例9.用于档案成像的dna-抗体
dna的稳定性(例如,半衰期为500年)和dna在即使长时间的脱水后保持其功能特性的能力使得dna缀合的抗体成为免疫组织化学(ihc)检测的理想档案试剂。在该实施方案中,dna缀合的抗体设计有末端限制性位点,其在消化和去除连接的荧光检测寡核苷酸后恢复其原始序列,从而使其为将来的档案检测做好准备。抗体缀合的dna末端(…ggg[半sma1位点])在连接检测后可以生成完整的sma1位点(…gggccc…)(图14a)。在成像和sma1(…gggxccc…)切割后,抗体缀合的dna链恢复到具有末端(…ggg)的原始序列(图14b-图14d)。与抗体附接的dna可以是双链的。dna缀合的抗体可以以双链形式存档。在另一个实施方案中,dna缀合的抗体可以以单链形式存档。双链dna可能比单链dna更稳定。当存档的dna缀合的抗体是双链形式时,可以在档案检索时在连接检测开始成像之前去除反义链。反义链的去除可以在储存之前发生。可以经由变性(化学或热)、切口酶促进的变性(其中切口酶使反义物成为较短的片段从而降低解链温度)或rna反义(其中rna酶可以选择性地去除双链体的rna部分)来实现反义链的去除(图14e)。在去除反义物后,染色组织可恢复到原始抗体染色状态,从而准备进行新鲜荧光检测(图14f)。
实施例10.通过分支寡聚化的信号扩增
图15a-图15f提供了通过使用分支标记的核酸进行信号扩增来对生物样品中的核酸和蛋白质结合试剂进行改善检测的实例。
图15a示出,通过本文所述的方法检测样品中的靶分子(例如,靶标)。靶分子可以是蛋白质、rna、dna或者通过扩增过程检测的其他分子或结构。靶标与包含能够结合靶分子的配体的检测分子接触。配体与一个或多个单链核酸(例如,标签)连接。该标签可以是dna、rna、dna或rna的非天然衍生物,或者可以像dna或rna一样碱基配对的合成碱基。标签被包含互补区和突出端区的反义寡聚体(例如,探针)识别。标签的互补区可以与标签上的互补区杂交。探针可以形成具有突出端的双链核酸。突出端区可以允许经由碱基配对来对接检测标记(例如,图15a中的标记检测物)。可以经由连接寡聚化或模板化(杂交)寡聚化添加一种或多种检测标记。探针可以是任何长度,例如,短于250个碱基。
图15b示出,长探针可以对接n个检测标记(例如检测物……第n个检测物)。检测物链可以是3至150个碱基。在一些情况下,检测物的对接可以产生没有末端突出端的核酸。在一些情况下,检测物的对接可以产生末端突出端。当存在末端突出端时,末端突出端可以允许线性或分支的延伸或者添加发夹末端(参见图15d),其可以是标记的或未标记的。
图15c示出,探针可以相对较短,并且长的第一检测物标记(例如,第一检测物)可以与探针杂交。第一检测物可以随后是多个标记的第二检测物链的碱基配对靶标。第一检测物——探针和标签可以是标记的或未标记的。
图15d示出,可以使用单标记或多标记的双链体检测物代替单链寡核苷酸的添加。该双链体可以经由手动循环或自组装延伸n次。该结构的末端可以是突出端、平端或发夹。
图15e示出,可以使用n分支检测物代替线性双链体检测物来构建延伸的标记结构。例如,第一检测标记(d1)的序列的一部分与探针的突出端互补。d1与探针杂交。第二检测标记(d2)与d1的序列的另一部分杂交。第三检测标记(d3)与d1和d2的一部分互补并杂交,从而产生分支检测物。通过结合第四检测标记(d4)可以进一步延伸分支检测物,第四检测标记可以进一步与第五检测标记(d5)和第六检测标记(d6)杂交。该结构的末端可以是突出端、平端或发夹。
图15f示出,在n分支结构的延伸中,线性和分支检测物可以混合。如图15c所示,线性检测物可以是双链体或具有第二检测物的短或长的单链。该结构可以通过单元循环或自组装来构建。该结构的末端可以是突出端、平端或发夹。
实施例11.线性和分支双链体连接寡聚化
图16a-图16f提供了线性和分支双链体连接寡聚化的实例。标记的线性核酸模块(例如,检测标记)可以在一端与双链核酸(例如,由与配体和反义寡聚体连接的单链核酸形成)连接,该双链核酸可以靶向样品中感兴趣的分子。标记的线性核酸模块可以在另一端与分支双链体核酸模块连接。连接可以通过酶促连接或化学交联来实现。线性核酸模块可以是双链体或单链核酸。线性核酸模块可以用一种或多种检测标签(例如,荧光团)标记。如果线性核酸模块是单链的,则可以通过使一种或多种已用一种或多种检测标签标记的互补单链核酸寡核苷酸退火来标记。线性模块可以是任何长度,并且在5’和3’端设计有独特或互补的突出端。如果突出端是独特的(例如,a和β是独特末端),则线性模块可能不会自身寡聚化(参见图16a)。图16a示出了具有独特互补末端[α和α’]及[β和β’]的标记双链体核酸单元。圆点表示可以通过各种方法检测的标记。该标记可包括荧光分子和其他荧光实体,以及酶、肽和放射性同位素。在一些情况下,每个核酸链的标记的数目不限于所示的圆点数目,因为密度将取决于标记类型和核酸链长度。为了实现扩增,可以使用单元的循环。如果突出端是互补的(未示出),例如,线性核酸模块具有互补的末端α和α’,则检测单元可以自组装。
如图16b中所示,可以通过使互补的单链探针退火来检测核酸标记的结构(诸如抗体或另一种核酸),从而形成与线性和分支标记的单元匹配的突出端。在图16b中示出了使用交替的α/β和α’/β’标记的双链体单元的线性扩增。
图16c示出,可以用相同的独特互补末端生成分支的核酸结构。示例性的3路和4路分支结构在图16c中示出。
图16d示出了3路分支的循环,其可以导致信号的2y扩增,其中y=循环数。所示结构可以通过循环交替的α/β和α’/β’标记的三路分支单元来生成(图16c)。
图16e示出了4路分支的循环,其可以导致信号的3y扩增,其中y=循环数。所示结构可以通过循环交替的α/β和α’/β’标记的四路分支单元来生成(图16c)。n个分支单元的循环可以提供(n-1)y的扩增,其中:n=分支单元的分支数,y=所执行的循环数。图中描述的分支单元的末端可以设计有互补的末端,从而允许结构的自组装。
两个互补模块通过连续循环的受控顺序应用可以促进寡聚化和信号扩增(图16b)。可以在模块的循环内引入3路、4路或n路分支以增加信号扩增(图16c-图16e)。3路分支可以由3个单链核酸产生,其产生具有3个突出端的t形结构。4路分支可以由4个单链核酸产生,其产生具有4个突出端的交叉结构,依此类推。分支和/或非分支结构的顺序应用可以允许由寡聚化循环的数目决定的信号的指数扩增,其可以由下式表示:(n-1)y,n=分支单元的分支数,y=所执行的循环数。
此外,分支核酸结构可以设计有内切核酸酶位点或具有可切割接头的标记,其中任一个都可用于随后去除检测标签(例如,荧光部分)。这可以允许连续应用、检测和去除标记的核酸结构,从而用于组织样品中蛋白质和/或核酸的高度多重化鉴定。此外,如本文所述,分支和线性的检测物单元可以具有互补端,使得其可以允许所述结构的自组装。
实施例12.原位核酸检测中的分支扩增
分支检测方法可用于检测组织中的核酸(图17a-图17c)。在本申请中,两种特异性识别探针可以靶向靶核酸中的相邻序列(图17a)。探针可以具有互补区,因此如果两个分子非常接近,则核酸杂交可以使它们结合在一起(图17a)。在本实施例中,两个相邻的核酸探针生成茎发夹结构,第二探针可与之杂交。此外,图17b-图17c显示两个探针可以具有两个独特的序列,其可以被第二单链核酸探针识别,其在与邻接的探针杂交后可生成3路分支结构,该结构可以是如上文所述的分支寡聚化的起始点(图16c-图16d)。
实施例13.分支寡聚化极大地放大了福尔马林固定石蜡包埋的(ffpe)组织中的信号
图18a-图18f示出了用dna标记的抗乙酰化微管蛋白第一抗体标记的ffpe小鼠大脑皮质的5μm厚切片的示例性图像。用alexa-594标记的第二抗体(图18a)或分支寡聚化(图18b-图18f)检测第一抗体。将组织和与标签互补的检测物探针一起温育,然后与分支“t”和alexa-594标记的线性检测物的循环一起经过两个(图18b)、四个(图18c)、六个(图18d)、八个(图18e)或十个(图18f)循环,其中循环包括一个“t”和一个线性检测物连接反应。主图像以相同的曝光和对比度显示;插图示出了处于最佳对比度设置的各自的子区域。
图18g示出了叠加有细胞体掩模(图18h中的白色区域)的6个循环的扩增的实例。图18i示出了第二抗体(菱形)和2-10个循环的分支寡聚化(圆形)的细胞体掩模内的像素的平均像素强度。使用不同通道(alexa647)中的荧光第二抗体的染色模式产生掩模。总体而言,分支寡聚化的实例证明了随着循环数增加的信号扩增。
实施例14.分支寡聚化极大地放大了树脂包埋组织中的信号
图19a-图19f示出了用dna标记的抗乙酰化微管蛋白第一抗体标记的小鼠大脑皮质切片的70nm厚的示例性图像,在油浸下以63x/1.4na成像。用alexa-594标记的第二抗体(图19a)或分支寡聚化(图19b-图19e)检测第一抗体。将组织和与标签互补的检测物探针一起温育,然后与分支“t”和alexa-594标记的线性检测物的循环一起经过两个(图19b)、四个(图19c)、六个(图19d)、或八个(图19e)循环,其中循环包括一个“t”和一个线性检测物连接反应。主图像以相同的曝光和对比度显示。插图示出了处于最佳对比度设置的各自的子区域,以相同的血管为中心,dapi染色的细胞核呈蓝色,微管蛋白免疫荧光呈绿色。图19f示出了第二抗体(菱形)和2-8个循环的分支寡聚化(圆形)的平均图像强度(来自16位图像的灰度值)。
- 还没有人留言评论。精彩留言会获得点赞!