一种预测非ST段抬高心肌梗死患者出现氯吡格雷抵抗的基因诊断组合物和试剂盒的制作方法
本发明属于生物领域,具体涉及不同类型冠心病患者出现抗血小板药物抵抗的预测。
背景技术:
血小板活化和聚集参与了冠心病的整个发展过程,阿司匹林、氯吡格雷为基础的抗血小板治疗是冠心病介入治疗术后药物治疗的基石。PCI术后给予阿司匹林、氯吡格雷能够延迟血管内皮化,延迟再狭窄和血栓形成过程,能显著降低心血管不良事件,尤其是支架内血栓发生的风险。临床证据表明,对于不同类型冠心病患者行PCI治疗后抗血小板治疗可以明显降低不良心血管事件的发生,降低出血风险。
近年来研究发现,患者对抗血小板药物的反应存在个体差异,低反应的患者发生血栓事件的风险更高。现有研究表明,冠心病患者中有5%-45%对阿司匹林抵抗,而对氯吡格雷抵抗的患者亦有5%-30%。阿司匹林抵抗的的患者中有47%对氯吡格雷亦呈现抵抗,对两者均抵抗的患者约有10%。这部分患者更易发生血栓事件。抗血小板药物抵抗一方面是指通过血小板功能检测发现其不能抑制血小板聚集,即生物化学抵抗;另一方面是指摄入治疗量的抗血小板药物后仍有心血管事件的发生,即临床治疗失败或临床抵抗。
临床证据表明,不同类型冠心病患者行PCI术后使用阿司匹林、氯吡格雷为基础的抗血小板治疗出现抵抗的比例存在明显差异。这表明,对于冠心病患者出现阿司匹林、氯吡格雷抵抗的诊断预测应该对冠心病类型进行区分。
基于病理生理机制和临床特征,将冠心病分为稳定性心绞痛、不稳定性心绞痛和心肌梗死,其中,心肌梗死又分为ST段抬高心肌梗死和非ST段抬高心肌梗死。冠状动脉造影是诊断冠心病的“金标准”,被广泛应用于冠心病的诊断中。冠状动脉造影可清楚地显影左、右冠状动脉及其主要分支,显现各支动脉狭窄性病变部位,并预测疾病严重程度。心电图ST-T段改变,即ST下斜型或水平型压低≥0.05mV,以及T波低平和倒置,一直以来被当作冠状动脉粥样硬化及狭窄引起的冠状动脉供血不足的典型心电图表现,并且由于其具有无创、简便、重复性好等优点,其在冠心病的诊断中应用广泛。也就是说,依靠冠状动脉造影和心电图这两种金标准方法,即可将冠心病分为稳定性心绞痛、不稳定性心绞痛、ST段抬高心肌梗死和非ST段抬高心肌梗死,准确可靠。
目前,尚没有可靠的方法预测不同类型的冠心病患者是否会发生氯吡格雷或阿司匹林抵抗。但是,一旦发生氯吡格雷或阿司匹林抵抗,就会导致PCI术治疗后不良心血管事件的发生,出血风险大大增加,甚至危及患者生命。
环状RNA(circularRNA,CircRNA)是一类具有特殊未知功能的RNA,而且是客观大量存在,由前体RNA通过剪切,然后由线性RNA的头对尾连接形成。研究表明,在生物体内大量存在环状RNA,环状RNA由于形成闭合的环,不受RNA外切酶影响,不易降解,在生物体内非常的稳定,使得环状RNA在作为新型临床诊断标记物的应用上具有明显优势。
技术实现要素:
本发明目的在于克服现有技术不足,提供一种预测不同类型冠心病患者(稳定性心绞痛、不稳定性心绞痛、ST段抬高心肌梗死和非ST段抬高心肌梗死)出现氯吡格雷抵抗的circRNAs 诊断组合物及预测方法,以在PCI术前早期评估不同类型冠心病患者发生氯吡格雷抵抗的风险,作为是否进行PCI术的参考依据或尽早做好PCI术后出现氯吡格雷抵抗的应急预案。
上述目的通过如下技术方案实现:
第一部分:预测稳定性心绞痛患者出现氯吡格雷抵抗的基因诊断组合物
一种用于预测稳定性心绞痛患者出现氯吡格雷抵抗的circRNAs组合物,该组合物包括 hsa_circ_0029642、hsa_circ_0006254和hsa_circ_0082617。
进一步地,所述的circRNAs组合物还包括内参GAPDH。
一种用于预测稳定性心绞痛患者出现氯吡格雷抵抗的基因诊断试剂盒,包括 hsa_circ_0029642、hsa_circ_0006254和hsa_circ_0082617的实时荧光定量PCR引物。
进一步地,hsa_circ_0029642的实时荧光定量PCR上游引物如Sequence NO.3所示,其实时荧光定量PCR下游引物如Sequence NO.4所示;hsa_circ_0006254的实时荧光定量PCR 上游引物如Sequence NO.5所示,其实时荧光定量PCR下游引物如Sequence NO.6所示; hsa_circ_0082617的实时荧光定量PCR上游引物如Sequence NO.7所示,其实时荧光定量PCR 下游引物如Sequence NO.8所示。
进一步地,还包括内参GAPDH的实时荧光定量PCR引物。
进一步地,GAPDH的实时荧光定量PCR上游引物如Sequence NO.1所示,其实时荧光定量PCR下游引物如Sequence NO.2所示。
进一步地,还包括实时荧光定量PCR所需要的酶和试剂。
一种用于预测稳定性心绞痛患者出现氯吡格雷抵抗的方法,包括:首先,收集稳定性心绞痛患者的外周静脉血,分离出血浆样本;然后提取血浆中总RNA,以GAPDH为内参,采用实时荧光定量PCR测定血浆样本中hsa_circ_0029642、hsa_circ_0006254和hsa_circ_0082617 的相对表达量,并代入方程Y=-0.215+7.772×hsa_circ_0029642相对表达量+8.354× hsa_circ_0006254相对表达量+5.459×hsa_circ_0082617相对表达量计算得到Y值;最后将该 Y值与诊断阈值1.756比较,大于1.756的预测为存在氯吡格雷抵抗,小于1.756的预测为不存在氯吡格雷抵抗。
第二部分:预测不稳定性心绞痛患者出现氯吡格雷抵抗的基因诊断组合物
一种用于预测不稳定性心绞痛患者出现氯吡格雷抵抗的circRNAs组合物,该组合物包括 hsa_circ_0029642、hsa_circ_0035589和hsa_circ_0067617。
进一步地,所述的circRNAs组合物还包括内参GAPDH。
一种用于预测不稳定性心绞痛患者出现氯吡格雷抵抗的基因诊断试剂盒,包括hsa_circ_0029642、hsa_circ_0035589和hsa_circ_0067617的实时荧光定量PCR引物。
进一步地,hsa_circ_0029642的实时荧光定量PCR上游引物如Sequence NO.3所示,其实时荧光定量PCR下游引物如Sequence NO.4所示;hsa_circ_0035589的实时荧光定量PCR 上游引物如Sequence NO.9所示,其实时荧光定量PCR下游引物如Sequence NO.10所示; hsa_circ_0067617的实时荧光定量PCR上游引物如Sequence NO.11所示,其实时荧光定量 PCR下游引物如Sequence NO.12所示。
进一步地,所述的基因诊断试剂盒还包括内参GAPDH的实时荧光定量PCR引物。
进一步地,GAPDH的实时荧光定量PCR上游引物如Sequence NO.1所示,其实时荧光定量PCR下游引物如Sequence NO.2所示。
进一步地,还包括实时荧光定量PCR所需要的酶和试剂。
一种用于预测不稳定性心绞痛患者出现氯吡格雷抵抗的方法,包括:首先,收集不稳定性心绞痛患者的外周静脉血,分离出血浆样本;然后提取血浆中总RNA,以GAPDH为内参,采用实时荧光定量PCR测定血浆样本中hsa_circ_0029642、hsa_circ_0035589和 hsa_circ_0067617的相对表达量,并代入方程Y=-0.183+9.145×hsa_circ_0029642相对表达量 +6.391×hsa_circ_0035589相对表达量+7.255×hsa_circ_0067617相对表达量计算得到Y值;最后将该Y值与诊断阈值2.041比较,大于2.041的预测为存在氯吡格雷抵抗,小于2.041的预测为不存在氯吡格雷抵抗。
第三部分:预测ST段抬高心肌梗死患者出现氯吡格雷抵抗的基因诊断组合物
一种用于预测ST段抬高心肌梗死患者出现氯吡格雷抵抗的circRNAs组合物,该组合物包括hsa_circ_0029642、hsa_circ_0040131和hsa_circ_0057959。
进一步地,所述的circRNAs组合物还包括内参GAPDH。
一种用于预测ST段抬高心肌梗死患者出现氯吡格雷抵抗的基因诊断试剂盒,包括 hsa_circ_0029642、hsa_circ_0040131和hsa_circ_0057959的实时荧光定量PCR引物。
进一步地,hsa_circ_0029642的实时荧光定量PCR上游引物如Sequence NO.3所示,其实时荧光定量PCR下游引物如Sequence NO.4所示;hsa_circ_0040131的实时荧光定量PCR 上游引物如Sequence NO.13所示,其实时荧光定量PCR下游引物如Sequence NO.14所示; hsa_circ_0057959的实时荧光定量PCR上游引物如Sequence NO.15所示,其实时荧光定量 PCR下游引物如Sequence NO.16所示。
进一步地,所述的基因诊断试剂盒还包括内参GAPDH的实时荧光定量PCR引物。
进一步地,GAPDH的实时荧光定量PCR上游引物如Sequence NO.1所示,其实时荧光定量PCR下游引物如Sequence NO.2所示。
进一步地,还包括实时荧光定量PCR所需要的酶和试剂。
一种用于预测ST段抬高心肌梗死患者出现氯吡格雷抵抗的方法,包括:首先,收集ST 段抬高心肌梗死患者的外周静脉血,分离出血浆样本;然后提取血浆中总RNA,以GAPDH 为内参,采用实时荧光定量PCR测定血浆样本中hsa_circ_0029642、hsa_circ_0040131和 hsa_circ_0057959的相对表达量,并代入方程Y=-0.146+5.883×hsa_circ_0029642相对表达量 +6.795×hsa_circ_0040131相对表达量+5.364×hsa_circ_0057959相对表达量计算得到Y值;最后将该Y值与诊断阈值1.593比较,大于1.593的预测为存在氯吡格雷抵抗,小于1.593的预测为不存在氯吡格雷抵抗。
第四部分:预测非ST段抬高心肌梗死患者出现氯吡格雷抵抗的基因诊断组合物
一种用于预测非ST段抬高心肌梗死患者出现氯吡格雷抵抗的circRNAs组合物,该组合物包括hsa_circ_0029642、hsa_circ_0040131和hsa_circ_0091771。
进一步地,所述的circRNAs组合物还包括内参GAPDH。
一种用于预测非ST段抬高心肌梗死患者出现氯吡格雷抵抗的基因诊断试剂盒,包括 hsa_circ_0029642、hsa_circ_0040131和hsa_circ_0091771的实时荧光定量PCR引物。
进一步地,hsa_circ_0029642的实时荧光定量PCR上游引物如Sequence NO.3所示,其实时荧光定量PCR下游引物如Sequence NO.4所示;hsa_circ_0040131的实时荧光定量PCR 上游引物如Sequence NO.13所示,其实时荧光定量PCR下游引物如Sequence NO.14所示; hsa_circ_0091771的实时荧光定量PCR上游引物如Sequence NO.17所示,其实时荧光定量 PCR下游引物如Sequence NO.18所示。
进一步地,所述的基因诊断试剂盒还包括内参GAPDH的实时荧光定量PCR引物。
进一步地,GAPDH的实时荧光定量PCR上游引物如Sequence NO.1所示,其实时荧光定量PCR下游引物如Sequence NO.2所示。
进一步地,还包括实时荧光定量PCR所需要的酶和试剂。
一种用于预测非ST段抬高心肌梗死患者出现氯吡格雷抵抗的方法,包括:首先,收集非ST段抬高心肌梗死患者的外周静脉血,分离出血浆样本;然后提取血浆中总RNA,以GAPDH为内参,采用实时荧光定量PCR测定血浆样本中hsa_circ_0029642、hsa_circ_0040131 和hsa_circ_0091771的相对表达量,并代入方程Y=-0.238+6.669×hsa_circ_0029642相对表达量+4.935×hsa_circ_0040131相对表达量+7.174×hsa_circ_0091771相对表达量计算得到Y 值;最后将该Y值与诊断阈值1.878比较,大于1.878的预测为存在氯吡格雷抵抗,小于1.878 的预测为不存在氯吡格雷抵抗。
本发明技术优势:
1、本发明circRNAs组合物hsa_circ_0029642、hsa_circ_0006254和hsa_circ_0082617可以联合用于预测稳定性心绞痛患者是否会发生氯吡格雷抵抗,灵敏度、特异性强,准确度高;本发明circRNAs组合物hsa_circ_0029642、hsa_circ_0035589和hsa_circ_0067617可以联合用于预测不稳定性心绞痛患者是否会发生氯吡格雷抵抗,灵敏度、特异性强,准确度高;本发明circRNAs组合物hsa_circ_0029642、hsa_circ_0040131和hsa_circ_0057959可以联合用于预测ST段抬高心肌梗死患者是否会发生氯吡格雷抵抗,灵敏度、特异性强,准确度高;本发明circRNAs组合物hsa_circ_0029642、hsa_circ_0040131和hsa_circ_0091771可以联合用于预测非ST段抬高心肌梗死患者是否会发生氯吡格雷抵抗,灵敏度、特异性强,准确度高。
2、本发明发现circRNAs可以用于预测不同类型冠心病是否会发生氯吡格雷抵抗,可以在PCI术前早期评估不同类型冠心病患者发生氯吡格雷抵抗的风险,作为是否进行PCI术的参考依据或尽早做好PCI术后出现氯吡格雷抵抗的应急预案。
3、本发明提供的circRNAs组合物具有优异的特异性和准确度,比如若使用预测稳定性心绞痛发生氯吡格雷抵抗的组合物(hsa_circ_0029642、hsa_circ_0006254和hsa_circ_0082617) 进行区分不稳定性心绞痛CPGR组和不稳定性心绞痛NCPGR组患者的ROC仅为0.745,相反仅为0.752;若使用预测ST段抬高心肌梗死发生氯吡格雷抵抗的组合物(hsa_circ_0029642、 hsa_circ_0040131和hsa_circ_0057959)进行区分非ST段抬高心肌梗死CPGR组和非ST段抬高心肌梗死NCPGR组患者的ROC仅为0.793,相反仅为0.778。
附图说明
图1为训练集中hsa_circ_0029642、hsa_circ_0006254和hsa_circ_0082617联合用于区分稳定性心绞痛CPGR组和稳定性心绞痛NCPGR组患者的ROC曲线;
图2为验证集中hsa_circ_0029642、hsa_circ_0006254和hsa_circ_0082617联合用于预测稳定性心绞痛CPGR组和稳定性心绞痛NCPGR组患者的灵敏度、特异度和准确度;
图3为训练集中hsa_circ_0029642、hsa_circ_0035589和hsa_circ_0067617联合用于区分不稳定性心绞痛CPGR组和不稳定性心绞痛NCPGR组患者的ROC曲线;
图4为验证集中hsa_circ_0029642、hsa_circ_0035589和hsa_circ_0067617联合用于预测不稳定性心绞痛CPGR组和不稳定性心绞痛NCPGR组患者的灵敏度、特异度和准确度;
图5为训练集中hsa_circ_0029642、hsa_circ_0040131和hsa_circ_0057959联合用于区分 ST段抬高心肌梗死CPGR组和ST段抬高心肌梗死NCPGR组患者的ROC曲线;
图6为验证集中hsa_circ_0029642、hsa_circ_0040131和hsa_circ_0057959联合区分ST 段抬高心肌梗死CPGR组和ST段抬高心肌梗死NCPGR组患者的灵敏度、特异度和准确度;
图7为训练集中hsa_circ_0029642、hsa_circ_0040131和hsa_circ_0091771联合区分非ST 段抬高心肌梗死CPGR组和非ST段抬高心肌梗死NCPGR组患者的ROC曲线;
图8为验证集中hsa_circ_0029642、hsa_circ_0040131和hsa_circ_0091771联合区分非ST 段抬高心肌梗死CPGR组和非ST段抬高心肌梗死NCPGR组患者的灵敏度、特异度和准确度。
具体实施方式
下面结合实施例具体介绍本发明的实质性内容,但本领域技术人员应当知道,不应将本发明的保护范围局限于这些具体实施例。
实施例1:预测稳定性心绞痛患者出现氯吡格雷抵抗的circRNAs组合物及方法
一、实验样本
选取湖南省人民医院2016年1月至2017年12月期间患有冠心病拟行PCI术的患者,根据术前诊断(冠脉造影和心电图等)将冠心病患有分为稳定性心绞痛组(SAP组)、不稳定性心绞痛组(UA组)、ST段抬高心肌梗死组(STEMI组)和非ST段抬高心肌梗死组(NSTEMI 组)。术前均予300mg负荷量的氯吡格雷片(波立维)预治疗,检测其服药前、服药后12 小时以5μM的二磷酸腺苷诱导的血小板最大聚集率(MPAR),同时测定服药前血浆中目标 circRNAs的相对表达量。以服药后12小时MPAR≤10%定义为氯吡格雷抵抗。据此可以将SAP 组、UA组、STEMI组和NSTEMI组患者根据是否出现氯吡格雷抵抗(CPGR)分为:
病例纳入标准:(1)冠心病及分型经过金标准冠脉造影和心电图等确诊;(2)本次给药前未服用过氯吡格雷或停药半年以上,未进行过PCI术及冠脉支架植入史。
病例排除标准:(1)有明显消化道溃疡或上消化道穿孔史;(2)有明确肝肾功能异常; (3)排除糖尿病、感染、肿瘤、严重高血压、免疫系统疾病;(4)有抽烟、酗酒史。
各组患者的年龄、性别无显著差异;各组患者服药前MPAR无显著差异。
外周血采集及血浆分离保存:选用EDTA抗凝管收集每个患者外周静脉血4-5mL,静置 1-2小时后离心(2000r/min,10min,22℃),小心吸取上层清亮血浆液体于无菌冻干管中,标记后放入-80℃冰箱储存备用。
二、实验方法
1、总RNA提取及质量检测
参照TaKaRa RNAiso Blood试剂盒说明书操作,每份样品取血浆250μL,提取血浆样品中的总RNA。应用分光光度计测定总RNA的光密度D(260)和D(280)值,用D(260)值计算其浓度,并计算D(260)/D(280)值检测其纯度,D(260)/D(280)值范围在1.8~2.1认为合格。
2、实时荧光定量PCR检测目标circRNAs
按PrimeScript RT reagent Kit with gDNAEraser试剂盒的说明书进行操作。目标circRNAs 和内参GAPDH的实时荧光定量PCR引物由广州锐博生物设计合成,具体见下表。
2.1去除基因组DNA
反应体系为:5×gDNAEraser Buffer 2.0μL,gDNAEraser 1.0μL,总RNA2μg,RNase Free dH2O补至10μL。反应条件为:42℃2min,4℃。
2.2反转录反应
上一步实验的反应液:10.0μL,Prime Script RT Enzyme MixⅠ1.0μL,RTPrimer Mix 1.0μL,5×Prime Script Buffer 24.0μL,RNase Free dH2O 4.0μL,总共20μL。反应条件为:37℃15min, 85℃5s,4℃。
2.3 RT-PCR反应
用Applied Biosystems Stepous荧光定量PCR测定仪进行反应,按下列组分配制PCR反应液:SYBR Premix Ex TaqⅡ10μL,PCR上游引物(10μmol/L)0.8μL,PCR下游引物(10μmol/L) 0.8μL,ROX Reference Dye 0.4μL,RT反应液(cDNA溶液)2.0μL,dH2O(灭菌蒸馏水)6μL,总共20μL。采用两步法PCR反应程序。反应结束后确认PCR的扩增曲线和融解曲线。应用 2-ΔΔCt法计算目标circRNAs相对表达量。
3、统计学方法
数据采用SPSS 22.0进行分析。计量资料用均值±偏差表示,采用t检验,计数资料用百分率表示,采用χ2检验,以P<0.05为差异有统计学意义,并建立ROC曲线,计算曲线下面积(area under the curve,AUC)及95%可信区间。运用Logistic回归筛选变量,建立回归方程,产生一组新变量Y。对新变量及各单项指标进行ROC曲线分析。
三、实验结果
1、总RNA质量检测
应用紫外分光光度计检测各样本总RNA的D(260)/D(280)值均在1.8~2.1之间,各样本总 RNA均有较好质量,可以进行实时定量PCR检测。
2、稳定性心绞痛CPGR组和稳定性心绞痛NCPGR组患者血浆中hsa_circ_0029642、 hsa_circ_0006254和hsa_circ_0082617的相对表达量比较
将各组患者随机对半分为训练集和验证集。在训练集中,稳定性心绞痛CPGR组比稳定性心绞痛NCPGR组患者血浆中hsa_circ_0029642、hsa_circ_0006254和hsa_circ_0082617的相对表达量均显著上调,分别上调(9.9±1.4)倍、(6.4±1.1)倍、(7.5±1.2)倍。
3、hsa_circ_0029642、hsa_circ_0006254、hsa_circ_0082617单独用于区分稳定性心绞痛 CPGR组和稳定性心绞痛NCPGR组患者的ROC分析
训练集中用SPSS 22.0绘制hsa_circ_0029642、hsa_circ_0006254、hsa_circ_0082617相对表达量单独用于区分稳定性心绞痛CPGR组和稳定性心绞痛NCPGR组患者的ROC曲线, AUC分别为0.751、0.602、0.635,具有较低或中等准确性。
4、hsa_circ_0029642、hsa_circ_0006254和hsa_circ_0082617联合用于区分稳定性心绞痛 CPGR组和稳定性心绞痛NCPGR组患者的logistics回归模型的建立及用于区分稳定性心绞痛 CPGR组和稳定性心绞痛NCPGR组患者的ROC分析
训练集中以各样本中hsa_circ_0029642、hsa_circ_0006254、hsa_circ_0082617的相对表达量作为自变量(设X1=hsa_circ_0029642相对表达量,X2=hsa_circ_0006254相对表达量, X3=hsa_circ_0082617相对表达量),以组别(CPGR组和NCPGR组)作为应变量,对 hsa_circ_0029642、hsa_circ_0006254、hsa_circ_0082617在稳定性心绞痛CPGR组和NCPGR 组样本中的相对表达量进行二元逻辑回归,得到二元逻辑回归方程:Y= -0.215+7.772X1+8.354X2+5.459X3;再将各样本中hsa_circ_0029642、hsa_circ_0006254、 hsa_circ_0082617的相对表达量代入该二元逻辑回归方程,即可得到各个样本的回归值Y,以可能的回归值Y作为诊断点,计算灵敏度和特异性,据此绘制ROC曲线(如图1所示), AUC为0.933,具有较高的准确性。根据ROC曲线的坐标计算维登指数=特异性+灵敏度-1,维登指数最大值时对应的Y值为能进行诊断区分稳定性心绞痛CPGR组和稳定性心绞痛 NCPGR组患者的最佳cut-off值1.756,即诊断阈值。
5、hsa_circ_0029642、hsa_circ_0006254和hsa_circ_0082617联合用于区分稳定性心绞痛 CPGR组和稳定性心绞痛NCPGR组患者的准确度的验证分析
在验证集中,将各样本hsa_circ_0029642、hsa_circ_0006254和hsa_circ_0082617相对表达水平代入上述回归方程,得到各样本的回归值Y,Y高于诊断阈值的预测为稳定性心绞痛 CPGR组,低于诊断阈值的预测为稳定性心绞痛NCPGR组,预测结果如图2所示。
实施例2:预测不稳定性心绞痛患者出现氯吡格雷抵抗的circRNAs组合物及方法
一、实验样本
同实施例1。
二、实验方法
1、总RNA提取及质量检测
参照TaKaRa RNAiso Blood试剂盒说明书操作,每份样品取血浆250μL,提取血浆样品中的总RNA。应用分光光度计测定总RNA的光密度D(260)和D(280)值,用D(260)值计算其浓度,并计算D(260)/D(280)值检测其纯度,D(260)/D(280)值范围在1.8~2.1认为合格。
2、实时荧光定量PCR检测目标circRNAs
按PrimeScript RT reagent Kit with gDNAEraser试剂盒的说明书进行操作。目标circRNAs 和内参GAPDH的实时荧光定量PCR引物由广州锐博生物设计合成,具体见下表。
2.1去除基因组DNA
反应体系为:5×gDNAEraser Buffer 2.0μL,gDNAEraser 1.0μL,总RNA2μg,RNase Free dH2O补至10μL。反应条件为:42℃2min,4℃。
2.2反转录反应
上一步实验的反应液:10.0μL,Prime Script RT Enzyme MixⅠ1.0μL,RTPrimer Mix 1.0μL, 5×Prime Script Buffer 24.0μL,RNase Free dH2O 4.0μL,总共20μL。反应条件为:37℃15min, 85℃5s,4℃。
2.3 RT-PCR反应
用Applied Biosystems Stepous荧光定量PCR测定仪进行反应,按下列组分配制PCR反应液:SYBR Premix Ex TaqⅡ10μL,PCR上游引物(10μmol/L)0.8μL,PCR下游引物(10μmol/L) 0.8μL,ROX Reference Dye 0.4μL,RT反应液(cDNA溶液)2.0μL,dH2O(灭菌蒸馏水)6μL,总共20μL。采用两步法PCR反应程序。反应结束后确认PCR的扩增曲线和融解曲线。应用 2-ΔΔCt法计算目标circRNAs相对表达量。
3、统计学方法
数据采用SPSS 22.0进行分析。计量资料用均值±偏差表示,采用t检验,计数资料用百分率表示,采用χ2检验,以P<0.05为差异有统计学意义,并建立ROC曲线,计算曲线下面积(area under the curve,AUC)及95%可信区间。运用Logistic回归筛选变量,建立回归方程,产生一组新变量Y。对新变量及各单项指标进行ROC曲线分析。
三、实验结果
1、总RNA质量检测
应用紫外分光光度计检测各样本总RNA的D(260)/D(280)值均在1.8~2.1之间,各样本总 RNA均有较好质量,可以进行实时定量PCR检测。
2、不稳定性心绞痛CPGR组和不稳定性心绞痛NCPGR组患者血浆中hsa_circ_0029642、 hsa_circ_0035589和hsa_circ_0067617的相对表达量比较
将各组患者随机对半分为训练集和验证集。在训练集中,不稳定性心绞痛CPGR组比不稳定性心绞痛NCPGR组患者血浆中hsa_circ_0029642、hsa_circ_0035589和hsa_circ_0067617 的相对表达量均显著上调,分别上调(8.3±1.1)倍、(8.7±1.5)倍、(9.4±1.5)倍。
3、hsa_circ_0029642、hsa_circ_0035589、hsa_circ_0067617单独用于区分不稳定性心绞痛CPGR组和不稳定性心绞痛NCPGR组患者的ROC分析
训练集中用SPSS 22.0绘制hsa_circ_0029642、hsa_circ_0035589、hsa_circ_0067617相对表达量单独用于区分不稳定性心绞痛CPGR组和不稳定性心绞痛NCPGR组患者的ROC曲线,AUC分别为0.724、0.729、0.738,具有较低或中等准确性。
4、hsa_circ_0029642、hsa_circ_0035589和hsa_circ_0067617联合用于区分不稳定性心绞痛CPGR组和不稳定性心绞痛NCPGR组患者的logistics回归模型的建立及用于区分不稳定性心绞痛CPGR组和不稳定性心绞痛NCPGR组患者的ROC分析
训练集中以各样本中hsa_circ_0029642、hsa_circ_0035589、hsa_circ_0067617的相对表达量作为自变量(设X1=hsa_circ_0029642相对表达量,X2=hsa_circ_0035589相对表达量, X3=hsa_circ_0067617相对表达量),以组别(CPGR组和NCPGR组)作为应变量,对 hsa_circ_0029642、hsa_circ_0035589、hsa_circ_0067617在不稳定性心绞痛CPGR组和NCPGR 组样本中的相对表达量进行二元逻辑回归,得到二元逻辑回归方程:Y= -0.183+9.145X1+6.391X2+7.255X3;再将各样本中hsa_circ_0029642、hsa_circ_0035589、 hsa_circ_0067617的相对表达量代入该二元逻辑回归方程,即可得到各个样本的回归值Y,以可能的回归值Y作为诊断点,计算灵敏度和特异性,据此绘制ROC曲线(如图3所示), AUC为0.945,具有较高的准确性。根据ROC曲线的坐标计算维登指数=特异性+灵敏度-1,维登指数最大值时对应的Y值为能进行诊断区分不稳定性心绞痛CPGR组和不稳定性心绞痛 NCPGR组患者的最佳cut-off值2.041,即诊断阈值。
5、hsa_circ_0029642、hsa_circ_0035589和hsa_circ_0067617联合用于区分不稳定性心绞痛CPGR组和不稳定性心绞痛NCPGR组患者的准确度的验证分析
在验证集中,将各样本hsa_circ_0029642、hsa_circ_0035589和hsa_circ_0067617相对表达水平代入上述回归方程,得到各样本的回归值Y,Y高于诊断阈值的预测为不稳定性心绞痛CPGR组,低于诊断阈值的预测为不稳定性心绞痛NCPGR组,预测结果如图4所示。
实施例3:预测ST段抬高心肌梗死患者出现氯吡格雷抵抗的circRNAs组合物及方法
一、实验样本
同实施例1。
二、实验方法
1、总RNA提取及质量检测
参照TaKaRa RNAiso Blood试剂盒说明书操作,每份样品取血浆250μL,提取血浆样品中的总RNA。应用分光光度计测定总RNA的光密度D(260)和D(280)值,用D(260)值计算其浓度,并计算D(260)/D(280)值检测其纯度,D(260)/D(280)值范围在1.8~2.1认为合格。
2、实时荧光定量PCR检测目标circRNAs
按PrimeScript RT reagent Kit with gDNAEraser试剂盒的说明书进行操作。目标circRNAs 和内参GAPDH的实时荧光定量PCR引物由广州锐博生物设计合成,具体见下表。
2.1去除基因组DNA
反应体系为:5×gDNAEraser Buffer 2.0μL,gDNAEraser 1.0μL,总RNA2μg,RNase Free dH2O补至10μL。反应条件为:42℃2min,4℃。
2.2反转录反应
上一步实验的反应液:10.0μL,Prime Script RT Enzyme MixⅠ1.0μL,RTPrimer Mix 1.0μL, 5×Prime Script Buffer 24.0μL,RNase Free dH2O 4.0μL,总共20μL。反应条件为:37℃15min, 85℃5s,4℃。
2.3 RT-PCR反应
用Applied Biosystems Stepous荧光定量PCR测定仪进行反应,按下列组分配制PCR反应液:SYBR Premix Ex TaqⅡ10μL,PCR上游引物(10μmol/L)0.8μL,PCR下游引物(10μmol/L) 0.8μL,ROX Reference Dye 0.4μL,RT反应液(cDNA溶液)2.0μL,dH2O(灭菌蒸馏水)6μL,总共20μL。采用两步法PCR反应程序。反应结束后确认PCR的扩增曲线和融解曲线。应用 2-ΔΔCt法计算目标circRNAs相对表达量。
3、统计学方法
数据采用SPSS 22.0进行分析。计量资料用均值±偏差表示,采用t检验,计数资料用百分率表示,采用χ2检验,以P<0.05为差异有统计学意义,并建立ROC曲线,计算曲线下面积(area under the curve,AUC)及95%可信区间。运用Logistic回归筛选变量,建立回归方程,产生一组新变量Y。对新变量及各单项指标进行ROC曲线分析。
三、实验结果
1、总RNA质量检测
应用紫外分光光度计检测各样本总RNA的D(260)/D(280)值均在1.8~2.1之间,各样本总 RNA均有较好质量,可以进行实时定量PCR检测。
2、ST段抬高心肌梗死CPGR组和ST段抬高心肌梗死NCPGR组患者血浆中 hsa_circ_0029642、hsa_circ_0040131和hsa_circ_0057959的相对表达量比较
将各组患者随机对半分为训练集和验证集。在训练集中,ST段抬高心肌梗死CPGR组比 NCPGR组患者血浆中hsa_circ_0029642、hsa_circ_0040131和hsa_circ_0057959的相对表达量均显著上调,分别上调(7.3±1.0)倍、(6.8±1.3)倍、(5.8±0.9)倍。
3、hsa_circ_0029642、hsa_circ_0040131、hsa_circ_0057959单独用于区分ST段抬高心肌梗死CPGR组和ST段抬高心肌梗死NCPGR组患者的ROC分析
训练集中用SPSS 22.0绘制hsa_circ_0029642、hsa_circ_0040131、hsa_circ_0057959相对表达量单独用于区分ST段抬高心肌梗死CPGR组和ST段抬高心肌梗死NCPGR组患者的 ROC曲线,AUC分别为0.704、0.657、0.602,具有较低或中等准确性。
4、hsa_circ_0029642、hsa_circ_0040131和hsa_circ_0057959联合用于区分ST段抬高心肌梗死CPGR组和ST段抬高心肌梗死NCPGR组患者的logistics回归模型的建立及用于区分 ST段抬高心肌梗死CPGR组和ST段抬高心肌梗死NCPGR组患者的ROC分析
训练集中以各样本中hsa_circ_0029642、hsa_circ_0040131、hsa_circ_0057959的相对表达量作为自变量(设X1=hsa_circ_0029642相对表达量,X2=hsa_circ_0040131相对表达量, X3=hsa_circ_0057959相对表达量),以组别(CPGR组和NCPGR组)作为应变量,对 hsa_circ_0029642、hsa_circ_0040131、hsa_circ_0057959在ST段抬高心肌梗死CPGR组和 NCPGR组样本中的相对表达量进行二元逻辑回归,得到二元逻辑回归方程:Y= -0.146+5.883X1+6.795X2+5.364X3;再将各样本中hsa_circ_0029642、hsa_circ_0040131、 hsa_circ_0057959的相对表达量代入该二元逻辑回归方程,即可得到各个样本的回归值Y,以可能的回归值Y作为诊断点,计算灵敏度和特异性,据此绘制ROC曲线(如图5所示), AUC为0.921,具有较高的准确性。根据ROC曲线的坐标计算维登指数=特异性+灵敏度-1,维登指数最大值时对应的Y值为能进行诊断区分ST段抬高心肌梗死CPGR组和ST段抬高心肌梗死NCPGR组患者的最佳cut-off值1.593,即诊断阈值。
5、hsa_circ_0029642、hsa_circ_0040131和hsa_circ_0057959联合用于区分ST段抬高心肌梗死CPGR组和ST段抬高心肌梗死NCPGR组患者的准确度的验证分析
在验证集中,将各样本hsa_circ_0029642、hsa_circ_0040131和hsa_circ_0057959相对表达水平代入上述回归方程,得到各样本的回归值Y,Y高于诊断阈值的预测为ST段抬高心肌梗死CPGR组,低于诊断阈值的预测为ST段抬高心肌梗死NCPGR组,预测结果如图6所示。
实施例4:预测非ST段抬高心肌梗死患者出现氯吡格雷抵抗的circRNAs组合物及方法
一、实验样本
同实施例1。
二、实验方法
1、总RNA提取及质量检测
参照TaKaRa RNAiso Blood试剂盒说明书操作,每份样品取血浆250μL,提取血浆样品中的总RNA。应用分光光度计测定总RNA的光密度D(260)和D(280)值,用D(260)值计算其浓度,并计算D(260)/D(280)值检测其纯度,D(260)/D(280)值范围在1.8~2.1认为合格。
2、实时荧光定量PCR检测目标circRNAs
按PrimeScript RT reagent Kit with gDNAEraser试剂盒的说明书进行操作。目标circRNAs 和内参GAPDH的实时荧光定量PCR引物由广州锐博生物设计合成,具体见下表。
2.1去除基因组DNA
反应体系为:5×gDNAEraser Buffer 2.0μL,gDNAEraser 1.0μL,总RNA2μg,RNase Free dH2O补至10μL。反应条件为:42℃2min,4℃。
2.2反转录反应
上一步实验的反应液:10.0μL,Prime Script RT Enzyme MixⅠ1.0μL,RTPrimer Mix 1.0μL, 5×Prime Script Buffer 24.0μL,RNase Free dH2O 4.0μL,总共20μL。反应条件为:37℃15min, 85℃5s,4℃。
2.3 RT-PCR反应
用Applied Biosystems Stepous荧光定量PCR测定仪进行反应,按下列组分配制PCR反应液:SYBR Premix Ex TaqⅡ10μL,PCR上游引物(10μmol/L)0.8μL,PCR下游引物(10μmol/L) 0.8μL,ROX Reference Dye 0.4μL,RT反应液(cDNA溶液)2.0μL,dH2O(灭菌蒸馏水)6μL,总共20μL。采用两步法PCR反应程序。反应结束后确认PCR的扩增曲线和融解曲线。应用 2-ΔΔCt法计算目标circRNAs相对表达量。
3、统计学方法
数据采用SPSS 22.0进行分析。计量资料用均值±偏差表示,采用t检验,计数资料用百分率表示,采用χ2检验,以P<0.05为差异有统计学意义,并建立ROC曲线,计算曲线下面积(area under the curve,AUC)及95%可信区间。运用Logistic回归筛选变量,建立回归方程,产生一组新变量Y。对新变量及各单项指标进行ROC曲线分析。
三、实验结果
1、总RNA质量检测
应用紫外分光光度计检测各样本总RNA的D(260)/D(280)值均在1.8~2.1之间,各样本总 RNA均有较好质量,可以进行实时定量PCR检测。
2、非ST段抬高心肌梗死CPGR组和非ST段抬高心肌梗死NCPGR组患者血浆中 hsa_circ_0029642、hsa_circ_0040131和hsa_circ_0091771的相对表达量比较
将各组患者随机对半分为训练集和验证集。在训练集中,非ST段抬高心肌梗死CPGR 组比NCPGR组患者血浆中hsa_circ_0029642、hsa_circ_0040131和hsa_circ_0091771的相对表达量均显著上调,分别上调(7.6±1.4)倍、(8.3±1.6)倍、(5.5±0.7)倍。
3、hsa_circ_0029642、hsa_circ_0040131、hsa_circ_0091771单独用于区分非ST段抬高心肌梗死CPGR组和非ST段抬高心肌梗死NCPGR组患者的ROC分析
训练集中用SPSS 22.0绘制hsa_circ_0029642、hsa_circ_0040131、hsa_circ_0091771相对表达量单独用于区分非ST段抬高心肌梗死CPGR组和非ST段抬高心肌梗死NCPGR组患者的ROC曲线,AUC分别为0.727、0.762、0.613,具有较低或中等准确性。
4、hsa_circ_0029642、hsa_circ_0040131和hsa_circ_0091771联合用于区分非ST段抬高心肌梗死CPGR组和非ST段抬高心肌梗死NCPGR组患者的logistics回归模型的建立及用于区分非ST段抬高心肌梗死CPGR组和非ST段抬高心肌梗死NCPGR组患者的ROC分析
训练集中以各样本中hsa_circ_0029642、hsa_circ_0040131、hsa_circ_0091771的相对表达量作为自变量(设X1=hsa_circ_0029642相对表达量,X2=hsa_circ_0040131相对表达量, X3=hsa_circ_0091771相对表达量),以组别(CPGR组和NCPGR组)作为应变量,对 hsa_circ_0029642、hsa_circ_0040131、hsa_circ_0091771在非ST段抬高心肌梗死CPGR组和 NCPGR组样本中的相对表达量进行二元逻辑回归,得到二元逻辑回归方程:Y= -0.238+6.669X1+4.935X2+7.174X3;再将各样本中hsa_circ_0029642、hsa_circ_0040131、 hsa_circ_0091771的相对表达量代入该二元逻辑回归方程,即可得到各个样本的回归值Y,以可能的回归值Y作为诊断点,计算灵敏度和特异性,据此绘制ROC曲线(如图7所示), AUC为0.942,具有较高的准确性。根据ROC曲线的坐标计算维登指数=特异性+灵敏度-1,维登指数最大值时对应的Y值为能进行诊断区分非ST段抬高心肌梗死CPGR组和非ST段抬高心肌梗死NCPGR组患者的最佳cut-off值1.878,即诊断阈值。
5、hsa_circ_0029642、hsa_circ_0040131和hsa_circ_0091771联合用于区分非ST段抬高心肌梗死CPGR组和非ST段抬高心肌梗死NCPGR组患者的准确度的验证分析
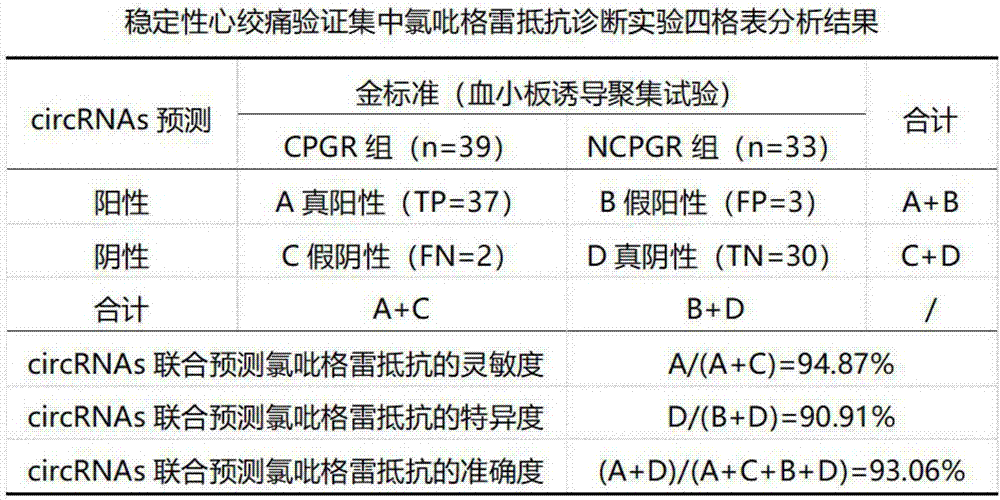
验证集中将各样本hsa_circ_0029642、hsa_circ_0040131和hsa_circ_0091771相对表达水平代入上述回归方程,得到各样本的回归值Y,Y高于诊断阈值的预测为非ST段抬高心肌梗死CPGR组,低于诊断阈值的预测为非ST段抬高心肌梗死NCPGR组,预测结果如图8所示。
实施例5:预测不同类型冠心病患者出现氯吡格雷抵抗的基因诊断试剂盒
1、用于预测稳定性心绞痛患者出现氯吡格雷抵抗的基因诊断试剂盒
一种用于预测稳定性心绞痛患者出现氯吡格雷抵抗的基因诊断试剂盒,包括 hsa_circ_0029642、hsa_circ_0006254和hsa_circ_0082617的实时荧光定量PCR引物。 hsa_circ_0029642的实时荧光定量PCR上游引物如Sequence NO.3所示,其实时荧光定量PCR 下游引物如Sequence NO.4所示;hsa_circ_0006254的实时荧光定量PCR上游引物如Sequence NO.5所示,其实时荧光定量PCR下游引物如Sequence NO.6所示;hsa_circ_0082617的实时荧光定量PCR上游引物如Sequence NO.7所示,其实时荧光定量PCR下游引物如Sequence NO.8所示。还包括内参GAPDH的实时荧光定量PCR引物。GAPDH的实时荧光定量PCR 上游引物如Sequence NO.1所示,其实时荧光定量PCR下游引物如Sequence NO.2所示。还包括实时荧光定量PCR所需要的酶和试剂。
2、用于预测不稳定性心绞痛患者出现氯吡格雷抵抗的基因诊断试剂盒
一种用于预测不稳定性心绞痛患者出现氯吡格雷抵抗的基因诊断试剂盒,包括 hsa_circ_0029642、hsa_circ_0035589和hsa_circ_0067617的实时荧光定量PCR引物。hsa_circ_0029642的实时荧光定量PCR上游引物如Sequence NO.3所示,其实时荧光定量PCR 下游引物如Sequence NO.4所示;hsa_circ_0035589的实时荧光定量PCR上游引物如Sequence NO.9所示,其实时荧光定量PCR下游引物如Sequence NO.10所示;hsa_circ_0067617的实时荧光定量PCR上游引物如Sequence NO.11所示,其实时荧光定量PCR下游引物如Sequence NO.12所示。还包括内参GAPDH的实时荧光定量PCR引物。GAPDH的实时荧光定量PCR 上游引物如Sequence NO.1所示,其实时荧光定量PCR下游引物如Sequence NO.2所示。还包括实时荧光定量PCR所需要的酶和试剂。
3、用于预测ST段抬高心肌梗死患者出现氯吡格雷抵抗的基因诊断试剂盒
一种用于预测ST段抬高心肌梗死患者出现氯吡格雷抵抗的基因诊断试剂盒,包括 hsa_circ_0029642、hsa_circ_0040131和hsa_circ_0057959的实时荧光定量PCR引物。 hsa_circ_0029642的实时荧光定量PCR上游引物如Sequence NO.3所示,其实时荧光定量PCR 下游引物如Sequence NO.4所示;hsa_circ_0040131的实时荧光定量PCR上游引物如Sequence NO.13所示,其实时荧光定量PCR下游引物如Sequence NO.14所示;hsa_circ_0057959的实时荧光定量PCR上游引物如Sequence NO.15所示,其实时荧光定量PCR下游引物如 Sequence NO.16所示。还包括内参GAPDH的实时荧光定量PCR引物。GAPDH的实时荧光定量PCR上游引物如Sequence NO.1所示,其实时荧光定量PCR下游引物如Sequence NO.2 所示。还包括实时荧光定量PCR所需要的酶和试剂。
4、用于预测非ST段抬高心肌梗死患者出现氯吡格雷抵抗的基因诊断试剂盒
一种用于预测非ST段抬高心肌梗死患者出现氯吡格雷抵抗的基因诊断试剂盒,包括 hsa_circ_0029642、hsa_circ_0040131和hsa_circ_0091771的实时荧光定量PCR引物。 hsa_circ_0029642的实时荧光定量PCR上游引物如Sequence NO.3所示,其实时荧光定量PCR 下游引物如Sequence NO.4所示;hsa_circ_0040131的实时荧光定量PCR上游引物如Sequence NO.13所示,其实时荧光定量PCR下游引物如Sequence NO.14所示;hsa_circ_0091771的实时荧光定量PCR上游引物如Sequence NO.17所示,其实时荧光定量PCR下游引物如 Sequence NO.18所示。还包括内参GAPDH的实时荧光定量PCR引物。GAPDH的实时荧光定量PCR上游引物如Sequence NO.1所示,其实时荧光定量PCR下游引物如Sequence NO.2 所示。还包括实时荧光定量PCR所需要的酶和试剂。
上述试剂盒涉及的引物序列如下表所示。
本发明circRNAs组合物hsa_circ_0029642、hsa_circ_0006254和hsa_circ_0082617可以联合用于预测稳定性心绞痛患者是否会发生氯吡格雷抵抗,灵敏度、特异性强,准确度高;本发明circRNAs组合物hsa_circ_0029642、hsa_circ_0035589和hsa_circ_0067617可以联合用于预测不稳定性心绞痛患者是否会发生氯吡格雷抵抗,灵敏度、特异性强,准确度高;本发明 circRNAs组合物hsa_circ_0029642、hsa_circ_0040131和hsa_circ_0057959可以联合用于预测 ST段抬高心肌梗死患者是否会发生氯吡格雷抵抗,灵敏度、特异性强,准确度高;本发明 circRNAs组合物hsa_circ_0029642、hsa_circ_0040131和hsa_circ_0091771可以联合用于预测非ST段抬高心肌梗死患者是否会发生氯吡格雷抵抗,灵敏度、特异性强,准确度高。本发明技术方案可以在PCI术前早期评估不同类型冠心病患者发生氯吡格雷抵抗的风险,作为是否进行PCI术的参考依据或尽早做好PCI术后出现氯吡格雷抵抗的应急预案。
序列表
<110> 姜振东
<120> 一种预测非ST段抬高心肌梗死患者出现氯吡格雷抵抗的基因诊断组合物
<160> 18
<170> SIPOSequenceListing 1.0
<210> 1
<211> 21
<212> DNA/RNA
<213> 人工序列(Artificial Sequence)
<400> 1
agggctgctt ttaactctgg t 21
<210> 2
<211> 21
<212> DNA/RNA
<213> 人工序列(Artificial Sequence)
<400> 2
ccccacttga ttttggaggg a 21
<210> 3
<211> 20
<212> DNA/RNA
<213> 人工序列(Artificial Sequence)
<400> 3
ccgcctgcaa tatgcaatca 20
<210> 4
<211> 20
<212> DNA/RNA
<213> 人工序列(Artificial Sequence)
<400> 4
acaacttgga aggcatgaga 20
<210> 5
<211> 22
<212> DNA/RNA
<213> 人工序列(Artificial Sequence)
<400> 5
tgctgaacac caaacatggt cc 22
<210> 6
<211> 21
<212> DNA/RNA
<213> 人工序列(Artificial Sequence)
<400> 6
acagcagagt tgcaagagta g 21
<210> 7
<211> 22
<212> DNA/RNA
<213> 人工序列(Artificial Sequence)
<400> 7
ttcgacttgg ccgttttctt gt 22
<210> 8
<211> 21
<212> DNA/RNA
<213> 人工序列(Artificial Sequence)
<400> 8
tggcctgtgg accgggaatg a 21
<210> 9
<211> 22
<212> DNA/RNA
<213> 人工序列(Artificial Sequence)
<400> 9
gatagccact tgttcgtgag tg 22
<210> 10
<211> 22
<212> DNA/RNA
<213> 人工序列(Artificial Sequence)
<400> 10
ccagaacgac tagagcatag tt 22
<210> 11
<211> 22
<212> DNA/RNA
<213> 人工序列(Artificial Sequence)
<400> 11
actcattcgc agtcaccatg aa 22
<210> 12
<211> 22
<212> DNA/RNA
<213> 人工序列(Artificial Sequence)
<400> 12
tgctgaactc ttctggcagc gg 22
<210> 13
<211> 21
<212> DNA/RNA
<213> 人工序列(Artificial Sequence)
<400> 13
gatcttgcgt agtcgcttga g 21
<210> 14
<211> 21
<212> DNA/RNA
<213> 人工序列(Artificial Sequence)
<400> 14
ggtcttgtct tgcttgcctc g 21
<210> 15
<211> 20
<212> DNA/RNA
<213> 人工序列(Artificial Sequence)
<400> 15
ctgacactag tgctcgattg 20
<210> 16
<211> 20
<212> DNA/RNA
<213> 人工序列(Artificial Sequence)
<400> 16
caccagtgga ttctgttcat 20
<210> 17
<211> 20
<212> DNA/RNA
<213> 人工序列(Artificial Sequence)
<400> 17
tccatcagtg ggcagtaact 20
<210> 18
<211> 20
<212> DNA/RNA
<213> 人工序列(Artificial Sequence)
<400> 18
tagcaaagta agatcgtcgt 20
- 还没有人留言评论。精彩留言会获得点赞!
- 用于优化对临床过程的时间分配的装置和方法
- 一种治疗心阳不振型st段抬高心肌梗死直接pci术后心肌灌注不良的中药组合物的制作方法
- 一种治疗痰浊闭阻型st段抬高心肌梗死直接pci术后心肌灌注不良的中药组合物的制作方法
- 一种治疗瘀血痹阻型st段抬高心肌梗死直接pci术后心肌灌注不良的中药组合物的制作方法
- 一种治疗心阴亏损型st段抬高心肌梗死直接pci术后心肌灌注不良的中药组合物的制作方法
- 一种治疗气滞心胸型st段抬高心肌梗死直接pci术后心肌灌注不良的中药组合物的制作方法
- 一种治疗心气不足型st段抬高心肌梗死直接pci术后心肌灌注不良的中药组合物的制作方法
- 一种治疗寒疑心脉型st段抬高心肌梗死直接pci术后心肌灌注不良的中药组合物的制作方法
- 一种急性心肌梗死标志物及其应用
- 急性心肌梗死相关基因serpinb13及其应用