提高L-精氨酸菌株生产能力的方法与流程
本发明属于基因工程领域,具体地说,涉及一种提高l-精氨酸菌株生产能力的方法,尤其涉及一种通过基因工程提高l-精氨酸产生菌生产能力的方法。
背景技术:
l-精氨酸(l-argnine,简称l-arg)是人体内所需半必需碱性氨基酸之一,作为一种含有胍基的碱性氨基酸,是生物体尿素循环的一种重要中间代谢物,具有多种独特的生理和药理作用,对于治疗生理功能、心血管疾病、激励免疫系统、维持婴儿的营养平衡、促进人体解毒等都具有良好的疗效,被专家称为是机体内运输和贮存氨基酸的重要载体,在肌内代谢中极为重要。它是合成胞浆蛋白和核蛋白的必需氨基酸;作为唯一的氨来源参与肌酸的合成;作为尿素循环的重要中间体,在肝脏中扮演着排除多余氨的角色,防止氨过量积累而引起中毒;它还具有调节人体免疫力的功能,可抑制肿瘤生长、促进受伤组织愈合等。并且,精氨酸是一氧化氮、尿素、鸟氨酸及肌丁胺的直接前体,是合成肌肉素的重要原素,且被用作聚胺、瓜氨酸及谷氨酰胺的合成。因此,l-精氨酸在医药、食品及化工领域方面具有重要而广泛的应用。比如,在临床上,除作为复方氨基酸输液的主要组分之一外,l-精氨酸及其盐类还广泛用于治疗各类肝昏迷忌用谷氨酸钠者和病毒性肝类谷丙转氨酶异常者,对病毒性肝炎疗效显著。对肠道溃疡、血栓形成和神经衰弱等症都有治疗效果。另外,l-精氨酸是运动营养饮料配方的重要组成部分,也是一种重要的饲料添加剂,还广泛地应用于高端养殖业。据统计,目前全世界l-精氨酸需求量在15000吨以上,并且需求量以每年12%-15%的速度增长。
l-精氨酸的生产方法有两种:一是蛋白质水解提取法,二是微生物发酵法。水解法存在操作费时,收率和产量低,成本高等问题,并且存在严重的污染而不适合大规模的生产。发酵法生产l-精氨酸工艺相对简单,且对环境友好,因此具有很大的发展潜力,成为国内外氨基酸工业的一个重要趋势。国际上著名的氨基酸公司比如日本味之素、协和发酵和德国迪高沙主要采用生物发酵和基因工程技术进行l-精氨酸生产。但是,国内的微生物发酵生产l-精氨酸的产酸水平普遍较低,成本较高,生产水平和产量远远不能满足国内需求,因此提高l-精氨酸发酵水平的研究具有重要的意义。
l-精氨酸的发酵菌种研究得较多的主要有谷氨酸棒杆菌(corynebacteriumglutamicum)、黄色短杆菌(brevibacteriumflavum)、钝齿棒杆菌(corynebacteriumcrenatum)、大肠杆菌(escherichiacoli)、枯草芽孢杆菌(bacillussubtilis)等,但目前用来生产l-精氨酸的微生物菌株主要是谷氨酸棒杆菌和钝齿棒杆菌。基因工程技术对于精氨酸高产菌选育具有重要的推动作用,利用基因工程构建l-精氨酸高产菌株是一种高效率、理性化的育种手段,但构建筛选出适合于工业规模生产的高产重组菌始终是一种迫切的需求。
技术实现要素:
为了克服现有l-精氨酸生产菌株发酵水平低的缺陷,本发明利用基因工程技术来改造谷氨酸棒杆菌,通过增强与l-精氨酸产生相关的基因、弱化分支代谢途径,能够使菌株的l-精氨酸生产能力大幅度提高。
为了达到上述目的,本发明采用如下技术方案:
一种提高l-精氨酸产生菌生产能力的方法,包括以下步骤:
a.敲除谷氨酸棒杆菌atcc13032基因组中的argr基因,获得基因敲除菌株atcc13032(δargr);
b.对步骤a中所述基因敲除菌株atcc13032(δargr)的基因组中argb基因进行a26v和m31v突变,获得基因突变菌株atcc13032(δargr,argbmut(a26vm31v));
c.对步骤b中所述基因突变菌株atcc13032(δargr,argbmut(a26vm31v))的基因组中atp依赖的dna解旋酶基因(ncgl0742)碱基序列进行v386m突变,获得l-精氨酸生产能力比所述基因突变菌株提高的基因工程菌株atcc13032(δargr,argbmut(a26vm31v),ncgl0742mut3)。
在一种实施方式中,上述步骤a中所述的基因敲除菌株atcc13032(δargr)通过下述方法制备:
a1.以atcc13032基因组为模板,使用序列为seqidno:1的引物argr-al-f和序列为seqidno:2的引物argr-al-r进行pcr扩增,得到约1kb的argr-al片段;
a2.以atcc13032基因组为模板,使用序列为seqidno:3的引物argr-ar-f和序列为seqidno:4的引物argr-ar-r进行pcr扩增,得到约1kb的argr-ar片段;
a3.使用hindiii和ecori酶切genbank登录号为fj437239.1的质粒pk18mobsacb,胶回收得到5.7kb载体片段;
a4.gibson连接上述argr-al片段、argr-ar片段和载体片段,转化dh5α感受态细胞,涂布卡那霉素lb平板,过夜培养;
a5.使用引物argr-al-f和argr-ar-r进行pcr扩增验证转化子,得到质粒pk18mobsacb-argr;
a6.制备谷氨酸棒状杆菌atcc13032感受态细胞;
a7.将质粒pk18mobsacb-argr转化入atcc13032感受态细胞;
a8.进行sacb蔗糖反筛,使用引物argr-al-f和argr-ar-r进行pcr扩增,验证在bhis平板生长而在含卡那霉素的bhis平板不能生长的转化子,得到菌株atcc13032(δargr)。
在一种实施方式中,上述步骤b中所述的基因突变菌株通过下述方法制备:
b1.以atcc13032基因组为模板,使用序列为seqidno:5的引物argb-al-f和序列为seqidno:6的引物argb-al-r进行pcr扩增,得到约1kb的argb-al片段;
b2.以atcc13032基因组为模板,使用序列为seqidno:7的引物argb-ar-f和序列为seqidno:8的引物argb-ar-r进行pcr扩增,得到约1kb的argb-ar片段;
b3.使用hindiii和ecori酶切genbank登录号为fj437239.1的质粒pk18mobsacb,胶回收得到5.7kb载体片段;
b4.gibson连接上述argb-al片段、argb-ar片段和载体片段,转化dh5α感受态细胞,涂布卡那霉素lb平板,过夜培养;
b5.使用引物argb-al-f和argb-ar-r进行pcr扩增验证转化子,得到质粒pk18mobsacb-argbmut;
b6.制备谷氨酸棒状杆菌atcc13032(δargr)感受态细胞;
b7.将质粒pk18mobsacb-argbmut转化入atcc13032(δargr)感受态细胞;
b8.进行sacb蔗糖反筛,使用引物argb-al-f和argb-ar-r进行pcr扩增,验证在bhis平板生长而在含卡那霉素的bhis平板不能生长的转化子,得到菌株atcc13032(δargr,argbmut(a26vm31v))。
在一种实施方式中,上述步骤c中所述的基因工程菌株通过下述方法制备:
c1.以atcc13032基因组为模板,使用序列为seqidno:9的引物ncgl0742mut3-al-f和序列为seqidno:10的引物ncgl0742mut3-al-r进行pcr扩增,得到约0.5kb的ncgl0742mut3-al片段;
c2.以atcc13032基因组为模板,使用序列为seqidno:11的引物ncgl0742mut3-ar-f和序列为seqidno:12的引物ncgl0742mut3-ar-r进行pcr扩增,得到约0.5kb的ncgl0742mut3-ar片段;
c3.使用hindiii和ecori酶切genbank登录号为fj437239.1的质粒pk18mobsacb,胶回收得到5.7kb载体片段;
c4.gibson连接上述ncgl0742mut3-al片段、ncgl0742mut3-ar片段和载体片段,转化dh5α感受态细胞,涂布卡那霉素lb平板,过夜培养;
c5.使用引物ncgl0742mut3-al-f和ncgl0742mut3-ar-r进行pcr扩增验证转化子,得到质粒pk18mobsacb-ncgl0742mut3;
c6.制备谷氨酸棒状杆菌atcc13032(δargr,argbmut(a26vm31v))感受态细胞;
c7.将质粒pk18mobsacb-ncgl0742mut3转化入atcc13032(δargr,argbmut(a26vm31v))感受态细胞;
c8.进行sacb蔗糖反筛,使用引物ncgl0742mut3-al-f和ncgl0742mut3-ar-r进行pcr扩增验证在bhis平板生长而在含卡那霉素的bhis平板不能生长的转化子,得到菌株atcc13032(δargr,argbmut(a26vm31v),ncgl0742mut3)。
上述步骤a7、b7和c7中所述转化为氯化钙转化法或电转化,优选电转化。
根据本发明的第二个方面,提供了一种基因工程菌atcc13032(δargr,argbmut(a26vm31v),ncgl0742mut3),其按照上述的方法构建。
根据本发明的第三个方面,提供了上述基因工程菌在l-精氨酸的生产中的应用。
该基因工程菌既可以直接作为发酵菌株通过发酵来生产l-精氨酸,也可以作为出发菌株做进一步改良以便筛选出l-精氨酸生产能力进一步提高的新的生产菌。
当通过对上述基因工程菌进行发酵来生产l-精氨酸时,发酵时所用的培养基可以是任何适用于谷氨酸棒杆菌生长发酵的培养基。
根据本发明的优选实施例,发酵培养基组成如下:60g/l葡萄糖,5g/l玉米浆,30g/l(nh4)2so4,8g/lkcl,2g/l尿素,0.5g/lkh2po4,0.5g/lk2hpo4,1g/lmgso4·7h2o,1g/lnacl,20mg/lfeso4·7h2o,10mg/lmnso4·5h2o,20mg/l尼克酸,20mg/lβ-丙氨酸,10mg/lvb1,0.2mg/l生物素,30g/lcaco3,koh调ph=7.7。
在一种优选的实施方式中,上述l-精氨酸生产菌进行发酵时包括种子培养阶段和菌体发酵阶段。这两个阶段分别使用种子培养基和发酵培养基,发酵培养基可以与种子培养基相同,也可以不相同。
优选地,当发酵培养基与种子培养基不相同时,种子培养基组成如下:3g/lnacl,5g/l酵母提取物,7g/l牛肉浸膏,10g/l蛋白胨,10g/l葡萄糖。
本发明的方法能够使产l-精氨酸的原始菌株corynebacteriumglutamicumatcc13032的l-精氨酸生产能力提高15倍,具有普及推广价值。
附图说明
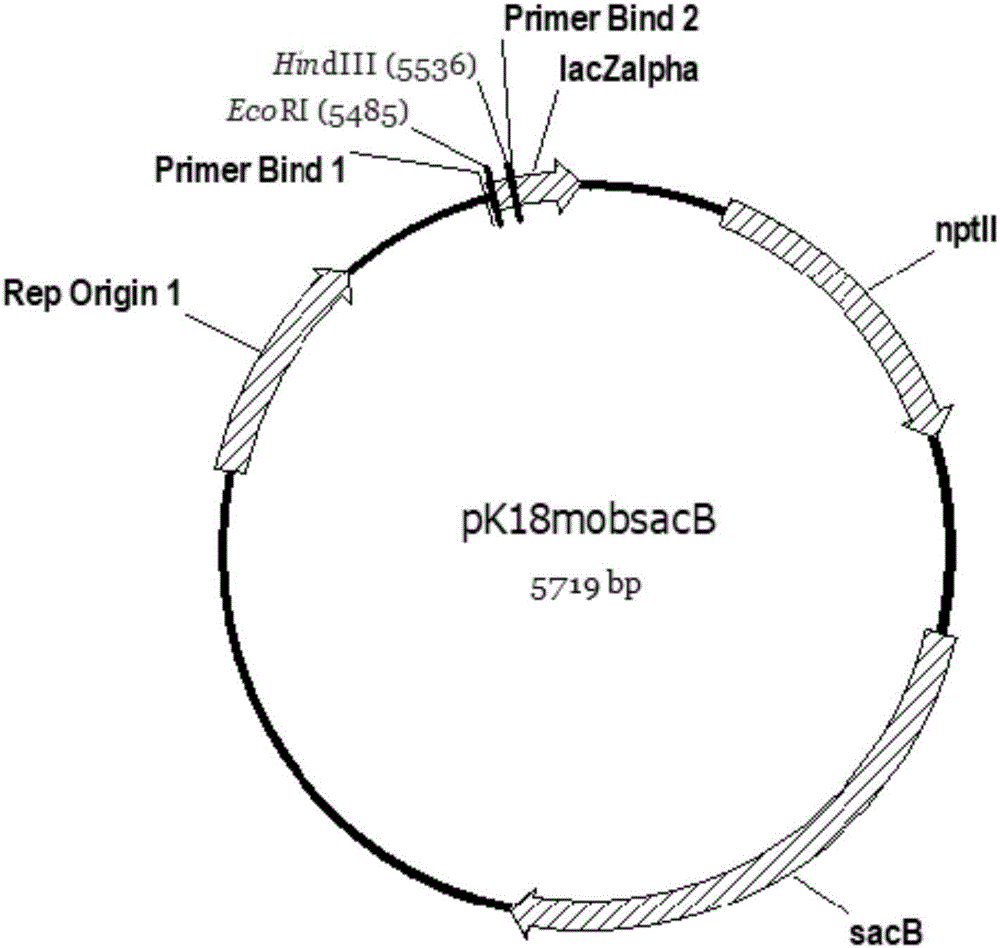
图1为质粒pk18mobsacb的示意图,该质粒由中国科学院微生物研究所刘双江馈赠。genbank:fj437239.1。具体信息参见https://www.ncbi.nlm.nih.gov/nuccore/215434894。
图2为本发明构建的重组质粒pk18mobsacb-argr的示意图。
图3为本发明构建的重组质粒pk18mobsacb-argbmut的示意图。
图4为本发明构建的重组质粒pk18mobsacb-ncgl0742mut3的示意图。
具体实施方式
以下结合具体实施例对本发明做进一步详细说明。应理解,以下实施例仅用于说明本发明而非用于限定本发明的范围。
本文中涉及到多种物质的添加量、含量及浓度,其中所述的百分含量,除特别说明外,皆指质量百分含量。
在本文中,术语“谷氨酸棒杆菌atcc13032”、“菌株atcc13032”、“atcc13032”表示相同的意义,都是指作为基因改造对象的原始菌株atcc13032,是一种l-精氨酸产生菌,购买自上海工业微生物研究所。
在本文中,术语“基因敲除菌(株)”和“atcc13032(δargr)”表示相同的意义,都是指atcc13032基因组中argr基因被敲除的菌株。
类似地,术语“基因突变菌(株)”、“atcc13032(δargrargbmut(a26vm31v)”、“atcc13032(δargr,argbmut(a26vm31v)”和“cibts1512”表示相同的意义,都是指基因敲除菌atcc13032(δargr)基因组中argbmut基因突变为argbmut(a26vm31v)基因的菌株。
术语“基因工程菌(株)”、“atcc13032(δargrargbmut(a26vm31v)ncgl0742mut3)”、“atcc13032(δargr,argbmut(a26vm31v),ncgl0742mut3)”、“cibts1512(ncgl0742mut3)”和“cibts3006”表示相同的意义,都是指基因突变菌atcc13032(δargr,argbmut(a26vm31v))基因组中进一步将ncgl0742基因突变为ncgl0742mut3基因的菌株,该突变是指将atp依赖的dna解旋酶基因(ncgl0742)碱基序列seqidno:13突变为seqidno:14,使得该dna解旋酶氨基酸序列第386位的缬氨酸(v)被甲硫氨酸(m)取代。
基因argr是一个在细菌中普遍存在的精氨酸操纵子调节基因,在不同的细菌中有不同的功能,发明人研究发现,通过敲除谷氨酸棒杆菌基因组中的这一负调控基因,可一定程度上解除其对精氨酸合成的抑制。
n-乙酰谷氨酸激酶(n-acetylglutamatekinase)对于谷氨酸棒杆菌完成精氨酸合成途径第一步由谷氨酸到乙酰谷氨酸具有催化功能而不受终产物l-精氨酸的反馈抑制。发明人研究发现,通过对n-乙酰谷氨酸激酶进行突变,将第26位的丙氨酸(a)突变为缬氨酸(v)、第31位的蛋氨酸(m)突变为缬氨酸(v),可以有效地提高谷氨酸棒杆菌atcc13032中l-精氨酸的合成能力。在本文中,将该n-乙酰谷氨酸激酶基因argb的突变基因简写为argbmut或argbmut(a26vm31v)。
atp依赖的dna解旋酶基因(ncgl0742)的碱基序列seqidno:13变化可以引起精氨酸合成能力的改变是一个意外发现。将其突变为seqidno:14能够在一定程度上提高谷氨酸棒杆菌的l-精氨酸产量。
实验发现,基因突变菌株cibts1512的l-精氨酸生产能力比原始菌株atcc13032提高了至少13倍;基因工程菌株cibts3006的l-精氨酸生产能力又比cibts1512提高了7.5%,即cibts3006比原始菌株atcc13032提高了至少14倍,验证了本发明的基因工程设计思想的正确性。
实施例
材料和方法
本文中的全基因合成、引物合成及测序皆由生工生物工程(上海)股份有限公司完成。
本文中的分子生物学实验包括质粒构建、酶切、感受态细胞制备、转化等主要参照《分子克隆实验指南》(第三版),j.萨姆布鲁克,d.w.拉塞尔(美)编著,黄培堂等译,科学出版社,北京,2002)进行。比如感受态细胞转化方法及感受态制备方法均参照《分子克隆实验指南》(第三版)第1章96页进行。必要时可以通过简单试验确定具体实验条件。
主要培养基及缓冲液:
lb液体培养基:10g/l胰蛋白胨,5g/l酵母提取物,10g/l氯化钠。
lb固体培养基:10g/l胰蛋白胨,5g/l酵母提取物,10g/l氯化钠,20g/l琼脂粉。
bhis液体培养基:37g/lbhi,91g/l山梨醇。
bhis固体培养基:37g/lbhi,91g/l山梨醇,20g/l琼脂粉。
bhis-suc固体培养基:37g/lbhi,91g/l山梨醇,200g/l蔗糖,10g/l葡萄糖。
byg培养基:3g/lnacl,5g/l酵母提取物,7g/l牛肉浸膏,10g/l蛋白胨,10g/l葡萄糖。
rg2培养基:60g/l葡萄糖,5g/l玉米浆,30g/l(nh4)2so4,8g/lkcl,2g/l尿素,0.5g/lkh2po4,0.5g/lk2hpo4,1g/lmgso4·7h2o,1g/lnacl,20mg/lfeso4·7h2o,10mg/lmnso4·5h2o,20mg/l尼克酸,20mg/lβ-丙氨酸,10mg/lvb1,0.2mg/l生物素,30g/lcaco3,koh调ph=7.7。
cgm基本培养基:10g/l葡萄糖,1g/l蛋白胨,10g/lnh4(so4)2,1g/lkh2po4,2g/l尿素,0.5g/lmgso4·7h2o,0.1mg/l生物素,0.1mg/lvb1,10mg/lfeso4·7h2o,10mg/lmnso4·5h2o,koh调ph=7.2。
20x电转母液:80g/l甘氨酸,2%吐温80。
以下实施例中,当使用含卡那霉素的培养基时,所述卡那霉素在培养基中的终浓度为50μg/ml。
以下实施例中使用的引物序列信息如表1所示。
表1、引物序列
表1中,名称中的“-f”代表正向;“-r”代表反向。
实施例1:敲除argr基因的菌株atcc13032(δargr)的制备
1.1atcc13032基因组抽提:接少量atcc13032甘油菌(购买自上海工业微生物研究所)到bhis试管,恒温摇床上30℃,220rpm培养18小时,12000rpm离心收集菌体,使用axygen细菌基因组小量抽提试剂盒抽提atcc13032基因组。
1.2敲除质粒pk18mobsacb-argr的构建
1.2.1以步骤1.1中抽提的atcc13032基因组为模板,使用引物argr-al-f和argr-al-r进行pcr扩增argr-al片段,pcr体系如下(以下pcr试剂购买自东洋纺toyobo的kod系列):kodbuffer5μl,dntp5μl,mgso44μl,引物argr-al-f0.5μl,引物argr-al-r0.5μl,kodplusneo1μl,模板0.4μl,ddh2o补足50μl。pcr程序为99℃热盖,95℃预变性5min;94℃变性30s,60℃退火30s,68℃延伸60s;35个循环,最后68℃延伸10min;16℃降温10min。扩增得到约1kb片段,胶回收目的片段。
1.2.2以步骤1.1中抽提的atcc13032基因组为模板,使用引物argr-ar-f和argr-ar-r按照步骤1.2.1相同的pcr条件扩增argr-ar片段,约1kb,胶回收目的片段。
1.2.3使用axygen的质粒抽提试剂盒抽提质粒pk18mobsacb(由中国科学院微生物研究所刘双江馈赠,其结构如图1所示),使用hindiii和ecori酶切质粒,胶回收,得到5.7kb载体片段。
1.2.4gibson连接以上片段,转化dh5α感受态细胞(购买自南京诺唯赞生物科技有限公司的商品化感受态细胞),涂布卡那霉素lb平板,过夜培养。
1.2.5使用引物argr-al-f和argr-ar-r进行pcr扩增验证转化子,pcr体系如下(以下pcr试剂购买自东洋纺toyobo的kod系列):kodbuffer2μl,dntp2μl,mgso41.6μl,引物argr-al-f0.4μl,引物argr-ar-r0.4μl,kodplusneo0.4μl,模板为菌体,ddh2o补足20μl。pcr程序为99℃热盖,95℃预变性5min;94℃变性30s,58℃退火30s,68℃延伸120s;35个循环,最后68℃延伸10min;16℃降温10min。阳性条带约为2kb。阳性转化子接lb液体试管,使用axygen的质粒抽提试剂盒抽提质粒测序,得到正确质粒pk18mobsacb-argr,其结构如图2所示。
1.3制备谷氨酸棒状杆菌atcc13032感受态细胞:
挑取谷氨酸棒状杆菌attc13032在bhis平板上划线,30℃恒温培养箱中过夜培养,挑取单菌落到bhis试管培养基中,在30℃,220rpm的过夜培养。接种1ml菌液到100ml的bhis液体培养基摇瓶中,恒温摇床上30℃,220rpm培养4-6h至od600值达到1.0左右。在超净工作台上,将菌液全部转移至50ml离心管中,4℃,4500×g离心,弃上清,用10%甘油洗涤菌体,使菌体重悬,4℃,4500×g离心,重复洗涤1遍,弃上清。最后加入600μl的10%甘油,使菌体悬浮,分装到1.5ml离心管中,每90μl制备为一支感受态细胞,感受态细胞可放置在-80℃冰箱中保存。
1.4pk18mobsacb-argr电转化atcc13032感受态细胞:
选取测序正确的质粒,吸取3μl(1μg以上)到谷氨酸棒状杆菌atcc13032感受态细胞中,混匀后转移至电转杯中,在25uf,2.5kv,200ω的条件下进行电击,电击时间为5.6ms,电击后立即转入900μl46℃预热的bhis液体培养基中,并在46℃水浴锅中水浴6min,然后置于恒温摇床中30℃,220rpm培养1h,使菌体复苏。复苏之后取50μl菌体涂布在含卡那霉素的bhis平板上,将平板倒置在30℃恒温培养箱中培养48小时。
1.5sacb蔗糖反筛:
挑取含卡那霉素的bhis平板上的转化子,接种到无抗性的bhis试管培养基中,在恒温摇床中30℃,220rpm培养24h,使其发生双交换。将菌体稀释1000倍后涂布在含20%蔗糖的bhis-suc平板上,倒置在30℃恒温培养箱中培养48小时。挑取bhis-suc平板转化子,分别点板bhis平板和含卡那霉素的bhis平板,倒置在30℃恒温培养箱中培养24小时。使用引物argr-al-f和argr-ar-r进行pcr扩增验证在bhis平板生长而在含卡那霉素的bhis平板不能生长的转化子,pcr扩增条件同步骤1.2.5,argr基因成功敲除的阳性条带约为2kb,阴性条带为2.5k。挑取阳性转化子到4ml的bhis试管培养基中,在恒温摇床上30℃,220rpm培养24小时,使用20%甘油保菌。得到了基因型为atcc13032(δargr)的菌株。
实施例2:突变argb基因的菌株atcc13032(δargrargbmut(a26vm31v)的制备
2.1突变质粒pk18mobsacb-argbmut的构建:
2.1.1以步骤1.1中抽提的atcc13032基因组为模板,使用引物argb-al-f和argb-al-r按照步骤1.2.1相同的pcr条件扩增argb-al片段,约1kb,胶回收目的片段。
2.1.2以步骤1.1中抽提的atcc13032基因组为模板,使用引物argb-ar-f和argb-ar-r按照步骤1.2.1相同的pcr条件扩增argb-ar片段,约1kb,胶回收目的片段。
2.1.3使用axygen的质粒抽提试剂盒抽提质粒pk18mobsacb(由中国科学院微生物研究所刘双江馈赠,其结构如图1所示),使用hindiii和ecori酶切质粒,胶回收,得到5.7kb载体片段。
2.1.4gibson连接以上片段,转化dh5α感受态细胞(购买自南京诺唯赞生物科技有限公司的商品化感受态细胞),涂布卡那霉素lb平板,过夜培养。
2.1.5使用引物argb-al-f和argb-ar-r按照步骤1.2.5相同的pcr条件扩增验证转化子,阳性条带约为2kb。阳性转化子接lb液体试管,抽提质粒测序,得到正确质粒pk18mobsacb-argbmut,其结构如图3所示。
2.2制备谷氨酸棒状杆菌atcc13032(δargr)感受态细胞:
挑取谷氨酸棒状杆菌atcc13032(δargr)在bhis平板上划线,30℃恒温培养箱中过夜培养,挑取单菌落到bhis试管培养基中,在30℃,220rpm的过夜培养。接种1ml菌液到100ml的bhis液体培养基摇瓶中,恒温摇床上30℃,220rpm培养4-6h至od600值达到1.0左右。在超净工作台上,将菌液全部转移至50ml离心管中,4℃,4500×g离心,弃上清,用10%甘油洗涤菌体,使菌体重悬,4℃,4500×g离心,重复洗涤1遍,弃上清。最后加入600μl的10%甘油,使菌体悬浮,分装到1.5ml离心管中,每90μl制备为一支感受态细胞,感受态细胞可放置在-80℃冰箱中保存。
2.3pk18mobsacb-argbmut电转化atcc13032(δargr)感受态细胞:
选取测序正确的质粒,吸取3μl(1μg以上)到谷氨酸棒状杆菌atcc13032(δargr)感受态细胞中,混匀后转移至电转杯中,在25uf,2.5kv,200ω的条件下进行电击,电击时间为5.6ms,电击后立即转入900μl46℃预热的bhis液体培养基中,并在46℃水浴锅中水浴6min,然后置于恒温摇床中30℃,220rpm培养1h,使菌体复苏。复苏之后取50μl菌体涂布在含卡那霉素的bhis平板上,将平板倒置在30℃恒温培养箱中培养48小时。
2.4sacb蔗糖反筛:
挑取含卡那霉素的bhis平板上的转化子,接种到无抗性的bhis试管培养基中,在恒温摇床中30℃,220rpm培养24h,使其发生双交换。将菌体稀释1000倍后涂布在含20%蔗糖的bhis-suc平板上,倒置在30℃恒温培养箱中培养48小时。挑取bhis-suc平板转化子,分别点板bhis平板和含卡那霉素的bhis平板,倒置在30℃恒温培养箱中培养24小时。使用引物argb-al-f和argb-ar-r进行pcr扩增验证在bhis平板生长而在含卡那霉素的bhis平板不能生长的转化子,pcr扩增条件同步骤1.2.5,得到条带约为2kb,对pcr产物进行测序得到argb成功突变的转化子。挑取阳性转化子到4ml的bhis试管培养基中,在恒温摇床上30℃,220rpm培养24小时,使用20%甘油保菌。得到基因型为atcc13032(δargrargbmut(a26vm31v)的菌株。
2.5把以上基因型正确的菌株在bhis平板上划线,30℃度培养2天左右。待长出单菌落后,挑取若干单菌落到4ml的bhis试管培养基中,在恒温摇床上30℃,220rpm培养24小时,将其中一株单菌使用20%甘油保菌,并命名为cibts1512。
实施例3:突变atp依赖的dna解旋酶基因(ncgl0742)的菌株cibts1512(ncgl0742mut3)的制备
3.1:重组质粒pk18mobsacb-ncgl0742mut3构建
3.1.1以步骤1.1中抽提的atcc13032基因组为模板,使用引物ncgl0742mut3-al-f和ncgl0742mut3-al-r按照步骤1.2.1相同的pcr条件扩增ncgl0742mut3-al片段,约0.5kb,胶回收目的片段。。
3.1.2以步骤1.1中抽提的atcc13032基因组为模板,使用引物ncgl0742mut3-ar-f和ncgl0742mut3-ar-r按照步骤1.2.1相同的pcr条件扩增ncgl0742mut3-ar片段,约0.5kb,胶回收目的片段。
3.1.3使用axygen的质粒抽提试剂盒抽提质粒pk18mobsacb(由中国科学院微生物研究所刘双江馈赠,其结构如图1所示),使用hindiii和ecori酶切质粒,胶回收,得到5.7kb载体片段。
3.1.4gibson连接以上片段,转化dh5α感受态细胞(购买自南京诺唯赞生物科技有限公司的商品化感受态细胞),涂布卡那霉素lb平板,过夜培养。
3.1.5使用引物ncgl0742mut3-al-f和ncgl0742mut3-ar-r进行pcr扩增验证转化子,pcr体系如下(以下pcr试剂购买自东洋纺toyobo的kod系列):kodbuffer2μl,dntp2μl,mgso41.6μl,引物ncgl0742mut3-al-f0.4μl,引物ncgl0742mut3-ar-r0.4μl,kodplusneo0.4μl,模板为菌体,ddh2o补足20μl。pcr程序为99℃热盖,95℃预变性5min;94℃变性30s,58℃退火30s,68℃延伸120s;35个循环,最后68℃延伸10min;16℃降温10min。阳性条带约为1kb。阳性转化子接lb液体试管,使用axygen的质粒抽提试剂盒抽提质粒测序,得到正确质粒pk18mobsacb-ncgl0742mut3,其结构如图4所示。
3.2制备谷氨酸棒状杆菌cibts1512感受态细胞:
挑取谷氨酸棒状杆菌cibts1512在bhis平板上划线,30℃恒温培养箱中过夜培养,挑取单菌落到bhis试管培养基中,在30℃,220rpm的过夜培养。接种1ml菌液到100ml的bhis液体培养基摇瓶中,恒温摇床上30℃,220rpm培养4-6h至od600值达到1.0左右。在超净工作台上,将菌液全部转移至50ml离心管中,4℃,4500×g离心,弃上清,用10%甘油洗涤菌体,使菌体重悬,4℃,4500×g离心,重复洗涤1遍,弃上清。最后加入600μl的10%甘油,使菌体悬浮,分装到1.5ml离心管中,每90μl制备为一支感受态细胞,感受态细胞可放置在-80℃冰箱中保存。
3.3pk18mobsacb-ncgl0742mut3电转化cibts1512感受态细胞:
选取测序正确的质粒,吸取3μl(1μg以上)到谷氨酸棒状杆菌cibts1512感受态细胞中,混匀后转移至电转杯中,在25uf,2.5kv,200ω的条件下进行电击,电击时间为5.6ms,电击后立即转入900μl46℃预热的bhis液体培养基中,并在46℃水浴锅中水浴6min,然后置于恒温摇床中30℃,220rpm培养1h,使菌体复苏。复苏之后取50μl菌体涂布在含卡那霉素的bhis平板上,将平板倒置在30℃恒温培养箱中培养48小时。
3.4sacb蔗糖反筛:
挑取含卡那霉素的bhis平板上的转化子,接种到无抗性的bhis试管培养基中,在恒温摇床中30℃,220rpm培养24h,使其发生双交换。将菌体稀释1000倍后涂布在含20%蔗糖的bhis-suc平板上,倒置在30℃恒温培养箱中培养48小时。挑取bhis-suc平板转化子,分别点板bhis平板和含卡那霉素的bhis平板,倒置在30℃恒温培养箱中培养24小时。使用引物ncgl0742mut3-al-f和ncgl0742mut3-ar-r进行pcr扩增验证在bhis平板生长而在含卡那霉素的bhis平板不能生长的转化子,pcr扩增条件同步骤1.6,得到条带约为1kb,对pcr产物进行测序得到成功突变的转化子。挑取阳性转化子到4ml的bhis试管培养基中,在恒温摇床上30℃,220rpm培养24小时,使用20%甘油保菌。
得到基因型为cibts1512(ncgl0742mut3)的菌株,命名为cibts3006。
实施例4:产精氨酸菌株发酵及产量测定
4.1菌株摇瓶发酵
4.1.1活化:从菌种甘油管划线至平板bhig,30℃度培养2天左右。
4.1.2种子培养:byg培养基配制混匀后分装10ml/瓶至250ml摇瓶中,用接种环挖取步骤4.1.1中活化的单菌落接种于种瓶中,30℃,220rpm培养24h。
4.1.3摇瓶发酵:rg2培养基配制混匀分装45ml/瓶至500ml单挡板摇瓶(预装有1.5g碳酸钙)中,接种5ml以上的步骤4.1.2中的种子液至rg2摇瓶中,30℃,220rpm培养约48h-72h,直至葡萄糖耗尽。发酵液高速离心,取上清,稀释50倍,hplc检测精氨酸产量。
4.2高效液相色谱hplc测定精氨酸含量
4.2.1方法:使用opa柱前衍生氨基酸分析法来测定发酵液中l-精氨酸含量。一级氨基酸在巯基试剂存在下与邻苯二醛(opa)反应生成opa-氨基酸,生成的氨基酸衍生物经反相高效液相色谱分离后用紫外或荧光检测,在一定的范围内其吸光值与氨基酸浓度成正比。
4.2.2衍生剂和流动相配制
硼酸缓冲液:0.4m硼酸缓冲液,准确称取6.183g硼酸,溶于超纯水中,用10nnaoh溶液调至ph10.2,定容至250ml容量瓶中。
衍生剂:准确称取500mg邻苯二甲醛(opa)固体,加5ml无水乙醇,加500μl巯基丙酸,用0.4m、ph10.2的硼酸缓冲液定容至50ml。
流动相a:40mmnah2po4溶液,准确称取5.5gnah2po4·h2o,溶于超纯水,用10nnaoh溶液调至ph7.8,定容至1l,0.22μm滤膜过滤后备用。
流动相b:acn:meoh:h2o=45:45:10,定容1l备用,试剂纯度为hplc级。
4.2.3高效液相色谱测定条件:
色谱柱:zorbaxeclipse-aaa4.6x75mm,3.5μm;流速:1.2ml/min;停止时间:14min;柱温:40度;dad设置:uv338nm,10nm(带宽),参比390nm,20nm(带宽)。
洗脱程序如表2所示。
表2、hplc洗脱程序
自动进样器分别取0.5μl样品,2.5μl硼酸缓冲液,0.5μl衍生剂,32μl超纯水,混合衍生后进样,精氨酸出峰时间为7.9分钟。根据峰面积对比标样,即可得到样品中l-精氨酸含量。
4.3菌株发酵的l-精氨酸产量:
根据步骤4.1中的发酵方案和步骤4.2中的测定方法,比较各菌株的l-精氨酸发酵产量,每个菌株做3个平行实验,结果如表3所示。
表3、菌株发酵的l-精氨酸水平比较
由表3可见,基因突变菌株cibts1512的l-精氨酸生产能力比原始菌株atcc13032提高了至少13倍;基因工程菌株cibts3006比原始菌株atcc13032提高了至少14倍,验证了本发明的基因工程设计思想的正确性。基因工程菌株cibts3006的l-精氨酸产量比亲本菌株cibts1512提高了7.5%,验证了atp依赖的dna解旋酶第386位的缬氨酸(v)被甲硫氨酸(m)取代能进一步提高l-精氨酸生产菌的精氨酸积累,具有工业化应用前景。
序列表
<110>中国科学院上海生命科学研究院
<120>提高l-精氨酸菌株生产能力的方法
<130>shpi1810448
<160>14
<170>siposequencelisting1.0
<210>1
<211>59
<212>dna
<213>人工序列()
<400>1
acaatttcacacaggaaacagctatgacatgattacggacttcacaaccacaggttcgc59
<210>2
<211>54
<212>dna
<213>人工序列()
<400>2
gcgattaacaagccttgaactaggggcgctgtcttacctcggctggttggccag54
<210>3
<211>53
<212>dna
<213>人工序列()
<400>3
gtggctgctggccaaccagccgaggtaagacagcgcccctagttcaaggcttg53
<210>4
<211>59
<212>dna
<213>人工序列()
<400>4
agtgccaagcttgcatgcctgcaggtcgactctagagcacgagacggtcctcaaccatg59
<210>5
<211>59
<212>dna
<213>人工序列()
<400>5
acaatttcacacaggaaacagctatgacatgattacggtgacaatggtgcagctgctgc59
<210>6
<211>57
<212>dna
<213>人工序列()
<400>6
cacggtgcgcaagaagaccacgtcggcagcaaaaacagccttgagatcatcatccac57
<210>7
<211>57
<212>dna
<213>人工序列()
<400>7
gatgatgatctcaaggctgtttttgctgccgacgtggtcttcttgcgcaccgtgggc57
<210>8
<211>59
<212>dna
<213>人工序列()
<400>8
agtgccaagcttgcatgcctgcaggtcgactctagaggtggcccaacgcgttgactgcg59
<210>9
<211>51
<212>dna
<213>人工序列()
<400>9
aggaaacagctatgacatgattacgaattccgaaatgacgaagtggcggga51
<210>10
<211>49
<212>dna
<213>人工序列()
<400>10
ccttcccgaggctgcagcggctgcatcgtccgagtcggcgcatcgggcg49
<210>11
<211>47
<212>dna
<213>人工序列()
<400>11
tcgcccgatgcgccgactcggacgatgcagccgctgcagcctcggga47
<210>12
<211>51
<212>dna
<213>人工序列()
<400>12
gttgtaaaacgacggccagtgccaagcttaaccacagcttccggttcaatc51
<210>13
<211>3213
<212>dna
<213>corynebacteriumglutamicumatcc13032
<400>13
atgcgtaggatttctcctcgactgctctcccaatatttgggacaagagcatgcgccaact60
gatcagcaatctgcgatcattggatccgaacccggcccactgttggtagtggctggtgcc120
ggcgcaggaaaaacggagacgatggctgcacgagtggtgtggttggtagcgaacggattc180
gtcgccccagatcaagtgctgggtctgacatttaccaggaaggcggcgcaacagctgtcg240
cagcgcatccgaaagcgtttggagactcttgctggtgtgcctcgcctgaaagacattgat300
cccaccggccagttggagaaaaaccttcaggcgatcaccccaacggtatccacctatgac360
tcctatgcgggcacgttgattagagaatacggattgctgcttccagtagaaccttccgca420
aggttgatcacacaaacggagctttatcacatcgctcgcaacgtggtgaacaactacgac480
ggtgagctcaccgccacccaaacgccggccactgtcacggaatacctcctcaagctggta540
tccgaaatggacaaccacatggttaccgcagaggatatccgtgaggagtccgatccgttc600
attaagcttttcgacgaactccccaagggcaagggtcagcgcgacaacctcaacgccgaa660
atgacgaagtggcgggatacacaggtcgctcgcctccagtacttgcccctcgtgaaggct720
ttgaaagaggaactgcacaatcaggctgtggtgacgtttggtgagcagatgtctaaggca780
gctcatctcgcatcgacgcatcctcaggtgggctattcgcagaggcgacggttccgcgtt840
gtcatgcttgatgagtatcaggacaccagccactcgcagcgtgtgttgttgagcagtctt900
ttcggtggcaccgatcctggtctcactgttaatgctgtgggcgatccaatgcaggcgatt960
tatggttggcgaggtgcgacagcggcgaacttggagaatttcgttgacgatttccccgtc1020
atccatctcgatggaaaaacgagagcaccgaaaaacgagttgaccacaagttggcgaaac1080
ccaccagaagtcctcacccttgccaacgcagtttcgcgggaggtgcttgggtcgcccgat1140
gcgccgactcggacggtgcagccgctgcagcctcgggaaggcgcaccgaccggtgaagtg1200
tcgctcggatggtttggtacggcggcgcaggaacgtgagtttgtggctgatgagatggtg1260
aagcattggaatgcgcgggaggagaagggcacatttactgctgcggtgttggtgcgtaag1320
aagcgtcattcggcaccgatggcggaggagctgaccaagcgtggcatccccgtggagatc1380
gtcggactgtctggtttgttggatatccctgagattgccgatctaatttctctagcaact1440
atgctcgtgcgtcctcacgataatcgggctgcgttgcgtattttggcgggcccgcatgtg1500
ggtttgggtgtggcggatttgcagcggttgcagggtcgtgcgcgcaatattgcgggtcgt1560
gtgtctcgtgagcgtcgagagaagaacccagatccattagcggagcttgatgcgattatt1620
gaggaagcgactgcgattgaaccggaagctgtggttggtctagctgatgcggttgccgat1680
ttgggtgagggcgatcgtttcagcgaggaggggttgagtcgtttgaagcgactggccact1740
cagttgcgatatttgcgtaagtacagcttgggtcgttcggtggcggacatttttgctgat1800
attgaaactgtgttcaatattcgcacggaggtgttgtcgaggcaggatcctcacgccgat1860
ggtgctgctggaacggtgcatttggataagttcgcagaagaggtcgcaagtcacggtggc1920
attgggctgcctgagctgttggactattttgagctcgcgaaggatcaggaagagggcctt1980
gagccgggtgaggtgacggttcgcagcgatcgtgtgcagatccttactgtccacaaggct2040
aagggtttggagtgggatatcgtttcggtgttgcatgccgatgcgtcgacctatgatgcg2100
aaggcttcgacgtggttgaaaaatgtcacgatgatcccgtcgtcgcttcgtggcgatgcc2160
gggaccggcgccccagagatggatacctctgaggcggacgatcgcaaagctctggaagat2220
tccggcaaggagtacaccagtgaagtgcgtgaggggttacgggaggaaaattcgcgactg2280
ttttatgtcggtatcacgcgcagcgaacgggtgttgctcgtgacgggttcggcgcttgat2340
gaaagtggcacaaaggcgaaagttccctacggccacttggagatccttcgggataaagcg2400
ccggagtgcgtggtgtcgtggtgggaaggggaagagggggacgtcgaaaagcaaaaacct2460
gcggaaggcgtcttcccgcaactgctcgccgctgactcctccggcgcggatttggtgcgc2520
ggcccgcgcgccgagccaaacaacgagggcgggctggaaagcttgtgggaaaaagaggta2580
agcgcgcttatcgacgaacaccgccgcctttccaaccccatcgtcgaagtcgaaacgccc2640
cgcgaactcacggccaccgacctcgtctctatgaaaaacaatcccgaacagttcgcccga2700
cgaatgcgtcgccctgtcccgttcaaaccaaacacctacgcaaaacgcggcacactgttc2760
caccaatggctcgaagatcggtttggcagcaccgcgcttctcgacgaaaccgagctcccc2820
ggcatcgacgaggactactcggatgacgcattcatcgaactccgcgacgcgttcctagga2880
tctacttgggaaaaccgcacaccggaattcgtcgaacatcccttcgaagtaacgatcggc2940
gaacacgtcatccgcggccgcatggacgccgtcttccacaccgatggcacctggatggtg3000
gtcgactggaaaaccggacgcaccccaaccggccccgaaatggacgcagcgatcatccag3060
ctcgctgtctatagactcgcctgggcacgactcaaaggcctcgaacctgaagaagtccgc3120
gcagcattccattacgtcgcccacgatcacacctttgagccgaacgatctgccgactcaa3180
gaagaactagcccggctgctcagtcaggaatga3213
<210>14
<211>3213
<212>dna
<213>人工序列()
<400>14
atgcgtaggatttctcctcgactgctctcccaatatttgggacaagagcatgcgccaact60
gatcagcaatctgcgatcattggatccgaacccggcccactgttggtagtggctggtgcc120
ggcgcaggaaaaacggagacgatggctgcacgagtggtgtggttggtagcgaacggattc180
gtcgccccagatcaagtgctgggtctgacatttaccaggaaggcggcgcaacagctgtcg240
cagcgcatccgaaagcgtttggagactcttgctggtgtgcctcgcctgaaagacattgat300
cccaccggccagttggagaaaaaccttcaggcgatcaccccaacggtatccacctatgac360
tcctatgcgggcacgttgattagagaatacggattgctgcttccagtagaaccttccgca420
aggttgatcacacaaacggagctttatcacatcgctcgcaacgtggtgaacaactacgac480
ggtgagctcaccgccacccaaacgccggccactgtcacggaatacctcctcaagctggta540
tccgaaatggacaaccacatggttaccgcagaggatatccgtgaggagtccgatccgttc600
attaagcttttcgacgaactccccaagggcaagggtcagcgcgacaacctcaacgccgaa660
atgacgaagtggcgggatacacaggtcgctcgcctccagtacttgcccctcgtgaaggct720
ttgaaagaggaactgcacaatcaggctgtggtgacgtttggtgagcagatgtctaaggca780
gctcatctcgcatcgacgcatcctcaggtgggctattcgcagaggcgacggttccgcgtt840
gtcatgcttgatgagtatcaggacaccagccactcgcagcgtgtgttgttgagcagtctt900
ttcggtggcaccgatcctggtctcactgttaatgctgtgggcgatccaatgcaggcgatt960
tatggttggcgaggtgcgacagcggcgaacttggagaatttcgttgacgatttccccgtc1020
atccatctcgatggaaaaacgagagcaccgaaaaacgagttgaccacaagttggcgaaac1080
ccaccagaagtcctcacccttgccaacgcagtttcgcgggaggtgcttgggtcgcccgat1140
gcgccgactcggacgatgcagccgctgcagcctcgggaaggcgcaccgaccggtgaagtg1200
tcgctcggatggtttggtacggcggcgcaggaacgtgagtttgtggctgatgagatggtg1260
aagcattggaatgcgcgggaggagaagggcacatttactgctgcggtgttggtgcgtaag1320
aagcgtcattcggcaccgatggcggaggagctgaccaagcgtggcatccccgtggagatc1380
gtcggactgtctggtttgttggatatccctgagattgccgatctaatttctctagcaact1440
atgctcgtgcgtcctcacgataatcgggctgcgttgcgtattttggcgggcccgcatgtg1500
ggtttgggtgtggcggatttgcagcggttgcagggtcgtgcgcgcaatattgcgggtcgt1560
gtgtctcgtgagcgtcgagagaagaacccagatccattagcggagcttgatgcgattatt1620
gaggaagcgactgcgattgaaccggaagctgtggttggtctagctgatgcggttgccgat1680
ttgggtgagggcgatcgtttcagcgaggaggggttgagtcgtttgaagcgactggccact1740
cagttgcgatatttgcgtaagtacagcttgggtcgttcggtggcggacatttttgctgat1800
attgaaactgtgttcaatattcgcacggaggtgttgtcgaggcaggatcctcacgccgat1860
ggtgctgctggaacggtgcatttggataagttcgcagaagaggtcgcaagtcacggtggc1920
attgggctgcctgagctgttggactattttgagctcgcgaaggatcaggaagagggcctt1980
gagccgggtgaggtgacggttcgcagcgatcgtgtgcagatccttactgtccacaaggct2040
aagggtttggagtgggatatcgtttcggtgttgcatgccgatgcgtcgacctatgatgcg2100
aaggcttcgacgtggttgaaaaatgtcacgatgatcccgtcgtcgcttcgtggcgatgcc2160
gggaccggcgccccagagatggatacctctgaggcggacgatcgcaaagctctggaagat2220
tccggcaaggagtacaccagtgaagtgcgtgaggggttacgggaggaaaattcgcgactg2280
ttttatgtcggtatcacgcgcagcgaacgggtgttgctcgtgacgggttcggcgcttgat2340
gaaagtggcacaaaggcgaaagttccctacggccacttggagatccttcgggataaagcg2400
ccggagtgcgtggtgtcgtggtgggaaggggaagagggggacgtcgaaaagcaaaaacct2460
gcggaaggcgtcttcccgcaactgctcgccgctgactcctccggcgcggatttggtgcgc2520
ggcccgcgcgccgagccaaacaacgagggcgggctggaaagcttgtgggaaaaagaggta2580
agcgcgcttatcgacgaacaccgccgcctttccaaccccatcgtcgaagtcgaaacgccc2640
cgcgaactcacggccaccgacctcgtctctatgaaaaacaatcccgaacagttcgcccga2700
cgaatgcgtcgccctgtcccgttcaaaccaaacacctacgcaaaacgcggcacactgttc2760
caccaatggctcgaagatcggtttggcagcaccgcgcttctcgacgaaaccgagctcccc2820
ggcatcgacgaggactactcggatgacgcattcatcgaactccgcgacgcgttcctagga2880
tctacttgggaaaaccgcacaccggaattcgtcgaacatcccttcgaagtaacgatcggc2940
gaacacgtcatccgcggccgcatggacgccgtcttccacaccgatggcacctggatggtg3000
gtcgactggaaaaccggacgcaccccaaccggccccgaaatggacgcagcgatcatccag3060
ctcgctgtctatagactcgcctgggcacgactcaaaggcctcgaacctgaagaagtccgc3120
gcagcattccattacgtcgcccacgatcacacctttgagccgaacgatctgccgactcaa3180
gaagaactagcccggctgctcagtcaggaatga3213
- 还没有人留言评论。精彩留言会获得点赞!