一种细菌移植入消化道后对其活性进行评价的方法与流程
本发明涉及一种细菌移植入消化道后对其活性进行评价的方法,尤其是涉及采用双重标记对移植入消化道的细菌的活性进行评价的方法。
背景技术
针对外源的细菌植入宿主肠道后的追踪问题,可以采取在体外培养特定细菌时进行非天然糖代谢标记、偶联荧光基团并使用的方法再将其通过灌胃等方式植入宿主体内,使用其带有的荧光基团进行示踪,如文献naturemedicine.21,1091–1100(2015)。另外,也有报道也可以通过使用非天然糖或者非天然的d-型氨基酸(丙氨酸)对宿主进行灌胃的方式对其体内的肠道菌群进行代谢标记,如文献biochemistry.56,3889-3893(2017)和nat.microbiol.2,17099(2017)。d-型丙氨酸是在细菌肽聚糖(peptidoglycan)中的五肽结构末端高度保守的一种特殊氨基酸,细菌在肽聚糖的合成和代谢过程中会在这一位置通过青霉素结合蛋白(penicillinbindingproteinspbps)中的转肽酶结构域进行肽段交联(与邻近的肽段)、水解(去掉最末端的d-丙氨酸)、替换(与周围环境中的其他d-aminoacid,daa)等修饰。之前人们发现,某些青霉素结合蛋白对d-型丙氨酸侧链上带有的修饰基团有很高的容忍性,人们利用这一特点,将侧链上带有各种荧光基团的daa探针通过代谢标记的方式标记到各种细菌的细胞壁肽聚糖结构上。由于在哺乳动物细胞中不存在细胞壁结构,因此保证了daa探针对细菌的高选择性,且由于肽聚糖的高周转(turnover)速率,导致daa探针的标记非常迅速,且能实现很高的标记强度。
目前存在的可以对细菌移植后的菌株存活情况进行评价的方法,是通过对移植前后的粪便样品进行深度的细菌dna测序并结合复杂的生物信息学分析以得到移植菌是否存活的信息,如文献microbiome.5,50(2017)、cellhostµbe.23,229–240(2018)、science.352,586-589(2016)和专利cn20148004928x。
对菌群移植后的植入菌追踪与活性评价问题,一直以来缺乏有效的研究手段,直到2016年才有了首次报道,通过粪便样品深度16srna测序并结合生物信息学手段分析可以区分出菌株是来自植入菌还是原有菌群,如文献science.352,586-589(2016)。但存在测序技术复杂、成本高、数据分析难度大等问题。对益生菌的活性评价这一问题,现有方法只能通过对动物模型或者人体实验后的粪便进行传统的细菌培养计数法,或应用分子生物学的手段如16srrna测序、荧光原位杂交等方法进行分析。其中,培养计数法无法对难以培养的细菌进行分析;基于核酸的检测方法无法区分死细菌与活细菌,因此对植入菌的活性状况尚无法进行准确评估。
技术实现要素:
基于目前上述的问题,本发明提供了通过双重标记对移植入消化道的细菌的活性进行评价的方法。
本发明一方面涉及移植入消化道的细菌的活性评价方法,其包括,将移植前的植入菌带有a基团标记物;移植入消化道内一段时间之后,利用b基团标记物体内代谢标记接受植入菌后的受体肠道菌群,以检测同时带有a基团标记和b基团标记的细菌,和仅带有a基团标记和b基团标记的其中一个的细菌。
另一方面,如上的方法包括分析菌群同时带有a基团标记和b基团标记和仅带有a基团标记或b基团标记的菌体比例,进一步地,包括分离同时带有a基团标记和b基团标记的菌体,通过16sdna测序得到其种属信息和种属比例。
本发明还涉及用于评价移植入消化道的细菌活性的试剂盒,其包含标记植入菌的a基团标记物和b基团的标记物,和/或辅剂、稀释液、缓冲液或载体。
附图说明
根据如下详细说明并结合附图,能够更好理解本发明的所公开的如权利要求书中描述的方法或其他方面、特征和优点,其中:
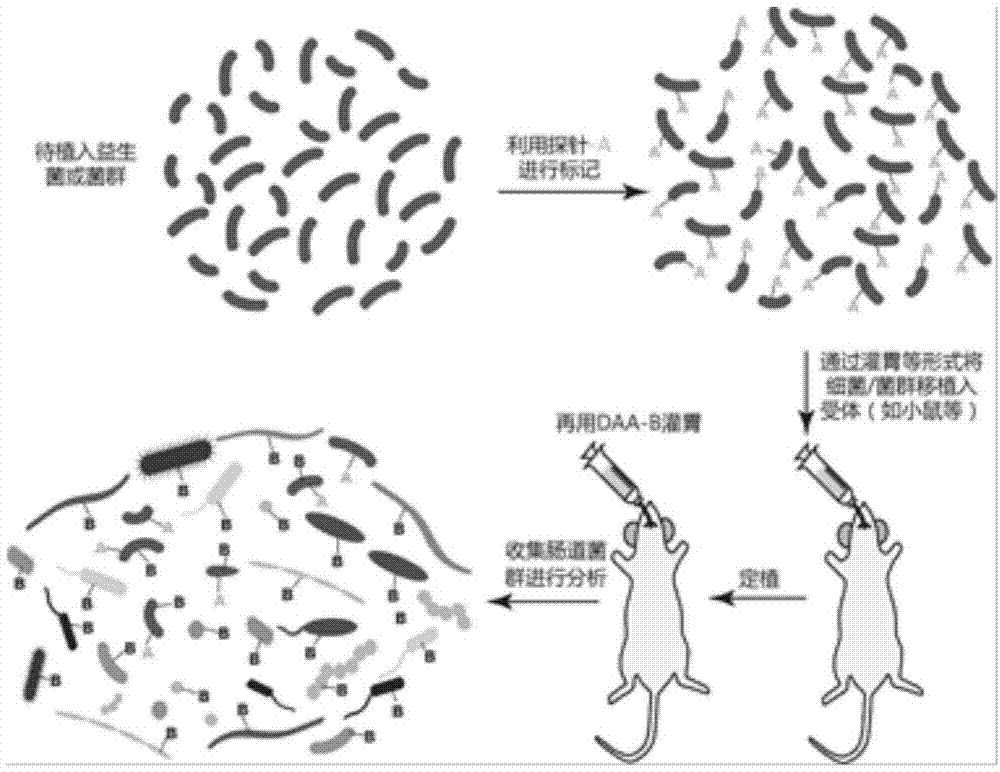
图1是本发明的实施方式中粪便移植后植入菌活性评价的流程示意图;
图2是本发明的实施方式中部分非天然糖分子探针的结构示意图;
图3是本发明的实施方式中带有荧光基团或生物正交基团的d-型氨基氨酸结构示意图;
图4是本发明的实施方式中植入菌经daa-tamra荧光标记后的显微观察图;
图5是本发明的此实施方式中植入菌经移植入消化道后daa-cy5荧光标记后的显微观察图;
图6是本发明的此实施方式中流式细胞仪分析荧光标记的植入菌并分离双重荧光标记的植入菌;
图7是本发明的此实施方式中对分离后的双重荧光标记的植入菌进行16srdna测序分析图谱。
具体实施方式
参考如下详细说明和示例性实施方式,应该理解的是,本申请不限于说明书阐述或附图所示的细节或方法。
参考图1所示,本发明涉及的移植入消化道内的细菌的活性评价方法中,在植入菌植入前的培养过程中(如体内或体外培养),加入a基团标记物(或称为第一基团标记物)以使得培养后并且具有活性的植入菌带有a基团标记;随后将植入菌移植到宿主消化道内(如通过灌胃),定植一段时间之后(如6-12h),利用带有b基团的标记物(或称为第二基团标记物)体内代谢标记处理接受植入菌后的受体肠道菌群,例如采用对受体宿主进行灌胃处理,此时能够在受体宿主消化道内存活的植入菌会同时带有a基团标记和b基团标记,仅带有a基团标记的细菌为未能在受体消化道内存活的植入菌,仅带有b基团标记的细菌为受体消化道内原有细菌。
a基团标记物可以是但不限于非天然探针分子,进一步可以为荧光基团探针或生物正交反应(基团)标记物,例如某些实施方式中,a基团标记物可以为非天然糖分子探针(部分探针结构如图2所示,但不限于图中所示)、带有荧光基团或生物正交基团的d-型氨基酸(结构式如图3所示),或标记活细菌的荧光染料,例如calceinam或者fluoresceindiacetate,以及其他具有标记功能的荧光染料或色素染料。
b基团标记物可以采用荧光探针,优选地采用带有荧光基团或生物正交基团的d-型氨基酸探针,如daa-cy5探针、daa-tamra探针等。
本发明还涉及用于评价移植入消化道的细菌活性的试剂盒,其包含的a基团标记物(或称为第一基团标记物)和b基团标记物(或称为第二基团标记物)可以采用如上所述的评价方法中相同的标记物和/或辅剂,例如a基团标记物采用非天然糖分子探针、带有荧光基团或生物正交基团的d-型氨基酸等,b基因标记物可以采用带有荧光基团或生物正交基团的d-型氨基酸探针,如daa-cy5探针或daa-tamra探针等,以及可以进一步包括辅剂、稀释液、缓冲液或载体等。
本发明中所涉及的植入菌可以为粪便移植中的肠道菌群或某些固定菌株的组合,也可以为临床中应用为微生物制剂(如妈咪爱、丽珠肠乐等),也可以为发酵食品中的发酵菌(如如酸奶等发酵乳制品中的各类细菌)或者用于以上细菌植入情形的某一细菌种或基因改造后的细菌以及上述所述菌群、菌株或制剂的组合。
本发明申请中使用的术语“a基团标记”、“a基团标记物”、“b基团标记”、“b基团标记物”旨在说明如上方法采用不同类型和种类或两者之间能够显微\荧光激发的情况下区分的基团标记物或标记,这也被本领域技术人员能够所接受或理解的含义。
在一个具体实施方式中,显示为图1所示的针对粪便移植后的植入菌的活性的评价,其通过灌胃daa-amide-tamra(0.1-1mm,2x3h,amide为羧基端带有酰胺保护的探针,结构如图3所示)探针的方式,如图4所示,图示中daa-amide-trmra为荧光标记显微观察图,dic表示微干涉相差显微观察图,merge表示两者重叠图,显然地,供体小鼠的肠道菌群基本都能带有较强的荧光标记,能够实现对大约85%的肠道菌群进行高强度的代谢标记。在无氧环境下分离菌群并用无菌生理盐水洗两次后,将菌群通过灌胃的方式移植给另一只小鼠,待定植6-12h后,再利用daa-cy5(0.1-1mm,2x3h)探针进行灌胃。后取其结肠菌群,洗后使用荧光显微镜观察,如图5所示,图示中trmra为采用如上荧光标记显微观察图,cy5表示采用daa-cy5荧光标记显微观察图,dic表示微干涉相差显微观察图,merge表示两者重叠图,可见两种颜色的标记在不同的细菌上有明显的不同,可发现同时带有两种颜色的细菌以及仅带有其中一种荧光的细菌,其中同时含有两种颜色标记的细菌,即为能够在受体内存活的植入菌群。然后用流式细胞仪进行分析并将双色标记(cy5和trmra)的菌群进行分选,如图6所示,可见在受体肠道菌群中约有8%(显示为8.6%)的菌群存活的植入菌。分选后得到的细菌进行16srdna测序分析,图7中所示的测序分析图谱中,相比分选前的总样品(显示为total),分选后的菌群(显示为facs)主要由某些梭菌属(clostridium)的细菌组成,即此部分能够在移植中存活的细菌多为梭菌属,表明粪菌移植后的作用效果可能由某少部分真正能够存活的细菌所导致。
在另外具体实施方式中,针对移植后的酸奶中的益生菌的活性的评价,将双歧杆菌、保加利亚乳杆菌、嗜热链球菌、嗜酸乳杆菌、干酪乳杆菌、发酵乳杆菌、植物乳杆菌七种食用菌的酸奶发酵菌粉(30mg)加入到5ml巴氏灭菌的鲜牛奶中,再在其中加入终浓度为0.05-1mm的daa-tamra探针。在40摄氏度下培养7小时后(缓慢搅动),慢速离心(400xg,3min),取上清,再在无氧条件下用pbs洗pellet,慢速离心,取上清,重复一次后,将三次的上清液合并,并离心(13000xg,10min)沉淀后,再用pbs洗一次,重悬后通过灌胃植入到小鼠消化道内。待定植6-12h后,再利用daa-cy5(0.1-1mm,2x3h)探针进行灌胃。后取其结肠菌群,洗后使用荧光显微镜观察并用流式细胞仪进行分析分选,并对分选后的细菌进行测序分析,可得知来自酸奶的哪些类型的细菌可以在受体肠道内存活。
在另外实施方式中,针对目前药用益生菌经胃给药后的活性评价,此实施方式中,药用益生菌在临床应用广泛并且多为otc,例如目前上市的妈咪爱(枯草杆菌二联活菌颗粒),适怡(酪酸梭菌肠球菌三联活菌片)等。将这类冻干菌粉在合适的培养温度下培养复苏,在培养复苏的过程中,加入0.05-1mm的daa探针,或者其他实施方式中在培养复苏后加入(5-100μm)的calceinam染料。用pbs洗两次后,重悬,通过灌胃植入到小鼠消化道内。待定植6-12h后,再利用daa-cy5(0.1-1mm,2x3h)探针进行灌胃。后取其结肠菌群,洗后使用荧光显微镜观察并用流式细胞仪进行分析分选,并对分选后的细菌进行测序分析,即可得知来自益生菌药物中的哪些类型的细菌可以在受体肠道内存活。
在发明的其他实施方式中,可以针对单株细菌(或基因改造均)在经胃途径后的存活情况的评价,此单株细菌可以为但不限于植物乳杆菌,干酪乳杆菌,副干酪乳杆菌,瑞士乳杆菌,嗜酸乳杆菌,保加利亚乳杆菌,鼠李糖乳杆菌,发酵乳杆菌,罗伊氏乳杆菌,短乳杆菌,短双歧杆菌,长双歧杆菌,乳酸乳球菌,嗜热链球菌,屎肠球菌,枯草芽孢杆菌,地衣芽孢杆菌,蜡样芽孢杆菌,凝结芽胞杆菌,酪酸梭菌,以及上述细菌种类的相应基因改造菌株。在这些细菌的体外培养时,在培养基中加入一定浓度(50μm-1mm)的daa探针,待收集到一定数量的细菌后,用无菌生理盐水洗两次并重悬至一定浓度,将一定数量的标记后细菌通过灌胃的方式移植给另一只小鼠,待定植6-12h后,再利用daa-cy5(0.1-1mm,2x3h)探针进行灌胃。后取其结肠菌群,洗后使用荧光显微镜观察并用流式细胞仪进行分析,即可得知每一种细菌在受体肠道内存活的比例情况。
本发明涉及的相关技术内容,与现有的依靠深度测序来研究植入菌在宿主体内存活定植情况的方法比较,无需昂贵的测序及复杂的生物信息分析就能够快速准确地对植入菌的存活情况进行分析,并且应用于对各类待移植菌的体内存活能力进行评估筛选。
本发明虽然已以较佳实施例公开如上,但其并不是用来限定本发明,任何本领域技术人员在不脱离本发明的精神和范围内,都可以利用上述揭示的方法和技术内容对本发明技术方案做出可能的变动和修改,因此,凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化及修饰,均属于本发明技术方案的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!