一种肿瘤放射治疗增敏聚合物及其制备方法、胶束纳米粒子及其应用与流程
本发明属于高分子合成技术领域,尤其涉及一种肿瘤放射治疗增敏聚合物及其制备方法、胶束纳米粒子及其应用。
背景技术
放疗已被广泛用作癌症的主要治疗方法之一,电离辐射方法杀死癌细胞的机制是通过辐射粒子与一系列生物分子,如dna的相互作用来杀死癌细胞。在放疗增敏方面,氧气分子可以作为一种有效的化学放射增敏剂,用来增加放疗效果,在整个放疗过程中,起着非常重要的作用。然而,体积较大的肿瘤组织中的缺氧微环境限制了放射治疗的最终疗效,导致放疗效果减弱。除了通过改善低氧肿瘤中氧的浓度策略来调节肿瘤微环境外,放射增敏剂也经常用于增强肿瘤组织对放射治疗的放射敏感性。开发高效放射增敏剂,一直是有效改善放射疗效的最重要方法之一。
一般而言,放射增敏剂可以分为两类:一是通过高z纳米粒子吸收辐射并将能量沉积在肿瘤内,最终达到增强辐射强度的作用;二是小分子化合物,通过抑制内源放射保护性物质,辐射分解产生的细胞毒性化合物来抑制细胞修复(细胞dna中的胸腺嘧啶结构),模拟氧气的亲电子作用等机理杀死肿瘤细胞。在临床应用中,由于长期毒性问题,不使用高z纳米颗粒。在小分子化学放射敏感剂中,电子亲和性的化合物最具前景,因为通过选择性地与固定辐射后dna损伤的dna自由基反应形成较高的生物安全性,例如,尼莫拉唑和甘氨双唑钠,其已被批准用于临床应用。然而,由于生物利用度有限,特别是在肿瘤组织的乏氧区域,小分子的治疗效率仍然需要改善。
具有肿瘤放疗增敏活性的小分子放疗增敏剂有很多种,但是目前获得临床应用的却很少。目前在临床中获得应用或者在临床实验阶段的,主要是硝基咪唑类化合物,它们可以将放射治疗时射线对肿瘤乏氧细胞造成的dna损伤固定并抑制其dna的修复。其中,2-硝基咪唑类化合物虽然增敏活性较高,但是也具有较高的神经毒性,因而未能获得广泛应用。5-硝基咪唑类化合物也被证明具有较好放射增敏的性能,并且目前唯一获得临床批准的,作为肿瘤放疗增敏剂的甘氨双唑钠已经上市销售,它可以提高实体肿瘤组织内乏氧细胞对射线的敏感性且对正常组织无明显影响。但是甘氨双唑钠在水溶液中的稳定性极差,而且在肿瘤组织中的富集效果不理想。这些缺陷将导致甘氨双唑钠进入机体后,在短时间内就被代谢完全。这些缺点限制了其广泛应用。目前,纳米载体的化学放射疗法近年来引起了高度重视。优化的纳米载体通过被动或主动靶向促进药物递送到肿瘤组织中,实现在肿瘤部位富集,增强放射治疗的疗效。制备高生物相容性的两亲性嵌段聚合物放疗增敏剂,在水溶液中自组装得到胶束纳米粒子,静脉注射后可延长血液循环,增加肿瘤富集,该方法为更加高效的肿瘤发射治疗提供了可能。
技术实现要素:
有鉴于此,本发明的目的在于提供一种肿瘤放射治疗增敏聚合物及其制备方法、胶束纳米粒子及其应用,该聚合物具有优异的增敏效果。
本发明提供了一种肿瘤放射治疗增敏聚合物,具有式i结构:
式i中,40≤m≤226;30≤n≤100;0.2≤x≤1;0≤y≤0.8。
优选地,所述60≤m≤150;45≤n≤80;0.5≤x≤0.8;0.2≤y≤0.5。
优选地,所述m=113,x=0.64,y=0.36,n=50。
本发明提供了一种上述技术方案所述肿瘤放射治疗增敏聚合物的制备方法,包括以下步骤:
将聚乙二醇-b-聚谷氨酸与甲硝唑,在缩合剂作用下,进行酯化反应,得到具有式i结构的聚乙二醇-b-(聚谷氨酸-g-甲硝唑)嵌段聚合物:
式i中,40≤m≤226;30≤n≤100;0.2≤x≤1;0≤y≤0.8。
优选地,所述酯化反应的温度为45~55℃;酯化反应的时间为90~100h。
优选地,所述聚乙二醇-b-聚谷氨酸和甲硝唑的物质的量比为0.018~0.022:1。
本发明提供了一种胶束纳米粒子,由上述技术方案或上述技术方案所述制备方法制备的肿瘤放射治疗增敏聚合物在水溶液中自组装,得到胶束纳米粒子。
优选地,所述肿瘤放射治疗增敏聚合物的临界胶束浓度为8.8×10-3mg/ml。
本发明提供了一种上述技术方案所述胶束纳米粒子作为肿瘤放疗增敏剂的应用。
本发明提供了一种肿瘤放射治疗增敏聚合物,具有式i结构。该聚合物为甲硝唑接枝的聚乙二醇-b-聚谷氨酸,其在水溶液中自组装成胶束纳米粒子,表面是亲水性的聚乙二醇结构,纳米粒子作为肿瘤放疗增敏剂的应用时具有较好的增敏效果。该聚合物的生物安全性较高,具有很大的临床应用潜力。实验结果表明:胶束纳米粒子的平均粒径为55nm,该尺寸便于纳米粒子在肿瘤组织部位富集;聚合物的半波电势为-0.475mv;胶束纳米粒子的增敏比为2.18;21天后,纳米粒子照射组(hms)的肿瘤相比于照射之前,其体积大小明显缩小(降低至原来的75%)。
附图说明
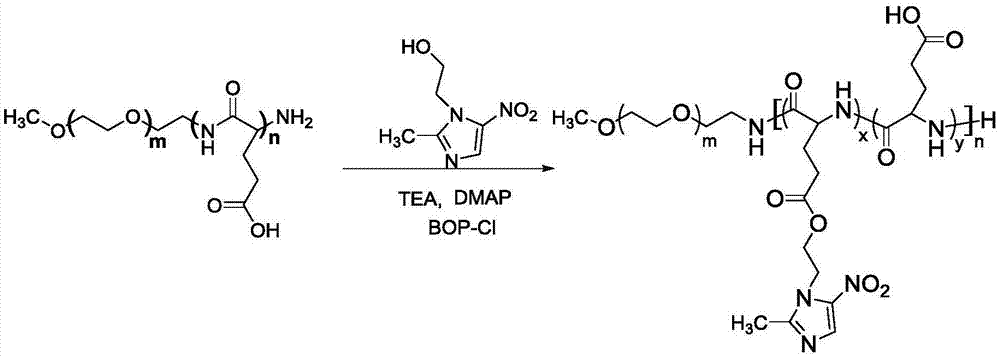
图1为本发明嵌段聚合物聚乙二醇-b-聚(谷氨酸-g-甲硝唑)的合成路线图;
图2为本发明实施例3制备的嵌段聚合物聚乙二醇113-b-聚(谷氨酸0.36-g-甲硝唑0.64)50的1hnmr谱图;
图3为本发明实施例3制备的聚合物浓度对激发光光谱中波长在339nm和332nm处的强度的比值作图;
图4为本发明实施例3制备的纳米胶束粒子的动态光散射表征图;
图5为聚合物粒子与小分子抗癌药物阿霉素在小鼠体内长时间循环表征图;
图6为聚合物粒子在小鼠体72h内随时间变化的富集表征图;
图7为本发明实施例3制备的聚乙二醇-b-聚(谷氨酸-g-甲硝唑)、甘氨双唑钠、甲硝唑的半波电位(e1/2)表征图;
图8为聚乙二醇-b-聚(谷氨酸-g-甲硝唑)嵌段聚合物纳米粒子(hms),甘氨双唑钠(gs)和甲硝唑(mn)在无、有辐射剂量(4gy)条件下对小鼠乳腺癌4t1细胞的毒性评价;
图9为磷酸盐缓冲溶液(pbs),聚乙二醇-b-聚(谷氨酸-g-甲硝唑)嵌段聚合物纳米粒子(hms),甘氨双唑钠(gs)和甲硝唑(mn)在乏氧和常氧条件下,细胞存活分数对电子束辐射剂量依赖性表征图;
图10为磷酸盐缓冲溶液(pbs)组、聚乙二醇-b-聚(谷氨酸-g-甲硝唑)(hms)聚合物组以及小分子增敏剂甘氨双唑钠(gs)和甲硝唑(mn)组对小鼠乳腺癌4t1细胞彗星试验图;
图11为磷酸盐缓冲溶液(pbs),聚乙二醇-b-聚(谷氨酸-g-甲硝唑)嵌段聚合物纳米粒子(hms),甘氨双唑钠(gs)和甲硝唑(mn)h22肿瘤生长曲线图;
图12为治疗后第21天时,切下的肿瘤的照片。
具体实施方式
本发明提供了一种肿瘤放射治疗增敏聚合物,具有式i结构:
式i中,40≤m≤226;30≤n≤100;0.2≤x≤1;0≤y≤0.8。
在本发明中,所述m为聚合度,40≤m≤226;优选地,60≤m≤150。
所述n为聚合度,30≤n≤100;优选地,45≤n≤80。
所述x为与甲硝唑(mn)反应的plg的数目,0.2≤x≤1;优选地,0.5≤x≤0.8。
所述y为未与甲硝唑(mn)反应的plg的数目,0≤y≤0.8;优选地,0.2≤y≤0.5。
在本发明具体实施例中,所述肿瘤放射治疗增敏聚合物具体为聚乙二醇113-b-聚(谷氨酸0.36-g-甲硝唑0.64)50;即m=113,x=0.64,y=0.36,n=50。
本发明提供了一种上述技术方案所述肿瘤放射治疗增敏聚合物的制备方法,包括以下步骤:
将聚乙二醇-b-聚谷氨酸与甲硝唑,在缩合剂作用下,进行酯化反应,得到具有式i结构的聚乙二醇-b-聚(谷氨酸-g-甲硝唑)嵌段聚合物。
参见图1,图1为本发明嵌段聚合物聚乙二醇-b-聚(谷氨酸-g-甲硝唑)的合成路线图。
聚乙二醇-b-聚(谷氨酸-g-甲硝唑)嵌段聚合物为甲硝唑接枝到聚乙二醇-b-聚谷氨酸的产物,其接枝率通过调节反应体系中嵌段聚合物和甲硝唑的比例来调节;在本发明具体实施例中,所述接枝效率为40%、64%和80%的嵌段聚合物。
本发明优选在4-二甲胺基吡啶、无水三乙胺的存在下进行酯化反应。本发明优选以n-甲基吡咯烷酮为溶剂进行酯化反应。在本发明中,所述缩合剂优选选自双(2-氧代-3-恶唑烷基)次磷酰氯;所述缩合剂和甲硝唑的物质的量比优选为1:0.99~1.05。
在本发明中,所述酯化反应的温度优选为45~55℃,更优选为48~52℃;在具体实施例中,酯化反应的温度为50℃。酯化反应的时间优选为90~100h,更优选为92~98h;在具体实施例中,酯化反应的时间为96h。
在本发明中,所述聚乙二醇-b-聚谷氨酸和甲硝唑的物质的量比优选为0.018~0.022:1,更优选为0.019~0.021:1;在具体实施例中,所述聚乙二醇-b-聚谷氨酸和甲硝唑的物质的量比为0.02:1。
本发明提供了一种胶束纳米粒子,由上述技术方案或上述技术方案所述制备方法制备的肿瘤放射治疗增敏聚合物在水溶液中自组装,得到胶束纳米粒子。
本发明通过嵌段聚合物聚乙二醇-b-聚(谷氨酸-g-甲硝唑)在水溶液中进行自组装,可以得到以聚乙二醇为亲水壳层,以聚(谷氨酸-g-甲硝唑)为疏水核心的两亲性嵌段聚合物胶束纳米粒子。
本发明优选将聚乙二醇-b-聚(谷氨酸-g-甲硝唑)溶解在二甲亚砜溶液中,然后迅速加入水中形成稳定的纳米粒子,最后将其中的二甲亚砜溶剂通过在水中透析的方法除去,得到纳米胶束粒子。
在本发明中,所述肿瘤放射治疗增敏聚合物的临界胶束浓度为8.8×10-3mg/ml。
本发明还提供了一种上述技术方案所述胶束纳米粒子作为肿瘤放疗增敏剂的应用。
本发明采用以下测试方法对聚乙二醇-b-(聚谷氨酸-g-甲硝唑)嵌段聚合物进行性能测试:
a、循环伏安法测量还原电位(e1/2)
将小分子化合物与聚合物(gs,mn,pegm-b-p(lgx-g-mny)n)在二甲亚砜溶液(5ml)中以0.002mol/l(mn当量浓度)进行循环伏安测量还原电位,其中,使用bu4npf6(0.2m)作为支持电解质,ag/agcl作为参比电极,以及铂工作电极和辅助电极,并且使用100mv/s的扫描速率。由于配合物对空气和水分的敏感性,在手套箱中称出样品,将其在氮气保护下置于电化学池中,然后溶解。在实验的时间范围内,没有观察到降解并且溶液保持透明。
b、细胞毒性实验
将4t1细胞以1×104细胞/孔的密度接种在96孔板中,4t1细胞在含有10%的胎牛血清的培养基中培养(温度37℃,5%的co2)。在培养24小时后,换新鲜培养基,加入聚乙二醇-b-(聚谷氨酸-g-甲硝唑)嵌段聚合物纳米粒子(hms),甘氨双唑钠(gs)和甲硝唑(mn),上述浓度以mn当量浓度(30,60,90,120,150和180μg/ml)。以有氧和乏氧两种状态下进行,乏氧环境是通过安宁包(anaeropack-anaero(mitsubishigaschemicalcompany,inc.))产生,随后,以4gy的剂量进行x射线辐射,并将细胞再温育36小时,通过mtt法测定。
c、彗星实验:
细胞的dna损伤情况可以使用彗星实验的方法来测定。首先是将4t1细胞接种在6孔培养皿中,密度为1×105个/孔。培养12h后将培养皿放入装有安宁包的厌氧袋中(模拟乏氧环境),放回培养箱继续培养24h,然后吸走孔中培养基,换成甲硝唑当量浓度为180μg/ml的胶束-dmem溶液、甲硝唑-dmem溶液和甘氨双唑钠-dmem溶液并培养24h。然后细胞接受x射线照射,剂量为4gy。细胞用磷酸盐缓冲溶液洗两次,离心收集细胞,加入磷酸盐缓冲溶液重悬细胞,密度为1×106个/ml。
将正常熔点的琼脂糖铺在载玻片上,然后用盖玻片盖好使琼脂糖铺平。将20μl细胞悬浮液与100μl0.5%低熔点琼脂糖混匀然后铺在第一层琼脂糖表面并用盖玻片压平。待其固化后将整个载玻片放入准备好的细胞裂解液(含有10%二甲基亚砜)中3h,保持温度在4℃。将载玻片取出,用磷酸盐缓冲溶液洗净残留的细胞裂解液,然后浸入碱性电泳缓冲液(1mmol/ledta,300mmol/lnaoh)中,保持30-60min以便使得dna在碱性条件发生变性或者解螺旋。接下来进行单细胞电泳,电压设置为25v,电流为200ma,时长20min。电泳结束后用0.4mmol/ltris-hcl(ph=7.5)中和三次,每次10min。最后向载玻片上滴加20μl碘化丙啶染液,盖上盖玻片并避光10min。使用荧光显微镜观察载玻片,激发波长为515-560nm。可以观察到拖尾的彗星图样,使用软件cometassaysoftwareproject(casp)对其进行分析可以得到量化的结果。
d、抑瘤实验
将肿瘤大小均匀的荷瘤小鼠分为4组,每组5只小鼠。第一组小鼠提前24h通过尾静脉注射100μl聚合物胶束溶液,甲硝唑当量为17.6mg/kg。第二组小鼠提前1h尾静脉注射100μl甘氨双唑钠溶液(由于甘氨双唑钠在体内容易代谢,提前时间不要超过1h),甲硝唑当量同样为17.6mg/kg。第三组提前1h尾静脉注射100μl甲硝唑溶液,同样为17.6mg/kg,第四组小鼠注射等体积的磷酸盐缓冲溶液作为对照。
将150μl戊巴比妥钠(溶于磷酸盐缓冲溶液)溶液(1%)通过皮下注射到小鼠体内对小鼠进行麻醉,然后将小鼠四肢固定使肿瘤部位暴露出来。接下来在医院专业人员的指导下对荷瘤小鼠进行放射治疗。照射剂量设定为4gy,辐照范围为25cm×25cm,放射源和皮肤间距离为100cm,辐射能为6mev。照射完毕将小鼠放回动物实验中心继续饲养观察,每隔一天对小鼠进行体重称量和肿瘤尺寸测量并记录数据。肿瘤体积计算公式为v=ab2/2。注:a指的是肿瘤的大径,b指的是肿瘤的小径。
x射线放射治疗重复进行三次,分别在第1天、第3天和第5天。每次照射前都需要注射样品,方法同上。照射完带回动物实验中心继续饲养、观察和测量。
为了进一步说明本发明,下面结合实施例对本发明提供的一种聚乙二醇-b-(聚谷氨酸-g-甲硝唑)嵌段聚合物及其制备方法进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
实施例1
在250ml的单口烧瓶中加入聚乙二醇-b-聚谷氨酸(2.5g,0.23mmol),甲硝唑(2.5g,0.23mmol),4-二甲胺基吡啶(1.1g,6.14mmol),无水三乙胺(1ml),n-甲基吡咯烷酮(100ml),随后用将缩合剂二环己基碳二亚胺(2.39g,11.6mmol),溶解在50ml的n-甲基吡咯烷酮中,冰浴、氮气保护下,逐滴加入烧瓶中,随后,将温度升至50℃,搅拌反应2天,粗产物用二甲亚砜有机溶剂透析,然后用去离子水透析,最后得浅棕色粉末,收率为40%。
实施例2
在250ml的单口烧瓶中加入聚乙二醇-b-聚谷氨酸(5g,0.46mmol),甲硝唑(4.0g,23.0mmol),4-二甲胺基吡啶(2.1g,17.27mmol),无水三乙胺(1ml),n-甲基吡咯烷酮(100ml),随后用将缩合剂双(2-氧代-3-恶唑烷基)次磷酰氯(5.90g,23.2mmol),溶解在50ml的n-甲基吡咯烷酮中,冰浴、氮气保护下,逐滴加入烧瓶中,随后,将温度升至50℃,搅拌反应4天,粗产物用二甲亚砜有机溶剂透析,然后用去离子水透析,最后得浅棕色粉末,收率为80%。
实施例3
1、聚乙二醇-b-聚(谷氨酸-g-甲硝唑)嵌段聚合物的制备(如图1所示)
在250ml的单口烧瓶中加入聚乙二醇-b-聚谷氨酸(5.0g,0.46mmol),甲硝唑(4.0g,23.0mmol),4-二甲胺基吡啶(2.1g,17.27mmol),无水三乙胺(1ml),n-甲基吡咯烷酮(100ml),随后用将缩合剂双(2-氧代-3-恶唑烷基)次磷酰氯(5.90g,23.2mmol),溶解在50ml的n-甲基吡咯烷酮中,冰浴、氮气保护下,逐滴加入烧瓶中,随后,将温度升至50℃,搅拌反应4天,粗产物用二甲亚砜有机溶剂透析,然后用去离子水透析,最后得浅棕色粉末,收率为85.8%。所得到的聚合物聚乙二醇113-b-聚(谷氨酸0.36-g-甲硝唑0.64)50的1hnmr表征如图2所示。图2为本发明实施例3制备的嵌段聚合物聚乙二醇113-b-聚(谷氨酸0.36-g-甲硝唑0.64)50的1hnmr谱图。
2、自组装制备聚合物胶束纳米粒子
称取上述制备的聚合物(100mg)于2ml离心管中,加入1ml二甲亚砜,超声溶解。10ml样品瓶中加入9ml磷酸盐缓冲液,放入小磁子,开始搅拌。用移液枪将聚合物溶液迅速加入到样品瓶中,然后在去离子水中透析除去二甲亚砜,得到浓度为1mg/ml的聚合物纳米粒子溶液。最终组装体纳米粒子的浓度可以通过所用的聚合物二甲亚砜溶液的浓度,加入的磷酸盐缓冲溶液的体积以及最终定容的溶液体积进行调控。本申请依次制备了从1mg/ml至10mg/ml的嵌段聚合物胶束溶液。
首先,本发明以芘作为荧光探针,测试其在339nm和332nm激发光强度的对比对聚合物浓度作图,可以得到聚合物的临界胶束浓度为8.8×10-3mg/ml(如图3所示,图3为本发明实施例3制备的聚合物浓度对激发光光谱中波长在339nm和332nm处的强度的比值作图),溶液中芘的浓度为5×10-7mol/l。这说明浓度为1~5mg/ml的聚合物纳米粒子,在进入血液循环且被小鼠血液稀释约10倍后,依然能够保持纳米粒子的状态。通过动态光散射表征,发现得到的纳米粒子的平均粒径为55nm(如图4所示,图4为本发明实施例3制备的纳米胶束粒子的动态光散射表征图),该尺寸便于纳米粒子在肿瘤组织部位富集。同时,自组装所得的纳米粒子在水溶液中形成的粒子,表面是亲水性的聚乙二醇结构。这些特征都说明此胶束纳米粒子可以在体内血液的环境中长时间循环并在肿瘤组织中富集,如图5、图6所示,图5为聚合物粒子与小分子抗癌药物阿霉素在小鼠体内长时间循环表征图;图6为聚合物粒子在小鼠体72h内随时间变化的富集表征图。从图5和图6可知:小分子阿霉素在小鼠体内的清除速率较快,半衰期为0.85小时,然而负载至聚合物粒子的阿霉素,在小鼠体内清除速率较慢,有较长的循环,半衰期为6.45小时;同时,在小鼠体内药物富集的情况可以看出聚合物粒子在小鼠体内24小时达到最大富集。
接着,通过循环伏安法测定了聚乙二醇113-b-聚(谷氨酸0.36-g-甲硝唑0.64)50、甘氨双唑钠以及甲硝唑的半波电势(e1/2),通过半波电势,我们得出本发明的聚合物的亲电能力强于其他两个小分子,其辐射增敏作用也强,如图7所示,图7为本发明实施例3制备的聚乙二醇-b-聚(谷氨酸-g-甲硝唑)、甘氨双唑钠、甲硝唑的半波电位(e1/2)表征图,扫描率为100mvs-1。从图7可以看出:聚合物的半波电势为-0.475mv。
进一步的,我们进行了小鼠乳腺癌细胞(4t1)细胞实验,用安宁包的厌氧袋来模拟乏氧环境,加入不同浓度的聚合物粒子、甘氨双唑钠、甲硝唑,培养24小时,然后通过4gy的电子射线照射,最后通过mtt方法检测其细胞存活率,如图8所示。在乏氧条件及电子射线的照射下,聚乙二醇-b-聚(谷氨酸-g-甲硝唑)嵌段聚合物纳米粒子(hms)具有显著增强的杀死肿瘤细胞的能力。图8为聚乙二醇-b-聚(谷氨酸-g-甲硝唑)嵌段聚合物纳米粒子(hms),甘氨双唑钠(gs)和甲硝唑(mn)在无、有辐射剂量(4gy)条件下对小鼠乳腺癌4t1细胞的毒性评价;其中,a为无辐射剂量(4gy)条件下的毒性评价,b为有辐射剂量(4gy)条件下的毒性评价。通过图8中a可知,hms与小分子mn、gs在乏氧及无电子射线照射的条件下,对4t1细胞的毒性非常小,且相互之间无显著差别;图8中b可知,hms与小分子mn、gs在乏氧及有电子射线照射的条件下,对4t1细胞的毒性有显著的差别,其中hms的毒性最为明显,且具有一定的浓度依赖性。
接着通过细胞毒性研究了放射治疗中不同照射剂量对细胞生长状态的影响,发现聚合物的增敏比(ser)高于小分子,显著强于小分子放疗增敏剂,如图9所示,图9为磷酸盐缓冲溶液(pbs),聚乙二醇-b-聚(谷氨酸-g-甲硝唑)嵌段聚合物纳米粒子(hms),甘氨双唑钠(gs)和甲硝唑(mn)在乏氧和常氧条件下,细胞存活分数对电子束辐射剂量依赖性表征图;其中,a为乏氧条件下,细胞存活分数对电子束辐射剂量依赖性表征图;b为常氧条件下,细胞存活分数对电子束辐射剂量依赖性表征图;其中,甘氨双唑钠(gs)和甲硝唑(mn)的浓度为180μg/ml。通过图9可知,随着照射剂量的增大(从0gy到10gy)所有的曲线均表现出相同的趋势,细胞存活率逐渐降低。而当细胞处于乏氧状态时,放疗对肿瘤细胞的杀伤程度已经比较接近正常氧含量的细胞放疗的结果,这表明聚合物胶束作为放疗增敏剂具有优异的增敏效果。而相比之下,小分子放疗增敏剂的增敏效果较差。
进一步dna损伤实验,通过“彗星”尾部的dna含量可以用来表征dna的损伤程度,得出聚合物胶束作为放疗增敏剂效果要比小分子放疗增敏剂好,如图10所示,图10为磷酸盐缓冲溶液(pbs)组、聚乙二醇-b-(聚谷氨酸-g-甲硝唑)(hms)聚合物组以及小分子增敏剂甘氨双唑钠(gs)和甲硝唑(mn)组对小鼠乳腺癌4t1细胞彗星试验图;其中,a为辐射剂量(4gy)的电子束照射后,各组小分子及聚合物对4t1细胞的彗星试验;b为各组小分子及聚合物对4t1细胞的彗星试验“拖尾率”对比。“彗星”尾部的dna含量可以用来表征dna的损伤程度。从图10可以看出,hms组dna损伤程度比较严重,达到近40%,通过对比可得聚合物胶束作为放疗增敏剂效果要比小分子放疗增敏剂好。
再次,我们构建了h22小鼠肝癌细胞的皮下肿瘤模型。在肿瘤大小长至大约500mm3的时候,将所制备纳米粒子溶液以及甘氨双唑钠溶液,在相同的甲硝唑当量下,分别通过尾静脉注射到荷瘤小鼠体内,然后进行x射线放射治疗,照射相同的剂量(4gy)。每隔两天重复以上操作,共照射3次,照射完毕,继续饲养观察。每隔一天记录肿瘤体积大小。21天后,纳米粒子照射组(hms)的肿瘤相比于照射之前,其体积大小明显缩小(降低至原来的75%),而甘氨双唑钠组(gs)肿瘤体积增大至原来的1.5倍,甲硝唑组(mn)肿瘤体积增大至原来的2.25倍。注射磷酸盐缓冲溶液的对照组(pbs),肿瘤体积增大至原来的7倍;如图11和图12所示,图11为磷酸盐缓冲溶液(pbs),聚乙二醇-b-聚(谷氨酸-g-甲硝唑)嵌段聚合物纳米粒子(hms),甘氨双唑钠(gs)和甲硝唑(mn)h22肿瘤生长曲线图;图12为治疗后第21天时,切下的肿瘤的照片。通过该实验,充分证明了嵌段聚合物纳米粒子作为肿瘤放疗增敏剂具有十分高效的肿瘤放疗增敏效果。与市场销售的甘氨双唑钠注射液相比,效果显著提高。
由以上实施例可知,本发明提供了一种肿瘤放射治疗增敏聚合物,具有式i结构。该聚合物为甲硝唑接枝的聚乙二醇-b-聚谷氨酸,其在水溶液中自组装成胶束纳米粒子,表面是亲水性的聚乙二醇结构,纳米粒子作为肿瘤放疗增敏剂的应用时具有较好的增敏效果。该聚合物的生物安全性较高,具有很大的临床应用潜力。实验结果表明:胶束纳米粒子的平均粒径为55nm,该尺寸便于纳米粒子在肿瘤组织部位富集;聚合物的半波电势为-0.475mv;胶束纳米粒子的增敏比为2.18;21天后,纳米粒子照射组(hms)的肿瘤相比于照射之前,其体积大小明显缩小(降低至原来的75%)。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!