一种利用β-紫罗兰酮促进杜氏藻积累类胡萝卜素和β-胡萝卜素的方法与流程
本发明属于食品科学技术领域,具体涉及一种利用β-紫罗兰酮促进杜氏藻积累类胡萝卜素和β-胡萝卜素的方法。
背景技术
类胡萝卜素是一类重要的天然色素的总称,分布广泛在高等植物、藻类以及某些光合和非光合细菌、真菌中。类胡萝卜素对动物和人具有重要的生理功能,具有改善视力、抗氧化、提高免疫功能和预防心血管疾病等功效。类胡萝卜素在工业上可作为营养补充剂、化妆品、食用色素和着色剂。类胡萝卜素中β-胡萝卜素是橘黄色的天然色素,在胡萝卜、木瓜和芒果以及绿色蔬菜等都含有丰富的β-胡萝卜素,天然β-胡萝卜素是维生素a的前体,是人体维生素a的主要来源,还有抗氧化(清除自由基)、增强人体免疫力、保护视力、延缓衰老、防癌抗癌等功效。
目前β-胡萝卜素的生产方法主要有化学合成、天然提取和微生物发酵等。过去,化学合成的β-胡萝卜素产品基本上是独占市场,目前使用的β-胡萝卜素也大都是化学合成产品,因为化学法生产的β-胡萝卜素成本低,但几乎都是全反式异构体,生物活性低,有致染色体畸变作用,不具备天然β-胡萝卜素的许多生理功能,降低了产品的功效。近年来开始利用三孢布拉霉(blakesleatrispora)发酵生产天然β-胡萝卜素,这种方法生产的β-胡萝卜素全反式结构占85%以上,顺式结构占5~10%,有一定的生物活性。而从杜氏藻提取的含有40%顺式结构的天然β-胡萝卜素的生物活性好,但成本较高。杜氏藻是一种极其耐盐的真核单细胞绿藻,主要是在盐田、盐湖以及海洋中发现,抗逆性强,培养条件简单,能在高盐环境下培养,可以避免其它微生物的污染,有利于进行大规模的室外培养;而且在高光、高盐和营养胁迫等条件下,巴氏杜氏藻(dunaliellabardawil)能够大量累积β-胡萝卜素,最高可达干重的14%,是极佳的天然β-胡萝卜素的生物来源。但养殖杜氏藻的周期较长,相对限制了β-胡萝卜素的产量,寻找促进杜氏藻大量积累β-胡萝卜素的物质,成为该领域的关键技术问题。
技术实现要素:
为了能够快速累积类胡萝卜素和类胡萝卜素中β‐胡萝卜素,提高杜氏藻中类胡萝卜素和类胡萝卜素中β‐胡萝卜素的含量,本发明提供了一种利用β-紫罗兰酮促进杜氏藻积累类胡萝卜素和类胡萝卜素中β-胡萝卜素的方法。
本发明的目的通过以下技术方案实现:
一种利用β-紫罗兰酮促进杜氏藻积累类胡萝卜素和β-胡萝卜素的方法,包括如下步骤:将待诱导的杜氏藻细胞在含有β-紫罗兰酮的培养基中进行诱导培养,类胡萝卜素及类胡萝卜素中β-胡萝卜素在藻细胞中积累,然后提取色素。
所述待诱导的杜氏藻细胞为对数生长期(包括前期、中期和后期)和/或稳定期的杜氏藻细胞。当杜氏藻细胞处于对数生长期(包括前期、中期和后期)和/或稳定期时,藻液的od630≥0.7。
所述杜氏藻优选为巴氏杜氏藻。
所述β-紫罗兰酮的加入量为1~20mg/l(即1l的培养基中加入1~20mg的β-紫罗兰酮),优选为1~18mg/l,更优选为1~15mg/l;所述培养基为液体培养基,优选为杜氏藻液体培养基。
所述诱导培养的时间为2h~7天。
所述诱导培养的条件为在光照度为1000-8000lx,光暗周期为6-24h:6-24h,温度为20-35℃,以10-200r/min的转速震荡培养,优选为在光照度为8000lx,光暗周期为14h:10h,温度为26℃,以50r/min的转速震荡培养。
所述杜氏藻液体培养基,其成分为:nano30.420g/l,nacl87.690g/l,nah2po4·2h2o0.015g/l,nahco30.840g/l,kcl0.074g/l,mgso4·7h2o1.230g/l,cacl2·2h2o0.044g/l,fe-edta溶液0.5ml/l,a5微量元素溶液1ml/l。
fe-edta溶液:na2edta1.804g/l,fecl3·6h2o0.483g/l;a5微量元素溶液:h3bo32.860g/l,mncl2·4h2o1.810g/l,znso4·7h2o0.220g/l,cuso4·5h2o0.079g/l,(nh4)6mo7o24·4h2o0.039g/l。
所述方法的具体步骤为:
将杜氏藻细胞加入液体培养基中培养,待藻液的od630≥0.7时,加入β-紫罗兰酮继续培养,提取色素,获得类胡萝卜素和β-胡萝卜素。所述培养的条件为在光照度为1000-8000lx,光暗周期为6-24h:6-24h,温度为20-35℃,以10-200r/min的转速震荡培养,优选为在光照度为8000lx,光暗周期为14h:10h,温度为26℃,以50r/min的转速震荡培养。
所述提取色素的方法为:将培养完成的藻液进行离心,弃上清液,将藻泥与有机溶剂混合,浸提,离心,将上层液进行滤膜过滤。
所述有机溶剂为丙酮、乙醇、甲醇或乙腈等;所述浸提的时间为15~30min,所述滤膜为0.45μm滤膜。
本发明的有益效果是加入β-紫罗兰酮后能有效提高杜氏藻的类胡萝卜素的含量和类胡萝卜素中β‐胡萝卜素含量,可能是因为β-紫罗兰酮能促进类异戊二烯的合成,而类异戊二烯是合成类胡萝卜素的前体物质。本发明中β-紫罗兰酮的用量极少,在刺激杜氏藻大量积累β‐胡萝卜素的同时,不会明显增加生产成本。由于β-紫罗兰酮是挥发性的香气成分,在杜氏藻采收提取β‐胡萝卜素前2~6小时加入β-紫罗兰酮处理,效果会更佳(即藻细胞处于对数生长期或稳定期)。
与现有技术相比,本发明的优点是:
(1)本发明利用的杜氏藻属于真核自养微生物,培养条件简单,抗逆性强,能在高盐环境下培养,可以避免其它微生物的污染,有利于进行大规模的室外培养。而且杜氏藻自身无毒无害,可直接用作天然保健品。
(2)本发明利用的β-紫罗兰酮用量极少,在刺激杜氏藻大量积累β‐胡萝卜素的同时,不会明显增加生产成本。β-紫罗兰酮为易挥发的香气物质,能快速扩散,短时间内即可促进杜氏藻积累β‐胡萝卜素。
(3)本发明在高盐、强光、缺氮等极端环境的胁迫下,β‐胡萝卜素会有更高的产率,获得更高的收益。
本发明简单易行、成本低廉、能显著提高总类胡萝卜素和β-胡萝卜素的产量,而且杜氏藻是极其耐盐的单细胞绿藻,培养条件简单,且不易被其他微生物污染,相对于细菌以及三孢布拉霉等异养微生物更利于大规模养殖,符合工业化大规模生产的标准。
附图说明
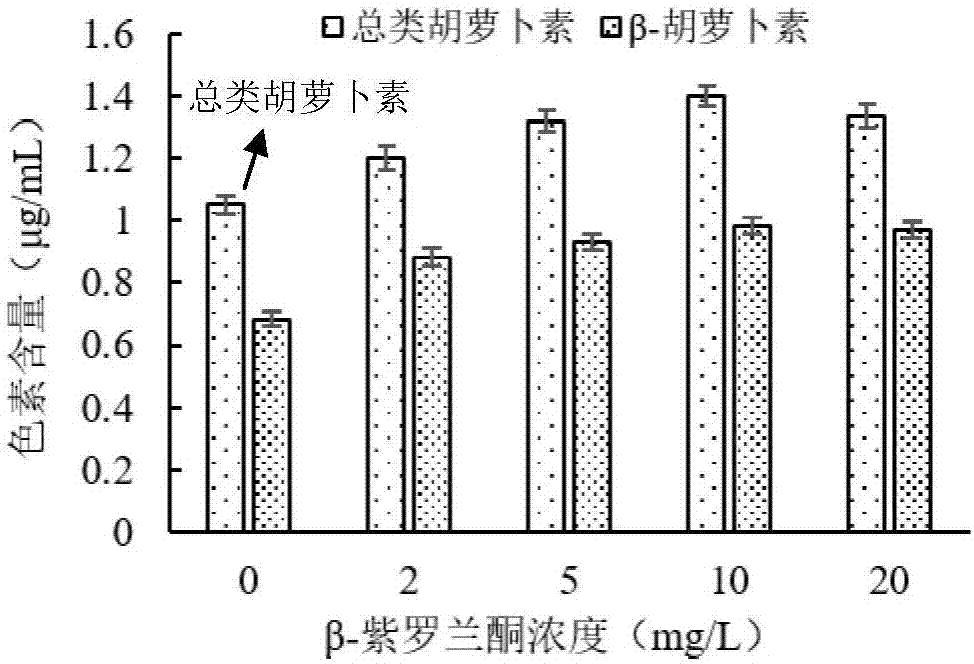
图1为添加2~20mg/l的β-紫罗兰酮处理巴氏杜氏藻(od630=0.714)3小时总类胡萝卜素和β-胡萝卜素的含量;
图2为添加2~20mg/l的β-紫罗兰酮处理巴氏杜氏藻(od630=0.714)6小时总类胡萝卜素和β-胡萝卜素的含量;
图3为添加1~50mg/l的β-紫罗兰酮处理巴氏杜氏藻(od630=1.421)4天总类胡萝卜素和β-胡萝卜素的含量。
具体实施方式
下面结合具体实施例对本发明作进一步详细描述,但本发明的实施方式不限于此。
测定色素含量的方法为:用分光光度计或酶标仪分别测定665.2nm、652.4nm和470nm波长处的吸光度值,再用下列公式进行计算:
叶绿素a(μg/ml)=16.72·a665.2-9.16·a652.4
叶绿素b(μg/ml)=34.09·a652.4-15.28·a665.2
总类胡萝卜素(μg/ml)=(1000·a470-1.63·chla-104.96·chlb)/221
测定β-胡萝卜素含量的方法为:首先是制作β-胡萝卜素标准曲线,用丙酮分别稀释100μg/mlβ-胡萝卜素标液,配制以下不同浓度的β-胡萝卜素溶液:0.1、0.2、0.3、0.4、0.5和1μg/ml,然后用酶标仪测定453nm处的吸光值,从而得到一条标准曲线y=0.795x+0.0098,r2=0.999,其中y为453nm处的吸光值;x为β-胡萝卜素含量(μg/ml)。
实施例1
(1)活化培养
首先配制杜氏藻液体培养基,其成分为:nano30.420g/l,nacl87.690g/l,nah2po4·2h2o0.015g/l,nahco30.840g/l,kcl0.074g/l,mgso4·7h2o1.230g/l,cacl2·2h2o0.044g/l,fe-edta溶液(na2edta1.804g/l,fecl3·6h2o0.483g/l)0.5ml/l,a5微量元素溶液(h3bo32.860g/l,mncl2·4h2o1.810g/l,znso4·7h2o0.220g/l,cuso4·5h2o0.079g/l,(nh4)6mo7o24·4h2o0.039g/l)1ml/l;
然后将巴氏杜氏藻细胞接种于上述液体培养基中,在光照度为8000lx,光暗周期为14h:10h(光照14h,无光10h)(光暗交替培养),温度为26℃,以50r/min的转速震荡培养,获得同步生长的藻液。
(2)诱导培养
当藻液中藻细胞处于对数生长期(od630=0.714)时,分别向藻液添加0、2、5、10和20mg/lβ-紫罗兰酮,继续培养(光照度为8000lx,光暗周期为14h:10h(光照14h,无光10h),温度为26℃,以50r/min的转速震荡培养)3小时。
(3)色素提取
取2ml藻液在8000r/min转速下离心5min,弃上清液,向藻泥中加入2ml丙酮,涡旋分散,浸提20min后,10000r/min转速下离心15min,取上层丙酮相转移到新的离心管中,用0.45μm滤膜过滤。
(4)含量测定
用酶标仪分别测定上述丙酮相溶液在665.2nm、652.4nm和470nm波长处的吸光度值,再用下列公式进行计算:
叶绿素a(μg/ml)=16.72·a665.2-9.16·a652.4
叶绿素b(μg/ml)=34.09·a652.4-15.28·a665.2
总类胡萝卜素(μg/ml)=(1000·a470-1.63·chla-104.96·chlb)/221
测定β-胡萝卜素含量的方法为:首先是制作β-胡萝卜素标准曲线,用丙酮分别稀释100μg/mlβ-胡萝卜素标液,配制以下不同浓度的β-胡萝卜素溶液:0.2、0.5、1、2、3、4、5和10μg/ml,然后用酶标仪测定453nm处的吸光值,从而得到一条标准曲线y=0.795x+0.0098,r2=0.999,其中y为453nm处的吸光值;x为β-胡萝卜素含量(μg/ml)。
按上述公式计算总类胡萝卜素和β-胡萝卜素含量,发现添加2~20mg/l的β-紫罗兰酮处理巴氏杜氏藻3h后,总类胡萝卜素和β-胡萝卜素含量比未加β-紫罗兰酮处理的对照组分别提高14.3~33.3%和29.1~43.8%(见图1)。
实施例2
(1)活化培养(同实施例1)
(2)诱导培养
同实施例1,不同之处在于加入β-紫罗兰酮后继续培养6小时。
(3)色素提取(同实施例1)
(4)含量测定
测定总类胡萝卜素和β-胡萝卜素含量的方法同实施例1,结果发现添加2~20mg/l的β-紫罗兰酮处理巴氏杜氏藻6h后,总类胡萝卜素和β-胡萝卜素含量比未加β-紫罗兰酮处理的对照组分别提高9.3~33.0%和16.2~38.1%(见图2)。
实施例3
(1)活化培养(同实施例1)
(2)诱导培养
当巴氏杜氏藻细胞处于稳定期(od630=1.421)时,分别向藻液添加0、1、2、5、20和50mg/lβ-紫罗兰酮,继续培养4天。
(3)色素提取(同实施例1)
(4)含量测定
经计算,发现添加1、2和5mg/l的β-紫罗兰酮处理巴氏杜氏藻4天后,总类胡萝卜素和β-胡萝卜素含量比未加β-紫罗兰酮处理的对照组分别提高13.9~28.6%和31.0~39.3%,而高浓度即50mg/l的β-紫罗兰酮处理4天后,由于巴氏杜氏藻细胞生物量有所下降,总类胡萝卜素和β-胡萝卜素含量比对照组显著减少(见图3)。说明低浓度的β-紫罗兰酮能促进杜氏藻积累总类胡萝卜素和β-胡萝卜素。
- 还没有人留言评论。精彩留言会获得点赞!