促进纤维丙酮丁醇乙醇发酵生产的酶解缓冲液及其应用的制作方法
本发明属于木质纤维素资源化利用
技术领域:
,具体涉及一种促进纤维丙酮丁醇乙醇发酵生产的酶解缓冲液及其应用。
背景技术:
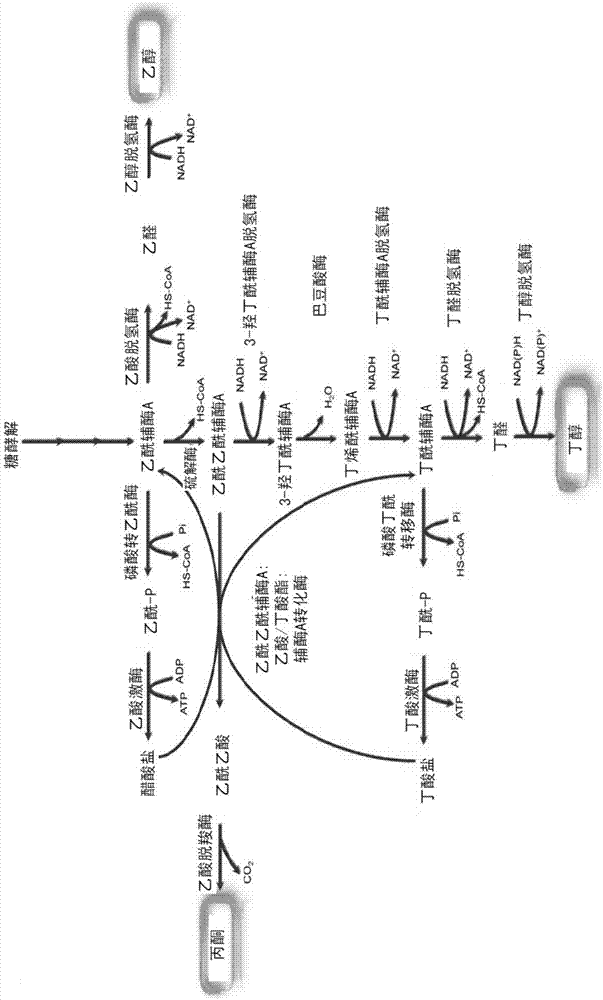
正丁醇是一种重要的大宗化学品和潜在的替代燃料,广泛应用于工、食品、医药等领域。利用木质纤维素原料,通过丙酮-丁醇-乙醇(abe)发酵制备生物基正丁醇具有可再生、环境友好等优势,是近年来研究的热点。然而,除abe发酵存在较高的产物抑制外,产丁醇微生物多对外界环境和刺激较为敏感。在木质纤维素转化为生物基正丁醇的工艺路线中,木质纤维素通过预处理手段实现解聚,在解聚之后,通过酶解糖化获得纤维糖水解液,在通过产丁醇微生物将纤维糖酶解液中的糖分转化为丙酮、丁醇等物质。在此过程中,为实现纤维素酶解最适ph,提高纤维素酶解效率,通常利用强碱弱酸型盐溶液作为缓冲剂,稳定纤维素酶解过程中水相的ph。目前常用于木质纤维素酶解的缓冲剂多为一定浓度的,由柠檬酸/柠檬酸钠配制而成的ph在4.5-5.5的盐溶液。该类盐溶液具备较强的稳定性,在酶解后,含有柠檬酸/柠檬酸钠盐的酶解液适用于多种生物化学品的发酵。然而遗憾的是,添加柠檬酸/柠檬酸钠缓冲液形成的酶解液对abe发酵产生明显的抑制。有报道显示(chuangxue等,“thevitalroleofcitratebufferinacetone–butanol–ethanol(abe)fermentationusingcornstoverandhigh-efficientproductrecoverybyvaporstripping–vaporpermeation(vsvp)process”[j],biotechnologyforbiofuels,2016,9,146),对于丁醇发酵,当酶解过程的柠檬酸/柠檬酸钠盐浓度从30mm提升至100mm时,发酵结束后,丁醇和abe总溶剂的浓度分别由11.2g/l和19.8g/l降低至6.4g/l和11.1g/l。其原因是该类缓冲盐降低细胞内的ph值和质子的动力,抑制产丁醇菌株的生长,影响细胞膜的通透性(liuk.等,“pardo-planaso,etal.processdevelopmentforbiologicalproductionofbutanolfromeasternredcedar”[j],bioresourcetechnology,2015,176,88-97)。此外,在酶解结束后,未解离的柠檬酸具有较高渗透压,直接影响细胞的代谢生长(aroraa,等,“understandingthepinediluteacidpretreatmentsystemforenhancedenzymatichydrolysis”[j],acssustainablechemicalengineering,2015,3,2423-2428)。而柠檬酸/柠檬酸钠也会螯合培养基内部分发酵必须的微量元素,进而影响细胞的代谢(elizabethcasey等,“effectofsaltsontheco-fermentationofglucoseandxylosebyageneticallyengineeredstrainofsaccharomycescerevisiae”,biotechnologyandbiofuels,2013,6,83)。为解决传统的柠檬酸/柠檬酸钠酶解缓冲液对丙酮丁醇发酵的抑制,一些研究采用乙酸/乙酸钠缓冲盐溶液代替柠檬酸/柠檬酸钠缓冲液或将其作为发酵培养基的一部分,在酶解结束后添加,在随后的发酵过程中,均获得了较小的抑制和较好的丙酮丁醇发酵效果(ibrahimmf等,“oilpalmemptyfruitbunchasalternativesubstrateforacetone–butanol–ethanolproductionbyclostridiumbutyricumeb6”[j],appliedbiochemistryandbiotechnology,2012,166,1615-1625;qureshin等,“soymolassesasfermentationsubstrateforproductionofbutanolusingclostridiumbeijerinckiiba101”[j],journalofindustrialmicrobiologyandbiotechnology,2001,26,290-295)。这类方法的原理是乙酸作为共同碳源,将细胞内部乙酸浓度维持在较高水平,提高产丁醇微生物代谢途径中,催化丙酮合成的coa转移酶的活性,进而强化abe代谢过程中丙酮的合成(chenck等,“effectofacetateonmolecularandphysiologicalaspectsofclostridiumbeijerinckiincimb8052solventproductionandstraindegeneration”[j],appliedenvironmentalmicrobilogy,1999,65,499-505)。为此,专利cn105483164a以此原理为基础,在发酵产溶剂期加入一定浓度的乙酸,胁迫丙酮丁醇梭菌代谢生产较高浓度丙酮。然而,在酶解过程中添加乙酸/乙酸钠缓冲盐溶液尽管能一定程度上促进丙酮的代谢,但无法实现对丁醇代谢的促进和提升。此外,在传统的缓冲盐系统的酶解过程后,由于酶解液中营养物质的匮乏,丙酮丁醇梭菌代谢生产能力较差,多需要外源加入外源营养物质,如氨基酸、无机盐等,以满足高效的丙酮丁醇代谢生产。外源营养物质的添加无疑增加了纤维丙酮丁醇发酵的复杂程度,提升了发酵过程的染菌概率。因此,目前存在的问题是需要研究开发一种既能够促进丙酮和丁醇代谢,又不需添加外源营养物质的多功能酶解缓冲液。技术实现要素:本发明所要解决的技术问题是针对现有技术的不足提供一种促进纤维丙酮丁醇乙醇发酵生产的酶解缓冲液。该酶解缓冲液能够提供使木质纤维素高效降解的水环境,且能够刺激和促进酶解后的丙酮、丁醇和乙醇的生成,其中缓冲剂中的阴离子源可以进一步作为碳源底物被产丁醇菌利用,同时,该缓冲液还能够提供abe发酵所需的多数微量营养物质。为此,本发明第一方面提供了一种酶解缓冲液,其包括的阴离子源,所述阴离子源为丁酸根或含有丁酸根的混合物。在本发明的一些实施例中,所述含有丁酸根的混合物包括含有丁酸根和其他阴离子的混合物。在本发明的一些具体优选的实施例中,所述其他阴离子为乙酸根。在本发明的一些优选的实施例中,所述含有丁酸根和其他阴离子的混合物为乙酸根和丁酸根的混合物。在本发明的另一些优选的实施例中,所述含有丁酸根和其他阴离子的混合物为去除乙醇、丁醇、丙酮的含有乙酸、丁酸的丙酮-丁醇-乙醇(abe)发酵液。根据本发明,所述酶解缓冲液还包括阳离子源,所述阳离子源包括金属阳离子和/或由氨气或氨水经过与阴离子源混合后形成的nh4+。在本发明的一些实施例中,所述金属阳离子包括k+、na+、ca2+、mg2+、co2+、cu2+、zn2+、fe2+和mn2+中的一种或多种。在本发明的一些实施例中,在所述酶解缓冲液中阴离子源与阳离子源的总摩尔比为(1-5):1,优选为(1-3):1。本发明中,所述酶解缓冲液的ph为4-7,优选ph为4-6,进一步优选为4.5-5.5。在本发明的一些实施例中,所述酶解缓冲液中,阴离子源的的总浓度为5-1000mm,优选为10-500mm,进一步优选为50-300mm。本发明第二方面提供了一种利用本发明第一方面所述的酶解缓冲液在促进木质纤维素发酵生产丙酮丁醇乙醇中的应用,其包括:步骤a,将木质纤维素原料粉碎,经预处理后,得到木质纤维素预处理残渣;步骤b,将木质纤维素预处理残渣与酶解缓冲液混合,加入纤维素酶进行酶解,得到酶解液;步骤c,用ph调节剂调节酶解液的ph至6-7.5,得到ph为6-7.5的酶解液;步骤d,向ph为6-7.5的酶解液中接入产丁醇菌种,进行产丙酮丁醇乙醇的发酵生产,制得含有丙酮、丁醇和乙醇的发酵培养物。本发明中,所述ph调节剂包括金属氧化物、金属氢氧化物、氨气和氨水中的一种或几种。在本发明的一些实施例中,构成所述金属氧化物或金属氢氧化物金属阳离子包括k+、na+、ca2+、mg2+、co2+、cu2+、zn2+、fe2+和mn2+中的一种或多种。在本发明的一些具体优选的实施例中,ph调节剂为k+、mg2+所对应的金属氧化物和/或氢氧化物。在本发明的一些进一步具体优选的实施例中,所述ph调节剂为氢氧化钾和氢氧化镁的混合液,其中氢氧化钾和氢氧化镁的摩尔比为3:1。本发明中,所述酶解液包括酶解原液和/或酶解上清液。本发明中,所述产丁醇菌种包括丙酮丁醇梭菌、拜氏梭菌、巴氏梭菌、糖丁酸梭菌、糖乙酸多丁醇梭菌和产丁醇基因工程菌中的一种或多种。根据本发明方法,所述丙酮丁醇乙醇发酵方式适用于批次发酵,补料分批发酵,连续发酵;固定化发酵,菌体回收发酵,游离发酵;同步糖化发酵;半同步糖化发酵等。本发明中,所述产丁醇菌种由相应的菌株经过种子培养获得。在本发明的一些实施例中,所述产丁醇菌株发酵包括单菌发酵、产丁醇菌与其他一种或多种菌混和进行的共发酵。本发明涉及一种促进纤维丙酮丁醇乙醇发酵生产的酶解缓冲液的配制方法。该方法利用可以被产丁醇梭菌代谢的丁酸等有机弱酸与微生物代谢所必须的金属氢氧化物或氨水提供阳离子,配制而成ph为4-7,适用于纤维素酶酶解木质纤维素的缓冲盐溶液。在酶解完成后,通过加入碱性物质调节ph,即可实现纤维丙酮丁醇乙醇的发酵生产,而无需提供其他外源营养物质。本发明提供了一种简化的酶解缓冲液配制方案,有效解决了传统的柠檬酸/柠檬酸钠缓冲液对丙酮丁醇乙醇发酵的抑制问题,通过酶解过程中加入乙酸、丁酸等中间产物,影响丙酮丁醇乙醇代谢流,促进溶剂的高效生产。附图说明下面将结合附图来说明本发明。图1示出木质纤维素代谢途径。具体实施方式为使本发明容易理解,下面将详细说明本发明。如前所述,现有的酶解缓冲液均存在这样或那样一些问题,例如,柠檬酸/柠檬酸钠缓冲液形成的酶解液对abe发酵产生明显的抑制,而在酶解过程中添加乙酸/乙酸钠缓冲盐溶液尽管能一定程度上促进丙酮的代谢,但无法实现对丁醇代谢的促进和提升。同时,在传统的缓冲盐系统的酶解过程后,由于酶解液中营养物质的匮乏,无法满足正常的丙酮丁醇乙醇发酵和菌株代谢的需要,多需要外源加入外源营养物质以满足正常的丙酮丁醇乙醇代谢生产;而外源营养物质的添加无疑增加了纤维丙酮丁醇乙醇发酵的复杂程度,提升了发酵过程的染菌概率。鉴于此,本发明人针对酶解缓冲液进行了大量研究。本发明人研究发现,在酶解缓冲液中引入丁酸根阴离子,能够提供一种不脱毒、不添加外源营养的酶解缓冲体系,酶解液能够(1)提供使木质纤维素高效降解的弱酸性水环境;(2)为酶解后的发酵过程提供丁醇代谢刺激和促进作用,并能够作为碳源底物利用;(3)该缓冲盐具备abe发酵所需的多数微量营养物质;这种酶解缓冲液具有高效和多功能的特点,且能够在酶解过程前加入。本发明正是基于上述发现做出的。因此,本发明第一方面所涉及的酶解缓冲液为一种促进木质纤维素发酵生产丙酮丁醇乙醇的酶解缓冲液,其包含阴离子源。在本发明的一些实施例中,所述阴离子源为丁酸根。在本发明的一些实施例中,所述阴离子源为含有丁酸根的混合物。图1示出木质纤维素代谢途径。本发明人研究发现,传统的乙酸根为代表的酶解缓冲液,例如,hongzhenluo等,“effectivelyenhacingacetoneconcentrtationandacetone/butanolratioinabefermenattionbyaglucose/acetateco-substratesystemincorporatingwithglucoselimitationandc.acetobutylicum/s.cerevisiaeco-culturing”[j],biochemicalengineeringjournal2017,118,132-142中,乙酸根在acetoacetyl-coa酶的催化下生成的是乙酰辅酶a,之后进一步代谢为乙醇和丙酮,这样所得的丙酮-丁醇-乙醇溶剂混合物中丁醇的比例会相应的减少,一方面是因为丙酮和乙醇比例增加,另一方面是乙酰辅酶a到丁醇产物的途径较长,且需要大量nadh和nadph等辅酶的驱动。因此缓冲盐中单独加入乙酸后对丁醇的生产促进相对较弱。而含有丁酸根的酶解液中,例如,xinli等,“increasingbutanol/acetoneratioandsolventproductivityinabefermentationbyconsecutivelyfeedingbutyratetoweakenmetabolicstrengthofbutyrateloop”[j],bioprocessbiosystemengineering,2014,37,1609-1616,丁酸根在acetoacetyl-coa酶和还原性辅因子(如nadh)驱动下,还原为丁酰辅酶a(butyryl-coa),之后,丁酰辅酶a在丁醛脱氢酶(butyraldehydedehydrgenase)和丁醇脱氢酶(butanoldehydrogenase)的依次生物催化下,转化为丁醇。同时,酶解液中的丁酸根提供了异源的丁酸,这样可以促进这一代谢途径内的代谢流,因此达到促进丁醇生产,作为碳源利用的效果。现有技术中,发酵过程中额外添加的乙酸、丁酸等均为发酵的产溶剂期作为刺激因子和额外碳源补进发酵系统(乙酸钠缓冲盐除外)。而本发明人研究发现,在产溶剂期加入乙酸或丁酸大大增加了工艺复杂性和调控难度,而在酶解缓冲液中加入乙酸和/或丁酸不但可以形成ph稳定的弱酸缓冲盐用于木质纤维素低底物的酶解,还可以有效地简化发酵过程无机盐等底物的添加过程,并可以促进发酵过程中丁醇的代谢,提升溶剂产量。在本发明的一些实施例中,所述含有丁酸根的混合物包括含有丁酸根和其他阴离子的混合物。在本发明的一些具体优选的实施例中,所述其他阴离子为乙酸根。在本发明的一些优选的实施例中,所述含有丁酸根和其他阴离子的混合物为乙酸根和丁酸根的混合物。在本发明的一些具体优选的实施例中,在所述丁酸根和乙酸根的混合物中,基于丁酸和乙酸的质量计的丁酸根与乙酸根的质量比为(1-10):1,优选为(1-3):1,进一步优选为(1-2):1,更进一步优选为1:1。在本发明的另一些优选的实施例中,所述含有丁酸根和其他阴离子的混合物为去除乙醇、丁醇、丙酮的含有乙酸、丁酸的丙酮-丁醇-乙醇(abe)发酵液。根据本发明,所述酶解缓冲液还包括阳离子源,所述阳离子源包括金属阳离子和/或由氨气或氨水经过与阴离子源混合后,形成的nh4+。在本发明的一些实施例中,所述金属阳离子包括k+、na+、ca2+、mg2+、co2+、cu2+、zn2+、fe2+和mn2+中的一种或多种,优选为k+和mg2+。在本发明的一些具体实施方式中,所述酶解缓冲液包含阴离子源和阳离子源。在一些优选的具体实施例中,所述所述酶解缓冲液含有作为阴离子源的丁酸根和作为阳离子源的k+、na+、ca2+、mg2+、co2+、cu2+、zn2+、fe2+和mn2+中的一种或多种,优选为k+和mg2+。在一些优选的具体实施例中,所述所述酶解缓冲液含有作为阴离子源的丁酸根和乙酸根和作为阳离子源的k+、na+、ca2+、mg2+、co2+、cu2+、zn2+、fe2+和mn2+中的一种或多种,优选为k+和mg2+。在一些优选的具体实施例中,所述所述酶解缓冲液含有作为阴离子源的为去除乙醇、丁醇、丙酮的含有乙酸、丁酸的丙酮-丁醇-乙醇(abe)发酵液和作为阳离子源的k+、na+、ca2+、mg2+、co2+、cu2+、zn2+、fe2+和mn2+中的一种或多种,优选为k+和mg2+。在一些优选的具体实施例中,所述所述酶解缓冲液含有作为阴离子源的丁酸根和作为阳离子源的由氨气或氨水经过与阴离子源混合后,形成的nh4+。在一些优选的具体实施例中,所述所述酶解缓冲液含有作为阴离子源的丁酸根和乙酸根和作为阳离子源的由氨气或氨水经过与阴离子源混合后,形成的nh4+。在一些优选的具体实施例中,所述所述酶解缓冲液含有作为阴离子源的为去除乙醇、丁醇、丙酮的含有乙酸、丁酸的丙酮-丁醇-乙醇(abe)发酵液和作为阳离子源的由氨气或氨水经过与阴离子源混合后,形成的nh4+。在本发明的一些具体实施方式中,在所述酶解缓冲液中,阴离子源与阳离子源的总摩尔比为(1-5):1,优选为(1-3):1。本发明中,所述酶解缓冲液的ph为4-7,优选ph为4-6,进一步优选为4.5-5.5,更进一步优选为4.8-5。在本发明的一些实施例中,所述酶解缓冲液中,阴离子源的的总浓度为5-1000mm,优选为10-500mm,进一步优选为50-300mm。本发明中对于酶解缓冲液的配制方式没有特别的限制,例如,所述酶解缓冲液既可以在与待酶解物质(木质纤维素预处理残渣)混合前形成,也可以在与待酶解物质(木质纤维素预处理残渣)混合后形成。在本发明的一些实施例中,所述酶解缓冲液在与待酶解物质(木质纤维素预处理残渣)混合前形成。所述酶解缓冲液由阴离子源和阳离子源在水中混合制备完成后,再与待酶解物质(木质纤维素预处理残渣)混合,形成酶解缓冲液与待酶解物质(木质纤维素预处理残渣)的混合物。在本发明的一些具体的实施例中,向阴离子源的水溶液中加入阳离子源水溶液至ph为4-7,优选ph为4-6,进一步优选为4.5-5.5,更进一步优选为4.8-5,制成酶解缓冲液,再将待酶解物质(木质纤维素预处理残渣)加入酶解缓冲液中,形成酶解缓冲液与待酶解物质(木质纤维素预处理残渣)的混合物。在本发明的一些实施例中,所述酶解缓冲液在与待酶解物质(木质纤维素预处理残渣)混合后形成。将所述阴离子源与待酶解物质(木质纤维素预处理残渣)混合后,再向其中加入阳离子源,混合形成酶解缓冲液与待酶解物质(木质纤维素预处理残渣)的混合物。在本发明的一些具体的实施例中,向阴离子源的水溶液中加入待酶解物质(木质纤维素预处理残渣),混合均匀后,向其中加入阳离子源水溶液至ph为4-7,优选ph为4-6,进一步优选为4.5-5.5,更进一步优选为4.8-5,形成酶解缓冲液与待酶解物质(木质纤维素预处理残渣)的混合物。本发明第二方面所涉及的如本发明第一方面所述的酶解缓冲液在促进木质纤维素发酵生产丙酮丁醇乙醇中的应用,可以理解为一种利用本发明第一方面所述的酶解缓冲液促进木质纤维素发酵生产丙酮丁醇乙醇的方法。该方法包括:步骤a,将木质纤维素原料粉碎,经预处理后,得到木质纤维素预处理残渣;步骤b,将木质纤维素预处理残渣与酶解缓冲液混合,加入纤维素酶进行酶解,得到酶解液;步骤c,用ph调节剂调节酶解液的ph至6-7.5,得到ph为6-7.5的酶解液;步骤d,向ph为6-7.5的酶解液中接入产丁醇菌种,进行产丙酮丁醇乙醇的发酵生产,制得含有丙酮、丁醇和乙醇的发酵培养物。本发明中对于酶解缓冲液的配制方式没有特别的限制,例如,所述酶解缓冲液既可以在与待酶解物质(木质纤维素预处理残渣)混合前形成,也可以在与待酶解物质(木质纤维素预处理残渣)混合后形成。在本发明的一些实施例中,所述酶解缓冲液在与待酶解物质(木质纤维素预处理残渣)混合前形成。所述酶解缓冲液由阴离子源和阳离子源在水中混合制备完成后,再与待酶解物质(木质纤维素预处理残渣)混合,形成酶解缓冲液与待酶解物质(木质纤维素预处理残渣)的混合物。在本发明的一些具体的实施例中,向阴离子源的水溶液中加入阳离子源水溶液至ph为4-7,优选ph为4-6,进一步优选为4.5-5.5,更进一步优选为4.8-5,制成酶解缓冲液,再将待酶解物质(木质纤维素预处理残渣)加入酶解缓冲液中,形成酶解缓冲液与待酶解物质(木质纤维素预处理残渣)的混合物。在本发明的一些实施例中,所述酶解缓冲液在与待酶解物质(木质纤维素预处理残渣)混合后形成。将所述阴离子源与待酶解物质(木质纤维素预处理残渣)混合后,再向其中加入阳离子源,混合形成酶解缓冲液与待酶解物质(木质纤维素预处理残渣)的混合物。在本发明的一些具体的实施例中,向阴离子源的水溶液中加入待酶解物质(木质纤维素预处理残渣),混合均匀后,向其中加入阳离子源水溶液至ph为4-7,优选ph为4-6,进一步优选为4.5-5.5,更进一步优选为4.8-5,形成酶解缓冲液与待酶解物质(木质纤维素预处理残渣)的混合物。本发明中所述木质纤维素原料包括但不限于甘蔗秸秆、麦秸秆和玉米秸秆中的一种或几种。在步骤a中,将所述木质纤维素原料粉碎至40-80目以上。这可以理解为,在步骤a中,将所述木质纤维素原料粉碎至40-80目所对应的粒径以下。本发明中对于木质纤维素原料进行预处理的方法没有特别的限制,例如,可以采用高温高压蒸煮、酸处理和碱处理中的一种或几种进行预处理。在本发明的一些实施例中,将干燥的木质纤维素原料粉碎至粒径在40目-80目以下。将粉碎后的木质纤维素原料与事先配制好的酸溶液或碱溶液充分混合,并在100-150℃,优选120-140℃下预处理1-4h,优选1-2h。之后,冷却至室温,并在10000rpm下离心获得固体木质纤维素预处理残渣。用去离子水冲洗木质纤维素预处理残渣至表面呈中性。并将所得中性木质纤维素预处理残渣在105℃下烘至绝干。上述实施例中对于用于预处理的酸溶液没有特别的限制,例如,可以采用5%(w/v)稀硫酸。上述实施例中对于用于预处理的碱溶液没有特别的限制,例如,可以采用10%(w/v)乙二胺水溶液。上述实施例中,对于预处理残渣至表面ph值的检测方法没有特别的限制,可以采用常规的方法检测预处理残渣至表面ph值,例如,可以采用ph试纸直接检测湿态预处理残渣表面的ph值。发明人研究发现预处理后的木质纤维素预处理残渣呈酸性或碱性都会对后续酶解过程的缓冲体系构建造成影响。例如,用碱液预处理后洗不到中性相当于碱,也就是金属阳离子多了,如果碱性很强会影响很大,碱性不强的话,正好能够满足下文氢氧化钾等的碱浓度要求。而残渣不清洗或者不清洗至中性的后果是预处理后的碱液中溶解了对细菌有毒性的酚类和有机酸,如果不进行清洗,这部分抑制物会对后续发酵过程造成影响,优选将残渣洗至中性。再例如,用酸液预处理后,大量酸根离子存在于酶解液中,当采用此类方法进行后续发酵时,过高浓度的阴离子酸根存在于酶解液中产生过高的渗透压,对后续的发酵菌株代谢造成显著抑制。本发明人研究发现,由于丁醇的发酵是两段的,在步骤c中如果不调节初始ph,则后续的步骤d中的发酵可能只产酸,不产醇。本发明人进一步研究发现,在步骤c中采用ph值调节剂调节酶解液的ph至6-7.5,则后续的步骤d中的发酵丁醇产率较高。本发明中,所述ph调节剂包括金属氧化物、金属氢氧化物、氨气和氨水中的一种或几种。在本发明的一些实施例中,构成所述金属氧化物或金属氢氧化物金属阳离子包括k+、na+、ca2+、mg2+、co2+、cu2+、zn2+、fe2+和mn2+中的一种或多种,优选为k+、mg2+。在本发明的一些优选的实施例中,ph调节剂为k+、mg2+所对应的金属氧化物和/或氢氧化物。在本发明的一些具体优选的实施例中,所述ph调节剂为氢氧化钾和氢氧化镁的混合液,其中氢氧化钾和氢氧化镁的摩尔比为3:1。本发明中,所述酶解液包括酶解原液和/或酶解上清液。本发明中,所述酶解原液由木质纤维素预处理残渣与酶解缓冲液混合,加入纤维素酶进行酶解直接获得。相应的,本发明中所述酶解上清液由酶解原液经过过滤后获得。不难理解,采用酶,缓冲盐体系,未酶解固相秸秆渣混合后同时进行酶解和接种发酵的发酵方式为同步糖化发酵;而采用酶解上清液与未酶解固相的混合物接种发酵为半同步糖化发酵。本发明中,所述产丁醇菌种包括丙酮丁醇梭菌、拜氏梭菌、巴氏梭菌、糖丁酸梭菌、糖乙酸多丁醇梭菌和产丁醇基因工程菌中的一种或多种。本发明中所述基因工程菌是指经基因工程改造,具备生产丁醇能力,且具有乙酸、丁酸代谢途径,表达乙酰乙酰-coa转移酶的基因工程菌中的一种或多种。根据本发明方法,所述产丙酮丁醇乙醇发酵方式适用于批次发酵,补料分批发酵,连续发酵;固定化发酵,菌体回收发酵,游离发酵;同步糖化发酵;半同步糖化发酵等。本发明中,所述产丁醇菌种由相应的菌株经过种子培养获得。在本发明的一些实施方式中,所述产丙酮和丁醇的发酵可以为单菌发酵,也可以为产丁醇菌种和其他一种或多种菌种混合后,进行共发酵。这可以理解为,可以采用以下接种方式进行产丙酮丁醇乙醇的发酵:(1)采用产丁醇菌种相应的单一菌株经种子培养获得的种子培养液接种后进行产丙酮丁醇乙醇的发酵生产;(2)采用产丁醇菌种相应的两株以上的菌株单独培养的种子液混合后形成的混合种子液接种后进行产丙酮丁醇乙醇的发酵生产;(3)采用产丁醇菌种相应的两株以上的菌株混合培养获得的混合种子液接种后进行产丙酮丁醇乙醇的发酵生产;(4)采用产丁醇菌种相应的菌株和其他一种或多种菌种相应的菌株单独培养的种子液混合后形成的混合种子液接种后进行产丙酮丁醇乙醇的发酵生产;(5)采用产丁醇菌种相应的菌株和其他一种或多种菌种相应的菌株混合培养获得的混合种子液接种后进行产丙酮丁醇乙醇的发酵生产。在本发明的一些优选的实施例中,采用产丁醇菌种相应的菌株和其他一种或多种菌种相应的菌株单独培养的种子液混合后形成的混合种子液接种后进行产丙酮丁醇乙醇的发酵生产。在本发明的一些具体实施例中,用于拜氏梭菌种子培养的培养基配方如下:葡萄糖40g/l,磷酸一氢钾0.5g/l,磷酸二氢钾0.5g/l,乙酸铵2.2g/l,对氨基苯甲酸1mg/l,生物素0.01mg/l,硫酸镁0.2g/l.硫酸锰0.01g/l,硫酸亚铁0.01g/l,氯化钠0.01g/l。用无菌氮气构建厌氧环境。在本发明的另一些实施例中,所述丙酮丁醇梭菌种子培养的培养基配方如下:葡萄糖40g/l,硫酸镁0.2g/l,磷酸一氢钾1g/l,磷酸二氢钾1g/l,乙酸铵2.2g/l,对氨基苯甲酸1mg/l,生物素0.01mg/l,硫酸镁0.2g/l.硫酸锰0.01g/l,硫酸亚铁0.01g/l。在本发明又一些实施例中,所述丙酮丁醇梭菌种子液的培养基配方如下:葡萄糖35g/l,酵母浸粉3g/l,牛肉蛋白胨2g/l,硫酸镁0.2g/l,磷酸一氢钾1g/l,磷酸二氢钾1g/l,乙酸铵2g/l。本发明在酶解缓冲液中引入丁酸根阴离子,该酶解缓冲液具有以下特征:1.由于丁酸的极性小于乙酸,其对细胞的刺激和胁迫较乙酸更小,因此对细胞的毒性更小。因此,本发明所提供的方案不但适用于丙酮丁醇乙醇发酵,同时也可以拓展到其他生物基化学品的发酵生产。2.本发明的丁酸为ph较低的丁酸和丁酸盐的缓冲液,不是丁酸溶液。3.不同于在丙酮丁醇乙醇发酵产溶剂期或发酵对数期添加的现有的酶解缓冲液,本发明的所提供的酶解缓冲液是在酶解过程前就已经在缓冲液的水相中添加了丁酸根,丁酸根不但影响丙酮丁醇乙醇代谢生产的产酸期和产溶剂期,同时还能够为发酵前的酶解过程提供ph稳定的缓冲体系4.本发明强调酶解过程和发酵过程的集成性,除丁酸根提供的缓冲效果外,金属阳离子的引入可以为发酵提供多数营养物质,在发酵之前,解决了脱毒和外源营养添加等操作步骤繁琐等问题,简化了工艺的同时,促进了丁醇的发酵生产。本发明中所述用语“木质纤维素”是天然木材或木质类材料经过化学处理得到的有机纤维,其外观为棉絮状,呈白色或灰白色。木质纤维素主要由纤维素(占干物质重的30-50%)、半纤维素(占干物质重的20-40%)及木质素(占干物质重的15-25%)三部分构成,此外还包括少量的结构蛋白、脂类和灰分。其中,所述“纤维素”(cellulose)是葡萄糖单元通过β-1,4糖苷键线性连接形成的均相聚合物,是一种大分子多糖,其不溶于水及一般有机溶剂,是植物细胞壁的主要成分。纤维素纤维之间通过氢键相互作用,并可以形成结晶区域和无定型区域。所述“半纤维素”是由不同类型的单糖(包括五碳糖和六碳糖)构成的杂聚多糖,其中木聚糖的比例大约为50%。所述“木质素”是一种无定形的、分子结构中富含氧代苯丙醇结构或其衍生结构单元的芳香性高聚物。木质素分散于纤维素纤维之间,但二者通常没有直接的化学键连接,木质素主要起着抗压作用;半纤维素贯穿于木质素和纤维素纤维之间,起着连接二者的作用,进而形成非常牢固的纤维素-半纤维素-木质素网络结构。木质纤维素的这一结构是植物在长期进化过程中自然选择的结果,因此木质纤维素生物质对环境中生物的或非生物的侵蚀都具有较强的抵抗能力。本发明中所述用语“木质纤维素预处理残渣”、“固体木质纤维素预处理残渣”和“木质纤维素残渣”可以互换使用。本发明中所述用语“丙酮-丁醇-乙醇发酵”是指用于制备或生成丙酮、丁醇和乙醇的发酵;由于该发酵的培物中乙醇含量较少,因此也可以将其看作是主要用于制备或生成丙酮和丁醇的丙酮-丁醇发酵。本发明中所述“水”一词在没有特别说明或指定的条件下是指去离子水、蒸馏水和超纯水中的一种或几种。实施例为使本发明更加容易理解,下面将结合附图和实施例来进一步详细说明本发明,这些实施例仅起说明性作用,并不局限于本发明的应用范围。本发明中所使用的原料或组分若无特殊说明均可以通过商业途径或常规方法制得。实施例1:利用乙酸/丁酸稀溶液配制纤维酶解缓冲液并实现乙二胺预处理后的甘蔗秸秆渣酶解糖化和abe发酵(1)将榨汁后的甘蔗秸秆用去离子水冲洗,至表面无残留游离糖分,105℃下烘至绝干。之后粉碎至粒径在40目以下。将甘蔗秸秆渣与事先配制好的10%(w/v)乙二胺水溶液充分混合,并在120℃下预处理1h。之后,将反应器冷却至室温,并在10000rpm下离心获得固体甘蔗秸秆预处理残渣。用去离子水冲洗预处理残渣至表面呈中性。所得中性预处理残渣在105℃下烘至绝干。测得固体收率49.8%,固体木质纤维素预处理残渣中纤维素、半纤维素、木质素含量分别为59.8%,18.8%和13.9%。(2)将烘干后的甘蔗秸秆预处理残渣与事先配制好的,含有2g/l乙酸和2g/l丁酸的有机酸混合液按照固体添加量6%(w/v)混合。之后,用含有氢氧化钾、氢氧化镁的碱性水溶液调节固液混合物的ph至4.8,其中氢氧化钾和氢氧化镁的摩尔比为3:1。向调节好ph的固液混合物内加入20fpu/g预处理残渣的纤维素酶(购自kdn集团)。之后,在50℃,180rpm下酶解72h。酶解结束后,用400目尼龙滤布过滤酶解液得到酶解上清液。用高效液相色谱测得酶解上清液中的葡萄糖和木糖浓度分别为28.9g/l和10.2g/l。(3)利用浓氨水调节酶解上清液的ph至7,获得ph为7的酶解上清液。(4)以5%(v/v)的接种量向ph为7的酶解上清液中接入拜氏梭菌种子液(实验室保存的clostridiumbeijerinckiiatcc55025,od600>2)。种子液的培养基配方如下:葡萄糖40g/l,磷酸一氢钾0.5g/l,磷酸二氢钾0.5g/l,乙酸铵2.2g/l,对氨基苯甲酸1mg/l,生物素0.01mg/l,硫酸镁0.2g/l.硫酸锰0.01g/l,硫酸亚铁0.01g/l,氯化钠0.01g/l。用无菌氮气构建厌氧环境。接种后,持续向发酵罐中通入无菌高纯氮气(>99.999%)2h以构建厌氧发酵环境。之后,发酵罐在37℃,50rpm下继续批次发酵72h。发酵结束后,取发酵上清液离心(去除微小的固相颗粒)制样。利用高效液相色谱检测发酵上清液中的葡萄糖和木糖浓度,利用气相色谱检测发酵上清液中的abe和乙酸、丁酸等有机酸副产物。经检测,发酵上清液中无葡萄糖和木糖残留。发酵液中丙酮、丁醇、乙醇浓度分别为2.4g/l,8.8g/l和1.7g/l。发酵液中的乙酸、丁酸浓度分别为2.4g/l和1.3g/l。实施例2:利用abe发酵液中的有机酸配制酶解缓冲液,并进行批次abe发酵。取实施例1中的abe发酵液,在45℃,20kpa下悬蒸,至浓缩发酵液的体积为原始发酵液的一半。之后,向减压浓缩发酵液中补入去离子水,使发酵液的体积与浓缩前的体积保持一致。利用气相色谱检测稀释后的浓缩发酵液中乙醇浓度为0.6g/l,乙酸和丁酸浓度为2.5g/l和1.5g/l,发酵液的ph为4.3。向稀释后的浓缩发酵液中加入浓氨水,调节ph至5。之后,取实施例1中所述乙二胺水溶液预处理并水洗得到的中性甘蔗秸秆残渣,按照6%(w/v)固体添加量与调节ph后的发酵液混合。加入20fpu/g固体残渣的纤维素酶(购自kdn集团)。固液混合物在55℃,200rpm下酶解72h。之后,用400目尼龙滤布过滤得到酶解上清液。继续向酶解上清液中加入浓氨水,调节酶解上清液ph至7.4。以10%(w/v)接种量接入事先培养好的拜氏梭菌种子液(配方同实施例1)。接种后的初始发酵液中葡萄糖和木糖浓度分别为29.7g/l和9.6g/l。接种后的发酵装置以高纯氮气构建厌氧发酵环境后,在37℃,30rpm下培养72h。发酵终止后,取发酵液离心,测得发酵上清液中葡萄糖和木糖浓度分别为0.4g/l和0.6g/l。发酵液中丙酮、丁醇、乙醇浓度分别为2.2g/l,8.5g/l和1.5/l。发酵液中乙酸和丁酸浓度分别为3.3g/l,1.9g/l。实施例3:利用不同浓度的丁酸/丁酸铵酶解缓冲液酶解小麦秸秆并进行游离abe发酵(1)麦秸秆粉碎至粒径在40目以下,之后,与事先配制好的5%(w/v)稀硫酸充分混合,并在120℃下预处理1h。之后,将反应器冷却至室温,并在10000rpm下离心获得固体小麦秸秆预处理残渣。用去离子水冲洗残渣至表面呈中性。所得中性残渣在105℃下烘至绝干。平行4组。(2)将反应得到的4组预处理残渣分别按照10%(w/v)的固体添加量加入25mm、50mm、75mm和100mm的丁酸/丁酸铵缓冲液,该缓冲液的ph为4.8。充分混合后,所得的固液混合物中加入30fpu/g残渣的纤维素酶,分别在50℃,200rpm下酶解72h。(3)离心取酶解上清液,以葡萄糖生物传感器(sba-10,山东省科学院)分别检测4组酶解液中的葡萄糖浓度,利用4m氢氧化钾水溶液调节酶解液ph至6.8,获得ph为6.8的酶解上清液。(4)以10%(v/v)的接种量向调节好ph的酶解上清液中接入丙酮丁醇梭菌种子液(od600>0.8,实验室保藏clostridiumacetobutylicumatcc824),并向发酵罐中持续通入无菌高纯氮气(>99.999%)1h以上,以构建厌氧环境。所述丙酮丁醇梭菌种子液的培养基配方如下:葡萄糖40g/l,硫酸镁0.2g/l,磷酸一氢钾1g/l,磷酸二氢钾1g/l,乙酸铵2.2g/l,对氨基苯甲酸1mg/l,生物素0.01mg/l,硫酸镁0.2g/l.硫酸锰0.01g/l,硫酸亚铁0.01g/l。接种后,发酵装置置于37℃下恒温培养,搅拌速率为30rpm。发酵72h后,终止发酵。取发酵上清液。用气相色谱检测检测发酵上清液中的abe和乙酸、丁酸等有机酸副产物。4组酶解液中的葡萄糖浓度和利用酶解液进行abe发酵后得到的发酵液中abe浓度,有机酸副产物浓度如表1所示。表1不同浓度的丁酸/丁酸铵酶解缓冲液的酸法小麦秸秆酶解效果和abe发酵结果浓度(g/l)25mm50mm75mm100mm酶解葡萄糖37.2237.6536.9337.46丁醇9.498.698.276.72丙酮2.222.111.961.77乙醇1.662.131.921.86乙酸2.012.823.824.36丁酸3.84.014.625.84由表1可知,在一定的浓度范围内,添加丁酸/丁酸铵酶解缓冲液处理之后的纤维酶解液对abe发酵基本无抑制。相反,由于在低浓度酶解缓冲液下,酶解环境的酸碱度有一定的波动,所得葡萄糖浓度和abe发酵水平略低于略高浓度酶解缓冲液下的数据。证明丁酸/丁酸盐酶解缓冲液具有较低的产丁醇菌株细胞毒性,是一种较为理想的适用于abe发酵的缓冲液配制方案。对比例1:利用不同酶解缓冲盐溶液对碱法处理玉米秸秆糖化效果的对比将60目粒径以下的绝干玉米秸秆以10%(w/v)的固体添加量与1.5%(w/v)的氢氧化钠溶液混合并搅拌均匀。所得固液混合体系置入密闭高压反应器内,反应器于120℃,200rpm下反应1h。之后用400目尼龙滤布去除预处理黑液,并用去离子水清洗预处理后获得的固相物质,直至固体表面ph至7。之后,在105℃下烘干过夜。上述实验过程平行6组。将上述6组预处理烘干残渣分别与50mm的ph=4.7的磷酸/磷酸氢二钾、乙酸/乙酸钠、乙酸/乙酸钾、丁酸/丁酸钾、柠檬酸/柠檬酸钠、去离子水(对照组)等溶液以固体添加量6%(w./v)混合,搅拌均匀后,依次加入15fpu/g固体的纤维素酶(购自kdn集团)。所得固液混合物在55℃,200rpm下分别酶解72h。之后,分别在10000rpm下离心,获得上清液。所得上清液用高效液相色谱测定酶解后的葡萄糖和木糖浓度,检测结果如表2所示。表2不同酶解缓冲盐溶液酶解碱法处理玉米秸秆的纤维酶解液糖分对比由表2可知,利用丁酸/丁酸钾酶解缓冲液替代传统乙酸/乙酸钠和柠檬酸/柠檬酸钠缓冲液时,所得酶解糖浓度与传统方法所得糖浓度基本维持一致,证明可以利用丁酸/丁酸钾缓冲液作为纤维酶解缓冲液使用。对比例2:利用不同酶解缓冲盐溶液对碱法预处理甜高粱秸秆进行半同步糖化abe发酵。将高粱渣水洗,至高粱渣表面游离糖分全部洗掉,烘至绝干并粉碎。将80目粒径以下的高粱渣以5%(w/v)的固体添加量与1%(w/v)的氢氧化钾溶液混合并搅拌均匀。所得固液混合体系置入密闭高压反应器内,反应器于100℃,200rpm下反应2h。之后用400目尼龙滤布去除预处理黑液,并用去离子水清洗预处理后获得的固相物质,直至固体表面ph至7。之后,在105℃下烘干过夜。上述实验过程平行5组。将上述5组预处理烘干残渣分别与50mm的ph=4.8的磷酸/磷酸氢二钾、乙酸/乙酸钾、丁酸/丁酸钾、柠檬酸/柠檬酸钾、去离子水(对照组)溶液以固体添加量6%(w./v)混合,搅拌均匀后,依次加入15fpu/g固体的纤维素酶(购自kdn集团),所得固液混合物在55℃,200rpm下分别酶解36h。之后,分别用浓氨水调节酶解体系ph至6.5,并将酶解液温度迅速降低至37℃。在降温完成后,以10%(v/v)的接种量向酶解液中加入事先培养好的丙酮丁醇梭菌种子液(od600>0.8,实验室保藏clostridiumacetobutylicumatcc824),并向发酵罐中持续通入无菌高纯氮气(>99.999%)2h以上,以构建厌氧环境。所述丙酮丁醇梭菌种子液的培养基配方如下:葡萄糖35g/l,酵母浸粉3g/l,牛肉蛋白胨2g/l,硫酸镁0.2g/l,磷酸一氢钾1g/l,磷酸二氢钾1g/l,乙酸铵2g/l。在接种完成后,在37℃,50rpm下继续发酵96h。发酵完成后,离心去除未水解的纤维残渣和菌体。得发酵上清液。采用高效液相色谱检测发酵上清液中的葡萄糖和木糖,采用气相色谱检测发酵上清液中的abe和乙酸、丁酸副产物。所得结果如表3所示表3不同酶解缓冲盐溶液对碱法预处理甜高粱秸秆进行半同步糖化abe发酵结果比较由表3可知,在丁酸缓冲盐体系下,半同步糖化发酵甜高粱秸秆渣后,abe发酵浓度最高,证明同等添加量下,含有丁酸根的纤维酶解缓冲盐对abe发酵抑制效果较小。此外,亦从表2可知,在丁酸/丁酸钾缓冲盐实验组内,丁醇浓度最高,丁醇/丙酮比例最大,证明酶解缓冲盐内的丁酸根离子可以在后续的发酵过程中,对丁醇的生物合成起到促进作用。应当注意的是,以上所述的实施例仅用于解释本发明,并不构成对本发明的任何限制。通过参照典型实施例对本发明进行了描述,但应当理解为其中所用的词语为描述性和解释性词汇,而不是限定性词汇。可以按规定在本发明权利要求的范围内对本发明作出修改,以及在不背离本发明的范围和精神内对本发明进行修订。尽管其中描述的本发明涉及特定的方法、材料和实施例,但是并不意味着本发明限于其中公开的特定例,相反,本发明可扩展至其他所有具有相同功能的方法和应用。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1