一种新型生物矿化菌种及其获取和筛选方法与流程
本发明属于生物治污领域,特别提供了一种具有生物矿化能力的新菌种。该菌种可分解溶液中的有机磷,并促进溶液中铅离子矿化并形成沉淀,因此可用于水污染的治理,特别的,可用于含铅废水的处理。本发明菌种在处理废水时,具有快速高的优点,并为金属回收提供了便捷。本发明还提供了制备和筛选该新菌种的方法。
背景技术
重金属污染是危害最大的水污染问题,长期困扰人民群众的日常生活。随着我国农业水平、工业水平和生活水平的提高和发展,重金属通过农药化肥使用、工厂排放废水和生活垃圾等人为方式逐渐污染水源水系,造成水资源的重金属污染隐患。并且重金属具有毒性大、不易被代谢、容易被生物富集并有生物放大效应的特点,严重危害人类健康和生态环境。
铅是重金属污染中毒性较大的一种,一旦进入人体将很难排除。铅对人体神经细胞具有不可逆的伤害作用,尤其能进入胎盘屏障,造成新生儿先天智力低下。
目前治理重金属水污染的方法主要有化学法、物理法和和生物方法等。其中的化学法和物理法的适用方法有限,且容易造成二次污染。生物方法是20世纪80年代随着生物技术的发展而产生的一种重金属废水处理技术,包括微生物法、植物法和动物方法,其中植物方法和动物方法都存在着成本高、治理周期长的问题。
微生物法包括吸附法和沉淀法。其中吸附法是利用具有吸附重金属特性的微生物材料来吸附水溶液中的重金属;微生物通过还原反应使金属离子转变成不易溶解的沉淀状态或降低其毒性的方法称为微生物沉淀法。
微生物沉淀法处理含铅废水因其处理成本低、选择性好、且速度快、无毒、无害、无二次污染等特点正受到越来越多的重视。传统的微生物修复技术中,微生物都是作为吸附剂、还原剂和沉淀剂对重金属进行处理。由于其重金属后期的迁移性较大,严重制约了在实际环境中的长周期使用。相比于普通的生化修复的高成本性以及植物修复的低效性而言,微生物成矿作用能够快速高效经济地固化重金属或者放射性金属,并且有利于贵重金属的生物回收。生物矿化在自然界广泛发生,将该类技术应用于自然界重金属治理具有环保等优势。
目前,具有生物矿化作用的菌种尚未发掘完全,本发明人经过长期研究和努力,发掘了自然界新型的具有良好成矿作用的菌种,为社会带来了明显的经济效益和环保效益。
技术实现要素:
本发明的目的在于提供一种可对溶液中的铅离子进行微生物矿化处理的新菌种。
本发明生物材料样品保藏单位:中国典型培养物保藏中心
保藏单位地址:湖北省武汉市武昌区八一路299号武汉大学校内(武汉大学第一附小对面),武汉大学保藏中心
保藏日期:2018.06.11
保藏编号:cctccm2018360rz9a
分类命名:bacillussp
一方面,本发明提供了种芽孢杆菌属的新菌种,可以同步分解有机磷、促进溶液中铅离子矿化,并且形成沉淀颗粒。
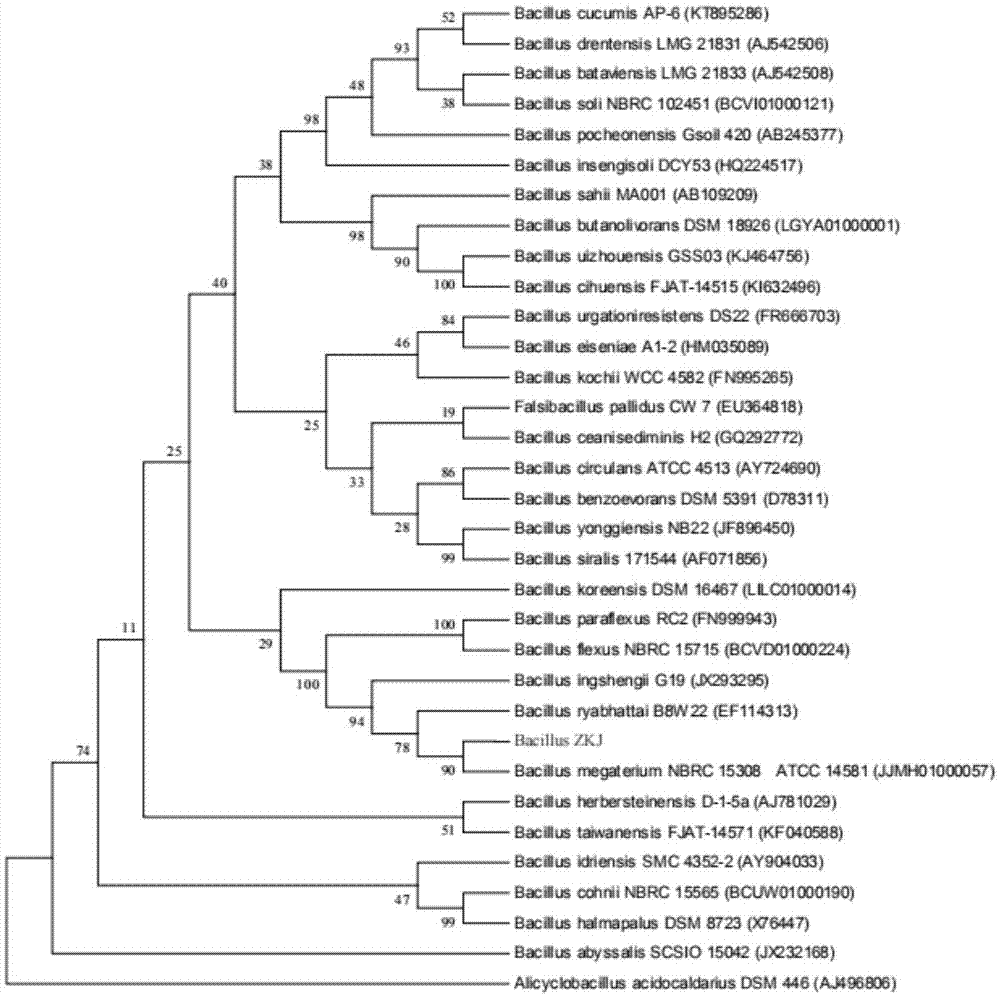
本发明新菌种属于芽孢杆菌属。根据16srrna基因测序blast结果(参见表1)以及生物进化树(参见图1)分析来看,该菌种与巨大芽孢杆菌bacillusmegaterium的相似性最高,为99.17%。巨大芽孢杆菌为产孢杆菌,且为革兰氏阳性菌及好氧菌。该菌种是有机磷(核酸、磷脂等)的分解菌,能使土壤中不能被植物利用的磷化物转变成可被利用的可溶性磷化物。
表1:本发明菌种的16srrna基因测序blast结果:由中国典型培养物保藏中心鉴定
本发明新菌种可以同步分解有机磷促进溶液中铅离子矿化并且形成颗粒沉淀,最终晶体结构为pb3(po4)2,其物质组成稳定,并且颗粒具有一定的强度,具有工程应用价值。(参见图2和8)
另一方面,本发明提供了获取和筛选一种芽孢杆菌属新菌种的方法。
本发明的菌种获取和筛选方法,是采用富集、涂布、划线、斜面保藏等进行细菌的分离纯化。选择了长期施肥、含有较高磷素的花圃土壤作为分离菌源,利用不同铅浓度的lb培养基作为分离方法,并以产生pb3(po4)2沉淀且沉淀产物结构紧密,具有工程应用价值为筛选指标。
本发明的新菌种获取步骤为:
(1)采花圃土壤,过20目~50目筛,
(2)取过筛后的土壤,加入到无菌水中,震荡搅拌,静置,
(3)取静置后的上清液,进行培养,培养方法可以是溶液富集培养或者是涂布划线培养;优选的,溶液富集培养使用的培养液为含200mg/l铅离子的lb液体培养基;优选的,涂布划线培养使用的固体培养基为含有100mg/l铅离子的lb固体培养基,以及
(4)取液体或固体培养基表面长势最好的菌落进行斜面保藏,获得该新菌种。
在一项技术方案中,本发明的花圃土壤为长期施肥、含有较高磷素的花圃土壤。
在一项技术方案中,液体富集lb培养基的组成为:每1000ml水中含有0.3197g硝酸铅、10g胰蛋白胨、5g酵母提取物和5g氯化钠。
在一项技术方案中,用于涂布划线培养的固体lb培养基的组成为每1000ml水中含有0.1598g硝酸铅、10g胰蛋白胨、5g酵母提取物、5g氯化钠和15g琼脂。
本发明的菌种以将其加入含铅溶液之中的最终沉淀产物为紧密颗粒状pb3(po4)2为筛选指标。也即,将前述方法分离的菌种经发酵培养后添加到含铅溶液中进行除铅试验,产生的颗粒状沉淀产物结构细致紧密(如图2),且具有一定的强度和稳定性。采用xrd方法检测沉淀产物的组成,证实为pb3(po4)2时(见图12),则为菌种筛选目标。
本发明的菌种的筛选方法为:
(1)取上述获取方法中所获取的菌种,或者,取其他备选菌种,进行分离和发酵培养,
(2)将发酵培养后的菌种添加到铅溶液中进行除铅试验,
(3)如铅溶液中产生了紧密颗粒状的沉淀产物,则分离该沉淀,进行下一步操作,
(4)采用xrd方法对沉淀进行检测,如沉淀证实为磷酸铅pb3(po4)2,则所述菌种为所需菌种。
在一项技术方案中,用于筛选菌种时的发酵培养的培养基的组成为:每1000ml水中含有15g酵母提取物和10g氯化铵nh4cl(氯化铵摩尔浓度为0.187g/mol),由此既不会形成氯化铅沉淀,又可促进细胞酶代谢,提高该类细菌后期除铅能力(图5是含或不含氯化铵对应的生长曲线,图6是含或不含氯化铵对应的去除率变化图)。
另一方面,本发明提供了一种处理含铅溶液的方法,优选的,使用本发明的菌种对重金属废水或者含铅溶液中的铅离子进行微生物矿化并产生金属盐沉淀,从而达到去除溶液中去铅离子的目的。
在一项技术方案中,发酵之后的菌体细胞与代谢产物通过离心分离,菌体细胞经生理盐水悬浮后进行除铅实验,明显形成团聚絮凝体(如图3)。超纯水溶胀细胞无絮凝现象发生,且相比之下对铅的去除率较低(如图7)。说明该菌体细胞表面具有很强的团聚絮凝作用,可以进一步提高铅的去除率。
另一方面,本发明提供了一种从重金属废水或含铅溶液中提取硝酸铅的方法,优选的,使用本发明菌种对重金属废水或者含铅溶液中的铅离子进行微生物矿化并产生金属盐沉淀,收集沉淀即得硝酸铅。
在一项技术方案中,代谢产物进行除铅实验,也可发生絮凝现象(如图4),且铅离子去除率很高。相同初始铅浓度,相同投加量下菌液、细胞、代谢产物的除铅实验如图11所示,其沉淀产物的扫描电镜图见图8、图9、图10。
本发明中所称的细胞是培养液(菌液)经过离心分离之后得到的沉淀物,用生理盐水将细胞沉淀悬浮后将其加到重金属溶液中去。与菌液相比,没有代谢产物、培养基本身成分,仅仅是细胞与生理盐水的悬浮液。
本发明所称的活细胞是经过生理盐水悬浮的细胞,其表面完整;死细胞是超纯水溶胀的细胞,因为溶胀作用使得细胞破碎。
本发明所称的代谢产物是细菌在发酵培养基中生长所产生的,将发酵培养后的菌液经过离心可以得到上清液(即分泌在培养基中的代谢产物)。
附图说明
图1是菌种的生物进化树。
图2是菌液除铅过程中形成的颗粒状产物。
图3是菌液细胞除铅过程中形成的团聚絮凝体。
图4是代谢产物除铅过程中形成的团聚絮凝体。
图5是发酵培养基中有无氯化铵对应的菌体生长曲线。
图6是发酵培养基中有无氯化铵对应的除铅实验。
图7是活细胞与死细胞对应的除铅实验(150ml初始浓度300mg/l的铅溶液中加入40ml菌液离心后的细胞沉淀)。
图8是菌液除铅沉淀产物的扫描电镜图。
图9是细胞除铅沉淀产物的扫描电镜图。
图10是代谢产物除铅沉淀产物的扫描电镜图。
图11是150ml初始浓度300mg/l的铅溶液,菌液、代谢产物、细胞沉淀用量均为20ml对应的除铅实验。
图12是最终沉淀产物的xrd分析结果,表明最终生成物的物质组成为磷酸铅。
图13是经发酵培养后菌体表面官能团ftir分析。
图14是不同初始铅离子浓度下对应的除铅实验(菌液用量在图例中表示,不同形状表示不同的菌液用量)。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
以下结合具体实施例对本发明的具体实现进行详细描述:
实施例一:新菌种的获取
方法1:采花圃土壤过20目~50目筛,取10g过筛后的土壤加入到含90ml无菌水的锥形瓶内,并且放入小玻璃珠,振荡后使微生物细胞分散在溶液中,静置30s之后取上清液进行富集培养。富集培养采用了含200mg/l铅离子的液体lb培养基(每1000ml水中含有0.3197g硝酸铅、10g胰蛋白胨、5g酵母提取物和5g氯化钠),取培养基表面长势最好的菌落进行斜面保藏以备后期筛选试验。
方法2:采花圃土壤过20目~50目筛,取10g过筛后的土壤加入到含90ml无菌水的锥形瓶内,并且放入小玻璃珠,振荡后使微生物细胞分散在溶液中,静置30s之后取上清液进行涂布划线培养,涂布划线培养采用含100mg/l铅离子的固体lb培养基(每1000ml水中含有0.1598g硝酸铅、10g胰蛋白胨、5g酵母提取物、5g氯化钠和15g琼脂),取培养基表面长势最好的菌落进行斜面保藏以备后期筛选试验。
实施例二:新菌种的筛选
取实施例一中采用方法1或方法2获取的菌落,进行分离和发酵培养,发酵培养的培养基为每1000ml水中含有15g酵母提取物和10g氯化铵nh4cl,将发酵培养后的菌种添加到150ml含有300mg/l的铅溶液中进行除铅试验,如铅溶液中产生了紧密颗粒状的沉淀产物,则分离该沉淀,进行xrd测定,如沉淀证实为磷酸铅pb3(po4)2,则所述菌种为所需菌种。
实施例三:使用新菌种除去含铅溶液中的铅离子
配制发酵培养基,用接种环挑起上述实施例中筛选的单个菌落接种于发酵培养基中,20h后用所得的发酵后菌液加到铅溶液中去。铅溶液初始浓度为300mg/l,菌液用量10ml及以上,经过4天处理可以达到90%的铅离子去除率。
当然用量若增加,可以缩短处理时间即可达到90%的去除率。本发明人测试了铅离子初始浓度为100、200、300、400、500mg/l的实验,发现若需达到90%的去除率,则初始铅浓度越高,应该加入的菌液越多(见图14以及表2)
表2:各类物质的除铅实验结果
实施例四:各物质除铅对比试验
测试物质为菌液、代谢产物、细胞沉淀,用量均为20ml。菌液就是发酵培养基接种微生物之后,经过振荡培养箱在30℃,120r/min培养20h后得到的培养液;代谢产物是菌液经过10000r/min离心10min后得到的上清液;细胞是菌液经过10000r/min离心10min后得到的细胞沉淀,经过生理盐水悬浮后加到铅溶液中。试验结果如图所示(图2菌液除铅现象,图3细胞除铅现象,图4代谢产物除铅现象,图11是三类物质对应的铅离子去除率)。
实施例七:氯化铵对菌体生长和除铅效果的影响
如实施例二的方法筛选菌种,区别仅在于培养基中不含有氯化铵nh4cl,其余步骤相同,菌种生长的测定采用od600值来反映,即紫外分光光度计,将波长调至600nm。在10000r/min条件下将菌液离心10min,不含菌体细胞的上清液作为空白样品,未经离心含有菌体细胞的菌液做为待测样品。测定吸光度,吸光度越高代表菌体细胞浓度越大。
在不含氯化铵的培养基中,菌体生长更快(结果参见图5)。但因为后期去除率要低于含氯化铵的菌液,所以除铅实验只采用含氯化铵的菌液(见表2以及图14)。因为氯化铵会促进酶代谢,提高除铅效率,所以实验所用的菌液都是培养基中含有氯化铵的。而代谢产物和细胞沉淀也是含有氯化铵的菌液离心后得到的。
图14是初始铅离子浓度为100、200、300、400、500mg/l对应的除铅实验。每个初始浓度下对应了5种菌液用量。各条折线(不同的图形)表示不同的菌液用量(单位:ml)。例如100mg/l的各条折线对应菌液用量4、6、8、10、15ml(图14中第一张100mg/l)。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!