基于T4DNA聚合酶的西瓜花叶病毒检测传感器及其组装方法与流程
本发明属于病毒检测
技术领域:
,具体涉及一种基于t4dna聚合酶的西瓜花叶病毒检测传感器及其组装方法。
背景技术:
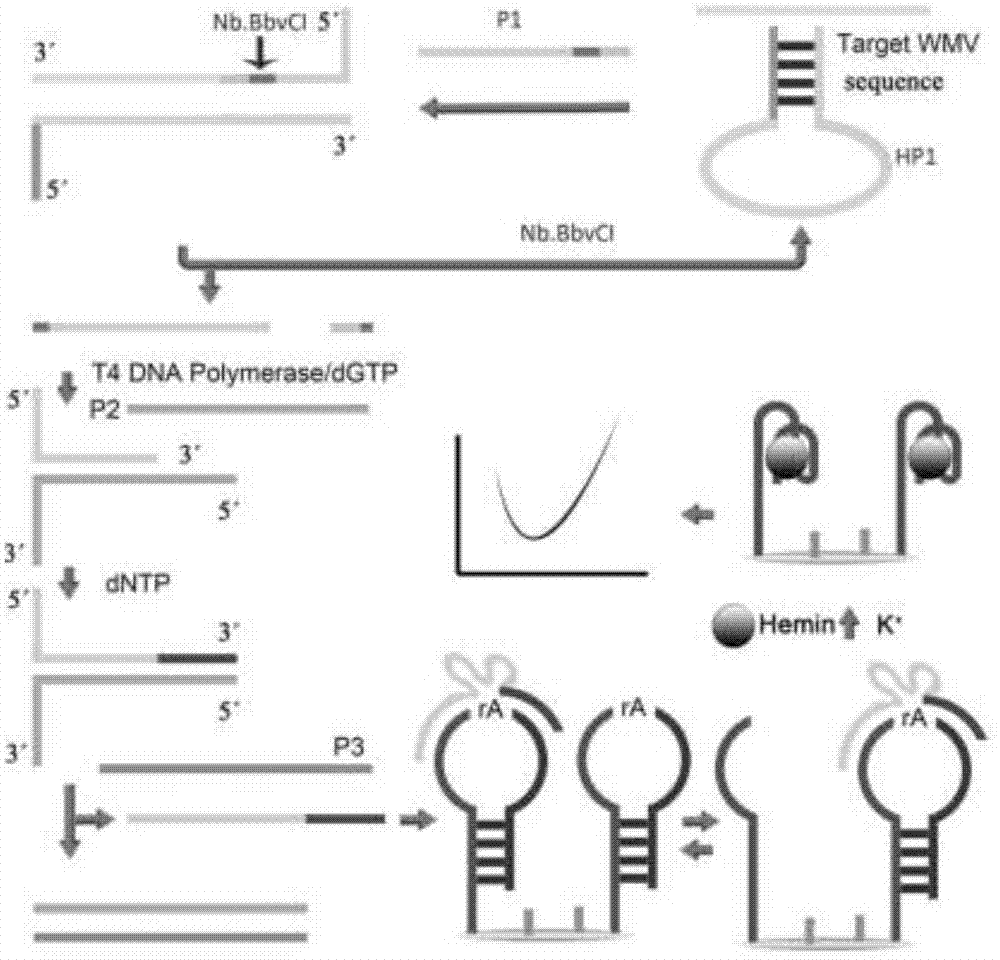
西瓜花叶病毒(watermelonmosaicvirus-2,wmv-2)为马铃薯y病毒科(potyviridae)马铃薯y病毒属(potyvirus)重要成员,在葫芦科和豆科作物中,它是重要的病毒之一,能够使受侵染的植物产量严重下降。目前,植物病毒的检测方法主要采用分子生物学和血清学检测。分子生物学检测技术灵敏度高,但存在rna抽提繁琐且易降解的问题。血清学检测由于其操作简单且能同时处理大量样品而被广泛采用,但需要购买价格昂贵的血清学检测试剂盒,并且检测结果的准确性取决于抗体的质量。由于生物样品中与疾病相关的基因组数量较少,因此建立超灵敏的dna或rna检测方法是十分必要的。电化学技术具有操作成本低、携带方便、灵敏度高、稳定性好等优点,广泛应用于多种病毒检测。在过去几年中,开发了许多基于核酸外切酶,内切核酸酶和聚合酶的无pcr方法的dna扩增技术。值得注意的是,切口核酸内切酶信号扩增,单链切口和聚合酶链延伸的结合,由于其在实际样品中的高灵敏度,低成本和自主循环扩增,因此在低丰度dna的检测中引起了极大的关注。聚合和断裂循环过程通常由多种酶操作,包括内切核酸酶,核酸外切酶和聚合酶等,以通过靶再循环操作促进信号放大。然而,通常使用没有二级结构的dna模板,这对靶dna的选择性没有优势,并且切口酶和聚合酶的识别位点重叠,这将延长反应时间。此外,产生的dna复制子可以与游离dna模板杂交,在一定程度上阻碍了对靶标的检测性能。因此,优化这种指数扩增系统以提高检测灵敏度和选择性,以及对电化学测量的适应性是非常重要的。t4dna聚合酶具有多种功能,包括5'→3'聚合酶活性和3'→5'外切酶活性,其聚合速率大于脱氢水解。t4dna聚合酶具有3'→5'外切酶活性,以ssdna或dsdna为模板,比dna聚合酶i中的活性更高。技术实现要素:本发明提供一种基于t4dna聚合酶的西瓜花叶病毒检测传感器及其组装方法。用于解决传统的内切/聚合反应获得产物能够与模板杂交,阻碍反应的进一步进行,进而在一定程度上阻碍了对靶标的检测性能的问题。本发明的技术方案为:一种基于t4dna聚合酶的西瓜花叶病毒检测传感器,包括:探针p1、探针p2、探针p3、发卡探针hp1、nb.bbvcⅰ、t4dna聚合酶、dgtp、dntp、发夹探针hp2、金电极;所述探针p1的基因序列如seqidno.1所示:seqidno.1:5′-acacacagcgatcacccatgcctcagctttt-3′;所述探针p2的基因序列如seqidno.2所示:seqidno.2:5′-gggtttaacatgggtgatcgaaatagtgggtg-3′;所述探针p3的基因序列如seqidno.3所示:seqidno.3:5′-cacccactatttcgatcacccatgttaaaccc-3′;所述发卡探针hp1的基因序列如seqidno.4所示:seqidno.4:5′-atgcctcagataagccacaaaaaaaagctgaggcat-3′;所述发夹探针hp2的基因序列如seqidno.5所示:seqidno.5:5′-sh5’-sh-(ch2)6-ttttgggttgggcgggatgggtttatraggtgtgtatcccgccc-3′。进一步地,一种基于t4dna聚合酶的西瓜花叶病毒检测传感器,所述t4dna聚合酶具有3′→5′外切酶活性和5′→3′聚合酶活性。本发明还提供了一种基于t4dna聚合酶的西瓜花叶病毒检测传感器的组装方法,包括以下步骤:(1)将目标dna溶液、探针p1溶液、发卡探针hp1溶液混合,室温孵育20-60min,利用目标dna与p1共同打开发夹探针hp1;(2)加入nb.bbvcⅰ溶液,室温孵育10-50min,利用nb.bbvcⅰ识别cctcagc位点,37℃酶切产生切口,获得p1-25和p1-6两个片段;(3)再加入探针p2溶液,使之与p1-25杂交,得到杂交产物;(4)降温至12℃,向所述杂交产物中加入t4dna聚合酶与dgtp混合溶液,进行3′→5′外切反应,外切反应结束后,加入dntp溶液进行5′→3′聚合反应;(5)聚合反应结束后,再加入探针p3溶液,使之与p2完全互补,即获得游离mg2+-依赖dnazyme的反应混合液;(6)将金电极表面进行抛光处理;(7)将发夹探针hp2溶液滴加于抛光处理后的金电极表面,37℃恒温孵育1h,将hp2通过au-s键连接到金电极上,加入mch封闭金电极;(8)将游离mg2+-依赖dnazyme的反应混合液滴加到hp2修饰的金电极表面上,37℃恒温孵育40min,使之与hp2的环杂交;(9)加入一定浓度的mg2+缓冲液,在mg2+存在下,mg2+-依赖dnazyme剪切其识别位点,将hp2的茎环结构剪切为两部分;(10)加入一定浓度的hemin和含k+缓冲液,反应40min,连接电极的部分在hemin和k+存在下变化为hemin/g-quadruplex-baseddnazyme;(11)再加入一定浓度的h2o2溶液,在h2o2存在下四聚体dnazyme模拟酶能够发生氧化还原反应,产生电流变化,从而指示信号;(12)以步骤(11)所得的金电极为工作电极,pt电极为对电极,sce电极作为参比电极,采用差分脉冲伏安法对电流进行检测,并记录i-t曲线;(13)根据不同浓度目标dna溶液的电流值为纵坐标,以对应的目标dna溶液浓度为横坐标,建立浓度标准曲线;(14)将电流值与目标dna溶液浓度进行线性拟合,确定线性范围和目标dna的检测限。进一步地,步骤(1)中所述探针p1溶液的浓度为0.25-1μmol/l。进一步地,步骤(4)中所述t4dna聚合酶的浓度为2-6u。进一步地,步骤(4)中t4dna聚合酶外切反应时间为10-20min。进一步地,步骤(4)中t4dna聚合酶聚合反应时间为10-20min。进一步地,步骤(1)中所述目标dna的基因序列如seqidno.6所示:seqidno.6:5′-ttttgtggcttatc-3′。进一步地,步骤(7)中探针hp2溶液的浓度为0.2-0.5μm。进一步地,步骤(14)中所述线性范围为50fm-1nm,最低检测限为50fm。与现有技术相比,本发明的有益效果为:(1)本发明利用t4dna聚合酶的外切和聚合功能对传统内切/聚合反应方法进行升级,得到的产物不会与模板进行杂交结合,进而影响进一步反应。(2)本发明的测体系线性范围为50fm-1nm,最低检测限为50fm,能够实现wmv的大田高灵敏快速检测。总之,本发明的电化学传感器具有特异性好、灵敏度高、反应速度快、干扰性小等优点。附图说明图1是本发明的电化学传感器组装反应流程图;图2是本发明实施例2的不同浓度目标dna的差分脉冲曲线图;其中,a:目标dna的浓度从上至下分别为0,50fm,100fm,500fm,1pm,10pm,100pm,1nm;图3是本发明实施例3的不同浓度目标dna的标准曲线图;图4是本发明实施例4中不同p1浓度值与电流值的关系图;图5是本发明实施例5中t4dna聚合酶外切反应时间与电流值关系图;图6是本发明实施例6中t4dna聚合酶聚合反应时间与电流值关系图;图7是本发明实施例7中不同hp2浓度值与电流值的关系图。具体实施方式下面结合实施例与附图对本发明做进一步说明,本发明不受下述实施例的限制。实施例1一种基于t4dna聚合酶的西瓜花叶病毒检测传感器,包括:探针p1、探针p2、探针p3、发卡探针hp1、nb.bbvcⅰ、t4dna聚合酶、dgtp、dntp、发夹探针hp2、金电极;各dna序列如下:所述探针p1的基因序列如seqidno.1所示:seqidno.1:5′-acacacagcgatcacccatgcctcagctttt-3′;所述探针p2的基因序列如seqidno.2所示:seqidno.2:5′-gggtttaacatgggtgatcgaaatagtgggtg-3′;所述探针p3的基因序列如seqidno.3所示:seqidno.3:5′-cacccactatttcgatcacccatgttaaaccc-3′;所述发卡探针hp1的基因序列如seqidno.4所示:seqidno.4:5′-atgcctcagataagccacaaaaaaaagctgaggcat-3′;所述发夹探针hp2的基因序列如seqidno.5所示:seqidno.5:5′-sh5’-sh-(ch2)6-ttttgggttgggcgggatgggtttatraggtgtgtatcccgccc-3′。一种基于t4dna聚合酶的西瓜花叶病毒检测传感器的组装方法,原理步骤如图1所示,包括以下步骤:1、将2μl目标dna(wmvcdna)溶液(0,50fm,100fm,500fm,1pm,10pm,100pm,1nm)、2μl探针p1溶液(0.8μm)、2μl发卡探针hp1溶液(0.4μm)混合,室温孵育50min,利用目标dna与p1共同打开发夹探针hp1;wmvcdna的基因序列如seqidno.6所示:seqidno.6:5′-ttttgtggcttatc-3′。(1)加入2μlnb.bbvcⅰ溶液(0.5μm),室温孵育40min,利用nb.bbvcⅰ识别cctcagc位点,37℃酶切产生切口,获得p1-25和p1-6两个片段;(2)再加入2μl探针p2溶液(0.8μm),使之与p1-25杂交,得到杂交产物;(3)降温至12℃,向所述杂交产物中加入4μlt4dna聚合酶(6u)与2μldgtp混合溶液(0.5μm),进行3′→5′外切反应,t4dna聚合酶外切反应时间为15min,外切反应结束后,加入2μldntp(0.5μm)溶液进行5′→3′聚合反应,t4dna聚合酶聚合反应时间为20min;(4)聚合反应结束后,再加入2μl探针p3溶液(0.8μm),使之与p2完全互补,即获得游离mg2+-依赖dnazyme的反应混合液;(5)将金电极利用水刀磨料射流抛光技术抛光至镜面,并用pbs和灭菌水冲洗;(6)将10μl发夹探针hp2溶液(0.5μm)滴加于抛光处理后的金电极表面,37℃恒温孵育1h,将hp2通过au-s键连接到金电极上,加入mch封闭金电极;(7)吸取20μl游离mg2+-依赖dnazyme的反应混合液滴加到hp2修饰的金电极表面上,37℃恒温孵育1.5h,使之与hp2的环杂交;(8)加入1μlmg2+缓冲液(50μm),在mg2+存在下,mg2+-依赖dnazyme剪切其识别位点,将hp2的茎环结构剪切为两部分;(9)加入1μl的hemin(0.3μm)和5μl含k+缓冲液(11mm),反应40min,连接电极的部分在hemin和k+存在下变化为hemin/g-quadruplex-baseddnazyme;(10)再加入2μl的h2o2溶液,在h2o2存在下四聚体dnazyme模拟酶能够发生氧化还原反应,产生电流变化,从而指示信号。实施例2以实施例1中最后所得的金电极为工作电极,pt电极为对电极,sce电极作为参比电极,采用差分脉冲伏安法对电流进行检测,并记录i-t曲线;结果如图2所示,电流值的大小与目标dna(wmvcdna)浓度呈正相关关系。实施例3根据实施1中不同浓度目标dna(wmvcdna)溶液的电流值为纵坐标,以对应的目标dna溶液浓度为横坐标,建立浓度标准曲线;结果如图3所示,将电流值与目标dna溶液浓度进行线性拟合得到一条直线,线性相关度在0.99以上,采用3σ法对检测限进行计算,得到线性范围为50fm-1nm,最低检测限为50fm。实施例4研究不同p1浓度对电流信号的影响,其中目标dna的浓度为10pm;以实施例1为参照,设置6个对照组,每组设置三个平行,其余条件均相同,采用差分脉冲伏安法读取电信号的变化,实施例1与6个对照组的p1浓度与电流值如表1所示:表1:各组的p1浓度值与电流值组别p1浓度电流值实施例10.8μm1.29μa对比例10.2μm0.42μa对比例20.4μm0.66μa对比例30.6μm1.05μa对比例41.0μm1.47μa对比例51.2μm1.50μa对比例61.4μm1.53μa以p1浓度值为横坐标,以电流值为纵坐标,做折线图,如图4所示。从图4中可以看出,检测到的电流值随着p1浓度值在0.2-1.0μm区间内增大而增大,当浓度超过1.0μm后,电流趋于稳定。由此可知,p1浓度值最佳为1.0μm。实施例5研究t4dna聚合酶外切反应时间对电流信号的影响,其中目标dna的浓度为10pm;以实施例1为参照,设置6个对照组,每组设置三个平行,其余条件均相同,采用差分脉冲伏安法读取电信号的变化,实施例1与6个对照组的t4dna聚合酶外切反应时间与电流值如表2所示:表2:各组的t4dna聚合酶外切反应时间与电流值以t4dna聚合酶外切反应时间为横坐标,以电流值为纵坐标,做折线图,如图5所示。从图5中可以看出,检测到的电流值随着t4dna聚合酶外切反应时间在5-20min区间内增大而增大,当外切反应时间超过20min后,电流趋于稳定。由此可知,外切反应时间最佳为20min。实施例6研究t4dna聚合酶聚合反应时间对电流信号的影响,其中目标dna的浓度为10pm;以实施例1为参照,设置6个对照组,每组设置三个平行,其余条件均相同,采用差分脉冲伏安法读取电信号的变化,实施例1与6个对照组的t4dna聚合酶聚合反应时间与电流值如表3所示:表3:各组的t4dna聚合酶聚合反应时间与电流值组别聚合反应时间电流值实施例120min1.49μa对比例15min0.40μa对比例210min0.9μa对比例315min1.28μa对比例425min1.52μa对比例530min1.58μa对比例635min1.62μa以t4dna聚合酶聚合反应时间为横坐标,以电流值为纵坐标,做折线图,如图6所示。从图6中可以看出,检测到的电流值随着t4dna聚合酶聚合反应时间在5-25min区间内增大而增大,当外切反应时间超过25min后,电流趋于稳定。由此可知,外切反应时间最佳为25min。实施例7研究不同hp2浓度对电流信号的影响,其中目标dna的浓度为10pm;以实施例1为参照,设置6个对照组,每组设置三个平行,其余条件均相同,采用差分脉冲伏安法读取电信号的变化,实施例1与6个对照组的hp2浓度与电流值如表4所示:表4:各组的hp2浓度与电流值组别hp2浓度电流值实施例10.5μm1.53μa对比例10.1μm0.29μa对比例20.2μm0.72μa对比例30.3μm1.02μa对比例40.4μm1.20μa对比例50.6μm1.54μa对比例60.7μm1.56μa以hp2浓度值为横坐标,以电流值为纵坐标,做折线图,如图7所示。从图7中可以看出,检测到的电流值随着p1浓度值在0.2-0.5μm区间内增大而增大,当浓度超过0.5μm后,电流趋于稳定。由此可知,hp2浓度值最佳为0.5μm。上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。序列表<110>临沂大学<120>一种基于t4dna聚合酶的西瓜花叶病毒检测传感器<141>2018-08-08<160>6<170>siposequencelisting1.0<210>1<211>31<212>dna<213>a<220><221>misc_feature<222>(1)..(31)<223>探针p1的基因序列<400>1acacacagcgatcacccatgcctcagctttt31<210>2<211>32<212>dna<213>a<220><221>misc_feature<222>(1)..(32)<223>探针p2的基因序列<400>2gggtttaacatgggtgatcgaaatagtgggtg32<210>3<211>32<212>dna<213>a<220><221>misc_feature<222>(1)..(32)<223>探针p3的基因序列<400>3cacccactatttcgatcacccatgttaaaccc32<210>4<211>36<212>dna<213>a<220><221>misc_feature<222>(1)..(36)<223>发卡探针hp1的基因序列<400>4atgcctcagataagccacaaaaaaaagctgaggcat36<210>5<211>44<212>dna<213>a<220><221>misc_feature<222>(1)..(44)<223>发夹探针hp2的基因序列<400>5ttttgggttgggcgggatgggtttatraggtgtgtatcccgccc44<210>6<211>14<212>dna<213>a<220><221>misc_feature<222>(1)..(14)<223>目标dna的基因序列<400>6ttttgtggcttatc14当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1