可快速固化的双交联水凝胶及其制备方法与应用与流程
本发明涉及一种双交联水凝胶,具体涉及一种三维的干细胞的培养,并促使所述干细胞进行增殖和分化的双交联水凝胶及其制备方法与应用,属于组织工程材料制备技术领域。
背景技术:
人体组织损伤、缺损会导致功能障碍。随着科学技术的发展,组织工程已成为修复损伤组织的一种重要手段。组织工程是指运用工程学和生命科学的原理和方法,研究正常和病理条件下组织结构与功能的关系,开发生物替代品,修复、维持和改善组织功能;其基本策略为使用细胞、生物材料和生长因子,通过体外的培养与构建策略,重建组织结构和功能应用工程学和生命科学的原理,开发能够恢复、维持或改善组织功能的生物替代品。
目前,组织工程主要思路是将功能相关的活细胞接种于细胞外基质替代物上,这种替代物能为细胞提供一个空间结构,细胞能够在上面生长,通过体外培养一定时间后形成细胞与替代物的复合物,然后将得到的复合物移植到体内受损组织处,修复受损组织。近年来,组织工程的研究内容主要集中在开发研究生物材料、生长因子、种子细胞培养及细胞与支架材料的复合及塑形等方面。
目前组织工程中细胞接种的常用方法包括:细胞接种于支架材料上和细胞与材料共混成水凝胶支架,其中细胞与材料共混能更好的控制细胞的分布,而且在细胞粘附、增殖、迁移与立体结构方面有诸多优势;此外通过控制共混水凝胶支架的形状可以提高组织修复的精确度和准确度。但为了确保细胞的活性通常需要寻找具有较高生物相容性的材料。
干细胞具有高增殖率、多分化潜能以及低免疫原性等特性,是最理想的组织工程用种子细胞。组织工程常用的包埋细胞的水凝胶材料包括明胶、胶原、透明质酸、壳聚糖、海藻酸盐、聚乳酸、聚己内酯等。高分子化合物具有较多的活性官能团,可以对其进行化学修饰,从而用不同的方法形成水凝胶,另外,通过调节水凝胶支架的性质,例如在水凝胶支架中掺杂细胞外基质,可能会增加细胞的黏附和趋化宿主细胞的迁移,同时也可能会增加种子细胞的分化能力。但多数人工合成高分子材料生物相容性低,降解不彻底,而天然的高分子材料降解速率较快,机械性能较差;因此,寻找生物相容性好以及可降解的材料作为三维培养细胞的支架尤为重要。
技术实现要素:
本发明的主要目的在于提供一种可快速固化的双交联水凝胶及其制备方法,以克服现有技术中的不足。
本发明的另一个目的在于提供所述可快速固化的双交联水凝胶的应用。
为实现上述发明目的,本发明采用了如下技术方案:
本发明实施例提供了一种可快速固化的双交联水凝胶的制备方法,包括以下步骤:
(1)至少将结冷胶与甲基丙烯酸酐混合反应,获得双键修饰的结冷胶;
(2)至少将甲基丙烯酸缩水甘油酯与胶原混合反应,获得双键修饰的胶原;
(3)至少将所述双键修饰的结冷胶与光引发剂及所述双键修饰的胶原混合,并于二价离子浴中浸泡获得离子交联的水凝胶,之后进行光引发反应,获得紫外光二次固化的双交联水凝胶。
本发明实施例还提供了由前述方法制备的可快速固化的双交联水凝胶。
本发明实施例还提供了前述的可快速固化的双交联水凝胶于细胞培养或组织工程领域的用途。
本发明实施例还提供了一种三维细胞培养载体,其包含前述的可快速固化的双交联水凝胶。
本发明实施例还提供了一种细胞培养方法,其包括:
以前述的可快速固化的双交联水凝胶作为三维细胞培养载体进行干细胞的培养,并促使所述干细胞进行增殖和分化。
较之现有技术,本发明的有益效果在于:
1)本发明提供的基于功能化结冷胶和胶原体系构建可快速固化的双交联水凝胶的方法,将其应用于干细胞的增殖与血管分化研究,实现了与细胞共混凝胶化。将甲基丙烯酸酐和甲基丙烯酸缩水甘油酯分别修饰在结冷胶和鼠尾胶原上,获得双键修饰且可水溶的结冷胶和胶原,通过引入胶原,可以提高干细胞在支架上的粘附、增殖。
2)本发明提供的可快速固化的双交联水凝胶,为物理和化学双交联水凝胶,结合了两种交联方式,其优点在于利用结冷胶对二价离子的快速响应性制备凝胶,进一步通过光交联实现凝胶二次固化,提高凝胶的机械性能,且固化时间短,同时制备方法简单,可大量制备。
3)本发明的可快速固化的双交联水凝胶,将鼠尾来源的胶原材料与常用的食品添加剂结冷胶进行双键化修饰,之后复合并与细胞共混,将胶原和结冷胶相结合,提高细胞的粘附、增殖以及迁移作用,所获的双交联水凝胶的固化时间短、内部孔隙分布均匀、生物相容性好、毒性低,其内部孔径100-300μm,适合营养物质和细胞代谢物流通,为干细胞的存活和增殖提供良好的三维支撑生存环境,同时,由于胶原的引入,能进一步提高干细胞在三维支架上的粘附和增殖,通过加入促血管化生长因子(vegf/bfgf),有效促进干细胞分化成血管内皮细胞。
附图说明
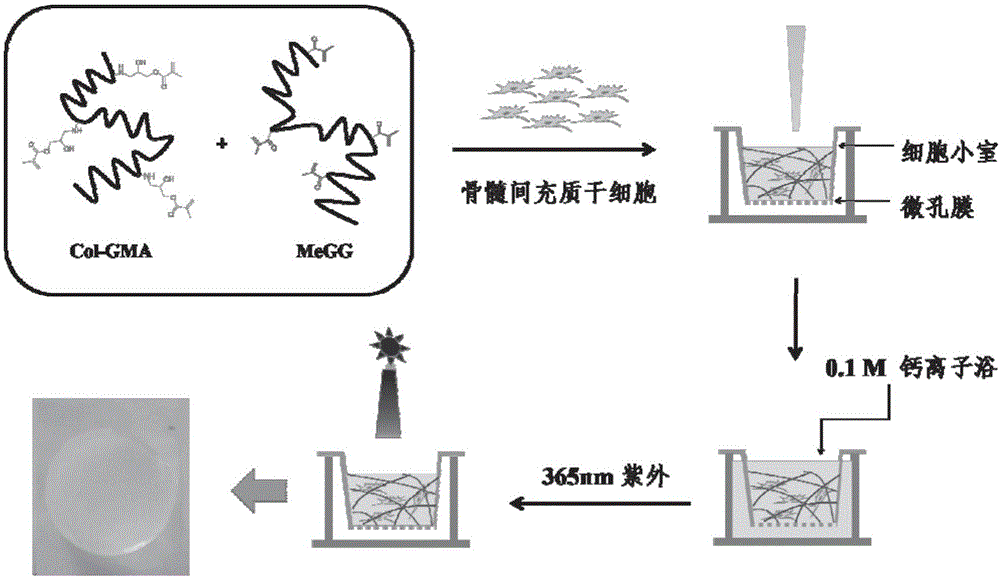
图1是本发明一典型实施例中所获双交联水凝胶的制备机理示意图。
图2是本发明一典型实施例中所获双交联水凝胶的外观图和微观结构图。
图3是本发明一典型实施例中所获双交联水凝胶的溶胀图。
图4是本发明一典型实施例中所获双交联水凝胶的体外降解图。
图5是干细胞在本发明一典型实施例中所获双交联水凝胶的流变图。
图6a、6b、6c分别是干细胞在本发明一典型实施例中所获双交联水凝胶中的增殖图、生长共聚焦图以及三维扫描图。
图7a、7b、7c、7d是干细胞在本发明一典型实施例中所获双交联水凝胶中向血管内皮细胞分化的mrna表达水平图。
具体实施方式
针对现有技术的诸多缺陷,本案发明人经长期研究和大量实践,得以提出本发明的技术方案。如下将对该技术方案、其实施过程及原理等作进一步的解释说明。但是,应当理解,在本发明范围内,本发明的上述各技术特征和在下文(实施例)中具体描述的各技术特征之间都可以相互结合,从而构成新的或者优选的技术方方案。限于篇幅,在此不再一一累述。
作为本发明技术方案的一个方面,其所涉及的系一种可快速固化的双交联水凝胶的制备方法,包括以下步骤:
(1)至少将结冷胶与甲基丙烯酸酐混合反应,获得双键修饰的结冷胶;
(2)至少将甲基丙烯酸缩水甘油酯与胶原混合反应,获得双键修饰的胶原;
(3)至少将所述双键修饰的结冷胶与光引发剂及所述双键修饰的胶原混合,并于二价离子浴中浸泡获得离子交联的水凝胶,之后进行光引发反应,获得紫外光二次固化的双交联水凝胶。
在一些实施方案中,步骤(1)包括:使包含体积比为100∶2~8的结冷胶与甲基丙烯酸酐的第一混合体系于50-60℃反应4~6h,并维持反应体系的ph值为7~9,获得双键修饰的结冷胶。
在一些实施方案中,步骤(1)还包括:在所述的反应结束后,将所获反应混合物透析1~3天,之后冷冻干燥,获得双键修饰的结冷胶;
进一步地,所述透析采用的透析袋的截留分子量为7000~14000kda。
在一些优选的实施方案中,步骤(1)具体包括:于温度为70-90℃的条件下,将结冷胶溶解于去离子水中形成浓度为1-2w/v%的均一透明的溶液,随后降温至50-60℃,再将甲基丙烯酸酐滴加入到结冷胶溶液中形成第一混合体系并进行所述的反应,并维持反应体系的ph值为7~9。
在一些优选的实施方案中,所述结冷胶与甲基丙烯酸酐的体积比为100∶2~8。
进一步地,其ph值优选为8。
进一步地,具体包括:具体包括:以碱性物质调节调节所述反应体系的ph值为7~9。
更进一步地,所述碱性物质包括浓度为2~5mol/l的naoh溶液。
在一些实施方案中,步骤(2)包括:使包含摩尔比为60-80∶1的胶原与甲基丙烯酸缩水甘油酯的第二混合体系于室温反应10-30h,获得双键修饰的胶原。
在一些较为优选的实施方案中,步骤(2)具体包括:将胶原溶解于浓度为1~2w/v%的醋酸溶液中,随后调节所获胶原溶液的ph值至7-8,再滴加入甲基丙烯酸缩水甘油酯,形成所述的第二混合体系。
在一些较为优选的实施方案中,步骤(2)具体包括:将胶原溶解于浓度为1~2w/v%的醋酸溶液,之后加入有机碱、表面活性剂和甲基丙烯酸缩水甘油酯,并混合均匀,获得第二混合体系。
进一步地,所述有机碱与甲基丙烯酸缩水甘油酯的摩尔比为1~1.5∶1。
进一步地,所述有机碱包括三乙胺,但不限于此。
进一步地,所述表面活性剂包括吐温20。
进一步地,所述第二混合体系还包含0.05~0.15v/v%的表面活性剂,亦即,所述表面活性剂与第二混合体系的体积比为0.05~0.15∶100。
进一步较为具体的实施方案中,步骤(2)还包括:在所述的反应结束后,将所获反应混合物与乙醇按照1∶10~20的体积比混合,并收集沉淀,随后将收集的沉淀重新溶于去离子水,冷冻干燥获得双键修饰的胶原。
在一些实施方案中,步骤(3)包括:将所述双键修饰的结冷胶溶解于磷酸盐缓冲溶液中,随后加入光引发剂和双键修饰的胶原,混合均匀后于0.1~0.2mol/l的钙离子浴中浸泡1~3min形成离子交联的水凝胶,随后在波长300~500nm、光强5~10mw/cm2下进行光引发反应3~5min,获得紫外光二次固化水凝胶。
在一些较为优选的实施方案中,步骤(3)具体包括:将所述双键修饰的结冷胶按照1-3wt%:1的质量比溶解于磷酸盐缓冲溶液中,并加入光引发剂形成光引发反应体系,之后于30-40℃按照1-3mg/ml的浓度加入双键修饰的胶原,混合均匀后转移到模具中,于0.1~0.2mol/l的钙离子浴中浸泡1~3min形成离子交联的水凝胶,随后在波长300~500nm、光强5~10mw/cm2下进行光引发反应3~5min,获得紫外光二次固化水凝胶。
其中,用ca2+浴进行离子交联,以及用300~500nm紫外光引发双键交联反应。
在一些实施方案中,所述光引发剂包括光引发剂i2959,即2-羟基-4′-(2-羟基乙氧基)-2-甲基苯丙酮。
在一些实施方案中,所述光引发剂在光引发反应体系中的浓度为0.1~1w/v%,优选为0.3~0.6w/v%。
在一些实施方案中,双键修饰的结冷胶具有双键结构,双键修饰的结冷胶的结构式如式(1)所示:
双键修饰的胶原具有双键结构,双键修饰的胶原的结构式如式(2)所示:
其中,collagen为鼠尾胶原。
本发明实施例还提供一种由前述方法制备的可快速固化的双交联水凝胶,所述双交联水凝胶机械强度为1kpa,并具有多孔结构,其中所含孔洞的孔径为100~300μm。
本发明实施例还提供了前述的可快速固化的双交联水凝胶于细胞培养领域或组织工程领域中的用途。
本发明实施例还提供一种三维细胞培养载体,包含前述的可快速固化的双交联水凝胶。
本发明实施例还提供一种细胞培养方法,包括:
以前述的可快速固化的双交联水凝胶作为三维细胞培养载体进行干细胞的培养,并促使所述干细胞进行增殖和分化。
在一些实施方案中,所述干细胞于所述双交联水凝胶上的负载量为100-1000万个/ml。
藉由上述技术方案,本发明的双交联水凝胶将鼠尾来源的胶原材料与常用的食品添加剂结冷胶进行双键化修饰,之后复合并与细胞共混,将胶原和结冷胶相结合,提高细胞的粘附作用、增殖以及迁移作用,所获的双交联水凝胶的固化时间短、内部孔隙分布均匀、生物相容性好、毒性低、可给细胞提供所需的三维生存环境,提高干细胞在三维支架上的粘附和增殖,并且实现血管内皮细胞的分化;同时制备方法简单,可大量制备。
下面结合若干优选实施例及附图对本发明的技术方案做进一步详细说明,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。以下实施例中采用的实施条件可以根据实际需要而做进一步调整,未注明的实施条件通常为常规实验中的条件。
实施例1
步骤一:将结冷胶溶于去离子水中,升温至90℃得到浓度为1w/v%的均一透明的溶液,随后降温至50℃,逐滴加入甲基丙烯酸酐,反应6h,并维持ph为8。
其中,甲基丙烯酸酐与结冷胶的体积比为3∶100,反应过程中用5mol/l的naoh溶液维持溶液的ph值在8左右。
步骤一反应结束后用14000kda截留量透析除去未反应的甲基丙烯酸酐,-80℃冷冻过夜,-50℃冷冻干燥3d,获得双键修饰的结冷胶,双键修饰的结冷胶的结构式如(1)所示:
这种双键修饰的结冷胶是由甲基丙烯酸酐修饰的化合物,其接枝率为60%。
这种双键修饰的结冷胶是一种由甲基丙烯酸酐修饰的化合物,双键修饰的结冷胶主要是在糖分子上修饰上双键,降低了相变温度,使本来在50-45℃发生相变形成水凝胶调整到25℃左右形成水凝胶,有利于与细胞共混。
步骤二:将鼠尾胶原溶解于1%醋酸溶液中,并依次加入甲基丙烯酸缩水甘油酯、三乙胺、吐温20室温反应24h。其中所述鼠尾胶原与甲基丙烯酸缩水甘油酯的摩尔比为75∶1,三乙胺与甲基丙烯酸缩水甘油酯的摩尔比为1.5∶1,吐温20与该混合体系的体积比为0.05∶100。
步骤二的反应结束后,在15倍体积的无水乙醇中沉淀,得到白色絮状沉淀,12000rpm离心5min收沉淀,用去离子水溶解上述沉淀,随后12000rpm离心5min去除没有溶解的絮状物,-80℃冷冻过夜,-50℃冷冻干燥3d,获得双键修饰的胶原,双键修饰的胶原结构式如式(2)所示:
这种双键修饰的胶原是一种由甲基丙烯酸缩水甘油酯修饰的化合物,双键修饰的胶原主要是在胶原分子上修饰上双键,改善了其水溶性,提高胶原在水中的溶解性。
步骤三:将上述双键修饰的结冷胶配成浓度为2%的pbs溶液,于30℃加入上述双键修饰的胶原,胶原的浓度为2mg/ml,再加入0.5%的光引发剂12959,混合均匀后转移到模具中,在0.1mol/l的ca2+浴中交联1mim,形成离子交联的水凝胶,然后在365nm紫外光光强不低于7mw/cm2下光照交联3min形成离子与光固化双交联水凝胶。
实施例2
步骤一:将结冷胶溶于去离子水中,升温至90℃得到浓度为2w/v%的均一透明的溶液,随后降温至50℃,逐滴加入甲基丙烯酸酐,反应6h,并维持ph为8左右。
其中,甲基丙烯酸酐与结冷胶的体积比为3∶100,反应过程中用5mol/l的naoh溶液维持溶液的ph值在8左右。
步骤一反应结束后用7000kda截留量透析除去未反应的甲基丙烯酸酐,-80℃冷冻过夜,-50℃冷冻干燥3d,获得双键修饰的结冷胶,双键修饰的结冷胶的结构式如(1)所示:
这种双键修饰的结冷胶是由甲基丙烯酸酐修饰的化合物,其接枝率为60%。
这种双键修饰的结冷胶是一种由甲基丙烯酸酐修饰的化合物,双键修饰的结冷胶主要是在糖分子上修饰上双键,降低了相变温度,使本来在50-45℃发生相变形成水凝胶调整到25℃左右形成水凝胶,有利于与细胞共混。
步骤二:将鼠尾胶原溶解于1%醋酸溶液中,并依次加入甲基丙烯酸缩水甘油酯、三乙胺、吐温20室温反应10h。其中所述鼠尾胶原与甲基丙烯酸缩水甘油酯的摩尔比为60∶1,三乙胺与甲基丙烯酸缩水甘油酯的摩尔比为1∶1,吐温20与该混合体系的体积比为0.15∶100。
步骤二的反应结束后,在15倍体积的无水乙醇中沉淀,得到白色絮状沉淀,12000rpm离心5min收沉淀,用去离子水溶解上述沉淀,随后12000rpm离心5min去除没有溶解的絮状物,-80℃冷冻过夜,-50℃冷冻干燥3d,获得双键修饰的胶原,双键修饰的胶原结构式如式(2)所示:
这种双键修饰的胶原是一种由甲基丙烯酸缩水甘油酯修饰的化合物,双键修饰的胶原主要是在胶原分子上修饰上双键,改善了其水溶性,使本只能溶于酸性环境中的胶原溶解在水相中。
步骤三:将上述双键修饰的结冷胶配成浓度为2%的pbs溶液,于40℃加入上述双键修饰的胶原,胶原的浓度为1mg/ml,再加入0.5%的光引发剂i2959,混合均匀后转移到模具中,在0.1mol/l的ca2+浴中交联1mim,形成离子交联的水凝胶,然后在365nm紫外光光强不低于7mw/cm2下光照交联3min形成离子与光固化双交联水凝胶。
实施例3
步骤一:将结冷胶溶于去离子水中,升温至70℃得到浓度为1w/v%的均一透明的溶液,随后降温至50℃,逐滴加入甲基丙烯酸酐,反应6h,并维持ph为8。
其中,甲基丙烯酸酐与结冷胶的体积比为2∶100,反应过程中用2mol/l的naoh溶液维持溶液的ph值在7左右。
步骤一反应结束后用14000kda截留量透析除去未反应的甲基丙烯酸酐,-80℃冷冻过夜,-50℃冷冻干燥3d,获得双键修饰的结冷胶,双键修饰的结冷胶的结构式如(1)所示:
这种双键修饰的结冷胶是由甲基丙烯酸酐修饰的化合物,其接枝率为60%。
这种双键修饰的结冷胶是一种由甲基丙烯酸酐修饰的化合物,双键修饰的结冷胶主要是在糖分子上修饰上双键,降低了相变温度,使本来在50-45℃发生相变形成水凝胶调整到25℃左右形成水凝胶,有利于与细胞共混。
步骤二:将鼠尾胶原溶解于2%醋酸溶液中,并依次加入甲基丙烯酸缩水甘油酯、三乙胺、吐温20室温反应30h。
其中,所述鼠尾胶原与甲基丙烯酸缩水甘油酯的摩尔比为80∶1,三乙胺与甲基丙烯酸缩水甘油酯的摩尔比为1.5∶1,吐温20与该混合体系的体积比为0.15∶100。
步骤二的反应结束后,在10倍体积的无水乙醇中沉淀,得到白色絮状沉淀,12000rpm离心5min收沉淀,用去离子水溶解上述沉淀,随后12000rpm离心5min去除没有溶解的絮状物,-80℃冷冻过夜,-50℃冷冻干燥3d,获得双键修饰的胶原,双键修饰的胶原结构式如式(2)所示:
这种双键修饰的胶原是一种由甲基丙烯酸缩水甘油酯修饰的化合物,双键修饰的胶原主要是在胶原分子上修饰上双键,改善了其水溶性,使本只能溶于酸性环境中的胶原溶解在水相中。
步骤三:将上述双键修饰的结冷胶配成浓度为2%的pbs溶液,于35℃加入上述双键修饰的胶原,胶原的浓度为2mg/ml,再加入0.5%的光引发剂i2959,混合均匀后转移到模具中,在0.1mol/l的ca2+浴中交联1mim,形成离子交联的水凝胶,然后在365nm紫外光光强为5mw/cm2下光照交联3min形成离子与光固化双交联水凝胶。
实施例4
步骤一:将结冷胶溶于去离子水中,升温至80℃得到浓度为2w/v%的均一透明的溶液,随后降温至60℃,逐滴加入甲基丙烯酸酐,反应6h,并维持ph为8。
其中,甲基丙烯酸酐与结冷胶的体积比为8∶100,反应过程中用5mol/l的naoh溶液维持溶液的ph值在9左右。
步骤一反应结束后用14000kda截留量透析除去未反应的甲基丙烯酸酐,-80℃冷冻过夜,-50℃冷冻干燥3d,获得双键修饰的结冷胶,双键修饰的结冷胶的结构式如(1)所示:
这种双键修饰的结冷胶是由甲基丙烯酸酐修饰的化合物,其接枝率为60%。
这种双键修饰的结冷胶是一种由甲基丙烯酸酐修饰的化合物,双键修饰的结冷胶主要是在糖分子上修饰上双键,降低了相变温度,使本来在50-45℃发生相变形成水凝胶调整到25℃左右形成水凝胶,有利于与细胞共混。
步骤二:将鼠尾胶原溶解于1%醋酸溶液中,并依次加入甲基丙烯酸缩水甘油酯、三乙胺、吐温20室温反应24h。其中所述鼠尾胶原与甲基丙烯酸缩水甘油酯的摩尔比为75∶1,三乙胺与甲基丙烯酸缩水甘油酯的摩尔比为1.5∶1,吐温20与该混合体系的体积比为0.15∶100。
步骤二的反应结束后,在20倍体积的无水乙醇中沉淀,得到白色絮状沉淀,12000rpm离心5min收沉淀,用去离子水溶解上述沉淀,随后12000rpm离心5min去除没有溶解的絮状物,-80℃冷冻过夜,-50℃冷冻干燥3d,获得双键修饰的胶原,双键修饰的胶原结构式如式(2)所示:
这种双键修饰的胶原是一种由甲基丙烯酸缩水甘油酯修饰的化合物,双键修饰的胶原主要是在胶原分子上修饰上双键,改善了其水溶性,使本只能溶于酸性环境中的胶原溶解在水相中。
步骤三:将上述双键修饰的结冷胶配成浓度为2%的pbs溶液,加入0.5%的光引发剂i2959,再于40℃加入上述双键修饰的胶原,胶原的浓度为2mg/ml,混合均匀后转移到模具中,在0.1mol/l的ca2+浴中交联1mim,形成离子交联的水凝胶,然后在365nm紫外光光强为10mw/cm2下光照交联3min形成离子与光固化双交联水凝胶。
实施例5
步骤一:将结冷胶溶于去离子水中,升温至90℃得到浓度为2w/v%的均一透明的溶液,随后降温至50℃,逐滴加入甲基丙烯酸酐,反应4h,并维持ph为8。
其中,甲基丙烯酸酐与结冷胶的体积比为3∶100,反应过程中用5mol/l的naoh溶液维持溶液的ph值在8左右。
步骤一反应结束后用14000kda截留量透析除去未反应的甲基丙烯酸酐,-80℃冷冻过夜,-50℃冷冻干燥1d,获得双键修饰的结冷胶,双键修饰的结冷胶的结构式如(1)所示:
这种双键修饰的结冷胶是由甲基丙烯酸酐修饰的化合物,其接枝率为60%。
这种双键修饰的结冷胶是一种由甲基丙烯酸酐修饰的化合物,双键修饰的结冷胶主要是在糖分子上修饰上双键,降低了相变温度,使本来在50-45℃发生相变形成水凝胶调整到25℃左右形成水凝胶,有利于与细胞共混。
步骤二:将鼠尾胶原溶解于1%醋酸溶液中,并依次加入甲基丙烯酸缩水甘油酯、三乙胺、吐温20室温反应24h。其中所述鼠尾胶原与甲基丙烯酸缩水甘油酯的摩尔比为75∶1,三乙胺与甲基丙烯酸缩水甘油酯的摩尔比为1∶1,吐温20与该混合体系的体积比为0.15∶100。
步骤二的反应结束后,在15倍体积的无水乙醇中沉淀,得到白色絮状沉淀,12000rpm离心5min收沉淀,用去离子水溶解上述沉淀,随后12000rpm离心5min去除没有溶解的絮状物,-80℃冷冻过夜,-50℃冷冻干燥3d,获得双键修饰的胶原,双键修饰的胶原结构式如式(2)所示:
这种双键修饰的胶原是一种由甲基丙烯酸缩水甘油酯修饰的化合物,双键修饰的胶原主要是在胶原分子上修饰上双键,改善了其水溶性,提高胶原在水中的溶解性。步骤三:将上述双键修饰的结冷胶配成浓度为2%的pbs溶液,加入上述双键修饰的胶原,胶原的浓度为2mg/ml,再加入0.5%的光引发剂i2959,混合均匀后转移到模具中,在0.2mol/l的ca2+浴中交联3mim,形成离子交联的水凝胶,然后在365nm紫外光光强不低于7mw/cm2下光照交联5min形成离子与光固化双交联水凝胶。
上述步骤一至步骤三可通过图1表示。
性能测试一
在场环扫描电镜测试仪上测试本实施例所获双交联水凝胶内部结构及孔径大小,其操作方法包括:
将上述双交联水凝胶液氮冷冻,-50℃冷冻干燥24h,0.2ma喷金3min,扫描电镜观察水凝胶微观形貌图(如图2所示)。通过扫描电镜可以看出,该双交联水凝胶微观结构多孔,孔径约100~300μm。
性能测试二
将上述双键修饰的结冷胶用pbs配成浓度为2%的溶液,加入上述双键修饰的胶原,胶原的浓度为2mg/ml,再加入0.5%的光引发剂i2959,混合均匀后转移到模具中,在0.1mol/l的ca2+浴中交联1mim,形成离子交联的水凝胶,然后在365nm紫外光光强不低于7mw/cm2下光照交联3min形成离子与光固化双交联水凝胶,将该水凝胶浸泡于2mlpbs中于37℃温和振荡,然后从pbs中提取水凝胶(n=3),在24小时内不同时间点用滤纸快速擦拭水凝胶表面。然后,测量各水凝胶的湿重(wt),并与初始湿重(w0)进行比较,研究所制备的水凝胶的溶胀动力学,通过溶胀结果图3可以看出上述双交联水凝胶在pbs中会发生收缩,5h左右达到平衡状态,收缩率为26%
性能测试三
将上述双交联水凝胶浸泡于2mlpbs中于37℃温和振荡,并且每3天更换pbs,体外降解一个月,每周从pbs中取出水凝胶(n=3),于液氮中冷冻,随后-50℃冷冻干燥24h,测量各水凝胶的干重(w2),并与初始干重(w1)进行比较,研究所制备的水凝胶在体外降解速率,通过体外降解结果图4可以看出上述双交联水凝胶在pbs中会发生降解,一个月后质量损失25%左右。
性能测试四
将上述双交联水凝胶在流变测试仪上测试本实施例所获双交联水凝胶的机械性能,通过流变结果图5可以看出,g’>g”且呈线性关系,说明已成凝胶状态,而且g’在1kpa左右。
性能测试五
本实施例所获双交联水凝胶对干细胞增殖检测
用钙黄绿素染色法和四唑盐比色法(wst法)来测定本实施例双交联水凝胶在鼠源骨髓干细胞(bmsc细胞)中的细胞存活和细胞增殖,其操作方法包括:
将上述双键修饰的结冷胶用pbs配成浓度为2%的溶液,加入上述双键修饰的胶原,胶原的浓度为2mg/ml,再加入0.5%的光引发剂i2959,2m的nahco3溶液调整ph至7,将全培养基培养的第4代bmsc细胞消化、计数、1000rpm离心3min;与上述双键修饰的胶原与双键修饰的结冷胶混合液混合均匀确保细胞浓度为107个/ml;取上述细胞共混液100μl于模具中,在0.1mol/l的ca2+浴中交联1mim,形成离子交联的水凝胶,然后在365nm紫外光光强不低于7mw/cm2下光照交联3min形成离子与光固化双交联水凝胶,干细胞与本实施例的双交联水凝胶共混,将该水凝胶转移至24孔板中,加入完全培养基,放入5%co2、37℃培养箱中培养。
培养1d、3d和7d后将培养基取出,pbs清洗3次,利用live/dead试剂盒测定,在激光共聚焦488/561nm激发下观察细胞活性;活细胞被钙黄绿素染色发出绿色荧光,死细胞被染色发出红色荧光。
如图6a、6b、6c所示,鼠源的骨髓干细胞在本实施例所获光固化水凝胶中存活较好并显示三维结构和明显增殖,表明本发明对细胞增殖无影响且能为细胞提供三维生长环境。
培养1d、3d和7d后将培养基取出,每孔加入900μl新鲜培养基,加入100μlwst-1充分混匀,放入5%co2、37℃培养箱中孵育4h,取100μl于96孔板中酶标仪450nm处测试od值。
如图6a、6b、6c所示bmsc与本实施例所获双交联水凝胶共混后,培养1d细胞存活较好,培养7d细胞呈现明显增殖,表明本实施例所获双交联水凝胶毒性低、生物相容性好。
性能测试六
鼠源骨髓干细胞在本实施例所获双交联水凝胶中向血管内皮细胞分化检测
用rt-pcr检测血管生成相关基因mrna的表达水平来判断干细胞的是否分化。
第4代鼠源骨髓干细胞分为四组:
第一组与本实施例所获双交联水凝胶共混后于血管分化培养基培养作为实验组;
第二组与本实施例所获双交联水凝胶共混后于完全培养基培养作为实验组;
第三组血管分化培养基六孔板中培养细胞作为实验组;
第四组完全培养基六孔板中培养细胞作为对照组(tcp)。
将四组细胞放入5%co2、37℃培养箱中培养,隔天换新鲜培养基,培养28d,弃去培养基,pbs洗3次,在每个时间点通过trizolplusrna纯化试剂盒从在非血管发生和血管发生培养基中培养的包裹骨髓干细胞的水凝胶中提取总细胞rna,使用6孔板中的骨髓干细胞作为对照。使用a260/280nm评估rna的纯度。之后,使用primescripttmrt试剂盒将500ngrna逆转录成cdna。使用sybrgreenipcr试剂盒rt-pcr检测。将第0天的第4代骨髓干细胞设为校准品对照,并通过非调节参考基因表达(gapdh)将目标基因表达标准化。
如图7a、7b、7c、7d所示,二维培养的骨髓干细胞在非血管发生和血管发生培养基中都不能有效地促进骨髓干细胞分化成血管内皮。相反,骨髓干细胞在3d培养可促进骨髓干细胞向血管内皮细胞分化,特别是在血管生成培养基中。这些结果提示本实施例所获双交联水凝胶能有效促进骨髓干细胞向血管内皮细胞分化,这些分化的内皮细胞具有独特的表型和生物合成活性。
对照例1:
一般情况下,纯的结冷胶具有温敏性,在50-45℃形成水凝胶,而且阳离子能促进快速凝胶化,但较高的凝胶温度不适合与细胞混合,从而限制了其在生物医学中的应用。
与对照例1相比,本发明实施例1-5所获水凝胶对结冷胶进行双键化修饰,修饰后的结冷胶凝胶点降低至20-25℃较上述纯的结冷胶形成的水凝胶有更广泛的生物应用,例如,本发明实现与细胞共混凝胶化,较上述三维支架材料更易于细胞包埋。
对照例2
一般情况下,纯的结冷胶具有温敏性,在50-45℃形成水凝胶,而且阳离子能促进快速凝胶化,但较高的凝胶温度不适合与细胞混合,从而限制了其在生物医学中的应用。因此对结冷胶进行双键化修饰,修饰后的结冷胶凝胶点降低,但双键修饰程度高于100%的结冷胶失去了温敏性以及对阳离子的响应。
与对照例2相比,本发明实施例1-5所获水凝胶对结冷胶进行双键化修饰,修饰后的结冷胶凝胶点降低至20-25℃较上述双键修饰程度高于100%的结冷胶形成的水凝胶有更广泛的生物应用,例如,本发明实现与细胞共混凝胶化,且对阳离子和紫外光均保持较好的响应,较上述三维支架材料性能更好。
对照例3
一般情况下,纯的结冷胶具有温敏性,在50-45℃形成水凝胶,而且阳离子能促进快速凝胶化,但较高的凝胶温度不适合与细胞混合,从而限制了其在生物医学中的应用。因此对结冷胶进行双键化修饰,修饰后的结冷胶凝胶点降低,但双键修饰程度低于50%的结冷胶凝胶点降低至37℃左右,不利于与细胞共混。
与对照例3相比,本发明实施例1-5所获水凝胶对结冷胶进行双键化修饰,修饰后的结冷胶凝胶点降低至20-25℃较上述双键修饰程度低于50%的结冷胶形成的水凝胶有更广泛的生物应用,例如,本发明实现与细胞共混凝胶化,且对阳离子和紫外光均保持较好的响应,较上述三维支架材料性能更好。
对照例4
一般情况下,胶原难溶于水溶液,常规的做法是将胶原溶于醋酸溶液中交联形成凝胶,通过透析除去醋酸及小分子,冻干形成三维多孔支架材料。但是本对照例获得的凝胶降解率较快,支架的机械性能较差,从而限制了其在生物医学中的应用。
与对照例4相比,本发明实施例1~5所获水凝胶对鼠尾胶原进行双键化修饰,修饰后的鼠尾胶原可溶于水,较上述醋酸溶液中形成的水凝胶有更广泛的生物应用,例如,本发明实现与细胞共混凝胶化,较上述三维支架材料更易于细胞生长。
综上所述,藉由本发明的上述技术方案,本发明的双交联水凝胶的固化时间短、水凝胶内部孔隙分布均匀,生物相容性好、毒性低、可给细胞提供三维生存环境,提高干细胞在三维支架上的粘附和增殖,并且实现向血管内皮细胞分化;同时制备方法简单,可大量制备。
此外,本案发明人还参照实施例1~5的方式,以本说明书中列出的其它原料和条件等进行了试验,并同样制得了固化时间短、生物相容性好、毒性低、可给细胞提供三维生存环境的双交联水凝胶。
需要说明的是,在本文中,在一般情况下,由语句“包括......”限定的要素,并不排除在包括所述要素的步骤、过程、方法或者实验设备中还存在另外的相同要素。
应当理解,以上所述实例仅为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人是能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所做的等效变换或修饰,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!