用于富集氧化核酸的功能微球及富集氧化核酸的方法与流程
本发明涉及分子生物学领域,具体而言,涉及一种用于富集氧化核酸的功能微球及富集氧化核酸的方法。
背景技术:
机体在细胞中的线粒体、微粒体、质膜和胞质中的酶系统和非酶系统在代谢过程中,可以产生活性氧自由基。同时机体在受到外源化学物质和电离辐射等条件下也可能产生活性氧自由基。所述活性氧自由基可以与氧化dna或rna中的碱基形成加合物如脱氧鸟苷,所述脱氧鸟苷加合物在羟化酶的作用下,形成羟基脱氧核苷或羟基核苷,其中8-羟基-2'-脱氧鸟苷8-氧代脱氧鸟苷(8-oxooh-dg或8-oxo-dg)和8-羟基鸟苷(8-oh-g或8-oxo-g)是主要的氧化产物。
8-oxo-dg可直接引起基因突变和癌基因表达。如kuchino等报道:8-羟基脱氧鸟嘌呤具有同任何碱基配对的能力。脱氧鸟嘌呤的c8被羟基化后,脱氧鸟嘌呤同胞嘧啶特异性配对的能力丧失,导致dna复制时碱基的错配,从而出现多种基因突变的形式。wood等曾证实:在大肠杆菌中,8-氧代脱氧鸟苷具有诱导g—t置换的能力。cheng等也报道:8_氧代脱氧鸟苷可以引起g—t和a—c置换。8-氧代脱氧鸟苷可以引起突变,ras基因激活的主要原因为点突变。kamiya等m证实:用人工合成的第12位密码子碱基g置换的原癌基因c-ha-ras转染nts3t3细胞,可使部分细胞发生恶性转化。在已知的大约20种dna的加合物中,8-oxo-dg易于检出,且8-oxo-dg与基因突变明显相关,8-oxo-dg已成为研究最多的dna碱基氧化损伤修复产物,成为研究dna损伤修复最常用的生物学标志物(biomarker)。
8-oxo-dg作为内源性或外源性因素对dna氧化损伤作用的生物标志物,是一种极有前景的生物标志,通过8-oxo-dg的检测可以评估体内氧化损伤和修复的程度。氧化应激与dna损伤的相互关系,对研究退行性疾病、衰老机制、癌发生机制、环境毒物与氧化应激的关系等具有重要意义,也可以用来评价抗氧化剂治疗dna氧化损伤的效果。
目前8-oxo-dg的检测方法主要有32p后标记法、免疫荧光组织化学检测法、酶联免疫吸附(elisa)法、高效液相色谱-电化学法、气质联用分析法和高效毛细管电泳等。
技术实现要素:
本发明的目的在于提供一种用于富集氧化核酸的功能微球,以及所述功能微球在富集氧化核酸中的应用。
为了实现本发明的上述目的,特采用以下技术方案:
本发明涉及一种用于富集氧化核酸的功能微球,其包括固相微球载体以及通过linker偶联在所述固相微球载体上的功能化合物;
所述功能化合物包括氨基糖苷类化合物、精胺类化合物或亚精胺类化合物中的一种或多种。
所述功能化合物可在催化剂的作用下,与8-oxo-(d)g中的c=n形成加成反应。
根据本发明的一方面,本发明还涉及一种富集氧化核酸的方法,包括:
将含有8-oxog或8-oxo-dg的核酸溶液与如上所述的功能微球在催化剂存在的情况下进行偶联反应,得到功能微球-核酸接枝物。
与现有技术相比,本发明的有益效果为:
(1)本发明所提供的功能微球,合成方法简单,合成效率高;在进行氧化核酸富集时,可大大节约反应程序及时间。
(2)本发明所提供的功能微球对于含有8-oxo-(d)g的标准dna或rna样本,其富集效率高达80%以上。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
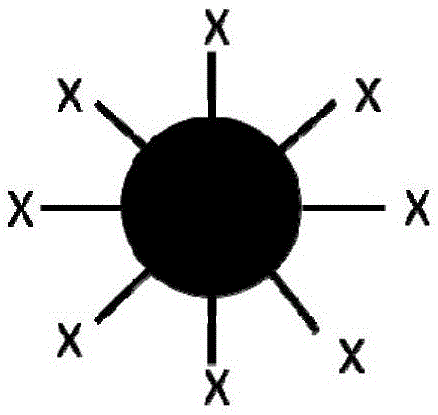
图1为本发明所提供的功能微球的示意图,●代表微米球,—代表linker,x代表功能化合物,如:氨基糖苷类化合物、精胺类化合物或亚精胺类;
图2为四氧化三铁磁性微球-peg4-dbco-卡那霉素富集含有8-oxo-dg的dna示意图
具体实施方式
本发明可通过后续对于本发明一些实施方案描述以及其中所包括的实施例的详细内容而更容易被了解。
在进一步叙述本发明之前,应明了本发明不会被局限于所述特定实施方案中,因为这些实施方案必然是多样的。亦应明了本说明书中所使用的用语仅是为了阐述特定实施方案,而非作为限制,因为本发明的范围将会被仅仅界定在所附的权利要求中。
本发明涉及一种用于富集氧化核酸的功能微球,其包括固相微球载体以及通过linker偶联在所述固相微球载体上的功能化合物;
所述功能化合物包括氨基糖苷类化合物、精胺类化合物或亚精胺类化合物中的一种或多种。
优选的,所述氨基糖苷类化合物包括叠氮化卡那霉素,叠氮化丁胺卡那霉素。
优选的,如上所述的功能微球,
所述linker包含端基为下列活性基团中的一种或多种:nh2、n3、sh、环辛炔衍生物、亲和素、生物素;
优选的,所述linker包含下列活性基团中的一种或多种:cooh-nh2、nh2-peg-cooh、pei-cooh、pei-n3、pei-环辛炔衍生物、sh-peg-sh、n3-peg-sh、n3-peg-环辛炔衍生物、生物素-peg-环辛炔衍生物、亲和素-peg-环辛炔衍生物;
优选的,如上所述的linker中还包含有二硫键。
具有叠氮基团的氨基化合物中的叠氮基团可以与环辛炔衍生物发生点击化学(clickchemistry)反应,具体为huisgen环加成反应。该反应没有催化剂或者配体,因此无需大量的条件优化,且快速、无毒性。
优选的,如上所述的功能微球,所述环辛炔衍生物选自二氟化环辛炔(difo)、双环[6.1.0]壬-4-炔-9-基甲醇(bcn)、氮杂二苯并环辛炔(dibac)、4-二苯并环辛炔醇(dibo)、adibo或二苯基环辛炔(dbco)中的任一种,或它们的衍生物中的任一种。
优选的,如上所述的功能微球,所述固相微球载体包括四氧化三铁磁性纳米粒子、二氧化硅纳米球、琼脂糖微球、金纳米微球、聚丙烯酰胺纳米球中的任一种。
根据本发明的一方面,本发明还涉及一种富集氧化核酸的方法,包括:
将含有8-oxo-g或8-oxo-dg的核酸溶液与如上所述的功能微球在催化剂存在的情况下进行偶联反应,得到功能微球-核酸接枝物。
优选的,如上所述的富集氧化核酸的方法,当所述linker中含有二硫键时,所述方法还包括打断二硫键后对所述核酸进行检测。
优选的,如上所述的富集氧化核酸的方法,所述打断二硫键的方法为使用二硫苏糖醇或巯基乙醇与所述固相载体共振荡孵育。
优选的,所述二硫苏糖醇或巯基乙醇的浓度为10μm~1500μm;
还可以选择20μm、30μm、40μm、50μm、60μm、70μm、80μm、90μm、100μm、200μm、300μm、400μm、500μm、600μm、700μm、800μm、900μm、1000μm、1100μm、1200μm、1300μm、1400μm。
优选的,如上所述的富集氧化核酸的方法,所述核酸溶液中的核酸为dna或rna;
优选的,所述核酸溶液中核酸的浓度为10-10000ng/ml;
还可以选择30ng/ml、50ng/ml、100ng/ml、200ng/ml、300ng/ml、400ng/ml、500ng/ml、600ng/ml、700ng/ml、800ng/ml、900ng/ml、1000ng/ml、2000ng/ml、3000ng/ml、4000ng/ml、5000ng/ml、6000ng/ml、7000ng/ml、8000ng/ml或9000ng/ml。
优选的,所述dna为全基因组dna;
优选的,所述dna为dna片段;
优选的,所示rna为总rna;
优选的,所示rna为信使rna;
优选的,所述rna为rna片段。
优选的,如上所述的富集氧化核酸的方法,所述催化剂包括六氯铱(iv)酸盐和/或六氰合铁(iii)酸盐。
优选的,所述催化剂在反应体系中的终浓度为10-1000μm;
还可以选择30μm、50μm、100μm、200μm、300μm、400μm、500μm、600μm、700μm、800μm或900μm。
优选的,如上所述的富集氧化核酸的方法,所述偶联反应的温度为4℃~100℃;
还可以选择10℃、20℃、30℃、40℃、50℃、60℃、70℃、80℃、90℃。
优选的,如上所述的富集氧化核酸的方法,当所述核酸溶液中的核酸为dna时,所述方法还包括:
对所述功能微球-核酸接枝物使用随机引物扩增得到扩增产物;
优选的,对所述扩增产物进行测序;
优选的,所述测序的方法包括一代测序、二代测序、三代测序。
除非另有限定,本发明使用的所有技术和科学术语具有与所公开的实施方案所属领域的普通技术人员通常理解的相同的含义。虽然与本发明所述的方法和材料类似或等同的方法和材料可用于本实施方式的实践或测试中,但下文仍然描述了合适的方法和材料。本发明提及的所有出版物、专利申请、专利以及其他参考文献通过引用全部内容结合于本文中。在冲突的情况下,本说明书(包括定义)将起支配作用。此外,材料、方法以及实施例仅仅是说明性的,而不旨在限制。实施方式的其他特征和优点将从以下详细的说明书和权利要求中变得明显。
为了促进理解本文描述的实施方式这一目的,将参考某些实施方式,并且将使用特定语言来描述这些实施方式。本文所使用的术语仅用于描述具体实施方式目的,而不旨在限制本公开的范围。
实施例1
四氧化三铁磁性微球-peg4-dbco-卡那霉素的合成
将表面包被叠氮(n3)的四氧化三铁磁性微球(1mg)重悬到1mldbco-peg4-dbco溶液(100μm,ph8.0)中,常温震荡2小时,磁力架分离磁性微球,磷酸缓冲溶液(ph7.4)洗掉3次,得到四氧化三铁磁性微球-peg4-dbco;重悬到1ml磷酸缓冲溶液,加入叠氮化卡那霉素溶液(100um),37℃震荡反应2小时,磁力架分离磁性微球,磷酸缓冲溶液(ph7.4)洗掉3次,得到四氧化三铁磁性微球-peg4-dbco-卡那霉素。
实施例2
四氧化三铁磁性微球-peg-dibo-精胺的合成
将表面包被sh的四氧化三铁磁性微球(1mg)重悬到1ml的dibo-peg4-dibo磷酸缓冲溶液(1mm,ph8.0)中,常温震荡2小时,磁力架分离磁性微球,磷酸缓冲溶液(ph7.4)洗掉3次,得到四氧化三铁微球-peg4-dbco;加入1ml的叠氮化精胺溶液(100μm),37℃震荡反应2小时,磁力架分离磁性微球,利用磷酸缓冲溶液(ph7.4)洗3次,得到四氧化三铁磁性微球-peg-dibo-精胺。
实施例3
琼脂糖凝胶微球-peg10-adibo-亚精胺的合成
将表面包被nh2的琼脂糖微球(100mg)重悬到1ml的dbco-peg-nhs磷酸缓冲溶液(1mm,ph7.5)中,缓慢震荡2小时,磷酸缓冲溶液(ph7.4)洗掉3次,加入1ml的叠氮化亚精胺溶液(100μm),常温震荡2小时,利用磷酸缓冲溶液(ph7.4)洗3次,得到琼脂糖凝胶微球-peg10-adibo-亚精胺。
实施例4
将实施例1制备得到的四氧化三铁磁性微球-peg4-dbco-卡那霉素用于含8-oxo-dg的dna的分离,如图2所示。
将40μg基因组dna片段(100-5000bp)溶解到50μl磷酸缓冲溶液中(ph7.5),加入四氧化三铁微球-peg4-dbco-卡那霉素(1mg)和六氯铱(iv)酸钠(100μm),在37摄氏度的水浴中反应30分钟。磁力架分离磁性微球,清洗后得到含有8-oxo-dg的dna片段,使用随机引物对dna片段进行扩增,对扩增产物进行定量分析或测序。
实施例5
将实施例2制备得到的四氧化三铁磁性微球-peg-dibo-精胺用于含8-oxo-dg的dna的分离。
将10μg基因组dna片段(100-300bp)溶解到50μl磷酸缓冲溶液中(ph7.5),加入四氧化三铁微球-peg4-dbco-精胺(1mg)和六氰合铁(iii)酸钾(500μm),在37摄氏度的水浴中反应30分钟。磁力分离微球,清洗后得到含有8-oxo-dg的dna片段,使用随机引物对dna片段进行扩增,对扩增产物进行定量分析或测序。
实施例6
将实施例3制备得到的琼脂糖凝胶微球-peg10-adibo-亚精胺用于含8-oxo-dg的dna的分离。
将50μg基因组dna片段(100-300bp)溶解到50μl磷酸缓冲溶液中(ph7.5),加入琼脂糖凝胶微球-peg10-adibo-亚精胺(10mg)和六氰合铁(iii)酸钠(500μm),在37摄氏度的水浴中反应30分钟。纯化磁珠,清洗后得到含有8-oxo-dg的dna片段,使用随机引物对dna片段进行扩增,对扩增产物进行定量分析或测序。
实施例7
将实施例2制备得到的四氧化三铁磁性微球-peg-dibo-精胺用于含8-oxo-g的rna的分离。
将30μg含有rna片段(100-200nt)溶解到50μl无rna酶的磷酸缓冲溶液中,加入四氧化三铁微球-peg4-dbco-精胺(2mg)和六氰合铁(iii)酸钾(200μm),在37摄氏度的水浴中反应30分钟。磁力分离微球,清洗后得到含有8-oxo-g的rna片段。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,但本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 还没有人留言评论。精彩留言会获得点赞!