一种耐重金属微生物的筛选方法与流程
本发明属于环境微生物领域,具体涉及一种耐重金属微生物的筛选方法。
背景技术:
铬(chromium)是现代工业极其重要的重金属原料,广泛应用在电镀,制革,染色工业,防腐和杀菌剂等领域,据估计全球每年有超过17万吨含铬产物进入环境[1]。环境中常见的铬为cr(iii)和cr(vi),其中cr(iii)低毒且在ph中性环境中迁移力弱,也是生物体重要的痕量元素;而cr(vi)毒性强,易溶于水,在环境中迁移能力强,可快速渗透进生物的细胞膜,破坏细胞内的蛋白质,核酸并影响代谢过程,短期和长期接触均有致癌风险。含cr(vi)废弃物进入环境后,极易通过食物链进入人体,因此美国环境保护署将cr(vi)列为17种对人类威胁最大的物质之一。
首次报道微生物对cr(vi)具有耐性是在20世纪70年代后期,romanenko和koren’kov从活性污泥中分离出一株pseudomonas,其在厌氧条件下能将cr(vi)还原为cr(iii){vi,1977#50}。目前为止许多微生物都已经被证实具有去除cr(vi)的能力,比如细菌中的aerococcus,micrococcus和aeromonas;酵母有s.cerevisiae,rhodotorulapilimanae,yarrowialipolytica和hanseulapolymorpha,真菌有trichoderma,hypocreatawa和paecilomyceslilacinus,代表性藻类有chlorellaminiata和cladophoraalbida。微生物对cr(vi)的去除机理具有多样性,包括外排作用,还原作用(直接还原,间接还原,胞外还原,膜结合还原以及胞内还原)和吸收作用(生物吸附和生物累积)。多样的微生物类别和耐性机理为除铬应用提供了可能。马锦民等回顾微生物处理含cr(vi)废水研究进展时发现,利用活体微生物法效果更好;牛永艳等将cr(vi)还原菌应用于微生物燃料电池阴极处理含铬废水,cr(vi)还原率可达68.9%;目前微生物也开始被尝试应用于肠道内铬累积的修复。
与耐铬微生物开发应用的蓬勃发展相比,筛选方法研究仍然传统而滞后,几乎所有的国内外文献均是将cr(vi)与培养基直接混合。但鉴于cr(vi)独特的理化性质,如其具有强氧化性,可产生络合作用等,微生物培养基与cr(vi)必然存在有效性的互相影响。郭丽艳等指出有机质类和无机酸对cr(vi)的特征吸收峰的位置和吸收强度均有不同程度的影响,而无机盐类对其影响较小;成分复杂的培养基较低碳源组分培养基更易降低重金属离子的有效性,并对重金属离子对微生物毒性的评价产生影响;tanu等研究表明,swm培养基和mvb培养基在不接种的情况下在72小时内分别对六价铬具有20%和40%的还原能力,而mm63培养基在不接种的情况下未表现出对六价铬的还原能力。因此传统将cr(vi)与培养基混合的方法使用场景局限,在简单或无机盐培养基中使用情况较好。但在复杂培养基,特别是多种碳源或含还原性物质培养基中,存在很多问题,例如,容易导致培养基中cr(vi)浓度不达标,cr(vi)真实浓度小;培养基中cr(vi)形态可能会发生变化,cr(vi)可能会被培养基成分还原;培养基组分容易被破坏。上述问题都会导致出现筛选出的耐cr(vi)菌种出现假阳性或假阴性情况。
技术实现要素:
为了解决上述技术问题,本发明提供了一种耐重金属微生物的筛选方法,本发明的方法能快速、简便、有效筛选出耐重金属微生物,并避免培养基的干扰。
为了达到上述目的,本发明采用的技术方案是:一种耐重金属微生物的筛选方法,依次包括以下步骤:
第一步,缓冲体系的建立:
配制缓冲溶液,向所述缓冲溶液中加入重金属盐溶液,再配制成不同浓度梯度的含有重金属离子的缓冲液,过滤灭菌后备用,其中,所述缓冲溶液为ph在7.0-8.0的中性无机盐缓冲溶液;
第二步,利用缓冲体系原位筛选耐重金属微生物活体细胞:
将所述含有重金属离子的缓冲液与环境样品混合,制备成环境样品悬浊液,混匀后在20~40℃恒温条件下培养0.5~5小时,让所述环境样品中的微生物接受重金属离子浸泡筛选,不耐重金属微生物在第二步中会细胞死亡;
第三步,耐重金属微生物活体细胞的分离及再培养:
完成浸泡后对所述环境样品悬浊液进行梯度稀释得到稀释液,将所述稀释液转接于不含重金属离子的培养基中,通过在培养基进行再培养得到稳定的耐重金属微生物。
优选地,在所述第一步中,所述缓冲溶液为磷酸二氢钾-氢氧化钠缓冲液、磷酸氢二钠-磷酸二氢钾缓冲液以及硼酸-硼砂缓冲液中的任意一种。更优选地,所述缓冲溶液为磷酸盐缓冲溶液。
优选地,在所述第一步中,所述重金属盐溶液为铬盐溶液、铜盐溶液、铁盐溶液、镉盐溶液以及锰盐溶液中的任意一种。
优选地,在所述第二步中,所述环境样品为土壤、活性污泥、畜禽粪便、堆肥以及淤泥中的任意一种。环境样品中天然的含有数量很大、种类繁多的微生物。上述环境样品相当于微生物的“天然仓库”。
优选地,在所述第二步中,所述含有重金属离子的缓冲液与环境样品的推荐重量比例为1:5~1:10,本领域技术人员可根据实际需要调整缓冲液与环境样品的比例。
优选地,在所述第三步中,所述培养基为含有还原糖或还原物质的微生物培养基。所述培养基为牛肉膏蛋白胨培养基、高氏1号培养基、马丁氏培养基、马铃薯培养基、察氏培养基、麦氏培养基以及葡萄糖蛋白胨培养基中的任意一种。含有还原糖或还原物质的微生物培养基的种类繁多,本领域技术人员可根据实际需要选择所需的培养基,不仅限于上述提到的培养基种类。
本发明设计构思是:针对传统筛选方法培养基与重金属离子易相互作用的问题,本发明提出一种利用含有重金属的缓冲液浸泡筛选耐重金属微生物的新方法,核心点在于将目标微生物提前接受不同浓度重金属离子浸泡,筛选出耐重金属的微生物细胞,然后通过在不含重金属离子的培养基上后续扩繁。也就是说,将重金属离子与微生物的接触过程和微生物的培养过程分离,从而避免重金属离子与培养基的互相作用。
本发明的积极效果在于:
(1)本发明仅在含有重金属离子的缓冲液中提前浸泡筛选耐重金属微生物,能够保证缓冲液中加入的重金属离子的真实浓度准确、可靠;
(2)本发明不向培养基中加入重金属离子,可以保证培养基成分不受重金属离子的影响和破坏;
(3)本发明仅在缓冲液中加入重金属离子,所加入的重金属离子的浓度可不受限制,可操作空间更大,可根据实际需要控制重金属离子浓度;而传统的筛选方法需要在培养基中加入重金属离子,如培养基中重金属离子浓度过高,则会破坏培养基成分;
(4)本发明能够避免所筛选出的耐重金属菌种出现假阳性或假阴性情况;
(5)利用本发明的方法分离出的微生物种类数多,微生物的多样性好。
总之,本发明的方法具有快速、简便,对培养基无干扰,无选择性,对耐重金属微生物识别率高,对非耐重金属微生物敏感的特点。利用本发明方法分离的微生物包括stenotrophomonas,chlorella,paecilomyce,staphylococcus,candidautilis等。
附图说明
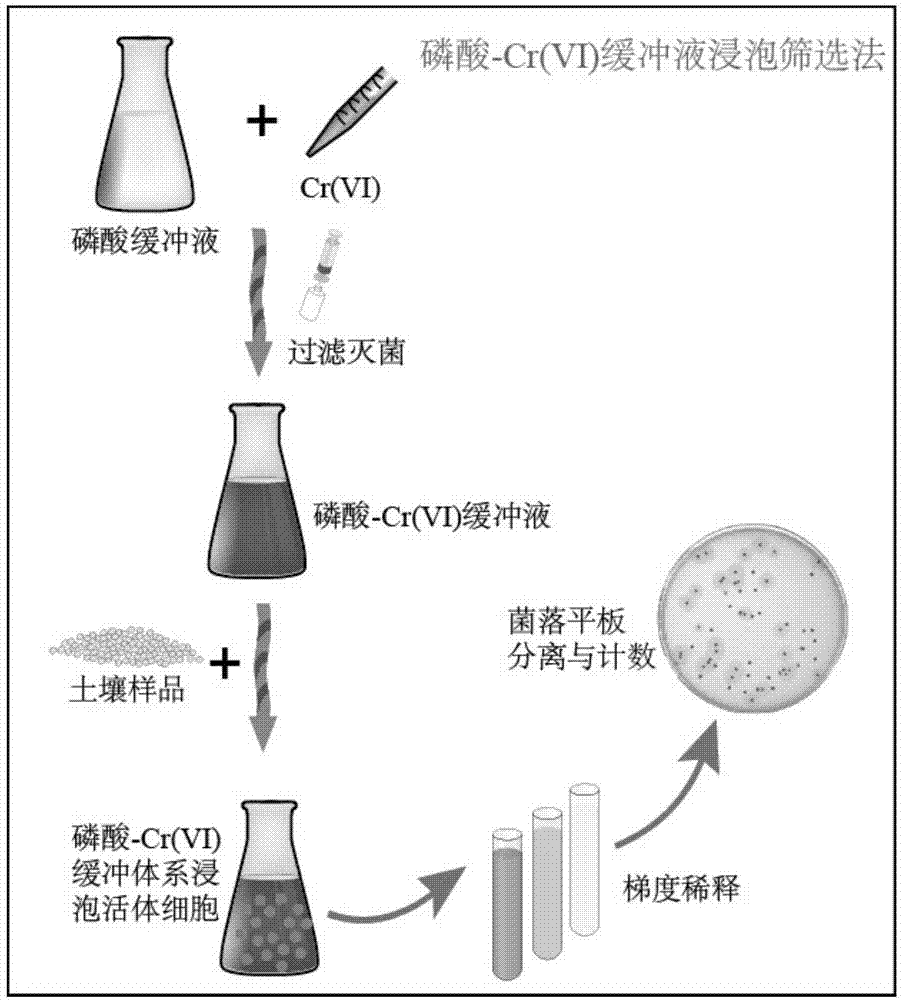
附图1为实施例1的利用磷酸-cr(vi)缓冲液浸泡筛选耐cr(vi)微生物流程图;
附图2为实施例1的磷酸-cr(vi)缓冲液浸泡后3种纯菌株后cfu变化对比图,不同小写字母表明在0.01水平下具有显著差异;
附图3为实施例1的不同耐铬微生物筛选方法比较图,图中不同小写字母表明cfu在0.01水平有显著差异。
具体实施方式
下面结合实施例对本发明作进一步描述:
实施例1:一种耐cr(vi)微生物的筛选方法
1、利用磷酸-cr(vi)缓冲液浸泡筛选耐cr(vi)微生物的方法(以下简称pcb法)
配制ph7.4磷酸氢二钠-磷酸二氢钾缓冲液,向1l烧杯内分别称取8gnacl,0.2gkcl,1.42gna2hpo4和0.27gkh2po4,然后向烧杯内加入约800ml去离子水,充分搅拌溶解,用浓盐酸将ph调节至7.4,用去离子水将溶液定容至1l。配置20gk2cr2o7l-1母液,称取20g烘干恒重k2cr2o7至1l烧杯,加入约800ml去离子水,充分溶解后定容至1l。将ph7.4磷酸缓冲液与20gk2cr2o7l-1母液按一定体积混合,并用0.22μm滤器过滤灭菌,配制成一定浓度磷酸-cr(vi)缓冲液。
将一定浓度磷酸-cr(vi)缓冲液与新鲜土壤按质量比(10:1)制备土壤悬浊液,充分混匀后在27°c恒温培养箱内振荡培养2h,让微生物细胞与cr(vi)离子充分接触,不耐cr(vi)微生物细胞在此步骤中死亡。完成浸泡接触后,利用无菌去离子水对土壤悬浊液进行梯度稀释,吸取50μl稀释悬浊液均匀涂布于平板,重复3次。磷酸-cr(vi)缓冲液浸泡后存活细胞可在无cr(vi)培养基上生长,本方法具体步骤详见附图1。研究中所涉及微生物培养基均为牛肉膏蛋白胨培养基,实际操作过程中可根据需要替换为其它任意培养基。通过耐/不耐cr(vi)纯菌株进行筛选效果验证,同时在尾矿土和草地土两类土壤中实际筛选,并与常规高温灭菌和过滤灭菌筛选方法进行比较。
2、常规筛选方法与对照
为比较不同筛选方法的优劣,同时采用以下两种常规方法作为对比。方法一:高温灭菌法(hs),即将k2cr2o7溶液加入培养基中一起灭菌处理,之后利用常规方法筛选。方法二:过滤灭菌法(fs),先将培养基灭菌,待培养基冷却至60℃,加入经0.22μm滤器过滤的k2cr2o7溶液,之后利用常规方法筛选。采用无菌水梯度稀释土壤微生物,用不含cr(vi)培养基进行微生物筛选作为空白对照。
3、pcb法纯菌株耐性验证
供试三种菌株分别为bacilluscereus,bacillussubtilis和comamonasjiangduensis,其中两种bacillus为革兰氏阳性菌;comamonasjiangduensis为革兰氏阴性菌。分别配制0,200,500,1000和1500mgl-1(k2cr2o7计)的磷酸-cr(vi)缓冲液,先将上述三种处对数生长期纯菌株用磷酸-cr(vi)缓冲液洗涤三次,再用缓冲液配制成含1.0×105ml-1的菌悬液。吸取100μl菌悬液加入至10ml含不同浓度k2cr2o7的磷酸-cr(vi)缓冲液中,27℃恒温培养2h,利用稀释平板法27℃培养3d,并计算cfu数。
4、pcb法土壤筛选验证
土壤分别取自安徽铜陵林冲尾矿土和扬州大学扬子津校区草坪土。分别采用上述三种方法筛选,设置k2cr2o7筛选浓度均为200mgl-1,三种方法的稀释平板均在27℃下恒温培养3d,通过cfu数评价三种方法的实际筛选效果。同时检测hs和fs法培养基中cr(vi)残留量,采用二苯碳酰二肼分光光度法测定。
5、数据分析与统计方法
试验数据采用microsoftexcel2010录入,采用ibmspssstatistics19.0进行数据统计分析,sigmaplot14.0制图。不同筛选方法的效果比较采用one-wayanova,多重比较采用lsd法。
6、结果与讨论
利用不同浓度磷酸-cr(vi)缓冲液浸泡浸泡2h后,3种纯菌株cfu均随cr(vi)浓度提高而降低(参见附图2)。bacilluscereus和bacillussubtilis均是典型的耐cr(vi)微生物,方差分析表明,在200mgk2cr2o7l-1条件下,bacilluscereus已受到显著抑制,平均cfu为4.3×104,但200mgk2cr2o7l-1未达到其半致死浓度,且在500~1500mgk2cr2o7l-1范围内,bacilluscereus展示出了对cr(vi)具有良好的耐性。在200mgk2cr2o7l-1条件下,bacillussubtilis未受到显著抑制,cfu数与对照相比无显著差异,平均cfu维持在8.2×105;高于200mgk2cr2o7l-1则显著抑制了cfu。这两株耐cr(vi)格兰氏阳性纯菌株验证了pcb法对耐cr(vi)微生物具有很好的识别率。comamonasjiangduensis是格兰氏阴性菌,目前无报道显示其具有耐cr(vi)能力,本实施例中,在200mgk2cr2o7l-1条件下,cfu仅为20,更高浓度下基本无任何存活细胞。这一结果从反面验证了pcb方法对非耐cr(vi)微生物的敏感性。
为进一步评估pcb法在实际分离中的作用,分别利用3种方法筛选含cr(vi)尾矿土壤和草地土壤。结果可知,尾矿土中pcb法和hs法获得耐cr(vi)微生物cfu数显著高于fs法处理,平均cfu为7.5×104,而fs法cfu仅为1.5×103;在草坪土壤中hs法获得耐cr(vi)微生物cfu数显著高于pcb和fs法,平均高达为1.9×107,而pcb和fs法平均仅为1.8×104和1.2×104(图3)。hs法能获得高cfu数并不意味着高筛选效率,因为在本研究中使用的牛肉膏蛋白胨培养基有机质丰富且成分复杂,经实际测定,高温灭菌后残留的cr(vi)仅为53.8%,低cr(vi)条件可能是cfu数显著增高的原因。fs法中牛肉膏蛋白胨培养基中检出cr(vi)残留量为78.6%,优于hs法,但fs法获得的cfu数在3种方法中最低(附图3)。我们认为这与微生物在含cr(vi)培养基中培养持续有关,比如耐cr(vi)微生物可通过代谢产物或直接利用还原酶将cr(vi)还原为cr(iii),而在持续培养条件下,一旦cr(vi)含量超过微生物可还原能力时,微生物即难于生长,这是目前含cr(vi)培养基培养的共有弊端。pcb法使微生物细胞与cr(vi)短期接触,能去除不耐cr(vi)微生物(如附图3,草坪土),同时由于cr(vi)不与培养基混合,不存在后期培养过程中的致死问题,提高了耐cr(vi)微生物的筛选概率(如附图3,尾矿土)。
实施例2:一种耐fe(ⅲ)微生物的筛选方法
三价铁离子是微生物重要的微量元素,但高浓度的三价铁也会对微生物产生毒性。同时三价铁具有氧化性,与培养基中的还原性糖,如葡萄糖易产生氧化还原反应。可通过本方法如下步骤实施,避免发生还原反应,并提高微生物筛选效率。
步骤(1).配置含有三价铁的无机缓冲溶液体系。本实例中采用磷酸氢二钠-磷酸二氢钾缓冲液,向烧杯内分别称取nacl8g,kcl0.2g,na2hpo41.42g,kh2po40.27g,并向烧杯内加入约800ml去离子水,充分搅拌溶解。滴加浓盐酸将ph调节至7.4,然后加入去离子水将溶液定容至1l。称量一定质量fecl3,配置成不同浓度fe3+-pbs缓冲液,经高温灭菌后,室温保存。
步骤(2).称量5g新鲜土壤,加入45mlfe3+-pbs缓冲液,充分振荡混匀,在27℃恒温培养箱内培养2h,让微生物接受fe3+离子浸泡筛选,不耐受微生物此步骤中细胞死亡。
步骤(3).将步骤2中振荡悬浊培养液中细胞,用去离子水进行梯度稀释,并转接到普通培养基上进行培养。对高浓度fe3+离子不耐受细胞均已死亡,而残留活体细胞具有对fe3+离子的耐性。
上述实施例只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人士能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!