耐硼赖氨酸芽孢杆菌ZJB-17007及其应用的制作方法
本发明涉及一株产酰胺水解酶的菌株——耐硼赖氨酸芽孢杆菌(lysinibacillusboronitolerans)zjb-17007,及其在催化n-苯乙酰基氨基酸制备手性氨基酸与催化氨基酸衍生物的n-苯乙酰基取代物制备手性氨基酸衍生物中的应用。
(二)
背景技术:
l-草铵膦化学名称为:4-[羟基(甲基)膦酰基]-l-高丙氨酸,是l-谷氨酸的一种结构类似物,能抑制谷氨酰胺合成酶(gs)活性,使植物体内氨积累,高浓度氨气积累阻断植物光呼吸作用,叶绿体结构的破坏以及基质的囊泡化,同时氨基酸合成受阻,导致细胞膜受损和细胞死亡,从而杀灭杂草。其具有广谱性,是世界第二大转基因作物耐受除草剂。
目前l-草铵膦合成方法有化学合成法和生物合成法。化学法主要通过以下4种方式构建l-草铵膦的手性中心:1)利用手性辅助试剂,手性诱导构建手性中心;2)以天然氨基酸为手性源,转化得到l-草铵膦;3)由手性催化剂催化的不对称合成反应;4)手性拆分外消旋体。但是化学法合成l-草铵膦工序多,收率较低,手性试剂成本高昂,且产生的三废量大,处理比较困难。生物法则具有严格的立体选择性,温和的反应条件、较高的收率和易于分离纯化等优势,因此,生物法生产l-草铵膦技术具有十分重要的产业化开发价值。
生物法生产l-草铵膦根据作用底物不同有蛋白酶水解双丙氨膦、通过磷酸二酯酶i、酰胺酶i和谷氨酰胺酶分步协同作用保持光学活性水解l-3-乙酰氨基-4-(羟基甲基膦酰基)丁酰胺、α-胰凝乳蛋白酶的拆分双丙氨膦乙酯、脱乙酰基酶拆分n-乙酰-草铵膦、酰胺酶拆分2-氨基-4-(羟基甲基膦酰基)-丁酰胺、酯水解酶水解l-草铵膦-n-羧酸酐、腈水合酶水解草铵膦含腈底物、转氨酶催化2-羰基-4-(羟基甲基膦酰基)丁酸等。
目前合成l-草铵膦的化学方法主要有:1)手性辅助剂诱导法,以(s)-2-羟基-3-蒎酮为手性辅助剂制备,产率为51%,e.e.值为79%;以d-缬氨酸甲酯为手性辅助剂,需要-78℃低温反应,产率为51%,e.e.值为93.5%。2)天然氨基酸手性源法,以l谷氨酸为手性源,e.e.值为99.4%;l-蛋氨酸为手性源,总收率为42.3%,e.e.值为93.5%,需要用到剧毒碘甲烷。3)不对称合成法,不对称催化加氢——催化剂用量大且三甲基硅氰价格昂贵;不对称strecker反应——用到剧毒氰化物;不对称michael加成——催化剂用量大,且产品收率和e.e.值低。4)外消旋体拆分法,此方法最高收率86%,e.e.值最高99%,但拆分后d-草铵膦未转化,浪费原料。
用酰胺水解酶选择性催化拆分2-n-苯乙酰基-4-[羟基(甲基)磷酰基]-dl-丁酸制备l-草铵膦的重要有效成分2-氨基-4-[羟基(甲基)磷酰基]-l-丁酸,为实现工业化路线的l-草铵膦合成提供了依据。
手性氨基酸及其衍生物在医药开发中的作用越来越大,目前的医药开发对手性纯度的要求越来越高。手性氨基酸生产工艺有化学拆分和酶法拆分等工艺。其中酶法拆分因为其条件温和,特异性强,污染小,较化学拆分有明显优势。其中酰胺水解酶选择性催化拆分n-苯乙酰基氨基酸生产手性氨基酸具有广阔的应用前景。
(三)
技术实现要素:
本发明的目的是提供一种能够产生酰胺水解酶的菌株——耐硼赖氨酸芽孢杆菌(lysinibacillusboronitolerans)zjb-17007,及其在催化n-苯乙酰-dl-氨基酸衍生物(2-n-苯乙酰基-4-[羟基(甲基)磷酰基]-dl-丁酸)制备l-草铵膦的重要有效成分l-氨基酸衍生物(2-氨基-4-[羟基(甲基)磷酰基]-l-丁酸)或催化n-苯乙酰-dl-氨基酸制备l-氨基酸中的应用,为化学-酶法生产l-草铵膦有效成分及l-氨基酸提供了新的酶源,促进了绿色化学催化的发展。
本发明采用的技术方案是:
第一方面,本发明提供一株产酰胺水解酶菌株——耐硼赖氨酸芽孢杆菌(lysinibacillusboronitolerans)zjb-17007,保藏于中国典型培养物保藏中心,保藏编号cctccno:m2017602,保藏日期2017年10月23日,地址:中国.武汉.武汉大学,430072。该菌株由浙江工业大学生物工程研究所从土壤中分离获得,经检测具有催化合成l-草铵膦的能力。
第二方面,本发明提供一种所述耐硼赖氨酸芽孢杆菌(lysinibacillusboronitolerans)zjb-17007在微生物催化拆分n-苯乙酰-dl-氨基酸衍生物(优选2-n-苯乙酰基-4-[羟基(甲基)磷酰基]-dl-丁酸)制备l-草铵膦的重要有效成分l-氨基酸衍生物(优选2-氨基-4-[羟基(甲基)磷酰基]-l-丁酸)中的应用,所述应用为:以耐硼赖氨酸芽孢杆菌zjb-17007经发酵培养获得的湿菌体为催化剂,以n-苯乙酰-dl-氨基酸衍生物(优选2-n-苯乙酰基-4-[羟基(甲基)磷酰基]-dl-丁酸)为底物,以缓冲液(优选氨水)为反应介质构成ph值为8.5的反应体系,在25-55℃,100-200rpm(优选30-40℃、150rpm)条件下进行转化反应,反应结束后,反应液经分离纯化得到l-氨基酸衍生物(优选2-氨基-4-[羟基(甲基)磷酰基]-l-丁酸)。所述反应体系中,催化剂用量以湿菌体重量计为10-200g/l,优选50g/l,所述底物初始加入终浓度为10-500mm,优选100mm。所述反应体系还可以由耐硼赖氨酸芽孢杆菌zjb-17007经发酵培养获得的发酵液和底物构成,ph8.5;其中发酵液中湿菌体在整个反应体系中的终浓度10-200g/l,优选50g/l,底物在反应体系中的终浓度10-500mm,优选100mm。
所述反应液分离纯化的方法为:反应结束后,将反应液用二氯甲烷萃取,将水层调ph至1.0-5.0(优选2.5),以1-6.0bv/h(优选4bv/h)的速度上样进行离子交换层析,先用去离子水洗涤,再用0.2-4.5m(优选1m)的氨水以0.5-3.0bv/h(优选2bv/h)进行洗脱,用浸染0.2%的茚三酮溶液的滤纸检测洗脱液,滤纸变紫表明洗脱液含有2-氨基-4-[羟基(甲基)磷酰基]-l-丁酸,收集含目标组分的洗脱液,减压蒸馏至膏状,用甲醇溶解重结晶,取晶体干燥,得到l-氨基酸衍生物(优选2-氨基-4-[羟基(甲基)磷酰基]-l-丁酸)。
第三方面,本发明还提供一种所述耐硼赖氨酸芽孢杆菌zjb-17007在催化n-苯乙酰-dl-氨基酸制备l-氨基酸的应用,所述的应用以耐硼赖氨酸芽孢杆菌zjb-17007经发酵培养获得的湿菌体为催化剂,以n-苯乙酰-dl-氨基酸为底物,以缓冲液(优选氨水)为反应介质构成ph8.5的转化体系,在25-55℃,100-200rpm(优选30-40℃、150rpm)条件下进行转化反应,反应结束后,反应液经分离纯化,得到l-氨基酸。所述转化体系中,催化剂用量以湿菌体重量计为20-300g/l(优选20-60g/l),所述底物初始加入终浓度为50-500mm(优选100mm)。所述n-苯乙酰-dl-氨基酸为下列之一:n-苯乙酰-dl-丙氨酸、n-苯乙酰-dl-丝氨酸、n-苯乙酰-dl-谷氨酸、n-苯乙酰-dl-酪氨酸、n-苯乙酰-dl-苏氨酸、n-苯乙酰-dl-缬氨酸、n-苯乙酰-dl-天冬氨酸、n-苯乙酰-dl-甲硫氨酸、n-苯乙酰-dl-亮氨酸、n-苯乙酰-dl-异亮氨酸、n-苯乙酰-dl-苯丙氨酸。所述反应液分离纯化的方法为:反应结束后,将反应液用二氯甲烷萃取,将水层调ph至1.0-5.0(优选2.5),以1-6.0bv/h(优选4bv/h)的速度上样进行离子交换层析,先用去离子水洗涤,再用0.2-4.5m(优选1m)的氨水以0.5-3.0bv/h(优选2bv/h)进行洗脱,用浸染0.2%的茚三酮溶液的滤纸检测洗脱液,滤纸变紫黑色表明洗脱液含有l-氨基酸,收集含目标组分的洗脱液,减压蒸馏至膏状,用甲醇溶解重结晶,取晶体干燥,得到l-氨基酸。
所述n-苯乙酰-dl-氨基酸按如下方法制备:氨基酸和naoh加入蒸馏水中,4℃冰浴条件下充分搅拌至溶液无色透明,滴加苯乙酰氯,滴加完成后,继续4℃冰浴条件反应2h,再常温(25-30℃)搅拌反应5h至溶液呈无色透明,加hcl调节ph至1.5-5.5(优选2-4),析出白色固体,抽滤烘干,得到,n-苯乙酰-dl-氨基酸;所述氨基酸与naoh摩尔比为1∶1~7(优选1:1.5-2.5);所述氨基酸与苯乙酰氯摩尔比为1∶0.1~2(优选1:0.5-1.0),所述蒸馏水体积用量以氨基酸质量计为3-10ml/g;所述氨基酸为下列之一:丙氨酸、丝氨酸、谷氨酸、酪氨酸、苏氨酸、缬氨酸、天冬氨酸、甲硫氨酸、亮氨酸、异亮氨酸、苯丙氨酸。
本发明所述耐硼赖氨酸芽孢杆菌zjb-17007经发酵获得的湿菌体按如下方法制备:
(1)斜面培养:
将耐硼赖氨酸芽孢杆菌zjb-17007接种至斜面培养基,在30℃培养48h,获得斜面菌体;所述斜面培养基终浓度为:酪蛋白胨1-20g/l,na2hpo40.5-5.0g/l,k2hpo40.5-6.0g/l,大豆蛋白胨1-5g/l,葡萄糖1-5g/l,nacl1-10g/l,琼脂20g/l,溶剂为去离子水,ph值为6.5-7.5。优选斜面培养基终浓度组成为:酪蛋白胨17g/l,na2hpo43.0g/l,k2hpo41.5g/l,大豆蛋白胨3g/l,葡萄糖2.5g/l,nacl5g/l,琼脂20g/l,溶剂为去离子水,ph值为7.0。
(2)种子培养:
从斜面菌体挑取一接种环菌体接种至种子培养基,在30℃培养24h,获得种子液;所述种子培养基终浓度组成为:酪蛋白胨1-20g/l,na2hpo40.5-5.0g/l,k2hpo40.5-6.0g/l,大豆蛋白胨1-5g/l,葡萄糖1-5g/l,nacl1-10g/l,溶剂为去离子水,ph值为6.5-7.5。优选种子培养基终浓度组成为:酪蛋白胨17g/l,na2hpo43.0g/l,k2hpo41.5g/l,大豆蛋白胨3g/l,葡萄糖2.5g/l,nacl5g/l,溶剂为去离子水,ph值为7.0。
(3)发酵培养:
将种子液以体积浓度1~10%(优选1%)的接种量接种至发酵培养基中,30℃,150rpm振荡培养60h后,在12000g下离心10min,收集湿菌体;所述发酵培养基终浓度组成:酪蛋白胨1-20g/l,na2hpo40.5-5.0g/l,k2hpo40.5-6.0g/l,大豆蛋白胨1-5g/l,葡萄糖1-5g/l,nacl1-10g/l,溶剂为去离子水,ph值为6.5-7.5;优选发酵培养基终浓度组成为:酪蛋白胨17g/l,na2hpo43.0g/l,k2hpo41.5g/l,大豆蛋白胨3g/l,葡萄糖2.5g/l,nacl5g/l,溶剂为去离子水,ph值为7.0。
本发明所述ph值为8.5的缓冲液构成为:柠檬酸缓冲液(100mm,ph4.0-6.0),磷酸缓冲液(100mm,ph6.0–8.0),tris-hcl(100mm,ph7.0–9.0),硼酸缓冲液(100mm,ph9.0–10.5),氨水缓冲液(以氨水调节底物溶液ph为7.0–10.0),罗二氏缓冲液(100mm,ph10.5–12.0);优选缓冲液组成为:以氨水调节底物溶液ph为8.5。
本发明的有益效果主要体现在:本发明提供了一株能够产生酰胺水解酶的菌株--耐硼赖氨酸芽孢杆菌(lysinibacillusboronitolerans)zjb-17007,本发明还提供了利用耐硼赖氨酸芽孢杆菌zjb-17007经发酵培养获得湿菌体做为生物催化剂催化2-n-苯乙酰基-4-[羟基(甲基)磷酰基]-dl-丁酸制备l-草铵膦的重要有效成分2-氨基-4-[羟基(甲基)磷酰基]-l-丁酸的方法,对2-n-苯乙酰基-4-[羟基(甲基)磷酰基]丁酸转化率达到49.5%,产物l-草铵膦达到e.e.%=99.9%,本发明还提供了利用耐硼赖氨酸芽孢杆菌zjb-17007经发酵培养获得湿菌体做为生物催化剂催化n-苯乙酰-dl-氨基酸制备l-氨基酸的方法,其转化率能达到49%,产物手性氨基酸可达到e.e.%=99-99.9%,拆分制备过程绿色高效,菌株易于培养收集应用,催化反应条件温和,具有重要的应用前景。
(四)附图说明
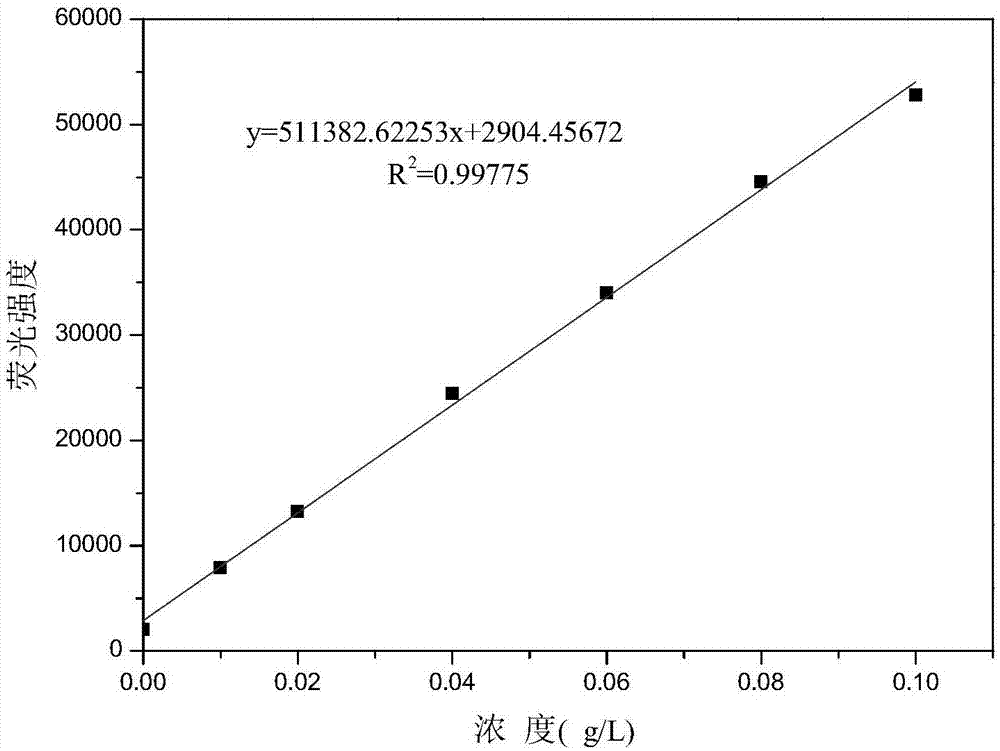
图1为高通量筛选方法下opa/nac-草铵膦的浓度标准曲线。
图2为柱前衍生化反相高效液相色谱下2-氨基-4-[羟基(甲基)磷酰基]-l-丁酸和2-氨基-4-[羟基(甲基)磷酰基]-d-丁酸的液相结果图谱。
图3为筛选所得菌株耐硼赖氨酸芽孢杆菌(lysinibacillusboronitolerans)zjb-17007的电镜观察结果。
(五)具体实施方式:
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:本发明所述超纯水为up水,是指电阻率达到18mω*cm(25℃)的水。本发明所述氨水是含氨25%~28%的水溶液。本发明所述常温为25-30℃。本发明实施例所述冰浴均为4℃。本发明2%茚三酮溶液配制方法为:将2g茚三酮与0.08g氯化亚锡溶于100ml超纯水中,然后搅拌过滤,取滤液避光保存。
实施例1:耐硼赖氨酸芽孢杆菌(lysinibacillusboronitolerans)zjb-17007的筛选
1、初筛
本发明从全国各地取土样,共取土样80份。筛选的具体方法:称取1g土样置于10ml0.85%的生理盐水中,摇晃后静置,取上清液至富集培养基中,于30℃,150r/min振荡培养2-3天。取1ml富集液加入50ml新鲜富集培养基中,如此重复3次后进行分离纯化。
选用溴百里香酚蓝滤纸作为指示滤纸检测能够降解底物的菌落。其原理为:含目的酶的菌落利用降解底物后,会产生酸性副产物(苯乙酸、乙酸、甲酸、苯甲酸),从而使指示滤纸局部的ph值发生改变。指示剂溴百里香酚蓝变色范围为5.8-7.6(黄-蓝),因此能利用含氯有机物的菌落周围呈现黄色,而不能利用的则菌落周围平板颜色仍为青绿色。
将富集液用无菌0.85%生理盐水逐级稀释10个梯度,选取10-4、10-5、10-6、10-7、10-8、10-9、10-10五个梯度的稀释液各取0.1ml均匀涂布在平板筛选培养基上,30℃恒温培养48h。将浸湿含有10%的溴百里酚蓝的无菌滤纸(指示滤纸)平铺于平板上,挑取指示滤纸上显示为黄色的对应的菌落接种到含有生长培养基的96孔板中,放入30℃、180rpm摇床恒温培养,期间检测od600的吸光值,绘制生长曲线,当菌株生长到对数期时候,转接300微升新鲜发酵培养基,接种96孔板后剩下的菌液密封保藏于4℃冰箱,作为菌种备用。转接后的含发酵培养基96孔板至于30℃、180rpm摇床恒温培养48h,使其充分生长与产酶,获得菌悬液。
2、opa/nac高通量筛选
将底物2-n-苯乙酰基-4-[羟基(甲基)磷酰基]-dl-丁酸溶于氨水,加入1ml步骤1制备的菌悬液,用氨水调节溶液ph值至8.5,构成10ml反应体系,使底物终浓度为50mm,于30℃、180rpm摇床恒温反应24h。所得转化液分别用超纯水对应稀释10倍,4℃冰浴,用opa/nac高通量筛选方法进行检测,筛选出相对荧光值较高的菌株。
opa/nac高通量筛选方法:用排枪吸取稀释后的冰浴反应液40μl至96孔荧光检测板,加入冰浴后的a液,酶标仪中振荡30s,再加入100μl超纯水,再次振荡30s,在λex=340nm;λem=455nm,测定荧光强度值,所得荧光强度值与2-氨基-4-[羟基(甲基)磷酰基]-l-丁酸标准曲线对比即可得到样品中所含2-氨基-4-[羟基(甲基)磷酰基]-l-丁酸的浓度,继而可以计算出2-氨基-4-[羟基(甲基)磷酰基]-l-丁酸的产量,得到酰胺水解酶生物催化拆分2-n-苯乙酰基-4-[羟基(甲基)磷酰基]-dl-丁酸制备l-草铵膦的重要有效成分2-氨基-4-[羟基(甲基)磷酰基]-l-丁酸的转化率。
所述a液:n-乙酰-l-半胱氨酸(0.448g)与邻苯二甲醛(0.185g)溶于10ml无水乙醇,冰浴条件下加入硼酸缓冲液(140mm,ph9.5)定容至50ml,冰浴条件下保存,可保存3天。所a液中n-乙酰-l-半胱氨酸终浓度0.313mol/l,邻苯二甲醛终浓度0.138mol/l。
所述2-氨基-4-[羟基(甲基)磷酰基]-l-丁酸标准曲线制作方法:用超纯水配制5g/l的2-氨基-4-[羟基(甲基)磷酰基]-l-丁酸标准溶液,稀释成3个浓度梯度:0.01~0.1g/l(0.01、0.02、0.04、0.06、0.08、0.1g/l)、0.1~1.0g/l(0.1、0.2、0.4、0.6、0.8、1.0g/l)、1.0~5.0g/l(1.0、2.0、3.0、4.0、5.0g/l),用排枪分别吸取不同浓度梯度的标准溶液40μl至96孔微孔荧光检测板,分别加入40μl配制好的冰浴保存的a液,在酶标仪中振荡30s,再分别加入100μl超纯水,再振荡30s,在,在λex=340nm;λem=455nm,测定荧光强度值,以所得荧光强度值为纵坐标,对应标品浓度为横坐标,制作标准曲线。共制得3个浓度范围的标准曲线,可知在样品浓度为0.01~0.1g/l时候线性良好(如图1),r2=0.9978,表明此法有很高的准确性和适用性。
3、高效液相色谱复筛
将步骤2筛选出菌株接种到斜面培养基,30℃培养48h后,至于4℃冰箱保存。
将保存于斜面上的菌株接种至种子培养基中,在30℃培养24h。将种子液以体积浓度1%的接种量接种至发酵培养基中,30℃,150rpm振荡培养60h。在12000g下离心5min,收集湿菌体。取湿菌体,加入底物2-n-苯乙酰基-4-[羟基(甲基)磷酰基]-dl-丁酸和氨水,用氨水调节溶液ph8.5,构成10ml反应体系,湿菌体终浓度50g/l,底物终浓度50mm,置于30℃水浴摇床转化24h。取1ml转化液,离心分离后取上清液进行hplc分析。最终得到一株催化活力较高的野生菌株,并将此菌株记为菌株zjb-17007。
高效液相色谱(hplc)复筛方法为:将上述转化液离心取上清,用超纯水稀释10倍后,取200μl至干净1.5mlep管,加入衍生化试剂200μl,在30℃反应5min后,加入600μl超纯水混匀后,用针筒滤膜(0.22μm)过滤后,放入hplc进行检测,得到转化液中2-氨基-4-[羟基(甲基)磷酰基]-l-丁酸和2-氨基-4-[羟基(甲基)磷酰基]-d-丁酸的浓度。
所述衍生化试剂:0.1g邻苯二甲醛、0.12gn-苯乙酰-l-半胱氨酸,用10ml无水乙醇溶解后,用硼酸缓冲液(100mm,ph9.8)定容至50ml。
所述hplc条件:美国戴安u3000高效液相色谱仪并配备荧光检测器;戴安c18硅羟基填料柱(250mm×4.6mm);流动相为含10%纯甲醇的乙酸铵(50mmph4.7)溶液,柱温控制在35℃,荧光激发波长λex=350nm、发射波长λem=450nm,进样量为10μl。在此条件下,2-氨基-4-[羟基(甲基)磷酰基]-l-丁酸和2-氨基-4-[羟基(甲基)磷酰基]-d-丁酸的出峰时间为7.800min、9.290min(如图2)。
富集培养基组成:2-n-苯乙酰基-4-[羟基(甲基)磷酰基]-dl-丁酸1g/l,葡萄糖5g/l,氯化钠1g/l,k2hpo4·3h2o0.8g/l,kh2po43.3g/l,mgso4·7h2o0.2g/l,溶剂为去离子水,ph为7。
平板筛选培养基组成:2-n-苯乙酰基-4-[羟基(甲基)磷酰基]-dl-丁酸1g/l,葡萄糖5g/l,氯化钠1g/l,k2hpo4·3h2o0.8g/l,kh2po43.3g/l,mgso4·7h2o0.2g/l,琼脂20g/l,溶剂为去离子水,ph为7。
生长培养基组成:氯化钠10g/l,蛋白胨10g/l,酵母粉5g/l,溶剂为去离子水。斜面培养基、种子培养基、发酵培养基组成同实施例3。
实施例2:菌株zjb-17007鉴定
1、形态学鉴定:
本发明实施例1筛选得到的菌株zjb-17007在固体培养基上,37℃培养24小时后形成圆形或近圆形,质地软,表面较光滑,扁平,边缘整齐,有光泽的淡黄色菌落,直径2-4mm。革兰氏染色观察:紫色长杆状,有芽孢。固体培养基组成:氯化钠10g/l,蛋白胨10g/l,酵母粉5g/l,琼脂20g/l,溶剂为去离子水。
2、生理生化鉴定:
利用biolog(genⅲ)自动微生物鉴定系统对菌株zjb-17007进行了94种表型测试,包括71种碳源利用情况检测以及23种化学敏感性检测:将菌株接种于特定的平板培养基,33℃恒温培养2天,用无菌棉签将平板上的菌体洗下,与接种液(if-a)混合,制成菌悬液,用浊度计调整至91%t/if-a。用8孔电动加液器将菌悬液分别加在biologgenⅲ微孔鉴定板的各孔中,每孔100μl。将微孔鉴定板放在33℃培养箱中,分别在培养12h、24h、36h、48h后将其置于biolog读数仪上读取结果。
菌株zjb-17007经biolog读数仪分析代谢指纹,菌株zjb-17007可较强利用65种碳源,对其他3种碳源不能利用或利用能力较弱;菌株zjb-17007对23种化学物质敏感。biolog系统给出48h鉴定结果如表1和表2所示。
表1.菌株zjb-17007对biologgenⅲ板上71种碳源的利用能力
表2.菌株zjb-17007对biologgenⅲ板上23种化学物质的化学敏感性
分子生物学鉴定:
以菌株zjb-17007的总dna为模板,利用引物p1:5'-agagtttgatcctggctcag-3'和p2:5'-aaggaggtgatccagccgca-3'扩增菌株的16srdna基因,将基因产物同t载体连接后,委托上海生工对该菌16srdna扩增及测序,得到该菌株的16srdna序列(seqidno.1)后,在ncbi网站上用blast检索genbank中相关菌株的16srdna基因序列,并进行同源性比对。本发明微生物与lysinibacillusboronitolerans菌株nbrc103108同源性最高(homology,99%,basedon16sribosomalrnagene),根据微生物遗传学鉴定原则,基于16srdna同源性高于95%,鉴定菌基本属于对照菌。因此,本实验鉴定菌株zjb-17007为耐硼赖氨酸芽孢杆菌(lysinibacillusboronitolerans),拟命名为耐硼赖氨酸芽孢杆菌(lysinibacillusboronitolerans)zjb-17007,保藏于中国典型培养物保藏中心,保藏编号cctccno:m2017602,保藏日期2017年10月23日,地址:中国·武汉·武汉大学,430072。
任何对核苷酸序列表中seqidno.1所示核苷酸序列进行一个或多个核苷酸的取代、缺失或插入所得的核苷酸序列,只要与该序列具有90%以上的同源性,均属于本发明的保护范围。
实施例3:湿菌体的制备
(1)斜面培养:
将耐硼赖氨酸芽孢杆菌zjb-17007接种至斜面培养基,在30℃培养48h,获得斜面菌体;
所述斜面培养基终浓度为:酪蛋白胨17g/l,na2hpo43.0g/l,k2hpo41.5g/l,大豆蛋白胨3g/l,葡萄糖2.5g/l,nacl5g/l,琼脂20g/l,溶剂为去离子水,ph值为7.0。
(2)种子培养:
从斜面菌体挑取一接种环菌体接种至种子培养基,在30℃培养24h,获得种子液;
所述种子培养基终浓度组成为:酪蛋白胨17g/l,na2hpo43.0g/l,k2hpo41.5g/l,大豆蛋白胨3g/l,葡萄糖2.5g/l,nacl5g/l,溶剂为去离子水,ph值为7.0。
(3)发酵培养:
将种子液以体积浓度1%的接种量接种至发酵培养基中,30℃,150rpm振荡培养60h后,在12000g下离心10min,收集湿菌体;
所述发酵培养基终浓度组成为:酪蛋白胨17g/l,na2hpo43.0g/l,k2hpo41.5g/l,大豆蛋白胨3g/l,葡萄糖2.5g/l,nacl5g/l,溶剂为去离子水,ph值为7.0。
实施例4、以2-n-苯乙酰基-4-[羟基(甲基)磷酰基]-dl-丁酸为底物的生物转化反应
(1)将底物2-n-苯乙酰基-4-[羟基(甲基)磷酰基]-dl-丁酸溶于氨水,再加入实施例3方法制备的湿菌体0.3g,并用氨水调节ph8.5,构成10ml反应体系,使底物终浓度为50mm,置于30℃水浴摇床,150rpm转化24h。取1ml转化液至ep管中,离心分离后取上清液按实施例1中所述方法进行hplc分析检测。结果表明,zjb-17007可使底物2-n-苯乙酰基-4-[羟基(甲基)磷酰基]-dl-丁酸转化得到产物2-氨基-4-[羟基(甲基)磷酰基]-l-丁酸,转化率为49.7%,产物2-氨基-4-[羟基(甲基)磷酰基]-l-丁酸的光学纯度为99.9%。
(2)将酶催化反应得到的含产物2-氨基-4-[羟基(甲基)磷酰基]-l-丁酸的转化液进行分离,提取出产物2-氨基-4-[羟基(甲基)磷酰基]-l-丁酸。
1)萃取:
将得到的转化液加入分液漏斗,同时加入等体积的二氯甲烷,摇晃后静置3h,从分液漏斗下端放出有机层,从上端倒出水相层。得到水相层为含有产物2-氨基-4-[羟基(甲基)磷酰基]-l-丁酸的水溶液。
2)用阴离子交换树脂进行产物分离
①树脂预处理
树脂201×7用50℃温水浸泡,使树脂充分膨胀并除去细小颗粒(倾斜或者浮选法);用1.0m的naoh水溶液浸泡3h,用去离子水洗至中性,再用1.0m的hcl水溶液浸泡3h后用去离子水洗至中性,然后用1.0m的naoh水溶液浸泡3h,转化为oh-形式,最后用去离子水洗至中性备用。
②装柱
采用湿法装柱(内径1.5cm,高40cm),先在离子交换柱内先加入13cm高度的去离子水,再取30ml湿树脂201×7装入玻璃杯,加入50ml去离子水,慢慢搅拌,悬浮状的树脂倒入离子交换柱中,让其自然沉降,使其在柱子内分泌均匀,不应有明显的分界线及气泡产生等。
③上样,洗脱
将步骤1)所得的水溶液调至ph2.5,以上柱流速4.0bv/h进行上样,每隔一段时间取出流出液进行液相检测,当吸附达到最高值时,先用去离子水洗涤,再用1.0m的氨水进行洗脱,洗脱速度为2.0bv/h,用浸染0.2%的茚三酮溶液的滤纸进行检测,滤纸变紫色表明洗脱液含有目标物质2-氨基-4-[羟基(甲基)磷酰基]-l-丁酸,收集含目标组分的洗脱液,每隔一段时间检测其中所含有的2-氨基-4-[羟基(甲基)磷酰基]-l-丁酸的含量。洗脱完毕后用去离子水洗涤离子交换柱,并将树脂转化成oh-用于下一次分离。
④纯化
洗脱液减压蒸馏得到黄色粘稠物质,加入甲醇溶解,冰浴下搅拌重结晶得到白色固体,过滤即得产物2-氨基-4-[羟基(甲基)磷酰基]-l-丁酸。
以步骤(1)反应条件制备的转化液1l经上述方法分离纯化后,得到2-氨基-4-[羟基(甲基)磷酰基]-l-丁酸固体4.9g,产物得率98.9%,光学纯度为99.9%。
实施例5:以2-n-苯乙酰基-4-[羟基(甲基)磷酰基]-dl-丁酸为底物的生物转化反应
将底物2-n-苯乙酰基-4-[羟基(甲基)磷酰基]-dl-丁酸溶于氨水,再加入实施例3方法制备的湿菌体0.5g,用氨水调节ph8.5,构成10ml反应体系,其中底物加入终浓度为100mm,置于30℃水浴摇床,150rpm转化24h。取1ml转化液至ep管中,离心分离后取上清液按实施例1中所述方法进行hplc分析检测得转化率49.9%。同样反应条件下制备1l转化液,按实施例4中方法分离纯化后,得到产物2-氨基-4-[羟基(甲基)磷酰基]-l-丁酸9.2g,产物得率92.9%,光学纯度为99.9%。
实施例6:以2-n-苯乙酰基-4-[羟基(甲基)磷酰基]-dl-丁酸为底物的生物转化反应
将底物2-n-苯乙酰基-4-[羟基(甲基)磷酰基]-dl-丁酸溶于氨水,再加入实施例3方法制备的湿菌体0.6g,用氨水调节ph8.5,构成10ml反应体系,其中底物加入终浓度为200mm,置于30℃水浴摇床,150rpm转化24h。取1ml转化液至ep管中,离心分离后取上清液按实施例1中所述方法进行hplc分析检测得转化率49.9%。同样反应条件下制备1l转化液,按实施例4中方法分离纯化后,得到产物2-氨基-4-[羟基(甲基)磷酰基]-l-丁酸19.0g,产物得率95.9%,光学纯度为99.9%。
实施例7:以2-n-苯乙酰基-4-[羟基(甲基)磷酰基]-dl-丁酸为底物的生物转化反应
将底物2-n-苯乙酰基-4-[羟基(甲基)磷酰基]-dl-丁酸溶于氨水,再加入实施例3方法制备的湿菌体2g,用氨水调节ph8.5,构成10ml反应体系,其中底物加入终浓度为200mm,置于30℃水浴摇床,150rpm转化24h。取1ml转化液至ep管中,离心分离后取上清液按实施例1中所述方法进行hplc分析检测得转化率49.9%。同样反应条件下制备1l转化液,按实施例4中方法分离纯化后,得到产物2-氨基-4-[羟基(甲基)磷酰基]-l-丁酸19.5g,产物得率97.9%,光学纯度为99.9%。
实施例8:以2-n-苯乙酰基-4-[羟基(甲基)磷酰基]-dl-丁酸为底物的生物转化反应
将底物2-n-苯乙酰基-4-[羟基(甲基)磷酰基]-dl-丁酸溶于氨水,再加入实施例3方法制备的湿菌体0.5g,用氨水调节ph8.5,构成10ml反应体系,其中底物加入终浓度为50mm,置于40℃水浴摇床,150rpm转化24h,取1ml转化液至ep管中,离心分离后取上清液按实施例1中所述方法进行hplc分析检测得转化率49.9%。同样反应条件下制备1l转化液,按实施例4中方法分离纯化后,得到产物2-氨基-4-[羟基(甲基)磷酰基]-l-丁酸4.86g,产物得率98.1%,光学纯度为99.9%。
实施例9:以2-n-苯乙酰基-4-[羟基(甲基)磷酰基]-dl-丁酸为底物的生物转化反应
将底物2-n-苯乙酰基-4-[羟基(甲基)磷酰基]-dl-丁酸溶于氨水,再加入实施例3方法制备的湿菌体2g,用氨水调节ph8.5,构成10ml反应体系,其中底物加入终浓度为200mm,置于50℃水浴摇床,150rpm转化24h.取1ml转化液至ep管中,离心分离后取上清液按实施例1中所述方法进行hplc分析检测得转化率49.9%。同样反应条件下制备1l转化液,按实施例4中方法分离纯化后,得到产物2-氨基-4-[羟基(甲基)磷酰基]-l-丁酸19.4g,产物得率97.9%,光学纯度为99.9%。
实施例10:以n-苯乙酰-dl-丙氨酸为底物的生物转化反应
6.0g丙氨酸和4.6gnaoh加入30ml蒸馏水中,冰浴条件下充分搅拌至溶液无色透明,滴加5.0g苯乙酰氯,滴加完成后,溶液呈淡黄色,继续冰浴条件反应2h,再常温搅拌反应5h至溶液呈无色透明,加hcl调节ph至2.0左右,析出白色固体,抽滤烘干得到白色固体即为n-苯乙酰-dl-丙氨酸13g。
将底物n-苯乙酰-dl-丙氨酸溶于氨水,再加入实施例3方法制备的湿菌体0.6g,用氨水调节ph8.5,构成10ml反应体系,其中底物加入终浓度为100mm,置于30℃水浴摇床,150rpm转化24h。取1ml转化液至ep管中,离心分离后取上清液按实施例1中所述方法进行hplc分析检测得转化率49.9%。同样反应条件下制备1l转化液,按实施例4中方法(用浸染0.2%的茚三酮溶液的滤纸进行检测,滤纸变紫黑色表明洗脱液含有目标物质)分离纯化后,得到产物l-丙氨酸4.36g,产物得率97.9%,光学纯度为99.9%。
实施例11:以n-苯乙酰-dl-苏氨酸为底物的生物转化反应
6.0g苏氨酸和4.6gnaoh加入30ml蒸馏水中,冰浴条件下充分搅拌至溶液无色透明,滴加5.0g苯乙酰氯,滴加完成后,溶液呈淡黄色,继续冰浴条件反应2h,再常温搅拌反应5h至溶液呈无色透明,加hcl调节ph至2.0左右,析出白色固体,抽滤烘干得到白色固体即为n-苯乙酰-dl-苏氨酸10.35g。
将底物n-苯乙酰-dl-苏氨酸溶于氨水,再加入实施例3方法制备的湿菌体3g,用氨水调ph8.5,构成100ml反应体系,其中底物加入终浓度为100mm,置于30℃水浴摇床,150rpm转化24h。取1ml转化液至ep管中,离心分离后取上清液按实施例1中所述方法进行hplc分析检测得转化率49.9%。同样反应条件下制备1l转化液,按实施例4中方法(用浸染0.2%的茚三酮溶液的滤纸进行检测,滤纸变紫黑色表明洗脱液含有目标物质)分离纯化后,得到产物l-苏氨酸5.88g,产物得率98.8%,光学纯度为99.9%。
实施例12:以n-苯乙酰-dl-酪氨酸为底物的生物转化反应
3.619gdl-酪氨酸和1.8gnaoh加入25ml蒸馏水中,冰浴条件下充分搅拌至溶液透亮,滴加2.875g苯乙酰氯,滴加完成后,溶液呈乳白色,继续冰浴条件反应2h,再常温搅拌反应5h后,加hcl调节ph至2.0左右,析出大量白色固体,抽滤烘干得到白色固体即为n-苯乙酰-dl-酪氨酸5.5g。
将底物n-苯乙酰-dl-酪氨酸溶于氨水,再加入实施例3方法制备的湿菌体0.3g,用氨水调节ph8.5,构成10ml反应体系,其中底物加入终浓度为100mm,置于30℃水浴摇床,150rpm转化24h。取1ml转化液至ep管中,离心分离后取上清液按实施例1中所述方法进行hplc分析检测得转化率49.8%。同样反应条件下制备1l转化液,按实施例4中方法(用浸染0.2%的茚三酮溶液的滤纸进行检测,滤纸变紫黑色表明洗脱液含有目标物质)分离纯化后,得到产物l-酪氨酸8.84g,产物得率97.6%,光学纯度为99.9%。
实施例13:以n-苯乙酰基dl-苯丙氨酸为底物的生物转化反应
3.3gdl-苯丙氨酸和1.8gnaoh加入25ml蒸馏水中,冰浴条件下充分搅拌,溶液透亮,滴加2.875g苯乙酰氯,滴加完成后,溶液呈乳白色,继续冰浴条件反应2h,再常温搅拌反应5h后,加hcl调节ph至4.0左右,析出大量白色固体,抽滤烘干得到白色固体即为n-苯乙酰-dl-苯丙氨酸5.2g。
将底物n-苯乙酰-dl-苯丙氨酸溶于氨水,再加入实施例3方法制备的湿菌体0.4g,用氨水调节ph8.5,构成10ml反应体系,其中底物加入终浓度为100mm,置于30℃水浴摇床,150rpm转化24h。取1ml转化液至ep管中,离心分离后取上清液按实施例1中所述方法进行hplc分析检测得转化率49.8%。同样反应条件下制备1l反应液,按实施例4中方法(用浸染0.2%的茚三酮溶液的滤纸进行检测,滤纸变紫黑色表明洗脱液含有目标物质)分离纯化后,得到产物l-苯丙氨酸8.11g,产物得率98.3%,光学纯度为99.9%。
实施例14:以n-苯乙酰-dl-亮氨酸为底物的生物转化反应
3.92g亮氨酸和3.2gnaoh加入30ml蒸馏水中,冰浴条件下充分搅拌至溶液透亮,滴加6.2g苯乙酰氯,滴加完成后,溶液呈淡黄色,继续冰浴条件反应2h,再常温搅拌反应5h后,加hcl调节ph至2.0左右,析出大量白色固体,抽滤烘干得到白色固体即为n-苯乙酰-dl-亮氨酸7.43g。
将底物n-苯乙酰-dl-亮氨酸溶于氨水,再加入实施例3方法制备的湿菌体0.6g,用氨水调节ph8.5,构成10ml反应体系,其中底物加入终浓度为100mm,置于30℃水浴摇床,150rpm转化24h,取1ml转化液至ep管中,离心分离后取上清液按实施例1中所述方法进行hplc分析检测得转化率49.7%。同样反应条件下制备1l转化液,按实施例4中方法(用浸染0.2%的茚三酮溶液的滤纸进行检测,滤纸变紫黑色表明洗脱液含有目标物质)分离纯化后,得到产物l-亮氨酸6.32g,产物得率96.4%,光学纯度为99.9%。
实施例15:以n-苯乙酰-dl-异亮氨酸为底物的生物转化反应
7.84g异亮氨酸和6.4gnaoh加入60ml蒸馏水中,冰浴条件下充分搅拌,溶液透亮,滴加5.78g苯乙酰氯,滴加完成后,溶液呈淡黄色,继续冰浴条件反应2h,再常温搅拌反应5h后,加hcl调节ph至2.0左右,溶液变为无色透明,析出少量白色固体,抽滤烘干得到白色固体即为n-苯乙酰-dl-异亮氨酸7.28g。
将底物n-苯乙酰-dl-异亮氨酸溶于氨水,再加入实施例3方法制备的湿菌体0.5g,用氨水调节ph8.5,构成10ml反应体系,其中底物加入终浓度为100mm,置于30℃水浴摇床,150rpm转化24h,取1ml转化液至ep管中,离心分离后取上清液按实施例1中所述方法进行hplc分析检测得转化率49.8%。同样反应条件下制备1l转化液,按实施例1中方法(用浸染0.2%的茚三酮溶液的滤纸进行检测,滤纸变紫黑色表明洗脱液含有目标物质)分离纯化后,得到产物l-异亮氨酸6.41g,产物得率93.7%,光学纯度为99.9%。
实施例16:以n-苯乙酰-dl-丝氨酸为底物的生物转化反应
6.0g丝氨酸和4.6gnaoh加入20ml蒸馏水中,冰浴条件下充分搅拌至溶液无色透明,滴加5.2g苯乙酰氯,滴加完成后,溶液呈淡黄色,继续冰浴条件反应2h,再常温搅拌反应5h后,溶液呈无色透明,加hcl调节ph至2.0左右,析出白色固体,抽滤烘干得到白色固体即为n-苯乙酰-dl-丝氨酸11g。
将底物n-苯乙酰-dl-丝氨酸溶于氨水,再加入实施例3方法制备的湿菌体0.5g用氨水调节溶液ph为8.5,构成10ml反应体系,其中底物加入终浓度为100mm,置于30℃水浴摇床,150rpm转化24h,取1ml转化液至ep管中,离心分离后取上清液按实施例1中所述方法进行hplc分析检测得转化率49.5%。同样反应条件下制备1l转化液,按实施例4中方法(用浸染0.2%的茚三酮溶液的滤纸进行检测,滤纸变紫黑色表明洗脱液含有目标物质)分离纯化后,得到产物l-丝氨酸4.91g,产物得率93.5%,光学纯度为99.9%。
实施例17:以n-苯乙酰-dl-甲硫氨酸为底物的生物转化反应
8.94g甲硫氨酸和7.2gnaoh加入120ml蒸馏水中,冰浴条件下充分搅拌至溶液透亮,滴加10.3g苯乙酰氯,滴加完成后,溶液呈透明,继续冰浴条件反应2h,再常温搅拌反应5h后,加hcl调节ph至2.0左右,析出大量白色固体,减压抽滤烘干得到n-苯乙酰-dl-甲硫氨酸14.8g。
将底物n-苯乙酰-dl-甲硫氨酸溶于氨水,再加入实施例3方法制备的湿菌体0.45g,用氨水调节溶液ph为8.5构成10ml反应体系,其中底物加入终浓度为100mm,置于30℃水浴摇床,150rpm转化24h。取1ml转化液至ep管中,离心分离后取上清液按实施例1中所述方法进行hplc分析检测得转化率49.4%。同样反应条件下制备1l转化液,按实施例4中方法(用浸染0.2%的茚三酮溶液的滤纸进行检测,滤纸变紫黑色表明洗脱液含有目标物质)分离纯化后,得到产物l-甲硫氨酸7.22g,产物得率96.9%,光学纯度为99.9%。
实施例18:以n-苯乙酰-dl-缬氨酸为底物的生物转化反应
9.36g缬氨酸和7.2gnaoh加入60ml蒸馏水中,冰浴条件下充分搅拌至溶液透亮,滴加14.24g苯乙酰氯,滴加完成后,溶液呈微黄色,略有浑浊,继续冰浴条件反应2h,再常温搅拌反应5h后,溶液变无色透明,加hcl调节ph至2.0左右,析出大量白色固体,抽滤烘干得到白色固体即为n-苯乙酰-dl-缬氨酸17.3g。
将底物n-苯乙酰-dl-缬氨酸溶于氨水,再加入实施例3方法制备的湿菌体0.2g,用氨水调节溶液ph为8.5,构成10ml反应体系,其中底物加入终浓度为100mm,置于30℃水浴摇床,150rpm转化24h。取1ml转化液至ep管中,离心分离后取上清液按实施例1中所述方法进行hplc分析检测得转化率49.2%。同样反应条件下制备1l转化液,按实施例4中方法(用浸染0.2%的茚三酮溶液的滤纸进行检测,滤纸变紫黑色表明洗脱液含有目标物质)分离纯化后,得到产物l-缬氨酸5.62g,产物得率96.0%,光学纯度为99.9%。
实施例19:以n-苯乙酰-dl-谷氨酸为底物的生物转化反应
5g谷氨酸和4.6gnaoh加入30ml蒸馏水中,冰浴条件下充分搅拌至溶液透亮,滴加5.735g苯乙酰氯,滴加完成后,溶液呈透明,继续冰浴条件反应2h,再常温搅拌反应5h后,加hcl调节ph至2.0左右,溶液变浑浊,4℃冰箱冷藏过夜后析出大量白色固体,减压抽滤烘干得到n-苯乙酰-dl-谷氨酸8.1g。
将底物n-苯乙酰-dl-谷氨酸溶于氨水,再加入实施例3方法制备的湿菌体0.4g,用氨水调节溶液ph为8.5,构成10ml反应体系,其中底物加入终浓度为100mm,置于30℃水浴摇床,150rpm转化24h,取1ml转化液至ep管中,离心分离后取上清液按实施例1中所述方法进行hplc分析检测得转化率49.3%。同样反应条件下制备1l转化液,按实施例4中方法(用浸染0.2%的茚三酮溶液的滤纸进行检测,滤纸变紫黑色表明洗脱液含有目标物质)分离纯化后,得到产物l-谷氨酸7.05g,产物得率95.9%,光学纯度为99.9%。
序列表
<110>浙江工业大学
<120>耐硼赖氨酸芽孢杆菌zjb-17007及其应用
<160>1
<170>siposequencelisting1.0
<210>1
<211>1408
<212>dna
<213>耐硼赖氨酸芽孢杆菌(lysinibacillusboronitolerans)
<400>1
ccttcggcggctggctccaaaggttacctcaccgacttcgggtgttacaaactctcgtgg60
tgtgacgggcggtgtgtacaaggcccgggaacgtattcaccgcggcatgctgatccgcga120
ttactagcgattccggcttcatgtaggcgagttgcagcctacaatccgaactgagaacga180
ctttatcggattagctccctctcgcgagttggcaaccgtttgtatcgtccattgtagcac240
gtgtgtagcccaggtcataaggggcatgatgatttgacgtcatccccaccttcctccggt300
ttgtcaccggcagtcaccttagagtgcccaactaaatgatggcaactaagatcaagggtt360
gcgctcgttgcgggacttaacccaacatctcacgacacgagctgacgacaaccatgcacc420
acctgtcaccgttgcccccgaaggggaaactatatctctacagtggtcaacgggatgtca480
agacctggtaaggttcttcgcgttgcttcgaattaaaccacatgctccaccgcttgtgcg540
ggcccccgtcaattcctttgagtttcagtcttgcgaccgtactccccaggcggagtgctt600
aatgcgttagctgcagcactaaggggcggaaaccccctaacacttagcactcatcgttta660
cggcgtggactaccagggtatctaatcctgtttgctccccacgctttcgcgcctcagcgt720
cagttacagaccagaaagtcgccttcgccactggtgttcctccaaatctctacgcatttc780
accgctacacttggaattccactttcctcttctgcactcaagtcccccagtttccaatga840
ccctccacggttgagccgtgggctttcacatcagacttaaaggaccgcctgcgcgcgctt900
tacgcccaataattccggacaacgcttgccacctacgtattaccgcggctgctggcacgt960
agttagccgtggctttctaataaggtaccgtcaaggtacagccagttactactgtacttg1020
ttcttcccttacaacagagttttacgatccgaaaaccttcttcactcacgcggcgttgct1080
ccatcaggctttcgcccattgtggaagattccctactgctgcctcccgtaggagtctggg1140
ccgtgtctcagtcccagtgtggccgatcaccctctcaggtcggctacgcatcgtcgcctt1200
ggtgagccgttacctcaccaactagctaatgcgccgcgggcccatcctatagcgacagcc1260
gaaaccgtctttcagtctctcgccatgaagcaagagagattattcggtattagccccggt1320
ttcccggagttatcccaaactatagggtaggttgcccacgtgttactcacccgtccgccg1380
ctaacgtcaaaggagcaagctccttttc1408
- 还没有人留言评论。精彩留言会获得点赞!