查尔酮-氨基二硫代甲酸酯类过氧化氢酶抑制剂及其合成方法和应用与流程
本发明涉及抗肿瘤药物化学领域,具体涉及一类新型查尔酮-氨基二硫代甲酸酯类化合物、它们的制备方法及其作为一类新的抗肿瘤药物先导化合物的应用。
背景技术:
查尔酮类化合物是一类存在于甘草(glycyrrhlza)、红花(carthamus)等天然药用植物中的有机化合物,其基本结构为1,3-二苯基丙烯酮,能与多种受体结合,在抗肿瘤、抗菌、抗氧化等方面具有广泛的生物活性。同时,查尔酮类化合物是合成黄酮类化合物的重要中间体,在有机合成中有着重要的用途。因此,制备新型的查尔酮衍生物并研究其抗肿瘤方面的应用具有重要的意义。同时,氨基二硫代甲酸酯作为明星骨架,在药物化学领域倍受青睐。可以作为药理片段,设计抗肿瘤、抗病毒、抗菌、抗氧化等药用小分子。
技术实现要素:
本发明目的在于提供一类优于抗肿瘤药物5-氟尿嘧啶的强效新型查尔酮-氨基二硫代甲酸酯类化合物。
本发明的另一个目的在于提供一种简单高效,绿色环保的合成新型查尔酮-氨基二硫代甲酸酯类化合物的方法。
本发明的再一个目的在于探寻所述化合物的抗肿瘤靶点,证明化合物对过氧化氢酶(catalase)的抑制作用。
为实现本发明目的,本发明所述一类新型查尔酮-氨基二硫代甲酸酯类化合物具有如下通式:
所述哌嗪取代基选c1-5烷基,c2-3酰基,c1-3羟基,c2-5酯基,苯基,甲氧基取代的苯基,间二氮杂苯,甲磺酰基,取代基与氮原子相连。
所述查尔酮-氨基二硫代甲酸酯类化合物选用式(iii)所示化合物:
本发明所述新型查尔酮-氨基二硫代甲酸酯类化合物主要通过下列步骤制得:
(1)化合物(ii)的制备方法:
溶剂中,将4-氨基查尔酮i在碱性条件下和氯乙酰氯反应得到化合物ii,所用的碱性化合物是氢氧化钠、氢氧化钾、碳酸钠、碳酸钾、磷酸钠、十二水磷酸钠、磷酸钾、碳酸氢钾、碳酸氢钠中的一种;所用的溶剂为乙醇、甲醇、n,n-二甲基甲酰胺、二甲基亚砜、四氢呋喃、二氧六环、二氯甲烷、二氯乙烷中之一或其中任意两种的混合物;反应在0-60℃之间进行。
(2)通式(iii)的制备方法:
溶剂中,化合物(ii),二硫化碳,氨基不同取代的二硫代甲酸酯类化合物在碱性条件下一锅煮反应得到化合物iiia~iiil,所用的碱性化合物是氢氧化钠、氢氧化钾、碳酸钠、碳酸钾、磷酸钠、十二水磷酸钠、磷酸钾、碳酸氢钾、碳酸氢钠中的一种;所用的溶剂为乙醇、甲醇、n,n-二甲基甲酰胺、二甲基亚砜、四氢呋喃、二氧六环、二氯甲烷、丙酮中之一或其中任意两种的混合物;反应在25-60℃之间进行。
本发明优点:该类化合物体外抗癌活性试验表明其对多种肿瘤细胞pc-3、mcf-7、mgc-803均具有一定的抑制作用,同时对过氧化氢酶(catalase)有显著的抑制作用。化合物iiia,iiib,iiic,iiid,iiik和iiil对三种癌细胞的活性优于抗肿瘤药物5-氟尿嘧啶,可作为进一步开发的候选或者先导化合物,应用于制备抗肿瘤药物。2、合成方法简单高效,绿色环保,收率高,达82%以上。
附图说明
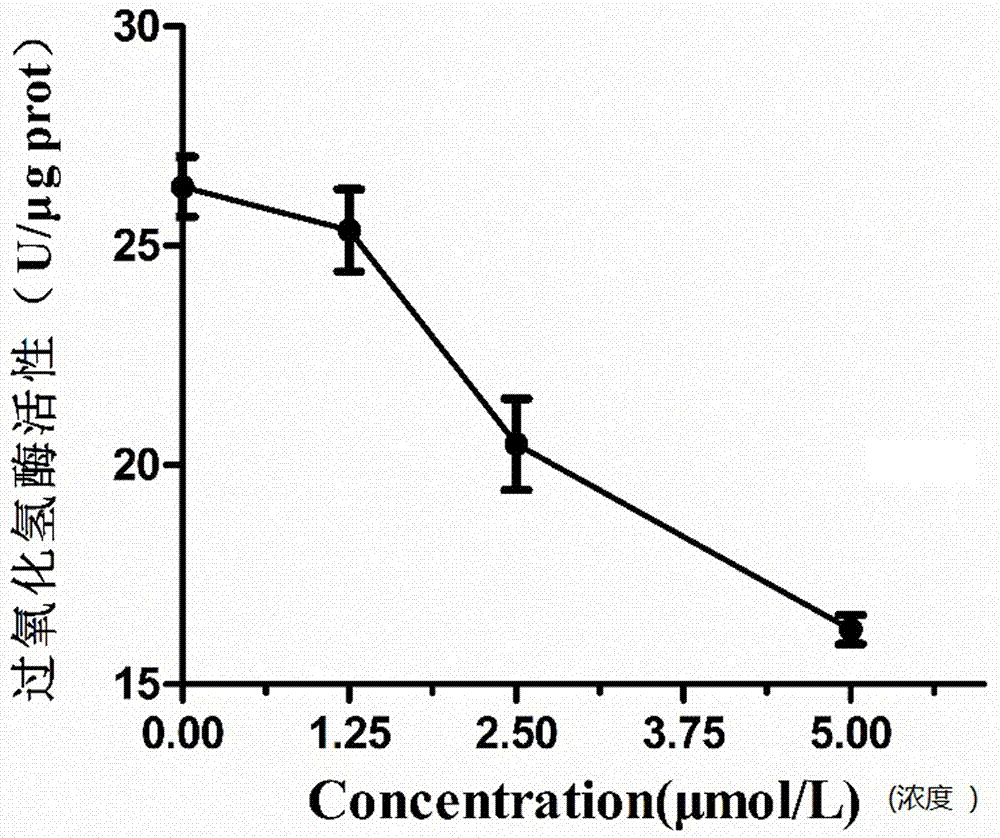
图1为不同浓度化合物iiid对pc3细胞内过氧化氢酶的影响曲线图。
具体实施方式
为对本发明进行更好地说明,举实施例如下:
实施例1化合物(ii)的制备
将4-氨基查尔酮化合物1(1.565g,5mmol)和无水碳酸钾(0.69g,5mmol)混合,加入20ml的二氯乙烷,体系中加入氯乙酰氯(5mmol),升温到40℃,继续反应。tlc监测反应进程,待反应结束后,向体系中加入蒸馏水,淬灭反应,然后用二氯乙烷萃取3次,再用饱和食盐水反萃二氯乙烷相3次,每次20ml,最后有机相用无水硫酸镁干燥,滤除硫酸镁,滤液减压蒸馏除去二氯乙烷。所得粗产品用硅胶柱柱层析分离纯化,石油醚/乙酸乙酯=8:1洗脱,得化合物(ii)。
实施例2通式(iii)的制备
将化合物(ii)(1.946g,5mmol)、二硫化碳(1.2g,15mmol)、氨基不同取代的二硫代甲酸酯类化合物(6mmol),加入10ml的丙酮,室温搅拌。tlc监测反应进程,待反应结束后,向体系中加入蒸馏水,淬灭反应,然后用二氯乙烷萃取3次,再用饱和食盐水反萃二氯乙烷相3次,每次10ml,最后有机相用无水硫酸镁干燥,滤除硫酸镁,滤液减压蒸馏除去二氯乙烷。所得粗产品用硅胶柱柱层析分离纯化,石油醚/乙酸乙酯=9:1洗脱,得化合物(iii)。
化合物(ii):1hnmr(400mhz,dmso-d6)δ10.9(s,1h),8.2(d,2h),7.9(d,1h),7.8(d,2h),7.7(d,1h),7.2(s,2h),4.3(s,2h),3.9(s,6h),3.7(s,3h).收率85%。化合物(iiia):1hnmr(400mhz,dmso-d6)δ10.7(s,1h),8.2(d,2h),7.9(d,1h),7.8(d,2h),7.7(d,1h),7.2(s,2h),4.3(s,2h),4.2(d,2h),4.0(s,2h),3.9(s,6h),3.7(s,3h),2.4(s,4h),2.2(s,3h).,收率83%。
化合物(iiib):1hnmr(400mhz,dmso-d6)δ10.7(s,1h),8.2(d,2h),7.9(d,1h),7.8(d,2h),7.7(d,1h),7.2(s,2h),4.4(s,2h),4.3–4.2(m,2h),4.0(dd,2h),3.9(s,6h),3.7(s,3h),3.6(d,4h),2.0(s,3h).,收率84%。
化合物(iiic):1hnmr(400mhz,dmso-d6)δ10.7(s,1h),8.2(d,2h),7.9(d,1h),7.8(d,2h),7.7(d,1h),7.2(s,2h),4.3(s,2h),4.2(s,2h),4.0(s,2h),3.9(s,6h),3.7(s,3h),2.5(s,4h),2.4(q,2h),1.0(t,3h).,收率89%。
化合物(iiid):1hnmr(400mhz,dmso-d6)δ10.7(s,1h),8.2(d,2h),7.9(d,1h),7.8(d,2h),7.7(d,1h),7.2(s,2h),4.5(t,1h),4.3(d,2h),4.2(d,2h),4.0(s,2h),3.9(d,6h),3.7(s,3h),3.5(q,2h),2.6–2.5(m,4h),2.5(t,2h).,收率82%。
化合物(iiie):1hnmr(400mhz,dmso-d6)δ10.7(s,1h),8.2(d,2h),7.9(d,1h),7.8(d,2h),7.7(d,1h),7.2(s,2h),4.3(d,2h),4.2(s,2h),4.0(dd,2h),3.9(s,6h),3.7(s,3h),3.5(s,4h),1.4(s,9h).,收率90%。
化合物(iiif):1hnmr(400mhz,dmso-d6)δ10.7(s,1h),8.2(d,2h),7.9(d,1h),7.8(d,2h),7.7(s,1h),7.3–7.2(m,2h),7.2(d,2h),7.0(d,2h),6.8(dd,1h),4.4(s,4h),4.1(s,2h),3.9(s,6h),3.7(s,3h),3.3(s,4h).,收率83%。
化合物(iiig):1hnmr(400mhz,dmso-d6)δ10.7(s,1h),8.2(d,2h),7.9(d,1h),7.8(d,2h),7.7(d,1h),7.2(s,2h),6.9(d,2h),6.9(d,2h),4.3(s,4h),4.1(s,2h),3.9(s,6h),3.7(d,6h),3.2(s,4h).,收率90%。
化合物(iiih):1hnmr(400mhz,dmso-d6)δ10.7(s,1h),8.4(d,2h),8.2(s,2h),7.9(d,1h),7.8(d,2h),7.7(d,1h),7.2(s,2h),6.7(s,1h),4.5(s,2h),4.4(s,2h),4.1(s,2h),3.9(s,4h),3.9(s,6h),3.7(s,3h).,收率82%。
化合物(iiii):1hnmr(400mhz,dmso-d6)δ10.7(s,1h),8.2(d,2h),7.9(d,1h),7.8(d,2h),7.7(d,1h),7.2(s,2h),4.3(s,2h),4.2(s,2h),4.0(s,2h),3.9(s,6h),3.7(s,3h),2.5(s,4h),2.3–2.2(m,2h),1.4(dt,2h),1.3(dq,2h),0.9(t,3h).,收率85%。
化合物(iiij):1hnmr(400mhz,dmso-d6)δ10.7(s,1h),8.2(d,2h),7.9(d,1h),7.8(d,2h),7.7(d,1h),7.2(s,2h),4.4(s,2h),4.3(s,2h),4.1(s,2h),3.9(s,6h),3.7(s,3h),3.3(s,4h),3.0(s,3h).,收率88%。
化合物(iiik):1hnmr(400mhz,dmso-d6)δ10.7(s,1h),8.2(d,2h),7.9(d,1h),7.8(d,2h),7.7(d,1h),7.2(s,2h),4.4(s,2h),4.2(s,2h),4.1–3.9(m,2h),3.9(s,6h),3.7(s,3h),3.7(s,4h).,收率86%。
化合物(iiil):1hnmr(400mhz,dmso-d6)δ10.7(s,1h),8.2(d,2h),7.9(d,1h),7.8(d,2h),7.7(d,1h),7.2(s,2h),4.6(s,4h),4.4(s,2h),3.9(s,6h),3.7(s,3h),3.4(s,4h).,收率85%。
实施例3上述化合物的抗肿瘤活性测定:
筛选所用化合物均是由本发明合成、纯化而得;样品储备液:称取1-2mg样品置于2mlep管中,然后用dmso配制成溶液,4℃保存放置,实验时根据所需浓度利用培养基稀释。取对数生长期的细胞,消化计数后,用培养基调整细胞密度,以4000-5000个cell/孔接种至96孔板中,每孔150μl,培养24h后,弃去培养基,加入用培养基稀释好的药物(50μg/ml、100μg/ml),每个浓度设6个复孔,另设空白对照组及阴性对照组。药物作用72h后,每孔加入20μlmtt,继续培养4h后,吸去液体,加入150ml的dmso,振荡均匀,酶标仪490nm处检测吸光度值,计算抑制率,计算公式如下:抑制率(%)=(1-给药组吸光度值/空白组吸光度值)×100%,50μg/ml时抑制率大于50%的样品,重新设置浓度进行细筛。试验结果采用spss软件计算ic50值和相关系数。实验结果见表1。
表1化合物抑制瘤细胞株的ic50值
a每个数值用平均值±标准偏差(mean±sd)表示,方差分析:p<0.05.5-fu:5-氟尿嘧啶。
实施例4化合物iiid的过氧化氢酶(catalase)抑制活性的测定:
为了探究化合物iiid是否抑制过氧化氢酶,我们采用过氧化氢酶(catalase)活性检测试剂盒检测经化合物iiid作用后pc3细胞内过氧化氢酶的活性,如图1所示,随着浓度的升高,过氧化氢酶活性降低,说明化合物iiid抑制了过氧化氢酶的活性。
- 还没有人留言评论。精彩留言会获得点赞!