抗乳腺癌肿瘤药物的筛选模型的制作方法
本发明涉及药物药效筛选领域,特别涉及一种抗乳腺癌肿瘤药物的筛选模型。
背景技术:
乳腺癌为女性癌症好发程度第一名之癌症种类,而且末期癌病患死亡率偏高,原因在于除了标靶药物以外没有较好的治疗方式,以及化疗药物因为个体化差异导致治疗愈不高。由此针对患者个体化精准医疗需求越来越迫切。个体化精准医疗一方面提高治疗的精确性,另一方面也可以有效地降低患者用药的随机性和盲目性,从而减轻患者用药的伤害。近年来,与临床病人用药疗效相关性高的动物模型为病人来源肿瘤移植物模型(patient-derivedxenograftmodel,pdx模型)广泛应用于精准医疗中,但是现有的传统小鼠异种移植模型建构复杂、时间过长、花费昂贵以及存在临床应用性不足的问题。
技术实现要素:
针对上述现有的抗乳腺癌肿瘤筛选药物模型建构复杂、时间过长、费用昂贵以及临床应用性不足的问题,本发明提供一种抗乳腺癌肿瘤药物的筛选模型。
为了解决上述技术问题,本发明采用的技术方案是:
一种抗乳腺癌肿瘤药物的筛选模型,其中,其构建的具体步骤包括:
1)采用醋酸电浆将中空纤维反应器表面改制30~60min,灭菌处理15~30min;
2)将乳腺癌细胞株或乳腺癌病患肿瘤组织进行消化处理,获得乳腺癌肿瘤单细胞;
3)将乳腺癌肿瘤单细胞植入中空纤维反应器内,封口,并将中空纤维反应器放入培养皿中,加入rpmi-1640培养基,进行细胞贴附培养,1~3天后将中空纤维反应器取出,待用;
4)确定目标药物,以健康小鼠为给药对象,取步骤3)获得的中空纤维反应器植入健康小鼠背部,24h后建立小鼠乳腺癌肿瘤病理模型;
5)将目标药物施用于小鼠乳腺癌肿瘤病理模型,每隔1~2天给药一次,于给药2天、4天、8天、10天取出中空纤维反应器,检测乳腺癌肿瘤单细胞活性,并以乳腺癌肿瘤单细胞活性作为评价抗乳腺癌肿瘤药物的指标,由此完成对所述抗乳腺癌肿瘤药物的筛选模型的构建过程。
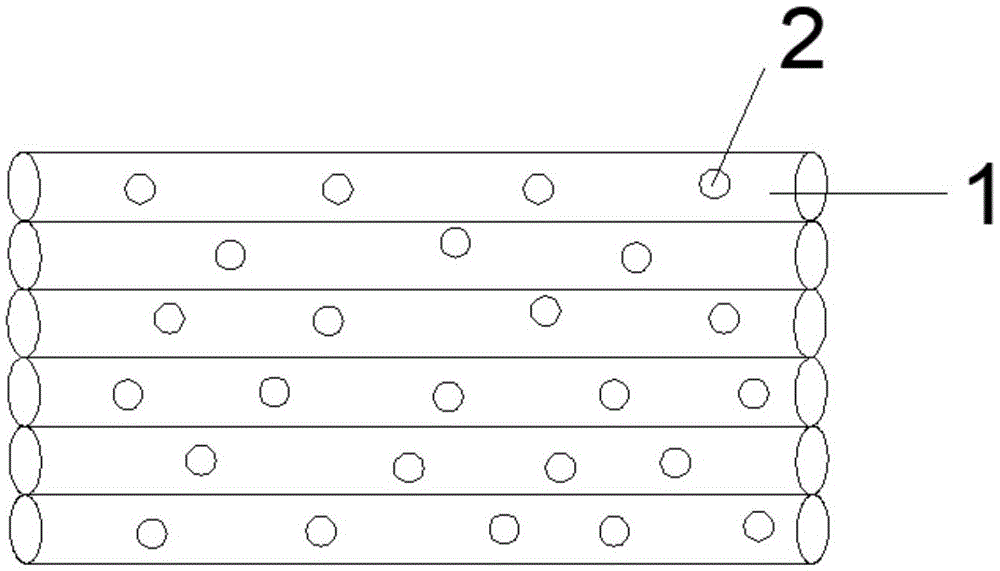
优选的是,所述的抗乳腺癌肿瘤药物的筛选模型,其中,所述中空纤维反应器包括多根平行排列的中空纤维管;每个所述中空纤维管表面均分布有多个孔洞。
优选的是,所述的抗乳腺癌肿瘤药物的筛选模型,其中,所述中空纤维管的直径为70~100μm,壁厚为2~4μm,长度为3~5cm。
优选的是,所述的抗乳腺癌肿瘤药物的筛选模型,其中,所述中空纤维反应器的尺寸为3cm×0.5cm~5cm×0.5cm;所述孔洞的直径为100~300nm。
优选的是,所述的抗乳腺癌肿瘤药物的筛选模型,其中,将中空纤维反应器植入健康小鼠背部前,还进行预处理的步骤;所述预处理步骤具体为:用胰岛素针抽取麻醉剂注入小鼠腹腔,并在背部剪出0.5cm宽的切口。
优选的是,所述的抗乳腺癌肿瘤药物的筛选模型,其中,所述乳腺癌肿瘤单细胞的植入密度为2×105细胞/5μl。
优选的是,所述的抗乳腺癌肿瘤药物的筛选模型,其中,所述给药途径为腹腔注射。
优选的是,所述的抗乳腺癌肿瘤药物的筛选模型,其中,所述乳腺癌肿瘤单细胞活性检测具体为:
1)将中空纤维反应器浸泡于2ml的第一移液器中,第一移液器中含有200μl0.5%噻唑蓝溶液和1000μl磷酸盐缓冲溶液,中空纤维反应器避光保存30min,离心分离出乳腺癌肿瘤单细胞;
2)将中空纤维反应器置于含有500μl二甲基亚砜的2ml第二移液器,避光保存24h;
3)取经步骤2)处理的细胞溶液100μl至于96孔盘,测定570nm吸光度值,以判断乳腺癌肿瘤单细胞的存活率。
优选的是,所述的抗乳腺癌肿瘤药物的筛选模型,其中,所述目标药物为抗乳腺癌肿瘤药物。
有益效果:
(1)本发明提供一种利用中空纤维反应器进行细胞培养的方法属于3d细胞培养,细胞在管径中生长有足够的接触点可以提供上涨讯号,相较于没有利用中空纤维反应器的方式细胞生长较快,细胞生理状态也比2d培养贴近生物体内的生长情况。
(2)中空纤维反应器包括多根平行排列的中空纤维管组成,每个中空纤维管表面均设有多个孔洞,孔洞有利于细胞培养时养分传送以及产物分泌,提高细胞成活率和生长速度,将中空纤维反应器植入小鼠皮下后由于管壁薄且具有交换营养与药物的孔洞,进行细胞培养比传统育瘤方式生长速度快,成功率较高,有利于临床病人肿瘤细胞异体移植,也不影响药物通透。
(3)本发明可快速进行抗乳腺癌肿瘤药物药效评价,极大地缩短了传统小鼠异种移植模型的药效实验所需的时间,从实验到结果不超过20天,并可降低临床实验成本,易于推广。
附图说明
图1为本发明中中空纤维反应器的结构示意图;
图2为本发明中一般乳腺癌肿瘤细胞株存活率数据图;
图3为本发明中患者源乳腺癌肿瘤细胞存活率数据图。
具体实施方式
下面结合附图对本发明的具体实施方式作进一步说明。在此需要说明的是,对于这些实施方式的说明用于帮助理解本发明,但并不构成对本发明的限定。此外,下面所描述的本发明各个实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互组合。
实施例1:小鼠乳腺癌肿瘤病理模型的建立
1、中空纤维反应器的制备
参考图1,中空纤维反应器包括多根平行排列的中空纤维1,每个中空纤维管表面均分布有多个孔洞2,中空纤维反应器用途中的中空纤维丝的材料是聚丙烯或聚氯烯,中空纤维管的直径为70~100μm,壁厚为2~4μm,长度为3~5cm,孔洞的直径为100~300nm,实验选用180个中空纤维反应器,用醋酸电浆将中空纤维反应器表面改质40min,并用uv光照射灭菌20分钟,以确保细胞皆处于无菌状态。
2、建立小鼠乳腺癌肿瘤模型
2.1建立一般乳腺癌肿瘤细胞模型
将乳腺癌细胞株进行消化处理,40个中空纤维反应器中植入乳腺癌肿瘤单细胞mcf7,40个中空纤维反应器中植入乳腺癌肿瘤单细胞mcf10a,将乳腺癌肿瘤单细胞mcf7或mcf10a(2×105cells/5μl)利用虹吸现象植入裁切成2.5cm×0.5cm中空纤维反应器的管腔内,再将两端开口往内折入0.5cm并封口,以确保细胞不流出中空纤维反应器,最后将中空纤维反应器培养于10公分的培养皿中,加入培养基rpmi-1640,经过48小时细胞贴附后,确定目标药物,以健康小鼠为给药对象,实验选用7周大balb/c小鼠20只,其中10只小鼠植入乳腺癌肿瘤单细胞mcf7的生物细胞反应器,另外10只小鼠植入乳腺癌肿瘤单细胞mcf10a的生物细胞反应器,将30g胰岛素针吸取200l麻醉药(900lpbs+50lzoletil50+50lrompun2%),注入腹腔,麻醉后在背部剪出一宽度约莫0.5cm宽的切口,利用剪刀深入切口,划开皮肤与肌肉间的黏膜,将中空纤维反应器置于微量药勺上,并植入小鼠背部内,利用手术缝线将伤口缝合2-3针,每个小鼠背部植入4个中空纤维反应器,24h后建立小鼠一般乳腺癌肿瘤病理模型。
2.2建立小鼠病源乳腺癌肿瘤模型
将乳腺癌病患肿瘤组织进行消化处理,60个中空纤维反应器中植入乳腺癌病患肿瘤单细胞,将乳腺癌病患肿瘤单细胞(2×105cells/5μl)利用虹吸现象植入裁切成2.5cm×0.5cm中空纤维反应器的管腔内,再将两端开口往内折入0.5cm并封口,以确保细胞不流出中空纤维反应器,最后将gnta培养于10公分的培养皿中,加入培养基rpmi-1640,经过48小时细胞贴附后,确定目标药物,以健康小鼠为给药对象,实验选用7周大balb/c小鼠15只,将30g胰岛素针吸取200l麻醉药,麻醉药为900lpbs+50lzoletil50+50lrompun2%,pbs为磷酸缓冲盐溶液,zoletil50为注射用盐酸替来他明,为麻醉针剂,含有游离型麻醉剂成分替来他明和兼有镇定剂和肌肉松弛作用的唑拉西洋,具有诱导期短、副反应小和安全的优点;rompun为盐酸二甲苯胺噻嗪,具有镇静、镇痛和中枢性肌肉松弛作用,通过pbs、zoletil50和rompun的合理配伍,使实验过程中麻醉效果达到最佳。麻醉药注入小鼠腹腔,麻醉后在背部剪出一宽度约莫0.5cm宽的切口,利用剪刀深入切口,划开皮肤与肌肉间的黏膜,将中空纤维反应器置于微量药勺上,并植入小鼠背部内,利用手术缝线将伤口缝合2-3针,每个小鼠背部植入4只中空纤维反应器,24h后建立小鼠病源乳腺癌肿瘤病理模型。
实施例2:建立抗乳腺癌肿瘤药物的筛选模型
1、实验分组
一般乳腺癌肿瘤模型的20只小鼠,分设mcf空白组、mcf10a空白组、mcf施药组、mcf10a施药组,每组各5只。其中mcf空白组、mcf10a空白组小鼠不施加抗癌药物,mcf施药组、mcf10a施药组小鼠施加doxorubicin(dox)药物。
病源乳腺癌肿瘤模型的15只小鼠,分设control组、ac-t组、ec-t组,每组各5只。ac-t为组合抗癌药物doxorubicin(a)、cyclophosphamide和paclitaxel(t)联合用药的简称,ec-t为epirubicin(e)、cyclophosphamide(c)和paclitaxel(t)联合用药的简称。
2、抗乳腺癌肿瘤药物的筛选模型
一般乳腺癌肿瘤模型的20只小鼠,mcf空白组、mcf10a空白组小鼠不施加抗癌药物,mcf施药组、mcf10a施药组小鼠施加doxorubicin(dox)药物,每隔2天给药一次,给药量为doxorubicin20mg/kg,施药10天分别从实验组小鼠背部取出中空纤维反应器,检测一般乳腺癌肿瘤单细胞h460和a549活性,并以mcf、mcf10a细胞活性作为评价抗乳腺癌肿瘤药物的指标,由此完成对一般抗乳腺癌肿瘤药物的筛选模型的构建过程。
病源乳腺癌肿瘤模型的15只小鼠,control组不施加药物,ac-t组施加doxorubicin(a)、cyclophosphamide和paclitaxel(t)、ec-t组施加epirubicin(e)、cyclophosphamide(c)和paclitaxel(t),给药量为doxorubicin20mg/kg,cyclophosphamide20mg/kg,paclitaxel20mg/kg,epirubicin20mg/kg,每隔2天给药一次,于给药10天分别从实验组小鼠背部取出中空纤维反应器,检测病源乳腺癌肿瘤单细胞活性,并以病源乳腺癌肿瘤单细胞活性作为评价抗乳腺癌肿瘤药物的指标,由此完成对病源抗乳腺癌肿瘤药物的筛选模型的构建过程。
3、细胞活性测试
1)将中空纤维反应器浸泡于2ml的移液器中,移液器中含有200μl0.5%噻唑蓝溶液和1000μl磷酸盐缓冲溶液,中空纤维反应器避光保存30min,离心分离出细胞;
2)将中空纤维反应器置于含有500μl二甲基亚砜的2ml第二移液器,避光保存24h;
3)取经步骤2)处理的细胞溶液100μl至于96孔盘,测定570nm吸光度值,以判断乳腺癌肿瘤细胞培养的存活率,并以乳腺癌肿瘤单细胞活性作为评价抗乳腺癌肿瘤药物的指标。
一般乳腺癌肿瘤的筛选结果如图2所示,一般抗乳腺癌肿瘤药物的筛选模型分设mcf空白组、mcf10a空白组、mcf施药组、mcf10a施药组,空白组不施药10天后,mcf10a细胞存活率高于mcf;给药10天后mcf10a的细胞存活率下降明显,其对doxorubicin药物较敏感。
病源乳腺癌药物的筛选结果如图3所示,病源抗乳腺癌肿瘤药物的筛选模型分设control组、ac-t组、ec-t组,每组各5只,施药10天进行细胞活性测试,ac-t组、ec-t组与control组相比,细胞存活率均低于control组,而control组应不施加抗乳腺癌肿瘤药物,细胞存活率最高,ec-t组细胞存活率最低,说明epirubicin(e)、cyclophosphamide(c)和paclitaxel(t)联合用药病人最敏感。
以上结合附图对本发明的实施方式作了详细说明,但本发明不限于所描述的实施方式。对于本领域的技术人员而言,在不脱离本发明原理和精神的情况下,对这些实施方式进行多种变化、修改、替换和变型,仍落入本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!