小分子诱导人成纤维细胞直接重编程为肝细胞的方法与流程
本发明属于细胞生物学、干细胞生物学(细胞重编程)、医学、药学交叉领域;更具体地,本发明涉及小分子诱导人成纤维细胞直接重编程(转分化)为肝细胞的方法。
背景技术:
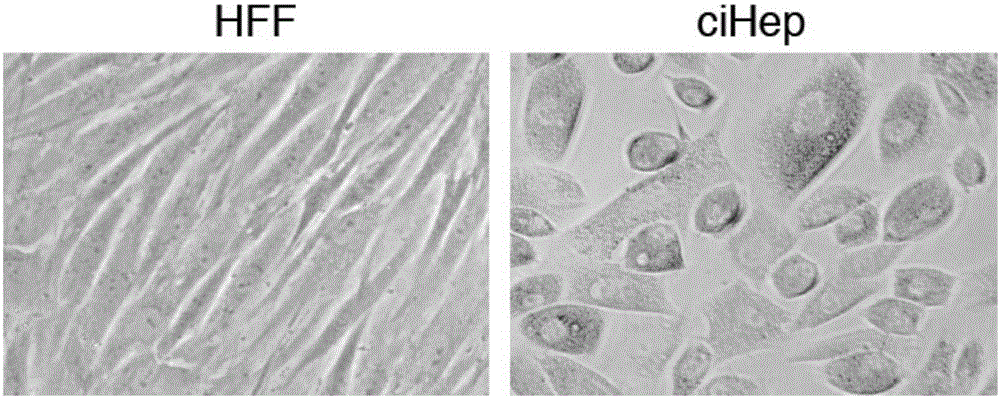
:中国是肝病大国,甲肝、乙肝、脂肪肝、酒精肝、肝硬化(肝纤维化)等患病人数众多,而其中由各种肝病、化学药物、创伤等多种原因导致的急慢性肝衰竭,病情危重,病死率高。肝移植是治疗终末期肝病或肝功能衰竭的有效手段,然而肝源的缺乏使很多患者,尤其是急性肝衰竭患者失去治疗机会。肝细胞移植、生物人工肝和源于生物工程技术的全肝移植是肝移植的重要替代手段而被日渐关注并被广泛研究,如何获得足够数量的可用于临床治疗的人肝细胞来源就成为国际研究热点。目前,获得功能肝细胞的途径主要有以下方式:1)从供肝分离原代肝细胞;2)由干细胞或诱导多能干细胞等定向分化为肝细胞;3)由成纤维细胞等体细胞转分化为肝细胞等。从供肝分离原代肝细胞因为肝源的严重缺乏使其应用受限。干细胞定向诱导分化获得功能肝细胞,因为干细胞的无限增殖潜能而成为最可能获得足够数量肝细胞的有效手段和途径。然而现有的定向分化方法存在以下一个或者多个缺陷:如分化效率低、转化纯度低、分化获得的肝细胞功能欠缺、可能产生免疫排斥反应、存在干性细胞分化不彻底而有潜在致癌风险以及成本高昂等,不能满足临床的需求。而将成纤维细胞直接重编程(转分化)为肝细胞,因为避免了重编程为ips(inducedpluripotentstemcell)细胞及其应用的潜在风险而受到关注。但目前已有的转分化为肝细胞方法采用的是导入外源基因的方式,存在致癌风险,这使其仍然很难临床应用;或者使用小分子将胃上皮细胞多能重编程为内胚层干细胞,然后定向分化为肝细胞、胰岛细胞、小肠上皮细胞等等。多能重编程应用于体内原位重编程存在较大困难和致癌风险;而且体内多能干细胞的定向分化具有较大困难和风险,因此难以实现成药性及临床应用;其体外应用也存在操作复杂,实验环节增加,质量难以控制,成本增加,临床应用风险增加等等缺陷。因此,如何避免导入外源诱导因子,仅用化学小分子将成纤维细胞直接重编程(转分化)为肝细胞,并克服上述定向分化或转分化肝细胞方法的缺陷,是肝细胞临床应用亟待解决的瓶颈问题。细胞重编程(cellreprogramming)是细胞从一种类型向另外一种类型的转换,是通过调控细胞信号通路及表观遗传修饰的变化来改变细胞命运的过程。所谓表观遗传是指dna序列不发生变化,但基因表达却发生了可遗传的改变。细胞重编程可通过核移植(nucleartransfer,nt)、胞质孵育、细胞融合、以及转录因子或化学因子诱导细胞重编程等方式实现。其中诱导细胞重编程是目前公认的突破性研究领域(注:本方法所指细胞重编程即为转录因子或化学因子诱导的细胞重编程)。诱导细胞重编程包括:(1)分化的细胞逆转恢复到多能或全能性状态的多能性重编程;(2)不经过多能干细胞阶段,从一种分化细胞类型直接转化为另一种分化细胞类型的直接重编程(转分化/谱系重编程)。仅用化学小分子诱导的细胞重编程又称为化学诱导细胞重编程。化学小分子的使用被认为是改善细胞重编程过程的一种最有前途的方法,不但可以替代并减少转录因子的使用,甚至可以完全替代转录因子实现细胞重编程。化学诱导细胞重编程消除了通过外源基因导入的细胞重编程方法的许多弊端,对细胞更有亲和力,更少突变的发生,达到了简化操作、减少致癌风险、缩短重编程周期、提高重编程效率的目的。尤其从应用的角度考虑,对于今后将直接重编程(以下简称:转分化)因子成药化,或体内原位将细胞转分化都是至关重要的。如心肌、大脑、肝脏等重要器官发生损伤或病变时,将成纤维细胞甚至病变细胞原位转分化为相应的正常分化功能细胞从而治愈损伤或疾病。化学诱导细胞重编程领域近年来不断获得突破性研究进展,不仅可以将成纤维细胞转化为ips细胞,还可以将成纤维细胞转分化为神经细胞和心肌细胞等。然而,仅使用化学小分子将人成纤维细胞转分化为肝细胞则未见任何报道。技术实现要素:本发明的目的在于提供一种小分子组合物诱导人成纤维细胞直接重编程(转分化)为肝细胞的方法及小分子组合物;该小分子组合物可添加药物载体或赋型剂研发制备成临床治疗肝纤维化,或慢性肝功能衰竭的药物或药物配方;或添加水性溶剂或有机溶剂、基础培养基或无血清培养基制备成科研用细胞转分化试剂或培养基;或用于将人成纤维细胞转分化为肝细胞,为医药应用及临床肝细胞移植治疗肝衰竭提供肝细胞源。在本发明的第一方面,提供一种用于化学诱导人成纤维细胞直接重编程(转分化)为肝细胞的小分子组合物(或配方),所述的组合物包括gsk3β抑制剂,tgfβ抑制剂和g9a组蛋白甲基转移酶(g9ahmtase)抑制剂;或所述的组合物由gsk3β抑制剂、tgfβ抑制剂、g9ahmtase抑制剂组成。在一个优选例中,所述的组合物包括:gsk3β抑制剂:5-80重量份;tgfβ抑制剂:0.1-50重量份;和g9ahmtase抑制剂:0.1-50重量份。在另一优选例中,所述的组合物可为溶液状态组合物,包括:gsk3β抑制剂:终浓度为:0.1-20um;和tgfβ抑制剂:终浓度为:0.01-20um;和g9ahmtase抑制剂:0.01-20um。在另一优选例中,所述的组合物包括:gsk3β抑制剂:10-70重量份;和tgfβ抑制剂:0.5-40重量份;和g9ahmtase抑制剂:0.5-40重量份。在另一优选例中,所述的组合物可为溶液状态组合物,包括:gsk3β抑制剂:终浓度为:0.5-10um;和tgfβ抑制剂:终浓度为:0.05-10um;和g9ahmtase抑制剂:0.05-10um。在另一优选例中,gsk3β抑制剂、tgfβ抑制剂、g9ahmtase抑制剂相加的重量占组合物总重量的0.01~99.9%;更佳地为50~99.9%;溶液状态下为0.1~50%,如1%,5%,10%,20%,30%等。在另一优选例中,所述的组合物中,gsk3β抑制剂(如gsk3β抑制剂chir99021),tgfβ抑制剂(如tgfβ抑制剂sb431542或/和a83-01),g9ahmtase抑制剂(如bix01294),以重量份比:(5-80)﹕(0.1-50)﹕(0.1-50);较佳地,(10-70)﹕(0.5-40)﹕(0.5-40)存在;或溶液状态下以摩尔浓度比:(0.1-20)﹕(0.01-20)﹕(0.01-20);较佳地,(0.5-10)﹕(0.05-10)﹕(0.05-10)存在。上述重量份比的重量单位可以是:千克(kg)、毫克(mg)、微克(ug)等任一重量单位;摩尔浓度比的摩尔单位可以是:摩(m)、毫摩(mm)、微摩(um)等任一摩尔浓度单位;且,所述的组合物应用于大动物和病人时,按小动物使用剂量通过相应的专业换算公式,换算出大动物或人的有效使用剂量(包括固态或溶液态的剂量换算),也属于本发明的保护范围。在另一优选例中,所述的gsk3β抑制剂包括:chir-99021、bio、im-12、tws119、1-azakenpaullone、chir-98014、tideglusib、ar-a014418、ly2090314、sb216763、azd1080等为代表的,具相同功能,或诱导相同靶点的同一类gsk3β信号通路抑制剂或化合物,或与它们等效的药剂制品、类似物、异构体和/或其盐、水合物或前体,或其组合;较佳地为gsk3β抑制剂chir-99021、bio或tws119;所述的tgfβ抑制剂包括:sb431542、a83-01、sb525334、ly2109761,repsox、sd-208、gw788388、sb505124、ew-7197,galunisertib等为代表的,具相同功能,或诱导相同靶点的同一类tgfβ信号通路抑制剂或化合物,或与它们等效的药剂制品、类似物、异构体和/或其盐、水合物或前体,或其组合;较佳地为tgfβ抑制剂sb431542、a83-01或ly2109761;所述的g9ahmtase抑制剂,包括:bix01294、unc0638、a-366、unc0631、brd4770、unc0224、unc0646、unc0642等为代表的,具相同功能,或诱导相同靶点的同一类g9ahmtase抑制剂或化合物,或与它们等效的药剂制品、类似物、异构体和/或其盐、水合物或前体,或其组合;较佳地为g9ahmtase抑制剂bix01294(或bix-01294)或unc0638。在另一优选例中,所述的组合物是药物或药物组合物,还包含药学上可接受的载体或赋形剂,其载体或赋形剂包括(但不限于)选自下组的一种或多种:水、盐水、磷酸缓冲液或其它水性溶剂;dmso(二甲基亚砜)、甘油和乙醇或其它有机溶剂;微球、脂质体、微乳液或高分子表面活性剂;胶体型载药系统或高分子载药系统;或防腐剂、抗氧剂、矫味剂、芳香剂、助溶剂、乳化剂、ph缓冲物质,黏合剂、填充剂、润滑剂或其它药物赋形剂。在另一优选例中,所述的组合物可制备的药物剂型包括(但不限于):固体剂型,包括(但不限于)粉剂、散剂、片剂、丸剂、胶囊剂、缓释剂、控速释剂;液体剂型,包括(但不限于)注射剂、输液剂、混悬剂,或其它液体剂型;气体剂型;或半固体剂型。在另一优选例中,所述的组合物可添加水性溶剂或有机溶剂配制成为科研用诱导成纤维细胞转分化肝细胞试剂;可添加基础细胞培养基或无血清培养基制备成诱导成纤维细胞转分化为肝细胞的培养基。组合物中各成分存在于含5-20%小牛血清、1%青链霉素混合液(100x)的基础细胞培养基或含有各种细胞因子或生长因子的无血清培养基中,但组合物中不包括基础细胞培养基或无血清培养基。在另一优选例中,所述的组合物可用于将人成纤维细胞转分化为肝细胞,为医药应用及临床肝细胞移植提供肝细胞源。在本发明的另一方面,提供所述的组合物的用途,用于研发或制备治疗肝纤维化,或慢性肝功能衰竭的药物(或药物配方);或用于制备诱导人成纤维细胞转分化为肝细胞的培养基或试剂;或用于将人成纤维细胞转分化为肝细胞,为医药应用及临床肝细胞移植提供肝细胞源。在本发明的另一方面,提供一种诱导人成纤维细胞直接重编程(转分化)为肝细胞的方法,其特征在于,所述方法包括:应用前面任一所述的组合物诱导调控人成纤维细胞转分化为肝细胞。在另一优选例中,提供制备诱导人成纤维细胞直接重编程(转分化)为肝细胞的培养基或试剂方法及其实验步骤,包括:(1)浓缩液试剂配制:根据前面任一所述的组合物,将各成分溶解于有机溶剂或水性溶剂中配制成浓缩液试剂;较佳地,所述的有机溶剂包括二甲基亚砜;较佳地,所述的水性溶剂包括:水,生理盐水,磷酸盐缓冲液;(2)成纤维细胞转分化肝细胞培养基获得:将步骤(1)中的浓缩液试剂分别稀释入含5-20%小牛血清的基础细胞培养基或含有各种细胞因子或生长因子的无血清培养基中(使得各组分的浓度符合前面任一所述的组合物中所限定的终浓度),获得诱导成纤维细胞转分化肝细胞的培养基;其中,该培养基各组分的百分含量还可上下浮动50%;较佳地上下浮动30%;更佳地上下浮动20%,如10%,5%;(3)诱导成纤维细胞转分化为肝细胞:将成纤维细胞在含5-20%小牛血清的基础细胞培养基或含有各种细胞因子或生长因子的无血清培养基中混悬、铺板,在细胞贴壁后换成步骤(2)的转分化培养基,37℃培养,每2-4天换液一次;3-15天传代一次。(4)诱导成纤维细胞转分化肝细胞的传代培养:弃原培养液,pbs洗涤一次,加入细胞消化液消化细胞,37℃,1-5分钟,终止细胞消化,离心,弃上清,将细胞沉淀重悬,按1:1-1:3传代铺板。应用步骤(2)的转分化培养基,参照上述方法培养,每2-4天换液一次。所用消化液包括胰酶,edta,acutase,tryplee等。3-15天传代一次。(5)诱导成纤维细胞转分化肝细胞细胞的收获:经上述实验步骤(3)、(4)转分化肝细胞培养和传代培养2-4周,即可将成纤维细胞转分化为肝细胞,并获得转分化后的肝细胞。在本发明的另一方面,提供一种用于诱导人成纤维细胞直接重编程(转分化)为肝细胞的药盒/试剂盒,所述的药盒/试剂盒中包括:前面任一所述的组合物;或基于该组合物研发制备的治疗肝纤维化,或肝功能衰竭的药物或药物配方;或基于该组合物制备的科研用试剂或培养基。如前面任一方面,所述的人成纤维细胞包括但不限于:人体不同组织或器官的成纤维细胞,如皮肤成纤维细胞、肝成纤维细胞(肝星状细胞)、肺间质成纤维细胞、肾成纤维细胞、肌成纤维细胞,以及人体其他组织或器官的成纤维细胞。较佳地为人皮肤成纤维细胞及肝成纤维细胞(肝星状细胞)。本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。附图说明图1、人成纤维细胞(hff)与转分化所得肝细胞(cihep)形态比较。图左:人成纤维细胞(hff);图右:人成纤维细胞转分化肝细胞(cihep)。该结果显示,人成纤维细胞转分化为肝细胞后,形态发生明显改变,与肝细胞形态吻合。图2、转分化肝样细胞的肝特异标志物染色的流式细胞分析。该结果说明,所获得的转分化肝样细胞的肝细胞特异性标志物呈现阳性的细胞比例非常高,而胚胎肝细胞标志物afp则基本不表达。因此,可以证明本发明的转分化培养基及培养方法将人成纤维细胞转分化获得了功能性的人肝成熟细胞。图3、转分化肝样细胞与原代肝细胞白蛋白生成的比较。其中,phh为:原代肝细胞;1-4为:人成纤维细胞转分化肝细胞;该结果可见,所获得的转分化肝样细胞具有人肝细胞特有的生成白蛋白的功能。图4、人成纤维细胞转分化的肝样细胞具尿素生成功能。尿素来源为血液中的血氨,其生成量体现肝细胞的解毒能力。该结果可见,人成纤维细胞转分化所得肝样细胞具有肝细胞特有的生成尿素的功能。图5、人成纤维细胞转分化肝样细胞的糖原染色。染色的深浅展现肝细胞储存糖原的能力。上图:人成纤维细胞转分化肝细胞的糖原染色。下图:人成纤维细胞;该结果显示,转分化培养获得肝样细胞的肝糖原染色阳性,而图下方成纤维细胞肝糖原染色阴性。证明本发明的方法获得的转分化肝样细胞具有人肝细胞相同的糖原储存活性。图6、转分化肝样细胞的p450酶(cyp3a4和cyp1a2)活性诱导。该结果可见,本发明的方法获得的转分化肝样细胞具肝细胞特有的p450代谢酶活性。图中纵坐标为酶的相对活性。图7、成纤维细胞与转分化肝细胞的脂肪染色比较。染色的深浅展现肝细胞代谢脂肪的能力。左图:人成纤维细胞;右图:人成纤维细胞转分化肝细胞的脂肪染色。该结果显示,转分化肝细胞脂肪染色阳性,成纤维细胞脂肪染色阴性;证明该方法转分化所得肝样细胞具有肝细胞代谢脂肪能力。图8、人成纤维细胞转分化肝细胞的脂肪摄取。染色的深浅展现肝细胞摄取脂肪的能力。该结果显示,该方法转分化所得肝样细胞,具有肝细胞的脂肪摄取和储存功能;而成纤维细胞不具备该功能。图9、人成纤维细胞转分化肝细胞的icg摄取。染色的深浅展现肝细胞摄取异物及排除异物的能力。该结果显示,转分化肝样细胞具有人肝细胞摄取异物及排除异物的能力,证明其具有肝细胞特有功能。具体实施方式本发明人经过深入的研究,揭示了一种小分子组合物诱导人成纤维细胞直接重编程(转分化)为肝细胞的方法及其小分子组合物;该小分子组合物可添加药物载体或赋型剂研发制备成临床治疗肝纤维化(肝硬化),或肝功能衰竭的药物或药物配方;可添加水性溶剂或有机溶剂、基础培养基或无血清培养基制备成科研用试剂或培养基;可用于将人成纤维细胞转分化为肝细胞,为医药应用及临床肝细胞移植提供肝细胞源。该小分子组合物化学诱导人成纤维细胞直接重编程(转分化)为肝细胞的方法可应用于人成纤维细胞如皮肤成纤维细胞、肝星形细胞等,经转分化获得的肝细胞样细胞具有正常肝细胞功能。基本机理诱导细胞重编程包括:(1)分化的细胞逆转恢复到多能或全能性状态的多能性重编程;(2)不经过多能干细胞阶段,从一种分化细胞类型转化为另一种分化细胞类型的直接重编程(转分化/谱系重编程)。仅用化学小分子诱导的细胞重编程又称为化学诱导细胞重编程。化学诱导细胞直接重编程(转分化)是指不改变基因序列的情况下,通过调控细胞信号通路及表观遗传的变化来改变细胞命运的过程。随着干细胞科学发展,细胞重编程在不断创新,已从外源导入转录因子实现重编程;到现在使用调控细胞信号通路和表观遗传的小分子组合也可实现“化学诱导多能细胞(ipsc)重编程”(hongkuideng等,science.341,651-4,2013)和“化学诱导细胞直接重编程”(lix等,cellstemcell;17(2):195-203,2015;huw等,cellstemcell.17(2):204-212,2015);重编程的起始和目的细胞类型也从分化细胞重编程为多能干细胞,扩展到直接重编程为另一种分化细胞。从已报道通过细胞重编程将多种类型的正常分化细胞重编程为同一种类型的细胞实例(见图表1)的机理可以看出,起始细胞的类型不是关键,筛选能够构建并维持目的细胞特有的基因表达谱或生物学行为,以及能够突破起始细胞重编程过程中的各种“能障”的诱导因子组合,才是细胞重编程关键。表1多种起始细胞重编程为同一个目的细胞实例因此,本发明人认为,只要找到能够突破各种“能障”和构建并维持目的细胞特有基因表达谱的诱导因子或化合物,不同胚层的各种分化细胞,包括成纤维细胞,就都可能通过细胞重编程完成细胞命运的转变。因此,本方法按上述思路设计并筛选小分子组合,诱导调控成纤维细胞转分化为肝细胞(目的细胞)。本发明首先选择容易取材的皮肤成纤维细胞为突破点。筛选出能够构建并维持正常肝细胞(目的细胞)特有基因表达谱,同时能够突破成纤维细胞向正常肝细胞转分化过程中的各种“能障”的小分子组合,构建了小分子诱导成纤维细胞直接重编程(转分化)为肝细胞的方法平台;该创新方法具有以下优点:①小分子性质稳定,作用的时间、剂量及组合方式易于控制,作用效果稳定可靠;②转分化后的肝细胞具有正常成熟的人肝细胞形态和功能;③该方法的成纤维细胞可取材于患者本人,因此转分化获得肝细胞具有个性化特征,并有两大优势:一是更易于进入临床应用,并最大限度降低或避免转化肝细胞移植引起的免疫排斥反应;二是可以构建具群体代表性的肝细胞库,应用于新药的肝毒安全评测和药效筛选;④不需要导入外源基因或改变细胞基因结构,避免了外源基因导入或基因改变引起新的致癌风险。所以,更为安全可靠;⑤该方法采取化学诱导直接重编程,不需要重编程为诱导多能干细胞(ipsc),避免了诱导多能干细胞引起的致癌风险;⑥化学小分子稳定,成药性好。该方法易于应用于体内原位转分化。因此可用于研发或制备成治疗人肝纤维化,或肝功能衰竭的药物。本发明目前已明确的机理主要是通过gsk3β抑制剂、tgfβ抑制剂、g9ahmtase抑制剂等三类小分子组合,多靶点诱导成纤维细胞的信号通路、表观遗传及化学生物学改变,从而将成纤维细胞转分化为肝细胞;通过体内肝成纤维细胞原位转分化肝细胞,可以降低或缓解肝纤维化;且可增强或恢复肝细胞功能,达到治疗肝纤维化(肝硬化),或肝功能衰竭的目的。需要说明的是,gsk3β抑制剂、tgfβ抑制剂、g9ahmtase抑制剂,包含了类别、功能相同,或诱导靶点相同,效应、效果一致的三种系列小分子;所形成的不同组合,都能够不同程度地诱导成纤维细胞转分化为肝细胞。因此,其功能相同或诱导靶点相同,或对同一条信号通路起相同效应的同类小分子化合物,以及所构成的能够诱导调控人成纤维细胞转分化为肝细胞的小分子组合都属于本发明保护范围内。另一方面,人成纤维细胞(fibroblast),也称为纤维母细胞,是疏松结缔组织的主要细胞成分,由胚胎时期的间充质细胞(mesenchymalcell)分化而来。成纤维细胞根据不同功能活动状态,可划分为成纤维细胞和纤维细胞;成纤维细胞功能活动旺盛,细胞质嗜弱碱性,具明显的蛋白质合成和分泌活动;处于成熟期或称静止状态的被称为纤维细胞;在一定条件下,二者可实现互相转化。成纤维细胞具有不同类型,存在与体内各种组织或器官中;在不同的组织或器官中有不同的名称和特性,包括皮肤成纤维细胞、肝成纤维细胞(肝星状细胞)、肺间质成纤维细胞、肌成纤维细胞等。而本方法所述的人体成纤维细胞包括但不限于:人体不同组织或器官的成纤维细胞,如皮肤成纤维细胞、肝成纤维细胞(肝星状细胞)、肺间质成纤维细胞、肾成纤维细胞、肌成纤维细胞,以及人体其他组织或器官的成纤维细胞。较佳地为人皮肤成纤维细胞及肝成纤维细胞(肝星状细胞)。本发明的方法所述的人体成纤维细胞包括但不限于:人体不同组织或器官的成纤维细胞,如皮肤成纤维细胞、肝成纤维细胞(肝星状细胞)、肺间质成纤维细胞、肾成纤维细胞、肌成纤维细胞,以及人体其他组织或器官的成纤维细胞。较佳地为人皮肤成纤维细胞和肝成纤维细胞(肝星状细胞)。药物组合物及其应用本发明人经过广泛的研究,首次提出同时不同程度地抑制gsk3β、tgfβ信号通路,以及抑制g9ahmtase即可诱导成纤维细胞转分化为肝细胞。该小分子组合物有潜力研发为治疗肝纤维化(肝硬化)、或慢性肝衰竭的新药物或药物配方;并可直接制备为化学诱导成纤维细胞直接重编程(转分化)为肝细胞的科研用培养基或试剂;还可用于将人成纤维细胞转分化为肝细胞,为医药应用及临床肝细胞移植治疗肝衰竭提供肝细胞源。应理解,除了本发明实施例中所列举的具体gsk3β抑制剂、tgfβ抑制剂以外的其它可抑制gsk3β信号通路、tgfβ信号通路的,诱导调控相同靶点的,或具相同功能的,能够诱导产生相同效应、效果的同种类抑制剂也可实现同样的技术效果,也应被包含在本发明中。同样,除了本发明实施例中所列举的g9ahmtase抑制剂以外的其它具相同功能的,或诱导调控相同靶点的g9ahmtase抑制剂也可实现同样的技术效果;也应被包含在本发明中。如本文所用,术语“含有”或“包括”包括了“包含”、“基本上由……构成”、和“由……构成”。如本文所用,术语“基本上由……构成”指在组合物中,除了含有必要成分或必要组份之外,还可含有少量的且不影响有效成分的次要成分和/或杂质。例如,可以含有甜味剂以改善口味、抗氧化剂以防止氧化,以及其他本领域常用的药物添加剂、载体、赋形剂。如本文所用,术语“药学上可接受的”的成分是适用于人和/或动物而无过度不良副反应(如毒性、刺激和变态反应)的,即有合理的效益/风险比的物质;如本领域常用的药物载体或赋形剂。如本文所用,术语“有效量”是指可对人和/或动物产生功能或活性的且可被人和/或动物所接受的量。如本文所用,术语“药学上可接受的载体或赋形剂”,其中载体指能改变药物进入人体的方式和在体内的分布、控制药物的释放速度并将药物输送到靶向器官的体系;药物载体本身并不是必要的活性成分,且施用后没有过分的毒性。合适的载体是本领域普通技术人员所熟知的,包括但不限于:水、盐水、磷酸缓冲液以及其它水性溶剂;dmso(二甲基亚砜)、甘油和乙醇以及其它有机溶剂;微球、脂质体、微乳液、高分子表面活性剂;胶体型载药系统、新型高分子载药系统、新型药物载体以及其他药学上的载体;其中赋形剂指在药物制剂中除主药以外的附加物,也可称为辅料。如片剂中的黏合剂、填充剂、崩解剂、润滑剂;中药丸剂中的酒、醋、药汁等;半固体制剂软膏剂、霜剂中的基质部分;液体制剂中的防腐剂、抗氧剂、矫味剂、芳香剂、助溶剂、乳化剂、增溶剂、渗透压调节剂、着色剂等均可称为赋形剂。对赋形剂的一般要求是性质稳定,与主药无配伍禁忌,不产生副作用,不影响疗效,在常温下不易变形、干裂、霉变、虫蛀、对人体无害、无生理作用,不与主药产生化学或物理作用,不影响主药的含量测定等。在remington’spharmaceuticalsciences(mackpub.co.,n.j.1991)中可找到关于药学上可接受的载体或赋形剂的充分讨论。其载体或赋形剂包括但不限于:水、盐水、磷酸缓冲液等水溶液;dmso(二甲基亚砜)、甘油和乙醇等有机溶剂;微球、脂质体、微乳液、高分子表面活性剂;胶体型载药系统、新型高分子载药系统、新型药物载体以及其他药学上的载体;液体制剂中的防腐剂、抗氧剂、矫味剂、芳香剂、助溶剂、乳化剂、ph缓冲物质,片剂中的黏合剂、填充剂、润滑剂以及其它药物赋形剂等。如本文所用,术语“组合物可制备的药物剂型”中的药物剂型指:为适应治疗或预防的需要而制备的药物应用形式,称为药物剂型;本发明任一组合物可制备的药物剂型包括但不限于:粉剂、散剂、片剂、丸剂、胶囊剂、缓释剂、控速释剂及其它固体剂型;注射剂、输液剂、混悬剂及其它液体剂型,以及气体剂型、半固体剂型等其它剂型。如本文所用,“重量份”或“重量份数”可互换使用,所述的重量份可以是任何一个固定的以微克、毫克、克数或千克数表示重量(如1ug、1mg、1g、2g、5g、或kg等)。例如,一个由1重量份组分a和9重量份组分b构成的组合物,可以是1克组分a+9克组分b,也可以是10克组分a+90克组分b等构成的组合物。在所述组合物,某一组分的百分比含量=(该组分的重量份数/所有组分的重量份数之和)×100%。因此,由1重量份组分a和9重量份组分b构成的组合物中,组分a的含量为10%,组分b为90%。此外,在溶液状态时,上述“重量份”也可以换算成为“摩尔数”;“重量份比”也可以换算成为“摩尔浓度比”。所述重量份比的重量单位可以是:千克(kg)、毫克(mg)、微克(ug)等任一重量单位;摩尔浓度比的摩尔单位可以是:摩(m)、毫摩(mm)、微摩(um)等任一摩尔浓度单位;gsk3β抑制剂(如gsk3β抑制剂chir99021),tgfβ抑制剂(如tgfβ抑制剂sb431542或/和a83-01),g9ahmtase抑制剂(如g9ahmtase抑制剂bix01294),以重量份比:(5-80)﹕(0.1-50)﹕(0.1-50);较佳地,(10-70)﹕(0.5-40)﹕(0.5-40)存在;或溶液状态下以摩尔浓度比:(0.1-20)﹕(0.01-20)﹕(0.01-20);较佳地,(0.5-10)﹕(0.05-10)﹕(0.05-10)存在。作为本发明的优选方式,所述的组合物中,包括的成分及重量份比如表2或摩尔浓度比如表3(溶液状态)所示。表2表3组分摩尔浓度比(摩尔单位:m、mm、um…….)较佳摩尔浓度比gsk3β抑制剂0.1-20,例如0.1、0.5、1、3、5、10、15、200.5-10tgfβ抑制剂0.01-20,例如0.01、0.5、1、3、5、10、15、200.05-10g9ahmtase抑制剂0.01-20,例如0.01、0.5、1、3、5、10、15、200.05-10表2和表3的配方范围可以作为参考性指导。但是应理解,当用于研发制备药物组合物时,所用的组合物的有效剂量可随施用的模式和待治疗肝纤维化,或慢性肝衰竭患者身体状况,或肝功能衰竭的严重程度而变化。且,体内使用时,通常使用“重量/公斤(体重)”作为剂量单位;所述的小分子组合物应用于大动物和肝病病人时,按小动物使用剂量通过相应的专业换算公式,换算出的大动物或人的有效使用剂量(包括固态或溶液态的剂量换算),也属于本发明的保护范围。如本发明所用,所述的“gsk3β抑制剂”是指能够抑制细胞中gsk3β信号通路的抑制剂的总称,包括但不限于:chir-99021,bio、im-12、tws119等为代表的,具相同功能,或诱导相同靶点的同一类gsk3β信号通路抑制剂或化合物:chir-99021(ct99021),其是gsk-3α和β抑制剂,ic50分别为10nm和6.7nm,比对cdc2,erk2及其他激酶的抑制性强500倍;chir-99021(ct99021)hcl,其是chir-99021的盐酸盐,是一种gsk-3α/β抑制剂,在无细胞试验中ic50为10nm/6.7nm,可用于区分gsk-3和其最接近的同源物cdc2与erk2;bio,其是一种特异性的gsk-3抑制剂,无细胞试验中作用于gsk-3α/β的ic50为5nm;im-12,其是一种选择性的gsk-3β抑制剂,其ic50为53nm,增强了wnt信号通路;tws119,其是一种gsk-3β抑制剂,在无细胞试验中ic50为30nm;1-azakenpaullone,其是一种高度选择性gsk-3β抑制剂,ic50为18nm;chir-98014,其是一种有效的gsk-3α/β抑制剂,无细胞试验中ic50为0.65nm/0.58nm;tideglusib,其是一种不可逆的,非atp竞争性的gsk-3β抑制剂,无细胞试验中ic50为60nm;ar-a014418,其是一种atp竞争性和选择性的gsk3β抑制剂,无细胞试验中ic50和ki为104nm和38nm;ly2090314,其是一种有效的gsk-3抑制剂,作用于gsk-3α/β,ic50为1.5nm/0.9nm;sb216763,其是一种有效的,选择性gsk-3α/β抑制剂,ic50为34.3nm;azd1080,其是一种口服生物有效的,选择性的,可透过大脑的gsk3抑制剂,抑制人类gsk3α和gsk3β,ki分别为6.9nm和31nm,比作用于cdk2,cdk5,cdk1和erk2选择性高14倍以上。作为本发明的优选方式,所述的gsk3β抑制剂是chir-99021,其别名为ct99021;其分子结构式如以下式(i)所示:如本发明所用,所述的“tgfβ抑制剂”是指能够抑制细胞中tgfβ信号通路的抑制剂的总称,包括但不限于:sb431542、a83-01、sb525334、ly2109761、repsox等为代表的,具相同功能,或诱导相同靶点的同一类tgfβ信号通路抑制剂或化合物:sb-431542,其是有效的,选择性的alk5抑制剂,ic50为94nm,比对p38、mapk和其他激酶的抑制性强100倍;a83-01,其是alk5,alk4和alk7的抑制剂,ic50分别为12,45和7.5nm;sb525334,其是一种有效的,选择性tgfβreceptori(alk5)抑制剂,无细胞试验中ic50为14.3nm,作用于alk4比作用于alk5效果低4倍,对alk2,3,和6没有活性;ly2109761,其是一种新型的,选择性tgf-βreceptortypei/ii(tβri/ii)双重抑制剂,无细胞试验中ki分别为38nm和300nm;repsox,其是一种有效的,选择性tgfβr-1/alk5抑制剂,作用于atp与alk5结合以及alk5自磷酸化,无细胞试验中ic50分别为23nm和4nm;sd-208,其是一种选择性tgf-βri(alk5)抑制剂,withic50为48nm,选择性比tgf-βrii高100多倍;gw788388,其是一种有效的,选择性alk5抑制剂,无细胞试验中ic50为18nm,也抑制tgf-βii型受体和activinii型受体活性,但不抑制bmpii型受体;galunisertib(ly2157299)是有效的tgfβreceptori(tβri)抑制剂,无细胞试验中ic50为56nm;sb505124,其是一种选择性tgfβr抑制剂,作用于alk4和alk5,无细胞试验中ic50分别为129nm和47nm,也抑制alk7,但不抑制alk1,2,3或6;ew-7197,其是一种高效的,选择性的,口服生物有效的tgf-βreceptoralk4/alk5抑制剂,ic50分别为13nm和11nm。作为本发明的优选方式,所述的tgfβ抑制剂是sb431542(或称为sb-431542);其分子结构式如以下式(ii)所示:作为本发明的优选方式,所述的tgfβ抑制剂是a83-01(或称为a8301);其分子结构式如以下式(iii)所示:g9a组蛋白甲基转移酶(g9ahmtase)又称作常染色质组蛋白赖氨酸n-甲基转移酶2(euchromatichistone-lysinen-methyltransferase2,ehmt2)。如本发明所用,所述的“g9ahmtase抑制剂”是指能够抑细胞中g9ahmtase的抑制剂的总称,包括但不限于:bix01294、unc0638、a-366、unc0631、brd4770、unc0224、unc0646、unc0642等为代表的,具相同功能,或诱导相同靶点的同一类g9ahmtase抑制剂或化合物:bix01294,其是一种g9ahistonemethyltransferase抑制剂,无细胞试验中ic50为2.7μm,降低大部分组蛋白h3k9me2,也微弱抑制glp(主要是h3k9me3),对其他组蛋白甲基转移酶没有显著的抑制活性;bix01294特异性抑制负责甲基化h3k9位点的hmts活性;unc0638是一种有效的选择性的组蛋白赖氨酸甲基转移酶(hmtase)抑制剂,作用于g9a和glp,ic50分别为<15nm和19nm,有效且选择性地作用于多种表观遗传和非表观遗传靶点;unc0638特异性抑制负责甲基化h3k9位点的hmts活性;a-366是一种有效的、选择性的g9a/glp组蛋白甲基转移酶抑制剂,ic50为3.3nm。对g9a/glp的选择性比21个其他甲基转移酶高1000倍以上;unc0631是一种强效histonemethyltransferaseg9a抑制剂,ic50为4nm;brd4770是一种histonemethyltransferaseg9a抑制剂,其ic50为6.3μm,并且会诱导细胞死亡。brd4770是新型组蛋白甲基转移酶g9a(ehmt2)抑制剂,在panc-1细胞中ec50值为5um(三甲基化h3k9);unc0224是g9ahmtase抑制剂,ic50为15nm;unc0646是组蛋白赖氨酸甲基转移酶g9a和glp的高效选择性抑制剂(对g9a和glp的ic50值分别为6nm和15nm)。unc0646也可有效地阻断g9a/glp甲基转移酶在细胞中的活性(在mcf7细胞中ic50=10nm),且表现出较低的细胞毒性(在mcf7细胞中ec50=4.7μm)。在体内,科研人员先前发现包括细胞化学探针unc0638在内的高效选择性g9a/glp抑制剂,unc0638在功能潜力和细胞毒性等方面都出众。然而,该抑制剂药代动力学(pk)特征不佳,并不适用于动物实验;unc0642是一种有效的选择性g9a/glp抑制剂,抑制组胺h3受体和sigma-2受体,ki分别为45nm和900nm。unc0642的发现,该物质不仅具有较高的体外和细胞效能、低细胞毒性、优先的选择性,还展现出了更好的体内pk特征,使之更适合于动物实验。作为本发明的优选方式,所述的g9ahmtase抑制剂是bix01294(或bix-01294);其分子结构式如以下式(iv)所示:本发明还包括与上述化合物ⅰ、ⅱ或ⅲ、ⅳ等效的化合物、药剂制品、类似物和/或其盐、水合物或前体;也包括其自然生成和人工合成化合物。所述化合物的类似物包括但不限于:所述化合物的异构体、外消旋体。化合物具有一个或多个不对称中心。所以,这些化合物可以作为外消旋的混合物、单独的对映异构体、单独的非对映异构体、非对映异构体混合物、顺式或反式异构体存在。所述的“盐”包括但不限于:(1)与如下无机酸形成的盐:如盐酸、硫酸、硝酸、磷酸等;(2)与如下有机酸形成的盐,如乙酸、草酸、丁二酸、酒石酸、甲磺酸、马来酸、或精氨酸等。其它的盐包括与碱金属或碱土金属(如钠、钾、钙或镁)形成的盐等。所述的“化合物的前体”指当用适当的方法施用或处理后,该化合物的前体在培养基中,或动物,或人体内可转变成上述任一化合物的一种化合物,或上述任一化合物的一种化合物所组成的盐或溶液。本发明组合物中,gsk3β抑制剂、tgfβ抑制剂、g9ahmtase抑制剂,以重量份比:(5-80)﹕(0.1-50)﹕(0.1-50);较佳地,(10-70)﹕(0.5-40)﹕(0.5-40)存在;或溶液状态下以摩尔浓度比:(0.1-20)﹕(0.01-20)﹕(0.01-20);较佳地,(0.5-10)﹕(0.05-10)﹕(0.05-10)存在。本发明的组合物用于化学诱导人成纤维细胞转分化为肝细胞。对于本发明所述的组合物的剂型没有特别的限制,可以是任何适用于哺乳动物服用的剂型;可制备的剂型包括:粉剂、散剂、片剂、丸剂、胶囊剂、缓释剂、控速释剂及其它固体剂型;注射剂、输液剂、混悬剂及其它液体剂型;以及气体剂型、半固体剂型等其它剂型。优选的,所述的剂型可以是但不限于:粉末剂、颗粒剂、胶囊、缓释剂、片剂等固体剂型或注射剂、输液剂、溶液剂、混悬液等液体剂型。本发明的组合物的制备方法根据所需制备的剂型以及给药途径来决定,本领域技术人员在参考了本发明所提供的组合以及配比后,采用常规的药物组合物的制备方法即可制备出本发明的组合物。应理解,尽管在具体实施方式中,本发明人列举了几种组合物形式,但本领域人员也可由此推导:本发明的其它任何一种组合形式也是同样具有突出效果的。本发明人首次证实了本发明的小分子组合物可用于研发制备预防、改善或治疗肝纤维化,或慢性肝衰竭的药物或药物配方。当用于预防、改善或治疗肝纤维化,或慢性肝衰竭时,所用的组合物的有效剂量可随施用的模式和待治疗肝纤维化,或慢性肝衰竭类型以及,或肝功能衰竭的严重程度而变化。具体情况根据受试者的个体情况来决定,这在熟练医师或药剂师可以判断的范围内。本发明中,所述的成纤维细胞包括但不限于:人体不同组织或器官的成纤维细胞,如皮肤成纤维细胞、肝成纤维细胞(肝星状细胞)、肺间质成纤维细胞、肾成纤维细胞、肌成纤维细胞,以及人体其他组织或器官的成纤维细胞。较佳地为人皮肤成纤维细胞及肝成纤维细胞(肝星状细胞)。培养基和试剂本发明还提供了用于小分子组合物诱导人成纤维细胞直接重编程(转分化)为肝细胞的培养基(以下简称:成纤维细胞转分化肝细胞培养基)。按本发明所提供的组合物终浓度配方,选择具体终浓度的小分子组合物进行配制。作为本发明的优选方式,将该具体小分子组合物中的不同成分,分别根据其溶质的不同性质和不同溶解度将其溶解于dmso(二甲基亚砜)或其它有机溶剂或水性溶剂中配成浓缩液试剂(从1∶50-1∶10,000范围);然后按该具体小分子组合物终浓度要求,将各小分子有机溶液浓缩液试剂稀释,添加入含10%小牛血清的基础细胞培养基(或含有各种细胞因子或生长因子的无血清培养基)中,即可获得所述的成纤维细胞转分化肝细胞培养基。其中,该培养基各组分的百分含量还可上下浮动50%;较佳地上下浮动30%;更佳地上下浮动20%,如10%,5%;(百分数均以v/v计)。作为本发明的优选方式,所述的基础细胞培养基包括但不限于:dmem/f12、mem、dmem、f12、imdm、rpmi1640、neuronalbasal或fischers等,均为市场上可购得的商品。作为本发明的优选方式,所述的“无血清培养基”指:不含血清而含有支持细胞增殖和生物反应的多种营养成分(如生长因子、组织提取物等)的细胞培养基。即将除血清以外的各种细胞因子或生长因子等添加剂,添加到基础细胞培养基中组成的细胞培养基。作为本发明的优选方式,所述的含有各种细胞因子或生长因子的无血清培养基包括但不限于:its、n2、b27等,均为可自行配制或商购产品。应理解,本领域技术人员熟悉所述的基础细胞培养基或无血清培养基的配制或购买途径,因此,基础细胞培养基或无血清培养基并不限于本发明中所举例的这些。作为本发明的优选方式,所述的“成纤维细胞转分化肝细胞培养基”具体配制如下实施:(1)将①gsk3β抑制剂(或gsk3β抑制剂chir-99021):终浓度为0.1-20um;优选量为:0.5-10um;和②tgfβ抑制剂(或tgfβ抑制剂sb431542或/和a83-01):终浓度为0.01-20um;优选量为:0.05-10um;和③g9ahmtase抑制剂(或g9ahmtase抑制剂bix01294)终浓度为0.01-20um;优选量为:0.05-10um;混合,即可获得本发明用于化学诱导人成纤维细胞直接重编程(转分化)为肝细胞的小分子组合物。(2)将上述各小分子分别经过:溶解配制浓缩液→稀释到基础细胞培养液中→混合,即可配制获得“成纤维细胞转分化肝细胞培养基”。本发明还提供了用于化学诱导人成纤维细胞直接重编程(转分化)为肝细胞的实验动物注射或口服用试剂。作为本发明的优选方式,将前述任一组合物中的各小分子组合物,按公斤体重计算出相应的用药量,将其溶于captisol(1-30%),tween-80(5%)溶液中获得实验动物注射或口服用试剂。较佳地为captisol(1-30%)。培养方法本发明还公开了一种小分子组合物诱导人成纤维细胞直接重编程(转分化)为肝细胞的方法,所述方法步骤包括:(1)浓缩液试剂配制:根据本发明中任一所述的组合物,将各成分溶解于有机溶剂或水性溶剂中配制成浓缩液试剂;较佳地,所述的有机溶剂包括二甲基亚砜;较佳地,所述的水性溶剂包括:水,生理盐水,磷酸盐缓冲液;(2)培养基获得:将步骤(1)中的浓缩液试剂分别稀释入含5-20%小牛血清的基础细胞培养基或含有各种细胞因子或生长因子的无血清培养基中(使得各组分的浓度符合前面所述的组合物中所限定的浓度),获得诱导成纤维细胞转分化肝细胞的培养基;其中,该培养基各组分的百分含量还可上下浮动50%;较佳地上下浮动30%;更佳地上下浮动20%,如10%,5%。(3)诱导成纤维细胞转分化为肝细胞:将成纤维细胞在含5-20%小牛血清的基础细胞培养基或含有各种细胞因子或生长因子的无血清培养基中混悬、铺板,在细胞贴壁后弃原培养基,换步骤(2)的成纤维细胞转分化肝细胞的培养基37℃培养,每2-4天换液一次;3-15天传代一次。(4)诱导成纤维细胞转分化的传代培养:弃原培养液,pbs洗涤一次,加入细胞消化液消化细胞,37℃,1-5分钟,终止细胞消化,离心,弃上清,将细胞沉淀重悬,按1:1-1:3传代铺板。按实验步骤第(2)和(3)步骤培养,每2-4天换液一次。所用消化液包括胰酶,edta,acutase,tryplee等。3-15天传代一次。(5)诱导成纤维细胞转分化并获得转分化肝细胞:经上述实验步骤(3)、(4)转分化培养和传代培养成纤维细胞2-4周,即可获得转分化肝细胞。可用该肝细胞进行其他科研实验;新药药毒、药效检测评估;为构建生物人工肝,临床细胞移植等提供肝细胞源。成纤维细胞的转分化肝细胞培养如上述培养方法实验步骤。转分化获得的肝细胞的功能检测:成纤维细胞的转分化肝细胞培养如上述,用培养不同时间获得的肝细胞检测其相关功能。本发明的化学诱导成纤维细胞直接重编程(转分化)为肝细胞的小分子组合物及其制备的培养基和试剂以及其实验方法,不仅可研发制备治疗肝纤维化,或慢性肝衰竭的药物或药物前体,还可广泛作为防治组织或器官纤维化,或慢性肝衰竭的方法及机理研究;以及肝病研究、药理及毒理安全性检测的细胞模型。所获得的转分化肝细胞可继续进行功能检测、临床前期研究等。该方法不仅为防治肝纤维化,或慢性肝衰竭研究开辟了一个新途径,还为肝细胞的医药临床应用及科研应用提供新细胞源,具有广泛的应用前景;而且丰富了干细胞重编程理论,拓展其应用范围。具有重要的科学意义和极大的应用价值。本发明的有益效果在于:1.率先借鉴已有细胞重编程研究结果,提出:筛选能够构建并维持重编程目的细胞的特有基因表达谱或生物学行为特性,以及能够突破起始细胞重编程过程中的各种“能障”的诱导因子组合,就可以将成纤维细胞直接转分化为目的细胞,这一创新思路。为研究其他体细胞转分化提供新思路;2.率先仅使用化学小分子组合,诱导成纤维细胞直接重编程(转分化)为肝细胞;为医药应用及临床肝细胞移植治疗肝衰竭提供新的肝细胞源。3.本发明中,应用的小分子性质稳定,作用的时间、剂量及组合方式易于控制,作用效果稳定可靠;4.本发明无外源基因导入,不改变细胞的基因结构,避免外源基因导入或结构基因改变引起新的致癌风险,因此安全可靠;5.率先使用小分子组合诱导成纤维细胞直接重编程为肝细胞,而不经过重编程为诱导多能干细胞(ipsc)阶段,避免了诱导多能干细胞体内致癌风险;易于体内应用细胞原位转分化,成药性较好;6.该方法的成纤维细胞可取材于患者本人,因此转分化获得肝细胞具有个性化特征,并有两大优势:一是更易于进入临床应用,并最大限度降低或避免转化肝细胞移植引起的免疫排斥反应;二是可以构建具群体代表性的肝细胞库,应用于新药的肝毒安全评测和药效筛选;7.化学小分子稳定,成药性好。该方法易于应用于体内原位转分化。因此可用于研发或制备成治疗人肝纤维化,或肝功能衰竭的新药物或药物前体,研发出相应的治疗新方法、新手段;8.该小分子组合可制备成化学诱导成纤维细胞转分化为肝细胞的科研用培养基和试剂;可为转分化肝细胞相关机理研究及肝病研究提供培养基或试剂盒;9.本发明小分子组合物及其诱导成纤维细胞转分化肝细胞方法简单,实验环节少,成本低廉,易于生产应用。其转分化肝细胞不仅可为医药应用项目提供肝细胞源,而且易于直接应用于临床。可带动并促进相关生物医药产业发展。下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如[美]j.s.博尼费斯农等著;章静波,方瑾,王海杰等译,《精编细胞生物学实验指南[shortprotocolsincellbiology]》,科学出版社2007;中所述的条件;或按照制造厂商所建议的条件。实施例1、小分子诱导人成纤维细胞直接重编程(转分化)为肝细胞的小分子组合物,及其培养基和试剂的配制设计如下组合物或培养基,可按摩尔浓度或重量浓度进行配制:1、成纤维细胞转分化肝细胞小分子组合物的配方(1)成纤维细胞转分化肝细胞组合物1gsk3β抑制剂chir-99021:终浓度5um;tgfβ抑制剂sb431542:终浓度2um;g9ahmtase抑制剂bix01294:终浓度3um;(2)成纤维细胞转分化肝细胞组合物2gsk3β抑制剂chir-99021:终浓度6um;tgfβ抑制剂sb431542:终浓度0.5um;g9ahmtase抑制剂bix01294:终浓度5um;(3)成纤维细胞转分化肝细胞组合物3gsk3β抑制剂chir-99021:终浓度3um;tgfβ抑制剂a83-01:终浓度1um;g9ahmtase抑制剂bix01294:终浓度2um;(4)成纤维细胞转分化肝细胞组合物4gsk3β抑制剂bio:终浓度1um;tgfβ抑制剂a83-01终浓度1um;g9ahmtase抑制剂unc0638:终浓度3um;(5)成纤维细胞转分化肝细胞组合物5gsk3β抑制剂chir-99021:终浓度3um;tgfβ抑制剂sb431542:终浓度5um;g9ahmtase抑制剂unc0638:终浓度5um;(6)成纤维细胞转分化肝细胞组合物6gsk3β抑制剂bio:终浓度3um;tgfβ抑制剂sb431542:终浓度2um;g9ahmtase抑制剂bix01294:终浓度2.5um;(7)成纤维细胞转分化肝细胞组合物7gsk3β抑制剂chir-99021:终浓度5um;tgfβ抑制剂ly2109761:终浓度2um;g9ahmtase抑制剂bix01294:终浓度2um;(8)成纤维细胞转分化肝细胞组合物8gsk3β抑制剂chir-99021:终浓度4um;tgfβ抑制剂sb431542:终浓度3um;g9ahmtase抑制剂bix01294:终浓度2um;(9)成纤维细胞转分化肝细胞组合物9gsk3β抑制剂tws119:终浓度4um;tgfβ抑制剂a83-01:终浓度2um;g9ahmtase抑制剂bix01294:终浓度5um;各具体小分子组合物按前述“培养方法”步骤(1)先溶解于dmso中制成浓缩液试剂。2、成纤维细胞转分化肝细胞培养基配制将上述实验步骤1配制的成纤维细胞转分化肝细胞组合物1~9各成分dmso浓缩液试剂按前述培养方法步骤(2)配制(选用的基础细胞培养基是dmem),获得成纤维细胞转分化肝细胞培养基1~9(即培养基1与组合物1的化合物终浓度相同,培养基2与组合物2的化合物终浓度相同,…,培养基9与组合物9的化合物终浓度相同)。实施例2、成纤维细胞转分化肝细胞培养基6诱导成纤维细胞转分化肝细胞1、成纤维细胞转分化肝细胞培养将成纤维细胞在添加入含10%小牛血清的基础细胞培养基dmem中混悬、铺板,37℃培养。待成纤维细胞贴壁后,弃原培养基,换成纤维细胞转分化肝细胞培养基6,37℃培养,每3天换液1次;7天传代一次。2、成纤维细胞转分化肝细胞的传代培养传代培养步骤:弃原培养液,pbs洗涤一次,加入细胞消化液消化细胞,37℃,3分钟,终止细胞消化,离心,弃上清,将细胞沉淀重悬,按1:2传代铺板。换成纤维细胞转分化肝细胞培养基6培养,每4天换液1次。所用消化液是胰酶(也可用edta,acutase,tryplee)等。5天传一次代。3、转分化肝细胞的收获经上述实验步骤1-2的成纤维细胞转分化肝细胞培养以及传代培养2-4周,可获得转分化肝细胞,可用于进行其他科研实验。4、人成纤维细胞(hff)与转分化所得肝细胞(cihep)形态比较将人成纤维细胞与上述步骤3转分化所得肝细胞进行形态比较,结果如图1。图1实验结果显示,人成纤维细胞转分化为肝细胞后,形态发生明显改变,与肝细胞形态吻合。实施例3、成纤维细胞转分化肝细胞培养基1诱导人成纤维细胞转分化为肝样细胞的肝特异标志物染色的流式细胞分析转分化肝细胞培养基1诱导人成纤维细胞转分化为肝细胞的方法步骤同实施例2。对获得的转分化肝样细胞的肝特异标志物染色的流式细胞分析。采用常规的免疫染色方法,将上述实验步骤诱导人成纤维细胞转分化为肝细胞获得的肝样细胞进行人肝细胞特异性标志物(aat,alb,asgpr,cyp3a,hnf4a)免疫染色。免疫染色方法为:(1)弃细胞培养液,pbs漂洗1次,(2)0.05%胰酶,37℃,5分钟消化,用胰酶终止剂,或者含血清/白蛋白的细胞培养液终止胰酶作用,800-1000rpm离心3-5分钟,弃上清;(3)2%多聚甲醛固定10分钟后,pbs漂洗5分钟×3次,(4)10%羊血清封闭:室温,60分钟,(5)0.1%triton:5-10min,(6)一抗(兔抗alb抗体,鼠抗cyp3a抗体或兔抗asgpr抗体)室温1小时或4℃过夜,(7)pbs漂洗5分钟×3次,(8)二抗(cy3标记的羊抗兔抗体,fitc标记的羊抗鼠或羊抗兔抗体)室温45-60min,(9)pbs洗净,5min×3次。然后进行流式细胞分析,结果见图2。由图2实验结果显示,所获得的转分化肝样细胞的肝细胞特异性标志物呈现阳性的细胞比例非常高,而胚胎肝细胞标志物afp则基本不表达。因此,可以证明本发明的转分化培养基及培养方法将人成纤维细胞转分化获得了功能性的人肝成熟细胞。实施例4、成纤维细胞转分化肝细胞培养基2、3、4、5诱导人成纤维细胞转分化为肝样细胞与原代肝细胞白蛋白生成的比较转分化肝细胞培养基2、3、4、5(其处理组依序编为1、2、3、4组)诱导人成纤维细胞转分化为肝细胞的方法步骤同实施例2。将所获得的4组诱导人成纤维细胞转分化所得肝样细胞与人原代肝细胞(phh)进行白蛋白生成的比较。具体方法为:通过elisa试剂盒对上述实验步骤所获得的4组诱导人成纤维细胞转分化所得肝样细胞和商购的人原代肝细胞进行白蛋白分泌功能检测;检测实施步骤参见试剂盒说明书(美国bioassaysystem公司/diag-250,bcgalbuminassaykit)。4组诱导人成纤维细胞转分化所得肝样细胞与人原代肝细胞(phh)进行白蛋白生成的比较结果见图3。由图3实验结果显示,所获得的转分化肝样细胞具有人肝细胞特有的生成白蛋白的功能。实施例5、成纤维细胞转分化肝细胞培养基6、7、8、9诱导人成纤维细胞转分化为肝样细胞的尿素生成功能测定转分化肝细胞培养基6、7、8、9(其处理组依序编为1、2、3、4组)诱导人成纤维细胞转分化为肝细胞的方法步骤同实施例2。将所获得的4组诱导人成纤维细胞转分化所得肝样细胞与人原代肝细胞进行尿素生成功能对照检测;具体方法为:通过尿素氮检测试剂盒对上述实验所获得转分化肝样细胞和商购的人原代肝细胞进行尿素合成功能检测;检测实施步骤参见试剂盒说明书(美国bioassaysystem公司/diur-500,ureaassaykit);尿素来源为血液中的血氨,其生成量体现肝细胞的解毒能力。4组人成纤维细胞转分化所得肝样细胞尿素生成结果见图4。尿素来源为血液中的血氨,其生成量体现肝细胞的解毒能力。由图4实验结果显示,人成纤维细胞转分化所得肝样细胞具有肝细胞特有的生成尿素的功能。实施例6、成纤维细胞转分化肝细胞培养基6、7、8、9诱导人成纤维细胞转分化为肝样细胞的糖原染色转分化肝细胞培养基6、7、8、9(其处理组依序编为1、2、3、4组)诱导人成纤维细胞转分化为肝细胞的方法步骤同实施例2。将人成纤维细胞转分化所得肝样细胞进行糖原染色。染色的深浅展现肝细胞储存糖原的能力。用schiff方法作肝糖原染色。具体方法为:(1)弃细胞培养液,pbs漂洗1次;(2)4%多聚甲醛固定10分钟后,pbs漂洗5分钟×3次;(3)加入pas-i液10min,流水冲洗;(4)加入pas-ii液1-2min,流水冲洗;(5)显微镜取照片。人成纤维细胞转分化所得肝样细胞的糖原染色结果如图5;图中6、7、8、9转分化培养基所得转分化肝样细胞糖原染色结果从上图的左至右依次排列为1、2、3、4。由图5实验结果显示,转分化培养获得肝样细胞的肝糖原染色阳性,而图下方成纤维细胞肝糖原染色阴性。证明本发明的方法获得的转分化肝样细胞具有人肝细胞相同的糖原储存活性。实施例7、成纤维细胞转分化肝细胞培养基6、7、8、9诱导人成纤维细胞转分化为肝样细胞的p450酶(cyp3a4和cyp1a2)活性诱导转分化肝细胞培养基6、7、8、9(其处理组依序编为1、2、3、4组)诱导人成纤维细胞转分化为肝细胞的方法步骤同实施例2。将人成纤维细胞转分化获得肝样细胞的p450酶(cyp3a4和cyp1a2)活性诱导:(1)将上述实验步骤诱导人成纤维细胞转分化获得肝样细胞进行p450酶(cyp3a4)在利福平(rifampicine)诱导下升高的情况。p450酶活性诱导的方法如下:用利福平不同浓度(1um、10um、25um)处理,以不加入利福平且其它条件相同的处理组作为对照。每24小时换液一次,48小时收取细胞提取rna,用real-timepcr测定p450酶cyp3a4基因表达水平;(2)将上述实验步骤获得的肝样细胞在奥美拉措诱导后检测p450酶cyp1a2基因表达水平。p450酶活性诱导的方法如下:用奥美拉措不同浓度(1um、10um、25um)处理,以不加入奥美拉措且其它条件相同的处理组作为对照。每24小时换液一次,48小时收取细胞提取rna,用real-timepcr测定p450酶cyp3a4基因表达水平。p450酶(cyp3a4和cyp1a2)活性诱导结果见图6(图左:cyp3a4在不同浓度利福平诱导下的活性升高;图右:cyp1a2在不同浓度奥美拉措诱导下的活性升高)。图中,6、7、8、9转分化培养基所得转分化肝样细胞p450酶活性诱导结果从左至右依次排列为1、2、3、4。由图6实验结果显示,本发明的方法获得的转分化肝样细胞具肝细胞特有的p450代谢酶活性。图中纵坐标为酶的相对活性。实施例8、成纤维细胞转分化肝细胞培养基8诱导人成纤维细胞转分化为肝样细胞的脂肪染色,染色的深浅展现肝细胞代谢脂肪的能力转分化肝细胞培养基8诱导人成纤维细胞转分化为肝细胞的方法步骤同实施例2。使用脂肪染色常规试剂盒,方法步骤见试剂盒。染色结果见图7。由图7实验结果显示,转分化肝细胞脂肪染色阳性,成纤维细胞脂肪染色阴性;证明该方法转分化所得肝样细胞具有肝细胞的代谢脂肪能力。实施例9、成纤维细胞转分化肝细胞培养基9诱导人成纤维细胞转分化为肝样细胞的脂肪摄取。染色的深浅展现肝细胞摄取脂肪的能力。转分化肝细胞培养基9诱导人成纤维细胞转分化为肝细胞的方法步骤同实施例2。使用脂肪摄取常规试剂盒,方法步骤见试剂盒。摄取结果见图8。图8实验结果显示,该方法转分化所得肝样细胞,具有肝细胞的脂肪摄取和储存功能;而成纤维细胞不具备该功能。实施例10、人成纤维细胞转分化肝细胞的icg摄取。染色的深浅展现肝细胞摄取异物及排除异物的能力。转分化肝细胞培养基2诱导人成纤维细胞转分化为肝细胞的方法步骤同实施例2。使用icg摄取常规试剂盒,方法步骤见试剂盒。摄取结果见图9。由图9实验结果显示,转分化肝样细胞具有人肝细胞摄取异物及排除异物的能力,证明其具有肝细胞相关功能。综上,本发明的“小分子诱导人成纤维细胞直接重编程(转分化)为肝细胞的方法”具有以下的特点:1、小分子性质稳定,作用的时间、剂量及组合方式易于控制,作用效果稳定可靠;2、转分化获得的肝细胞具有正常成熟的人肝细胞形态和功能;具有白蛋白生成,尿素合成,糖原储存、p450酶活性诱导及其他肝细胞特有功能;3、该转分化方法的成纤维细胞可取材于患者本人,因此转分化获得肝细胞具有个性化特征,并有两大优势:一是更易于进入临床应用,并最大限度降低或避免转化/转分化肝细胞移植引起的免疫排斥反应;二是可以构建具群体代表性的肝细胞库,应用于新药的肝毒安全评测和药效筛选;4、不需要导入外源基因或改变细胞基因结构,避免了外源基因导入或基因改变引起新的致癌风险。所以,更为安全可靠;5、该方法采取化学诱导直接重编程,不需要多能重编程为诱导多能干细胞(ipsc),避免了诱导多能干细胞引起的致癌风险;且易于应用于体内原位细胞转分化;6、化学小分子稳定,成药性好。该方法易于应用于体内原位细胞转分化。因此可用于研发制备成治疗人肝纤维化,或肝功能衰竭的药物。7、该转分化方法普适性和可重复性好;8、方法简单,易于操作,成本较低;9、常规培养、周期短、适于批量生产和易于产业化等特点。在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1