使用兔皮提取物促进细胞增殖的方法与流程
本申请涉及细胞学领域、免疫学领域和生物医药领域。特别地,本申请涉及一种使用兔皮提取物促进细胞(例如间充质干细胞、少突胶质细胞或神经干细胞)增殖的方法,其包括在含有兔皮提取物的细胞培养基中培养所述细胞。本申请还涉及,一种促进细胞(例如间充质干细胞、少突胶质细胞或神经干细胞)增殖的细胞培养基,其包含兔皮提取物。本申请还涉及,兔皮提取物用于促进细胞(例如间充质干细胞、少突胶质细胞或神经干细胞)增殖的用途。此外,本申请还涉及一种新的兔皮提取物,以及其制备方法和用途。
背景技术:
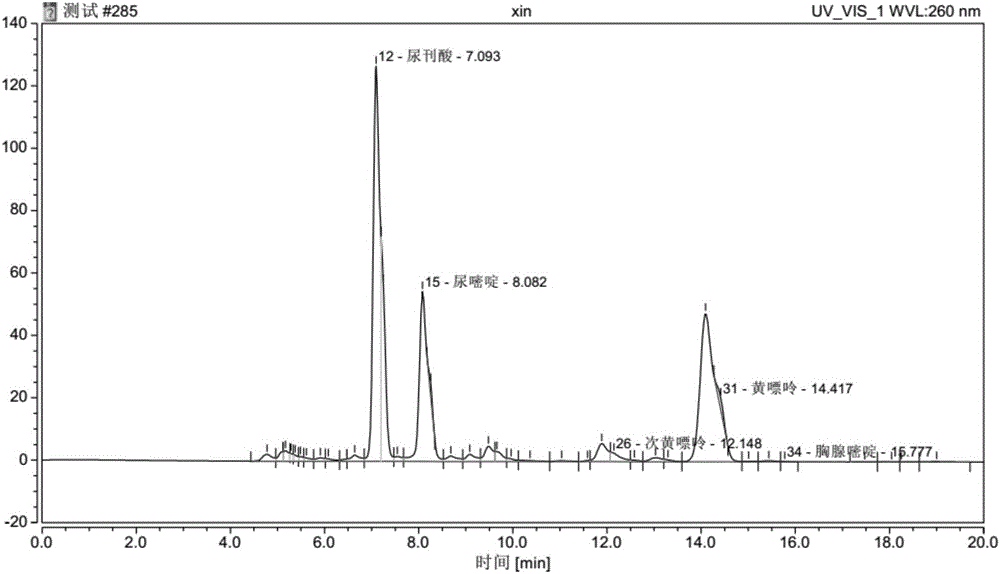
:脊髓损伤是一种具有高发率、高致残率、低恢复率特征的严重的中枢神经损伤。目前,针对脊髓损伤,尚无有效的治疗手段。脊髓损伤的治疗仍是世界范围内的医学难题。近十年来,细胞移植治疗脊髓损伤成为了新的热点,为脊髓损伤的修复带来了新的希望,而其中骨髓间充质干细胞(其能够分化成神经元的前体细胞),少突胶质细胞(其为中枢神经系统的髓鞘形成细胞),神经干细胞(其能够分化成神经元的前体细胞)尤其受到重视,是细胞移植中最受欢迎的细胞。骨髓间充质干细胞是存在于骨髓中的具有多向分化潜能的干细胞。因其具有多向分化潜能、造血支持和促进干细胞植入、免疫调控和自我复制等特点,骨髓间充质干细胞日益受到人们的关注。骨髓间充质干细胞不仅可分化为成骨细胞、软骨细胞、脂肪细胞等,其在体内或体外特定的诱导条件下还可分化为神经细胞,并且在连续传代培养和冷冻保存后仍具有多向分化潜能。因此,骨髓间充质干细胞可作为理想的种子细胞,用于衰老和病变引起的组织器官损伤修复。近年来,使用骨髓间充质干细胞来治疗脊髓损伤、脑卒中、帕金森病、创伤性脑损伤等疾病,已取得了显著的成效。然而,骨髓间充质干细胞在培养过程中存在易组织化,生长缓慢和易分化等问题,并且随着培养时间的延长,细胞的粘附性逐渐增高,增殖能力逐渐降低,这大大影响了骨髓间充质干细胞的临床应用。少突胶质细胞是中枢神经系统的髓鞘形成细胞,其起源于胚胎神经管的神经上皮细胞,且其主要功能是在中枢神经系统中包绕轴突、形成绝缘的髓鞘结构、协助神经电信号的跳跃式高效传递,维持和保护神经元的正常功能。动物实验研究发现,少突胶质细胞可用于治疗大鼠脊髓损伤,促进白质在损伤脊髓的存留,改善损伤脊髓处突髓鞘化。然而,少突胶质细胞在培养过程中存在生长缓慢和易分化等问题,并且随着培养时间的延长,细胞的粘附性逐渐增高,增殖能力逐渐降低,这大大影响了少突胶质细胞的临床应用。神经干细胞是中枢神经系统的种子细胞,其在神经发育、中枢神经损伤修复和神经退行性病变中有十分重要的作用。神经干细胞在体内主要分布于大脑室管膜下区、海马和脊髓中央管周围。体内的神经干细胞在平常处于静止状态,而在中枢神经损伤时显示出增殖和分化活力,并且可以向损伤附近迁移,弥补损失的神经细胞。然而,神经干细胞在体内的数量是有限的。在中枢神经系统损伤发生后,神经干细胞的数量可能不足以弥补损伤丧失的神经元,因此促进神经干细胞增殖就显得尤为重要。与此同时,神经干细胞在培养过程中存在生长缓慢和易分化等问题,这大大影响了神经干细胞的临床应用。因此,探索体外促进骨髓间充质干细胞、少突胶质细胞和神经干细胞增殖的方法显得尤为重要,对于骨髓间充质干细胞、少突胶质细胞和神经干细胞治疗神经系统疾病的临床应用具有重要意义。本领域需要开发促进骨髓间充质干细胞、少突胶质细胞和神经干细胞增殖的方法。痘苗病毒接种兔炎症皮肤提取物(下文中也简称为兔皮提取物)是含有从接种痘苗病毒而发痘的兔的炎症皮肤组织中提取分离的非蛋白性的活性物质的提取物。此类提取物在被提取后的状态下为液体,但也可通过干燥制成固体。已有文献报道,此类提取物可用于治疗腰痛症、颈肩腕综合征、症状性神经痛、伴随皮肤病(湿疹、皮肤炎、荨麻疹)的搔痒、过敏性鼻炎、亚急性视神经脊髓病(smon)后遗症的冷感-知觉异常-疼痛(参见例如cn103110663a)。基于此类提取物的生物活性,已开发了含有痘苗病毒接种家兔炎症皮肤提取液的制剂(神经妥乐平/neur0tr0pin,在本申请中也简称为“ntp”或“ntp制剂”)。尽管已经对兔皮提取物进行了大量的研究,然而,兔皮提取物的许多活性和功能仍尚不明确。在本申请中,发明人首次发现,兔皮提取物具有促进细胞(特别是间充质干细胞、少突胶质细胞或神经干细胞)增殖的活性和功能,从而提供了一种促进细胞(例如间充质干细胞、少突胶质细胞或神经干细胞)增殖的方法。技术实现要素:在本申请中,发明人经过大量研究后发现,从接种了痘苗病毒的兔的发痘的皮肤提取的兔皮提取物能够促进多种细胞(例如少突胶质细胞、间充质干细胞(例如骨髓间充质干细胞)和神经干细胞)的增殖。基于此,本申请涉及了以下方面。在第一方面,本申请提供了一种体外培养细胞或体外促进细胞增殖的方法,其包括使用兔皮提取物的步骤,其中所述兔皮提取物为接种了痘苗病毒的兔的发痘的皮肤的提取物。在某些优选的实施方案中,所述细胞选自少突胶质细胞、间充质干细胞(例如骨髓间充质干细胞)和神经干细胞。在某些优选的实施方案中,所述细胞为少突胶质细胞。在某些优选的实施方案中,所述细胞为间充质干细胞(例如骨髓间充质干细胞)。在某些优选的实施方案中,所述细胞为神经干细胞。在某些优选的实施方案中,所述方法包括,在含有所述兔皮提取物的细胞培养基中培养所述细胞的步骤。在某些优选的实施方案中,所述细胞培养基为添加了兔皮提取物的基础细胞培养基。在某些优选的实施方案中,所述细胞培养基为添加了兔皮提取物的完全细胞培养基。在某些优选的实施方案中,所述细胞培养基为包含兔皮提取物的dmem培养基、f12培养基或dmem/f12培养基。在某些优选的实施方案中,所述细胞培养基含有0.2-3nu/ml的兔皮提取物。例如,所述细胞培养基含有0.2-0.5nu/ml,0.5-1nu/ml,1-1.5nu/ml,1.5-2nu/ml,2-2.5nu/ml或2.5-3nu/ml的兔皮提取物。在某些优选的实施方案中,所述细胞培养基还包含有额外的试剂,例如血清(例如胎牛血清),细胞因子,b27细胞培养添加剂(b27),或其任何组合。在某些优选的实施方案中,所述细胞因子包括但不限于,表皮细胞生长因子(egf),白血病抑制因子(lif),成纤维细胞生长因子(fgf;包括但不限于afgf和bfgf),或其任何组合。在某些优选的实施方案中,所述方法用于非诊断、非治疗目的。在第二方面,本申请涉及,兔皮提取物用于体外培养细胞或用于体外促进细胞增殖的用途,其中所述兔皮提取物为接种了痘苗病毒的兔的发痘的皮肤的提取物。在某些优选的实施方案中,所述细胞选自少突胶质细胞、间充质干细胞(例如骨髓间充质干细胞)和神经干细胞。在某些优选的实施方案中,所述细胞为少突胶质细胞。在某些优选的实施方案中,所述细胞为间充质干细胞(例如骨髓间充质干细胞)。在某些优选的实施方案中,所述细胞为神经干细胞。在某些优选的实施方案中,将所述兔皮提取物添加到细胞培养基中,然后用于体外培养细胞或用于体外促进细胞增殖。换言之,所述兔皮提取物可以用作细胞培养或细胞培养基的添加剂,用于体外培养细胞或用于体外促进细胞增殖。在某些优选的实施方案中,所述兔皮提取物以0.2-3nu/ml的水平存在于所述细胞培养基中。例如,所述兔皮提取物以0.2-0.5nu/ml,0.5-1nu/ml,1-1.5nu/ml,1.5-2nu/ml,2-2.5nu/ml或2.5-3nu/ml的水平存在于所述细胞培养基中。在某些优选的实施方案中,所述细胞培养基为添加了兔皮提取物的基础细胞培养基。在某些优选的实施方案中,所述细胞培养基为添加了兔皮提取物的完全细胞培养基。在某些优选的实施方案中,所述细胞培养基为包含兔皮提取物的dmem培养基、f12培养基或dmem/f12培养基。在某些优选的实施方案中,所述细胞培养基还包含有额外的试剂,例如血清(例如胎牛血清),细胞因子,b27细胞培养添加剂(b27),或其任何组合。在某些优选的实施方案中,所述细胞因子包括但不限于,表皮细胞生长因子(egf),白血病抑制因子(lif),成纤维细胞生长因子(fgf;包括但不限于afgf和bfgf),或其任何组合。在某些优选的实施方案中,所述用途用于非诊断、非治疗目的。在第三方面,本申请还涉及,兔皮提取物用于制备组合物的用途,所述组合物用于培养细胞或用于促进细胞增殖,其中所述兔皮提取物为接种了痘苗病毒的兔的发痘的皮肤的提取物。在某些优选的实施方案中,所述细胞选自少突胶质细胞、间充质干细胞(例如骨髓间充质干细胞)和神经干细胞。在某些优选的实施方案中,所述细胞为少突胶质细胞。在某些优选的实施方案中,所述细胞为间充质干细胞(例如骨髓间充质干细胞)。在某些优选的实施方案中,所述细胞为神经干细胞。在某些优选的实施方案中,所述组合物为包含所述兔皮提取物的细胞培养基。在某些优选的实施方案中,所述兔皮提取物以0.2-3nu/ml的水平存在于所述细胞培养基中。例如,所述兔皮提取物以0.2-0.5nu/ml,0.5-1nu/ml,1-1.5nu/ml,1.5-2nu/ml,2-2.5nu/ml或2.5-3nu/ml的水平存在于所述细胞培养基中。在某些优选的实施方案中,所述细胞培养基为添加了兔皮提取物的基础细胞培养基。在某些优选的实施方案中,所述细胞培养基为添加了兔皮提取物的完全细胞培养基。在某些优选的实施方案中,所述细胞培养基为包含兔皮提取物的dmem培养基、f12培养基或dmem/f12培养基。在某些优选的实施方案中,所述细胞培养基还包含有额外的试剂,例如血清(例如胎牛血清),细胞因子,b27细胞培养添加剂(b27),或其任何组合。在某些优选的实施方案中,所述细胞因子包括但不限于,表皮细胞生长因子(egf),白血病抑制因子(lif),成纤维细胞生长因子(fgf;包括但不限于afgf和bfgf),或其任何组合。在第四方面,本申请还提供了一种细胞培养基,其包含兔皮提取物,其中所述兔皮提取物为接种了痘苗病毒的兔的发痘的皮肤的提取物。在某些优选的实施方案中,所述细胞培养基用于培养细胞或用于促进细胞增殖。在某些优选的实施方案中,所述细胞选自少突胶质细胞、间充质干细胞(例如骨髓间充质干细胞)和神经干细胞。在某些优选的实施方案中,所述细胞为少突胶质细胞。在某些优选的实施方案中,所述细胞为间充质干细胞(例如骨髓间充质干细胞)。在某些优选的实施方案中,所述细胞为神经干细胞。在某些优选的实施方案中,所述细胞培养基为添加了兔皮提取物的基础细胞培养基。在某些优选的实施方案中,所述兔皮提取物以0.2-3nu/ml的水平存在于所述细胞培养基中。例如,所述兔皮提取物以0.2-0.5nu/ml,0.5-1nu/ml,1-1.5nu/ml,1.5-2nu/ml,2-2.5nu/ml或2.5-3nu/ml的水平存在于所述细胞培养基中。在某些优选的实施方案中,所述细胞培养基为添加了兔皮提取物的完全细胞培养基。在某些优选的实施方案中,所述细胞培养基为包含兔皮提取物的dmem培养基、f12培养基或dmem/f12培养基。在某些优选的实施方案中,所述细胞培养基还包含有额外的试剂,例如血清(例如胎牛血清),细胞因子,b27细胞培养添加剂(b27),或其任何组合。在某些优选的实施方案中,所述细胞因子包括但不限于,表皮细胞生长因子(egf),白血病抑制因子(lif),成纤维细胞生长因子(fgf;包括但不限于afgf和bfgf),或其任何组合。在本申请中,细胞培养基(例如基础细胞培养基,完全细胞培养基,dmem培养基、f12培养基或dmem/f12培养基)可通过常规方法配制获得,或者也可以商购获得。在本申请中,所述兔皮提取物为接种了痘苗病毒的兔的发痘的皮肤的提取物。此类兔皮提取物可以通过常规方法(例如,中国发明专利申请cn1493302a、cn103110663a、cn105163746a、cn106109498a、cn106573020a中公开的兔皮提取物的提取方法),从接种了痘苗病毒的兔的发痘的皮肤提取获得,或者可以商购获得。兔皮提取物是来自接种痘苗病毒而发痘的兔的炎症皮肤组织的提取物,其中含有极多种类的物质。换言之,兔皮提取物和利用兔皮提取物制备的制剂不是以特定的1种或数种物质作为有效成分,不能简单地通过测定某一种或数种有效成分的含量来确定其活性/效能。为了客观评价兔皮提取物的活性/效能,已提出通过测定生物活性(效价)来进行兔皮提取物的有效成分定量。简言之,根据“日药理志”(第72卷第5号,573-584页,1976年)中记载的方法,使用sart应激(反复寒冷负荷)动物(其为疼痛阈值比正常动物低的慢性应激动物),通过炎症足加压(randall-selitto)法进行镇痛试验,测定兔皮提取物的镇痛系数。在炎症足加压法中,对小鼠的尾部施加压力刺激,以直至小鼠显示逃避反应的加压重量为指标,测定镇痛效果。所谓镇痛系数是将在给予药物后测定的加压重量除以给予药物前测定的加压重量得到的值。关于兔皮提取物的活性,以显示预定值以上的镇痛系数的情况作为镇痛效果阳性,求出被判断为阳性的动物只数的比例,作为镇痛有效率(%)。随后,根据对于稀释为各种浓度的标准品测定的结果,计算出ed50值。由此,如下来定义用于评价兔皮提取物的生物活性(效价)的单位:将ed50值为给药量100mg/kg(小鼠体重)的兔皮提取物lmg所显示的活性定义为1neurotropin单位(即,1nu)。在本申请中,当描述兔皮提取物或制剂的有效成分量(效价)时,使用nu这样的单位(有时也直接简称为“单位”,u)来进行表示。在本领域中,nu单位已被用于描述兔皮提取物或相关制剂的有效成分量(效价)。例如,目前市售的ntp注射剂含有1.2nu单位/ml的有效成分,ntp片剂含有4nu单位/片的有效成分。在本申请中,“neurotropin单位”、“单位”,“nu”和“u”具有相同的含义,且可互换使用。γ-氨基丁酸(简称gaba)是一种天然存在的非蛋白质氨基酸。研究显示,gaba是哺乳动物中枢神经系统中重要的抑制性神经传达物质,其在人体大脑皮质、海马、丘脑、基底神经节和小脑中起重要作用,并对机体的多种功能具有调节作用。研究还显示,大鼠海马区gaba能神经元的数量和gaba含量随着年龄的增加而降低。gaba能神经支配脑血管,调节脑循环,脑循环缺血将导致血管性痴呆。腹腔注射gaba可以改善由脑缺血导致的血管性痴呆大鼠的学习记忆功能,且可增加海马gaba受体表达。脑内gaba能神经元退行性病变与衰老有密切关系,而外源性给予gaba可以改善衰老相关的脑功能障碍。另外,还已报道,gaba可以提高葡萄糖磷酸酯酶的活性,促进脑组织的新陈代谢和恢复脑细胞功能。这些研究结果都表明,gaba能够帮助维持神经系统的正常功能,促进神经系统的修复,提示了gaba对于神经系统的细胞(例如少突胶质细胞、间充质干细胞(例如骨髓间充质干细胞)和神经干细胞)的有益作用(例如促进神经系统的细胞的增殖)。瓜氨酸是一种α氨基酸。研究显示,瓜氨酸能够提高脑力清晰度,帮助改善脑神经细胞贮藏与调回讯息的能力。这些研究结果提示了瓜氨酸对于神经系统的细胞(例如少突胶质细胞、间充质干细胞(例如骨髓间充质干细胞)和神经干细胞)的有益作用。肌肽,即β-丙氨酰-l-组氨酸,是一种由β-丙氨酸和l-组氨酸两种氨基酸组成的二肽。研究表明,肌肽具有很强的抗氧化能力,并且动物实验数据显示,肌肽具有神经保护作用,能够防止永久性脑部缺血损伤。这些研究结果提示了肌肽对于神经系统的细胞(例如少突胶质细胞、间充质干细胞(例如骨髓间充质干细胞)和神经干细胞)的有益作用。因此,在某些情况下,含有更高含量的gaba、瓜氨酸、和/或肌肽的兔皮提取物是特别有利的。因此,在如上所述的各个方面中,在某些优选的实施方案中,所述兔皮提取物是本申请发明人开发的新兔皮提取物,其与传统方法(例如cn103110663a中公开的方法)制备获得的兔皮提取物相比,每nu单位含有更高含量的γ-氨基丁酸(γ-aminobutyricacid,gaba)、瓜氨酸、和/或肌肽。在某些优选的实施方案中,每nu单位的所述兔皮提取物含有至少0.8ngγ-氨基丁酸,例如含有至少1ng,至少2ng,至少5ng,至少10ng,至少20ng,至少50ng,至少70ng,至少100ng,至少120ng,或至少150ngγ-氨基丁酸。在某些优选的实施方案中,每nu单位的兔皮提取物中含有0.8-150ngγ-氨基丁酸,例如含有0.8-1ng,1-2ng,2-5ng,5-10ng,10-20ng,20-50ng,50-70ng,70-100ng,100-120ng,或120-150ngγ-氨基丁酸。在某些优选的实施方案中,每nu单位的兔皮提取物中含有至少4ng肌肽,例如含有至少5ng,至少7ng,至少10ng,至少12ng,至少15ng,至少20ng,至少22ng,至少25ng,或至少30ng肌肽。在某些优选的实施方案中,每nu单位的兔皮提取物中含有4-30ng肌肽,例如含有4-5ng,5-7ng,7-10ng,10-12ng,12-15ng,15-20ng,20-22ng,22-25ng,或25-30ng肌肽。在某些优选的实施方案中,每nu单位的兔皮提取物中含有至少60ng瓜氨酸,例如含有至少80ng,至少100ng,至少120ng,至少150ng,至少170ng,或至少200ng瓜氨酸。在某些优选的实施方案中,每nu单位的兔皮提取物中含有60-200ng瓜氨酸,例如含有60-80ng,80-100ng,100-120ng,120-150ng,150-170ng,或170-200ng瓜氨酸。在某些优选的实施方案中,所述兔皮提取物不含有任何有机溶剂(例如苯酚)。在某些优选的实施方案中,所述兔皮提取物是通过本发明人开发的新提取方法制备获得的。特别地,使用传统工艺来制备兔皮提取物费时费力。例如,中国专利申请cn1493302a、cn103110663a、cn105163746a、cn106109498a、cn106573020a中均公开了兔皮提取物的提取方法;然而,在这些提取方法中,仅初步提取步骤的耗时就达到了6-11日,非常耗时。与此同时,在传统的兔皮提取物的提取方法中,通常需要使用有机溶剂(例如苯酚),这在提取物的安全性和可靠性以及环境安全等方面导致了潜在的风险。此外,通过传统方法(例如cn103110663a中公开的方法)制备获得的兔皮提取物仅含有低含量的γ-氨基丁酸、瓜氨酸和肌肽。因此,在本领域中,需要开发新的制备兔皮提取物的方法,以期减少提取步骤的耗时,提高提取效率;减少或避免有机溶剂(例如苯酚)的使用,从而提高所获得的兔皮提取物的安全性和可靠性;并且,提高所获得的兔皮提取物中γ-氨基丁酸、瓜氨酸、和/或肌肽的含量。有鉴于上述情况,本申请的发明人经过大量的研究后,开发了一种新的制备兔皮提取物的方法。与传统的制备兔皮提取物的方法相比,本发明制备方法的初步提取步骤(即,步骤(b))仅需12-30小时,该步骤的耗时可减少超过75%,从而大大提高了提取效率。与此同时,本发明的制备方法可以不使用任何有机溶剂(例如苯酚),从而可以确保所获得的兔皮提取物的品质更加稳定、安全、可靠(例如,所获得的兔皮提取物中不含任何有机溶剂)。此外,本申请的发明人还发现,通过本发明方法制备获得的兔皮提取物含有更高含量的γ-氨基丁酸、瓜氨酸、和/或肌肽,且因此具有更优异的技术效果(例如,具有更高的gaba活性)。因此,在某些优选的实施方案中,所述兔皮提取物是通过本发明人开发的新方法制备获得的。在某些优选的实施方案中,所述制备方法包括以下步骤:(a)提供来自接种了痘苗病毒的兔的发痘的皮肤;(b)将所述皮肤与水混合,并搅拌2-10小时,得到混合物;随后,将所述混合物的ph调整到9.5-10.5,并继续搅拌10-20小时;(c)对步骤(b)的产物进行固液分离(例如进行抽滤,过滤和/或离心),从而获得第一提取液;和(d)利用所述第一提取液来制备所述兔皮提取物。在某些优选的实施方案中,所述痘苗病毒(vacciniavirus)可以是任意株系的痘苗病毒,包括但不限于痘苗病毒利斯特(lister)株、痘苗病毒大连(dairen)株、痘苗病毒池田(ikeda)株、痘苗病毒em-63株、痘苗病毒纽约市公众卫生局(newyorkcityboardofhealth)株、痘苗病毒安卡拉(ankara)株、痘苗病毒哥本哈根(copenhagen)株、痘苗病毒天坛(tiantan)株、痘苗病毒wr株、水牛痘病毒等。在某些优选的实施方案中,所述兔可以为属于兔形目的任意的兔,包括但不限于穴兔、家兔(即,将穴兔驯化的兔)、野兔(例如日本野兔)、鼠兔、雪兔等。在某些优选的实施方案中,所述兔为家兔。在某些优选的实施方案中,所述家兔可以为任何品种(breed)的家兔,包括但不限于,日本白色种家兔和新西兰白色种(新西兰白)家兔。可通过各种方法来获得接种了痘苗病毒的兔的发痘的皮肤。在某些优选的实施方案中,通过给兔接种痘苗病毒,然后采集发痘的炎症皮肤,从而获得接种了痘苗病毒的兔的发痘的皮肤。在某些优选的实施方案中,接种了痘苗病毒的兔的发痘的皮肤是可商购获得的。在某些优选的实施方案中,在进行步骤(b)之前,对所述皮肤进行预处理。在某些优选的实施方案中,所述预处理包括,冷冻,解冻,清洗,消毒,超声波处理,破碎,或其任何组合。在某些优选的实施方案中,在进行步骤(b)之前,对所述皮肤进行清洗和/或消毒。在某些优选的实施方案中,在进行步骤(b)之前,对所述皮肤进行破碎处理。在某些优选的实施方案中,在进行步骤(b)之前,对所述皮肤进行清洗、消毒和破碎处理。在某些优选的实施方案中,在进行步骤(b)之前,对所述皮肤进行冷冻、解冻、清洗、消毒和破碎处理。在某些优选的实施方案中,所述破碎处理包括,(a)在液氮中研磨,(b)在粉碎机中粉碎,或(c)(a)和(b)的组合。在某些优选的实施方案中,在进行步骤(b)之前,对所述皮肤进行破碎处理,从而将所述皮肤破碎为颗粒物。优选地,所述颗粒物的粒径为50-500μm,例如50-75μm,75-100μm,100-150μm,150-200μm,200-500μm,或75-200μm。在某些优选的实施方案中,在进行步骤(b)之前,对所述皮肤进行破碎处理,从而将所述皮肤破碎为颗粒物,随后将所述颗粒物在30-40℃(例如30-32℃,32-35℃,35-37℃或37-40℃)下放置4-16小时(例如,4-8小时,8-12小时或12-16小时)。不受任何理论拘束,通常认为皮肤的破碎处理是有利的,因为其能够促进皮肤组织中的活性物质的提取。在某些优选的实施方案中,在步骤(b)中,所述皮肤与水的重量体积比(g/ml)为1:(1-5),例如1:(1-1.5),1:(1.5-2),1:(2-2.5),1:(2.5-3),1:(3-4)或1:(4-5)。在某些优选的实施方案中,在步骤(b)中,所述皮肤与水的重量体积比为1:2.5。在某些优选的实施方案中,在步骤(b)中,在室温下(例如15-35℃,15-20℃,20-25℃,25-30℃或30-35℃),将所述皮肤与水混合,并搅拌2-10小时(例如,2-4小时,4-6小时,6-8小时或8-10小时),从而得到混合物。在某些优选的实施方案中,在步骤(b)中,使用碱将所述混合物的ph调整到9.5-10.5,例如调整为ph10。在某些优选的实施方案中,所述碱为无机碱,例如naoh或koh。在某些优选的实施方案中,在步骤(b)中,将所述混合物的ph调整到9.5-10.5,并在升高的温度下(例如40-50℃,40-42℃,42-45℃,45-48℃或48-50℃)继续搅拌10-20小时(例如,12-14小时,14-16小时,16-18小时或18-20小时)。在本发明的制备兔皮提取物的方法中,在步骤(b)中,通过使用两阶段的提取方案,即,先用水提取,再用碱性溶液(特别是碱溶液)提取,大大缩短了该步骤所耗费的提取时间(即,可缩短至12-30小时)。相比于之前已报道的提取方法,例如cn103110663a中公开的提取方法(其初步提取步骤耗时达6-11日),本发明的制备兔皮提取物的方法的初步提取步骤(即,步骤(b))的耗时可减少超过75%,从而大大提高了提取效率。在某些优选的实施方案中,在步骤(c)中,通过过滤或抽滤对步骤(b)的产物进行固液分离;优选地,以50-500μm(例如50-75μm,75-100μm,100-150μm,150-200μm,200-500μm,或75-200μm)的过滤孔径,对步骤(b)的产物过滤或抽滤。在某些优选的实施方案中,本发明的制备方法的步骤(d)包括以下步骤:(d1)将所述第一提取液的ph调整到4.0-5.0,并进行加热处理,随后,进行固液分离(例如进行抽滤,过滤和/或离心),从而获得第二提取液;(d2)将所述第二提取液的ph调整到9.0-10.0,并进行加热处理,然后,进行固液分离(例如进行抽滤,过滤和/或离心),从而获得第三提取液;(d3)将所述第三提取液的ph调整到3.5-5.5,并与吸附剂接触,使第三提取液中的活性物质吸附于吸附剂上;(d4)对步骤(d3)的产物进行固液分离(例如进行抽滤,过滤和/或离心),收集吸附剂;和(d5)用ph为9.0-11.0的提取溶剂提取吸附剂上所吸附的活性物质,从而获得第四提取液,即为兔皮提取物。在某些优选的实施方案中,在步骤(d1)中,使用酸将所述第一提取液的ph调整到4.0-5.0,例如调整为ph4.5。在某些优选的实施方案中,所述酸为无机酸,例如hcl。在某些优选的实施方案中,在步骤(d1)中,将所述第一提取液的ph调整到4.0-5.0,并加热至85-105℃(例如85-90℃,90-95℃,95-100℃或100-105℃)。在某些优选的实施方案中,在步骤(d1)中,所述加热处理进行0.5-1.5小时,例如0.5-1小时或1-1.5小时。不受任何理论拘束,通常认为,酸性条件下的热处理可帮助除去提取液中的部分杂质蛋白。在某些优选的实施方案中,在步骤(d1)中,通过离心和随后的过滤或抽滤来进行固液分离,从而获得第二提取液。在某些优选的实施方案中,在步骤(d2)中,使用碱将所述第二提取液的ph调整到9.0-10.0,例如调整为ph9.5。在某些优选的实施方案中,所述碱为无机碱,例如naoh或koh。在某些优选的实施方案中,在步骤(d2)中,将所述第二提取液的ph调整到9.0-10.0,并加热至85-105℃(例如85-90℃,90-95℃,95-100℃或100-105℃)。在某些优选的实施方案中,在步骤(d2)中,所述加热处理进行0.25-1.5小时,例如0.25-0.5小时,0.5-1小时或1-1.5小时。在某些优选的实施方案中,在步骤(d2)中,在对所述第二提取液进行加热处理后,将其搅拌10-20小时(例如,10-12小时,12-14小时,14-16小时,16-18小时或18-20小时),然后再进行固液分离,从而获得第三提取液。不受任何理论拘束,通常认为,碱性条件下的加热处理以及随后的搅拌处理可帮助除去提取液中的部分杂质蛋白。在某些优选的实施方案中,在步骤(d2)中,通过过滤或抽滤(例如,使用孔径为0.22-0.65μm(例如0.45μm)的滤膜)来进行固液分离,从而获得第三提取液。在某些优选的实施方案中,在步骤(d3)中,使用酸将所述第三提取液的ph调整到3.5-5.5,例如3.5-4.0,4.0-4.5,4.5-5.0或5.0-5.5。在某些优选的实施方案中,所述酸为无机酸,例如hcl。在某些优选的实施方案中,在步骤(d3)中,所述吸附剂选自活性炭,高岭土,以及其任何组合。在某些优选的实施方案中,步骤(d3)中所使用的吸附剂与步骤(b)中所使用的皮肤的重量比(g/g)为1:(10-50),例如1:(10-15),1:(15-20),1:(20-25),1:(25-30),1:(30-40)或1:(40-50)。在某些优选的实施方案中,在步骤(d3)中,可以在与吸附剂接触之前、同时或之后,将所述第三提取液的ph调整到3.5-5.5。在某些优选的实施方案中,在步骤(d3)中,将所述第三提取液的ph调整到3.5-5.5,并与吸附剂接触(例如混合),随后在室温下(例如15-35℃,15-20℃,20-25℃,25-30℃或30-35℃)搅拌1-4小时,例如1-2小时,2-3小时,或3-4小时。在某些优选的实施方案中,在步骤(d3)中,将所述吸附剂填充于吸附柱中,然后与ph值经调整的第三提取液接触,从而吸附第三提取液中的活性物质。不受任何理论拘束,通常认为,适当的搅拌和/或填充柱的使用可促进第三提取液中的活性物质吸附于吸附剂上。在某些优选的实施方案中,在步骤(d4)中,通过过滤或抽滤(例如,使用滤纸)来对步骤(d3)的产物进行固液分离,从而获得吸附了活性物质的吸附剂。在某些优选的实施方案中,步骤(d5)包括,将所述吸附剂与ph为9.0-11.0的提取溶剂接触(例如混合),然后进行固液分离(例如进行抽滤,过滤和/或离心),从而获得第四提取液。在某些优选的实施方案中,在步骤(d5)中,所述提取溶剂为碱性溶液(例如,碱性的水溶液,甲醇溶液,乙醇溶液,异丙醇溶液,或其任何组合;优选,碱的溶液)。在某些优选的实施方案中,在步骤(d5)中,使用ph为9.0-11.0(例如ph为9.0-9.5,9.5-10.0,10.0-10.5或10.5-11.0)的碱性溶液(例如,碱性的水溶液,甲醇溶液,乙醇溶液,异丙醇溶液,或其任何组合;优选,碱的溶液)来提取吸附剂上吸附的活性物质。在某些优选的实施方案中,所述碱的溶液为无机碱的水溶液,例如naoh或koh的水溶液。在某些优选的实施方案中,步骤(d3)中所使用的吸附剂与步骤(d5)中所使用的提取溶剂的重量体积比(g/ml)为1:(10-100),例如1:(10-20),1:(20-30),1:(30-40),1:(40-50),1:(50-60),1:(60-70),1:(70-80),1:(80-90)或1:(90-100)。在某些优选的实施方案中,在步骤(d5)中,在加热和/或搅拌的条件下,用所述提取溶剂提取吸附剂上吸附的活性物质。不受任何理论拘束,通常认为,适当的搅拌和/或加热处理可促进活性物质从吸附剂上洗脱。在某些优选的实施方案中,在步骤(d5)中,在40-50℃的温度下(例如40-42℃,42-45℃,45-48℃或48-50℃),并且在搅拌的条件下(例如搅拌1-4小时,例如1-2小时,2-3小时,或3-4小时),用所述提取溶剂提取吸附剂上吸附的活性物质。在某些优选的实施方案中,在步骤(d5)中,用所述提取溶剂提取吸附剂上吸附的活性物质一次或多次,例如至少2次;然后合并每一次提取获得的提取液,从而获得第四提取液。易于理解,用提取溶剂提取吸附剂上吸附的活性物质时,每一次提取所使用的提取溶剂可以是相同的或者不同的。例如,在某些优选的实施方案中,在步骤(d5)中,先用ph为9.0-10.0的提取溶剂进行第一次提取,然后再用ph为10.0-11.0的提取溶剂进行第二次提取,然后合并两次提取获得的提取液,从而获得第四提取液。在某些优选的实施方案中,所述制备方法在步骤(d)之后还包括选自下列的一个或多个步骤:(e1)对所述第四提取液进行超滤;(e2)对所述第四提取液进行加热处理;(e3)将所述第四提取液的ph调整到6.5-7.5;(e4)对所述第四提取液进行稀释或浓缩;(e5)对所述第四提取液进行灭菌处理;和(e6)对所述第四提取液进行冻干处理。在某些优选的实施方案中,在步骤(e1)中,超滤所采用的分子量界限为5-40kd,例如5-10kd,10-15kd,15-20kd,20-30kd或30-40kd。在某些优选的实施方案中,在步骤(e2)中,将所述第四提取液加热至60-100℃,例如60-70℃,70-80℃,80-90℃或90-100℃,且任选地,静置10-18小时,例如10-12小时,12-14小时,14-16小时或16-18小时。在某些优选的实施方案中,在步骤(e3)中,使用酸将所述第四提取液的ph调整到6.5-7.5,例如6.5-7.0或7.0-7.5。在某些优选的实施方案中,所述酸为无机酸,例如hcl。在某些优选的实施方案中,在步骤(e4)中,使用注射用水,生理盐水或生理缓冲液对所述第四提取液进行稀释。在某些优选的实施方案中,在步骤(e4)中,将所述第四提取液浓缩至期望的浓度。在某些优选的实施方案中,在步骤(e5)中,使用高压灭菌、超高温灭菌(uht)、巴氏灭菌、过滤灭菌或其任何组合,对所述第四提取液进行灭菌处理。在某些优选的实施方案中,所述制备方法在步骤(d)之后还包括步骤(e1)-(e6)中的1个、2个、3个、4个、5个或6个步骤。在某些优选的实施方案中,所述制备方法在步骤(d4)之后还包括步骤(e1)-(e5)。在本发明的制备方法中,在步骤(d)之后,可以根据实际需要,以任何期望的顺序来进行步骤(e1)-(e6)中的1个、2个、3个、4个、5个或6个步骤。在某些优选的实施方案中,在本发明的制备方法的步骤(b)中,不使用苯酚。在某些优选的实施方案中,在本发明的制备方法的步骤(b)中,不使用有机溶剂。在某些优选的实施方案中,根据本发明的制备方法不使用苯酚。在某些优选的实施方案中,根据本发明的制备方法不使用有机溶剂。一般认为,苯酚的使用可实现两方面的技术效果:一方面,苯酚可用作杀菌剂起到灭菌消毒的作用;另一方面,苯酚作为有机溶剂,可促进活性物质的提取。然而,在某些情况下,在活性物质的提取或者药物的制备过程中,期望尽可能地避免使用任何有机溶剂(例如苯酚),从而避免此类有机溶剂(例如苯酚)在终产物中的残留,影响后续的应用(例如临床应用)。在本发明的某些优选实施方案中,本发明的制备方法(特别是步骤(b))不需要使用任何有机溶剂(例如苯酚),从而所获得的兔皮提取物中不含任何有机溶剂。因此,本发明的制备方法以及由此所获得的兔皮提取物是特别有利的。因此,在第五方面,本申请提供了如上文所描述的用于制备兔皮提取物的方法。在第六方面,本申请提供了一种兔皮提取物,其通过如上文所描述的制备方法制得。如上文所描述的,本发明的优选制备方法可以不使用任何有机溶剂。相应地,通过此类方法所制得的兔皮提取将完全不含任何有机溶剂,这在某些情况下是特别有利的。并且,与传统方法(例如cn103110663a中公开的方法)制备获得的兔皮提取物相比,通过如上文所描述的制备方法制得的兔皮提取物每nu单位含有更高含量的γ-氨基丁酸、瓜氨酸、和/或肌肽。通过本发明的制备方法获得的兔皮提取物是独特的,具有更好的应用前景。在第七方面,本申请提供了一种组合物,其包含如上所述的兔皮提取物(特别是,通过本发明的制备方法获得的兔皮提取物)。如上文所描述的,通过本发明制备方法获得的兔皮提取物含有更高含量的γ-氨基丁酸、瓜氨酸、和/或肌肽,具有特别显著的、良好的促进细胞增殖的作用。因此,可以将本发明的兔皮提取物添加到细胞培养基中,用于促进细胞增殖。因此,在某些优选的实施方案中,所述组合物为细胞培养基,其包含通过本发明的制备方法获得的兔皮提取物。在某些优选的实施方案中,所述细胞培养基为添加了根据本发明的兔皮提取物的dmem培养基、f12培养基或dmem/f12培养基。dmem培养基、f12培养基或dmem/f12培养基可通过常规方法配制获得,或者也可以商购获得。在某些优选的实施方案中,所述细胞培养基还包含有额外的试剂,例如血清(例如胎牛血清),细胞因子,b27细胞培养添加剂(b27),或其任何组合。在某些优选的实施方案中,所述细胞因子包括但不限于,表皮细胞生长因子(egf),白血病抑制因子(lif),成纤维细胞生长因子(fgf;包括但不限于afgf和bfgf),或其任何组合。另外,之前已报道,利用接种了痘苗病毒的兔的发痘的皮肤而制备的兔皮提取物可用于多种疾病或病症的治疗。此类疾病或病症包括但不限于,腰痛症、颈肩腕综合征、症状性神经痛、伴随皮肤病(例如湿疹、皮肤炎、荨麻疹)的搔痒、过敏性鼻炎、亚急性视神经脊髓病后遗症的冷感-知觉异常-疼痛、带状疱疹后神经痛、肩周炎、变形性关节炎等(参见例如cn103110663a)。此外,还发现,所述兔皮提取物可用于治疗中枢神经系统疾病(例如创伤性脑损伤(tbi)和脊髓损伤(sci)),可用于促进脊髓损伤后的运动功能恢复,或用于抑制胶质瘢痕形成(特别是脊髓损伤后的胶质瘢痕形成)。因此,可以将本发明的兔皮提取物用于制备治疗所述疾病或病症的药物或药物组合物。因此,在某些优选的实施方案中,所述组合物为药物组合物,其还包含有药学上可接受的载体或赋形剂。在某些优选的实施方案中,所述药物组合物为含有根据本发明的兔皮提取物的注射剂。在某些优选的实施方案中,所述药物组合物为含有根据本发明的兔皮提取物的片剂。在某些优选的实施方案中,所述药物组合物,为适用于全身静脉给药的药物剂型,例如注射液或冻干粉剂。如上文所论述的,本发明的兔皮提取物能够用于多种疾病或病症的治疗。因此,在第八方面,还提供了本发明的兔皮提取物在制备药物中的用途,所述药物用于治疗腰痛症、颈肩腕综合征、症状性神经痛、伴随皮肤病(例如湿疹、皮肤炎、荨麻疹)的搔痒、过敏性鼻炎、亚急性视神经脊髓病后遗症的冷感-知觉异常-疼痛、带状疱疹后神经痛、肩周炎、变形性关节炎或中枢神经系统疾病,用于促进脊髓损伤后的运动功能恢复,或用于抑制胶质瘢痕形成。在某些优选的实施方案中,所述中枢神经系统疾病选自创伤性脑损伤(tbi)和脊髓损伤(sci)。在某些优选的实施方案中,所述药物用于促进脊髓损伤后的运动功能恢复。在某些优选的实施方案中,所述药物用于抑制胶质瘢痕形成,特别是脊髓损伤后的胶质瘢痕形成。在某些优选的实施方案中,所述脊髓损伤为由(例如车祸或坠落等外伤所致的)脊柱骨折或脱位引起的脊髓损伤。在某些优选的实施方案中,所述胶质瘢痕形成是由脊髓损伤后胶质细胞增生导致的。在某些优选的实施方案中,所述药物还包含药学上可接受的载体或赋形剂。在某些优选的实施方案中,所述药物为适用于全身静脉给药的药物剂型,例如注射液或冻干粉剂。发明的有益效果在本申请中,发明人首次发现,从接种了痘苗病毒的兔的发痘的皮肤提取的兔皮提取物能够促进多种细胞(例如少突胶质细胞、间充质干细胞(例如骨髓间充质干细胞)和神经干细胞)的增殖。由此,本申请提供了一种体外培养细胞或体外促进细胞增殖的方法。本发明的方法可以实现多种细胞(例如少突胶质细胞、间充质干细胞(例如骨髓间充质干细胞)和神经干细胞)的体外快速增殖,为此类细胞的临床应用奠定了基础。进一步,本申请的发明人开发了一种新的兔皮提取物。与传统方法(例如cn103110663a中公开的方法)制备获得的兔皮提取物相比,本发明的兔皮提取物含有更高含量的γ-氨基丁酸、瓜氨酸、和/或肌肽,且因此具有更优异的技术效果(例如,具有更高的gaba活性)。此外,本发明的兔皮提取物能够实现完全不含有有机溶剂(例如苯酚),从而具有更加优良的有效性和安全性,具有更好的应用前景。更进一步,本申请的发明人开发了一种新的制备兔皮提取物的方法。与现有技术相比,本发明的制备兔皮提取物的方法具有以下有益效果:在本发明制备方法的初步提取步骤(即,步骤(b))中,通过使用两阶段的提取方案,即,先用水提取,再用碱性溶液(特别是碱溶液)提取,大大缩短了该初步提取步骤所耗费的提取时间(即,可缩短至12-30小时)。相比于之前已报道的提取方法,例如cn103110663a中公开的提取方法(其初步提取步骤耗时达6-11日),本发明制备方法的初步提取步骤(即,步骤(b))的耗时可减少超过75%,从而大大提高了提取效率。此外,在某些优选的情况下,与现有技术相比,本发明的制备方法(特别是步骤(b))不需要使用任何有机溶剂(例如苯酚),从而可以确保所获得的兔皮提取物的品质更加稳定、安全、可靠(例如,所获得的兔皮提取物中不含任何有机溶剂)。因此,本发明的制备方法以及由此所获得的兔皮提取物是特别有利的。另外,利用本发明制备方法获得的兔皮提取物含有更高含量的γ-氨基丁酸、瓜氨酸、和/或肌肽,且因此具有更优异的技术效果。另外,本申请的发明人还发现,本发明的兔皮提取物能够抑制脊髓损伤后的胶质瘢痕形成,并显著提高脊髓损伤动物的bbb评分。本发明的兔皮提取物对于脊髓损伤后的运动功能恢复具有显著的促进作用。下面将结合附图和实施例对本发明的实施方案进行详细描述,但是本领域技术人员将理解,下列附图和实施例仅用于说明本发明,而不是对本发明的范围的限定。根据附图和优选实施方案的下列详细描述,本发明的各种目的和有利方面对于本领域技术人员来说将变得显然。附图说明图1显示了实施例1中制得的兔皮提取物的hplc检测结果(横坐标:时间/min;纵坐标:吸光度/mau)。图2显示了实施例1中制得的兔皮提取物的lv吸收光谱的检测结果(横坐标:波长/nm;纵坐标:吸光度)。图3a显示了实施例2中用抗o4抗体对培养的细胞进行免疫荧光检测的结果(荧光显微照片)。结果显示,所培养的细胞为抗o4抗体检测阳性的,为少突胶质细胞。图3b显示了实施例2中用dapi染色法对培养的细胞进行检测的结果(荧光显微照片),其中,示出了被染色的细胞核。图3c为图3a和图3b的合并图像。结果显示,抗o4抗体检测阳性的细胞和dapi染色的细胞的比例为1:1。图4a-4c分别显示了在开始培养后的第2天(图4a)、第4天(图4b)、第6天(图4c),培养于含有不同浓度的兔皮提取物的细胞培养基中的各组少突胶质细胞的增殖情况。图5a-5b分别显示了在开始培养后的第2天(图5a)和第4天(图5b),培养于含有不同浓度的兔皮提取物的细胞培养基中的各组骨髓间充质干细胞的增殖情况。图6a显示了实施例4中所培养的细胞的光学显微照片。结果显示,所培养的细胞表现出神经干细胞特有的透亮、立体感强、周围有放射状毛刺的悬浮的细胞球形态。图6b显示了实施例4中用抗nestin抗体对培养的细胞进行免疫荧光检测的结果(荧光显微照片)。结果显示,所培养的细胞为抗nestin抗体检测阳性的,为神经干细胞。图6c显示了实施例4中用dapi染色法对培养的细胞进行检测的结果(荧光显微照片),其中,示出了被染色的细胞核。图6d为图6b和图6c的合并图像。结果显示,抗nestin抗体检测阳性的细胞和dapi染色的细胞的比例为1:1。图7a-7c分别显示了在开始培养后的第1天(图7a)、第2天(图7b)、第3天(图7c),培养于含有不同浓度的兔皮提取物的细胞培养基中的各组神经干细胞的增殖情况。图8a-8d分别显示了在gaba(10μm)、ntp注射剂、ntp注射剂+荷包牡丹碱(bicuculline,10μm)、本发明的兔皮提取物、或本发明的兔皮提取物+荷包牡丹碱(10μm)的存在下,大鼠海马神经元细胞的gaba电流。图8a-8b分别显示了,细胞样品1(图8a)和细胞样品2(图8b)响应gaba、本发明的兔皮提取物或本发明的兔皮提取物+荷包牡丹碱的gaba电流。图8c-8d分别显示了,细胞样品1(图8c)和细胞样品2(图8d)响应gaba、ntp注射剂或ntp注射剂+荷包牡丹碱的gaba电流。图9显示了,脊髓损伤大鼠接受生理盐水或指定剂量的兔皮提取物治疗后的运动功能恢复情况(即,bbb评分)。图10显示了,脊髓损伤大鼠接受生理盐水或指定剂量的兔皮提取物治疗后的胶质瘢痕形成情况(即,gfap免疫染色)。具体实施方式现参照下列意在举例说明本发明(而非限定本发明)的实施例来描述本发明。本领域技术人员知晓,实施例以举例方式描述本发明,且不意欲限制本发明所要求保护的范围。下述实施例中使用的实验方法,如无特殊说明,均为常规方法。下述实施例中所使用的试剂和材料等,如无特殊说明,均为市售购买的产品。其中,所使用的部分试剂和试剂盒的来源如下:dmem/f12细胞培养基购自gibco公司;cck-8试剂盒购自贝博公司;b27购自invitrogen公司;抗o4抗体、抗nestin抗体和抗βⅲ-微管蛋白抗体均购自sigma-aldrich公司;抗gfap抗体和抗cnpase抗体均购自abcam公司;和bfgf、egf和lif均购自peprotech公司。实施例1.兔皮提取物的制备采集皮内接种痘苗病毒利斯特(lister)株的家兔(新西兰白色种家兔,体重大于2.5kg)的发痘的兔皮,将其预先冷冻于-20℃的冰柜中,备用。(a)从-20℃冰柜中取出冻结的兔皮,称取80g,先切成2-3厘米的小块,边切边放置于液氮中。待全部切完后,将兔皮放于粉碎机中,粉碎为颗粒物(75-200μm)。将粉碎之后的兔皮放置于烧杯中,并加保鲜膜封口,等待解冻至室温(每隔半小时,测量一次;一般情况下,在液氮处理之后,兔皮可在2.5-3小时达到室温)。随后,将兔皮放置于恒温培养箱中,于37±2℃下放置12小时。(b)将(a)中得到的产物和200ml的超纯水放入烧杯内,在室温下搅拌6小时。(c)将(b)中得到的混合物转移至圆底烧瓶中,边搅拌边用5mol/lnaoh调整ph至10.0±0.5,然后在45℃下提取12-18小时(过夜)。随后,利用连接真空泵的抽滤装置,使用80目滤布,对圆底烧瓶中的混合物进行抽滤,并将滤出液体(第一提取液)转移至新的圆底烧瓶中。(d)将(c)中得到的滤出液体(第一提取液)边搅拌边用5mol/lhcl将ph调整为4.5±0.5,并在95℃下加热60分钟。加热后,将整个混合物冷却至50℃以下,10000rpm离心1小时,过滤,留取上清(第二提取液)至新的圆底烧瓶中。(e)将(d)中得到的上清(第二提取液)边搅拌边用5mol/lnaoh将ph调整为9.5±0.5,并在95℃下加热30分钟,然后冷却并搅拌过夜(12-18小时)。然后,用连接真空泵的抽滤装置,使用0.45μm滤膜对整个混合物进行过滤,将滤出液体(第三提取液)转移至新的烧杯中。(f)在(e)中得到的滤出液体(第三提取液)中加入4g活性炭,边搅拌边用5mol/lhcl将ph调整为4.5±0.5。在室温下搅拌2小时后,用滤纸加压过滤,滤取活性炭,滤液废弃。然后,在吸附了有效成分的活性炭中加入超纯水200ml,边搅拌边用5mol/lnaoh将ph调整为10.0±0.5。在45℃下搅拌2小时后,加压过滤(滤纸、0.22μm滤膜),将滤液(第四提取液)移送至蓝盖瓶中。所获得的第四提取液,即为痘苗病毒免疫的家兔的兔皮提取物。(g)将(f)中得到的滤液(第四提取液)加入超滤机中,用分子量界限10kd的过滤膜进行超滤,然后将滤液移送至新的蓝盖瓶中,以进一步除去不想要的杂质。加热蓝盖瓶,使得滤液加热至80℃,并保存一晚(10~18小时),之后将滤液(第五提取液)冷却至室温。将得到的滤液(第五提取液)用于后续的实验中。(h)测定(g)中得到的滤液(第五提取液)的uv吸收值,然后通过添加注射用水,将其在270nm处的吸光度调整为0.4-0.5。在此情况下,兔皮提取物的有效成分的浓度为约1.2nu/ml。然后用5mol/lhcl将ph调整为7.0±0.5。(i)将(h)中得到的产物进行抽样检测,包括:(1)对其进行hplc检测以确认5种类型的核酸碱基的含量;(2)测定其lv吸收光谱的特征;(3)测定各种氨基酸的含量;和(4)进行lc-ms/ms检测。(j)将(h)中得到的产物在121℃下用高压灭菌器进行20-30分钟的湿热灭菌,保存,备用。(1)hplc检测根据制造商说明书,采用高效液相色谱系统(thermofisherscientific,ultimate3000),采用以下条件对(h)中得到的产物进行hplc检测:进样量:10μg;波长:260.0nm;流速:0.6ml/min;运行时间:20min;稀释因子:1.0。hplc的检测结果示于表1和图1中。表1.痘苗病毒免疫的家兔的兔皮提取物的hplc检测结果表1和图1的hplc检测结果显示,所制备的兔皮提取物中,5种类型的核酸碱基的含量符合相关标准。(2)lv吸收光谱的检测根据制造商说明书,采用紫外分光光度计(shimadzu,uv1800),对(h)中得到的产物进行lv吸收光谱的检测。lv吸收光谱的检测结果示于表2和图2中。表2.痘苗病毒免疫的家兔的兔皮提取物的lv吸收光谱检测结果表2和图2的hplc检测结果显示,所制备的兔皮提取物的最大吸收值在268-272nm的范围内。(3)氨基酸含量的检测根据制造商说明书,采用离子色谱仪(dionex,ics-3000),对(h)中得到的产物进行氨基酸含量的检测。氨基酸含量的检测结果示于表3中。表3.痘苗病毒免疫的家兔的兔皮提取物的氨基酸含量检测结果种类含量(mg/kg)精氨酸39.043赖氨酸0.375丙氨酸7.393苏氨酸3.646甘氨酸4.527缬氨酸2.370丝氨酸7.586脯氨酸3.472异亮氨酸11.723亮氨酸22.798蛋氨酸3.293组氨酸1.323苯丙氨酸9.979谷氨酸1.568天冬氨酸1.950胱氨酸0.314酪氨酸3.728表3的检测结果显示,所制备的兔皮提取物中含有至少13种氨基酸。(4)lc-ms/ms检测另外,还使lc-ms/ms方法对(h)中得到的产物进行检测。在检测前,将(h)中获得的兔皮提取物的浓度(效价)调整为1.2nu/ml,并且将市购获得的ntp注射剂(神经妥乐平/neur0tr0pin,1.2nu/ml)用作对照。所使用的仪器和检测条件如下:液相色谱(lc)仪器:shimazdu20axr;色谱柱:phexnomonexbi-phenyl2.6um,3.0x50mm;流动相a:水(含有0.1%甲酸);流动相b:乙腈(含有0.1%甲酸);流速:0.5ml/min;进样体积:3ul;柱温:35℃;洗脱程序:二级质谱(ms/ms)仪器:qtrap5500(absciex),esi源ms/ms条件:化合物检测条件:定量结果如下:分析物所制备的兔皮提取物,ng/mlntp注射剂,ng/ml瓜氨酸20439.5肌肽31.12.54gaba1790.463左旋肉碱111126上述检测结果显示,本实施例所制备的兔皮提取物每nu单位含有约170ng瓜氨酸,约25.9ng肌肽,约149nggaba,远远高于市售的ntp注射剂;其中,gaba的含量提高了约380倍,肌肽的含量提高了约12倍,瓜氨酸的含量提高了约5倍。实施例2.兔皮提取物促进少突胶质细胞增殖的作用的评估本实施例应用少突胶质细胞,研究实施例1制得的兔皮提取物对其促进增殖的作用。从新生48h内的sd雌性大鼠的大脑皮层内提取少突胶质细胞。在传代5次后,在显微镜下观察少突胶质细胞的形态。随后,将传代5次后的细胞在多聚赖氨酸包被的孔板中铺板。铺板后第1天,使用少突胶质细胞特异性抗体(抗o4抗体)和dapi染色法对培养的细胞进行鉴定和表征。实验结果如图3a-3c所示。图3a显示了用抗o4抗体对培养的细胞进行免疫荧光检测的结果(荧光显微照片)。结果显示,所培养的细胞为抗o4抗体检测阳性的,为少突胶质细胞。图3b显示了用dapi染色法对培养的细胞进行检测的结果(荧光显微照片),其中,示出了被染色的细胞核。图3c为图3a和图3b的合并图像。结果显示,抗o4抗体检测阳性的细胞和dapi染色的细胞的比例为1:1。这表明,所培养的细胞是少突胶质细胞,且细胞纯度为100%。将少突胶质细胞按照每孔5000个细胞的密度铺在96孔板中,设置7个实验组和1个对照组,其中:7个实验组采用的细胞培养基是dmem/f12培养基,其中分别添加浓缩的实施例1制备的兔皮提取物,使其在培养基中的终浓度分别为0.2nu/ml、0.5nu/ml、1nu/ml、1.5nu/ml、2nu/ml、2.5nu/ml、3nu/ml;1个对照组采用的细胞培养基是dmem/f12培养基,其中添加有pbs。将8组细胞在37℃、5%的co2培养箱内培养。在开始培养后的第2、4、6天,根据试剂盒说明书,使用cck-8试剂盒在450nm条件下对96孔板中培养的细胞进行增殖检测。实验结果如图4a-4c所示。图4a-4c分别显示了在开始培养后的第2天(图4a)、第4天(图4b)、第6天(图4c),培养于含有不同浓度的兔皮提取物的细胞培养基中的各组少突胶质细胞的增殖情况(使用cck-8试剂盒在450nm处测得的吸光度)。结果显示,所制备的兔皮提取物对少突胶质细胞的促增殖作用呈浓度和时间依赖性。此外,结果还显示,所制备的兔皮提取物促进少突胶质细胞增殖的浓度可以为例如,在细胞培养基中0.5-3nu/ml。这些结果表明,所制备的兔皮提取物能够促进少突胶质细胞的增殖。例如,可以采用包含浓度为1.5nu/ml的兔皮提取物的细胞培养基培养少突胶质细胞,从而促进所述细胞的增殖。实施例3.兔皮提取物促进骨髓间充质干细胞增殖的作用的评估本实施例应用大鼠股骨内骨髓间充质干细胞,研究实施例1制得的兔皮提取物对其促进增殖的作用。从新生48h内的wistar雌性大鼠股骨内提取骨髓间充质干细胞。在传代5次后,将骨髓间充质干细胞按照每孔5000个细胞的密度铺在96孔板中,设置7个实验组和1个对照组,其中:7个实验组采用的细胞培养基是dmem/f12培养基,其中分别添加浓缩的实施例1制备的兔皮提取物,使其在培养基中的终浓度分别为0.2nu/ml、0.5nu/ml、1nu/ml、1.5nu/ml、2nu/ml、2.5nu/ml、3nu/ml;1个对照组采用的细胞培养基是dmem/f12培养基,其中添加有pbs。将8组细胞在37℃、5%的co2培养箱内培养。在开始培养后的第2和4天,根据试剂盒说明书,使用cck-8试剂盒在450nm条件下对96孔板中培养的细胞进行增殖检测。实验结果如图5a-5b所示。图5a-5b分别显示了在开始培养后的第2天(图5a)和第4天(图5b),培养于含有不同浓度的兔皮提取物的细胞培养基中的各组骨髓间充质干细胞的增殖情况(使用cck-8试剂盒在450nm处测得的吸光度)。结果显示,所制备的兔皮提取物对骨髓间充质干细胞的促增殖作用呈浓度和时间依赖性。此外,结果还显示,所制备的兔皮提取物促进骨髓间充质干细胞增殖的浓度可以为例如,在细胞培养基中0.2-3nu/ml。这些结果表明,所制备的兔皮提取物能够促进骨髓间充质干细胞的增殖。例如,可以采用包含浓度为2nu/ml的兔皮提取物的细胞培养基培养骨髓间充质干细胞,从而促进所述细胞的增殖。实施例4.兔皮提取物促进神经干细胞增殖的作用的评估本实施例应用神经干细胞,研究实施例1制得的兔皮提取物对其促进增殖的作用。从孕14天的sd大鼠胎鼠的大脑皮层内提取神经干细胞,于5%co2下、dmem/f12细胞培养基(添加有bfgf、egf、lif及b27)中培养。在传代3次后,在显微镜下观察细胞的形态。随后,将传代3次后的细胞在多聚赖氨酸包被的孔板中铺板。铺板后第1天,使用神经干细胞特异性抗体(抗nestin抗体)和dapi染色法对培养的细胞进行鉴定和表征。实验结果如图6a-6d所示。图6a显示了所培养的细胞的光学显微照片。结果显示,所培养的细胞表现出神经干细胞特有的透亮、立体感强、周围有放射状毛刺的悬浮的细胞球形态。图6b显示了用抗nestin抗体对培养的细胞进行免疫荧光检测的结果(荧光显微照片)。结果显示,所培养的细胞为抗nestin抗体检测阳性的,为神经干细胞。图6c显示了用dapi染色法对培养的细胞进行检测的结果(荧光显微照片),其中,示出了被染色的细胞核。图6d为图6b和图6c的合并图像。结果显示,抗nestin抗体检测阳性的细胞和dapi染色的细胞的比例为1:1。这表明,所培养的细胞是神经干细胞,且细胞纯度为100%。将神经干细胞按照每孔20000个细胞的密度铺在96孔板中,设置3个实验组和1个对照组,其中:3个实验组采用的细胞培养基是dmem/f12培养基(已添加了bfgf、egf、lif及b27),其中分别添加浓缩的实施例1制备的兔皮提取物,使其在培养基中的终浓度分别为0.5nu/ml、1nu/ml、2nu/ml;1个对照组采用的细胞培养基是dmem/f12培养基(已添加了bfgf、egf、lif及b27),其中添加有pbs。将4组细胞在37℃、5%的co2培养箱内培养。在开始培养后的第1、2、3天,根据试剂盒说明书,使用cck-8试剂盒在450nm条件下对96孔板中培养的细胞进行增殖检测。实验结果如图7a-7c所示。图7a-7c分别显示了在开始培养后的第1天(图7a)、第2天(图7b)、第3天(图7c),培养于含有不同浓度的兔皮提取物的细胞培养基中的各组神经干细胞的增殖情况(细胞相对存活)。结果显示,所制备的兔皮提取物对神经干细胞的促增殖作用呈浓度和时间依赖性。此外,结果还显示,所制备的兔皮提取物促进神经干细胞增殖的浓度可以为例如,在细胞培养基中0.5-2nu/ml。这些结果表明,所制备的兔皮提取物能够促进神经干细胞的增殖。例如,可以采用包含浓度为2nu/ml的兔皮提取物的细胞培养基培养神经干细胞,从而促进所述细胞的增殖。此外,结果还显示,在2nu/ml的兔皮提取物的存在下,所培养的神经干细胞依然显示出悬浮、透亮、立体感强、周围有放射状毛刺的悬浮的细胞球形态,保持着神经干细胞的特征。实施例5.兔皮提取物对sd大鼠神经元细胞的作用的评估在本实施例中,利用膜片钳技术,评估了实施例1制备的兔皮提取物对sd大鼠原代神经元细胞的作用,特别是对所述细胞的gaba信号通路(gaba受体)的影响。所使用的仪器为epc10放大器系统(heka公司);所测试的样品为实施例1制备的兔皮提取物(1.2nu/ml),以及市购获得的ntp注射剂(1.2nu/ml)。1.材料和方法1.1实验所用试剂pbs/hepes/glucose缓冲液:6g葡萄糖,7.38ghepes,加入pbs1000ml(takara,t900),使用naoh调节ph=7.38。过滤除菌。细胞贴壁培养基:50mlfbs(gibco,10099-141),0.55ml谷氨酸(sigma,g1251-100g),5ml青霉素/链霉素100x(hyclone,sv30010),加入到500mldmem培养基中(gibco,10313021)。neurobasal培养基:10mlb27supplement(gibco,17504044),1.25mll-谷氨酰胺200mm(sigma,59202c-100ml),5ml青霉素/链霉素100x(hyclone,sv30010),加入到500mlneurobasalmedium(gibco,21103049)中。1.2实验所用仪器仪器和材料供应商型号膜片钳放大器heka(germany)epc-10quattro数据获取软件heka(germany)patchmaster拉制仪器sutterinstruments(usa)p-97分析软件moleculardevice(usa)clampfit二氧化碳细胞培养箱esco(singapore)ccl-170b-8倒置显微镜moticae31e微操纵器mciinstruments86pw420600移液器eppendorf(germany)eppendorfreferenceseries1.3大鼠海马神经细胞的分离和培养1)用多聚赖氨酸处理培养板,以覆盖培养板底部为宜,30min后吸取多余多聚赖氨酸,置37度co2培养箱过夜。2)实验前用pbs洗培养板2-3次,晾干备用。3)分装pbs(含糖)到50ml和15ml离心管中各6管,置于-20度冻30min,使其成为冰水混合物。4)将实验用手术器材分两部分放入异丙醇中浸泡1h。其中一部分:精细镊两把,虹膜剪刀一把,弯剪和眼科剪刀各1把,药匙一把,用于剥离脑组织;另一部分:神经镊2把,大剪刀1把,眼科剪刀一把,用于剥离胚胎鼠。5)取碎冰两盒(冰盒下置冰袋),将实验台打扫干净,将冰袋置实验板上,喷酒精尽量做到无菌。6)准备无菌35mm皿(内置滤膜)3-4个,1ml移液枪和无菌枪头。7)用75%乙醇对新生的sd大鼠乳鼠消毒,迅速断头。8)把剥离出的大脑放入冰的pbs中,等待2min。9)把脑取出放入含有冰pbs的平皿中,底部放一张滤纸,便于固定脑组织,使其不在平皿中滑动。10)剥开头骨,暴露并翻开大脑皮层,找到丘脑,将表面上的膜清理干净。11)将丘脑取出,放置于10ml含冰pbs离心管中。12)将游离的丘脑放入冰的pbs中洗1-2次。13)吸干pbs,加入typsin,放37度培养箱中温育20min,每5min摇晃一下。14)取出酶消化后的组织,吸去酶液,加入冰的pbs终止反应,用pbs清洗2-3次(不要振动组织)。15)静置2min,去掉上层液体。16)加入1ml的dmem(forneuro)进行吹打;吹打15次后,静置2min,收集上清液,放入离心管中(离心管保持低温)。17)再加入1mldmem,继续吹打10次,再收集上清液入同一皿中。第三次再加1ml,重复操作,3次后,将未消化的组织弃掉。18)将收集到的上清液放入预先铺好的板中(700000/孔)(6孔板),摇匀。19)4小时后,轻摇几下,把死细胞和碎片吸走,再用dmem清洗一次后,用neurobasal培养基进行培养。20)第二天,半数换液,更换neurobasal培养基。此后,隔两天换一次。21)海马神经元癫痫样放电模型建立:将体外培养至第12天的海马神经元换液。无镁处理组用无镁hbss轻轻洗3次,除去培养基中的存留镁离子,然后改用无镁hbss培养3h,随后恢复正常培养基或者含10μmssa的培养基,孵育细胞24小时后开始检测。2.电生理记录根据制造商的说明书,利用epc-10放大器(heka)进行细胞电生理信号的采集,并将数据储存于patchmaster(heka)软件中。简言之,用微电极拉制仪(p97,sutterinstruments)将毛细玻璃管(bf150-86-10,sutterinstruments)拉制成记录电极。电极填充内液体:130mmcscl,1.6mmmgcl2,10mmhepes,5mmegta,2mmna-atp,ph7.3。在倒置显微镜(ix71,olympus)下操纵微电极操纵仪(mp285,sutterinstruments)将记录电极接触到细胞上,给予负压抽吸,形成gω封接。形成gω封接后,进行快速电容补偿,然后继续给予负压,吸破细胞膜,形成全细胞记录模式。然后进行慢速电容的补偿并记录膜电容及串联电阻。gaba电流记录方法:细胞内液:130mmcscl,0.1mmcacl2,2mmmgcl2,1.1mmegta,5mmna2atp以及10mmhepes,ph=7.15,用csoh调节;细胞外液:140mmnacl,5mmcscl,2mmcacl2,1mmmgcl2,5mmhepes以及10mmglucose,ph=7.35,用naoh调节。外液中加入20μm-dnqx,20μm-dap5以及300nm-ttx。电压钳模式下,于-70mv稳定五分钟后,在-70mv下进行记录。3.实验结果使用上述实验方案,在gaba(10μm)、ntp注射剂、ntp注射剂+荷包牡丹碱(bicuculline,10μm)、实施例1制备的兔皮提取物、或实施例1制备的兔皮提取物+荷包牡丹碱(10μm)的存在下,记录大鼠海马神经元细胞的gaba电流(用2份细胞样品分别进行实验)。所使用的ntp注射剂和兔皮提取物的浓度(效价)均为1.2*10-2nu/ml。荷包牡丹碱是一种竞争性gabaa受体拮抗剂,用于特异性抑制gaba信号(电流)。实验结果如表4-5和图8a-8d所示。表4:大鼠海马神经元细胞响应实施例1制备的兔皮提取物的gaba电流(pa)表5:大鼠海马神经元细胞响应ntp的gaba电流(pa)图8a-8b分别显示了,细胞样品1(图8a)和细胞样品2(图8b)响应gaba、本发明的兔皮提取物或本发明的兔皮提取物+荷包牡丹碱的gaba电流。图8c-8d分别显示了,细胞样品1(图8c)和细胞样品2(图8d)响应gaba、ntp注射剂或ntp注射剂+荷包牡丹碱的gaba电流。结果显示,与ntp注射剂相比,本发明的兔皮提取物能够刺激大鼠海马神经元细胞产生显著更强的gaba电流。这一实验结果与实施例1中验证的实验结论(即,本发明的兔皮提取物中含有更高含量的gaba)相一致。本发明的兔皮提取物具有更好的应用前景。实施例6.兔皮提取物对脊髓损伤的治疗作用的评估在本实施例中,利用大鼠的脊髓损伤模型研究如上制备的兔皮提取物对脊髓损伤的治疗作用。简言之,采用8周龄雌性wista大鼠,应用纽约大学(nyu)标准脊髓损伤打击(impactormodelii)在大鼠胸10节段打击脊髓,构建脊髓损伤的动物模型。损伤后24小时,将实施例1制备的兔皮提取物分别以25nu/kg、50nu/kg、100nu/kg的剂量腹腔注射给药,每天一次,持续至损伤后2周。在该实验中,同时设置2组阴性对照,一组为未经受脊髓损伤的大鼠,另一组为用生理盐水进行治疗的脊髓损伤大鼠。随后,通过bbb评分(bassobeattiebresnahan运动功能评分)和gfap(glialfibrillaryacidicprotein)免疫染色来观察治疗后实验动物的功能恢复以及胶质瘢痕的大小,其中,根据bassodm,beattiems,bresnahanjc.asensitiveandreliablelocomotorratingscaleforopenfieldtestinginrats.jneurotrauma1995;12(1):1-21中描述的方法来测定bbb评分,并且,根据levig.等人描述的方法(enrichmentofdifferentiated,stellateastrocytesincerebellarinterneuronculturesasstudiedbygfapimmunofluorescenceandautoradiographicuptakepatternswith[3h]d-aspartateand[3h]gaba.brainres.1983nov;312(2):227-41)来进行gfap免疫染色。实验结果如图9-10所示。图9-10显示了,兔皮提取物与生理盐水对脊髓损伤大鼠的治疗效果的比较。其中,图9显示了,脊髓损伤大鼠接受生理盐水或指定剂量的兔皮提取物治疗后的运动功能恢复情况(即,bbb评分)。图10显示了,脊髓损伤大鼠接受生理盐水或指定剂量的兔皮提取物治疗后的胶质瘢痕形成情况(即,gfap免疫染色)。从图9可以看出,兔皮提取物治疗组大鼠的bbb评分显著高于生理盐水对照组,这表明本发明的兔皮提取物能够显著促进大鼠脊髓损伤后的运动功能恢复,可用于治疗脊髓损伤。从图10可以看出,兔皮提取物治疗组的大鼠的gfap表达水平显著低于对照组的大鼠的gfap表达水平,这表明本发明的兔皮提取物能够抑制胶质瘢痕的形成,促进脊髓损伤后的组织修复与功能恢复。这些实验结果表明,与对照组相比,本发明的兔皮提取物能够显著减少胶质瘢痕的形成、促进大鼠脊髓损伤后的运动功能恢复。由此表明,本发明的兔皮提取物对抑制脊髓损伤以及抑制胶质瘢痕形成具有确定的疗效。尽管本发明的具体实施方式已经得到详细的描述,但本领域技术人员将理解:根据已经公开的所有教导,可以对细节进行各种修改和变动,并且这些改变均在本发明的保护范围之内。本发明的全部范围由所附权利要求及其任何等同物给出。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1