一种获得高DHA含量的裂殖壶藻的方法及沉降罐与流程
本发明涉及微藻培养和不饱和脂肪酸生产领域,更特别地,涉及一种获得高dha含量的裂殖壶藻的方法及沉降罐。
背景技术:
二十二碳六烯酸(docosahexaenoicacid,dha)是目前发现的碳链最长、不饱和度最高的长链高度不饱和脂肪酸。dha是机体生物膜的重要结构组分,在婴幼儿神经发育、视网膜形成、智力发展等方面具有重要作用,而且也是前列腺素、换前列腺素和白三烯素等具有强烈生理活性的自身调节物质的前体,对预防心血管疾病、抗血脂、降血压、抑制肿瘤形成等具有显著作用。由于具有上述多种重要生理功能,dha已经成为价值高、市场广泛的脂肪酸产品。
裂殖壶藻,其分类地位按照真核生物六界分类法,即真核生物域,囊泡藻界chromalveolata,异鞭藻类(heterokontophyta或stramenopiles),双环门(bigyra),labyrinthulomycetes目,thraustochytriaceae科,schizochytrium属,也称为裂壶藻,单细胞、球形。裂殖壶藻细胞积累大量对人体有用的活性物质,如油脂、色素、角鲨烯等,其中油脂占细胞干重的70%以上,总脂中二十二碳六烯酸(dha)含量非常高,结构类似的脂肪酸含量低,容易分离纯化,而且没有鱼腥味,故裂殖壶菌是一种极具实现工业化生产dha潜力的微生物之一。
然而,目前裂殖壶藻大规模培养很难获得高dha含量的藻细胞用于提取dha。
技术实现要素:
为解决以上问题,本发明提供了一种获得高dha含量的裂殖壶藻的方法,包括以下步骤:
s1:将裂殖壶藻培养至对数期,得到裂殖壶藻培养物;
s2:向所述裂殖壶藻培养物中加入按所述裂殖壶藻培养物体积计0.01-0.15%的体积分数为30%的过氧化氢诱导藻细胞积累油脂,继续培养4-5天,得到诱导后的裂殖壶藻培养物;
s3:移除所述诱导后的裂殖壶藻培养物中的培养液,得到高dha含量的裂殖壶藻。
通过本发明的方法,将整个过程分为培养阶段、诱导阶段和沉降阶段,快速培养3-4天即可到达一定的生物量,然后通过添加促进剂过氧化氢来诱导藻细胞中的油脂和dha的积累,由此,既获得了高生物量,又获得了高油脂和dha含量。
在一个实施方案中,s1和s2在发酵罐中进行。
在一个优选实施方案中,s1中用于培养所述裂殖壶藻的初始培养基成分为:葡萄糖45.00gl-1,酵母粉10.00gl-1,谷氨酸钠10.00gl-1,氯化钠8.70gl-1,氯化钾0.56gl-1,氯化钙0.70gl-1,硫酸镁·七水4.80gl-1,磷酸二氢钾1.35gl-1,碳酸氢钠0.08gl-1,氯化铁·六水0.01gl-1,金属离子混合液a51.60mll-1,ph为6.5-7.5。
通过使用以上成分的初始培养基,裂殖壶藻能够快速生长分裂,在3-4天内即可达到可观的生物量。
在一个优选实施方案中,所述初始培养基中的葡萄糖和磷酸二氢钾与其余组分分开灭菌,灭菌后混合成所述初始培养基。将葡萄糖和磷酸二氢钾与其他成分分开灭菌可防止因美拉德等副反应的发生而降低培养基的培养效果。
在一个实施方案中,s1具体包括以下步骤:
s11:将生物量浓度为5-15gl-1的裂殖壶藻培养液按1:4-12的体积比接入装有所述初始培养基的发酵罐中;
s12:培养所述裂殖壶藻3-4天,即得到所述裂殖壶藻培养物;
培养条件为:温度28-30℃,通气量0.2-0.5vvm,搅拌速率120-180rpm,溶氧不低于8%,培养过程中持续补充葡萄糖,使培养物中还原性糖含量不低于15gl-1。
通过在培养过程中持续补充葡萄糖的含量,可使裂殖壶藻维持在高速生长的状态。
在一个实施方案中,s2中诱导条件为:维持还原性糖含量为15gl-1以上,维持还原性糖的c的摩尔浓度是有机氮中氮的摩尔浓度的的10倍以上,调节ph为5.0-6.0,溶氧为0.5-3%,搅拌速率为60-120rpm;
诱导第一天温度控制为23-25℃,第二天及以后控制为16-22℃,诱导时间为3-5天。
在s2中通过将c/n比升高,使得藻细胞摄取的有机碳无法转化成蛋白质,而是走脂类合成的通道,温度降低也有助于油脂的积累,结合过氧化氢的作用,使得dha的含量大大提高。
在一个实施方案中,s3包括以下步骤:
s31:将s2得到的诱导后的裂殖壶藻培养物装入沉降罐中;
s32:向所述诱导后的裂殖壶藻培养物液面上喷洒促沉降剂,所述促沉降剂为乙酸溶液与过氧化氢溶液的混合物;
s33:保持所述沉降罐中的温度为16-23℃,静置6-12h,待所述裂殖壶藻沉降;
s34:收集沉降浓缩的裂殖壶藻培养物,离心移除剩余的培养液,即得到高dha含量的裂殖壶藻。
促沉降剂中含有乙酸和过氧化氢,乙酸一方面促进裂殖壶藻的沉降,另一方面ph的降低和过氧化氢也有利于dha的积累,从而在沉降过程中仍然诱导细胞合成dha。
在一个实施方案中,s32中所述促沉降剂由体积分数70%的乙酸水溶液和体积分数为30%的过氧化氢水溶液混合得到,所述70%的乙酸水溶液与所述30%的过氧化氢水溶液的体积比为1:1-4,细胞密度越高,所加的过氧化氢水溶液的量越多;
沉降过程中还开启紫外灯照射所述沉降罐中的裂殖壶藻培养物。
紫外灯照射也有利于裂殖壶藻细胞积累
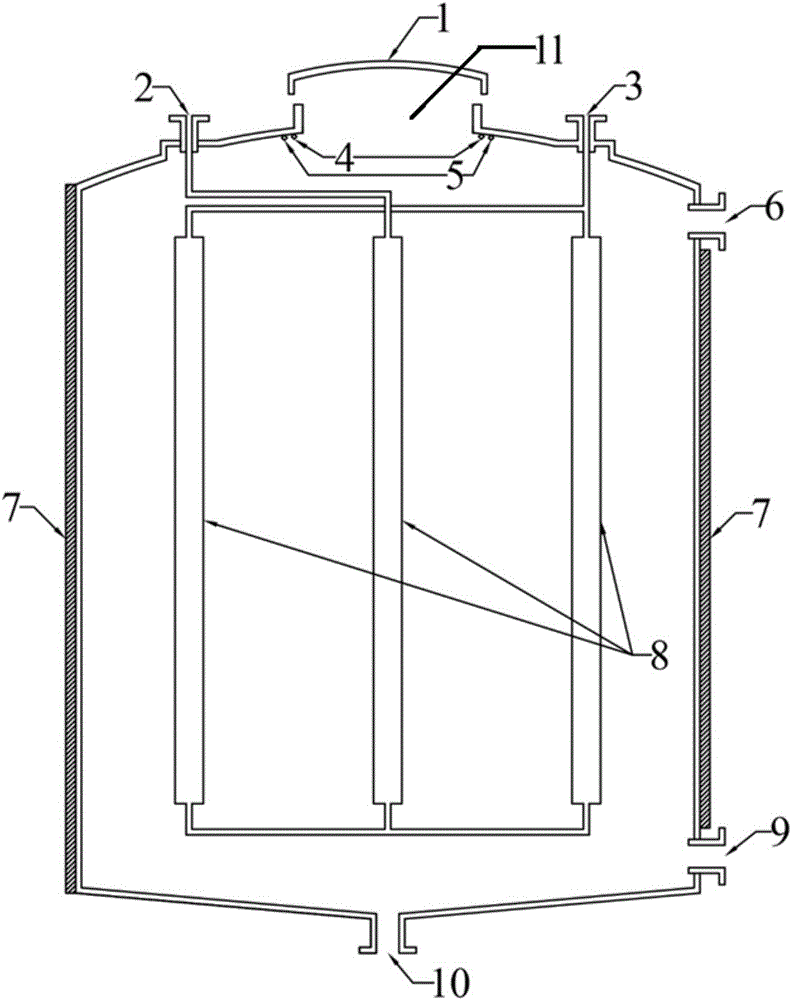
本发明还提供了一种用于沉降裂殖壶藻的沉降罐,其包括罐体、循环冷却系统和光照系统,所述罐体顶部中央设置有人孔,所述人孔上盖有罐盖,所述罐体底部向下隆起,底部中央设置有沉降物出口,所述罐体的侧壁上靠近顶部的位置设置有发酵液入口,所述罐体的侧壁上靠近底部的位置设置有上清液出口;所述罐体顶部内壁上靠近所述人孔设置有所述光照系统;所述罐体内部还设置有支架,用于支撑所述循环冷却系统。
在一个优选实施方案中,所述光照系统包括照明灯和紫外灯;
所述循环冷却系统包括通过连接管连通的多节冷却管以及冷却液入口和冷却液出口,所述冷却液入口和冷却液出口通过连接管分别与不同的冷却管连通。
附图说明
图1为本发明的沉降罐的示意图。
附图中,各标号所代表的部件列表如下:
1、罐盖,2、冷却液入口,3、冷却液出口,4、照明灯,5、紫外灯,6、发酵液入口,7、保温套,8、冷却管,9、上清液出口,10、沉降物出口,11、人孔。
具体实施方式
以下结合实例对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。
1.初始培养基的优化
基于之前对裂殖壶藻schizochytriumsp.s31,即atcc20888,购自美国菌种收藏中心(atcc)的培养,其培养基中海盐浓度、氮源浓度和碳源浓度对其生长影响较为明显。而裂殖壶藻合成dha的关键在于前期积累大量的生物量,之后才是进行快速诱导合成油脂dha。故前期的主要目标是使得裂殖壶藻进行快速增殖。
基于前期培养条件的摸索,适于生长的环境条件为25-30℃之间,初始ph可为7.0±1.0,摇瓶回旋往复速率100~150rpm,500ml摇瓶装液量为20-50%,避光或弱光照(≤15μmolm-2s-1)。为探究海盐浓度、氮源、氮源组成比例、葡萄糖浓度,以下培养环境条件设置为28±1℃,初始ph调整为7.0±0.1,摇瓶回旋往复速率为120rpm,500ml摇瓶装液量为100ml,黑暗。
1.1海盐浓度的优化
基于前期的基础培养基,为探究海盐浓度对裂殖壶藻生长的影响,设置基础培养基如表1和2所示。
表1用于摸索海盐浓度的基础培养基配方
表2a5的配方
向基础培养基中添加盐类后用于培养裂殖壶藻,每天测定裂殖壶藻培养物的生物量,评估每种培养基配方对裂殖壶藻的培养效果。培养结果如表3所示,人工海盐配方mix的成分如表4所示。
表3不同海盐浓度对裂殖壶藻生长的影响
表4人工海盐mix的配方
从结果来看,天然海盐和人工海盐按盐度32gl-1添加,裂殖壶藻的生物量增长均不理想,盐度控制为16-24gl-1之间更为理想,且盐度24比盐度16高出50%,但生物量积累仅高出1.3%。而酵母浸粉和谷氨酸钠中也含有金属离子,故盐度16gl-1添加为宜,也能降低后续发酵废水的处理难度。而天然海水盐存在批次间各成分含量比例不一致的问题,而在实验中也证实人工配制海盐mix的盐度控制为16-24gl-1时,能达到天然海盐的效果,故选用人工配制海盐的方法进行替代,选用mix16gl-1作为最佳培养基配方用于下一步研究。
1.2氮源浓度优化
基于前期的基础培养基和对海盐浓度的探索,为探究氮源对裂殖壶藻生长的影响,设置基础培养基如表5所示
表5用于摸索氮源浓度的基础培养基配方
基于之前的试验,酵母浸粉、蛋白胨、谷氨酸钠和玉米浆粉中,酵母浸粉和谷氨酸钠搭配最适于该裂殖壶藻生长,故此试验仅采用酵母浸粉和谷氨酸钠作为探究对象。向基础培养基中添加不同浓度的酵母浸粉和谷氨酸钠后用于培养裂殖壶藻,每天测定裂殖壶藻培养物的生物量,评估每种培养基配方对裂殖壶藻的培养效果。结果如表6所示。
表6不同氮源浓度对裂殖壶藻生长的影响
从表6中可知,当氮源浓度较高时,裂殖壶藻生长更快,但是考虑到成本和诱导时需要缺氮,我们选取中等浓度的氮源含量,即,10gl-1的酵母浸粉和10gl-1的谷氨酸钠作为氮源,既保证相对较高的生物量,同时还能降低成本,并且便于后期的缺氮处理。
1.3碳源优化
按上文中确定的海盐浓度和氮源浓度以及其他成分来摸索最优碳源浓度,添加不同浓度的葡萄糖作为碳源,确定最佳葡萄糖浓度,结果如表7所示。
表7不同葡萄糖浓度对裂殖壶藻生长的影响
从表7中可看出,30gl-1和45gl-1的葡萄糖浓度下,生物量浓度仅提高6.2%,继续提高到60gl-1时,生物量浓度仅提高2.2%,说明葡萄糖的最佳浓度拐点出现在30-45gl-1之间,而为保证提高初始生物量之后,葡萄糖足够裂殖壶藻使用,且在氮源利用殆尽之后还有多余的糖提供油脂合成的碳源,故取45gl-1为最佳浓度。
1.4铁元素的优化
按上文中确定的海盐浓度、氮源浓度和葡萄糖浓度以及其他成分来摸索最优碳源浓度,添加不同浓度的铁元素,确定最佳铁元素形式和浓度,结果如表8所示。
从表8可看出,添加几乎等量的二价铁元素和三价铁元素,对裂殖壶藻的生长影响甚微。可能的原因是,酵母浸粉中可能存在足够裂殖壶藻生存的铁元素,故额外添加的效果并不明显。但是为保证铁元素的充足供应,故应该额外添加。由于亚铁离子在实际生产中不如铁离子稳定,故选用氯化铁作为铁源添加,添加量为0.010gl-1。
通过以上实验,确定由于培养的裂殖壶藻的初始培养基组分如表9所示。表8用于培养裂殖壶藻的培养基组分
为了防止美拉德反应,在补料罐内配制浓缩的葡萄糖和磷酸二氢钾,121℃高温高压灭菌;在配料罐内配制余下营养物质,注入发酵罐实消121℃高温高压灭菌。待补料罐和发酵罐的温度均降至100℃以下后,将补料罐内的葡萄糖和磷酸二氢钾按量加入到发酵罐内。
2.裂殖壶藻的培养
用70%乙酸和1m氢氧化钾将初始培养基的ph调节至6.5-7.5,通气量设定为0.2~0.5vvm,确保溶氧不低于8%,设置搅拌速率120~180rpm(随溶氧联动控制)即可。将生物量浓度为5-15gl-1的裂殖壶藻种子液按1:4~12接入发酵罐内,以上流程可保证培养基能被充分利用,又能保证裂殖壶藻快速增殖生长。接入后分批补料培养,维持发酵罐内还原性糖的浓度不低于15gl-1,培养3-4天。
3.dha的诱导累积
培养裂殖壶藻3-4天后,向发酵罐中加入30%过氧化氢溶液,所加的过氧化氢溶液的体积为发酵罐中培养物的体积的0.01-0.15%;
每12h或24h,检测糖含量和有机氮的含量,补料维持罐内的还原性糖含量在15gl-1以上,并且保证还原性糖中碳的摩尔浓度是有机氮的10倍;
调节罐内的ph,诱导前24h为6.0-7.0,之后为5.0-6.0;溶氧为0.5~3%即可,通气量可随溶氧进行调节,仅需保证溶氧≥0.5%,搅拌速率可以降低至60-120rpm及以上;温度在第一天降至24±1℃,第二天后降至20±2℃,冬季可以低至16℃。
诱导3-5天,即可转移到沉降罐中进行沉降。
4.裂殖壶藻的沉降
使用沉降罐对裂殖壶藻培养物进行沉降。沉降罐的结构如图1所示,包括罐体、循环冷却系统和光照系统,所述罐体顶部中央设置有人孔11,所述人孔11上盖有罐盖1,所述罐体底部向下隆起,底部中央设置有沉降物出口10,所述罐体的侧壁上靠近顶部的位置设置有发酵液入口6,所述罐体的侧壁上靠近底部的位置设置有上清液出口9;所述罐体顶部内壁上靠近所述人孔11设置有所述光照系统;所述罐体内部还设置有支架,用于支撑所述循环冷却系统;所述光照系统包括照明灯4和紫外灯5;所述循环冷却系统包括通过连接管连通的多节冷却管8以及冷却液入口2和冷却液出口3,所述冷却液入口2和冷却液出口3通过连接管分别与不同的冷却管8连通。
关闭上清液出口9和沉降物出口10,将诱导后的裂殖壶藻培养物从发酵液入口6注入,然后从人孔11向罐内喷洒70%乙酸和30%过氧化氢混合液(体积比1:1-4,根据细胞密度来确定比例,细胞密度超过20gl-1,可为1:4,细胞密度在10gl-1可为1:1),按实际发酵液体积的0.02-0.05%喷洒在液面表层(根据实际沉降罐的装液量或液位高度确定,50%及以下建议为0.02%,90%以上为0.05%)。使用过程中需要做好防护措施,避免吸入和沾染。
关闭罐盖,开启紫外灯(5),开启循环冷却系统,将冷却液从冷却液入口(2)注入,经过冷却管(8)后从冷却液出口3出来。1-30000l规模的裂殖壶藻培养基在6-12h内均可高效沉降,上清液中固形物含量不高于1.5%。沉降完成后,关闭紫外灯5,停止循环冷却系统,从沉降物出口10处收集沉降浓缩的裂殖壶藻细胞用于提取,然后从上清液出口9出收集上清液。
含有丰富有机质的上清液,检测常规元素n、p、fe的含量,将氮元素稀释到10-35moll-1,按照bg11培养基的比例,加入缺乏的p、fe及微量元素,调节ph为8-10,即可用于小球藻的培养,按对数期生物量0.5-2.5gl-1接入;或者将氮元素含量稀释到15-45moll-1,按zarrouk培养基的配方比例,加入适当的碳酸氢盐、fe和微量元素,调节ph为7~10,即可用于螺旋藻的培养,按0.1-1.0gl-1接入,能使富含有机质的水得到净化处理。
以上沉降方法在可在沉降藻细胞的同时,创造出油脂及其中的dha的积累环境,上清液排放到跑道池后,过氧化氢能被分解掉,不会影响小球藻和螺旋藻的培养。
将沉降后收集的裂殖壶藻以及培养过程中各时间点采集的裂殖壶藻分别用于提取总脂,并通过气相色谱分析总脂中的脂肪酸组分,观察不同时间点处裂殖壶藻的含油率以及dha含量,结果如表9所示,表中的第n天表示从接入到发酵罐起计n天后。在本实施例中,培养阶段用了3天,培养3天后诱导4天,然后沉降12h。
表9不同时间点的裂殖壶藻样品的含油率和主要脂肪酸组成
由表9中可看出,在培养阶段的3天中,总脂含量和dha含量都增长缓慢,但是到诱导阶段时,总脂含量和dha含量都稳步增长,并且在沉降后,总脂和dha含量均有增长。最终,仅用7-8天的时间,裂殖壶藻的总脂含量达到32.8%,dha在总脂中所占的百分比为38.57%。可见,本发明的方法可提高裂殖壶藻中总脂和dha的含量,以及缩短发酵时间。
- 还没有人留言评论。精彩留言会获得点赞!