双功能大肠杆菌及其用途的制作方法
本发明涉及一种通过分子生物学手段,利用基因敲除、基因融合、基因表达等技术改造的细菌菌株,具体涉及一株能够灵敏检测和高效吸附水中铜离子的大肠杆菌,属于环境生物技术领域。
背景技术:
铜(cu)作为最常见的重金属元素之一,是生物体新陈代谢必须的微量元素,缺铜可以引起贫血、腹泻等,然而过量的铜对于生命体是有害的,人体内铜的过量沉积参与了很多疾病的发生和发展,如儿童肝硬化、tyrolean婴儿慢性间质性肝炎、wilson病等。当铜蓄积于人体脑部,可引起神经组织病变,出现小脑运动失常甚至出现帕金森综合症或阿尔茨海默病。随着我国工农业的高速发展,冶金、矿山、铸造、电镀等行业大量排放含铜污染物到环境中,给人们的生活和健康造成了巨大的威胁。比如众所周知的紫金山矿业铜污染事件,江西铜业重金属污染事件。所以加强对环境水体中铜的检测以及有效地去除和治理铜污染显得尤为重要。
目前最常用的铜检测分析技术主要有原子荧光光谱仪、电感耦合等离子体质谱(icp-ms)等。这些传统的分析方法虽然精密度高、准确性好,但是往往检测成本昂贵,操作繁琐,而且要求操作人员必须具有一定的专业技术知识。全细胞微生物传感器是一种便捷、快速、低成本的环境重金属检测工具,它采用基因工程技术对活体微生物进行改造,使其能够对重金属污染物进行定量分析。但是其特异性欠佳、灵敏度不高一直是限制其广泛应用的瓶颈问题。当重金属进入细菌体内以后,细菌会启动表达“外排泵”基因以泵出重金属,使菌体内重金属浓度维持在较低水平,导致检测灵敏度不高。例如大肠杆菌体内存在一套铜耐受操纵子cop,表达cuer、copa等相关蛋白,cuer是一个调节蛋白,能与cu特异性结合,结合后从启动子pcopa位置处解离出来,从而启动下游copa的表达。copa属于atpase家族,能够通过消耗atp,将细胞内cu泵到胞外。本发明涉及的菌株通过基因敲除技术将大肠杆菌基因组上合成铜外排泵的基因copa敲除,从而使进入菌体内的铜离子不能排出,与野生型菌株相比其检测灵敏度提高数个数量级。
除了对环境水体中铜离子检测外,对排放的各类含铜废水进行有效地治理也是当前亟待解决的工作。重金属废水的常规处理方法主要包括:化学沉淀法、蒸发浓缩法、离子交换法、电解法、吸附法和膜分离法等,但这些方法费用昂贵、去除不彻底、易产生有毒污泥和其他废料等二次污染。近年来生物吸附法,尤其是微生物吸附引起了人们广泛的重视,它作为一项新技术,已逐渐成为目前重金属废水最有效的处理方法之一。近年来基因工程技术因其在增强微生物吸附能力的应用上具有巨大潜力,该技术的关键为寻找理想的金属螯合蛋白。目前已报道的金属螯合蛋白,大多为富含半胱氨酸的蛋白肽,主要包括谷胱甘肽、植物螯合肽和金属硫蛋白等。这些蛋白都可以跟金属直接结合,然而基于植物螯合肽和金属硫蛋白的微生物吸附菌株一般存在吸附特异性差的缺点,即一般同时会吸附水体中多种金属离子,影响了后期对吸附的特定金属的回收和利用。cuer是大肠杆菌体内铜调控操纵子cop的一个调节蛋白,能与铜离子特异性结合,一般不与其他常见金属结合,具有很强的吸附选择性。如果将此吸附蛋白与细胞膜表面的跨膜蛋白进行融合,使铜吸附蛋白cuer锚定在细胞膜表面,直接与细胞外的铜离子进行结合,可显著提高其吸附量。
技术实现要素:
本发明通过基因融合技术,将铜特异性吸附蛋白cuer基因cuer片段与细菌膜蛋白信号肽lpp基因和跨膜蛋白ompa基因进行融合,将融合基因片段克隆到表达载体pbv220质粒中。pbv220质粒是一种温度控制型蛋白表达载体,无需添加昂贵的蛋白表达诱导剂,只需将温度调到42℃即可在细菌表面大量表达目的蛋白。此外,将大肠杆菌copa基因的启动子序列pcopa和绿色荧光蛋白gfp进行融合,得到铜离子检测荧光报告基因片段,再将此片段整合到上述载体中;再将得到的新载体转入到铜外排基因被敲除的copa-菌株中,得到一种既能利用荧光信号来特异、灵敏检测水中铜离子,又能利用细胞表面表达的铜吸附蛋白高效治理铜污染水体的双功能菌株。本发明涉及的这种菌株同时具有检测铜离子和吸附铜离子两种功能,且可以使用37℃和42℃两种温度分别控制其进行检测和吸附。该发明无需使用额外试剂,成本低、效率高,可实现检测和除污的一体化。
附图说明
图1为pcr扩增带frt位点的氯霉素抗性基因产物琼脂糖凝胶电泳鉴定结果
图2为pcr扩增野生型mc4100和成功敲除copa基因的菌株的琼脂糖凝胶电泳鉴定结果
图3为lpp-ompa-cuer融合基因琼脂糖凝胶电泳鉴定结果
图4为pcopa-gfp融合基因琼脂糖凝胶电泳鉴定结果
图5为线性化载体片段pbv220-lpp-ompa-cuer琼脂糖凝胶电泳鉴定结果
图6为pbv220-locg质粒载体框架图
图7为铜离子在不同温度下对pbv220-locg/copa-菌株荧光信号的诱导作用
图8为不同温度下诱导细菌表达铜吸附蛋白的结果比较
图9为pbv220-locg/copa-菌株和pbv220-locg/mc4100铜诱导能力比较
图10为不同金属离子对菌株的诱导作用比较
图11为不同金属离子对于铜离子诱导pbv220-locg/copa-菌株产生荧光信号的干扰作用
图12显示该菌株对铜离子检测的线性相关性较好
图13显示不同菌株在不同温度条件下对铜离子的吸附能力
图14显示pbv220-locg/copa-菌株在不同温度条件下对铜离子吸附能力随时间变化
图15显示pbv220-locg/copa-菌株的铜吸附量和溶液中铜离子浓度的关系
图16显示pbv220-locg/copa-菌株在不同的金属溶液中具有不同的吸附系数
图17显示不同金属离子对pbv220-locg/copa-菌株吸附性能的干扰作用
图18显示了pbv220-locg/copa-菌株对水中铜离子检测和吸附除污的一体化流程
实施例
实施例1.双功能大肠杆菌的构建
(一)敲除大肠杆菌copa基因,制备对铜离子敏感的菌株。
1.敲除引物以及鉴定引物的设计
分别设计两对引物,其中一对引物是两端含有copa基因两翼50bp同源序列的敲除引物copa-knockout-p1和copa-knockout-p2,以及copa基因上下游分别为800bp左右位置处的序列作为外侧的一对鉴定引物copa-check-p1和copa-check-p2,序列信息如下:copa-knockout-p1:
copa-knockout-p2:
下划线部分为含有copa基因两翼50bp的同源序列,方框部分为与氯霉素抗性基因模板的互补结合序列。
copa-check-p1:
ctcgcgatggacgagcgg
copa-check-p2:
gaacaaattacacaaacatactaagtcatacaagaacg
2.大肠杆菌topa基因的敲除步骤
1)pcr扩增带frt位点的氯霉素抗性基因
pcr体系如下:
pcr扩增条件如下:95℃3min;95℃40s;55℃40s;72℃2min;72℃10min;循环35次。
取2-3μlpcr扩增产物进行1%琼脂糖凝胶电泳鉴定。如图1所示,在1200bp左右有一条明亮条带扩增出来,则说明氯霉素抗性基因打靶片段扩增成功,剩余的所有扩增产物用宝生物dna胶回收试剂盒进行跑胶回收纯化,加入合适量的无菌去离子水洗脱回收的dna,再次取1-2μl电泳鉴定,确保条带大小正确,纯度较高,并储存备用。
2)pkd46质粒转化入野生型mc4100菌株,获得pkd46/mc4100菌株。
3)大肠杆菌pkd46/mc4100具备重组能力的电转化感受态细胞制备(1)将-80℃冻存的pkd46/mc4100接种于5ml含有氨苄霉素的lb液体培养基中,30℃振荡培养过夜。
(2)将过夜长浓的细菌以1:100的比例稀释加入到含有50mlamp+/lb液体培养基的锥形瓶中,30℃振荡培养至od600约为0.1左右,加入终浓度为0.02%的阿拉伯糖,继续30℃振荡培养到od600约为0.5左右。
(3)将菌液转移至冰上预冷的灭菌的50ml塑料离心管中,冰上放置30min。
(4)4℃,4000rpm离心15min,去上清,用30ml预冷的10%无菌甘油重悬菌体。
(5)4℃,4000rpm离心15min,去上清。
(6)重复步骤5一次。
(7)用400ml10%甘油重悬菌体,小心混匀后每管40μl分装,放-80℃冻存或直接用来转化。
4)打靶pcr扩增dna片段的电转化
(1)取40μlpkd46/mc4100感受态细胞,加入纯化的打靶dna片段若干微升,确保至少有3-4μg的dna量,轻轻混匀后转入电击杯,冰上放置5分钟。
(2)用bio-rad电击仪进行电击转化。条件:200ω,25f,电压2.3kv,
持续时间5ms左右。
(3)电击后迅速加入1ml液体lb培养基,37℃振荡培养1-2h,之后吸取一半菌液涂到氯霉素平板(氯霉素浓度20g/ml),37℃培养。
5)pcr鉴定长出的氯霉素抗性克隆,挑选敲除成功的阳性转化子
用高压灭菌的枪头挑取平板上长出的菌落,涂到已经分隔划线并编号的氯霉素平板上,37℃培养过夜,第二天用枪头挑取少许涂开的菌斑,混于事先配制好的总体积20lpcr体系中,做好pcr管上的编号,直接上pcr仪扩增。扩增体系与普通无特殊区别,扩增引物使用topa基因的外侧引物,并且加入一管野生型mc4100菌液作为扩增模板的对照。
pcr扩增条件如下:95℃3min;95℃40s;55℃40s;72℃2min;72℃10min;循环35次。
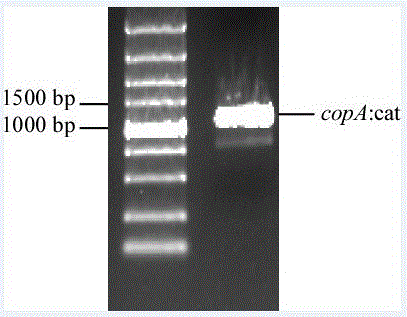
pcr结束后取3-5μl产物进行琼脂糖凝胶电泳鉴定。如图2所示,用设计在copa基因上下游约800bp左右的鉴定引物,以野生型菌株为模板,扩增出约4102bp的条带(泳道1),以待鉴定的敲除菌株copa-为模板扩增出约2749bp的条带(泳道2),表明已经在野生型mc4100菌株的基础上成功敲除了copa基因,得到copa-菌株。
(二)构建大肠杆菌膜表面铜吸附蛋白cuer的表达载体pbv220-lpp-ompa-cuer
1.lpp-ompa-cuer融合基因片段的设计和合成
将大肠杆菌信号肽lpp的第1-29位氨基酸残基、膜蛋白ompa的第46-159位氨基酸残基和铜吸附蛋白cuer的完整氨基酸序列进行融合,之间由数个氨基酸隔开。其编码序列根据大肠杆菌密码子偏好性进行优化,基因片段直接由公司合成,并亚克隆在puc57-lpp-ompa-cuer上。
2.表达载体pbv220-lpp-ompa-cuer的构建
1)构建所需引物序列设计如下:
lpp-ompa-cuer-f:
tggttaaaaattaaggagggaattccatgaaggcgaccaaactggtgctgg
lpp-ompa-cuer-r:
aacagaagcttggctgcaggtcgacttagcccgcacggtggtggcagcaac
2)pcr扩增lpp-ompa-cuer融合基因片段
pcr体系如下:
pcr扩增条件如下:95℃3min;95℃40s;55℃40s;72℃2min;72℃10min;循环35次。取2-3μlpcr扩增产物进行1%琼脂糖凝胶电泳鉴定并回收片段。如图3所示,lpp-ompa-cuer融合基因大约为860bp。
3)pbv220质粒的酶切。酶切体系如下:
37℃酶切3h后全部跑胶回收。
4)无缝克隆构建表达载体pbv220-lpp-ompa-cuer
根据和元生物技术有限公司的无缝克隆反应试剂盒说明书操作。按上述得到lpp-ompa-cuer融合基因片段和pbv220质粒酶切后线性化片段加入无菌离心管中。按以下体系进行反应:
以上体系混匀后于37℃孵育30min,然后转移至冰上置5min,将连接产物转化入e.colidh5α感受态细胞中并涂板。得到的单克隆用通用引物pbv220-f和pbv220-r经菌落pcr鉴定正确后进行测序。测序正确的质粒为pbv220-lpp-ompa-cuer,提取此质粒用于下一步实验。
(三)构建铜离子检测和吸附双功能载体pbv220-lpp-ompa-cuer-gfp-pcopa
1.pcopa-gfp融合基因片段的设计和合成
将copa基因阅读框上游的227bp启动子序列和绿色荧光蛋白序列gfp融合成一个片段,基因片段直接由公司合成,并亚克隆在puc57-pcopa-gfp上。
3.双功能载体pbv220-lpp-ompa-cuer-gfp-pcopa的构建
1)构建所需引物序列设计如下:
pcopa-gfp-f:
cagtcgaaagactgggccttttatttgtatagttcatccatgccatgtgtaatcccagc
pcopa-gfp-r:
acaaacaacagataaaacgaaattcctcaccccggtgccgattttcaggc
linear-pbv220-f:
tcgttttatctgttgtttgtcggtgaacgctctcc
linear-pbv220-r:
aaggcccagtctttcgactgagcctttcg
2)pcr分别扩增pcopa-gfp融合基因片段和线性化载体片段pbv220-lpp-ompa-cuer
pcr体系如下:
pcr扩增条件如下:95℃3min;95℃40s;55℃2min;72℃5min;72℃10min;循环35次。取2-3μlpcr扩增产物进行1%琼脂糖凝胶电泳鉴定并回收片段。如图4和图5所示,pcopa-gfp融合基因大约为944bp,线性化载体片段pbv220-lpp-ompa-cuer大约为4500bp。片段扩增成功后全部进行胶回收。
3)无缝克隆构建表达载体pbv220-lpp-ompa-cuer-gfp-pcopa
根据和元生物技术有限公司的无缝克隆反应试剂盒说明书操作。按上述得到pcopa-gfp融合基因片段和线性化载体片段pbv220-lpp-ompa-cuer加入无菌离心管中。按以下体系进行反应:
以上体系混匀后于37℃孵育30min,然后转移至冰上置5min,将连接产物转化入e.colidh5α感受态细胞中并涂板。得到的单克隆用通用引物pbv220-f和pbv220-r经菌落pcr鉴定正确后进行测序。测序正确的质粒命名为pbv220-lpp-ompa-cuer-gfp-pcopa,简称pbv220-locg。此质粒载体框架如图6所示,大小为5456bp,完整序列如序列表序列1所示。
(四)构建铜离子检测和吸附双功能菌株pbv220-lpp-ompa-cuer-gfp-pcopa/copa-
将质粒pbv220-lpp-ompa-cuer-gfp-pcopa转化到copa-菌株,即得到铜离子检测和吸附双功能菌株,命名为pbv220-lpp-ompa-cuer-gfp-pcopa/copa-,简称pbv220-locg/copa-。
实施例2pbv220-locg/copa-菌株的gfp荧光蛋白表达和铜吸附蛋白cuer表达情况
将pbv220-locg/copa-菌株接种到5mllb培养基中37℃生长过夜。随后将过夜菌按1:50倍数稀释,37℃培养扩大至菌密度od600至0.5左右,分装至4个平行试管中。往其中两只试管中添加终浓度为10μmcu2+,其余两管不添加。接着将添加有cu2+的其中一管和未添加cu2+的其中一管放置到42℃震荡培养箱,250rpm诱导5小时;另外将剩余两管(分别添加有cu2+和未添加cu2)。放置到37℃震荡培养箱,250rpm诱导5小时。诱导结束后,分别从各个管中吸取3-4ml菌液,离心后弃上清,收获的菌体重悬于db缓冲液(20mmtris-hcl,500mmnacl,ph8.0)中,然后取适量重悬菌液稀释,调整od值约0.2左右,混匀,再分别测量其稀释液荧光值与od600值。荧光强度于481nm激发光下在507nm处测定,荧光强度除以菌密度od600即为相对荧光强度。同时,将各个管菌体按上述方法调整至od值约4左右,取10μl处理完毕的菌液上清进行sds-page蛋白质凝胶电泳。如图7所示,添加cu2+的细菌均会产生较明显的荧光,而未加cu2+的细菌基本上没有荧光。这说明cu2+能够诱导pbv220-locg/copa-菌株产生荧光信号。如图8所示,37℃诱导的菌株和42℃诱导的相比,后者在30kda左右位置可见一条明显的诱导条带,此条带与细菌表面铜吸附蛋白lpp-ompa-cuer预期大小一致,说明42℃条件能够诱导细菌在其表面表达铜吸附蛋白,而37℃不能表达。此外,由图7和图8可知,pbv220-locg/copa-菌株加铜产生荧光信号以及在42℃条件下表达铜吸附蛋白都是独立的控制过程,两者互不干扰,这表明此双功能菌株可以分别对铜离子进行检测和吸附。
实施例3pbv220-locg/copa-菌株的检测敏感性测定
为了确定pbv220-locg/copa-菌株对铜离子检测的敏感性,将其与含双功能质粒pbv220-lpp-ompa-cuer-gfp-pcopa的野生型mc4100菌株(简称为pbv220-locg/mc4100)的敏感性进行比较,具体操作如下:
1.菌液制备
将pbv220-locg/copa-和pbv220-locg/mc4100菌株各取少量菌液,分别接种于含有氨苄青霉素的优化m9培养基,该优化培养基在基础培养基中添加5μg/l的维生素b1和20种天然氨基酸(每种10μg/l)以更有利于细菌的快速繁殖和蛋白表达。在250rpm,37℃振荡培养过夜;次日接到优化m9培养基中,37℃扩大培养,至od600约为0.5;将上述2种菌液,按照2ml/管分装加入到无菌试管中,每种细菌分装30管,向分装好的各试管菌液中分别加入等体积不同浓度cu2+溶液,使其终浓度分别为0.1、1.0、10、100、103、104、105、106、107、108nm,每种浓度各做3份平行管。
2.诱导培养
将上述菌液在37℃,250rpm下振荡培养5h取出。
3.吸光度值和荧光值测定
每管菌液各吸取100μl菌液10倍稀释于0.9mlph8.0tris-hcl缓冲液中,分别测量各管细菌稀释液荧光强度及od600值。
4.结果处理
以荧光强度/od600的相对荧光值为纵坐标,cu2+终浓度为横坐标,绘制曲线。
5.实验结果
如图9所示,pbv220-locg/copa-菌株对cu2+的敏感程度大大增加,在1nmcu2+浓度的情况下即可有荧光诱导出来,而且荧光强度在1-105nm范围内呈浓度依赖性升高。然而pbv220-locg/mc4100在相同条件下,铜离子浓度达到106nm才有明显的荧光诱导出来,且最高荧光强度也只达到pbv220-locg/copa-菌株最高荧光强度的1/5左右。这证明copa基因的敲除能够十分显著地提高菌株对铜离子的检测灵敏度。
实施例4pbv220-locg/copa-菌株的对铜离子检测的特异性测定
1.菌液制备
将pbv220-locg/copa-接种于含有氨苄青霉素的优化m9培养基中,250rpm,37℃振荡培养过夜;次日接到优化m9培养基中,37℃扩大培养,至od600约为0.5;按照2ml/管分装加入到无菌试管中,分装60管,向分装好的各试管菌液中分别加入等体积的cu2+、pb2+、hg2+、fe2+、zn2+、ni2+、co2+、mn2+、cd2+、ag+溶液,使其终浓度分别为10、50μm,每种金属溶液及每种浓度各做3份平行管。
2.诱导培养
将上述菌液在37℃,250rpm下振荡培养5h取出。
3.吸光度值和荧光值测定
每管菌液各吸取100μl菌液10倍稀释于0.9mlph8.0tris-hcl缓冲液中,分别测量各管细菌稀释液荧光强度及od600值,以荧光强度/od600为相对荧光值。
4.实验结果
如图10所示,在相同实验条件下,除了ag+能够使pbv220-locg/copa-菌株诱导出相对较弱的荧光信号,其余几种金属(pb2+、hg2+、fe2+、zn2+、ni2+、co2+、mn2+、cd2+)均不会使菌株产生明显的荧光信号。这表明该菌株具有较好的检测特异性。
实施例5pbv220-locg/copa-菌株的对铜离子检测的抗干扰测定
1.菌液制备
将pbv220-locg/copa-接种于含有氨苄青霉素的优化m9培养基中,250rpm,37℃振荡培养过夜;次日接到优化m9培养基中,37℃扩大培养,至od600约为0.5;按照2ml/管分装加入到无菌试管中,分装30管,向分装好的各试管菌液中分别加入终浓度为10μm的cu2+溶液,此外还向上述各管中同时再分别加入终浓度为50μm的pb2+、hg2+、fe2+、zn2+、ni2+、co2+、mn2+、cd2+、ag+溶液,其中一组只加cu2+溶液不加其他金属。每种反应样品各做3份平行管。
2.诱导培养
将上述菌液在37℃,250rpm下振荡培养5h取出。
3.吸光度值和荧光值测定
每管菌液各吸取100μl菌液10倍稀释于0.9mlph8.0tris-hcl缓冲液中,分别测量各管细菌稀释液荧光强度及od600值,以荧光强度/od600为相对荧光值。
4.实验结果
如图11所示,在相同实验条件下,即使溶液中同时存在浓度高于cu2+溶液5倍的其他几种金属(ag+、pb2+、hg2+、fe2+、zn2+、ni2+、co2+、mn2+、cd2+),也基本不会影响cu2+诱导pbv220-locg/copa-菌株产生的荧光信号强度,这表明该菌株具有较好的抗干扰检测性能。
实施例6pbv220-locg/copa-菌株的最适检测范围
1.菌液制备
将pbv220-locg/copa-接种于含有氨苄青霉素的优化m9培养基中,250rpm,37℃振荡培养过夜;次日接到优化m9培养基中,37℃扩大培养,至od600约为0.5;按照2ml/管分装加入到无菌试管中,分装30管,向分装好的各试管菌液中分别加入终浓度为0、1、5、25、100、500、1×103、5×103、1×104、5×104nm的cu2+溶液。每个浓度样品各做3份平行管。
2.诱导培养
将上述菌液在37℃,250rpm下振荡培养5h取出。
3.吸光度值和荧光值测定
每管菌液各吸取100μl菌液10倍稀释于0.9mlph8.0tris-hcl缓冲液中,分别测量各管细菌稀释液荧光强度及od600值,以荧光强度/od600为相对荧光值,测定时将不添加cu2+溶液的菌液作为调零对照管。
4.实验结果
如图12所示,该菌株对铜离子检测的线性范围为1.0-5.0×104nm,且线性回归方程为y=93.418+584.97log(x),相关系数r2=0.997。表明该菌株对铜离子的检测范围宽,线性相关性较好。最低检测下限低于《国家地表水环境质量标准gb3838-2002》规定的i类地表水中的铜离子标准(<0.01mg/l)。
实施例7pbv220-locg/copa-菌株的铜离子吸附能力测定
1.吸附菌体的制备
将pbv220-locg/copa-和含有空载质粒的pbv220/copa-分别接种于含有氨苄青霉素的lb培养基中,250rpm,37℃振荡培养过夜;次日分别按1:100稀释到lb培养基中,每种菌再分装,分别在37℃和42℃条件下扩大培养,大约8h后,离心,弃去上清,得到的菌体重悬于db缓冲液,并调整od大约10左右。
2.吸附实验
将上述得到的四种菌液样品,分别分装成4份,每份体积大约1.5ml,离心弃上清后,在对应的管子中分别加入等体积终浓度为1、5、25、100μm的cu2+溶液,轻轻吹打混匀,在室温下低速振荡30min后,再次离心弃上清,并用db缓冲液洗涤菌体2次,用去离子水重悬菌体至5ml,在微波消解仪中彻底消解菌体至溶液澄清透明,定容至15ml后,利用电感耦合等离子体质谱仪(icp-ms)测定消解液中铜离子浓度。同时制备等量的菌体,在真空冷冻干燥仪中制备得到菌体干粉,称重后计算1g菌体的铜离子吸附量(μmol/g),即为菌体铜吸附能力。每个样品各做3份平行管。
3.实验结果
如图13所示,pbv220-locg/copa-菌株在42℃条件下由于诱导出锚定于细胞膜表面的铜离子吸附蛋白cuer,所以对铜离子的吸附能力要明显强于37℃培养条件下的同种菌株。同理,pbv220/copa-菌株由于未诱导出吸附蛋白,故吸附能力37℃培养条件下的pbv220-locg/copa-菌株接近。pbv220-locg/copa-菌株在从低到高铜离子浓度的溶液中,相比对照菌株其铜吸附能力约增强4-5倍。
实施例8pbv220-locg/copa-菌株对铜离子的吸附速率
1.吸附菌体的制备
将pbv220-locg/copa-接种于含有氨苄青霉素的lb培养基中,250rpm,37℃振荡培养过夜;次日按1:100稀释到lb培养基中,分别在37℃和42℃条件下扩大培养,大约8h后,离心,弃去上清,得到的菌体重悬于db缓冲液,并调整od大约10左右。
2.吸附实验
将上述得到的两种菌液样品,分别取体积大约15ml,离心弃上清后,在对应的管子中分别加入等体积终浓度为20μm的cu2+溶液,轻轻吹打混匀,在室温下低速振荡,每个样品管中分别在0、1、2、5、10、20、30min的时间点取1ml菌液,离心后留取上清。将上清稀释若干倍后利用icp-ms测定上清液中未被菌体吸附的剩余铜离子浓度。
3.实验结果
如图14所示,pbv220-locg/copa-菌株在42℃培养10h后,能够有效吸附溶液中的铜离子,5min即可吸附掉溶液中一半的铜离子,在20min后吸附完大约85%以上的铜离子并达到饱和状态,不能继续吸附。相比之下,37℃培养的菌株对溶液中的铜离子吸附能力有限,相同条件下只能吸附20%左右。
实施例9pbv220-locg/copa-菌株的最大铜吸附能力
1.吸附菌体的制备
将pbv220-locg/copa-接种于含有氨苄青霉素的lb培养基中,250rpm,37℃振荡培养过夜;次日按1:100稀释到lb培养基中,在42℃条件下扩大培养,大约8h后,离心,弃去上清,得到的菌体重悬于db缓冲液,并调整od大约10左右。
2.吸附实验
将上述菌液样品分装成9管,每管体积大约1.5ml,离心弃上清后,在对应的管子中分别加入等体积终浓度为1、5、25、125、500、1.0×103、2.5×103、5.0×103、1.0×104μm的cu2+溶液,轻轻吹打混匀,在室温下低速振荡30min后,再次离心弃上清,并用db缓冲液洗涤菌体2次,用去离子水重悬菌体至5ml,在微波消解仪中彻底消解菌体至溶液澄清透明,定容至15ml后,利用电感耦合等离子体质谱仪(icp-ms)测定消解液中铜离子浓度。同时制备等量的菌体,在真空冷冻干燥仪中制备得到菌体干粉,称重后计算1g菌体的铜离子吸附量(μmol/g),即为菌体铜吸附能力。每个样品各做3份平行管。
3.实验结果
如图15所示,pbv220-locg/copa-菌株的铜吸附量随着溶液中铜离子浓度的增加而随之增加,在5mm的cu2+溶液中达到最大吸附饱和值,约为350μmol/g。表明此菌株具有较强的铜离子吸附能力。
实施例10pbv220-locg/copa-菌株对铜吸附的特异性分析
1.吸附菌体的制备
将pbv220-locg/copa-菌株接种于含有氨苄青霉素的lb培养基中,250rpm,37℃振荡培养过夜;次日按1:100稀释到lb培养基中,分别在37℃和42℃条件下扩大培养,大约8h后,离心,弃去上清,得到的菌体重悬于db缓冲液,并调整od大约10左右。
2.吸附实验
将上述得到的两种菌液样品,分别再各自分装成9份,每份体积大约1.5ml,离心弃上清后,在对应的管子中分别加入等体积终浓度为100μm的cu2+、pb2+、hg2+、zn2+、ni2+、co2+、cr3+、cd2+、ag+溶液,轻轻吹打混匀,在室温下低速振荡30min后,再次离心弃上清,并用db缓冲液洗涤菌体2次,用去离子水重悬菌体至5ml,在微波消解仪中彻底消解菌体至溶液澄清透明,定容至15ml后,利用电感耦合等离子体质谱仪(icp-ms)测定消解液中各种对应金属离子的浓度。同时制备等量的菌体,在真空冷冻干燥仪中制备得到菌体干粉,称重后计算1g菌体的对应金属离子吸附量(μmol/g),再将42℃培养的菌株所吸附的单位金属量除以37℃培养的菌株所吸附的对应金属量定义为吸附系数(adsorptioncoefficient),此吸附系数消除了细菌自身对不同金属离子吸附能力的偏差,代表细菌表面cuer对各种金属离子的吸附能力。每个样品各做3份平行管。
3.实验结果
如图16所示,pbv220-locg/copa-菌株在不同的金属溶液中具有不同的吸附系数。对cu2+的吸附系数介于4-5之间,对ag+的吸附系数为2-3之间。对其他各种金属的吸附系数大约为1。这说明细菌表面cuer对cu2+的吸附较为明显,对ag+也有一定的吸附能力,但对其他金属基本上不会吸附,具有较好的特异性。
实施例11pbv220-locg/copa-菌株对铜吸附的抗干扰能力分析
1.吸附菌体的制备
将pbv220-locg/copa-菌株接种于含有氨苄青霉素的lb培养基中,250rpm,37℃振荡培养过夜;次日按1:100稀释到lb培养基中,在42℃条件下扩大培养,大约8h后,离心,弃去上清,得到的菌体重悬于db缓冲液,并调整od大约10左右。
2.吸附实验
将上述得到的菌液样品,分装成9份,每份体积大约1.5ml,离心弃上清后,在所有的管子中均加入等体积终浓度为100μm的cu2+,此外还向上述各管中同时再分别加入终浓度为100μm的pb2+、hg2+、zn2+、ni2+、co2+、cr3+、cd2+、ag+溶液,其中一管只加cu2+溶液不加其他金属。轻轻吹打混匀,在室温下低速振荡30min后,再次离心弃上清,并用db缓冲液洗涤菌体2次,用去离子水重悬菌体至5ml,在微波消解仪中彻底消解菌体至溶液澄清透明,定容至15ml后,利用电感耦合等离子体质谱仪(icp-ms)测定消解液中铜离子浓度。同时制备等量的菌体,在真空冷冻干燥仪中制备得到菌体干粉,称重后计算1g菌体的铜离子吸附量(μmol/g)。每个样品各做3份平行管。
3.实验结果
如图17所示,在相同实验条件下,即使在同时存在相同浓度的其他几种金属(pb2+、hg2+、zn2+、ni2+、co2+、cr3+、cd2+、ag+)的情况下,pbv220-locg/copa-菌株对铜离子的吸附能力也基本不会受到影响,这表明该菌株具有较好的抗干扰吸附性能。
实施例12pbv220-locg/copa-菌株对环境水体中铜离子检测和吸附除污的一体化流程
1.环境水体样品的采集
从辖区内铸造、电镀工业园区周边的水渠中随机采集水样共10份,每份500ml左右。各个水样进行高速离心以去除悬浮物及沉渣,取上清用来检测及吸附。
2.吸附前的环境水样中铜离子浓度的检测
①细菌荧光法检测铜离子浓度
将pbv220-locg/copa-接种于含有氨苄青霉素的优化m9培养基中,37℃振荡培养过夜;次日接到优化m9培养基中,37℃扩大培养,至od600约为0.5;按照1.8ml/管分装加入到无菌试管中,分装60管,向分装好的各试管菌液中分别加入体积为200μl的cu2+溶液,使反应管铜离子终浓度分别为0、1、5、25、100、500、1×103、5×103、1×104、5×104nm的。每个浓度样品各做3份平行管。此外,向剩余试管中分别加入200μl经离心处理的环境水体样品,每个样品均做3份平行管。
将上述菌液在37℃,250rpm下振荡培养5h取出。每管菌液各吸取200μl菌液10倍稀释于1.8mlph8.0tris-hcl缓冲液中,分别测量各管细菌稀释液荧光强度及od600值,以荧光强度/od600为相对荧光值,测定时将不添加cu2+溶液的菌液作为调零对照管。
以各标准铜离子浓度的对数值为横坐标,以对应样品的相对荧光值为纵坐标,做线性拟合曲线并计算曲线方程式,并保证曲线拟合系数r2>0.99。将各环境水样测到的相对荧光值代入公式,即可计算得到环境水样中铜离子的浓度。
②icp-ms检测铜离子浓度
各个环境样品经稀释若干倍后,利用icp-ms测定上清液中铜离子浓度,其结果与细菌荧光法检测得到的铜离子浓度进行比对。
3.环境水样中铜离子的吸附
①吸附菌体的制备
将pbv220-locg/copa-接种于含有氨苄青霉素的lb培养基中,37℃振荡培养过夜;次日按1:100稀释到lb培养基中,在42℃条件下扩大培养,大约8h后,离心,弃去上清,得到的菌体重悬于db缓冲液,并调整od大约10左右。
②菌体的吸附
将上述得到的菌液样品,分装成10份,每份体积大约2.0ml,离心弃上清后,在对应的管子中分别加入2.0ml等体积的环境水体样品,轻轻吹打混匀,在室温下低速振荡30min后,再次离心并吸取上清。
4.吸附后的环境水样中铜离子浓度的检测
经过42℃条件处理的菌株吸附后,环境水样中剩余的铜离子浓度也分别用步骤2中的细菌荧光法和icp-ms法进行检测。
实验结果
如表1所示,采集的10份环境水样经icp-ms测定发现,均含有一定浓度的铜离子。依据我国《污水综合排放标准》(gb8978--1996),其中样品编号2、5、6、7中的铜离子浓度超标(>0.5mg/l)。采用细菌荧光法测定环境水样中的铜离子,数值基本上低于icp-ms结果,这可能是实际样品成分复杂,部分铜以络合的形式与其他物质结合,而细菌基本上只会对水中铜离子感应。此外,也可能有其他成分对荧光信号有一定干扰。总体而言,细菌荧光法虽然无法达到icp-ms的准确度,但是能够对环境水样中的铜离子进行测定,具有一定的可靠性。
采集的10份环境水样经42℃生长的同种细菌吸附后,icp-ms测定结果表明各管的铜离子明显降低,大约只有初始浓度的10%-40%,表明细菌能够有效吸附环境水体中的铜。样品2、5、6、7中的铜离子也以达到合格排放标准。同样,吸附后的水体经细菌荧光法再次测定,结果与icp-ms测定相比也具有一定的匹配度。
此菌株对环境水体中铜离子检测和吸附除污的一体化流程见图18所示,以上环境实际水样评价结果表明,此双功能菌株能够检测出水体中铜离子浓度是否达标,且能通过改变生长温度对铜离子进行有效吸附,减少排放污染。
表1:吸附前后环境水样中铜离子浓度的测定(μg/l)
<110>温州医科大学
<120>双功能大肠杆菌及其用途
<160>1
<170>patentinversion2.1
<210>1
<211>5456
<212>dna
<213>人工序列
<400>1
ggaattccatgaaggcgaccaaactggtgctgggtgcggttattctgggtagcaccctgc60
tggcgggttgcagcagcaacgcgaaaatcgaccagggtattaacaacaacggtccgaccc120
atgaaaaccagctgggtgcgggtgcgtttggtggctaccaagtgaacccgtatgttggtt180
ttgagatgggctacgattggctgggccgtatgccgtataagggtagcgtggaaaacggcg240
cgtacaaagcgcagggtgttcaactgaccgcgaagctgggctacccgatcaccgacgatc300
tggacatttatacccgtctgggtggcatggtgtggcgtgcggacaccaagagcaacgttt360
acggtaaaaaccacgataccggcgtgagcccggtttttgcgggtggcgtggagtatgcga420
tcaccccggaaattgcgacccgtggtatcccgggcatgaacattagcgatgtggcgaaga480
tcaccggtctgaccagcaaagcgattcgtttttatgaggaaaagggtctggttaccccgc540
cgatgcgtagcgagaacggctaccgtacctatacccagcaacacctgaacgaactgaccc600
tgctgcgtcaggcgcgtcaagtgggtttcaacctggaggaaagcggcgagctggttaacc660
tgtttaacgacccgcaacgtcacagcgcggatgtgaagcgtcgtaccctggaaaaagttg720
cggagatcgaacgtcacattgaggaactgcagagcatgcgtgaccagctgctggcgctgg780
cgaacgcgtgcccgggtgatgatagcgcggattgcccgatcattgaaaacctgagcggtt840
gctgccaccaccgtgcgggctaagtcgacctgcagccaagcttctgttttggcttatgag900
agaagattttcagcctgatacagattaaatcagaacgcagaagcggtctgataaaacaga960
atttgcctcccggcagtagcgcggtggtcccacctgaccccatgccgaactcagaagtga1020
aacgccgtagcgccgatggtagtgtggggtctccccatgcgagagtagccaactgccagg1080
catcaaataaaacgaaaggctcagtcgaaagactgggccttttatttgtatagttcatcc1140
atgccatgtgtaatcccagcagctgttacaaactcaagaaggaccatgtggtctctcttt1200
tcgttgggatctttcgaaagggcagattgtgtggacaggtaatggttgtctggtaaaagg1260
acagggccatcgccaattggagtattttgttgataatggtctgctagttgaacgcttcca1320
tcttcaatgttgtgtctaattttgaagttaactttgattccattcttttgtttgtctgcc1380
atgatgtatacattgtgtgagttatagttgtattccaatttgtgtccaagaatgtttcca1440
tcttctttaaaatcaataccttttaactcgattctattaacaagggtatcaccttcaaac1500
ttgacttcagcacgtgtcttgtagttcccgtcatctttgaaaaatatagttctttcctgt1560
acataaccttcgggcatggcactcttgaaaaagtcatgctgtttcatatgatctgggtat1620
ctcgcaaagcattgaagaccatacgcgaaagtagtgacaagtgttggccatggaacaggt1680
agttttccagtagtgcaaataaatttaagggtaagttttccgtatgttgcatcaccttca1740
ccctctccactgacagaaaatttgtgcccattaacatcaccatctaattcaacaagaatt1800
gggacaactccagtgaaaagttcttctcctttactcataaaacactcctttaagacagtt1860
ttgactggctgtgataaaggttaaaccttccagcaaggggaaggtcaagaaattaataaa1920
ccaggcgggtaaaagtccgtaaagattaaaaaatcggctcgatttgcatcaggattagac1980
atttatctctttgttttcctgtagttaagttgcgggtgctaagttaaatcaggatgcctg2040
aaaatcggcaccggggtgaggaatttcgttttatctgttgtttgtcggtgaacgctctcc2100
tgagtaggacaaatccgccgggagcggatttgaacgttgcgaagcaacggcccggagggt2160
ggcgggcaggacgcccgccataaactgccaggcatcaaaggaatcagaaggccatcctga2220
cggatggcctttttgcgtttctacaaactctttgtttatttttctaaatacattcaaata2280
tgtatccgctcatgagacaataaccctgataaatgcttcaataatattgaaaaaggaaga2340
gtatgagtattcaacatttccgtgtcgcccttattcccttttttgcggcattttgccttc2400
ctgtttttgctcacccagaaacgctggtgaaagtaaaagatgctgaagatcagttgggtg2460
cacgagtgggttacatcgaactggatctcaacagcggtaagatccttgagagttttcgcc2520
ccgaagaacgttttccaatgatgagcacttttaaagttctgctatgtggcgcggtattat2580
cccgtgttgacgccgggcaagagcaactcggtcgccgcatacactattctcagaatgact2640
tggttgagtactcaccagtcacagaaaagcatcttacggatggcatgacagtaagagaat2700
tatgcagtgctgccataaccatgagtgataacactgcggccaacttacttctgacaacga2760
tcgggaggaccgaaggagctaaccgcttttttgcacaacatgggggatcatgtaactcgc2820
cttgatcgttgggaaccggatctgaatgaagccataccaaacgacgagcgtgacaccacg2880
atgcctgtagcaatggcaacaacgttgcgcaaactattaactggcgaactacttactcta2940
gcttcccggcaacaattaatagactggatggaggcggataaagttgcaggaccacttctg3000
cgctcggcccttccggctggctggtttattgctgataaatctggagccggtgagcgtggg3060
tctcgcggtatcattgcagcactggggccagatggtaagccctcccgtatcgtagttatc3120
tacacgacggggagtcaggcaactatggatgaacgaaatagacagatcgctgagataggt3180
gcctcactgattaagcattggtaactgtcagaccaagtttactcatatatactttagatt3240
gatttaaaacttcatttttaatttaaaaggatctaggtgaagatcctttttgataatctc3300
atgaccaaaatcccttaacgtgagttttcgttccactgagcgtcagaccccgtagaaaag3360
atcaaaggatcttcttgagatcctttttttctgcgcgtaatctgctgcttgcaaacaaaa3420
aaaccaccgctaccagcggtggtttgtttgccggatcaagagctaccaactctttttccg3480
aaggtaactggcttcagcagagcgcagataccaaatactgtccttctagtgtagccgtag3540
ttaggccaccacttcaagaactctgtagcaccgcctacatacctcgctctgctaatcctg3600
ttaccagtggctgctgccagtggcgataagtcgtgtcttaccgggttggactcaagacga3660
tagttaccggataaggcgcagcggtcgggctgaacggggggttcgtgcacacagcccagc3720
ttggagcgaacgacctacaccgaactgagatacctacagcgtgagcattgagaaagcgcc3780
acgcttcccgaagggagaaaggcggacaggtatccggtaagcggcagggtcggaacagga3840
gagcgcacgagggagcttccagggggaaacgcctggtatctttatagtcctgtcgggttt3900
cgccaacctctgacttgagcgtcgattttgtgatgctcgtcaggggggcggagcctatgg3960
aaaaacgccagcaacgcggcctttttacggttcctggccttttgctggccttttgctcac4020
atgttctttcctgcgttatcccctgattctgtggataaccgtattaccgcctttgagtga4080
gctgataccgctcgccgcagccgaacgaccgagcgcagcgagtcagtgagcgaggaagcg4140
gaagagcgcccttatctttccctttatttttgctgcggtaagtcgcataaaaaccattct4200
tcataattcaatccatttactatgttatgttctgaggggagtgaaaattcccctaattcg4260
atgaagattcttgctcaattgttatcagctatgcgccgaccagaacaccttgccgatcag4320
ccaaacgtctcttcaggccactgactagcgataactttccccacaacggaacaactctca4380
ttgcatgggatcattgggtactgtgggtttagtggttgtaaaaacacctgaccgctatcc4440
ctgatcagtttcttgaaggtaaactcatcacccccaagtctggctatgcagaaatcacct4500
ggctcaacagcctgctcagggtcaacgagaattaacattccgtcaggaaagcttggcttg4560
gagcctgttggtgcggtcatggaattaccttcaacctcaagccagaatgcagaatcactg4620
gcttttttggttgtgcttacccatctctccgcatcacctttggtaaaggttctaagctta4680
ggtgagaacatccctgcctgaacatgagaaaaaacagggtactcatactcacttctaagt4740
gacggctgcatactaaccgcttcatacatctcgtagatttctctggcgattgaagggcta4800
aattcttcaacgctaactttgagaatttttgcaagcaatgcggcgttataagcatttaat4860
gcattgatgccattaaataaagcaccaacgcctgactgccccatccccatcttgtctgcg4920
acagattcctgggataagccaagttcatttttctttttttcataaattgctttaaggcga4980
cgtgcgtcctcaagctgctcttgtgttaatggtttcttttttgtgctcatacgttaaatc5040
tatcaccgcaagggataaatatctaacaccgtgcgtgttgactattttacctctggcggt5100
gataatggttgcatgtactaaggaggttgtatggaacaacgcataaccctgaaagattat5160
gcaatgcgctttgggcaaaccaagacagctaaaagatctctcacctaccaaacaatgccc5220
ccctgcaaaaaataaattcatataaaaaacatacagataaccatctgcggtgataaatta5280
tctctggcggtgttgacataaataccactggcggtgatactgagcacatcagcaggacgc5340
actgaccaccatgaaggtgacgctcttaaaaattaagccctgaagaagggcagcattcaa5400
agcagaaggctttggggtgtgtgatacgaaacgaagcattggttaaaaattaagga5456
- 还没有人留言评论。精彩留言会获得点赞!