一种紫苏抗肿瘤多肽及其制备方法和应用与流程
本发明涉及植物蛋白质工程技术领域,特别是一种紫苏抗肿瘤多肽及其制备方法和应用。
背景技术:
多肽是一类具有多种生物学活性的肽类化合物,存在于动、植物和微生物体内,能够调节机体各个系统器官和细胞的功能,其作用涉及机体的免疫系统、内分泌系统、神经系统以及细胞的增殖分化等过程。一些小分子活性肽凭借其分子量小、靶向性好、低毒性以及易于穿透细胞膜等特点已成为抗肿瘤药物研制关注的热点。近年来研究发现,一些植物活性肽能够通过阻断肿瘤细胞dna的复制,诱导肿瘤细胞凋亡,从而对癌细胞的增殖和转移具有抑制作用,曾晓波等研究发现,菜籽蛋白经酶解产生的多肽对s180肉瘤细胞的增殖具有抑制作用,其抑制作用一方面是由于菜籽肽对肿瘤细胞膜产生影响,从而阻断了肿瘤细胞的转移;另一方面可能是由于菜籽蛋白增强了机体的免疫力所致。
紫苏籽直径大约在1~3ml之间,形状为球形或卵圆形颗粒状,颜色呈灰褐色或灰棕色,籽皮硬、脆,容易压碎脱皮。紫苏籽含油量高达45%左右,紫苏油中含有丰富的不饱和脂肪酸,其中α-亚麻酸约占总脂肪酸含量的63%,是一种理想的食用保健油。紫苏籽中蛋白质含量高达25%左右,氨基酸组成齐全,含有人体所需的18种氨基酸,其中8种必需氨基酸含量丰富且均衡,还含有各种矿物质、维生素以及其他人体所需的营养成分。目前紫苏也是国家卫生部首批颁布的60种药食同源植物资源之一,它含有多种具有特殊功能和生理活性的化学成分。近年来,紫苏籽所含有的营养成分和特殊活性物质已被科学家发现和应用,它已成为一种被广泛关注的保健油和蛋白质资源,经济价值很高。
目前国内外学者对紫苏蛋白的研究主要集中在制备工艺及其体外抗氧化性,中国专利公开号cn106243191a公开了一种紫苏籽抗氧化肽的制备方法,该方法只是对紫苏多肽的体外抗氧化性做了初步研究,未对其生物学活性和药理作用做进一步的研究。自由基理论研究表明:抗氧化和抗肿瘤存在一定的协同作用,具备抗氧化作用的活性物质一般具备一定的抗肿瘤效果,因此,有必要对紫苏蛋白进行分离纯化制备紫苏多肽,并深入研究其抗肿瘤活性,为多肽抗肿瘤药物研发提供新的途径,同时也能够提升紫苏蛋白的利用价值。
技术实现要素:
本发明的目的是要解决现有现有技术中存在的不足,提供一种紫苏抗肿瘤多肽及其制备方法和应用。
为达到上述目的,本发明是按照以下技术方案实施的:
本发明的一个技术方案:一种紫苏抗肿瘤多肽的制备方法,包括以下步骤:
step1、收集成熟的紫苏籽,去除杂质,低温压榨脱油后将紫苏饼粕捣碎,取捣碎后的紫苏饼粕置于索氏提取的纸筒中,采用石油醚于50℃回流去除残油,待浸出的石油醚为无色时停止加热,冷却至室温后将脱脂后的紫苏饼粕倒出,用粉碎机粉碎后过60目筛子,得脱脂紫苏粉;
step2、用蒸馏水将脱脂紫苏粉浸泡溶胀,调节料液比1:10,ph值为9,在超声波作用下使脱脂紫苏粉中的蛋白质充分溶解,超声功率200w,超声时间32min,然后在5000rpm下离心5min收集上清液,用稀盐酸调节上清液的ph为3~4,达到蛋白的等电点,离心收集沉淀,将沉淀用水清洗2次,调节ph至中性,经冷冻干燥后得紫苏分离蛋白;
step3、采用碱性蛋白酶alcalase对紫苏分离蛋白进行酶解,酶解工艺条件为:底物质量浓度30g/l,ph9.5,酶解温度60℃,碱性蛋白酶alcalase用量为step2获得的紫苏分离蛋白重量的7%,酶解时间4h,酶解结束后100℃水浴灭活5min,5000rpm离心5min后取上清,即为紫苏蛋白酶解产物;
step4、使用装有截留分子量为3kda超滤膜的amiconultra-15离心超滤管对紫苏蛋白酶解产物进行分离,离心机转速为8000rpm,离心时间25min,收集超滤液;
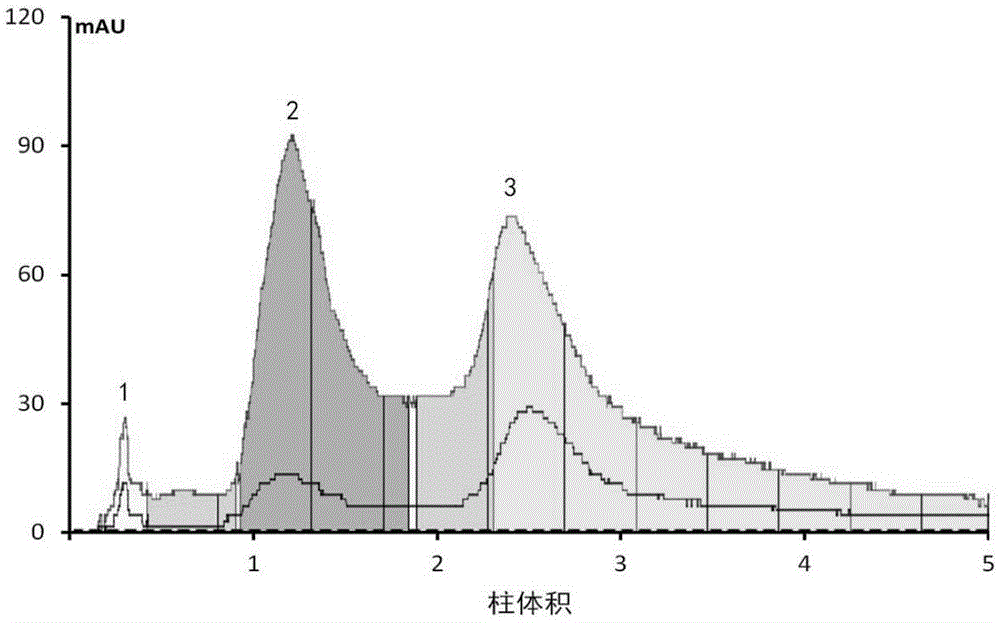
step5、采用biotage快速制备液相色谱全自动纯化系统对超滤液分离纯化,色谱柱为sephadexg-15,洗脱液为0.1mol/l的nacl,流速1ml/min,检测波长280nm,收集洗脱峰3,冷冻干燥得紫苏抗肿瘤多肽。
本发明的另一个技术方案为:一种紫苏抗肿瘤多肽,由上述一种紫苏抗肿瘤多肽的制备方法制得,所述紫苏抗肿瘤多肽分子量为715.33da。
上述制得的所述紫苏抗肿瘤多肽在抗肝癌药物中的应用,用于抑制人肝癌细胞hepg2的增殖。
与现有技术相比,本发明制得紫苏抗肿瘤多肽表明对人肝癌细胞hepg2的增殖具有较强的抑制作用,当浓度达到100μg/ml时,其抑制率达到了90%以上,基本接近抗癌药紫杉醇的抑制效果。本发明所涉及的紫苏抗肿瘤多肽来源于天然植物紫苏,对人体无毒无副作用,因此可作为抗癌药物做临床应用研究。
附图说明
图1为本发明实施例的紫苏蛋白酶解产物的超滤液的sephedexg-15凝胶过滤色谱图。
图2为本发明实施例的紫苏抗肿瘤多肽的高效液相色谱分析。
图3为本发明实施例的紫苏抗肿瘤多肽的质谱分析。
图4为采用mtt法检测紫苏抗肿瘤多肽对hepg2细胞的抑制作用图表。
图5为荧光显微镜观察紫苏抗肿瘤多肽对hepg2细胞的促凋亡作用,a:空白对照;b:6.25μg/ml;c:25μg/ml;d:100μg/ml。
图6为流式细胞术检测紫苏抗肿瘤多肽对hepg2细胞的促凋亡作用;a:空白对照;b:6.25μg/ml;c:25μg/ml;d:100μg/ml。
具体实施方式
为使本发明的目的、技术方案及优点更加清楚明白,以下结合附图和实施例,对本发明进行进一步的详细说明。此处所描述的具体实施例仅用于解释本发明,并不用于限定发明。
一种紫苏抗肿瘤多肽的制备方法,其特征在于,包括以下步骤:
step1、收集成熟的紫苏籽,去除杂质,低温压榨脱油后将紫苏饼粕捣碎,取捣碎后的紫苏饼粕置于索氏提取的纸筒中,采用石油醚于50℃回流去除残油,待浸出的石油醚为无色时停止加热,冷却至室温后将脱脂后的紫苏饼粕倒出,用粉碎机粉碎后过60目筛子,得脱脂紫苏粉;
step2、采用超声波辅助碱溶酸沉法从脱脂紫苏粉中分离提取紫苏蛋白,具体为:用蒸馏水将脱脂紫苏粉浸泡溶胀,调节料液比1:10,ph值为9,在超声波作用下使脱脂紫苏粉中的蛋白质充分溶解,超声功率200w,超声时间32min,然后在5000rpm下离心5min收集上清液,用稀盐酸调节上清液的ph为3~4,达到蛋白的等电点,离心收集沉淀,将沉淀用水清洗2次,调节ph至中性,经冷冻干燥后得紫苏分离蛋白;
step3、采用碱性蛋白酶alcalase对紫苏分离蛋白进行酶解,酶解工艺条件为:底物质量浓度30g/l,ph9.5,酶解温度60℃,碱性蛋白酶alcalase用量为step2获得的紫苏分离蛋白重量的7%,酶解时间4h,酶解结束后100℃水浴灭活5min,5000rpm离心5min后取上清,即为紫苏蛋白酶解产物;
step4、使用装有截留分子量为3kda超滤膜的amiconultra-15离心超滤管对紫苏蛋白酶解产物进行分离,离心机转速为8000rpm,离心时间25min,收集超滤液;
step5、采用biotage快速制备液相色谱全自动纯化系统对超滤液分离纯化,色谱柱为sephadexg-15,洗脱液为0.1mol/l的nacl,流速1ml/min,检测波长280nm,洗脱曲线如图1所示,收集洗脱峰3,冷冻干燥得紫苏抗肿瘤多肽,本实施例中将紫苏抗肿瘤多肽命名为psp3。
对实施例1中得到的紫苏抗肿瘤多肽psp3进行高效液相色谱分析和质谱分析
(1)采用反相高效液相色谱(rp-hplc)分析紫苏抗肿瘤多肽psp3的纯度,将样品溶解于水中,浓度为0.5mg/ml,色谱柱为sinochromods-bp5μm(4.6mm*200mm),流动相为水和乙腈(含0.1%三氟乙酸),进样量为20μl。参数设定为:流速1.0ml/min;乙腈的线性梯度5%-40%;时间60min;检测波长280nm,由图2所示的液相色谱结果表明,该紫苏抗肿瘤多肽具有较高的纯度。
(2)用质谱法测定紫苏抗肿瘤多肽psp3的分子量,将样品紫苏溶液稀释为0.125mg/ml的样品,取10μl样品注入质谱仪测定其分子量,离子化方式:电喷雾离子源;扫描模式:正离子扫描,检测范围50-1000m/z;干燥气温度:300℃;干燥气流量10l/min;雾化气压力:40psig;毛细管电压:4000v;毛细管出口电压70v,由图3质谱结果可知,该紫苏抗肿瘤多肽的分子量为715.33da。
对实施例1制得的紫苏抗肿瘤多肽进行抗肿瘤活性研究(体外实验)
(1)采用mtt法检测紫苏抗肿瘤多肽psp3对人肝癌细胞细胞hepg2的抑制率,取对数生长期的hepg2细胞,制备成细胞浓度为5×104的细胞悬液,接种到96孔板中,每孔加如100μl细胞悬液,每个样本做6个重复,置于37℃,5%co2培养箱中培养24小时,吸去培养液,pbs清洗2次,用完全培养基将样品配置成不同的浓度(6.25、12.5、25、50、100μg/ml),每孔加入200μl上述浓度的样品,阳性对照组加入相同量的含10μg/ml紫杉醇的培养基,阴性对照组加入相同量的培养基。将96孔板置于37℃,5%co2培养箱中培养24小时,然后每孔加入5mg/ml的mtt20μl,继续培养4h,吸去培养基,每孔加入dmso50μl,摇床轻轻混匀10min。酶标仪490nm处测定吸光度值。由公式(1)计算样品对肿瘤细胞的抑制率。
(2)hoechst33258染色法检测紫苏抗肿瘤多肽psp3对hepg2细胞的促凋亡作用,分别将空白对照组和样品浓度为6.25、25、100μg/ml处理的hepg2细胞收集到离心管中,1000rpm,4℃下离心5min,去上清,加入0.5ml4%的多聚甲醛溶液缓慢悬浮细胞,固定10min后,取100μl细胞悬液涂布于载玻片上,自然晾干,用pbs溶液浸洗5min,重复三次,加500μl10μg/ml的hoechst33258染色液,室温避光染色10min,pbs溶液浸洗3次,用抗荧光淬灭的封片液封片,荧光显微镜观察。
(3)annexinv-fitc/pi双染色法检测紫苏抗肿瘤多肽psp3对hepg2细胞的促凋亡作用,取对数生长期的hepg2细胞,接种到6孔板中,过夜培养,待细胞贴壁后,吸去培养液,加入样品浓度为0、6.25、25、100μg/ml的培养基。培养24h后,用不含edta的胰蛋白酶消化,室温2000rpm离心5min收集细胞,用pbs洗涤两次,加入300μl的bindingbuffer悬浮细胞,加入5μl的annexinv-fitc室温避光染色15min,然后加入5μl的pi染色5min再加入200μl的bindingbuffer,用流式细胞仪检测细胞凋亡情况。
经本实施例测定,紫苏抗肿瘤多肽psp3在体外对人肝癌细胞细胞hepg2具有较强的抑制作用,由图4可以看出,抗肿瘤多肽psp3对hepg2细胞的抑制作用随着处理浓度的增加而增加,当浓度达到100μg/ml时,其抑制率达到了90%以上,基本接近阳性对照物紫杉醇的抑制效果。由图5可以看出,空白对照组的细胞形态完整均匀,呈现淡蓝色荧光,无凋亡现象。而紫苏抗肿瘤多肽psp3处理组均有亮蓝色强荧光出现,随着处理浓度的增加,呈现亮蓝色荧光的细胞数液随着增加,且明显可见细胞核凝聚、断裂、边缘化。在高浓度样品处理组中出现了明显的强荧光碎片,表明hepg2细胞已进入凋亡的晚期,染色体断裂成碎片形成凋亡小体。由图6可以看出,随着处理浓度的增加,左下象限的活细胞数量逐渐减少,右下象限和右上象限的细胞数量明显增多,由表1可见,凋亡率依次为:7.4%、16.7%、28.3%、52.5%,处理组明显高于对照组,且呈剂量依赖性。
表1
综述,本发明制得紫苏抗肿瘤多肽表明对人肝癌细胞hepg2的增殖具有较强的抑制作用,当浓度达到100μg/ml时,其抑制率达到了90%以上,基本接近抗癌药紫杉醇的抑制效果。
本发明的技术方案不限于上述具体实施例的限制,凡是根据本发明的技术方案做出的技术变形,均落入本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!