一种乙酰胆碱受体簇集稳定表达的细胞模型及应用方法与流程
本发明属于细胞模型
技术领域:
,尤其涉及一种乙酰胆碱受体簇集稳定表达的细胞模型及应用方法。
背景技术:
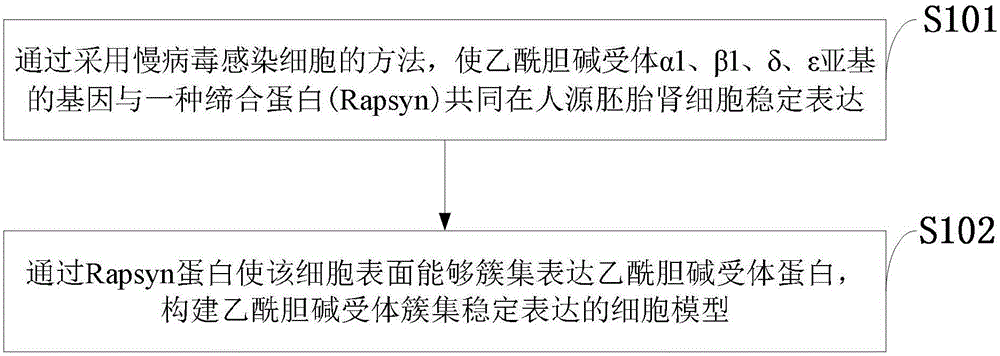
:目前,业内常用的现有技术是这样的:重症肌无力(myastheniagravis,mg)是一种由自身抗体所介导的横纹肌神经-肌肉接头处神经递质信号传递障碍的自身免疫性疾病,发病机制与抗乙酰胆碱受体(acetylcholinereceptorantibody,achr)抗体密切相关,其发病年龄广、致残率高、易复发、预后差等特点严重威胁人类的健康。到日前为止,国内外有关achr抗体的检测方法主要有放射免疫沉淀试验、酶联免疫吸附法(elisa法)及免疫荧光测量法。1)放射免疫沉淀法:灵敏度较高,但有部分患者血清中难以查到抗体,该方法仅利用部分乙酰胆碱受体作为抗原,无法真实模拟细胞表面簇集的乙酰胆碱受体,因而利用该方法检测,许多重症肌无力患者血清乙酰胆碱受体抗体表现为阴性或低滴度。同时,该方法操作相对复杂,也很难同时进行大量样本的检测。2)elisa法:elisa技术是目前国内外临床检测achr抗体的主要方法之一。该法虽具有方便、快捷、无放射性等特点,但该法依然无法再现人体内细胞表面乙酰胆碱受体抗原抗体反应的微环境,因此利用elisa法检测,仍然存在部分确诊重症肌无力的患者出现乙酰胆碱受体抗体阴性的情况;而且目前商品化试剂盒多,各公司产品敏感度存在差异,很难实行统一标准,不同厂家和型号的试剂盒验出的结果不具有良好的可比性。3)免疫荧光测量法:主要包括荧光素酶免疫系统法和免疫荧光分析法。与放射免疫沉淀法和elisa等方法相比,其敏感性相对较差,应用价值更为有限。当前,由于上述原因,有20%左右的患者采用上述方法不能检测出血清乙酰胆碱受体抗体。因此,建立敏感度高、实验性血清乙酰胆碱受体抗体检测方法是提高重症肌无力诊断的有效途径,也是目前临床迫切需要解决的问题。综上所述,现有技术存在的问题是:现有抗体检测技术存在敏感度低的重要缺陷,无法有效地再现人体内细胞表面乙酰胆碱受体抗原抗体反应的微环境,因而不能有效检测出重症肌无力患者血清内的乙酰胆碱受体抗体。另外,国内外采用elisa法检测抗体时固相载体包被的抗原质量有差异,影响检测结果。包被的抗原浓度要求控制于最适稀释浓度,包被浓度过高则结合的抗体洗脱的概率也越高,而浓度过低则不能达到检测要求。上述多种原因造成目前抗体检测阳性率低,对重症肌无力诊断的准确度较低。解决上述技术问题的难度和意义:近年,由于20%的重症肌无力患者血清抗体无法用常规的临床检测方法检出,这些患者的临床诊治严重滞后和受限。虽然已有研究表明基于细胞的抗体检测方法(cell-basedassays,cba)可以提高重症肌无力患者血清抗体阳性检出率,但遗憾的是目前现有的重症肌无力的细胞模型无法稳定表达乙酰胆碱受体簇集,每次检测均需重新转染质粒,耗费大量的时间和支出成本,并且无法保证了细胞模型的稳定性和均一性,无法在临床上广泛推广。因此,建立乙酰胆碱受体簇集抗原表达稳定的、敏感度高的、实验性血清乙酰胆碱受体抗体检测方法是提高重症肌无力诊断的有效途径,也是目前临床迫切需要解决的问题,对于提高临床诊断率、发掘可干预的药物治疗靶点具有重要意义。技术实现要素:针对现有技术存在的问题,本发明提供了一种乙酰胆碱受体簇集稳定表达的细胞模型及应用方法,采用构建乙酰胆碱受体簇集稳定表达的细胞模型来检测血清抗体的技术,该细胞模型高度模仿了神经肌肉接头处紧密簇集的乙酰胆碱受体的三维构象,增加了结合乙酰胆碱受体的亲和度,同时增加了乙酰胆碱受体的密度,预期会显著提高阳性抗体的诊断率。与现有其他每次检测均需转染质粒的细胞模型相比,本发明节约了时间和支出成本,同时具有良好的稳定性和均一性,有较高的基础研究与临床推广价值。本发明是这样实现的,一种乙酰胆碱受体簇集稳定表达的细胞模型,所述一种乙酰胆碱受体簇集稳定表达的细胞模型为:乙酰胆碱受体簇集稳定表达的细胞模型,具体特征为创新性应用慢病毒感染细胞的方法,通过rapsyn蛋白使人源胚胎肾细胞(hek293t)表面稳定表达乙酰胆碱受体蛋白簇集,从而构建乙酰胆碱受体簇集稳定表达的细胞模型,结合抗原抗体检测biacorespr技术与免疫荧光技术检测血清乙酰胆碱受体抗体,从而提高抗体阳性检测率。本发明的另一目的在于提供一种所述乙酰胆碱受体簇集稳定表达的细胞模型的构建方法,所述乙酰胆碱受体簇集稳定表达的细胞模型的构建方法通过采用慢病毒感染细胞的方法,使乙酰胆碱受体α1、β1、δ、ε亚基基因与一种缔合蛋白(rapsyn)的基因在人源胚肾细胞稳定表达,通过rapsyn蛋白使该细胞表面能够稳定表达乙酰胆碱受体蛋白簇集,构建乙酰胆碱受体簇集稳定表达的细胞模型。进一步,所述乙酰胆碱受体簇集稳定表达的细胞模型的构建方法包括以下步骤:(1)慢病毒构建;(2)稳定表达achr细胞株的构建与筛选。进一步,慢病毒构建包括以下步骤:1)过表达achr质粒制备:人源性achrα1,β1,rapsn序列构建于cmv-mcs-pgk-puro质粒(phy-008chrna1-p2a-chrnb1-t2a-rapsn,参见图2),achrδ,ε序列构建于cmv-mcs-pgk-blasiticin质粒(phy-009chrnd-t2a-chrne,见图3),测序鉴定序列;扩增目的片段,将回收的目的基因进行双酶切,将过表达载体部分与目的片段连接;2)过表达achr慢病毒包装:使用依赖型成上皮样细胞,将构建好的过表达慢病毒载体及2个辅助包装载体质粒(比例浓度4:1.5:1.5)共转染,加入pei促进载体进入工具细胞;静置15min后加入到培养的上皮样细胞培养液体系;完成感染后,12h后加入enhancingbuffer,4h后更换新鲜培养液,继续培养48h后收集富含慢病毒颗粒的细胞上清液;3)过表达achr慢病毒浓缩收集:换液48h后,吸取细胞上清液于50ml离心管,4℃,4500g离心5min,上清液用0.45μm滤器过滤后转移到新的离心管中,最后将滤液分批转移到centrifugalfilterdevices中,4℃,4500g,离心10min,弃下层的液体于盛有消毒液的废液杯中,最后一次4℃,4500g,离心20min,此时可见滤器上层中的液体即为病毒浓缩液。进一步,稳定细胞系筛选与建立的具体步骤为:1)细胞载体培养与传代:采用人胚胎肾细胞(hek293t)细胞,生长在dmem完全培养基中,放在37℃恒温,二氧化碳培养箱中,每2-3天传代一次,每次按照1传4或1传5比例进行。2)细胞载体感染过表达achr慢病毒:以合适的比例(聚合度约为30%左右,遇到生长较快或慢的细胞,聚合度应适当降低或增加)接种靶细胞于6孔板中。感染前,病毒原液从-80℃冰箱取出后冰浴融化,用含8μg/mlpolybrene的新鲜培养基按合适的moi值稀释病毒原液,吸除6孔板里旧培养基,加含有慢病毒稀释液到靶细胞中,换液时间可根据细胞状态可适当延长(通常为4-8h);3)稳定过表达achr细胞系的筛选:细胞聚合度约为80%-90%时,可传到t25培养瓶中;加入含5μg/mlpuromycin和blasticidin的培养液进行稳定表达achr细胞株筛选,培养2周;二氧化碳培养箱中37℃培养72h后按照1:10的比例将转染细胞传代,后通过有限稀释法挑取单克隆;westernblot(elisa)与pcr检测蛋白、分子的表达情况,挑取多个单克隆进行表达检测,筛选出表达量最高的克隆传代保存。4)有限稀释法扩增稳定过表达achr的细胞系:将细胞消化下来做连续的10倍稀释,每稀释一梯度都在9孔板中培养,生长一周左右再次挑取单克隆进行培养,如此反复3次。本发明的另一目的在于提供一种所述的乙酰胆碱受体簇集稳定表达的细胞模型的应用方法,所述乙酰胆碱受体簇集稳定表达的细胞模型的应用方法包括免疫荧光技术、流式细胞技术和biacorespr技术检测抗体表达,所述免疫荧光技术检测抗体表达包括以下步骤:1)稳定表达achr细胞株经胰酶消化后种于经pll包被的细胞爬片,24h后细胞贴壁,使用4%pfa固定20min,pbs洗3次;2)使用含3%bsa和0.2%triton的封闭液封闭1h,加入血清标本(1:100)和achrδ抗体(1:100),4℃过夜孵育;3)pbs洗3次,孵育荧光二抗,分别为:dylight488(标记血清-细胞结合)、alexaflour594(标记稳定表达achr细胞)和hoechst,混匀后室温孵育45min;4)pbs洗3次,封片,避光干燥后荧光显微镜成像,根据转染荧光强度及共定位情况判断结果。所述流式细胞技术检测抗体表达包括以下步骤:1)将稳定表达achr细胞铺板于6孔板中,调整密度为1×106/孔,预冷的pbs重悬;2)100μlpbs重悬并孵育血清(1:200)和achrδ抗体(1:200),室温孵育20min后预冷的pbs洗2次;3)间接标记流式荧光二抗:dylight488(标记血清-细胞结合)和apc(标记稳定表达achr细胞),室温避光孵育20min;4)预冷的pbs洗2次后400μlpbs重悬,转移至流式管中,上机检测。所述biacorespr技术测抗体表达包括以下步骤:1)将样品溶解在不同ph值的缓冲液中,使其带上不同量的电荷;2)将样品流过芯片表面,观察它与芯片的结合曲线,判断出合适的条件;3)将抗体用不同ph值的缓冲液稀释10-40倍,以5μl/m的流速流过芯片表面,观察抗体与芯片的吸附结果。4)取100μlnhs和100μledc混合,取150μl按预结合的比例稀释后的偶联蛋白,取100μlethanolaminehcl,将以上试剂平衡到室温25摄氏度左右,高速离心五分钟;5)将上述三种试剂放在样品架上,设定加样流速为10μl/min,inject方式进样,分别上样nhs/edc100μl,样品100μl和ethanolamine-hcl60μl;6)将抗原用合适的缓冲液稀释成适当浓度,离心后上样,观察抗原抗体结合过程;7)设置阴性对照与阳性对照进行biacore方法学抗体检测,定量分析抗体的表达。综上所述,本发明的优点及积极效果为:本发明通过采用慢病毒感染细胞的方法,使乙酰胆碱受体α1、β1、δ、ε亚基基因与一种缔合蛋白(rapsyn)的基因在人源胚肾细胞(hek293t)稳定表达,通过rapsyn蛋白使该细胞表面能够稳定表达乙酰胆碱受体蛋白簇集(clustered-achr),从而构建乙酰胆碱受体簇集稳定表达的细胞模型,结合抗原抗体检测免疫荧光技术、流式细胞技术和biacorespr技术检测血清乙酰胆碱受体抗体,从而提高抗体阳性检测率。本发明创新性地利用了慢病毒成功构建了簇集表达乙酰胆碱受体稳定的细胞模型,高度模仿了神经肌肉接头处的紧密簇集乙酰胆碱受体的三维构象,增加了结合乙酰胆碱受体的亲和度,同时增加了乙酰胆碱受体的密度,预期会显著提高阳性抗体的诊断率,目前国内无相关报道。同目前常用的酶联免疫吸附法(elisa方法)相比,该方法预期可以大大提高血清阴性重症肌无力患者的抗体阳性检出率,与现有其他每次检测均需转染质粒的细胞模型相比,本发明节约了时间和支出成本,同时具有良好的稳定性和均一性,有很大的基础研究与临床推广价值。附图说明图1是本发明实施例提供的乙酰胆碱受体簇集稳定表达的细胞模型构建方法流程图。图2是本发明实施例提供的慢病毒质粒phy-008chrna1-p2a-chrnb1-t2a-rapsn结构图。图3本发明实施例提供的慢病毒质粒phy-009chrnd-t2a-chrne结构图。图4是是本发明实施例提供的乙酰胆碱受体簇集表达细胞模型构建方法实现流程图。图5本发明实施例提供的稳定表达乙酰胆碱受体簇集的细胞模型检测血清achr-ab原理图。具体实施方式为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。本发明实施例提供的乙酰胆碱受体簇集稳定表达的细胞模型为:应用慢病毒感染细胞的方法,通过rapsyn蛋白使人源胚胎肾细胞(hek293t)表面稳定表达乙酰胆碱受体蛋白簇集,从而构建乙酰胆碱受体簇集稳定表达的细胞模型,结合抗原抗体检测biacorespr技术与免疫荧光技术检测血清乙酰胆碱受体抗体,从而提高抗体阳性检测率。如图1所示,本发明实施例提供的乙酰胆碱受体簇集稳定表达的细胞模型的构建方法包括以下步骤:s101:通过采用慢病毒感染细的方法,使乙酰胆碱受体α1、β1、δ、ε亚基的基因与一种缔合蛋白(rapsyn)共同在人源胚胎肾细胞稳定表达;s102:通过rapsyn蛋白使该细胞表面能够簇集表达乙酰胆碱受体蛋白,构建乙酰胆碱受体簇集稳定表达的细胞模型。本发明实施例提供的乙酰胆碱受体簇集稳定表达的细胞模型的构建方法具体包括以下步骤:(1)慢病毒构建;(2)稳定表达achr细胞株的构建与筛选。进一步,慢病毒构建包括以下步骤:1)过表达achr质粒制备:人源性achrα1,β1,rapsn序列构建于cmv-mcs-pgk-puro质粒(phy-008chrna1-p2a-chrnb1-t2a-rapsn,参见图2),achrδ,ε序列构建于cmv-mcs-pgk-blasiticin质粒(phy-009chrnd-t2a-chrne,见图3),测序鉴定序列;扩增目的片段,将回收的目的基因进行双酶切,将过表达载体部分与目的片段连接;2)过表达achr慢病毒包装:使用依赖型成上皮样细胞,将构建好的过表达慢病毒载体及2个辅助包装载体质粒(比例浓度4:1.5:1.5)共转染,加入pei促进载体进入工具细胞;静置15min后加入到培养的上皮样细胞培养液体系;完成感染后,12h后加入enhancingbuffer,4h后更换新鲜培养液,继续培养48h后收集富含慢病毒颗粒的细胞上清液;3)过表达achr慢病毒浓缩收集:换液48h后,吸取细胞上清液于50ml离心管,4℃,4500g离心5min,上清液用0.45μm滤器过滤后转移到新的离心管中,最后将滤液分批转移到centrifugalfilterdevices中,4℃,4500g,离心10min,弃下层的液体于盛有消毒液的废液杯中,最后一次4℃,4500g,离心20min,此时可见滤器上层中的液体即为病毒浓缩液。进一步,稳定细胞系筛选与建立的具体步骤为:1)细胞载体培养与传代:采用人胚胎肾细胞(hek293t)细胞,生长在dmem完全培养基中,放在37℃恒温,二氧化碳培养箱中,每2-3天传代一次,每次按照1传4或1传5比例进行。2)细胞载体感染过表达achr慢病毒:以合适的比例(聚合度约为30%左右,遇到生长较快或慢的细胞,聚合度应适当降低或增加)接种靶细胞于6孔板中。感染前,病毒原液从-80℃冰箱取出后冰浴融化,用含8μg/mlpolybrene的新鲜培养基按合适的moi值稀释病毒原液,吸除6孔板里旧培养基,加含有慢病毒稀释液到靶细胞中,换液时间可根据细胞状态可适当延长(通常为4-8h);3)稳定过表达achr细胞系的筛选:细胞聚合度约为80%-90%时,可传到t25培养瓶中;加入含5μg/mlpuromycin和blasticidin的培养液进行稳定表达achr细胞株筛选,培养2周;二氧化碳培养箱中37℃培养72h后按照1:10的比例将转染细胞传代,后通过有限稀释法挑取单克隆;westernblot(elisa)与pcr检测蛋白、分子的表达情况,挑取多个单克隆进行表达检测,筛选出表达量最高的克隆传代保存。4)有限稀释法扩增稳定过表达achr的细胞系:将细胞消化下来做连续的10倍稀释,每稀释一梯度都在9孔板中培养,生长一周左右再次挑取单克隆进行培养,如此反复3次。本发明的另一目的在于提供一种所述的乙酰胆碱受体簇集稳定表达的细胞模型的应用方法,所述乙酰胆碱受体簇集稳定表达的细胞模型的应用方法包括免疫荧光技术、流式细胞技术和biacorespr技术检测抗体表达,所述免疫荧光技术检测抗体表达包括以下步骤:1)稳定表达achr细胞株经胰酶消化后种于经pll包被的细胞爬片,24h后细胞贴壁,使用4%pfa固定20min,pbs洗3次;2)使用含3%bsa和0.2%triton的封闭液封闭1h,加入血清标本(1:100)和achrδ抗体(1:100),4℃过夜孵育;3)pbs洗3次,孵育荧光二抗,分别为:dylight488(标记血清-细胞结合)、alexaflour594(标记稳定表达achr细胞)和hoechst,混匀后室温孵育45min;4)pbs洗3次,封片,避光干燥后荧光显微镜成像,根据转染荧光强度及共定位情况判断结果。所述流式细胞技术检测抗体表达包括以下步骤:1)将稳定表达achr细胞铺板于6孔板中,调整密度为1×106/孔,预冷的pbs重悬;2)100μlpbs重悬并孵育血清(1:200)和achrδ抗体(1:200),室温孵育20min后预冷的pbs洗2次;3)间接标记流式荧光二抗:dylight488(标记血清-细胞结合)和apc(标记稳定表达achr细胞),室温避光孵育20min;4)预冷的pbs洗2次后400μlpbs重悬,转移至流式管中,上机检测。所述biacorespr技术测抗体表达包括以下步骤:1)将样品溶解在不同ph值的缓冲液中,使其带上不同量的电荷;2)将样品流过芯片表面,观察它与芯片的结合曲线,判断出合适的条件;3)将抗体用不同ph值的缓冲液稀释10-40倍,以5μl/m的流速流过芯片表面,观察抗体与芯片的吸附结果。4)取100μlnhs和100μledc混合,取150μl按预结合的比例稀释后的偶联蛋白,取100μlethanolaminehcl,将以上试剂平衡到室温25摄氏度左右,高速离心五分钟;5)将上述三种试剂放在样品架上,设定加样流速为10μl/min,inject方式进样,分别上样nhs/edc100μl,样品100μl和ethanolamine-hcl60μl;6)将抗原用合适的缓冲液稀释成适当浓度,离心后上样,观察抗原抗体结合过程;7)设置阴性对照与阳性对照进行biacore方法学抗体检测,定量分析抗体的表达。下面结合实验对本发明的应用效果作详细的描述。通过实验对细胞模型进行验证:(1)质粒表达验证(pcr验证)1)构建好含有过表达载体的菌落后在37℃恒温培养箱内过夜培养,挑选若干个单菌落,进行小量摇菌培养;2)将合成的引物稀释成终浓度为10μmol/l的储藏液(引物见后文附表);3)准备新鲜菌液2-3μ作为pcr模版,按照如下pcr体系进行扩增:模版1-2μg引物12μl引物22μlpcrmix25μlddh2o补足50μl4)pcr结束后进行琼脂糖凝胶电泳,并回收目的基因;5)将初步鉴定为阳性的样品,每个克隆挑选两个送测序公司进行测序鉴定。(2)转染蛋白表达验证(westernblot)1)收集蛋白样品,将上述转染好的细胞样品置于冰上,吸掉培养液,加入200ul2×裂解液,静置30分钟;2)将细胞样品及裂解液转移至ep管中,并放入预先开启的100℃干式恒温金属浴中,加热5分钟,使蛋白充分变性;3)冷却到室温后,安装好电泳槽与sds-page胶,加入runningbuffer后,把蛋白样品直接上样到sds-page胶加样孔内,每孔25ul样品,另选一孔加入蛋白marker1ul,之后以35ma电流电泳约1小时,直到条带达到sds–page胶底端附近;4)转膜,将滤纸、膜、胶放入蛋白转印系统,刷平后,92a、25v转膜1小时;5)将膜取出后按需要剪好,放入pbst配制的5%脱脂奶粉中,多功能脱色摇床上,室温,65rpm,1小时;6)pbst洗三遍后四种亚基及rapsn抗体4℃过夜孵育;7)pbst洗三次,在多功能脱色摇床上,室温,65rpm,每次5分钟;8)膜放入上述5%脱脂牛奶配制的1:10000驴抗鼠抗体溶液,室温,65rpm,1小时;9)pbst洗三次,多功能脱色摇床上,室温,65rpm,每次5分钟;10)显色,膜上加显色液a、b后静置1分钟后,用塑料膜包好后;使用clinxchemiscope荧光及化学发光成像系统照片;11)膜放入stripingbuffer在多功能脱色摇床上,室温,65rpm,30分钟;12)pbst洗三次,在多功能脱色摇床上,室温,65rpm,每次5分钟;13)放入pbst配制的5%脱脂奶粉中,多功能脱色摇床上,室温,65rpm,1小时;14)膜放入上述5%脱脂牛奶配制的1:3000鼠抗gadph抗体溶液,4℃,过夜;pbst洗三次,多功能脱色摇床,室温,65rpm,每次5分钟;15)膜放入上述5%脱脂牛奶配制的1:1000驴抗鼠抗体溶液,室温,65rpm,1小时;16)pbst洗三次,多功能脱色摇床上,室温,65rpm,每次5分钟;17)显色,膜上加显色液a、b后静置1分钟后,用塑料膜包好后;18)使用clinxchemiscope荧光及化学发光成像系统照片。(3)荧光染色与成像共定位验证1)慢病毒转染后的稳转细胞株经胰酶消化后种于经pll包被的细胞爬片,24h后细胞贴壁,使用4%pfa固定20min,pbs洗3次;2)使用含3%bsa和0.2%triton的封闭液封闭1h,加入血清标本(1:100)和achrδ抗体(1:100),4℃过夜孵育;3)pbs洗3次,孵育荧光二抗,分别为:dylight488(标记血清-细胞结合)、alexaflour594(标记稳转细胞)和hoechst,混匀后室温孵育45min;4)pbs洗3次,封片,避光干燥后荧光显微镜成像,根据转染荧光强度及共定位情况判断结果。(4)荧光结果判定根据转染荧光强度及共定位情况记为0-4分:0分:转染细胞无任何红色染色标记;0.5分:个别转染细胞有非常弱的红色染色标记,但没有明显荧光共定位;1分:小于20%的转染细胞有红色荧光,并有较弱的荧光共定位;2分:转染细胞的20-50%有中等强度荧光共定位;3分:转染细胞的50-80%有中等强度荧光共定位;4分:转染细胞的80%以上有中等强度荧光共定位。2-4分组在以上标准基础上若荧光较暗淡则减1分,荧光强而明亮加1分。每个标本做两次取平均值为该标本得分。测序引物引物序列cmv-fcgcaaatgggcggtaggcgtgpgk-rctaccggtggatgtggaatghy-kl-00525-m1ggaagcactccgtgacctattchy-kl-00525-m2agaccaggagtctaacaatgcghy-kl-00525-m3acattagcgtcgtggtgtcctchy-kl-00525-m4aatgcccctttgggtccgtcaghy-kl-00525-m5gggcaggaccagaccaagaag表1.图2质粒pcr鉴定引物表测序引物引物序列cmv-fcgcaaatgggcggtaggcgtgpgk-rctaccggtggatgtggaatghy-kl-00526-m1ccgtggagtggatcatcattghy-kl-00526-m2cctgggatacatctccaaggchy-kl-00526-m3gattaccgactcaactacagchy-kl-00526-m4gtgctgctcgcctacttcctgc表2.图3质粒pcr鉴定引物表以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1