治疗G蛋白偶联受体介导的病症的组合物和方法与流程
相关申请
本申请要求2017年6月16日提交的美国临时申请第62/520,812号的优先权的权益,其全部内容通过引用合并于此。
联邦资助研究的声明
本发明在政府支持下完成,由美国国立卫生研究院资助(项目编号:r01ns054791和mh18501)。政府享有本发明的某些权力。
背景技术:
包括慢性瘙痒(例如,瘙痒)、炎症、自身免疫性、皮肤病和药物副作用在内的g蛋白偶联受体介导的疾病造成痛苦。关于g蛋白偶联受体介导的疾病的病理学,大多是未知的。亟需治疗g蛋白偶联受体介导的疾病。
技术实现要素:
本发明部分地基于对新颖g蛋白偶联受体——人mrgprx4和鼠mrgpra1——的鉴别。mrgprx4和mrgpra1在具体类型的固有免疫细胞内被表达,介导史蒂文斯-约翰逊综合征(stevensjohnsonsyndromes(sjs)),并且似乎牵涉入自身免疫性疾病中。mrgprx4和mrgpra被包括拉莫三嗪(lamotrigine)和别嘌呤醇(allopurinol)在内的多种造成sjs的药物活化。此外,mrgprx4和mrgpra也在感觉神经元内被表达,且对于瘙痒感和胆汁淤积性瘙痒来说是重要的。在一些具体例中,mrgprx4和mrgpra1是胆红素的受体。如本文所述,在这一发现之前,尚未有胆红素受体被鉴别。在一些具体例中,人mrgprx4是sjs、自身免疫性疾病如多发性硬化、胆汁淤积性瘙痒和其它慢性瘙痒症的药物靶点。如本文所述,在这一发现之前,mrgprx4在任何生物学过程和疾病中扮演的角色完全未知。在一些具体例中,使用基于表达mrgprx4的细胞(mrgprx4细胞系和cdna,以及mrgpra1突变鼠系)的试验来筛选并测试以这些反应为靶向的药物。如本文所述,表达mrgprx4的细胞系是全新的,且用于药物筛选的高通量筛选。在一些具体例中,阻断mrgprx4是治疗sjs;自身免疫性疾病如多发性硬化;以及胆汁淤积性瘙痒和其它慢性瘙痒症的新颖途径。
在一个优选的方面,提供一种筛选药剂的方法,所述药剂调节一种或多种g蛋白偶联受体介导的病症或疾病,所述方法包含:(1)令一个或多个表达g蛋白偶联受体的细胞与候选药剂接触;以及(2)检测所述一个或多个细胞的应答,从而选择用于评估的所述药剂来调节g蛋白偶联受体介导的病症或疾病。适当地,将所述细胞的应答检测为所述g蛋白偶联受体的活化。该方法还可包括确定所述候选药剂是否调节所述g蛋白偶联受体介导的病症或疾病。
本发明也部分地基于下述发现,人mrgprx3及其鼠同族体mrgpra6在角化细胞、上皮细胞和背根神经节(drg)中的初级感觉神经元内被表达。还发现,抗微生物肽防御素和抗菌肽(cathelicidin)是mrgprx3和mrgpra6的激动剂。防御素和抗菌肽可在多种疾病和病症中扮演角色,该疾病和病症包括创伤愈合、慢性炎症、恶性转化、皮肤病如银屑病和皮炎、呼吸道疾病、消化道和胃肠道疾病、疼痛和瘙痒。在一些具体例中,以mrgprx3和mrgpra6为靶向治疗创伤愈合、慢性炎症、恶性转化、皮肤病如银屑病和皮炎、呼吸道疾病、消化道和胃肠道疾病、疼痛和瘙痒。如本文所述,mrgprx3在任何生物学过程和疾病中扮演的角色完全未知。在一些具体例中,使用基于表达mrgprx3的细胞的试验和mrgpra6突变小鼠来筛选并测试以这些反应为靶向的药物。如本文所述,表达mrgprx3的细胞系是新颖的,且用于药物筛选的高通量筛选。
本文还提供使用基于表达mrgprx3和mrgprx4的细胞的试验来筛选以这些受体为靶向的药物的方法。本发明还提供用于候选药物的高通量筛选的表达mrgprx3和mrgprx4的细胞系。在一些具体例中,阻断mrgprx4治疗了药物副作用(例如,sjs)、胆汁淤积性瘙痒和其它慢性瘙痒症、以及自身免疫性疾病(例如,多发性硬化)。在一些具体例中,以mrgprx3治疗了创伤愈合、慢性炎症、恶性转化、皮肤病如银屑病和皮炎、呼吸道和胃肠道疾病、疼痛和瘙痒。
本发明也部分地基于包含重组核酸的单离细胞,所述重组核酸表达mas相关的g蛋白偶联受体成员x3(mrgprx3)或mrgprx4。例如,重组核酸表达mrgprx3。另选地,重组核酸表达mrgprx4。在其它情况下,表达mrgprx3的重组核酸包含一个或多个突变。例如,所述一个或多个突变产生不能活化信号转导通道的mrgprx3蛋白。另选地,表达mrgprx4的重组核酸包含一个或多个突变。例如,所述一个或多个突变产生不能活化信号转导通道的mrgprx4蛋白。在一些具体例中,所述细胞选自免疫细胞、神经细胞和皮肤细胞。在一些具体例中,所述免疫细胞选自固有免疫细胞。在一些具体例中,所述细胞选自干细胞。在一些具体例中,所述细胞选自细胞系。在一些具体例中,所述细胞是初级细胞。在一些具体例中,所述细胞获自哺乳动物。在一些具体例中,所述神经细胞由背根神经节中的初级感觉神经元组成。在一些具体例中,所述免疫细胞由树突细胞组成。在一些具体例中,mrpgrx4和mrpgra1在树突细胞内和背根神经节中的初级感觉神经元内被表达。在一些具体例中,所述皮肤细胞是角化细胞。
本发明也部分地基于重组核酸,所述重组核酸表达mas相关的g蛋白偶联受体成员x3(mrgprx3)或mrgprx4。例如,重组核酸是表达载体并表达mrgprx3。另选地,重组核酸表达mrgprx4。在其它情况下,表达mrgprx3的重组核酸包含一个或多个突变。例如,所述一个或多个突变产生不能活化信号转导通道的mrgprx3蛋白。另选地,表达mrgprx4的重组核酸包含一个或多个突变。例如,所述一个或多个突变产生不能活化信号转导通道的mrgprx4蛋白。在一些具体例中,载体包含核酸序列的,所述核酸序列编码mas相关的g蛋白偶联受体成员x3(mrgprx3)或mrgpra6。在一些具体例中,载体包含核酸序列,所述核酸序列编码包含一个或多个突变的mrgprx3核酸序列。在一些具体例中,载体包含核酸序列,所述核酸序列编码包含一个或多个突变的mrgpra6核酸序列。在一些具体例中,载体包含核酸序列的,所述核酸序列编码mas相关的g蛋白偶联受体成员x4(mrgprx4)或mrgpra1。在一些具体例中,载体包含核酸序列,所述核酸序列编码包含一个或多个突变的mrgprx4核酸序列。在一些具体例中,载体包含核酸序列,所述核酸序列编码包含一个或多个突变的mrgpra1核酸序列。
本文提供筛选调节g蛋白偶联受体介导的病症或疾病的药物的方法,所述方法包括:令表达g蛋白偶联受体的细胞与候选药剂接触;检测g蛋白偶联受体介导的活化;确定所述候选药剂是否调节g蛋白偶联受体介导的病症或疾病。在一些具体例中,g蛋白偶联受体基因选自mrgprx4和mrgprx3。在一些具体例中,g蛋白偶联受体介导的病症选自药物副作用、自身免疫性疾病、多发性硬化、疼痛、瘙痒、胆汁淤积性瘙痒、炎症、恶性转化、皮肤病和创伤愈合。在一些具体例中,所述细胞选自免疫细胞、神经细胞和皮肤细胞。在一些具体例中,所述免疫细胞选自固有免疫细胞。在一些具体例中,所述细胞选自干细胞。在一些具体例中,所述细胞选自细胞系。在一些具体例中,所述细胞是初级细胞。在一些具体例中,所述细胞获自哺乳动物。在一些具体例中,所述神经细胞由背根神经节中的初级感觉神经元组成。在一些具体例中,所述免疫细胞由树突细胞组成。在一些具体例中,mrpgrx4和mrpgra1在树突细胞内和背根神经节中的初级感觉神经元内被表达。在一些具体例中,所述皮肤细胞是角化细胞。在一些具体例中,通过鉴别细胞内钙的增加来检测mrgprx3或mrgprx4的活化。
本文还提供治疗受试者体内g蛋白偶联受体介导的病症的方法,所述方法包括将mrgprx3拮抗剂和/或mrgpra6拮抗剂给药至受试者,从而治疗g蛋白偶联受体介导的病症。在一些具体例中,g蛋白偶联受体介导的病症选自疼痛、瘙痒、胆汁淤积性瘙痒、炎症、恶性转化、皮肤病和创伤愈合。
还提供治疗受试者体内g蛋白偶联受体介导的病症的方法,所述方法包括将mrgprx3拮抗剂和/或mrgpra6激动剂给药至受试者,从而治疗g蛋白偶联受体介导的病症。在一些具体例中,g蛋白偶联受体介导的病症选自疼痛、瘙痒、胆汁淤积性瘙痒、炎症和皮肤病(例如,银屑病和过敏性皮炎)。
在此类方法的一些具体例中,拮抗剂或激动剂包含抗体或其片段、结合蛋白、多肽、或它们的任意组合。在一些具体例中,拮抗剂或激动剂包含小分子。在一些具体例中,拮抗剂或激动剂包含核酸分子。在一些具体例中,核酸分子包含双链核糖核酸(dsrna)、小发夹rna和短发夹rna(shrna)、或反义rna、或它们的任何部分。在此类方法的一些具体例中,拮抗剂或激动剂的给药在将所述化合物给药至受试者之前、与之同步或之后。在一些具体例中,拮抗剂或激动剂是外用给药、口服给药、经吸入给药或经注射给药。
本文还提供治疗受试者体内g蛋白偶联受体介导的病症的方法,所述方法包括将mrgprx4或mrgpra1拮抗剂给药至受试者,从而治疗g蛋白偶联受体介导的病症。在此类方法的一些具体例中,g蛋白偶联受体介导的病症选自药物副作用如史蒂文斯-约翰逊综合征(sjs)和中毒性表皮坏死松解症(ten)、自身免疫性疾病、多发性硬化、疼痛、瘙痒和胆汁淤积性瘙痒。
还提供治疗受试者体内g蛋白偶联受体介导的病症的方法,所述方法包括将mrgprx4或mrgpra1激动剂给药至受试者,从而治疗g蛋白偶联受体介导的病症。在此类方法的一些具体例中,g蛋白偶联受体介导的病症选自药物副作用、自身免疫性疾病、瘙痒和胆汁淤积性瘙痒。
在此类方法的一些具体例中,拮抗剂或激动剂包含抗体或其片段、结合蛋白、多肽、或它们的任意组合。在一些具体例中,拮抗剂包含小分子。在一些具体例中,拮抗剂或激动剂包含核酸分子。在一些具体例中,核酸分子包含双链核糖核酸(dsrna)、小发夹rna和短发夹rna(shrna)、或反义rna、或它们的任何部分。在一些具体例中,拮抗剂或激动剂的给药在将所述化合物给药至受试者之前、与之同步或之后。在此类方法的一些具体例中,拮抗剂或激动剂是外用给药、口服给药、经吸入给药或经注射给药。
本文还提供减轻受试者体内由给药化合物诱发的药物副作用的严重性的方法,所述方法包括:将所述化合物给药至受试者;将mrgpra1或mrgprx4拮抗剂或激动剂给药至所述受试者,从而减轻所述受试者体内的药物副作用的严重性。
本文还提供确定受试者是否具有增加的发展出对于化合物的药物副作用的风险的方法,所述方法包括:从具有或处于发展出对化合物的药物副作用风险下的受试者获得测试样本;测定所述测试样本内至少一种g蛋白偶联受体基因的表达水平;将所述测试样品中所述g蛋白偶联受体基因的表达水平与参考样品中所述g蛋白偶联受体基因的表达水平比较;以及如果所述测试样本中所示g蛋白偶联受体基因的表达水平不同于所述参考样本中所示g蛋白偶联受体基因的表达水平,则确定给药所述化合物至所述患者将诱发药物副作用。在一些具体例中,g蛋白偶联受体基因是mrgpra1或mrgprx4。在一些具体例中中,mrgpra1或mrgprx4是突变体。
本文还提供用于治疗g蛋白偶联受体介导的病症或疾病的药物组合物,所述组合物包含有效量的g蛋白偶联受体拮抗剂或激动剂。在一些具体例中,g蛋白偶联受体拮抗剂是mrgprx4或mrgprx3拮抗剂,或者是mrgprx3、mrgprx4和其它mrgpr成员的双重/多重(dual/multivalent)拮抗剂。在某些其它具体例中,g蛋白偶联受体激动剂是mrgprx4或mrgprx3激动剂。在一些具体例中,拮抗剂或激动剂选自抗体或其片段、结合蛋白、多肽、小分子、核酸、或它们的任意组合组成的组。在一些具体例中,拮抗剂或激动剂是外用给药、口服给药、经吸入给药或经注射给药。在一些具体例中,g蛋白偶联受体介导的病症或疾病选自药物副作用、自身免疫性疾病、多发性硬化、疼痛、瘙痒、胆汁淤积性瘙痒、炎症、恶性转化、皮肤病和创伤愈合。
还提供试剂盒,所述试剂盒包括1)本文公开的药物组合物,以及2)用于治疗所述g蛋白偶联受体病症或疾病的书面使用说明。药物组合物可适当地包含有效量的g蛋白偶联受体拮抗剂如mrgprx4或mrgprx3拮抗剂。在一些具体例中,药物组合物可适当地包含有效量的g蛋白偶联受体拮抗剂如mrgprx4或mrgprx3激动剂。书面使用说明可以是例如标签或包装插页,其公开所述药物组合物治疗例如药物副作用、自身免疫性疾病、多发性硬化、疼痛、瘙痒、胆汁淤积性瘙痒、炎症、恶性转化、皮肤病和/或创伤愈合的使用方法。
本文还提供单离细胞的组合物,所述单离细胞包含重组核酸,所述重组核酸表达mas相关的g蛋白偶联受体成员x3(mrgprx3)或mrgpra6。在一些具体例中,重组核酸表达mrgprx3。在一些具体例中,重组核酸表达mrgpra6。在一些具体例中,表达mrgprx3的重组核酸包含一个或多个突变。在一些具体例中,所述一个或多个突变产生不能活化信号转导通道的mrgprx3蛋白。在一些具体例中,表达mrgpra6的重组核酸包含一个或多个突变。在一些具体例中,所述一个或多个突变产生不能活化信号转导通道的mrgpra6蛋白。在一些具体例中,单离细胞包括人胚胎肾293(hek293)细胞。
本文还提供单离细胞的组合物,所述单离细胞包含重组核酸,所述重组核酸表达mas相关的g蛋白偶联受体成员x4(mrgprx4)或mrgpra1。在一些具体例中,重组核酸表达mrgprx4。在一些具体例中,重组核酸表达mrgpra1。在一些具体例中,表达mrgprx4的重组核酸包含一个或多个突变。在一些具体例中,所述一个或多个突变产生不能活化信号转导通道的mrgprx4蛋白。在一些具体例中,表达mrgpra1的重组核酸包含一个或多个突变。在一些具体例中,所述一个或多个突变产生不能活化信号转导通道的mrgpra1蛋白。在一些具体例中,单离细胞包括人胚胎肾293(hek293)细胞。
本文还提供鉴别mrgprx3或mrgpra6的拮抗剂的方法,所述方法包括:令单离细胞(例如,包含重组核酸的单离细胞,所述重组核酸表达mas相关的g蛋白偶联受体成员x3(mrgprx3)或mrgpra6)与诱发假变态类型反应的化合物接触,令所述单离细胞与候选拮抗剂接触,检测mrgprx3或mrgpra6的活化,其中mrgprx3或mrgpra6的活化相对于不存在所述化合物时mrgprx3或mrgpra6的活化降低,则确定所述候选化合物是拮抗剂。
还提供鉴别mrgprx3或mrgpra6的激动剂的方法,所述方法包括:令单离细胞(例如,包含重组核酸的单离细胞,所述重组核酸表达mas相关的g蛋白偶联受体成员x3(mrgprx3)或mrgpra6)与诱发药物副作用的化合物接触,令所述单离细胞与候选激动剂接触,检测mrgprx3或mrgpra6的活化,其中mrgprx3或mrgpra6的活化相对于不存在所述化合物(即,对照)时mrgprx3或mrgpra6的活化增加,则确定所述候选化合物是激动剂。优选地,候选激动剂将mrgprx3或mrgpra6的活化相对于不存在所述候选激动剂(对照)时的测试试验增加至少1、2、3、4或5个百分点,更优选地,候选激动剂将mrgprx3或mrgpra6的活化相对于不存在所述候选激动剂(对照)时的相同测试试验增加至少7、10、15、20、25、30、40、50、60、70、80、90或100个百分点。优选的用于评估候选激动剂的测试试验包括实施例9的试验,该试验后,可通过钙成像或肌醇磷酸酯检测来评估活化。
本文还提供鉴别mrgprx4或mrgpra1的拮抗剂的方法,所述方法包括:令单离细胞(例如,包含重组核酸的单离细胞,所述重组核酸表达mas相关的g蛋白偶联受体成员x4(mrgprx4)或mrgpra1)与诱发药物副作用的化合物接触,令所述单离细胞与候选拮抗剂接触,检测mrgprx4或mrgpra1的活化,其中mrgprx4或mrgpra1的活化相对于不存在所述化合物(即,对照)时mrgprx4或mrgpra1的活化降低,则确定所述候选化合物是拮抗剂。优选地,候选拮抗剂将mrgprx4或mrgpra1的活化相对于不存在所述候选拮抗剂(对照)时的测试试验降低至少1、2、3、4或5个百分点,更优选地,候选拮抗剂将mrgprx4或mrgpra1的活化相对于不存在所述候选拮抗剂(对照)时的相同测试试验降低至少7、10、15、20、25、30、40、50、60、70、80、90或100个百分点。优选的用于评估候选拮抗剂的测试试验包括实施例9的试验,该试验后,可通过钙成像检测来评估活化。也可通过肌醇磷酸酯检测来评估活化。
还提供鉴别mrgprx4或mrgpra1的激动剂的方法,所述方法包括:令单离细胞(例如,包含重组核酸的单离细胞,所述重组核酸表达mas相关的g蛋白偶联受体成员x4(mrgprx4)或mrgpra1)与诱发药物副作用的化合物接触,令所述单离细胞与候选激动剂接触,检测mrgprx4或mrgpra1的活化,其中mrgprx4或mrgpra1的活化相对于不存在所述化合物(即,对照)时mrgprx4或mrgpra1的活化增加,则确定所述候选化合物是激动剂。优选地,候选激动剂将mrgprx4或mrgpra1的活化相对于不存在所述候选激动剂(对照)时的测试试验增加至少1、2、3、4或5个百分点,更优选地,候选激动剂将mrgprx4或mrgpra1的活化相对于不存在所述候选激动剂(对照)时的相同测试试验增加至少7、10、15、20、25、30、40、50、60、70、80、90或100个百分点。优选的用于评估候选激动剂的测试试验包括实施例9的试验,该试验后,可通过钙成像或肌醇磷酸酯检测来评估活化。
本文提供减轻受试者体内由给药化合物诱发的g蛋白偶联受体介导的病症的严重性的方法,所述方法包括:将所述化合物给药至受试者;将mrgprx4拮抗剂、mrgprx3拮抗剂或它们的组合给药至所述受试者,从而减轻所述受试者体内的g蛋白偶联受体介导的病症的严重性。
还提供减轻受试者体内由给药化合物诱发的g蛋白偶联受体介导的病症的严重性的方法,所述方法包括:将所述化合物给药至受试者;将mrgprx4激动剂、mrgprx3激动剂或它们的组合给药至所述受试者,从而减轻所述受试者体内的g蛋白偶联受体介导的病症的严重性。
还提供减轻受试者体内由给药化合物诱发的药物副作用的严重性的方法,所述方法包括:将所述化合物给药至受试者;将mrgprx4拮抗剂给药至所述受试者,从而减轻所述受试者体内的药物副作用的严重性。
还提供减轻受试者体内创伤愈合、慢性炎症、恶性转化、皮肤病如银屑病和皮炎、呼吸道和胃肠道疾病、疼痛或瘙痒的严重性的方法;将mrgprx3拮抗剂给药至所述受试者,从而减轻受试者体内创伤愈合、慢性炎症、恶性转化、皮肤病如银屑病和皮炎、呼吸道和胃肠道疾病、疼痛和/或瘙痒的严重性。
还提供减轻受试者体内创伤愈合、慢性炎症、恶性转化、皮肤病如银屑病和皮炎、呼吸道和胃肠道疾病、疼痛或瘙痒的严重性的方法;将mrgprx3激动剂给药至所述受试者,从而减轻受试者体内创伤愈合、慢性炎症、恶性转化、皮肤病如银屑病和皮炎、呼吸道和胃肠道疾病、疼痛和/或瘙痒的严重性。
例如,本文所述的方法预防g蛋白偶联受体介导的病症或将该病症的严重性减轻至少1%,例如,至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或至少99%。
受试者优选为需要此治疗或预防措施的哺乳动物,如已经被诊断具有假变态类型反应或其倾向的受试者。哺乳动物是任何哺乳动物,例如,人、灵长动物、小鼠、大鼠、狗、猫、马、以及家畜或食用动物如牛、绵羊、猪、鸡和山羊。在优选的具体例中,哺乳动物是人。
所述抑制剂或拮抗剂或激动剂可包括但不限于,结合至其具体靶点或靶点的天然配体并调节生物学活性的核酸、肽、抗体、或小分子。
在一些情况,拮抗剂或激动剂包含小分子。小分子是质量小于2000道尔顿的化合物。小分子的分子质量优选小于1000道尔顿,更优选小于600道尔顿,如该化合物的分子质量小于500道尔顿、小于400道尔顿、小于300道尔顿、小于200道尔顿或小于100道尔顿。
小分子是有机的或无机的。例示性的有机小分子包括但不限于,脂肪族烃、醇、醛、酮、有机酸、酯、单糖、二糖、芳香烃、氨基酸和脂质。例示性的无机小分子包含微量矿物质、离子、自由基和代谢物。另选地,小分子可经合成性地工程化,以由片段、或小部分、或更长氨基酸链组成,以填充酶的结合袋。典型的小分子小于一千道尔顿。
在一些情况下,拮抗剂或激动剂包含核酸分子。例如,核糖核酸(rna)或脱氧核糖核酸(dna)抑制mrgprx3或mrgprx4的表达,从而抑制mrgprx3或mrgprx4的活性。在一些情况下,核酸包括小干扰rna(sirna)、rna干扰(rnai)、信使rna(mrna)、小发夹rna或短发夹rna(shrna)、双链核糖核酸(dsrna)、反义rna或微小microrna、或其任何部分。但是,该领域技术人员将轻易鉴别出其它抑制/对抗或活化/激动mrgprx3或mrgprx4的核酸。
如前所述,拮抗剂或激动剂可以是抗体,例如单克隆或多克隆mrgprx3或mrgprx4抗体。例如,可用作拮抗剂的mrgprx3或mrgprx4抗体包括单克隆多克隆抗体,如鼠、兔、灵长动物(例如,猴)或人源化的抗体(例如,可商购的novusbiologicals的兔多克隆mrgprx4抗体,编号nls2429;abcam的兔多克隆mrgprx4抗体b97784;abcam的大鼠多克隆mrgrpx4抗体ab188740;和thermofischer的抗mrgprx3多克隆抗体pa5-3395)。此类单克隆抗体的片段也可以是适当的拮抗剂或激动剂,包括所标注的可商购抗体的片段。用作mrgprx3或mrgprx4拮抗剂或激动剂的合适且优选的抗体片段可通过本文公开的试验轻易地鉴别。合适的片段可具有某些序列,所述序列与相对应抗体例如所标注的可商购抗体的序列一致性为至少30%、40%、50%、60%、70%、80%、90%或95%。此类片段可以是用作mrgprx3或mrgprx4拮抗剂或激动剂的完整剂,或可以共价链接至另一序列或其它分子,例如以形成含有抗体片段序列的融合分子,或含有具有合适的与相对应抗体如所标注的可商购抗体的序列一致性的序列。
也如本文所讨论,可轻易地鉴别包括小分子、多肽、抗体和抗体片段以及核酸在内的合适且优选的mrgprx4和mrgprx3拮抗剂和激动剂,包括通过本文公开的试验鉴别。
拮抗剂或激动剂的给药在将所述化合物给药至受试者之前、与之同步或之后。
可使用多种给药途径。例如,拮抗剂或激动剂是外用给药、口服给药、经吸入给药或经注射给药。
拮抗剂或激动剂的有效量是0.001mg/kg至250mg/kg体重,例如,0.001mg/kg、0.05mg/kg、0.01mg/kg、0.05mg/kg、1mg/kg、5mg/kg、10mg/kg、25mg/kg、50mg/kg、75mg/kg、100mg/kg、125mg/kg、150mg/kg、175mg/kg、200mg/kg、225mg/kg或250mg/kg体重。基本上,主治医生或兽医将决定适宜的量和给药方案。
在一些情况下,拮抗剂或激动剂的给药方案为每天至少一次、每周至少一次或每月至少一次。拮抗剂或激动剂可适当地持续给药一天、一周、一个月、两个月、三个月、六个月、九个月或一年。在一些情况下,拮抗剂每天给药,例如每24小时给药。或者,拮抗剂连续给药或每天给药若干次,例如,每1小时一次、每2小时一次、每3小时一次、每4小时一次、每5小时一次、每6小时一次、每7小时一次、每8小时一次、每9小时一次、每10小时一次、每11小时一次或每12小时一次。
确定化合物是否诱发药物副作用的方法通过以下实施:令本文所述的单离细胞与候选化合物接触,检测mrgprx4的活化,其中mrgprx4的活化确定了所述候选化合物诱发药物副作用。
例如,通过细胞内的钙水平性对于不存在该化合物时增加而鉴别mrgprx3或mrgpra6的活化。在一些情况下,细胞内的钙水平增加至少1%,例如,至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或至少99%。使用本文所述的方法或该领域技术人员可获得的那些方法测定细胞内的钙浓度。
例如,通过细胞内的钙水平性对于不存在该化合物时增加而鉴别mrgprx4或mrgpra1的活化。在一些情况下,细胞内的钙水平增加至少1%,例如,至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或至少99%。使用本文所述的方法或该领域技术人员可获得的那些方法测定细胞内的钙浓度。
筛选候选的mrgprx4拮抗剂,证实其抗衡或抑制、降低、或阻抑mrgprx4多肽的生物学活性。筛选候选的mrgprx3拮抗剂,证实其抗衡或抑制、降低、或阻抑mrgprx3多肽的生物学活性。
还提供鉴别mrgprx4或mrgprx3的拮抗剂的方法,所述方法包括:令本文所述的单离细胞与诱发假变态类型反应的化合物接触,令本文所述的单离细胞与候选拮抗剂接触,检测mrgprx3或mrgprx4的活化,其中mrgprx3或mrgprx4的活化相对于不存在所述候选拮抗剂时mrgprx3或mrgprx4的活化降低,则确定所述候选化合物是拮抗剂。优选地,候选拮抗剂将mrgprx3或mrgprx4的活化相对于不存在所述候选拮抗剂(对照)时的测试试验降低至少1、2、3、4或5个百分点,更优选地,候选拮抗剂将mrgprx3或mrgprx4的活化相对于不存在所述候选拮抗剂(对照)时的相同测试试验降低至少7、10、15、20、25、30、40、50、60、70、80、90或100个百分点。优选的用于评估候选拮抗剂的测试试验包括实施例9的试验,该试验后,可通过钙成像或肌醇磷酸酯检测来评估活化。
还提供鉴别mrgprx4或mrgprx3的激动剂的方法,所述方法包括:令本文所述的单离细胞(例如,包含重组核酸的单离细胞,所述重组核酸表达mas相关的g蛋白偶联受体成员x3(mrgprx3)或mrgprx4)与诱发假变态类型反应的化合物接触,令本文所述的单离细胞与候选激动剂接触,检测mrgprx3或mrgprx4的活化,其中mrgprx3或mrgprx4的活化相对于不存在所述候选激动剂时mrgprx3或mrgprx4的活化增加,则确定所述候选化合物是激动剂。优选地,所选择的候选激动剂将mrgprx3或mrgprx4的活化相对于不存在所述候选激动剂(对照)时的测试试验降低至少1、2、3、4或5个百分点,更优选地,候选激动剂将mrgprx3或mrgprx4的活化相对于不存在所述候选激动剂(对照)时的相同测试试验降低至少7、10、15、20、25、30、40、50、60、70、80、90或100个百分点。优选的用于评估候选激动剂的测试试验包括实施例9的试验,该试验后,可通过钙成像或肌醇磷酸酯检测来评估活化。
本文还提供治疗受试者体内的自身免疫性疾病(例如,多发性硬化)的方法,所述方法包括:鉴别正苦于自体免疫性疾病或处于发展出自体免疫性疾病风险下的受试者,以及向该受试者给药有效量的包含mrgprx4拮抗剂的组合物,从而治疗或预防受试者体内的自身免疫性疾病(例如,多发性硬化)。
例示性的自身免疫性疾病选自以下组成的组:乳糜泻、1型糖尿病、格雷福斯病(gravesdisease)、炎症性肠病、多发性硬化、银屑病、类风湿性关节炎和全身性红斑狼疮(sle或狼疮)。
本文还提供治疗受试者体内的创伤愈合的方法,所述方法包括:鉴别正经历创伤愈合或处于经历创伤愈合风险下的受试者,以及向该受试者给药有效量的包含mrgprx3拮抗剂的组合物,从而治疗或帮助受试者体内的创伤愈合。
本文还提供治疗受试者体内的皮肤病的方法,所述方法包括:鉴别正苦于皮肤病或处于发展出皮肤病风险下的受试者,以及向该受试者给药有效量的包含mrgprx3拮抗剂的组合物,从而治疗或预防受试者体内的皮肤病。
还提供治疗受试者体内的皮肤病的方法,所述方法包括:鉴别正苦于皮肤病或处于发展出皮肤病风险下的受试者,以及向该受试者给药有效量的包含mrgprx3激动剂的组合物,从而治疗或预防受试者体内的皮肤病。
例示性的通过此类方法治疗的皮肤病包括银屑病、皮炎、皮肤溃疡和癌(例如,黑素瘤)。
本文还提供治疗受试者体内的炎症(例如,慢性炎症)的方法,所述方法包括:鉴别正苦于炎症或处于发展出炎症风险下的受试者,以及向该受试者给药有效量的包含mrgprx3拮抗剂的组合物,从而治疗或预防受试者体内的炎症(例如,慢性炎症)。
例示性的炎症选自以下组成的组:慢性炎症、阑尾炎、粘液囊炎、结肠炎、膀胱炎、皮炎、静脉炎、反射交感性营养不良/复杂局部疼痛综合征(rsd/crps)、鼻炎、肌腱炎、扁桃体炎、寻常痤疮、反应性呼吸道疾病如哮喘和呼吸道感染、自身免疫性疾病、自身炎症性疾病、乳糜泻、慢性前列腺炎、憩室炎、肾小球性肾炎、化脓性汗腺炎、过敏症、肠病(包括肠道上皮疾病,如炎症性肠病如肠道易激综合征和结肠炎)、间质性膀胱炎、耳炎、盆腔炎、再灌注性损伤、风湿热、类风湿性关节炎、结节病、移植排斥和血管炎。
本文还提供治疗受试者体内的恶性转化(例如,癌症)的方法,所述方法包括:鉴别正苦于恶性转化或处于发展出恶性转化风险下的受试者,以及向该受试者给药有效量的包含mrgprx3拮抗剂的组合物,从而治疗或预防受试者体内的恶性转化(例如,癌症)。
例示性的癌症选自以下组成的组:癌、肉瘤、肿瘤、实体肿瘤、血癌、白血病、淋巴癌、皮肤癌、黑素瘤、乳腺癌、卵巢癌、子宫癌、前列腺癌、睾丸癌、结直肠癌、胃癌、肠癌、膀胱癌、肺癌、非小细胞肺癌、胰腺癌、肾细胞癌、肾癌、肝癌、肝细胞癌、脑癌、头颈癌、视网膜癌、神经胶质瘤、脂肪瘤、喉癌、甲状腺癌、成神经细胞瘤、子宫内膜癌、骨髓瘤和食道癌。
本文所述的组合物经由以下方式给药:口服给药、静脉内给药、外用给药、肠胃外给药、腹腔内给药、肌肉内给药、鞘内给药、病灶内给药、颅内给药、鼻腔给药、眼内给药、心内给药、玻璃体内给药、骨内给药、脑内给药、动脉内给药、关节内给药、皮内给药、透皮给药、经粘膜给药、舌下给药、经肠给药、唇下给药、吹入给药、栓剂给药、吸入给药或皮下给药。
定义
除非另做定义,否则本文中使用的所有科技术语均具有本发明所属领域技术人员所一般理解的意义。下述参考文献对技术人员提供本发明中使用的多个术语的一般性定义:《剑桥科技词典》(thecambridgedictionaryofscienceandtechnology(walkered.,1988));rieger等人编撰的《遗传性术语表(第五版)》(theglossaryofgenetics,5thed.,r.riegeretal.(eds.),springerverlag(1991));以及hale和marham所著《哈珀·柯林斯生物学词典》(hale&marham,theharpercollinsdictionaryofbiology(1991)).如本文中所用,除非明确排除,否则下述术语具有归于其下方的意义。
本文所述的抗体及其片段包括但不限于,多克隆抗体、单克隆抗体、嵌合抗体、dab(域抗体)、单链抗体、fab片段、fab’片段、f(ab’)2片段、fv和scfv。抗体的片段具备其对应抗体的免疫活性。在一些具体例中,抗体的片段含有1500或更少、1250ofless,1000或更少、900或更少、800或更少、700或更少、600或更少、500或更少、400或更少、300或更少、200或更少个氨基酸。例如,蛋白质或肽抑制剂含有1500或更少、1250或更少、1000或更少、900或更少、800或更少、700或更少、600或更少、500或更少、400或更少、300或更少、200或更少、100或更少、80或更少、70或更少、60或更少、50或更少、40或更少、30或更少、25或更少、20或更少、10或更少个氨基酸。例如,本发明的核酸抑制剂含有400或更少、300或更少、200或更少、150或更少、100或更少、90或更少、80或更少、70或更少、60或更少、50或更少、40或更少、35或更少、30或更少、28或更少、26或更少、24或更少、22或更少、20或更少、18或更少、16或更少、14或更少、12或更少、10或更少个核苷酸。
分子和细胞生物化学中的通用方法可见于标准教材,例如《分子克隆:实验室手册(第四版)》(molecularcloning:alaboratorymanual,4thed.(sambrooketal.,coldspringharborlaboratorypress2012));《精编分子生物学实验指南(第五版)》(shortprotocolsinmolecularbiology,5thed.(ausubeletal.eds.,johnwiley&sons2002));《蛋白质方法》(proteinmethods(bollagetal.,johnwiley&sons1996));《用于基因治疗的非病毒载体》(nonviralvectorsforgenetherapy(wagneretal.eds.,academicpress1999));《病毒载体》(viralvectors(kaplift&loewyeds.,academicpress1995));《免疫学方法手册》(immunologymethodsmanual(i.lefkovitsed.,academicpress1997));以及《细胞和组织培养:生物技术实验室操作》(cellandtissueculture:laboratoryproceduresinbiotechnology(doyle&griffiths,johnwiley&sons1998))。本公开中所指的用于基因操作的试剂、克隆载体和试剂盒可从供应商如biorad、stratagene、invitrogen、sigma-aldrich和clontech获得。
如本文中所用,术语“抗体”(ab)包括单克隆抗体、多克隆抗体、多特异性抗体(例如,双特异性抗体)和抗体片段,只要它们表现出所希望的生物学活性即可。本文中,术语“免疫球蛋白”(ig)与“抗体”互换地使用。
“单离的抗体”是已经与其天然环境的成分单离及/或自该天然环境的成分回收的抗体。抗体天然环境的污染物组分是将会干扰该抗体的诊断性或治疗性用途的材料,且可包括酶、激素和其它蛋白性或非蛋白性溶质。在优选的具体例中,该抗体被纯化:(1)至超过95重量%的抗体,如通过lowry方法所测,且最优选超过99重量%;(2)至足以通过使用旋杯式测序仪获得至少15个n端或内部氨基酸的残基的程度;或(3)至通过sds-page在还原或非还原性条件下使用考马斯蓝或优选银染色的同质性。单离的抗体包括重组细胞内的原位抗体,这是由于该抗体的天然环境的至少一种成分将不存在。但通常情况下,单离的抗体将通过至少一个纯化步骤制备。
抗体四链基本单元是由两条相同的轻(l)链和两条相同的重(h)链组成的异四聚体糖蛋白。igm抗体由5个该异四聚体基本单元与被称为j链的额外的肽一起组成,并因此含有10个抗原结合位点,而所分泌的iga抗体可聚合以形成包含2至5个四链基本单元以及j链的多价组合体。在igg的情形中,该四链单元通常为约150,000道尔顿。每一l链通过一价二硫键链接至h链,同时,两个h链依据该h链同种型而通过一个或多个二硫键彼此链接。每一h链和l链也具有规则间隔的链间二硫桥。每一h链在n端具有可变域(vh),对于α链和γ链,该vh域后接着三个恒定域(ch),对于μ同种型和ε同种型,该vh域后接着四个ch域。每一l链在n端具有可变域(vh),接着是位于该vh域另一端的恒定域(cl)。vl与vh对准,且cl与重链的第一个恒定域(ch1)对准。据信,特定的氨基酸残基在轻链可变域与重链可变域之间形成界面。将vh和vl配对在一起形成单个抗原结合部位。对于不同类别抗体的结构和特性,见,例如,《基础和临床免疫学(第八版)》(basicandclinicalimmunology,8thedition,danielp.stites,abbai.terrandtristramg.parslow(eds.),appleton&lange,norwalk,conn.,1994)第71页第6章。
基于其恒定域(cl)的氨基酸序列,来自任何脊椎物种的l链均可分配至被称为kappa(κ)和lambda(λ)的两种截然不同的类型中的一种。依据其重链的恒定域(ch)的氨基酸序列,免疫球蛋白可分为不同的类别或同种型。存在五种类型的免疫球蛋白:iga、igd、ige、igg和igm,分别具有指代为alpha(α)、delta(δ)、epsilon(ε)、gamma(γ)和mu(μ)的重链。基于ch序列和功能的相对较小的差异,该γ类和α类进一步分为多个子类,如,人类表达下述子类:igg1、igg2、igg3、igg4、iga1和iga2。
术语“可变”指的是下述事实:不同抗体的v域的某些片段的序列大为不同。该v域介导抗原结合,并界定特定抗体对于其特定抗原的特异性。但是,可变性在该可变域的110个氨基酸跨度上并非均匀分布。反而该v区域由多个以被称为“高变区”的较短的极度可变区域分开的被称为构架区(fr)的相对不变的伸展段组成,该构架区为15至30个氨基酸,而每个高变区的长度为9至12个氨基酸。天然重链和轻链的可变域各自包含四个fr,主要采用β-折叠构型,由三个高变区连接,它们形成环圈连接,并在一些情形中形成该β-折叠结构的一部分。每一链中的高变区通过该fr而极为靠近地保持在一起,并与来自另一链的高变区保持在一起,促成抗体的抗原结合部位的形成(见,《具有免疫学意义的蛋白质序列(第五版)》(kabatetal.,sequencesofproteinsofimmunologicalinterest,5thed.publichealthservice,nationalinstitutesofhealth,bethesda,md.(1991)))。恒定域不直接牵涉入抗体至抗原的结合中,但展现多种效应子功能,如抗体依赖性细胞毒性(adcc)中抗体的参与。
当在本文中使用时,术语“高变区”指的是作为抗原结合的原因的抗体的氨基酸残基。高变区通常包含来自“互补决定区”或“cdr”(如,当根据kabat计数系统计数时,vl中大约在残基24至34(l1)、残基50至56(l2)和残基89至97(l3)左右,vh中大约在残基31至35(h1)、残基50至65(h2)和残基95至102(h3);《具有免疫学意义的蛋白质序列(第五版)》(kabatetal.,sequencesofproteinsofimmunologicalinterest,5thed.publichealthservice,nationalinstitutesofhealth,bethesda,md.(1991)))的氨基酸残基;及/或那些来自“高变环”(如,当根据chothia计数系统计数时,vl中的残基24至34(l1)、残基50至56(l2)和残基89至97(l3),以及vh中的残基26至32(h1)、残基52至56(h2)和残基95至101(h3);chothiaandlesk,j.mol.biol.196:901-917(1987))的残基;及/或那些来自“高变环”/cdr(如,当根据imgt计数系统计数时,vl中的残基27至38(l1)、残基56至65(l2)和残基105至120(l3),以及vh中的残基27至38(h1)、残基56至65(h2)和残基105至120(h3);lefranc,m.p.etal.nucl.acidsres.27:209-212(1999);ruiz,m.eal.nucl.acidsres.28:219-221(2000))的残基。视情况,该抗体在下述一个或多个点具有对称插入:当根据aho;honneger,a.andplunkthun,a.j.mol.biol.309:657-670(2001)计数时,vl中的28、36(l1)、63、74至75(l2)和123(l3),以及vh中的28、36(h1)、63、74至75(h2)和123(h3)。
如本文中所用,术语“单克隆抗体”指的是从基本同质的抗体群体获得的抗体,即,除了可能以微量存在的可能天然出现的突变以外,包含该群体的个体抗体是相同的.单克隆抗体是高度特异性的,被引导至单个抗原位点。此外,与包括被引导至不同决定位(表位)的不同抗体的多克隆抗体制剂不同,每一个单克隆抗体被引导至该抗原上的单一决定位。该单克隆抗体的优点除了它们的特异性之外,还在于它们可通过其它抗体无杂质地合成。修饰语“单克隆”被视为需要通过任何特定方法生产该抗体。例如,可用于本发明的单克隆抗体可通过kohleretal.,nature,256:495(1975)中首次描述的杂种细胞方法制备,或可使用在细菌、真核动物或植物细胞中的重组dna方法(见,例如,美国专利4,816,567)制造。“单克隆抗体”也可使用例如clacksonetal.,nature,352:624-628(1991)和marksetal.,j.mol.biol.,222:581-597(1991)中描述的技术从噬菌体抗体库中单离。
单克隆抗体包括“嵌合”抗体,其中该重链及/或轻链的一部分与源自特定物种的抗体或属于特定抗体类别或子类的相应序列相同或同源,同时,该链的剩余部分於源自另一物种或属于另一抗体类别或子类的相应序列相同或同源,一级此类抗体的片段,只要它们展现所希望的生物学活性即可(见,美国专利no.4,816,567;以及morrisonetal.,proc.natl.acad.sci.usa,81:6851-6855(1984))。还提供源自人类抗体的可变域抗原结合序列。据此,本文中最感兴趣的嵌合抗体包括具有一个或多个人类抗原结合序列(如,cdr)且含有一个或多个源自非人类抗体的序列如fr或c区序列的抗体。此外,本文中最感兴趣的嵌合抗体是那些包含一个抗体类别或子类的人类可变域抗原结合序列以及源自另一抗体类别或子类的另一序列如fr或c区序列。本文中感兴趣的嵌合抗体也包括那些含有与本文中描述的那些相关或源自不同物种如非人灵长动物(如,旧大陆猴、猿等)的可变域抗原结合序列的嵌合抗体。嵌合抗体也包括灵长动物源化(primatized)抗体和人源化抗体。
而且,嵌合抗体可包含未见于接受者抗体中或供体抗体中的残基。做出这些修饰以进一步细化抗体效能。进一步的细节见jonesetal.,nature321:522-525(1986);riechmannetal.,nature332:323-329(1988);以及presta,curr.op.struct.biol.2:593-596(1992)。
“人源化抗体”通常认为是具有一个或多个被引入该抗体中的来自非人类来源的氨基酸残基的人类抗体。这些非人类氨基酸残基一般称为“输入”残基,它们典型取自“输入”可变域。传统上,遵循winter及合作者的方法(jonesetal.,nature,321:522-525(1986);reichmannetal.,nature,332:323-327(1988);verhoeyenetal.,science,239:1534-1536(1988)),通过以输入高变区序列替换人类抗体的相应序列来实施人源化。据此,此类“人源化的”抗体是嵌合抗体(美国专利4,816,567),其中,实质上少于完整的人类可变域已经被替换为来自非人类物种的相应序列。
“人类抗体”是仅含有存在于由人类天然产生的抗体中的序列的抗体。但是,如本文中所用,人类抗体可包含未见于天人出现的人类抗体内的残基或修饰,包括本文所述的那些修饰和变体序列。典型地,做出这些修饰以增强抗体效能。
“完整的”抗体是包含抗原结合位点以及cl和至少重链恒定域ch1、ch2和ch3的抗体。该恒定域可以是天然序列恒定域(如,人类天然序列恒定域)或其氨基酸序列变体。优选地,完整的抗体具有一种或多种效应子功能。
“抗体片段”包含完整抗体的一部分,优选该完整抗体的抗原结合区或可变区。抗体片段的实例包括fab、fab'、f(ab')2和fv片段;双特异性抗体;线性抗体(见,美国专利5,641,870;zapataetal.,proteineng.8(10):1057-1062[1995]);单链抗体分子;以及由抗体片段形成的多特异性抗体。
短语抗体的“功能性片段或类似物”是具有与全长度抗体一样的定性生物学活性的化合物。例如,抗ige抗体的功能性片段或类似物是可以一定方式结合至ige免疫球蛋白的化合物,从而防止或实质上降低该分子具有结合至高亲和性受体fcεri的能力的可能性。
抗体的木瓜蛋白酶消化产生了两个相同的称为“fab”片段的抗原结合片段,以及剩余的“fc”片段,是反应易于结晶的能力的消化作用。fab片段由整个l链连同h链的可变域(vh)、以及一条重链的第一恒定域(ch1)组成。关于抗原位点,每一fab片段都是单价的,即,每一fab片段具有一个抗原结合位点。对抗体进行胃蛋白酶处理导致单个的大f(ab')2片段,该片段大致上对应于两个经二硫键链接的具有二价抗原结合活性的fab片段,且该片段仍能交联抗原。fab’片段与fab片段的不同之处在于,fab’片段在ch1域的羧基端还具有包括来自该抗体铰接区的一个或多个半胱氨酸的少量残基。本文中,fab'-sh指代其恒定域的半胱氨酸残基承载游离巯基的fab’。f(ab')2抗体片段最初作为两个fab’片段之间具有铰接半胱氨酸的成对fab’片段而生产。抗体片段的其它化学偶联也是已知的。
“fc”片段包含通过二硫键保持在一起的两个h链的羧基端部分。通过在该fc区内的序列确定抗体的效应子功能,该fc区也是由见于某种类型的细胞上的fc受体(fcr)识别的部分。
“fv”是含有完全抗原识别和结合位点的最小抗体片段。这一片段由紧密、非共价关联的一个重链可变区和一个轻链可变区的二聚体组成。这两种结构域的折叠产生6个高变环(从h链和l链各产生3个环),这6个高变环贡献了用于抗原结合的氨基酸残基并向抗体提供抗原结合特异性。但是,甚至单个可变域(或仅包含对于抗原为特异性的3个cdr的半fv)也具有识别并结合抗体的能力,即使结合的亲和性低于整个结合位点。
“单链fv”也简写为“sfv”或“scfv”,是包含连接为多肽单链的vh抗体域和vl抗体域。优选的,sfv多肽还包含位于vh域与vl域之间的多肽链接基,该链接基使得sfv能形成所希望的用于抗原结合的结构。对于sfv的回顾,见罗斯伯格(rosenburg)和穆尔(moore)编撰的《单克隆抗体病理学》第113卷(thepharmacologyofmonoclonalantibodies,vol.113,rosenburgandmooreeds.,springer-verlag,newyork,pp.269-315(1994))中的pluckthun;下文的borrebaeck1995。
术语“二体抗体”指的是通过下述制备的小抗体片段:构建在vh域与vl域之间具有短链接基(约5至10个残基)的sfv片段(见前述段落),从而实现多个v域的链间而非链内的配对,得到二价片段,即,具有两个抗原结合位点的片段。双特异性的二体抗体两个“交叉”sfv片段的异二聚体,其中,两个抗体的vh域和vl域存在于不同的多肽链上。二体抗体更完整地揭示于ep404,097、wo93/11161和hollingeretal.,proc.natl.acad.sci.usa,90:6444-6448(1993)中。
如本文中所用,“内化”抗体是在结合至哺乳动物细胞上的抗原(如,细胞表达多肽或受体)时被该细胞吸收(即,进入该细胞)的抗体。当然,内化抗体将包括抗体片段、人类或嵌合抗体、和抗体偶联物。对于某些治疗性应用,预期在体内进行内化。被内化的抗体分子数将足以或适合杀死细胞尤其是被感染的细胞或抑制该细胞的生长。依据该抗体或抗体偶联物的潜能,在一些情形中,将单一抗体分子摄取入该细胞内足以杀死该抗体所结合的靶点细胞。例如,某种毒素在杀伤方面的潜能高,使得该毒素偶联至该抗体而得的一个分子的内化足以杀死被感染的细胞。
如本文中所使用,如果抗体以可检测的水平与该抗原反应,优选其亲和常数ka大于或等于约104m-1,或大于或等于约105m-1,或大于或等于约106m-1,或大于或等于约107m-1,或大于或等于约108m-1,则称该抗体为“免疫特异性的”、对于抗原为“特异性的”或“特异性地结合”抗原。抗体对其同源抗原的亲和性一般也表达为解离常数kd,在某些实施方式中,如果hum2e抗体以小于或等于10-4m、小于或等于10-5m、小于或等于10-6m、小于或等于10-7m、或小于或等于10-8m的kd结合至m2e时,则hum2e特异性地结合至m2e。可使用传统技术例如scatchardetal.(ann.n.y.acad.sci.usa51:660(1949))中揭示的技术轻易地测定抗体的亲和性。
抗体与抗原、细胞或其组织的结合特性通常可使用免疫检测方法进行测定,该方法包括,例如,基于免疫荧光的测定如免疫组化(ihc)和/或荧光活化细胞分选(facs)。
具有指定抗体的“生物学特征”的抗体是具备该抗体区别于其它抗体的一种获得生物学特征的抗体。例如,某些实施方式中,具有指定抗体的生物学特征的抗体将结合与所指定抗体结合的相同表位,和/或具有如同所指定抗体一般的常见效应子功能。
术语“拮抗剂”抗体以最广泛的意义使用,且包括部分或完全地封锁、抑制或中和其特异性结合的表位、多肽或细胞的生物学活性。鉴别拮抗剂抗体的方法可包含:令被备选拮抗剂抗体特异性结合的多肽或细胞与该备选拮抗剂抗体接触,并测量正常情况下与该多肽或细胞相关的一种或多种生物学活性的可检测的改变。
抗体“效应子功能”是指那些可归因于抗体的fc区(原生序列fc区或氨基酸序列变体fc区)的生物学活性,并随着抗体同种型而改变。抗体效应子功能的实例包括:c1q结合和补体依赖性细胞毒性;fc受体结合;抗体依赖性细胞介导的细胞毒性(adcc);自体吞噬;细胞表面受体(如,b细胞受体)的下调;和b细胞活化。
术语“抗原结合位点”或“结合部位”是指免疫球蛋白分子的参与抗原结合的部分。抗原结合位点由重(“h”)链和轻(“l”)链的n端可变(“v”)区的氨基酸残基形成。重链和轻链的v区内的三个高度分化的拉伸,称为“高变区”,插在被称为“构架区”或“fr”的更保守侧翼拉伸之间。因此,术语“fr”是指天然地见于免疫球蛋白的高变区之间且与高可变区相邻的氨基酸序列。在抗体分子中,轻链的三个高变区和重链的三个高变区相对于彼此设置在三维空间内,以形成抗原结合表面。抗原结合表面与结合抗原的三维表面互补,且重链和轻链各自的三个高变区称为“互补性决定区”或“cdr”。
如本文中所用,术语“表位”包括任何能
特异性结合至免疫球蛋白、scfv或t细胞受体的蛋白质决定子。表位决定子由分子的化学活性表面分组如氨基酸或糖侧链组成,且具有特异性的三维结构特征以及特异性的电荷特征。例如,抗体可对抗多肽的n端或c端、蛋白质的线性或非线性肽序列、以及包含第一抗原的氨基酸和第二抗原的氨基酸的表位。
如本文中所用,术语“免疫细胞”通常包括源自骨髓中产生的造血干细胞(hsc)的白血球(白细胞)。“免疫细胞”包括,例如,淋巴细胞(t细胞、b细胞、天然杀手(nk)细胞)和髓系细胞(嗜中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、单核细胞、巨噬细胞、树突细胞)。在一些具体例中,免疫细胞包含嵌合抗原受体。如本文中所用,术语“嵌合抗原受体”或“car”是指抗原结合结构域,其融合至能活化或刺激免疫细胞的细胞内信号传导结构域,且在某些具体例中,car还包含跨膜结构域。
如本文中所用,术语“免疫结合”和“免疫结合特性”是指在免疫球蛋白分子与对于该免疫球蛋白为特异性的抗原之间的非共价相互作用类型。免疫结合作用的强度或亲和性可以该作用的解离常数(kd)表达,其中较小的kd表示较大的亲和性。所选择多肽的免疫结合特性可使用该领域中周知的方法定量。一个此类方法需要测量抗原结合位点/抗原复合物形成和解离的速率,其中哪些速率取决于复合物成员的浓度、作用的亲和性、以及在两个方向上同等影响速率的几何参数。因此,可通过计算该浓度以及关联和解离的实际速率来测定“结合速率常数(kon)”和“分解速率常数(koff)”。(nature361:186-87(1993))。koff/kon之比使得消除所有与亲和性无关的参数成为可能,且等于解离常数kd。daviesetal.(1990)annualrevbiochem59:439-473)。当通过试验诸如放射性配体结合试验或该领域技术人员已知的类似试验测量的平衡结合常数(kd)为≤1μm,优选≤100nm,更优选≤10nm,,更优选≤1nm,且最优选≤100pm至约1pm时,则称本发明的抗体被特异性地结合至本文所述的抗原或表位(例如,ctla、pd1、pdl1、或其它免疫抑制性蛋白质和/或肿瘤抗原)。
本发明也包含多肽片段和核酸片段,只要它们分别展现全长度多肽和核酸的所希望的生物学活性(即,对抗mrgprx3或mrgprx4)即可。采用几乎任何长度的核酸片段。例如,本发明的多种实作中包括例示性的总长度为约10,000、约5000、约3000、约2,000、约1,000、约500、约200、约100、约50个碱基对长度(包括所有中间长度)的多核苷酸链段。同样,采用几乎任何长度的多肽片段。例如,本发明的多种实作中包括例示性的总长度为约10,000、约5,000、约3,000、约2,000、约1,000、约5,000、约1,000、约500、约200、约100、约50个氨基酸长度(包括所有中间长度)的多肽链段。
多核苷酸、多肽或其它剂是纯化的和/或单离的。具体地说,本文中,“单离的”或“纯化的”核酸分子、多核苷酸、多肽或蛋白质,当通过重组技术生产时,是基本上不含其它培养材料或培养基的;当化学合成时,是基本上不含化学前体或其它化学品的。纯化的化合物至少含有,60重量%(干重)的该感兴趣的化合物。优选该制剂含有至少75重量%、更优选至少90重量%、最优选99重量%的该该兴趣的化合物。例如,纯化的化合物含有,以重量计,至少90%、91%、92%、93%、94%、95%、98%、99%或or100%(w/w)的所希望的化合物。通过任何适宜的标准方法,例如,柱层析、薄层层析或高效液相色谱(hplc)分析来测量纯度。纯化的或单离的多核苷酸(核糖核酸(rna)或脱氧核糖核酸(dna))不含在其天然状态下位于其侧翼的基因或序列。纯化的或单离的多肽不含在天然状态下位于其侧翼的氨基酸或序列。纯化也定义了对于给药至人类受试者为安全的无菌程度,如,缺少感染性或毒性剂。
同样,“基本上纯的”意为已经与其天然伴随组分单离的核苷酸或多肽。典型地,以重量计,当核苷酸和多肽的至少60%、70%、80%、90%、95%或甚至99%不含其天然关联的蛋白质和天然出现的有机分子时,则该核苷酸和多肽是基本上纯的。
“单离的核酸”意为核酸不含在该核酸所源自的有机体的天然出现的基因组中位于该核酸侧翼的基因。该术语覆盖,举例而言:(a)一种dna,其作为天然出现的基因组dna的一部分但侧翼没有在其天然来源的有机体基因组中位于该分子侧翼的两个核酸序列;(b)一种核酸,其被以使得所得分子与天然出现的载体或基因组dna不同的方式并入载体或原核细胞或真核细胞的基因组dna内;(c)一种独立分子,如合成的互补dna(cdna)、基因组片段、通过聚合酶链反应(pcr)生产的片段、或限制酶断片;以及(d)一种重组核苷酸序列,其是杂合基因即编码融合蛋白的基因的一部分。根据本发明的单离的核酸分子进一步包括通过合成生产的分子,以及已经在化学上改变和/或具有经修饰的骨架的任何核酸。例如,单离的核酸是纯化的cdna或rna多核苷酸。单离的核酸分子也包括信使核糖核酸(mrna)分子。
术语“载体”用来指代载剂核酸分子,可将异源核酸序列插入其中以便引入细胞内,在该细胞内,该异源核酸序列被复制并表达。该术语还表示可用于相同目的的某些生物媒介物,例如,病毒载体和噬菌体,这两种感染剂均能引入异源核酸序列。
“表达载体”是重组或合成生成的核酸构造体,具有一系列允许在宿主细胞内转录特定多核苷酸序列的特异性核酸成分。表达载体可以是质粒的一部分、病毒基因组、或核酸片段。典型地,表达载体包括可操作地链接至启动子的待转录多核苷酸。在这一语境汇总,“可操作地链接”意为,两个或多个遗传成分例如多核苷酸编码序列和启动子被放置相关位置处,允许该成分发挥适宜的生物学功能,例如该启动子引导该编码序列的转录。如本文中所用,术语“启动子”是指引导核酸转录的核酸控制序列的阵列。如本文中所用,启动子包括接近转录起始位点的必要核酸序列,例如,在聚合酶ii型启动子的情况下,tata成分。启动子也任选地包括远端增强子或阻遏子成分,其可定位在与转录起始位点相距多达数千碱基对之处。表达载剂中可存在的其它成分包括增强转录的成分(例如,增强子)和终止转录的成分(例如,终止子),以及赋予从该表达载体产生的重组蛋白以某些结合亲和性或抗原性的成分。
“候选化合物”意为天然出现的或人工衍生的化学品。候选化合物可包括,例如,肽、多肽、合成有机分子、天然有机分子、核酸分子、肽核酸分子、以及它们的组分和衍生物。
术语“药物组合物”意为任何组合物,其含有至少一种治疗活性剂或生物活性剂,且适用于给药至患者。任何这些制剂可通过该领域中周知且接受的方法制备。见,例如,《雷明顿:药物科学与实践(第二十版)》(remington:thescienceandpracticeofpharmacy,20thedition,(ed.a.r.gennaro),mackpublishingco.,easton,pa.,2000)。
“g蛋白偶联受体(gpcr)”意为一种蛋白受体,其感知细胞外的分子并在该细胞内活化信号转导通道,并最终活化细胞应答。gpcr被称为七次跨膜受体,因为它们穿过细胞膜七次。
“激动剂”意为一种化学物质,其结合至受体并活化该抽提以产生生物应答。与激动剂造成活动相反,“拮抗剂”阻断b该激动剂的活性,并且,反向激动剂造成与该激动剂活动反向而行的活性。如本文中所用,术语“拮抗剂”和“抑制剂”可互换使用,指代任何抗衡或抑制、降低或阻抑其靶点分子生物学活性的分子。在一些具体例中,当激动剂诱发或增加其靶点分子(例如,mrgprx4或mrgprx3)的生物学活性时,则激动剂是“超级激动剂”。在一些具体例中,当拮抗剂抗衡或抑制、降低或阻抑其靶点分子(例如,mrgprx4或mrgprx3)的生物学活性时,则拮抗剂是“超级拮抗剂”。合适的mrgprx3拮抗剂、mrgprx4拮抗剂、mrgprx3激动剂和/或mrgprx4激动剂包括可溶性受体、肽抑制剂、小分子抑制剂、配体融合物和抗体。
“野生型”或“wt”意为物种在自然界中出现的典型形式的表型。或者,野生型被概念化为标准产物,即基因座处的“正常”等位基因,与非标准产生者“突变”等位基因形成对照。
如本文中所用,术语“给药”是指将mrgprx3或mrgprx4拮抗剂或者mrgprx3或mrgprx4激动剂例如转移、递送、引入或运输至需要治疗疾病或病症的受试者的任何模式。此类模式包括但不限于,口服给药、外用给药、静脉内给药、腹腔内给药、肌肉内给药、皮内给药、鼻腔给药和皮下给药。
“mrgprx3或mrgprx4拮抗剂”意为任何小分子、化学化合物、抗体、核酸分子或多肽、或它们的片段,其能够阻断、防止、减少或改变mrgprx3或mrgprx4的活化信号转导通道的能力。
“mrgprx3或mrgprx4激动剂”意为任何小分子、化学化合物、抗体、核酸分子或多肽、或它们的片段,其能够增加、活化或改变mrgprx3或mrgprx4的活化信号转导通道的能力。mrgprx3激动剂或mrgprx4激动剂可通过本文公开的方案鉴别,例如下文实施例9。
“改变”意为通过该领域标准方法如本文所述的那些检测的多肽例如mrgprx3或mrgprx4的活性的变化(增加或降低)。如本文中所用,改变包括基因或多肽的表达水平或活性变化10%或更高,优选变化25%,更优选变化40%,且最优选多肽的活性变化50%或更高。
如本文中所用,“改变”也包括基因或多肽的表达水平变化2被倍或更多,例如,5倍、10倍、20倍、30倍、40倍、50倍、100倍、500倍、1000倍或更多。
“缓解”意为减少、阻抑、衰减、缩减、迟滞或稳定化疾病的发展或进展,例如,假变态类型的反应。
“扩增”意为增加分子拷贝数。在一个实例中,使用聚合酶链反应(pcr)来扩增核酸。
“结合”意为具有对于分子的物理化学亲和性。结合通过本发明的任何方法测量,例如,药物/化合物与在细胞上表达的受体的结合。
本公开中,“包含”、“含有”和“具有”等可具有美国专利法中规定的属于它们的意义,且可意为“包括”等;“主要由...组成”等具有美国专利法中规定的属于它们的意义,且该术语是开放性的,允许超过其所引述者的存在,只要其所引述的基本或新颖特征没有被超过其所引述者的存在改变即可,但不包括先前技术具体例。
“检测”是指直接或间接地鉴别待检测的信号转导通道的mrgprx3或mrgprx4活化的存在、不存在或量。
“有效量”意为相对于未治疗患者缓解疾病症状所需的化合物的量。用来实践本发明的用于治疗性处理疾病的活性化合物的有效量可变,取决于给药模式以及受试者的年龄、体重和一般健康情况。基本上,主治医生或兽医将决定适宜的量和给药方案。这一量被称为“有效”量。
如本文中所用,术语“治疗”(treating和treatment)是指将剂或配方给药至患有负面症状、病症或疾病的由临床症状的个体,以实现症候严重性和/或频率的降低、消除症候和/或其基础肇因、和/或促进对损伤的改善或补救。
本文中提供的范围理解为该范围内所有值的略写。例如,1至50的范围理解为包括来自由1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49或50所组成的组的任意数字、数字组合或子范围以及前述整数之间的所有中间的十分位小数如,举例而言,1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8和1.9。关于“子范围”,尤其预期从该范围的任一端延伸的“嵌套子范围”。例如,例示性范围1至50的嵌套子范围可包括在一个方向上的1至10、1至20、1至30和1至40,以及在另一方向上的50至40、50至30、50至20和50至10。
“重组”意为通过基因重组(例如分子克隆)的实验室方法将来自多个来源的遗传材料带至一起,创建无法在生物有机体内找到的序列而形成的核酸分子。
“异源启动子”是一种启动子,其不同于自然界中基因或核酸序列被可操作地链接至的启动子。术语“可操作地链接”是指核酸表达控制序列(例如,启动子、信号序列、或转录因子结合位点的阵列)与第二核酸序列之间的功能性链接,其中该表达控制序列影响该核酸对应于该第二序列的转录和/或转译。如本文中所用,“异源多核苷酸”或“异源基因”是起源于相异于特定宿主细胞的来源的多核苷酸或基因,或者,如果来自相同来源,则从其原始形式被修饰。
“降低”意为至少10%、25%、50%、75%或100%的负向改变。
“参考”意为标准或对照条件。
除非明确指出或从语境中明显可见,否则如本文中所用,术语“一”和“该”理解为单数或复数。除非明确指出或从语境中明显可见,否则如本文中所用,术语“或”理解为包含的。
除非明确指出或从语境中明显可见,否则本文中使用的术语“约”理解为处于该领域正常公差范围内,例如,处于均值的2标准偏差内。“约”可理解为处于所指出值的10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.1%、0.05%或0.01%内。除非从语境中明确排除,否则本文中提供的所有数值均以术语“约”修饰。
从下述对本发明优选具体例的说明和权利要求书可明了本发明的其它特征和优点。除非另做定义,否则本文中使用的所有科技术语均具有与本发明所属领域技术人员所一般理解的相同的意义。尽管与本文所述类似或等效的方法和材料可用于实践或测试本发明,但适当的方法和材料描述如下。本文中引用的所有已公开的外国专利和专利申请通过引用而并入本文。以本文中引用的登录号指明的genbank和ncbi文件通过引用而并入本文。本文中引用的所有其它已出版的参考文献、文档、手稿和科学文献通过引用而并入本文。在矛盾的情况下,包括定义在内,以本说明书为准。此外,材料、方法和实施例仅做例示性说明之用,而非试图限制。
附图说明
图1a至图e是一系列示例性说明、图表、照片和显微照片,其证明拉莫三嗪(lamotrigine)直接结合鼠mrgpra1和它的人类同源物mrgprx4。图1a是基因座示意图,显示鼠和人的mrgpr基因。鼠mrgpra3、mrgprc11和它们的人类同源物mrgprx1被特异性地表达在背根神经节(drg)中的感觉神经元内,并且应答包括氯喹(cq)和bam8-22(bam)在内的瘙痒物质而发挥瘙痒受体的功能。鼠mrgprb2和它的人类同源物mrgprx2是碱性促分泌素(例如,化合物48/80和pamp)的受体,被特异性地表达在肥大细胞中,并且介导药物诱发的过敏反应。mrgprx4同源物mrgpra1在这一研究中有所描述。。saal1、ptpn5和zdhhc13是该基因组内的无关基因。图1e是显示ltg诱发mrgpra1-gfp内化的图。染料标记的ltg可创建明亮的红色荧光(德克萨斯红(texasred))。使用培养基、带染料的培养基、ltg、带染料的ltg将血清饥饿(>4hs)mrgpra1-gfp细胞在37℃处理15分钟。染色显示,待染料的ltg被内化入mrgpra1-gfp细胞中。图1c是显示mrgprx2/细胞膜色谱(cmc)柱和mrgprx4/cmc柱上的洗脱曲线的图。ltg不能保留在mrgprx2/cmc柱上。拉莫三嗪在mrgprx4/cmc柱上的保留时间为16.7分钟。图1c和图1d是显示ltg的mrgprx4/cmc穿透曲线的图(图1c)和通过1/[lr]s对1/[l]m作图而得的回归曲线的图(图1d)。带有棒的各点表示均值±sem(n=5)。在图1d中,拉莫三嗪浓度分别为2.0×10-8、4.0×10-8、8.0×10-8、1.6×10-7和3.2×10-7mol/l。kd拉莫三嗪=(4.17±0.24)×10-7mol/l。每个结果重复超过三次。
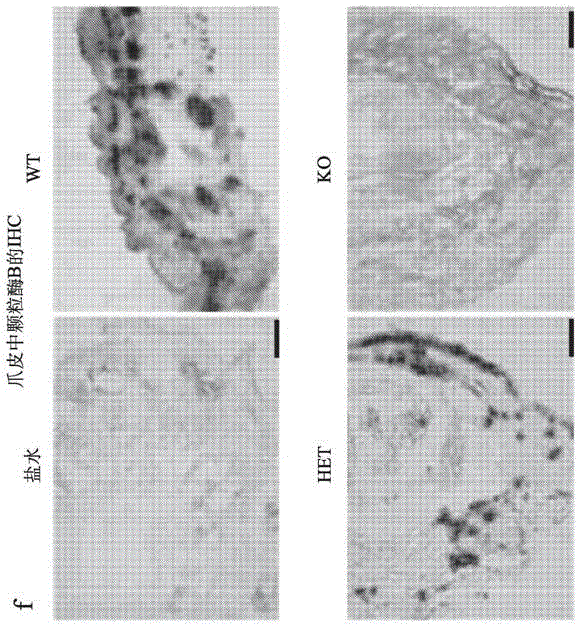
图2a至图2f是一系列例示性说明、照片、显微照片和图表,其证明ltg可在129s1/svlmjwt小鼠体内诱发sjs样表型,但在mrgpra1ko小鼠体内无此现象。图2a是例示性说明,其演示如何生成mrgpra1开放阅读框被替换为gfp的鼠。图2b是照片,其证明在口服给药50mg/kg体重ltg的7至10天后,wt小鼠在其眼内发展出粘膜分泌物并且爪子上由血泡,类似于在苦于sjs的患者体内见到的症候,而mrgpra1ko鼠不具有这些症候。图2c和图2e是照片和图表,其证明在使用ltg治疗7天后,wt和hetmrgpra1+/gfp鼠发展出结膜分泌物,而使用盐水治疗的wt鼠或使用ltg治疗的ko鼠无此现象。h&e染色显示,wt鼠和het鼠体内上皮与结膜结合处附近的局部组织缺损和一定程度的炎性细胞浸润,而盐水治疗的鼠和ko鼠无此现象。wt鼠和het鼠的结膜也具有增加的对凋亡细胞标记物tunel的染色(ltgwt:40.45±2.58%;ltghet:40.39±1.45%),而盐水治疗的鼠和ko鼠不展现这一增加的细胞死亡(盐水wt:7.08±1.99%;ltgko:13.56±1.74%),(**,p<0.01)。图2d和图2f是照片和图表,其证明在使用ltg治疗的第9天,wt鼠和het鼠的症候进一步发展,它们显示显著的爪子水肿和血泡(图2d),而盐水治疗的鼠和ko鼠无此现象。h&e染色显示,wt鼠和het鼠的皮肤内有大量的红细胞和炎性细胞浸润,而盐水治疗的鼠和ko鼠无此现象。黑色虚线矩形内的组织在图6a至图6f中放大。tunel试验在wt鼠和het鼠体内检出大量死亡的上皮细胞(绿色)(ltgwt:48.74±5.94%;ltghet:45.99±1.84%),(**,p<0.01),而盐水治疗的鼠和ko鼠无此现象(盐水wt:10.56±1.45%;ltgko:6.10±1.63%)。比例尺,图6f中为100μm,图6c、图6d中为50μm。图2f是表明下述的图表:elisa结果显示了使用ltg治疗9天后,对爪皮中颗粒酶b和tnf-α表达的定量。**,p<0.01(每种基因型n=5)。
图3a至图3f是一系列图表、照片、显微照片、facs图和免疫印迹,其证明mrgpra1被表达在一个子集的树突细胞(dc)内,其中这些树突细胞在sjs表型的形成中扮演关键角色。图3a是免疫印迹,表明rt-pcr显示mrgpra1仅表达在wt鼠的脾脏和淋巴结中,而ko鼠中不表达。图3b是细胞分类图,表明流式细胞术显示gfp+细胞是树突细胞的标记物cd11c+和mhcii+。图3c和图3d是免疫印迹和显微照片,表明从wt鼠和ko鼠的脾脏中分出cd11c+和mhcii高细胞、cd11c-和mhcii-细胞、cd11c+和mhciiint细胞、cd11c-和mhcii+细胞,进行rt-pcr检测(图3c)和钙成像(图3d)。如图3c所示,rt-pcr显示仅wt鼠的cd11c+和mhcii高细胞表达mrgpra1。如图3d所示,钙成像显示了从wt鼠的脾脏中分出的四种不同细胞在10秒(加入ltg之前)、60秒(加入ltg之后)、180秒(洗除ltg)的应答。黄色箭头指示,ltg诱发了cd11c+和mhcii高细胞的两种细胞在60秒的[ca2+]i增加。比例尺为25μm。右图为各自的成像示踪。每条线是来自独特细胞的应答。仅cd11c+和mhcii高细胞具有对于ltg的良好应答(0.05mg/l)。图3e是表明钙成像试验(每个基因型n=3,每个实验计数>100个细胞,**,p<0.01)的定量的图。图3f是照片,表明将2,500万个从wt鼠或ko鼠单离的mhcii+和cd11c+树突细胞(dc)经由尾静脉注射到mrgpra1ko鼠体内(每组n=6)。摄入ltg(50mg/kg体重)7天后,接受wtdc的鼠形成结膜分泌物。接受a1kodc的鼠不具有任何表型。
图4a至图4f是一系列图表、照片、显微照片和免疫印迹,表明人树突细胞表达mrgprx4且可被ltg活化。图4a是免疫印迹,表明人树突细胞(hdc)的rt-pcr结果显示mrgprx4被表达在hdc中。图4b是图表,表明来自使用培养基、带染料的培养基、ltg(3μm)和带染料的ltg(3μm)在37℃处理15分钟的hdc的免疫染色的对应图像。ltg(以染料标记,红色)仅被内化到表达mrgprx4的细胞(绿色)内。比例尺为100μm。图4c是图表,表明显示来自曝露于0.1mg/lltg(通过黑色线条指示持续时间)的人树突细胞(hdc)的[ca2+]i变化的示踪实例,通过比率fura-2成像测量。每条踪迹是来自单一细胞的应答。图4d是显微照片,表明来自使用ltg治疗的hdc在接受对照sirna(无功能sirna)和mrgprx4sirna施加后的有应答细胞的百分比。使用对抗mrgprx4的sirna或对照sirna转染人dc。48小时后,使用ltg处理细胞并进行钙成像。与对照组相比,经mrgprx4sirna处理的细胞中的hdc活化显著减少。各组数据表达为均值±s.e.m.。使用双尾不成对学生t测试来测定统计学比较的显著性(每个基因型n=4;每个实验计数>100个细胞。**,p<0.01)。图4e表明,对来自sjs患者和耐受人群的mrgprx4基因的分析显示,mrgprx4g/g突变更可能出现在sjs患者体内。耐受人群中g/g突变的百分比为7.14%,而sjs患者中为50%。
图5是一系列照片和图表,演示sjs动物模型的建立。对129s1/svimjwt鼠强饲可诱发sjs的药物,例如拉莫三嗪(lamotrigine)(50mg/kg体重)、奥卡西平(oxcarbazepine)(200mg/kg体重)和别嘌呤醇(allopurinol)(100mg/kg体重),每天投药,共投药20天。7天后,在三个组中,小鼠在其眼部形成结膜分泌物。粘膜分泌物的最高发病率是被ltg诱发的(93.33%)。
图6a至图6f是一系列图表和显微照片,表明由ltg诱发的损伤。图6a是表明体重变化的图表,其显示wt鼠和het鼠在使用ltg治疗10天后体重减轻(wt:-3.89±0.47g;het:-4.48±0.89g),而盐水组和ko组的体重增加(盐水治疗的wt:0.84±0.3g;ko:1.07±0.69g)。图6b是图表,表明存活比例显示鼠在使用ltg治疗14天后的存活比率。14天后,ltg治疗的wt组和het组中仅30%的鼠存活,而盐水组和ko组中没有小鼠死亡。图6c是示出了h&e染色的显微照片,显示在使用40倍透镜的显微镜下的图2d中所示wt和ko矩形内的皮下组织。红血球和炎性细胞可能仅见于wt真皮中。比例尺为50μm。图6d是示出免疫荧光双染色的显微照片,其演示了使用ltg治疗9天后的小鼠眼皮中的cd8阳性细胞和cd3阳性细胞。比例尺为50μm。图6e是图表,表明眼皮中所计数的cd8阳性细胞和cd3阳性细胞的数目(原生wt:3.67±1.20,ltgwt:25±8.34,ltghet:25±2,ltgko:5.67±0.88;**,p<0.01;每个基因型n=5)。图6f是显微照片,表明在使用ltg和盐水治疗9天后的小鼠爪皮内颗粒酶b的ihc染色。蓝色阴影显示颗粒酶b的定位。比例尺为100μm。
图7是一系列照片,表明接受口服给药ltg(50mg/kg体重)20天的balb/cwt鼠和rag1(-/-)鼠。照片显示小鼠在第7、9和20天的表型。在第7天,balb/cwt鼠经历了在其眼部的粘膜分泌物的形成。在第9天,wt鼠在其爪内发展出血泡。在第20天,wt鼠的耳部出现脱皮和粗增厚。
图8a至图8c是一系列例示性说明、facs图和照片,表明cd4和cd8t细胞在ltg治疗期间扮演的角色。图8a是例示性说明,示出了下述治疗方案:129s1wt鼠接受分别在第-2、0和3天进行的3次腹腔内注射的抗鼠cd4和cd8的大鼠单克隆抗体。然后,在接受第二次抗体注射后,用ltg治疗该鼠14天。图8b是流式细胞分析图,证实书体内不存在cd4或cd8t细胞。在第7天和第14天,采集鼠的外周血和脾样本进行流式细胞分析。图8c是经历ltg治疗的鼠的照片。在第9天,接受盐水注射的鼠(左图,标记为“wt”)在其眼部发展出结膜分泌物并在其爪内发展出血泡,但在cd8和cd4t细胞耗竭组中没有发现这些表型。
图9a至9c是一系列流式细胞分析图和显微照片,表明mrgpra1细胞是cd11c和mhc-ii阳性细胞。图9a是流式细胞分析图,示出了mrgpra1ko鼠的mrgpra1开放阅读框被替换为gfp。使用流式细胞术表征来自mrgpra1gfp/gfp鼠的gfp+细胞;使用不同的抗体如cd4、cd8a、cd11b、cd45、cd317、cd370、f4/80、i-a/i-e、ly6c、ly6g、xcr1、cd3和cd11c对脾细胞和淋巴结染色。随后,在lsr-ii流式细胞仪(bdbiosciences)上实施细胞获取。结果显示,gfp+细胞高度表达cd11c和mhc-ii。图9b是示出免疫荧光染色的显微照片,其显示在a1ko鼠脾脏中,gfp细胞是cd11c+细胞而非cd3+细胞。比例尺为50μm。图9c是淋巴结细胞的流式细胞分析图,表明mrgpra1gfp/gfp细胞是mhc-ii+和cd11c+。
图10是一系列facs图,表明不同类型的脾细胞的分类。基于cd11c和mhc-ii表达,使用facsdiva软件将免疫细胞群体分门别类。分类的细胞随后立即用于rna单离或钙成像。
图11是表明注射wt鼠和a1ko鼠树突细胞的小鼠体重变化的图表。每天使用ltg治疗a1ko鼠,之后该鼠接受一次wt鼠和a1ko鼠树突细胞(dc)的注射。从第7天开始,接受wtdc的鼠经历体重减轻,而接受a1kodc的鼠经历体重增加。
图12是一系列显微照片,表明mrgprx4在人树突细胞内的表达。dapi(蓝色)和mrgprx4(绿色)的免疫荧光双染色显示mrgprx4被表达在人树突细胞内。使用hek293细胞和mrgprx2-hek细胞作为阴性对照,同时使用mrgprx4-hek细胞作为阳性对照。比例尺为200μm。
图13a至图13f是一系列图表,表明在胆汁淤积性瘙痒的模型中,mrgpr簇ko鼠抓挠较少。图13a是图表,示出了每天口服媒介物(橄榄油)或25mg/kganit的鼠的结果。在第五天,评估自发瘙痒。对测试室中的鼠录像30分钟,计数抓挠动作出现的次数。小鼠全部为同窝出生的8至12周龄的雄性。在整个治疗过程中,执行关于基因型的盲研究并归类。对于每种治疗和每个基因型,n为10,但使用媒介物治疗的簇ko组中那位6。图13b是图表,示出了当在评估瘙痒后通过心脏穿刺采集血清时的结果。通过jhu的动物病理学实验室测量总胆红素。图13c是示出治疗后肝脏重量结果的图表。图13d是示出血清胆汁酸值结果的图表。对照组n为4,wt治疗组n为10,而ko治疗组n为7。图13e是示出血清自家趋化素活性(autotaxinactivity)结果的图表。对照组n为4,wt治疗组n为12,而ko治疗组n为8.图13f是示出血清甲硫氨酸脑啡肽值结果的图表。对照组n为4,wt治疗组n为19,而ko治疗组n为10。
图14a是一系列图表,表明胆红素在wt鼠体内造成瘙痒而在簇ko鼠体内不造成瘙痒。黑色柱为wt鼠。红色柱为簇ko鼠。黄色柱为mrgpra1单基因敲除。对空无注射致痒原。在注射后30分钟,评估抓挠动作出现的次数。该研究中使用的鼠是8至12周龄的同窝出生的雄性。在分类过程中,执行关于治疗的盲研究。示出了带sem的均值。图16a是图表,示出了在颈背部皮下注射胆红素在含有5%dmso的媒介物(ph6.6至7.0)中的溶液的小鼠的结果。图14b是图表,示出了在颈背部注射50μl的吗啡在盐水中的1mg/kg溶液的小鼠的结果。图14c是图表,示出了在颈背部注射50μl的damgo在盐水中的1mg/kg溶液的小鼠的结果。图14d是图表,示出了在脸颊注射所标注剂量胆红素的小鼠的结果。图14e是图表,示出了在脸颊注射1.3mmdca的小鼠的结果。图14f是图表,示出了在脸颊注射4mmlpa的小鼠的结果。
图15a至图15d是一系列图表,表明胆红素以mrgpr依赖性的方式活化背根神经节神经元群体。图15a是荧光强度示踪,其中来自wt鼠的drg神经元被加载fluo-4am钙染料。将媒介物(0.5%dmso)加入神经元中。30秒后,施加1分钟的洗涤。加入50μm胆红素。使用50mmkcl作为阳性对照。每个踪迹表示单个神经元。图15b是荧光强度示踪,其中在第10秒施加胆红素。在第20秒,将浴溶液替换为3mmegta浴溶液。在此期间,再次施加胆红素。图15c是图表,表明将媒介物或50μm胆红素施加至wt和簇kodrg神经元。在成像期间,如果神经元的峰值荧光达到比基线增加至少50%或达到kcl峰值的50%,则神经元评分为“活化”。此外,神经元需要具有至少20秒的高于基线的信号。从分析中排除运动伪影。汇总至少三只鼠的神经元总数来计算百分比。图15d是示出评分为“活化”的神经元直径的直方图。
图16a至图16c是一系列图表,表明胆红素介导的瘙痒是非组胺能的。图16a是当将胆红素施加至肥大细胞时组胺释放不同于对照组的图表。图16b是荧光强度示踪,其中以浴形式将胆红素施加至腹腔肥大细胞未能引起钙流入。图16c是当将1mm胆红素注射入wt动物体内时结果的柱状图。黑色柱是注射媒介物的动物。红色柱是30mg/kg西利替嗪(cetirizine),其为h1r阻滞剂。
图17a至图17f是一系列图表,表明mrgpra1和mrgprx4被胆红素以gɑq依赖性的方式活化。图17a是表明当未定表达mrgpra1的hek细胞被加载fura-2钙染料时的结果的图表。加入50μm胆红素。30秒后,施加1分钟的洗涤,并令细胞返回基线。随后再次加入50μm胆红素。每个踪迹表示单个hek细胞。图17b是表明当使用u73122(gɑq阻滞剂)时的结果的图表。图17c是表明当使用u73343(u73122的紧密相关的类似物,不具有对抗gɑq的功能)时的结果的图表。图17d是表明与图17a相同但hek细胞稳定地表达mrgprx4的实验结果的图表。一次性施加50μm胆红素。每个踪迹表示单个细胞。图17e是表明与图17b相同但使用x4的实验结果的图表。图19f是表明与图17c相同但使用x4的实验结果的图表。
图18a至18c是一系列图表,表明mrgpra1和mrgprx4具有对于病理生理学浓度下的胆红素的ec50。使用稳定地表达mrgpra1或mrgprx4的hek细胞计算ec50。细胞加载有flipr钙成像染料,并且使用flexstation3机器(moleculardevices)读取荧光的变化。每孔进行三次平行实验,将来自各板的所有值归一化至最高应答孔。仅加入媒介物不造成任一细胞系的荧光变化。未转染的细胞展现一定程度的荧光变化,但剂量应答曲线无变化(未显示)。x轴示出修改后的对数尺度。图18a是示出mrgpra1对于大约49μm胆红素的ec50的图表。图20b是示出mrgprx4对于大约3μm胆红素的ec50的图表。图18c是表明未转染hek细胞不显示ec50应答的图表。
图19a至图19c是一系列表明导致瘙痒的mrgpra1活化的图表。注射1mm粪胆素、1mm血色素或1mmfmrf在wt动物体内引起瘙痒,但在簇ko动物体内未引起瘙痒。三个化合物全部为mrgpra1的激动剂而非其它mrgpr的激动剂。
图20a至图20c是一系列图表,表明mrgprx3是和bd的新颖角化细胞受体。图20a是一系列显示人mrgprx3被hbd3活化的相应ca2+示踪。图20b是qpcr结果的图表,显示通过sirna将mrgprx3从人初级角化细胞有效敲除。将mrgprx4作为对照物测量。图20c是表明敲除mrgprx3显著减少应答hbd3而产生ca2+的人角化细胞的百分比的图表。
图21a至图21d是一系列免疫印迹、图表是例示性说明,表明鼠mrgpra6是人mrgprx3的假定同源物。图21a是免疫印迹,其表明,rt-pcr显示mrgpra6、mrgpra12和mrgprb3在纯化的鼠角化细胞中的高表达。图21b是一系列显示鼠mrgpra6被mbd14活化的相应ca2+示踪。图21c是表明mrgprb3未被mbd14活化的相应示踪(其它mrgpr的数据未显示)。图21d是表明鼠和人基因组中mrgpr基因簇的示意图。虚线指示相对应的同源物。
图22是示出血红素代谢物和mrgpr分析结果的表。血红素代谢物在结构上是相关的。多种血红素代谢物活化鼠受体mrgpra1和人受体mrgprx4。物质的剂量列述于上,但表内示出的是活化的大约百分比。
图23a至23e是示出胆红素引起非组胺能的、mrgpr依赖性的瘙痒的图像。图23a是柱状图,指示抓挠动作出现与注射胆红素有关。将所标注量的胆红素以100μl体积注射到鼠的颈背部。蓝色柱(+hsa)表示已经注射预先使用1%人血清白蛋白孵化的60μg胆红素(100μl,1mm)的动物。媒介物,n=8;6μg,n=5;18μg,n=11;30μg,n=12;60μg,n=7;+hsa,n=12。图23b是示出与注射胆红素、组胺或氯喹相关的瘙痒行为的时间进程的折线图。根据5分钟间隔追踪抓挠动作出现。胆红素,n=16;组胺,n=13;氯喹,n=11。图23c是柱状图,示出将60μg胆红素注射入wt和簇-/-同窝出生鼠的颈背部的结果。wt,n=8;簇-/-,n=13。图23d是柱状图,示出将60μg(100μl,1mm)的所标注代谢物注射入wt和簇-/-同窝出生鼠的结果。氯高铁血红素(wt,n=10;簇-/-n=6)、胆绿素(wt,n=7;簇-/-n=7)、尿胆素原(wt,n=15;簇ko,n=8)、粪胆素(wt,n=7;簇-/-,n=5)。图23e是血红素降解途径的示意图。每种代谢物的骨架式以其如通过b3lyp功能性和6-31g(d)基组所计算的最佳3d几何结构示出。蓝色和橙色表示从dft计算获得的每种代谢物homo的轨道宇称。图23a、23c和23d:示出了均值+s.e.m.。每个开放的环表示一个鼠个体。*,p<0.05;**,p<0.01;***,p<0.001;双尾未配对学生t测试。
图24a至24n是显示胆红素活化鼠mrgpra1和人mrgprx4的数据。图24a至24e是显示稳定地表达mrgpra1或mrgprx4(图24f至24j)的hek293的ca2+成像和转化结合等温线的数据。图24a至24c和图24f至24h是显示加入通过黑色柱指示的50μm胆红素的数据。15秒后,施加1分钟的洗涤。示出了均值±95%置信区间(ci)。n=10。在图24a中,在洗涤后加入通过黑色柱指示的30μmfmrf。在图24b至24c和图24g至24h中,在成像前,将细胞与10μm的plc抑制剂u73122或10μm的gαq抑制剂ym254890预先孵化30分钟。胆红素、缀合胆红素、和血红素朝向(图24d)mrgpra1、(图24i)mrgprx4、以及(图24m)mrgprc11和bam8-22朝向mrgprc11(一种既定的肽配体)的浓度-ca2+应答曲线。数据是以三次平行实验实施的2至3个独立复本的相应实验,以均值±s.e.m.示出。胆红素、缀合胆红素、和血红素朝向(图24e)mrgpra1、(图24j)mrgprx4以及(图24n)mrgprc11和bam8-22至mrgprc11的转化结合等温线。数据是3个独立实验的平均值,以均值±s.e.m.示出。图24k示出了部分纯化的mrgpra1、mrgprx4和mrgprc11膜复合物的胆红素刺激g蛋白活性的柱状图。在0.5%dmso或50μm胆红素的存在下测量[35s]gtpγs结合。以均值±s.e.m.示出。**,p<0.01;双尾未配对学生t测试。图24l是示出注射60μg(100μl,1mm)胆红素的wt和a1-/-动物的抓挠动作出现的柱状图。以均值加s.e.m.示出。开放的环表示鼠个体。wt,n=10;a1-/-,n=12;*,p<0.05,双尾未配对学生t测试。
图25a至25i示出表明胆红素以mrgpr依赖性的方式活化感觉神经元的数据。图25a是示出在內源mrgpra1基因座(mrgpra1gfp)的控制下的gfp表达的图像。红色示出抗plap抗体染色,其中plap表达受到內源mrgprd基因座(mrgprdplap)的控制。蓝色示出对抗降钙素基因相关肽(cgrp)的抗体染色。比例尺为50μm。图25b是wt或a1-/-drg神经元的全细胞电流钳记录的图像表示。在wtdrg中,胆红素引起50个小直径神经元中5个的动作电位。在a1-/-drg中,胆红素引起60个小直径神经元中0个的动作电位。确切概率测试p<0.05。图25c是分别加入50μm胆红素和1mm氯喹(cq的wtdrg神经元的全细胞电流钳记录的图像表示。图25d是显示wtdrg神经元的ca2+成像的图表。在10秒基线后,加入50μm胆红素。20秒后,在加入1mm氯喹之前施加3分钟的洗涤。在15秒后,加入50mmkcl。示出了均值加95%ci。n=10个神经元。所施加的化合物用黑色柱表示。图25e是柱状图,显示当加入媒介物或50μm胆红素时,wt、a1-/-和簇-/-drg的活化百分比。*,p<0.05;**,p<0.01;***,p<0.001;chi平方测试。图25f是示出通过使用媒介物、1mm氯喹或50μm胆红素进行钙成像而评估的tg(mrgpra3-cre);lsl-tdtomato神经元的活化百分比的图表。如果δf>0.2持续至少30秒,则神经元视为被活化。图25g至25h,使用慢病毒(n=10)模拟感染(图25g)或使用编码mrgpra1(n=6)、mrgprx4(n=10)或mrgprx3(n=20)的慢病毒感染(图25h)48小时后,簇-/-drg神经元和drg神经元的ca2+成像。当以黑色柱指示时,加入了50μm胆红素。20秒后,在加入50mmkcl之前施加1分钟的洗涤。所施加的化合物用黑色柱表示。示出了均值±95%ci。n=10个神经元。图25i是指示未感染的、mrgpra1感染的、mrgprx4感染的和mrgprx3感染的簇-/-神经元被胆红素活化的百分比的图表。***,p<0.001。chi平方测试。
图26a至26i是图像,示出了mrgpra1-/-动物、簇-/-动物和bvr-/-动物全部展现减少的胆汁淤积性瘙痒。图26a是柱状图,示出了wt组、簇-/-组和a1ko-/-组中媒介物治疗鼠和anit治疗鼠的抓挠动作出现。在30分钟期间内评估抓挠的出现。对于媒介物队列:wt,n=15;簇-/-,n=6;a1-/-,n=6。对于anit队列:wt,n=20;簇-/-,n=14;a1-/-,n=14。图26b是柱状图,示出了wt组和bvr-/-组中媒介物治疗动物和anit治疗动物的抓挠动作出现。在30分钟期间内评估抓挠的出现。对于媒介物队列:wt,n=5;以及,bvr-/-,n=8。对于anit队列:wt,n=21;以及,bvr-/-,n=20。图26c是柱状图,示出了来自wt组合簇-/-组的anit治疗动物和媒介物治疗动物的血浆胆红素值。对于媒介物队列:wt,n=9;簇-/-,n=5。对于anit队列:wt,n=10;簇-/-,n=8。图26d是示出wtanit治疗动物抓挠动作出现的柱状图。腹腔内递送媒介物或1mg/kgqwf。媒介物,n=8;qwf,n=9。图26e是柱状图,示出了注射媒介物治疗血浆的wt鼠或注射anit治疗血浆的wt动物和bvr-/-动物的抓挠动作出现。对于媒介物血浆队列:n=7.对于胆汁淤积性anit治疗血浆:wt,n=10;以及,bvr-/-,n=8。图26f是描述自其采集高胆红素血浆的患者特征的表。图26g是柱状图,使出了注射高胆红素血症患者血浆的wt鼠或a1-/-鼠的抓挠动作出现。对于注射患者1血浆的队列:wt,n=7;a1-/-,n=9。对于注射患者2血浆的队列:wt,n=8;a1-/-,n=5。对于注射患者3血浆的队列:wt,n=7;a1-/-,n=8。对于注射患者4血浆的队列:wt,n=6;a1-/-,n=8。图26h是柱状图,示出了注射未治疗(nt)的对照人类血浆、fecl3治疗的对照人类血浆、nt胆汁淤积患者1血浆((图26g)中患者1wt数据的拷贝)或fecl3治疗的患者1血浆的小鼠的抓挠动作出现。对于对照血浆,nt,n=6;以及,fecl3,n=5。对于患者1血浆,nt,n=7;以及,fecl3,n=7。图26i是柱状图,示出了注射正常兔igg治疗的患者1血浆或抗胆红素igg治疗的患者1血浆的小鼠的抓挠动作出现。正常igg,n=5;抗胆红素,n=7。图26a至26i,以均值加s.e.m.示出。开放的环表示个体数据点。*,p<0.05;**,p<0.01;***,p<0.001;未配对双尾学生t测试。
图27a至27f示出了显示胆红素引起非组胺能瘙痒但不引起疼痛的数据。图27a是柱状图,显示抓挠动作出现与脸颊注射胆红素有关。注射10μl体积的所标注量的胆红素,并进行30分钟的抓挠动作出现评估。媒介物,n=6;1.8μg,n=5;3μg,n=4;6μg,n=5;6μg(-/-),n=6。图27b示出柱状图,下述擦拭与将6μg胆红素注射入脸颊有关。在注射后进行10分钟的擦拭评估,媒介物,n=5;胆红素,n=7。图27b示出柱状图,下述舔舐次数与将6μg胆红素注射入脸颊有关。在注射后进行10分钟的舔舐评估。每种条件下,n=3。图27d示出柱状图,显示h1阻滞剂不抑制胆红素诱发的瘙痒。在颈背部注射胆红素前30分钟,经腹腔内给药媒介物或30mg/kg西替利嗪。在注射后进行30分钟的抓挠动作出现评估。媒介物,n=10;西替利嗪,n=5。图27e是柱状图,显示应答100μm胆红素的肥大细胞组胺释放。化合物48/80的媒介物,n=4;化合物48/80(10μg/ml),n=4;媒介物,n=6;胆红素,n=8。图27f是显示鼠腹膜肥大细胞的ca2+成像的图表。在10秒基线后,加入100μm胆红素。15秒后,进行1分钟的洗涤,之后加入10μg/ml化合物48/80。当以黑色柱表示时,加入药物。示出了均值±95%ci。n=26。图27a至27c和27d至27e,示出了均值+s.e.m.。开放的环表示独立的数据点。*,p<0.05;**,p<0.01;***,p<0.001;双尾未配对学生t测试。n.s.:不显著。
图28a至28f是下述胆红素不活化其它mrgpr的数据。图28a是具有以黑色强调的先前公布的功能同系对的鼠和人mrpgr基因座的图示说明。图28b至28f是显示瞬时表达mrgpra3(图28b)、mrgprc11(图28c)、mrgprd(图28d)、mrgprx1(图28e)或mrgprx2(图28f)的hek293细胞的ca2+成像的图表。若以黑色柱指示,则加入了50μm胆红素。15秒后,施加1分钟的洗涤。洗涤后,如黑色柱指示,加入1mm氯喹(图28b)、3μmbam8-22(图28c)、1mmβ-丙氨酸(图28d)、3μmbam8-22(图28e)或10μg/ml化合物48/80(图28f)。示出了均值±95%ci。n=10。
图29a至29c示出了mrgpra1的crispr删除数据。图29a是示出wt与a1-/-基因组序列比较的示意图。以虚线显示2碱基对(bp)删除的定位。数字对应于mrgpra1开放阅读框。图29b示出了2bp删除的测序数据。图29c示出了始于起始密码子的mrgpra1-/-开放阅读框转译的示意图。该2bp删除创建了框移,其导致提前终止,以红色星号标记(极右侧)。
图30a和30b示出了图像,显示胆红素活化与氯喹类似的直径感觉群体。图30a是维恩图,示出了被胆红素和/或氯喹活化的总神经元(单独使用胆红素=7,氯喹=40,重叠=13)。图30b是胆红素活化的神经元胞体直径的直方图。
图31a至31k是示出wt、簇-/-、a1-/-和bvr-/-动物的肝损伤病理标记物血浆水平并无不同的图表。图31a是示出经媒介物和anit治疗的动物的血浆碱性磷酸酶(alp)水平的图表。对于媒介物队列:wt,n=10;簇-/-,n=4;a1-/-,n=4;bvr-/-,n=6。对于anit队列:wt,n=17;簇-/-,n=6;a1-/-,n=5;bvr-/-,n=15。图31b是示出经媒介物和anit治疗的动物的血浆天冬氨酸转氨酶(ast)水平的图表。对于媒介物队列:wt,n=10;簇-/-,n=4;a1-/-,n=4;bvr-/-,n=9。对于anit队列:wt,n=12;簇-/-,n=6;a1-/-,n=5;bvr-/-,n=17。图31c是示出经媒介物和anit治疗的动物的丙氨酸转氨酶(alt)水平的图表。对于媒介物队列:wt,n=10;簇-/-,n=4;a1-/-,n=4;bvr-/-,n=6。对于anit队列:wt,n=15;簇-/-,n=6;a1-/-,n=5;bvr-/-,n=17。图31d是示出经媒介物和anit治疗的动物的γ-谷氨酰转移酶(ggt)水平的图表。对于媒介物队列:wt,n=10;簇-/-,n=4;bvr-/-,n=6。对于anit队列:wt,n=17;簇-/-,n=6;bvr-/-,n=15。图31e是示出经anit和媒介物治疗的动物的血浆胆汁酸水平(μm)的图表。对于媒介物队列:wt,n=4;簇-/-,n=5;bvr-/-,n=5。对于anit队列:wt,n=10;簇-/-,n=7;bvr-/-,n=14。图31f是示出经媒介物和anit治疗的动物血浆中甲硫氨酸脑啡肽水平的图表。对于媒介物队列:wt,n=4;簇-/-和bvr-/-,n=5。对于anit队列:wt,n=19;簇-/-,n=10;bvr-/-,n=11。图31g是示出经媒介物和anit治疗的动物血浆中自家趋化素活性的图表。对于媒介物队列:wt和bvr-/-,n=4;簇-/-,n=5。对于anit队列:wt,n=12;簇-/-,n=8;bvr-/-,n=10。图31h是示出应答脸颊注射10μl的1.3mm脱氧胆酸(dca)的抓挠动作出现的图表。wt,n=9;簇-/-,n=9。图31i是示出应答脸颊注射10μl的4mm溶血磷脂酸(lpa)的抓挠动作出现的图表。wt,n=6;簇-/-,n=6。图31j是示出wt,n=7;簇-/-,n=8的图表。图31k是示出应答背部注射25μg的damgo(50μl体积)的抓挠动作出现的图表。wt,n=5;簇-/-,n=5。图31a至31j显示均值±s.e.m.。开放的环表示独立的数据点。*,p<0.05;**,p<0.01;***,p<0.001;双尾未配对学生t测试。n.s.:不显著。
图32a至32f是显示bvr-/-和a1-/-动物具有完整瘙痒巡回的数据。图32a是柱状图,显示对来自wt和bvr-/-鼠全脑的blvra转录物的定量pcr分析。图32b是对来自wt和bvr-/-鼠血浆的hplc分析的代表色谱图,使用c18柱单离并通过在450nm的吸收进行分析。图32c示出了来自wt鼠血浆的hplc色谱图,过量胆红素造成尖峰。图32d是柱状图,示出wt和bvr-/-动物血浆的总胆红素水平。wt,n=7;bvr-/-,n=6。图32e是示出应答注射150μg(50l,10mm)氯喹的抓挠动作出现的柱状图。注射氯喹后,在30分钟期间内评估抓挠的出现。wt,n=9;bvr-/-,n=5;a1-/-,n=6。图32f是示出应答注射60μg(100μl,1mm)胆红素的抓挠动作出现的柱状图。注射胆红素后,在30分钟期间内评估抓挠的出现。wt,n=8;bvr-/-,n=9。图32d至32f显示均值±s.e.m.。开放的环表示独立的数据点。**,p<0.01,学生t测试。n.s.:不显著。
图33a和33b是图表,显示a1-/-和bvr-/-动物具有与环孢菌素a治疗有关的瘙痒减少。图33a是柱状图,显示经媒介物和环孢菌素a治疗的wt和a1-/-动物的抓挠动作出现。对于媒介物队列:全部为n=5。对于环孢菌素a队列:wt,n=10;以及,a1-/-,n=8。图33b是柱状图,示出了经媒介物和环孢菌素a治疗的wt和bvr-/-动物的抓挠动作出现。在30分钟期间内评估抓挠动作的出现。对于媒介物队列:n=5。对于环孢菌素a队列:wt,n=11;以及,bvr-/-,n=7。图33a和33b显示均值+s.e.m.。开放的环表示个体数据点。*,p<0.05;**,p<0.01;***,p<0.001;双尾未配对学生t测试。n.s.:不显著。
图34a至34g示出了图表,显示qwf治疗不影响胆汁淤积性肝损伤的严重性。图34a是表达mrgpra1的hek细胞中胆红素诱发的ca2+信号的浓度应答曲线图。将200μm胆红素维持为与所标注剂量的qwf竞争。示出了均值±s.e.m.。进行两次平行实验,每次n=3。图34b至34c示出了将60μg(100ml,1mm)胆红素(图34b)或150μg氯喹(图34c)与媒介物或1mg/kgqwf共同注射时抓挠动作出现的柱状图。注射后,在30分钟期间内评估抓挠动作出现的次数。对于胆红素:媒介物,n=7;qwf,n=8。对于氯喹:媒介物,n=4;qwf,n=7。以均值加s.e.m.示出。**,p<0.05;未配对双尾学生t测试。图43d值34g为已经经历anit肝损伤的给药媒介和qwf的wt动物血浆胆红素(图34d)、ast(图34e)、alt(图34f)和alp(图34g)水平。图34d至34g显示均值±s.e.m.。开放的环表示独立的数据点。n.s.:不显著,双尾未配对学生t测试。
图35a和35b示出了数据,显示fecl3和抗胆红素抗体对血浆胆红素的耗竭。图35a显示100μm胆绿素+100μm胆红素标准和经治疗血浆样品的代表性hplc色谱图。在405nm测量吸收。图35b显示对未治疗的、经fecl3治疗的、经正常兔igg治疗的和经胆红素抗体治疗的样本中血浆胆红素的定量的柱状图。各点表示技术复制。均值±s.e.m.示出了**,p<0.01;n.s.,不显著,双因素方差分析以及随后进行的事后tukey测试。
具体实施方式
本发明至少部分地基于对新颖g蛋白偶联受体——人mrgprx4和鼠mrgpra1——的鉴别。mrgprx4和mrgpra1在具体类型的固有免疫细胞内被表达,介导史蒂文斯-约翰逊综合征(stevensjohnsonsyndromes(sjs)),并且似乎牵涉入自身免疫性疾病中。mrgprx4和mrgpra被包括拉莫三嗪(lamotrigine)和别嘌呤醇(allopurinol)在内的多种造成sjs的药物活化。此外,mrgprx4和mrgpra也在感觉神经元内被表达,且对于瘙痒感和胆汁淤积性瘙痒来说是重要的。在一些具体例中,mrgprx4和mrgpra1是胆红素的受体。如本文所述,在这一发现之前,尚未有胆红素受体被鉴别。在一些具体例中,人mrgprx4是sjs、自身免疫性疾病如多发性硬化、胆汁淤积性瘙痒和其它慢性瘙痒症的药物靶点。如本文所述,在这一发现之前,mrgprx4在任何生物学过程和疾病中扮演的角色完全未知。在一些具体例中,使用基于表达mrgprx4的细胞(mrgprx4细胞系和cdna,以及mrgpra1突变鼠系)的试验来筛选并测试以这些反应为靶向的药物。如本文所述,表达mrgprx4的细胞系是全新的,且用于药物筛选的高通量筛选。在一些具体例中,阻断mrgprx4是治疗sjs;自身免疫性疾病如多发性硬化;以及胆汁淤积性瘙痒和其它慢性瘙痒症的新颖途径。
本发明也至少部分地基于下述发现,人mrgprx3及其鼠同族体mrgpra6在角化细胞、上皮细胞和背根神经节(drg)中的初级感觉神经元内被表达。还发现,抗微生物肽防御素和抗菌肽(cathelicidin)是mrgprx3和mrgpra6的激动剂。防御素和抗菌肽可在多种疾病和病症中扮演角色,该疾病和病症包括创伤愈合、慢性炎症、恶性转化、皮肤病如银屑病和皮炎、呼吸道和胃肠道疾病、疼痛和瘙痒。在一些具体例中,以mrgprx3和mrgpra6为靶向治疗创伤愈合、慢性炎症、恶性转化、皮肤病如银屑病和皮炎、呼吸道和胃肠道疾病、疼痛和瘙痒。如本文所述,mrgprx3在任何生物学过程和疾病中扮演的角色完全未知。在一些具体例中,使用基于表达mrgprx3的细胞的试验和mrgpra6突变小鼠来筛选并测试以这些反应为靶向的药物。如本文所述,表达mrgprx3的细胞系是新颖的,且用于药物筛选的高通量筛选。本发明提出测定化合物是否影响g蛋白偶联受体介导的病症的方法,以及减轻受试者体内g蛋白偶联受体介导的病症的严重性的方法。本发明至少部分地基于下述发现:被唯一性地表达在称为树突细胞的免疫细胞中的g蛋白偶联受体,即人体内的mrgprx4和鼠体内的mrgpra1,与药物副作用和自身免疫性疾病密切相关。
在本文所述的发明之前,mrgprx4/mrgpra1在药物副作用和自身免疫性疾病中扮演的角色完全未知。本文描述使用基于表达mrgprx4/mrgpra1的细胞的试验来筛选诱发药物副作用或自身免疫性疾病的药物,并且筛选阻断或影响这些反应的mrgprx4拮抗剂。
本发明的单离细胞表达人g蛋白偶联受体(gpcr)mrgprx4或鼠gpcrmrgpra1,其在基于钙的筛选试验中令受体活化易于可视化。这些细胞系允许筛选fda批准药物和研发中药物的mrgprx4激动剂和拮抗剂活性。
在基于细胞的试验中使用这些细胞进行药物筛选,阳性结果(即,通过例如钙释放测量的细胞系活化)将指示,药物将会在患者体内正常地活化树突细胞并潜在地造成副作用。筛选研发中的药物将会预测它们的副作用;筛选目前使用中的药物将会鉴别这些药物的副作用的肇因;筛选拮抗剂将会导致新的治疗性药物,该药物可同时作为诱发药物副反应的药物而提供,因此阻滞细胞(例如,树突细胞和初级感觉神经元)活化而不干扰它们的预期用途。
本文描述用来筛查活化或拮抗这一受体的fda批准药物和临床实验化合物的细胞系。这些将可用来确定药物是否将诱发过敏型应答,且可用于筛查以研发阻滞这些应答的拮抗剂。
下文详述引入鼠模型来研究药物副反应对树突细胞和初级感觉神经元的活化,以及将mrgprx4鉴别为治疗性靶点以降低药物副反应。
如本文所述,鉴别了一种新颖的g蛋白偶联受体:人mrgprx4和鼠mrgpra1。mrgprx4和mrgpra1在具体类型的固有免疫细胞内被表达,介导史蒂文斯-约翰逊综合征(stevensjohnsonsyndromes(sjs)),并且似乎牵涉入自身免疫性疾病中。mrgprx4和mrgpra被包括拉莫三嗪(lamotrigine)和别嘌呤醇(allopurinol)在内的多种造成sjs的药物活化。此外,mrgprx4和mrgpra也在感觉神经元内被表达,且对于瘙痒感和胆汁淤积性瘙痒来说是重要的。mrgprx4和mrgpra1是胆红素的受体。在这一发现之前,尚未有胆红素受体被鉴别。因此,人mrgprx4是重要的药物靶点。直到如本文所述的这一发现为止,mrgprx4在任何生物学过程和疾病中扮演的角色是完全未知的。因此,使用基于表达mrgprx4的细胞(mrgprx4细胞系和cdna,以及mrgpra1突变鼠系)的试验来筛选并测试以这些反应为靶向的药物是全新的。表达mrgprx4的细胞系是全新的,且对于药物筛选的高通量筛选是重要的。阻断mrgprx4可以是治疗sjs、自身免疫性疾病如多发性硬化、以及胆汁淤积性瘙痒和其它慢性瘙痒症的新颖途径。
如本文所述,以人体内的mrgprx3和鼠体内的mrgpra6为靶向可治疗创伤愈合、慢性炎症、恶性转化、皮肤病(例如,银屑病和皮炎)、呼吸道和胃肠道疾病、疼痛和瘙痒。在如本文所述的本公开之前,mrgprx3在任何生物学过程和疾病中扮演的角色是未知的。因此,使用基于表达mrgprx3的细胞的试验和mrgpra6突变鼠来筛选并测试以这些反应为靶向的药物也是新颖的。表达mrgprx3的细胞系是新颖的,且对于药物筛选的高通量筛选是重要的。
mrgprx4/mrgpra1
mas相关g蛋白偶联受体成员x4是人体内由mrgprx4基因编码的蛋白质。mas1致癌基因是g蛋白偶联受体,其结合血管紧张肽-ii代谢物血管紧张肽-(1至7)。当通过结合血管紧张肽-(1至7)而被活化时,mas1受体具备很多种血管紧张肽-ii活化的血管紧张肽受体的效果。mas1受体激动剂具有与血管紧张肽-ii受体拮抗剂相似的疗效,包括降低血压。
药物副反应(adr)是严重的意外且不希望的药物安全性考量,其对大约that全部入院原因的6%和住院费用的9%负有责任,仅在美国,这一项每年即耗费高达301亿美元(zalewska-janowska,a.,etal.,immunolallergyclinnortham37,165-181(2017);sultana,j.,etal.,jpharmacolpharmacother4,s73-77(2013))。最严重的adr之一,史蒂文约翰逊综合征(sjs)和中毒性表皮坏死松解症(ten)是危及生命的严重皮肤adr(cadr),以由于大量角化细胞死亡造成的水疱病灶、粘膜破裂和皮疹/脱皮为特征,死亡率高达30%(downey,a.,etal.,jamacaddermatol66,995-1003(2012);lee,h.y.&chung,w.h.,curropinallergyclinimmunol13,330-336(2013))。尽管已经显示了不适当的免疫介导的细胞毒性的参与(downey,a.,etal.,jamacaddermatol66,995-1003(2012)),但药物如何触发sjs/ten的分子和细胞机制在很大程度上仍是未知数。如本文所述,已经建立了具有眼部粘膜损害和爪部血泡的新颖的药物诱发的sjs鼠模型。在一些具体例中,几种sjs/ten致病药物可直接活化鼠体内的g蛋白偶联受体(gpcr)mrgpra1及其人类功能性同源物mrgprx4。在mrgpra1敲除动物体内,药物诱发的sjs样表型被废除。此外,如本文所述,mrgpra1和mrgprx4两者均表达在树突细胞的子集上,该细胞子集是启动导致细胞毒性的适应性免疫应答所必需的专门抗原呈递细胞。最后,在cadr患者体内,已经鉴别出导致该受体对该药物敏感度增加的mrgprx4基因突变。这些发现表明了这些药物如何可触发严重副作用的新分子机制,并打开了对adr的潜在预防和治疗性措施的新大门。
sjs是较温和形式的ten,最早由albertm.stevens和frankc.johnson在1922年揭示(stevens,a.m.&johnson,f.c.,amjdischild24,526-533(1922))。自那时起,由于sjs/ten的死亡率和发病率,医疗领域对其的惊厥度一直在增加。虽然几种类型的感染和恶性肿瘤被认为与sjs/ten的病因有牵连,但sjs/ten的主要肇因是医疗的副作用(heng,y.k.,etal.,brjdermatol173,1250-1254(2015))。超过100种临床使用的药物,包括抗癫痫药(例如,拉莫三嗪、卡马西平(carbamazepine))、抗痛风药(例如,别嘌呤醇)、某些肿瘤的抗生素和非甾体抗炎药,已经被与sjs/ten关联,这是药物安全性的主要考量并受到食品药品监督管理局(fda)密切监控(schotland,p.,etal.eurjpharmsci94,84-92,(2016))。由致病药物诱发的免疫学反应已经被视为sjs/ten发病机制的底层机制。尽管已经提出了几种牵涉致病药物、抗原呈递细胞上的人类白细胞抗原(hla)、和t细胞上的t细胞受体的相互作用的模型(adam,j.,etal.brjclinpharmacol71,701-707(2011);chung,w.h.,etal.,jdermatol43,758-766(2016)),但由于缺少优良且简单的动物模型,药物如何触发sjs/ten的分子和细胞机制至少部分地仍是个谜。
史蒂文约翰逊综合征
史蒂文约翰逊综合征(sjs)是一种严重型的皮肤反应。与中毒性表皮坏死松解症(ten)一起形成疾病谱,但sjs严重性较低。早期症状包括发热和流感样症状。一些天后,皮肤开始起水疱并脱落,形成疼痛的原始区域。典型地,还牵涉粘膜如口腔粘膜。并发症包括脱水、败血症、肺炎和多器官衰竭。
最常见的肇因是药物如拉莫三嗪、卡马西平、别嘌呤醇、磺磺胺类抗生素和奈韦拉平(nevirapine)。其它肇因可包括感染如肺炎支原体和巨细胞病毒感染,或肇因可能仍是未知的。风险因子包括hiv/aids和全身性红斑狼疮。诊断基于少于10%的皮肤被牵涉其中而做出。当超过30%的皮肤被牵涉时,称为ten,而中间形式牵涉10%至30%的皮肤。多形性红斑(em)通常被视为独立的情况。
治疗典型在医院中进行,例如在烧伤病房或加护病房中。努力方向包括停止肇因、止疼药、抗组胺剂、抗生素、静脉注射免疫球蛋白、或皮质类固醇。每年,它与ten一起影响100万至200万人。男性发病率是女性的两倍。典型在30岁以下发病。皮肤一般在两至三周内再生,但完全恢复可能耗费数月。
尽管sjs可能由病毒感染和恶性肿瘤造成,但其主要肇因是药物。主因似乎是抗生素尤其是磺胺类药的使用。sjs可能与100至200种不同的药物有关。尚无在特定药物与个案sjs之间建立联系的可靠测试。确定何种药物是肇因,是基于首次使用该药物与皮肤反应开始之间的时间间隔而做出的。一种评估药物因果关系的公布算法(alden)给出了鉴别可靠药物的结构化辅助。
sjs可能由以下药物的副作用造成:万古霉素(vancomycin)、别嘌呤醇、丙戊酸盐(valproate)、左氧氟沙星(levofloxacin)、双氯灭痛(diclofenac)、依曲韦林(etravirine)、异维甲酸(isotretinoin)、氟康唑(fluconazole)、伐地考昔(valdecoxib)、西他列汀(sitagliptin)、奥司他韦(oseltamivir)、青霉素、巴比妥酸盐、磺胺类、苯妥英(phenytoin)、阿奇霉素(azithromycin)、奥卡西平(oxcarbazepine)、唑尼沙胺(zonisamide)、莫达非尼(modafinil)、拉莫三嗪、奈韦拉平(nevirapine)、乙胺嘧啶(pyrimethamine)、布洛芬(ibuprofen)、乙琥胺(ethosuximide)、卡马西平、安非他酮(bupropion)、特拉匹韦(telaprevir)和制霉菌素(nystatin)。
传统已知导致sjs、多形性红斑和中毒性表皮坏死松解症的药物包括磺胺类抗生素、青霉素类抗生素、多孢克肟(cefixime)(抗生素)、巴比妥酸盐(镇静剂)、拉莫三嗪、苯妥英(例如,狄兰汀(dilantin))(抗惊厥剂)和甲氧苄氨嘧啶(trimethoprim)。拉莫三嗪与丙戊酸钠的组合增加了sjs的风险。
非甾体抗炎药(nsaid)是成年人sjs的罕见肇因;老年患者、女性和初始治疗者的风险较高。典型地,药物诱发的sjs的症状在开始用药一周内出现。与nsaid类似,醋氨酚(paracetamol)(乙酰氨基酚(acetaminophen))也已经造成极少的sjs案例。具有全身性红斑狼疮或hiv感染的人对药物诱发的sjs更加敏感。
自身免疫性疾病
自身免疫性疾病是由于对正常身体部分的不正常免疫应答而出现的情况。存在至少80种类型的自身免疫性疾病。可牵涉几乎任何身体部分。常见症状包括发低烧和感觉疲倦。症状往往来了又去。
肇因通常未知。一些自身免疫性疾病如狼疮是家族遗传的,而某些肇因可能是感染或其它环境因素触发的。一些常见的自身免疫性疾病包括乳糜泻、1型糖尿病、格雷福斯病(gravesdisease)、炎症性肠病、多发性硬化、银屑病、类风湿性关节炎和全身性红斑狼疮。可能难以确诊。
治疗取决于病症的类型和严重程度。一般使用非甾体抗炎药(nsaid)和免疫抑制剂。偶尔也可使用静脉注射免疫球蛋白。虽然治疗一般改善症状,但它们典型并不治愈疾病。
在美国,大约2,400万(7%)人受到自身免疫性疾病的影响。女性患病率高于男性。一般在成人期开始发病。最早的自身免疫性疾病在1900年代早期就有所描述。
人类免疫系统典型产生t细胞和b细胞,这两种细胞都能与自身抗原反应,但这些自身反应性细胞一般或在变为有活性之前就在免疫系统内被杀死而处于无能力状态(由于过度活化而令其在免疫系统中保持静默),或通过调节细胞令它们远离其在免疫系统中扮演的角色。当这些机制中的任何一个失败时,都可能具有自身反应性细胞蓄积池,而这些细胞变得在免疫系统中具有功能。随着该t细胞发育为成熟免疫细胞而通过胸腺内的消极选择过程而执行防止自身反应性t细胞被创建的机制。
一些感染,例如空肠弯曲菌(campylobacterjejuni)感染,具有与宿主本身的自体细胞类似(但不相同)的抗原。这种情况下,对空肠弯曲菌的正常免疫应答可导致抗体的产生,该抗体也与骨骼肌上的受体反应,但反应程度较低(即,重症肌无力)。自身免疫性疾病的病理生理学机制的一个主要理解是基因组相关性扫描的应用,其已经鉴别了自身免疫性疾病中一定程度的基因共享。
另一方面,自身免疫是自身反应性免疫应答(例如,自身抗体、自身反应性t细胞)的存在,伴有或不伴有自其导致的损害或病理。这也可能被限制在某些器官(例如,在自身免疫性甲状腺炎中),或牵涉不同位置的特定组织(例如,肺出血肾炎(goodpasture'sdisease),其可能影响肺和肾两者中的基底膜)。
多发性硬化
多发性硬化(ms)是一种脱髓鞘病,其中脑和脊髓中神经细胞的绝缘封盖物被损害。这一损害破坏了神经系统部件的通讯能力,导致一定范围的征兆和症状,包括身体问题、心理问题以及有时为精神问题。具体症状可包括复视、单眼致盲、肌无力、感知苦难、或协调性困难。ms有若干种形式,新症状或以孤立发作的方式出现(复发式)或随时间而积累(进行式)。两次发作之前,症状可完全消失;但永久性神经问题往往保留,尤其是伴随着疾病的发展。
尽管肇因不明,但潜在机制被认为或是由免疫系统造成的破坏或是髓鞘生成细胞的衰竭。所提出的肇因包括遗传因素和环境因素,例如由病毒感染触发。ms一般是基于存在的征兆和症状以及支持医学测试的结果而诊断的。
对于多发性硬化,没有已知的治愈案例。在发作之后尝试治疗以改善官能并防止新的发作。用于治疗ms的药物尽管疗效轻微,但可能具有副作用且耐受性差。理疗可能有助于人们的官能活动能力。很多人寻求替代性治疗,但缺乏证据。长期结局难以预测,且好的结局更常见于女性、在生命早期发展出该疾病的那些人、具有复发病程的那些人、和最初经历很少次发作的那些人。预期寿命比未受影响的人群平均短5至10年。
多发性硬化是最常见的影响中枢神经系统的自身免疫性疾病。在2015年,全球大约230万人受到影响,不同地区和不同人群的发病率差异很大。那一年大约18,900人死于ms,远超1990年的12,000人。该疾病一般在20岁至50岁之间开始出现,且女性发病率是男性的两倍。名称多发性硬化是指在脑白质和脊髓白质上发展出的大量瘢痕(瘢痕——作为斑块或病灶而更广为人知)。
胆汁淤积性瘙痒
痒(也称为瘙痒)是造成抓挠的欲望或反射的感觉。痒已经抵制了很多尝试将其归类为任一种类型的感官体验的尝试。现代科学已经显示,瘙痒与疼痛具有很多相似性,而尽管两者都是吾令人愉悦的感官体验,但它们的行为应答模式不同。疼痛创建躲避反射,而瘙痒导致抓挠反射。用于瘙痒和疼痛的背根神经节中初级感觉神经元的无髓神经纤维都起源于皮肤,但它们的信息在两个截然不同的系统中集中传递,而这两个系统使用相同的神经束和脊髓丘脑束。
胆汁淤积性瘙痒是由于任何早期肝病造成的瘙痒,但与之关联性最高的实体是原发性胆汁性肝硬化、原发性硬化性胆管炎、阻塞性胆总管结石、胆管癌、胆汁淤积(也见药物诱发的瘙痒)、以及慢性丙肝病毒感染和其它形式的病毒性肝炎。
胆汁淤积意为“胆汁流动缓慢或停滞”,其可能由任何数量的肝脏(其产生胆汁)、胆囊(其存储胆汁)或胆管(也称胆管树,是允许胆汁离开肝脏和胆囊并进入小肠的通道)疾病造成。当这一疾病出现时,一般将会在胆汁中清除的缀合胆红素和废物回流到血流中。这造成主要为缀合胆红素的高胆红素血症和黄疸;肝脏结合胆汁以将其变为水溶性的,并且因为胆汁已经被肝脏处理过,当胆汁因为障碍而流回并回流到血液中时,血液将具有高水平的缀合胆红素。这与主要是未缀合胆红素的高胆红素血症形成对比,未缀合胆红素是结合至血清白蛋白的水溶性形式的胆红素;肝脏尚没有缀合胆红素的机会,且或可因为形成过多的未缀合胆红素而造成(例如在大量溶血或无效性红细胞生成中)或可因为被结合的胆红素过少而造成(吉伯氏病(gilbert'sdisease)或crigler-najjar综合征)。未结合高胆红素血症通常不造成瘙痒。
一般认为,沉积在皮肤中的胆汁盐对瘙痒(痒)负有责任,但血流中胆红素水平和瘙痒严重性的关联性似乎并不高。已经给药胆汁盐螯合剂的患者并未报告一定程度的缓解,而患有完全肝细胞衰竭(并因此不能产生这些以其作为起始的产物)的患者不具有瘙痒。这暗示由肝脏产生的产物在瘙痒中一定扮演某种角色。
慢性的痒或瘙痒造成更大痛苦(halvorsenja,etal.actadermvenereol92:543-6(2012))。临床相关的慢性瘙痒是多种病理学的结果(ikomaa,etal.natrevneurosci7:535-47(2006))。一个主要肇因是胆汁淤积。胆汁淤积是分泌胆汁的能力受损的结果,且可由于包括胆管的解剖型梗阻和肝衰竭在内的多种病理学而出现(bergasanv.pruritusofcholestasis.initch:mechanismsandtreatment,ed.ecarstens,takiyama.bocaraton(fl).numberof.(2014))。由胆汁淤积造成的瘙痒是非组胺能的,且可使用潜在疾病病理学解决方案而得以解决(bergasanv.pruritusofcholestasis.initch:mechanismsandtreatment,ed.ecarstens,takiyama.bocaraton(fl).numberof.(2014))。假设胆汁淤积性瘙痒是胆汁中存在的致痒原所导致的。目前,内源性阿片类物质、胆汁酸(ba)和溶血磷脂酸(lpa)是三类被建议治疗胆汁淤积性瘙痒的主要候选物。
内源性阿片类物质在胆汁淤积动物模型和患者两者的血清中均上调(swainmg,etal.1992.gastroenterology103:630-5(1992);thorntonjr,losowskyms.bmj297:1501-4-29(1988);thorntonjr,losowskyms.jhepatol8:53-9(1989);thorntonjr,losowskyms.gut30:1392-5(1989))。在小型临床试验中,阿片拮抗剂纳洛酮(naloxone)和纳美芬(nalmefene)被证明在控制胆汁淤积性瘙痒中有效(bergasanv.amjgastroenterol93:1209-10(1998);bergasanv,etal.hepatology27:679-84(1998);bergasanv,etal.gastroenterology102:544-9(1992);swainmg,etal.1992.gastroenterology103:630-5(1992))。ba,胆固醇的类固醇代谢物,在胆汁淤积患者血清中也增多,但它们的水平与患者报告的瘙痒强度不相关(bergasanv.pruritusofcholestasis.initch:mechanismsandtreatment,ed.ecarstens,takiyama.bocaraton(fl).numberof.(2014))。在一系列人类临床试验中,ba结合树脂被验证在缓解瘙痒中是有效的(dattadv,sherlocks.gastroenterology50:323-32(1966);europeanassociationforthestudyofthel.easlclinicalpracticeguidelines:managementofcholestaticliverdiseases.jhepatol51:237-67(2009))。但是,这些结论一直受到质疑(kremerae,etal.gastroenterology139:1008-18,(2010);kuiperem,etal.hepatology52:1334-40(2010))。在2013年,在瘙痒编码感觉神经元中鉴别出了tgr5,一种胆汁酸受体(alemif,etal.jclininvest123:1513-30(2013))。最终,胆汁淤积患者血清中的自家趋化素(将溶血磷脂酰胆碱转化为lpa的酶)得以上调(kremerae,etal.gastroenterology139:1008-18,(2010))。这一升高唯一性地出现在报告瘙痒的患者中(kremerae,etal.hepatology56:1391-400(2012))。
内源性阿片类、ba和lpa是非组胺能瘙痒的全部实例。胆汁淤积患者不展现传统的组胺释放征兆如红斑或肿胀(bergasanv.pruritusofcholestasis.initch:mechanismsandtreatment,ed.ecarstens,takiyama.bocaraton(fl).numberof.(2014))。此外,抗组胺药在治疗胆汁淤积性瘙痒中无效,仅少数患者报告其症状的临床改善(bergasanv.clinliverdis12:385-406(2008);bergasanv.pruritusofcholestasis.initch:mechanismsandtreatment,ed.ecarstens,takiyama.bocaraton(fl).numberof.(2014))。
胆汁淤积和胆红素
胆汁淤积一般将导致黄疸——皮肤和眼睛的黄化。由于沉积在皮肤中的胆红素水平升高而出现黄疸。胆红素是血红素的下游代谢物。在细胞内,血红素被血红素氧化酶1(hmox1)裂解为胆绿素,其随后被胆绿素还原酶(bvr)还原为胆红素。胆红素是极其亲脂的,且据信能跨越细胞膜。在血液中,胆红素被白蛋白结合。在肝脏中,ugt1a*28将胆红素结合至葡萄糖醛酸以形成水溶性化合物。缀合胆红素和未缀合胆红素两者均排泄在胆汁中。在人类健康方面,据信胆红素是具有心血管保护有益效果的生理抗氧化剂(bulmerac,etal.proglipidres52:193-205(2013);vitekl.,etal.atherosclerosis160:449-56(2002))。
mrgpr和非组胺能瘙痒
mas相关g蛋白偶联受体(mrgpr)已经被牵连到非组胺能瘙痒中,作为致痒原配体的受体并作为瘙痒编码神经元的分子标记物(liuq,etal.jneurosci32:14532-7(2012);liuq,etal.cell139:1353-65(2009))。小鼠体内存在超过27种被表达的mrgpr,仅一部分具有已知的生理配体(mcneilb,dongx.neuroscibull28:100-10(2012))。人体内存在4种被表达的mrgpr(mrgprx1至mrgprx4)。已经鉴定,mrgprx1、mrgprx3和mrgprx4被特异性地表达在人drg和三叉神经节(tg)中,而mrgprx2已经在人肥大细胞中被发现(flegelc,etal.plosone10:e0128951(2015);goswamisc,etal.molpain10:44(2014);lembopm,etal.natneurosci5:201-9(2002);mcneilbd,etal.nature519:237-41(2015))。
mrgprx3/mrgpra6
mas相关g蛋白偶联受体成员x3是人体内由mrgprx3基因编码的蛋白质。mas1致癌基因是g蛋白偶联受体,其结合血管紧张肽-ii代谢物血管紧张肽-(1至7)。当通过结合血管紧张肽-(1至7)而被活化时,mas1受体具备很多种血管紧张肽-ii活化的血管紧张肽受体的效果。mas1受体激动剂具有与血管紧张肽-ii受体拮抗剂相似的疗效,包括降低血压。
人类mrgprx3及其鼠同源物mrgpra6被表达在角化细胞和背根神经节(drg)内的初级感觉神经元中。更重要的是,抗微生物肽防御素和抗菌肽(cathelicidin)是mrgprx3和mrgpra6的激动剂。防御素和抗菌肽可在多种疾病和病症中扮演角色,该疾病和病症包括创伤愈合、慢性炎症、恶性转化、皮肤病如银屑病和皮炎、呼吸道和胃肠道疾病、疼痛和瘙痒。以mrgprx3和mrgpra6为靶向可治疗创伤愈合、慢性炎症、恶性转化、皮肤病如银屑病和皮炎、呼吸道和胃肠道疾病、疼痛和瘙痒。在如本文所述的本公开之前,mrgprx3在任何生物学过程和疾病中扮演的角色是未知的。因此,使用基于表达mrgprx3的细胞的试验和mrgpra6突变鼠来筛选并测试以这些反应为靶向的药物也是新颖的。表达mrgprx3的细胞系是新颖的,且对于药物筛选的高通量筛选是重要的。
损伤和病原体入侵触发了针对复原受损组织的一连串炎性应答和修复应答。还长期关注的是,重复刺激和慢性炎症是癌症的强风险因素。对创伤愈合过程的彻底理解将因此提供对各种癌症肇因的重要深入了解,并据此对其预防提供深入了解。该过程期间释放的大量宿主防御分子是一个抗微生物肽(amp)的大家族,名为防御素。由于这些amp除了直接杀死病原体之外还在炎性应答的多个阶段对多种类型的细胞发挥五花八门的免疫调节作用,这些amp特别有趣。特别地,人类β-防御素hbd3已经显示通过刺激上皮细胞迁移和增殖而有助于创伤愈合。如本文所述,新颖的g蛋白偶联受体(gpcr)——mrgprx3——是人类角化细胞和其它类型的上皮细胞中的防御素受体。如本文所述,在体内外检查了针对作为人类mrgprx3的鼠科动物同源物的鼠基因mrgpra6的配体同源性和表达谱以及这些受体的生理学和细胞生物学功能。
皮肤是最大的免疫器官,并且是对抗感染性挑战的第一道防线。当损伤和病原体入侵时,作为保护性应答,炎症级联反应被快速触发(pasparakis,m.,etal.natrevimmunol14,289–301(2014);singer,a.j.&clark,r.a.f.n.engl.j.med.341,738–746(1999))。局部皮肤炎症的特征为“伴有热和疼痛的红肿”,如古代罗马人所记载(owen,j.a.,etal.immunology.(w.h.freeman,2013)),并且牵涉多种类型的细胞和大量分子介体。这一复杂过程牵涉免疫、神经、血管和上皮系统的协同动作,并且对于我们的生存来说至关重要。
人类β-防御素hbd3促进角化细胞迁移和创伤愈合。防御素是抗微生物肽(amp)的一个大家族。这些阳离子肽由上皮和免疫细胞在组织损害和感染后立即产生,并且可杀死光谱的病原体(pazgier,m.,etal.cell.mol.lifesci.c.63,1294–1313(2006);amid,c.etal.bmcgenomics10,1–13(2009))。除了直接杀死之外,防御素也发挥多种免疫调节功能。人β-防御素3(hbd3)展现广泛的功能,包括对于各种免疫细胞的趋化活性(ganz,t.natrevimmunol3,710–720(2003);
mrgprx3是人类角化细胞中的主要hbd3受体。mrgprx3属于gpcr的mas相关g蛋白偶联受体(mrgpr)家族。如本文所述,过去十年的研究已经透露了这些受体在感觉神经元和免疫细胞内的不同表达模式和功能(liu,q.etal.cell139,1353–1365(2009);han,l.etal.natneurosci16,174–182(2013);mcneil,b.d.etal.nature519,237–241(2015))。4种人mrgprx中,mrgprx3在包括角化细胞在内的上皮细胞内高度表达,而其它的则是drg神经元、肥大细胞或其它免疫细胞类型特异性的(hruz,t.etal.adv.bioinformatics2008,420747(2008);kiatsurayanon,c.etal.j.dermatol.sci.doi:http://dx.doi.org/10.1016/j.jdermsci.(2016.05.006))。使用通用启动子过表达人mrgprx3,在大鼠体内诱发了角化细胞异常增生(kaisho,y.etal.biochem.biophys.res.commun.330,653–657(2005))。如本文所述,在初代人类角化细胞中的ca2+成像和敲除实验证明,mrgprx3为细胞应答hbd3所需。表达分析和配体同源性进一步指出,鼠基因mrgpra6作为mrgprx3的鼠科动物同源物,打开了对这些受体进行体内研究的大门。
创伤愈合
在未受损的皮肤中,表皮(表面层)和真皮(更深层)形成对抗外部环境的保护性屏障。当该屏障被打破,一组精心设计的生化级联事件被设定启动以修复损伤。这一过程被分为可预测的分期:血液凝固(止血)、炎症、组织生长(增殖)和组织重构(化脓)。血液凝固可视为炎症阶段的一部分而非独立阶段。
止血(血液凝固)是创伤愈合过程早期阶段的开端。在受伤后的最早数分钟内,血液中的血小板开始粘住受伤部位。这活化了血小板,造成一些事情发生。它们变化为更适合凝固的不确定形状,并且它们释放化学信号以促进凝固。这导致血纤蛋白的活化,其形成网状并发挥“胶水”的作用以将血小板彼此结合。这形成用作栓塞血管破裂处的凝块,减缓/防止进一步的流血。
在验证期过程中,受损的和死亡的细胞随着细菌和其它病原体或碎片一起被清除。这通过吞噬作用过程发成,其中白血球通过吞没碎片而将其“吃掉”。在增殖期过程中,血小板源生长因子被释放到伤口内,造成细胞的迁移和分裂。
在增殖(新组织生长)期内,出现胶原蛋白沉积、肉芽组织形成、上皮形成和伤口收缩。在血管新生中,血管内皮细胞形成新的血管。在纤维组织形成和肉芽组织形成中,成纤维细胞生长并通过排除胶原蛋白和纤连蛋白而形成新的、临时的细胞外基质(ecm)。同时,出现表皮的表皮细胞再生,其中上皮细胞增殖并在创面上“爬行”,提供对新组织的覆盖。在伤口收缩中,成肌纤维细胞通过抓紧伤口边缘而减小伤口尺寸,并使用类似于平滑肌细胞中的机制收缩。当细胞的角色接近完成时,不需要的细胞进行细胞凋亡作用。
在化脓和重构过程中,胶原蛋白沿着拉力线重新对准,通过程序性细胞死亡或细胞凋亡作用移除不再被需要的细胞。创伤愈合过程不仅复杂而且脆弱,并且它容易中断或失败,导致非愈合性慢性创伤的形成。对非愈合性慢性创伤富有责任的因素是糖尿病、静脉或动脉疾病、以及老年性代谢缺陷。
树突细胞
树突细胞(dc)是哺乳动物免疫系统的抗原呈递细胞(也称为辅助细胞)。它们的主要功能是处理抗原材料并将其呈递在免疫系统的t细胞表面上。它们充当固有免疫系统和适应性免疫系统之间的信使。树突细胞存在于那些与外部环境接触的组织如皮肤中(该处选自被称为朗格汉斯细胞(langerhanscell)的特定树突细胞类型)和鼻子、肺、胃和肠的内壁中。它们也可以未成熟状态见于血液中。一旦被活化,它们就迁移到淋巴结,在该处,它们与t细胞和b细胞相互作用以启动并塑造适应性免疫应答。不成熟的树突细胞也称为面纱细胞,这是因为它们具备大的细胞质“面纱”而非树突。
背根神经节
背根神经节(或脊髓神经节)(也称为后根神经节),是脊神经背根中的一簇神经细胞体(神经节)。背根神经节含有感觉神经元的细胞体(传入)。感觉神经元,也称为传入神经元,是经由它们的受体将特定类型的刺激转化为动作电位或分级电位的神经元。这一过程称为感觉转导。感觉神经元的细胞体定位在脊髓的背神经节中。初级感觉神经元是传入通路中的第一个,在该受体处开始并在具有次级感觉神经元的突触处终止,一般在中枢神经系统的核心内。
这一感觉信息沿着传入神经纤维在传入神经或感觉神经中游走,经由脊髓到达脑部。刺激可来自身体外的外感受器,例如光和声,或来自身体内的内感受器,例如血压或体位感。不同类型的感觉神经元具有不同的感觉受体,该感觉受体应答不同种类的刺激。
背根神经节神经元的轴突也称为传入神经。在周围神经系统中,传入神经是指将感觉信息传递给中枢神经系统(即,脑和脊髓)的轴突。神经元由三个部分组成:树突,其接收信息并将其传递至体细胞;体细胞,神经元的细胞体;以及轴突,其传递来自体细胞的信息。在神经元中,树突在突触部接收来自另一神经元轴突的信息,轴突将信息发送至下一个神经元的树突,即便树突上可能覆盖有髓磷脂。
质子感应g蛋白偶联受体被背根神经节感觉神经元表达,且可在酸诱发的伤害感受中扮演角色。在一些具体例中,背根神经节的初级感觉神经元中的g蛋白偶联受体(例如,mrgprx4或mrpgra1)介导感觉如疼痛和瘙痒。
背根神经节神经元的神经末梢具有各种感觉受体,该感觉受体被机械刺激、热刺激、化学刺激和有害刺激活化。高阈值通道在伤害感受中可能扮演角色。脊髓内释放的背神经末梢的突触前调节可能通过某些类型的gabaa受体出现,这可控制伤害感受和痛觉传输。
hek293细胞
人胚胎肾293细胞,一般也称为hek293、hek-293、293细胞,或较不精确地称为hek细胞,是起源于在组织培养中生长的人胚胎肾细胞(来自流产的人类胚胎)和起源于死产动物的特异性细胞系。hek293细胞极易生长,极易转染,并且多年来已经广泛用于细胞生物学研究。生物技术工业中也使用它们来生产治疗性蛋白质和用于基因疗法的病毒。本文描述稳定地表达mrgprx3或mrgprx4的hek293细胞。
药物组合物
在某些具体例中,本发明提供包含本发明所采用药剂的药物组合物。该药剂可稳定地配制并通过已知的用于此类递送的任何手段引入受试者体内或细胞环境中。
此类组合物典型包括该药剂和药学可接受的载体。如本文中所用,词语“药学可接受的载体”包括与药物给药相容的盐水、溶剂、分散介质、包衣、抗细菌剂、抗真菌剂、等渗和吸收延迟剂等。也可将补充活性化合物并入组合物中。
将药物组合物配制为与其预期的给药途径相容。给药途径的实例包括肠道外给药,例如,静脉内、真皮内、皮下、口服(例如,吸入)、透皮(外用)、经粘膜和直肠给药。用于肠道外、真皮内或皮下应用的溶液或悬浮液包括以下组分:无菌稀释剂如注射用水、盐水溶液、固定油、聚乙二醇、甘油、丙二醇或其它合成溶剂;抗细菌及如苯甲醇或对羟基苯甲酸甲酯;抗氧化剂如抗坏血酸或亚硫酸氢钠;螯合剂如乙二胺四乙酸;缓冲剂如醋酸盐、柠檬酸盐或磷酸盐;以及用于调节张度的试剂如氯化钠或葡萄糖。可使用酸或碱如盐酸或氢氧化钠调节ph。肠道外制剂可密封在由玻璃或塑料制成的安瓿、一次性注射器或多个剂量瓶中。
适用于注射用途的药物组合物包括无菌水溶液(若是水溶性的),或用于临时制备无菌可注射溶液或分散液的分散体和无菌粉末。对于静脉内给药,适合的载体包括生理盐水、抑菌水、cremophorel.tm.(basf,parsippany,n.j.)或磷酸盐缓冲盐水(pbs)。在所有情况下,组合物必须是无菌的,并且应该是容易达到可注射性程度的流体。其在制造和存储条件下应稳定,且必须防止微生物如细菌和真菌的污染活动。载体可以是溶剂或分散介质,其含有例如水、乙醇、多元醇(例如,甘油、丙二醇和液体聚乙二醇等)、以及它们的合适的混合物。举例而言,可通过使用涂层如卵磷脂、通过在分散液情况下维持所需的粒径、以及通过使用表面活性剂,维持适宜的流动性。可通过各种抗细菌剂和抗真菌剂例如对羟基苯甲酸酯类、氯丁醇、苯酚、抗坏血酸、硫柳汞等实现对于微生物活动的阻止。在很多情况下,在组合物中包括等渗剂如糖、多元醇如甘露醇和山梨醇、氯化钠将是优选的。可通过在组合物中包括延迟吸收的药剂如单硬脂酸铝和明胶带来延长的对于可注射组合物的吸收。
可通过将处于所选择溶剂中的所需量的活性化合物与上文枚举的成分中的一种或组合按需要合并,之后过滤灭菌而制备无菌可注射溶液。通常,可通过将活性化合物并入含有基础分散介质和所需的上文枚举的其它成分的无菌媒介物中来制备分散液。在用于制备无菌可注射溶液的无菌粉末的情况下,优选的制备方法是真空干燥和冻干,其导致活性成分加上任何来自其先前无菌过滤溶液的额外所需成分的粉末。
口服组合物通常包括惰性稀释剂或可食用的载体。出于口服治疗性给药的目的,可将活性化合物与赋形剂合并,并以片剂、锭剂或胶囊剂如明胶胶囊的形式使用。口服组合物也可使用作为漱口液而使用的流体载体制备。可包括药学上相容的粘合剂和/或佐剂材料作为组合物的一部分。片剂、丸剂、胶囊剂、锭剂等可含有以下任意成分或类似特性的化合物:粘合剂,如微晶纤维素、黄蓍胶或明胶;赋形剂,如淀粉或乳糖;崩解剂,如藻酸、primogel或玉米淀粉;润滑剂,如硬脂酸镁或sterotes;助流剂,如胶体二氧化硅;甜味剂,如蔗糖或糖精;或芳香剂如薄荷、水杨酸甲酯或橙味剂。
本发明的组合物也可配制为纳米颗粒制剂。可给药本发明的化合物用于中间释放、延迟释放、修正释放、持续释放、脉冲释放和/或控制释放应用。本发明的药物组合物可含有0.01%至99%(w/v)的活性材料。对于吸入给药,化合以气溶胶喷雾的形式从加压容器或分散器中递送,该容器或分散器含有适合的推进剂,例如,气体如二氧化碳,或从喷雾器中递送。此类方法包括美国专利6,468,798中描述的那些。
也可通过经粘膜或经皮手段进行全身性给药。对于经粘膜或经皮给药,在配制中使用合乎待渗透的障碍物所需的渗透剂。此类渗透剂是该领域中通常所知的,其包括,例如,用于经粘膜概要的清洁剂、胆汁盐和梭链孢酸衍生物。可通过使用鼻腔喷雾或栓剂执行经粘膜给药。对于经皮给药,将活性化合物配制在油膏、套、凝胶或乳霜内,如给领域中通常已知的。化合物也可制备为用于直肠递送的栓剂(例如,具有传统栓剂基质如可可脂和其它甘油酯)或保留灌肠剂的形式。
在一个具体例中,活性化合物制备为具有将保护该化合物不被从身体内快速清除的载体,例如控制释放配方,包括移植物和微胶囊化递送体系。可使用生物可降解的、生物相容的聚合物,如乙烯-醋酸乙烯酯、聚酐、聚乙醇酸、胶原、聚原酸酯和聚乳酸。此类制剂可使用标准技术制备。材料可从阿尔扎公司(alzacorporation)和诺华制药公司(novapharmaceuticals,inc.)商购而得。脂质体悬浮液(包括以被感染细胞为靶向的脂质体和病毒抗原的单克隆抗体)也可用作药学可接受的载体。这可根据该领域技术人员已知的方法制备,例如,美国专利4,522,811中所述。
可通过标准药学过程在细胞培养物或实验动物体内测定此类化合物的毒性和疗效,例如,测定ld50(将群体的50%致死的剂量)和ed50(对群体的50%为治疗有效的剂量)。毒性与疗效之间的加量比率是治疗指数,其可表达为ld50/ed50比。优选展现高治疗指数的化合物。尽管可使用展现毒副作用的化合物,但应谨慎设计将此类化合物靶向引导至受影响组织位点的递送体系,以便最小化对未受影响细胞的潜在损害,从而降低副作用。
可使用从细胞培养试验和动物研究获得的数据来制定用于人体的剂量范围。此类化合物的剂量优选处于循环浓度范围内,该范围包括低毒或无毒的ed50。剂量可在这一范围内变动,取决于所采用的剂型和所使用的给药途径。对于在本发明方法中使用的化合物,最初可从细胞培养试验中评估治疗有效剂量。可在动物模型中制定实现循环血浆浓度范围的剂量,该范围包括如在细胞培养中测得的ic50(即,实现对症状的半最大抑制的测试化合物浓度)。此类信息可用来更准确地测定人体中的可用剂量。举例而言,可通过高效液相色谱测量血浆中的水平。
如本文所定义,药剂的治疗有效量(即,有效剂量)取决于所选择的药剂。例如,可给药大约1pg(皮克)至1000mg范围内的单次剂量的药剂;在一些具体例中,可给药10pg、30pg、100pg、1000pg、10ng、30ng、100ng、1000ng、10μg、30μg、100μg、1000μg、10mg、30mg、100mg、1000mg。在一些具体例中,可给药1至5g的组合物。
可通过该领域中已知的方法确定本发明化合物的治疗有效量。本发明药物组合物的治疗有效数量除了取决于所选择的药剂和/或所使用的药物组合物之外,还取决于患者的年龄和通常生理状况以及给药途径。在某些具体例中,治疗剂量将通常为介于约10与2000mg/天之间,且优选介于约30与1500mg/天之间。可使用其它范围,包括例如50至500mg/天、50至300mg/天、100至200mg/天。
给药可以是每天一次、每天两次或更频繁,且可在疾病或病症的维持期过程中降低频率,例如,每两天或三天一次而非每天一次或每天两次。剂量和给药频率将取决于临床迹象,这些迹象证实缓解期的存在,伴有该领域技术人员所知的至少一种或更优选超过一种急性期临床迹象的减轻或不存在。技术人员应了解,某些因素可能影响有效治疗受试者所需的剂量和时机,这些因素包括但不限于,疾病或病症的严重性、先前进行的治疗、受试者的通常健康情况和/或年龄、以及存在的其它疾病。此外,使用治疗有效量的药剂治疗受试者可包括单一治疗,或者任选地,可包括一系列治疗。
应当了解,将药剂引入细胞环境中的方法将取决于细胞的类型及其微环境的构成。必须引入合适的量的药剂,且这些量可使用标准方法经验性地确定。个体药剂在细胞环境中的例示性有效浓度可以是500微摩尔/升或更低、50微摩尔/升或更低、10微摩尔/升或更低、1微摩尔/升或更低、500纳摩尔/升或更低、50纳摩尔/升或更低、10纳摩尔/升或更低,或甚至可使用其浓度为1纳摩尔/升或更低的组合物。
药物组合物可与给药说明一起包括在试剂盒、容器、包装或分配器中。
提出下述实施例以向该领域技术人员提供对于如何制作并使用本发明的测定、筛选和治疗方法的完全公开和说明,但并不试图限制发明人所认定的发明范畴。
[实施例]
实施例1:实施例2-11的材料和方法
使用下述材料和方法。
动物
野生型129s1/svlmj、野生型balb/cj和balb/c基因背景下的rag1-/-(c.129s7(b6)-rag1tm1mom/j)购自杰克逊实验室(jacksonlaboratory),在约翰霍普金斯医学院(johnshopkinsschoolofmedicine)内在无特定病原体条件下饲养。动物维持在12小时昼夜循环下,并任意采食高压蒸汽处理的食物和过滤水。使用8至10周龄的动物进行全部其它实验。所有动物均在约翰霍普金斯大学医学院(johnshopkinsuniversityschoolofmedicine)动物护理和使用委员会机构(institutionalanimalcareandusecommittee)批准的方案下实施操作。通过设盲条件实验实施牵涉在wt和突变样本和动物体内进行同等治疗的所有实验。
用于钙成像的药物制剂
在实验当天准备新鲜的拉莫三嗪(ltg)、别嘌呤醇、卡巴咪嗪(carbamazepine)和奥卡西平(全部来自sigma)。首先将这些药物溶解在二甲基亚砜(dmso)中,随后在使用前以至少10000x稀释到钙成像缓冲液中。每个实验中药物的最终浓度标注在对应的图注说明中。
hek293细胞培养和转染
在37℃,在生长培养基(dmem,以10%热灭活胎牛血清(fbs)、100u/ml青霉素和100mg/ml链霉素补充)中培养hek293人胚胎肾细胞(atcc)。为了生成表达mrgpr的细胞,使用lipofectamine3000(invitrogen)以pcdna3.1哺乳动物表达质粒瞬时转染hek293细胞,该质粒中插有编码mrgpr基因的cdna(mrgprx4和突变mrgprx4除外,它们被克隆并插入plx304载体中)。如先前所述,生成表达mrgpra1-gfp、mrgprc11-gfp和mrgprx4-gfp的稳定细胞系。简单地说,使用编码融合至质粒内mrgpr蛋白质c端的gfp的cdna转染hek293。使用博来霉素(zeocin)或杀稻瘟菌素在以10%fbs补充的dmem中选择被转染的细胞。每个克隆的细胞被进一步选择为稳定细胞系,并印证受体-gfp融合蛋白的膜定位。
hek293细胞中的钙成像
在最初的实验中,将hek293细胞种植在涂覆有100μg/ml聚-d-赖氨酸的盖玻片上,并用含有mrgpr基因的载体瞬时转染,培养24至48小时后,在37℃在黑暗中令细胞加载fura2-乙酰氧基甲酯钙指示剂(0.5μm,分子探针公司(molecularprobes))和普朗尼克(pluronic)f-127分散剂(0.1%,molecularprobes)30分钟,随后用钙成像缓冲液(cib;nacl125mm、kcl3mm、cacl22.5mm、mgcl20.6mm、hepes10mm、葡萄糖20mm、nahco31.2mm、蔗糖20mm,使用naoh调节至ph7.4)洗涤。将药物加入加载fura2的细胞中,使用基于显微镜的成像系统(nikoneclipsete200),使用340nm和380nm激发波长以及在520nm测量的发射来测量细胞内的游离钙。以1秒钟的间隔持续监测340/380nm激发下发射荧光比率的变化。之后,使用mrgpra1-gfp、mrgprc11-gfp和mrgprx4-gfp稳定细胞系执行实验,以印证从瞬时表达细胞获得的发现。
ec50测定
将稳定地表达mrgpra1或野生型和突变mrgprx4两者的hek细胞在96孔板上的100μl培养基中种植过夜。次日,将培养基替换为来自flipr钙5检验试剂盒(moleculardevices)的含染料溶液,稀释在具有20mmhepes的ph7.4的汉克平衡盐溶液(hank'sbalancedsaltsolution(hbss))中。在37℃孵化1小时后,令细胞在室温下在黑暗中恢复10分钟,随后在flexstation-3(分子装置公司(moleculardevices))中实施细胞内钙动员试验。被测试药物以3x浓度制备在hbss/hepes溶液中。根据制造商的说明,对各孔成像并进行同步数据采集180秒,在开始成像20秒之后,加入50μl药物。在至少三个独立的孔内测试物质,并对信号取平均值。通过从最大信号(在使用药物刺激之后获得)减去最小信号(在加入药物之前以基础水平获得)来确定应答。使用
药物标记和内化试验
为了使用红色荧光染料标记药物,首先将1μg的ltg溶解在50μl二甲基甲酰胺(dmf)中,再用450μl反应缓冲液(0.1m碳酸氢钠缓冲液,ph9.0)稀释以获得浓度为7.8mm的ltg。然后,将50μl的以10mg/ml溶解在dmf的texas-红结合磺酰氯(thermofisherscientific,t1905)缓慢加入ltg溶液中。将反应在4℃和连续搅拌下孵化1小时。随后将混合物稀释到细胞培养基中以备后续使用。以德克萨斯红染料标记的ltg可创建明亮的红色荧光,其最大激发/发射为大约595/615nm。在具有10%fbs的dmem中生长稳定地表达mrgpra1-gfp、mrgprc11-gfp或mrgprx4-gfp融合蛋白的hek293细胞。血清饥饿4至6小时后,或使用培养基、单独使用染料、未标记的ltg或使用德克萨斯红标记的ltg在37℃处理细胞15或60分钟。用pbs洗涤细胞,用4%多聚甲醛固定在pbs中。在400倍放大的共聚焦荧光显微镜(zeisslsm700)下将mrgpr-gfp或药物的亚细胞定位可视化。
ltg结合能力
使用shimadzulc-2010a仪器(日本京都的岛津公司(shimadzu,kyoto,japan))执行cmc分析,该仪器由泵、脱气机、自动进样器、柱箱和二极管阵列检测器组成。通过岛津公司(shimadzu)的lab-solution程序获取数据。流动相由磷酸盐缓冲盐水(pbs;5mm,ph7.4)组成,并以0.2ml/min的流速输送。通过将标准药物单独溶解在甲醇中制备拉莫三嗪的原液(100μm)。通过使用流动相稀释原料溶液而制备各种浓度的标准溶液。如下所述准备mrgprx2/cmc柱和mrgprx4/cmc柱。简单地说,收获表达mrgprx4的hek293细胞(1×108)并离心(1000g,10分钟,4℃)。通过在4℃以1000g离心10分钟而用生理盐水(ph=7.4)洗涤细胞。通过超声波将细胞在tris-hcl(50mm,ph=7.4)中裂解30分钟,并在4℃以1000g离心10分钟,离心两次。随后在4℃以12000g将收集的上清液离心20分钟,将球丸再次悬浮在5ml的冰冷生理盐水溶液中。将二氧化硅(45mg)在105℃活化30分钟。在4℃搅动且在真空下,用该活化的二氧化硅将细胞膜悬浮液均质化/吸附过夜。随后用蒸馏水洗涤细胞膜固定相,再使用湿封装过程封装到柱内(10mpa,5分钟)以获得cmc柱。
通过如下所述的mrgprx4/cmc体系手段测定拉莫三嗪的kd值。将各化合物的标准溶液单独加入流动相中以获得一组新的流动性,浓度范围分别为2.0×10-8m、4.0×10-8m、8.0×10-8m、1.6×10-7m和3.2×10-7m。将这一具有不同浓度的各化合物的流动相以0.2ml/min的流速在梯度程度下单独泵送通过mrgprx4/cmc,记录不同浓度化合物的穿透曲线。根据方程4,获得[lr]倒数值vs.[l]m的相应图表。此外,通过计算截距与斜率的比值而确定kd,并从截距的倒数获得[r]。
mrgpra1敲除-egfp敲入小鼠生成
sjs/ten小鼠模型
对8至10周龄的雄性鼠每天一次口服强饲悬浮在盐水中的致病药物(ltg、别嘌呤醇、奥卡西平)或盐水。如标注,剂量是基于毫克每千克动物体重的(例如,ltg为50mg/kg体重)。每天监测皮肤、眼睛和粘膜、生存率、体重、体态和大体外观(尤其是眼睛、粘膜和皮肤上)。
组织学分析和免疫染色
用戊巴比妥深度麻醉动物,并心内灌注20ml的0.1m冷pbs(ph7.4),之后心内灌注25ml的冷4%多聚甲醛(pfa)。切下爪皮、眼皮、脾、淋巴结,在4%pfa中固定超过两小时,在4℃先后在20%蔗糖溶液和30%蔗糖溶液中低温保存24小时。将组织样本包埋在最适切割温度(oct)中,并在连续切割为20μm切片并置于载玻片上之前一直冷冻。根据制造商的使用说明书,使用标准过程执行苏木精和曙红(h&e)染色(vitroviewtmh&e染色试剂盒)。为了定量凋亡细胞的量,通过下述apo-brdudna碎片化检验试剂盒(biovision)的方案执行末端脱氧核苷酸基转移酶dutp原位末端标记(tunel)分析,一种通过标记核酸末端而检测由凋亡细胞造成的dna碎片化的方法。为了评估组织中的总细胞数,所有细胞核均使用碘化丙啶染色。在200倍放大的共聚焦荧光显微镜(zeisslsm700)下捕获数码照片。计数tunel阳性细胞核数,并记录为其占在皮肤表皮层中观察到的总细胞核的百分比。
对于颗粒酶b免疫染色,用0.3%tritonx-100pbs溶液洗涤载玻片,在封闭液(10%正常山羊血清)中孵化1小时,然后在室温下用抗鼠颗粒酶b生物素(ebioscience,克隆号16g6)在封闭液中的1:500稀释液中孵化30分钟,使用abc试剂盒(vectorlaboratories)和tmb底物试剂盒(vectorlaboratories)如公司手册所述显色。
对于免疫荧光染色,洗涤载玻片,用10%正常山羊血清封闭,然后在4℃用稀释在封闭液中的以下初级抗体孵化过夜:鸡抗gfp(1:500,aveslabs)、alexafluor594仓鼠抗鼠cd11c(1:500,biolegend,克隆号n418)、alexaflour647大鼠抗鼠cd3(1:500,biolegend,17a2)、alexafluor594抗鼠cd8a(1:500,biolegend,53-6.7)。用0.3%triton溶液洗涤载玻片。对于gfp染色,然后将载玻片在室温下在alexaflour488山羊抗鸡igy(1:1000,thermofisher)中孵化2小时。接着,在pbs中洗涤载玻片,之后用防褪色溶液封固进行成像。
小鼠tnf-α和颗粒酶b的测量
在每天投药9天后,收集来自sjs/ten模型鼠的爪皮。将组织称重,并使用bio-genpro200均质仪(proscientific)在含有蛋白酶抑制剂鸡尾酒混合物(cellsignalingtechnology)的冷pbs中均质化。随后将匀浆在4℃以10,000g离心10分钟。使用
gfp+细胞的荧光活化细胞分类(facs)
为了表征来自mrgpra1gfp/gfp鼠的gfp+细胞,将该鼠的脾脏和淋巴结切为小片,并在37℃下在含有1mg/ml胶原蛋白酶d(sigma-aldrich)和30μg/mldnasei(worthingtonbiochemical)的rpmi1640培养基中消化30分钟。随后通过70-μm网状尼龙细胞过滤器(bdfalcon)过滤经消化的组织,以生成单细胞悬浮液。在室温下将脾细胞悬浮液中的污染红细胞在ack裂解缓冲液(qualitybiological)中裂解5分钟。剩余的细胞用pbs洗涤两次,并在冰上用live/deadaqua(thermofisher,molecularprobes)染色30分钟。随后,洗涤细胞,再次悬浮在facs染色缓冲液(1xpbs,具有2%热灭活的fbs)中,并使用抗鼠cd16/cd32fc封闭剂(bdbiosciences)封闭非特异性结合10分钟,之后在冰上使用一组可变的荧光团结合表面标记物染色抗体孵化30分钟,该抗体包括识别以下的抗体:cd4(克隆号rm4-5)、cd8a(53-6.7)、cd11b(m1/70)、cd45(30-f11)、cd317(927)、cd370(dngr1,7h11)、f4/80(bm8)、i-a/i-e(m5/114.15.2)、ly6c(hk1.4)、ly6g(1a8)、xcr1(zet;全部来自biolegend)、cd3(145-2c11)和cd11c(n418;ebioscience)。随时将所有染色的样本在染色缓冲液中洗涤两次,在lsr-ii型流式细胞仪(bdbiosciences)上执行细胞获取。所有流式细胞术数据经分析,如图11a至图11c所示分裂,并使用flowjo软件(flowjo,llc)绘图。使用来自mrgpra1+/+野生型(无gfp)鼠的脾细胞和淋巴结细胞来设定gfp阴性区域的门。当必要时,将“荧光减一”对照物用于其它表面染色。
小鼠免疫细胞分类用于rna制备和钙成像
为了基于cd11c和mhc-ii表达而将不同细胞类型的脾细胞分类,如上所述制备鼠脾细胞的单细胞悬浮液。随后,如制造商的方案所建议并进行一些改变,用easyseptm鼠cd11c阳性选择试剂盒(stemcelltechnologies)富集cd11c+细胞。简单地说,用鼠fcr封闭剂对细胞悬浮液进行非特异性结合封闭,随后用藻红蛋白(pe)结合的抗cd11c抗体染色,之后用识别pe的四聚体抗体复合物和磁性纳米颗粒孵化。随后,以免疫磁性分离一次性回收pe标记的细胞。不经重复的磁性分离,用apc-cy7结合的抗鼠i-a/i-e(克隆号m5/114.15.2)抗体(biolegend)染色富集的cd11c+细胞。基于cd11c和mhc-ii表达,使用facsdiva软件在facsariaiiu分选器(bdbioscience)上将细胞群体分门别类,如图12所示。分类的细胞随后立即用于rna单离以检查mrgpra1表达或进行钙成像(如上文hek细胞中所述)。
rna单离和定量rt-pcr
将来自不同器官的鼠组织样本均质化,根据制造商手册或使用rneasyplus迷你试剂盒(qiagen)或使用rneasy纤维组织迷你试剂盒提取它们的rna。使用rneasy微型试剂盒(qiagen)从单离的鼠细胞或培养的人类树突细胞提取rna。为最小化基因组dna(gdna)污染,使用gdna脱除柱(qiagen)并用dnasei在该柱上处理15分钟而纯化rna。遵循制造商的使用说明书,使用iscriptcdna合成试剂盒(bio-rad),用寡聚dt和随机引物将500ng的来自组织的总rna或30ng的来自细胞的总rna逆转录为互补dna(cdna)。执行没有逆转录酶的阴性对照反应以检查gdna的污染。随后,使用0.5l的taqman特异性引物/探针(thermofisher;用于mrgpra1的mm01703261;用于actb的mm04394036;用于mrgprx4的hs00607779;用于actb的hs01060665)、7.5l的taqman通用预混液(thermofisher)和5l的depc处理水,从2l的cdna进行定量pcr检验。使用以下温控技术执行pcr反应:50℃,2分钟;95℃,10分钟;随后在95℃进行45次循环(15秒);之后在60℃循环(1分钟)。通过2%琼脂糖凝胶电泳将pcr产物可视化。
cd4和cd8t细胞的体内耗竭
使用抗鼠cd4的大鼠单克隆抗体(bioxcell,克隆号gk1.5)和抗鼠cd8的大鼠单克隆抗体(bioxcell,克隆号2.43)进行cd4/cd8t淋巴细胞的体内耗竭。在第-2、0和3天,对雄性野生型129s1/svlmj鼠腹腔注射200μg的cd4抗体或cd8抗体。对照组使用类似方案用大鼠igg2b同型对照抗体(bioxcell)治疗。从第0天开始,对所有小鼠每天一次强饲ltg(50mg/kg体重)。在第7天,通过对脾脏和外周血的流式细胞分析来评估耗竭功效能。这一耗竭方案导致cd4耗竭鼠的脾脏和外周血中的cd4+分别减少大约98.4%和89.9%,而cd8耗竭鼠的脾脏和外周血中的cd8+分别减少99.1%和97.6%(图10)。
树突细胞过继转移
无菌地移除来自天然129s1wt鼠或mrgpra1-/-鼠的脾脏,使用鼠泛树突细胞单离试剂盒(miltenyibiotec)根据制造商手册单离dc。简单地说,如上所述,通过胶原蛋白酶d/dnasei消化生成来自脾脏的单细胞悬浮液。随后,将生物素结合的抗非输入细胞抗体和抗生物素磁性微珠先后加入该细胞悬浮液中。使用ls柱将树突细胞与微珠标记的非树突细胞单离。在开始每天给药ltg(50mg/kg体重)前一天,将悬浮在200μl的hanks平衡盐溶液(hbss)中的从wt鼠或ko动物新鲜单离的树突细胞经静脉(尾静脉)注射到天然的雄性mrgpra1敲除鼠(2x106细胞/鼠)体内。
人外周血树突细胞培养
从lonza(cc-2701)和stemcelltechnologies(70041)购买来自四位不同捐献者的人类外周血树突细胞。为了将细胞维持为不成熟的树突细胞,将细胞融解,并在37℃和5%co2的湿润孵化箱中,在以10%fbs、50ng/mlil-4和50ng/mlgm-csf补充的rpmi1640培养基中培养。这些树突细胞的所有实验均在细胞死亡之前的7天内完成。
人dc的sirna转染
使用抗mrgprx4的on-target加上smartpoolsirna(dharmacon)下调树突细胞内的mrgprx4表达。在开始培养后第3天,人类树突细胞用培养基洗涤两次,收集,并在室温下以200g离心10分钟。随后将细胞再次悬浮在
人dc的内化
将人类树突细胞种植在盖玻片上,并在具有10%fbs的rpmi1640培养基中培养5天。血清饥饿4至6小时后,用培养基、单独使用染料、未结合的ltg或德克萨斯红结合的ltg(德克萨斯红如上所述结合至ltg)在37℃下黑暗中将细胞处理15分钟。细胞用4%多聚甲醛固定在pbs中,并用pbs洗涤。随后,将固定的细胞在封闭液(10%正常山羊血清)中封闭1小时,之后在4℃下在兔抗mrgprx4(10ug/ml,abcam,ab188740)中孵化过夜。此后,用0.3%triton溶液洗涤细胞,并在室温下将细胞在alexaflour484结合的山羊抗兔igg(1:1000,thermofisher)中孵化2小时。盖玻片用pbs洗涤两次,用具有dapi的防褪色封固介质(vectorlaboratories)封固。
患者和样本
本研究得到台湾大学医院的研究伦理委员会的批准(ntuh-rec号:2015121334rinc),并根据赫尔辛基宣言的原则执行该研究。评估并由皮肤科专家诊断了拉莫三嗪的严重不良皮肤反应(cadr)的病例,包括斑丘疹(mpe)、具有嗜酸性粒细胞增多症和全身症状的药物反应(dress)和史蒂文约翰逊综合征(sjs)。拉莫三嗪耐受性的病例是从神经科门诊招募的,他们具有超过2个月的拉莫三嗪用药史但未报告任何相关的皮肤不良反应。如先前所述,从外周血分离出外周血单核细胞(pbmc)(25)。将血液样本与等量的ficoll-paqueplus溶液(gehealthcare)混合物,并以600g进一步离心40分钟。将pbmc保存在-80℃。
逆转录和mrgprx4测序
使用trizol试剂(invitrogen)从人类pbmc提取总rna。使用revertaidrt逆转录试剂盒(thermofisherscientific,k1691)进行rna的逆转录。使用mrgprx4正向引物5’-cagagatgatacagctggtg-3’(seqidno:1)和mrgprx4反向引物5’-gactgggatgaaatctgacg-3’(seqidno:2)进行pcr。pcr条件:94℃,3分钟;以及94℃,30次30秒循环;52℃,30秒;以及72℃,30秒。使用正向引物和反向引物两者执行测序。
实施例2:鉴别mrgprx4是牵涉入不良药物反应(adr)的g蛋白偶联受体
如本文所述,先前((10),通过引用并入本文)鉴别了为药物诱发的类过敏反应的肥大细胞特异性受体mrgprb2/mrgprx2(mas相关g蛋白偶联受体(mrgpr)子族的成员)(图1a)。为了确定mrgpr是否牵涉入其它类型的adr如史蒂文约翰逊综合征(sjs),筛选了对抗单独地表达在hek293细胞中的mrgpr的造成sjs的药物拉莫三嗪。使用ca2+成像试验,确定仅有鼠mrgpra1和人mrgprx4被几种sjs相关药物如拉莫三嗪(ltg)和奥卡西平特异性地活化。ltg对于人mrgprx4的ec50大约为200μm,这处于临床使用的剂量范围内(11,12)。ltg对于鼠mrgpra1的ec50大约为30μm。
为了评估配体和受体的物理相互作用,实施细胞膜色谱(cmc)实验,其中,表达mrgprx4的hek293细胞膜被固定在柱上,并监测流经该柱的ltg洗脱。使用这一亲和色谱技术,确定ltg将会保留在mrgprx4/cmc柱上,结合kd为417±24nm(图1b至1d),而不会保留在mrgprx2/cmc柱上(图1b)。由于大多数gpcr在配体-受体相互作用之后被从细胞表面内化到细胞内的隔室中(13),随后确定药物是否能诱发mrgpra1和mrgprx4的内化。为了评估这一问题,使用过度表达mrgpra1或mrgprx4受体与绿色荧光蛋白(gfp)的融合蛋白的hek293细胞,并将ltg与德克萨斯红荧光染料结合。用ltg刺激该细胞可诱发mrgpra1-gfp和mrgprx4-gfp受体的内化,而不具有激动剂时,该受体大多数保留在浆膜上(图1e)。使用德克萨斯红标记的ltg,观察到药物与gfp标记的受体一起被摄入到细胞内(图1e)。ltg不诱发mrgprc11-gfp的内化,且不被吸收到表达这一受体的细胞内(数据未显示)。综合来看,这些强烈暗示ltg可特异性地结合并活化mrgpra1和mrgprx4。
实施例3:用于mrgprx4介导的不良药物反应的鼠模型的生成
已知mrgpra1可结合造成sjs的药物拉莫三嗪,检查了其在体内扮演的角色。为了研发sjs/ten的鼠模型,每天以50mg/kg体重的剂量对野生型(wt)129s1/svlmj鼠口服强饲ltg。尽管这一ltg剂量高于临床建议用量,但它仍处于造成人体发展出sjs的ltg过量范围内(14)。药物治疗7至10天后,几乎每一只鼠的体重均减轻并表现出sjs/ten样症状,包括眼部粘膜分泌物和爪部的血泡,且14天死亡率为60%(图2b、图6a、图6b)。这一表型发作类似于人类患者体内的药物诱发的超敏反应,该超敏反应在暴露于抗原后数天至数周发作(15)。高剂量的包括奥卡西平和别嘌呤醇在内的其它sjs致病药物也可在这一小鼠品系中诱发表现,但发病率较低且爪部没有不正常(图5)。值得注意的是,发现每天口服给药高剂量的ltg仅在129s1品系和balb/c品系中诱发sjs样特征(图8),而c57bl/6鼠似乎具有耐药性。这暗示,不同鼠品系之间对于该药物的应答存在客观的变动。因此,生成了mrgpra1敲除鼠(mrgpra1gfp/gfp,ko鼠),其中在129s1/svlmj背景上将mrgpra1的开放阅读框替换为gfp(图2a)。接触相同的ltg治疗时,尽管mrgpra1杂合子小鼠(mrgpra1gfp/+,het鼠)发展出与wt鼠类似的表型,但mrgpra1ko鼠未死亡,体重也未减轻,并且从未发展出任何sjs样症状(图2c、图2d、图6a、图6b)。结膜和后爪切片的组织学染色表明,仅在经ltg治疗的wt和het鼠的组织内有明显的表皮坏死和炎性细胞浸润,而经ltg治疗的ko鼠或经盐水治疗的对照动物的组织内无此现象(图2c、图2d)。
实施例4:sjs鼠模型中的病理生理学检查
sjs/ten患者的组织病理学检查显示了表皮中的大量角化细胞凋亡(16,17)。一般认为,这一病理生理学由从细胞毒cd8+t细胞释放的细胞毒分子(例如,颗粒酶b、颗粒溶素、fas配体)和几种细胞因子(包括tnf-α、ifn-γ、il-6等)增多一起介导(17-21)。接着,在如本文所述的鼠模型中检查了这些特征。与人类sjs患者一致,在强饲ltg的mrgpra1wt和het鼠的皮肤中,存在凋亡表皮细胞数和cd8+t细胞数的显著增加,同时伴有颗粒酶b和tnf-α的增多(图2c、图2d、图2e、图2f、图6d、图6e和图6f)。但是,mrgpra1ko鼠在暴露于药物之后未显示细胞毒性迹象。使用rag1-/-鼠(其含有无功能的t和b淋巴细胞)和cd8耗竭动物(经由抗体耗竭而将其耗竭),证实cd8+t细胞及其中介物是否为在如本文所述的鼠模型中发展出sjs样表型所需。在暴露于ltg之后,这些鼠体内没有发展出表型,且没有或具有少量的cd8+t细胞(图7、图8)。所有这些数据暗示:1)cd8+t细胞为在如本文所述的动物模型内发展出sjs所需,以及2)mrgpra1对于启动这一免疫应答来说可能是必要的。
实施例5:mrgpra1的树突细胞表达
使用暗示了mrgpra1在sjs发展中扮演的角色的数据,确定这一受体在何处被表达的定位。逆转录pcr(rt-pcr)显示,mrgpra1主要表达在淋巴结和脾脏中(图3a)。随后,使用通过将mrgpra1基因替换为gfp而生成的mrgpra1ko鼠(mrgpra1gfp/gfp)作为报告鼠,以鉴别表达mrgpra1的细胞。对来自mrgpra1gfp/gfp鼠的脾细胞和淋巴结细胞的流式细胞分析表明了可分辨的gfp+小群体的存在(图3b和图9a)。进一步的表征显示,gfp+细胞展现具有传统树突细胞标记物(整合素cd11c和ii类主要组织相容性复合体(mhc-ii)两者的高表达)而非其它细胞类型标记物的造血细胞(cd45+)特征(图3b和图9b)。对来自这些鼠的脾脏组织切片的免疫染色证实了对不规则形状和具有cd11c+而非cd3+(t细胞的一种标记物)的树突样突起gfp+细胞的鉴别(图9c)。为进一步验证mrgpra1被表达在树突细胞中且其在树突细胞中是功能性的,基于它们的cd11c和mhc-ii表达,将来自mrgpra1+/+和mrgpra1gfp/gfp两种小鼠的脾细胞分为4个群体:cd11c+mhc-ii高(大多为树突细胞)、cd11c+mhc-iiint(大多为巨噬细胞)、cd11c-mhc-ii+(大多为b细胞)和cd11c-mhc-ii-(大多为t细胞)(分类策略如图10所示)。通过rt-pcr分析,仅在wt动物的cd11c+mhc-ii高群体中测得mrgpra1表达(图3c)。来自mrgpra1gfp/gfp敲除鼠的cd11c+mhc-ii高细胞中不存在mrgpra1。功能上,使用ca2+成像检验证明仅一个子集的wtcd11c+mhc-ii高细胞(大约5%)应答ltg,并且在ko细胞中,这一ltg诱发的活化被显著减少(图3d、图3e)。所有这些数据暗示,mrgpra1被特异性地表达在树突细胞的一个子集内而非其它免疫细胞内。接着,为了检查这些表达mrgpra1的树突细胞是否为在体内发展出药物诱发的sjs/ten症状所需,单离来自mrgpra1+/+鼠的树突细胞,并过继转移到mrgpra1ko动物体内。暴露于药物7至10天后,接受wt树突细胞的mrgpra1ko鼠体重减轻,且它们中的64%发展出sjs样眼部表现,而在接受ko树突细胞的对照动物中既没有观察到体重减轻也没有观察到表型(图3f和图11)。但是,这些表型见于注射wt树突细胞的动物,表型仅持续3至4天,并在第12天后消失。这可能是由于树突细胞在活化并与淋巴细胞相互作用后的短寿命(22)。这些发现强有力地支持对树突细胞中mrgpra1及其在触发和维持sjs/ten发病机制中所扮演角色的鉴别。
实施例6:人mrgprx4在sjs中扮演的角色
根据本文所述的ca2+成像数据,人mrgprx4对sjs致病药物的应答与鼠mrgpra1类似(图3c)。因此,探究了mrgprx4被牵涉入人体内sjs/ten发展的可能性。首先,通过rt-pcr检测人类cd11c+树突细胞中的mrgprx4转录物,并通过免疫染色检测该细胞中的mrgprx4蛋白(图4a和图12)。其次,ltg可以mrgprx4依赖性模式活化人树突细胞。与鼠树突细胞类似,在ca2+成像研究中,大约5%的人树突细胞被ltg活化(图4b、图4c)。使用短干扰rna(sirna)敲除mrgprx4的树突细胞展现了显著降低的应答ltg的活化细胞数(图4c)。另外,仅有表达mrgprx4的树突细胞会将德克萨斯红标记的ltg内化到其细胞质隔室中(图4d)。鉴别了mrgprx4基因中与cadr发病率有关的突变。将6位具有对于ltg的cadr的患者和28个耐受病例招募到本研究中。cadr包括sjs、dress和mpe。大多数ltg耐受病例显示位于mrgprx4的第495个核苷酸处的杂合子g/t等位基因(保藏号nm_054032.3,rs2468774,位置495)。在相同基因座处显著更普遍存在的是纯合子g/g等位基因,其在蛋白质水平上导致p.asn25lys的错义变体。28位耐受患者中的2位(7.1%)具有纯合子g/g等位基因,而6位cadr患者中的3位(50%)具有纯合子等位基因(图4e)。综合来看,这些结果暗示,mrgprx4是mrgpra1的人类同源物并在人体内介导sjs。
某些药物如何能使用药物特异性t细胞而导致细胞毒性已经困扰了研究者很长时间。如本文所述,这些发现是第一个证明这些药物可与树突细胞上的mrgprx4/mrgpra1受体相互作用的案例,而树突细胞是在捕捉、处理和呈递t细胞活化抗原中特异化的最有效的抗原呈递细胞(23)。但是,内化的药物在树突细胞中如何被处理以生成对t细胞的抗原呈递的机制需要进一步探究。在摄入药物之前,筛选可与mrgprx4受体反应的药物、筛选该受体拮抗剂、以及筛选患者体内的mrgprx4突变在降低cadr风险方面可能有益。
实施例1-6的参考文献列述于下:
1.zalewska-janowska,a.,spiewak,r.&kowalski,m.l.cutaneousmanifestationofdrugallergyandhypersensitivity.immunolallergyclinnortham37,165-181,doi:10.1016/j.iac.2016.08.006(2017).
2.sultana,j.,cutroneo,p.&trifiro,g.clinicalandeconomicburdenofadversedrugreactions.jpharmacolpharmacother4,s73-77,doi:10.4103/0976-500x.120957(2013).
3.downey,a.,jackson,c.,harun,n.&cooper,a.toxicepidermalnecrolysis:reviewofpathogenesisandmanagement.jamacaddermatol66,995-1003,doi:10.1016/j.jaad.2011.09.029(2012).
4.lee,h.y.&chung,w.h.toxicepidermalnecrolysis:theyearinreview.curropinallergyclinimmunol13,330-336,doi:10.1097/aci.0b013e3283630cc2(2013).
5.stevens,a.m.&johnson,f.c.aneweruptivefeverassociatedwithstomatitisandophthalmia:reportoftwocasesinchildren.amjdischild24,526-533(1922).
6.heng,y.k.,lee,h.y.&roujeau,j.c.epidermalnecrolysis:60yearsoferrorsandadvances.brjdermatol173,1250-1254,doi:10.1111/bjd.13989(2015).
7.schotland,p.,bojunga,n.,zien,a.,trame,m.n.&lesko,l.j.improvingdrugsafetywithasystemspharmacologyapproach.eurjpharmsci94,84-92,doi:10.1016/j.ejps.2016.06.009(2016).
8.adam,j.,pichler,w.j.&yerly,d.delayeddrughypersensitivity:modelsoft-cellstimulation.brjclinpharmacol71,701-707,doi:10.1111/j.1365-2125.2010.03764.x(2011).
9.chung,w.h.,wang,c.w.&dao,r.l.severecutaneousadversedrugreactions.jdermatol43,758-766,doi:10.1111/1346-8138.13430(2016).
10.mcneil,b.d.etal.identificationofamast-cell-specificreceptorcrucialforpseudo-allergicdrugreactions.nature519,237-241,doi:10.1038/nature14022(2015).
11.biton,v.pharmacokinetics,toxicologyandsafetyoflamotrigineinepilepsy.expertopindrugmetabtoxicol2,1009-1018,doi:10.1517/17425255.2.6.1009(2006).
12.khanna,d.etal.2012americancollegeofrheumatologyguidelinesformanagementofgout.part1:systematicnonpharmacologicandpharmacologictherapeuticapproachestohyperuricemia.arthritiscareres(hoboken)64,1431-1446,doi:10.1002/acr.21772(2012).
13.pavlos,n.j.&friedman,p.a.gpcrsignalingandtrafficking:thelongandshortofit.trendsendocrinolmetab28,213-226,doi:10.1016/j.tem.2016.10.007(2017).
14.alabi,a.,todd,a.,husband,a.&reilly,j.safetyprofileoflamotrigineinoverdose.theradvpsychopharmacol6,369-381,doi:10.1177/2045125316656707(2016).
15.pichler,w.j.delayeddrughypersensitivityreactions.annalsofinternalmedicine139,683-693(2003).
16.paul,c.etal.apoptosisasamechanismofkeratinocytedeathintoxicepidermalnecrolysis.brjdermatol134,710-714(1996).
17.chung,w.h.&hung,s.i.recentadvancesinthegeneticsandimmunologyofstevens-johnsonsyndromeandtoxicepidermalnecrosis.jdermatolsci66,190-196,doi:10.1016/j.jdermsci.2012.04.002(2012).
18.posadas,s.j.etal.delayedreactionstodrugsshowlevelsofperforin,granzymeb,andfas-ltoberelatedtodiseaseseverity.thejournalofallergyandclinicalimmunology109,155-161(2002).
19.nassif,a.etal.evaluationofthepotentialroleofcytokinesintoxicepidermalnecrolysis.jinvestdermatol123,850-855,doi:10.1111/j.0022-202x.2004.23439.x(2004).
a)caproni,m.etal.expressionofcytokinesandchemokinereceptorsinthecutaneouslesionsoferythemamultiformeandstevens-johnsonsyndrome/toxicepidermalnecrolysis.brjdermatol155,722-728,doi:10.1111/j.1365-2133.2006.07398.x(2006).
20.viard-leveugle,i.etal.tnf-alphaandifn-gammaarepotentialinducersoffas-mediatedkeratinocyteapoptosisthroughactivationofinduciblenitricoxidesynthaseintoxicepidermalnecrolysis.jinvestdermatol133,489-498,doi:10.1038/jid.2012.330(2013).
21.chen,m.,huang,l.,shabier,z.&wang,j.regulationofthelifespanindendriticcellsubsets.molimmunol44,2558-2565,doi:10.1016/j.molimm.2006.12.020(2007).
22.guermonprez,p.,valladeau,j.,zitvogel,l.,thery,c.&amigorena,s.antigenpresentationandtcellstimulationbydendriticcells.annualreviewofimmunology20,621-667,doi:10.1146/annurev.immunol.20.100301.064828(2002).
23.han,s.k.etal.orphangprotein-coupledreceptorsmrga1andmrgc11aredistinctivelyactivatedbyrf-amide-relatedpeptidesthroughthegalphaq/11pathway.proceedingsofthenationalacademyofsciencesoftheunitedstatesofamerica99,14740-14745,doi:10.1073/pnas.192565799(2002).
24.chen,y.c.etal.humanherpesvirusreactivationsanddynamiccytokineprofilesinpatientswithcutaneousadversedrugreactions--aprospectivecomparativestudy.allergy70,568-575,doi:10.1111/all.12602(2015).
实施例7:在胆汁淤积性瘙痒的模型中,mrgpr簇ko鼠抓挠较少
鼠mrgpr基因座含有27个完整的mrgpr开放阅读框。在鼠体内表达的很多mrgpr具有类似的结构(10;20)。为了避免mrgpr成员间的可能的补偿,执行了一组删除策略,其中一组mrgpr被基因删除(簇ko)。簇ko鼠失去了845kb的dna,所失去的dna含有12个完整的mrgprorf(22)。
给药α-萘基异硫氰酸酯(anit)导致胆汁淤积性损伤和瘙痒。anit通过以未知机制选择性地损伤胆管上皮细胞而造成肝内胆汁淤积(8)。anit治疗在wt动物和簇ko动物体内均导致了自发瘙痒的增加(图13a)。簇ko鼠的抓挠显著少于wt同窝出生仔畜,展现抓挠出现次数下降大约46%(图13a)。对于使用媒介物治疗的动物,wt和簇ko两者均基本上不展现自发瘙痒(图13a)。与对照状况相比,经治疗状况的胆汁淤积性损伤的指标如肝脏总量、直接胆红素值、总但公诉值和肝脏没全部显示显著提升(图13b、图13c)。wt处理状况和簇ko处理状况的这些指标之间没有差异,表明胆汁淤积性孙涵的严重性在wt动物与簇ko动物之间是相当的。基于这一点,治疗的不同不能解释瘙痒的不同。此外,胆汁酸、甲硫氨酸脑啡肽和自家趋化素(autotaxin)(三种假设在胆汁淤积性瘙痒中扮演角色的物质)中,在anit治疗的动物体内仅胆汁酸有所提升,而甲硫氨酸脑啡肽和自家趋化素均无显著提升(图13d至图13f)。wt治疗状况与簇ko治疗状况之间没有胆汁酸值的差异(图13d)。
实施例8:胆红素造成依赖于mrgpra1的瘙痒
anit治疗导致了多种病理变化。正常情况下以痕量存在于血清中的构成胆汁的物质没有得到调节。此外,anit造成肝细胞损伤,这导致生物体内平衡的进一步扰动。由于这些变化,存在多种能够解释见于簇ko动物体内的胆汁淤积性瘙痒减少。针对这个问题,将假设被牵涉入胆汁淤积性瘙痒中的多种胆汁组分注射到wt和簇ko同窝出生仔畜体内。注射后,评估了急性瘙痒。从这些注射中,鉴别胆红素为致痒原,这是先前从未发表的现象。wt鼠应答在脸颊或背部注射胆红素而抓挠(图14a、图14d)。这一抓挠应答是剂量依赖性的,且动物在较低剂量下不抓挠(图14a)。值得重视的是,注射胆红素没有在簇ko动物体内引起瘙痒(图14a)。由于胆红素在组胺释放试验中未活化肥大细胞且这一现象为钙成像所证实,研究者不相信胆红素介导的瘙痒天然是组胺能的(图15a、图15b)。此外,h1受体阻滞剂并不抑制行为(图15c)。注射其它致痒原——damgo、吗啡、lpa和dca,它们分别是胆汁淤积性瘙痒的三种提出的中介物成员,在wt动物和簇ko动物体内均引起了相当的瘙痒应答(图14b、图14c、图14e、图14f)。基于这一现象,簇ko动物体内胆汁淤积性瘙痒减少的机制是由于胆红素对抗该粗内mrgpr的活性下降。
为了支持这一行为数据,将胆红素以浴的形式施加至解离的drg神经元,唤起了钙的瞬时增加(图16a)。胆红素唤起钙通量是依赖于细胞外钙的存在(图16b)。50μm活化总drg的4%至6%(图16c)。重要的是,与媒介物对照相比,簇kodrg不展现应答胆红素而被活化的神经元数目的增加(图15c)。活化神经元的平均直径为20.6μm[19.2,21.7](图16d)。基于其大小,将这些神经元归类为小直径伤害感受性神经元(图16d)(19;25)。
簇ko动物体内有12个完整的mrgprorf被删除。为了确定哪一个(或哪些)牵涉入介导胆红素相关瘙痒中,将该簇中的每一个mrgpr连续转染到人胚胎肾(hek)细胞中。使用钙成像,针对这些被转染细胞测试胆红素,以鉴别哪些细胞群体在胆红素的存在下流出钙。未转染的hek细胞不应答胆红素,且在该簇的所有mrgpr中,仅有表达mrgpra1的细胞显示应答胆红素的阳性信号,其ec50为大约49μm(图17a、图18a)。u73122阻断钙流入,暗示瞬时钙增加是gαq介导的(图17b、图17c)。由于mrgpra1单基因ko动物在注射胆红素后不抓挠,上述行为印证了钙成像分析结果(图14a)。鼠mrgpra受体家族成员与人mrgprx家族成员的相关性最高。为了确定是否任何人类受体都应答胆红素,筛选了稳定地表达人类mrgprx1至mrgprx4四者中每一个的hek细胞系。这四者中,仅mrgprx4展现对胆红素的阳性应答,其ec50为2μm(图17d、图18b)。再一次,钙信号是gαq介导的(图17e、图17f)。
实施例9:其它血红素代谢物活化mrgpra1和mrgprx4
结构上,血红素代谢物非常相似。基于这一点,可预期其它血红素代谢物具有抗mrgpra1和mrgprx4的活性。事实上,如通过钙成像评估的,多种血红素代谢物活化这些受体但不活化相关的受体mrgpra3和mrgprx1(表1,图22)。血红素代谢物在结构上是相关的。多种血红素代谢物激活鼠受体mrgpra1和人受体mrgprx4。物质的剂量列述于上,但表内示出的是活化的大约百分比。这一钙成像结果由将少量已鉴别的mrgpra1激动剂注射入wt鼠体内而得到验证。其它具有对抗mrgpra1的活性的血红素代谢物如血色素和粪胆素,在wt鼠体内全部引起瘙痒,但在簇ko动物体内不存在这一现象。此外,使用结构上有所差异的激动剂fmrf活化mrgpra1造成了瘙痒。基于这一点,mrgpra1的活化足以诱发瘙痒。基于钙成像建立的功能同源性,人体内的mrgprx4活化导致瘙痒。
实施例7-9的参考文献列述于下:
1.alemif,kwone,pooledp,lieut,lyov,etal.2013.thetgr5receptormediatesbileacid-induceditchandanalgesia.jclininvest123:1513-30
2.bergasanv.1998.hypothesis:tastedisordersinpatientswithliverdiseasemaybemediatedinthebrain:potentialmechanismsforacentralphenomenon.amjgastroenterol93:1209-10.
3.bergasanv.2008.pruritusinprimarybiliarycirrhosis:pathogenesisandtherapy.clinliverdis12:385-406;x.
4.bergasanv.2014.pruritusofcholestasis.initch:mechanismsandtreatment,ed.ecarstens,takiyama.bocaraton(fl).numberof.
5.bergasanv,schmittjm,talbottl,allingdw,swainmg,etal.1998.open-labeltrialoforalnalmefenetherapyforthepruritusofcholestasis.hepatology27:679-84.
6.bergasanv,talbottl,allingdw,schmittjm,walkerec,etal.1992.acontrolledtrialofnaloxoneinfusionsforthepruritusofchroniccholestasis.gastroenterology102:544-9.
7.bulmerac,verkadehj,wagnerkh.2013.bilirubinandbeyond:areviewoflipidstatusingilbert’ssyndromeanditsrelevancetocardiovasculardiseaseprotection.proglipidres52:193-205.
8.chisholmjw,dolphinpj.1996.abnormallipoproteinsintheanit-treatedrat:atransientandreversibleanimalmodelofintrahepaticcholestasis.jlipidres37:1086-98.
9.dattadv,sherlocks.1966.cholestyramineforlongtermreliefoftheprurituscomplicatingintrahepaticcholestasis.gastroenterology50:323-32.
10.dongx,hans,zylkamj,simonmi,andersondj.2001.adiversefamilyofgpcrsexpressedinspecificsubsetsofnociceptivesensoryneurons.cell106:619-32.
11.europeanassociationforthestudyofthel.2009.easlclinicalpracticeguidelines:managementofcholestaticliverdiseases.jhepatol51:237-67.
12.flegelc,schobeln,altmullerj,beckerc,tannapfela,etal.2015.rna-seqanalysisofhumantrigeminalanddorsalrootgangliawithafocusonchemoreceptors.plosone10:e0128951.
13.goswamisc,thierry-miegd,thierry-miegj,mishras,hoonma,etal.2014.itch-associatedpeptides:rna-seqandbioinformaticanalysisofnatriureticprecursorpeptidebandgastrinreleasingpeptideindorsalrootandtrigeminalganglia,andthespinalcord.molpain10:44.
14.halvorsenja,dalgardf,thoresenm,bjertnesse,lienl.2012.itchandpaininadolescentsareassociatedwithsuicidalideation:apopulation-basedcross-sectionalstudy.actadermvenereol92:543-6.
15.ikomaa,steinhoffm,standers,yosipovitchg,schmelzm.2006.theneurobiologyofitch.natrevneurosci7:535-47.
16.kremerae,martensjj,kulikw,ruefff,kuiperem,etal.2010.lysophosphatidicacidisapotentialmediatorofcholestaticpruritus.gastroenterology139:1008-18,18e1.
17.kremerae,vandijkr,leckiep,schaapfg,kuiperem,etal.2012.serumautotaxinisincreasedinpruritusofcholestasis,butnotofotherorigin,andrespondstotherapeuticinterventions.hepatology56:1391-400.
18.kuiperem,vanerpecumkj,beuersu,hansenbe,thiohb,etal.2010.thepotentbileacidsequestrantcolesevelamisnoteffectiveincholestaticpruritus:resultsofadouble-blind,randomized,placebo-controlledtrial.hepatology52:1334-40.
19.lamotterh,dongx,ringkampm.2014.sensoryneuronsandcircuitsmediatingitch.natrevneurosci15:19-31.
20.lembopm,grazzinie,groblewskit,o'donnelld,roymo,etal.2002.proenkephalinageneproductsactivateanewfamilyofsensoryneuron--specificgpcrs.natneurosci5:201-9.
21.liuq,sikandp,mac,tangz,hanl,etal.2012.mechanismsofitchevokedbybeta-alanine.jneurosci32:14532-7.
22.liuq,tangz,surdenikoval,kims,patelkn,etal.2009.sensoryneuron-specificgpcrmrgprsareitchreceptorsmediatingchloroquine-inducedpruritus.cell139:1353-65.
23.mcneilb,dongx.2012.peripheralmechanismsofitch.neuroscibull28:100-10.
24.mcneilbd,pundirp,meekers,hanl,undembj,etal.2015.identificationofamast-cell-specificreceptorcrucialforpseudo-allergicdrugreactions.nature519:237-41.
25.rossse.2011.painanditch:insightsintotheneuralcircuitsofaversivesomatosensationinhealthanddisease.curropinneurobiol21:880-7.
26.swainmg,rothmanrb,xuh,vergallaj,bergasanv,jonesea.1992.endogenousopioidsaccumulateinplasmainaratmodelofacutecholestasis.gastroenterology103:630-5.
27.thorntonjr,losowskyms.1988.opioidpeptidesandprimarybiliarycirrhosis.bmj297:1501-4.
28.thorntonjr,losowskyms.1989.methionineenkephalinisincreasedinplasmainacuteliverdiseaseandispresentinbileandurine.jhepatol8:53-9.
29.thorntonjr,losowskyms.1989.plasmaleucineenkephalinisincreasedinliverdisease.gut30:1392-5.
30.vitekl,jirsam,brodanovam,kalabm,marecekz,etal.2002.gilbertsyndromeandischemicheartdisease:aprotectiveeffectofelevatedbilirubinlevels.atherosclerosis160:449-56.
实施例10:mrgprx3被表达在人类角化细胞中并为角化细胞应答hbd3所需
如图20a中所示,表达mrgprx3的hek细胞对产生强健的对合成性人β-防御素3(hbd3)的ca2+应答。使用rt-pcr分析mrgprx3在初级人类角化细胞中的表达,并证实该基因被以中间水平表达。对抗mrgprx3的sirna有效减少了这一受体的表达而不影响另一家族成员mrgprx4(图20b)。敲除mrgprx3将应答hbd3的角化细胞百分比从>80%显著减少至<20%,表明mrgprx3对于细胞感应并应答该配体来说是必需的。
实施例11:鼠mrgpra6是人mrgprx3的假定同源物
mrgpra6被表达在角化细胞中。
测定了人mrgprx3的鼠同源物的一致性。在进化期间,mrgpr基因簇被大大扩展,相对于人体内的4种mrgprx,该基因簇在鼠体内编码超过20个受体(图21c)。第一步是从鼠上皮中单离角化细胞,并确定哪些mrgpr基因被强健表达。rt-pcr表明,在鼠角化细胞内仅强力表达了3个基因,即mrgpra6、mrgpra12和mrgprb3。mrgpra1、mrgpra4和mrgprb6显示弱表达(图21a)。
mrgpra6应答mbd14,hbd3的唯一鼠同源物。
mrgprx3是孤儿受体,且hbd3是其首个被鉴别的激动剂。hbd3的良好保守的鼠同源物,鼠β-防御素14(mbd14),被用来进一步探索hmrgprx3的鼠同源物。显示在鼠角化细胞内表达的受体(图21a)中,mrgpra6是仅有的一个被mbd14强力活化的,而mrgpra1、mrgpra4、mrgpra12、mrgprb3和mrgprb6不显示任何应答(图21b)。
生成了mrgpra6ko鼠和mrgpra6-crebac鼠。这些鼠系是独特的,且对于体内创伤闭合试验和其它皮肤病模型来说是重要的。对于它们对mbd14的应答和进一步检查mrgpra6受体下游的细胞内信号传导通道的基于细胞的试验来说,从野生型和突变动物单离的角化细胞是重要的。同样,对于在皮肤病模型中测试mrgprx3的基于人类细胞的试验来说,具有mrgprx3敲除或突变表达的人类角化细胞是关键。其它牵涉mrgprx3功能的潜在皮肤病包括:银屑病、皮炎、慢性皮肤溃疡和癌。再者,由于hbd3和其它防御素也向呼吸道和肠道提供防御,mrgprx3的疾病迹象可以从皮肤系统扩展至粘膜系统。因此,以mrgprx3和mrgpra6为靶向具有治疗创伤愈合、慢性炎症、恶性转化、皮肤病如银屑病和皮炎、呼吸道和胃肠道疾病、疼痛和瘙痒的潜力。
实施例10-11的参考文献列述于下:
1.pasparakis,m.,haase,i.&nestle,f.o.mechanismsregulatingskinimmunityandinflammation.natrevimmunol14,289–301(2014).
2.singer,a.j.&clark,r.a.f.cutaneouswoundhealing.n.engl.j.med.341,738–746(1999).
3.owen,j.a.,punt,j.,kuby,j.&stranford,s.a.kubyimmunology.(w.h.freeman,2013).
4.pazgier,m.,hoover,d.m.,yang,d.,lu,w.&lubkowski,j.humanβ-defensins.cell.mol.lifesci.c.63,1294–1313(2006).
5.amid,c.etal.manualannotationandanalysisofthedefensingeneclusterinthec57bl/6jmousereferencegenome.bmcgenomics10,1–13(2009).
6.ganz,t.defensins:antimicrobialpeptidesofinnateimmunity.natrevimmunol3,710–720(2003).
7.
8.befus,a.d.etal.neutrophildefensinsinducehistaminesecretionfrommastcells:mechanismsofaction.j.immunol.163,947–953(1999).
9.subramanian,h.etal.β-defensinsactivatehumanmastcellsviamas-relatedgenex2.j.immunol.191,345–352(2013).
10.hirsch,t.etal.humanbeta-defensin-3promoteswoundhealingininfecteddiabeticwounds.j.genemed.11,220–228(2009).
11.
12.aarbiou,j.etal.neutrophildefensinsenhancelungepithelialwoundclosureandmucingeneexpressioninvitro.am.j.respir.cellmol.biol.30,193–201(2004).
13.otte,j.-m.etal.humanbetadefensin2promotesintestinalwoundhealinginvitro.j.cell.biochem.104,2286–2297(2008).
14.niyonsaba,f.etal.antimicrobialpeptideshumanbeta-defensinsstimulateepidermalkeratinocytemigration,proliferationandproductionofproinflammatorycytokinesandchemokines.j.invest.dermatol.127,594–604(2016).
15.liu,q.etal.sensoryneuron-specificgpcrsmrgprsareitchreceptorsmediatingchloroquine-inducedpruritus.cell139,1353–1365(2009).
16.han,l.etal.asubpopulationofnociceptorsspecificallylinkedtoitch.natneurosci16,174–182(2013).
17.mcneil,b.d.etal.identificationofamast-cell-specificreceptorcrucialforpseudo-allergicdrugreactions.nature519,237–241(2015).
18.hruz,t.etal.genevestigatorv3:areferenceexpressiondatabaseforthemeta-analysisoftranscriptomes.adv.bioinformatics2008,420747(2008).
19.kiatsurayanon,c.etal.angiogenicpeptide(ag)-30/5cactivateshumankeratinocytestoproducecytokines/chemokinesandtomigrateandproliferateviamrgxreceptors.j.dermatol.sci.doi:http://dx.doi.org/10.1016/j.jdermsci.2016.05.006
20.kaisho,y.etal.transgenicratsoverexpressingthehumanmrgx3geneshowcataractsandanabnormalskinphenotype.biochem.biophys.res.commun.330,653–657(2005).
实施例12:实施例12至17的材料和方法
使用下述材料和方法。
动物护理和使用
所有实验均根据约翰霍普金斯大学医学院(johnshopkinsuniversityschoolofmedicine)动物护理和使用委员会(animalcareandusecommittee)批准的方案下实施。
人血浆的单离
在约翰霍普金斯大学医学院机构审查委员会(institutionalreviewboard)批准的方案下,从正苦于高胆红素血症尤其是胆汁淤积的患者单离血浆(研究编号:irb00154650)。将全血采集至paxgene管(preanalytix761115)内,以300g涡旋5分钟。随后收集血浆,分为等量小样,在-20℃存储直至实验。正常对照人血浆购自sigma(p9523)。
分子和制备
使用以下分子:胆红素ixα(frontierscientific)、α-萘基异硫氰酸酯(anit,sigma)、胆绿素(sigma)、氯喹(sigma)、化合物48/80(sigma)、环孢霉素a(sigma)、氯高铁血红素(sigma)、人血清白蛋白(hsa,sigma)、bam8-22(sigma)、boc-gln-d-(甲酰)trp-phe-苄酯(qwf,sigma)、胆红素二酒石酸酯(leebiosciences)、西利替嗪(tocrisbiosciences)、粪胆素(santacruzbiotechnology)、尿胆素原(santacruzbiotechnology)、霍乱毒素(santacruzbiotechnology)、u73122(santacruzbiotechnology)、ym-254890(wakochemicals)、百日咳毒素(fisherscientific)、纤连蛋白(sigma)、fluo4-am(molecularprobes)和fura2-am(molecularprobes)。
胆红素对于氧化作用和光解作用高度易感。据此,恰在每次实验之前,将胆红素新鲜制备在dmso或0.1mnaoh中,并随后在黑暗处保存。对于钙成像分析,在使用前几秒,将胆红素溶解在钙成像缓冲液中。在所有可用的测试溶液中,dmso的最终浓度<0.5%。根据需要,将anit和环孢霉素a溶解在橄榄油中并新鲜制备。将尿胆素原和粪胆素溶解在磷酸盐缓冲盐水中并调节至ph为7.4之后以100μl等量小样(aliquot)在-20℃存储直至需要。全部其它药物均制备为100μl至1,000μl等量小样并在-20℃存储,之后在4℃融化。无论何时,尽可能地避免冻融循环。
行为研究
所有可用的行为测试均使用基因型盲实验实施和分析。所使用的鼠全部为8至12周龄雄性(20至30g),它们在c57bl/6j基因背景上生成或已经与c57bl/6j回交至少10代。所有瘙痒行为实验均在上午8点到下午12点之间实施。在实验前日,将动物在测试室内放置30分钟,之后对其进行一系列的三次模拟注射,其间中断5分钟。实验当天,首先令动物适应测试室10分钟,之后再注射。将致痒化合物皮下注射到颈背部或脸颊,并观察抓挠行为30分钟。抓挠动作出现定义为使用后抓直接在注射部位区进行的连续抓挠动作。在脸颊注射模型中,擦拭定义为一只前爪抚摸注射部位。两只前爪都用到脸上或脸颊被视为清整行为。通过计数以5分钟间隔的50分钟观察期内抓挠动作出现的次数来定量抓挠行为。以2分钟间隔在10分钟观察期内定量擦拭。对于h1r阻断,在注射胆红素之前30分钟,腹腔内给药30mg/kg的盐酸西利替嗪(ph7.4)。将舔舐行为定量为以秒计,并鉴别为舌头舔舐或用后爪足垫轻拂注射部位,而在此前或此后不舔舐身体的任何其它部位。
敲入鼠和敲除鼠的生成
如先前所述,生成mrgpr-簇δ-/-鼠、mrgpra1gfp鼠和mrgprdplap鼠4,21,44。如先前所述生成tg(mrgpra3-cre)鼠24。从杰克逊实验室(jacksonlabs)购买lsl-tdtomato鼠(ai9,007909)。使用以下引导rna序列使用c57bl/6背景上crispr-cas9生成mrgpra1-/-鼠:ttcccagcagcacctgtgcaggg(seqidno:3)。使用c57bl/6j背景上的ozgene(australia)生成blvra-/-鼠。
钙成像和分析
将细胞在钙成像缓冲液(cib;10mmhepes、1.2mmnahco3、130mmnacl、3mmkcl、2.5mmcacl2、0.6mmmgcl2、20mm葡萄糖和20mm蔗糖,ph7.4,且290至300mosm)中成像。为了监测细胞内[ca2+]的变化([ca2+]i),在成像之前,在黑暗中,令细胞在37℃下在cib中加载fura2-am(hek293细胞)或fluo4-am(drg神经元和肥大细胞)30分钟。加载fura2-am时,监测到来自340nm和380nm两处激发的510nm发光。加载fura4-am时,监测到来自488nm激发的520nm发光。如果细胞内[ca2+]相对于基线升高50%或相对于加入50mmkcl期间检查的[ca2+]i变化(仅神经元)升高50%,则将细胞鉴别为有应答。从分析中排除损坏的、脱附的、高基线的和动作感应的细胞。
hek293细胞
在最初的筛选中,将稳定地表达鼠g蛋白α-亚基gα15(一种独特的gα蛋白,其非选择性地将多种gpcr偶联至磷脂酶c)种植在涂覆有聚-d-赖氨酸盖玻片上,并使用编码所关注mrgrpr的构造体进行瞬时转染。12至24小时后,令细胞加载fura2-am。除非具体排除,否则在建立基准期之后,将化合物向成像室内灌注大约30秒。随后以5秒的间隔监测另外60秒内的应答。
drg神经元
在解离后24小时(原生基因型)或解离后48小时(病毒转导基因型),使用fluo-4am孵化drg。除非明确排除,否则在加入化合物之前,对细胞成像20秒以建立基线。30秒后,在加入另一物质之前施加2分钟的洗涤。在每次成像试验结束时,均加入50mmkcl作为阳性对照。在计算百分比时囊括的细胞全部显示,比加入kcl时的基线增加至少50%的[ca2+]i。
肥大细胞
如所述者纯化肥大细胞,种植在涂覆有30mg/ml纤连蛋白的盖玻片上,并令其在37c恢复2小时。随后令细胞加载fluo-4am。
ec50和ic50测定
将稳定地表达mrgpra1、mrgprx4和mrgrpc11的hek293细胞以10,000细胞/孔种在涂覆有聚-d-赖氨酸的96孔板中。令细胞加载fura2-am,洗涤两次,并维持在cib中。在弱光下将血红素代谢物新鲜溶解在dmso中,随后稀释在由20mmtris和150mmnacl组成的ph8.8缓冲液中。在每次实验之前,评估ph的潜在变化。从实施三次平行实验的将应答测定ec50值,重复2至4次。为了通过对抗胆红素的qwf确定潜在的拮抗剂,在施加激动剂之前,在cib中用各种剂量的qwf将细胞处理1分钟。
鼠腹膜肥大细胞纯化和钙成像
通过吸入co2牺牲8至12周龄的成年雄性鼠。将总计25ml的肥大细胞解离培养基(mcdm;具有3%胎牛血清的hbss和10mmhepes,ph7.2)在冰上骤冷,之后再用来制作两种连续腹腔灌洗液。合并灌洗液并以200g涡旋。球丸再次悬浮在2mlmcdm中,在4ml的等渗70%percoll悬浮液(2.8mlpercoll、320ml10%hbss、40ml1mhepes、830mlmcdm)上分层,在4℃以500g涡旋20分钟。从球丸中回收肥大细胞。将肥大细胞再次悬浮在具有10%胎牛血清(fbs)和25ng/ml重组鼠干细胞因子(sigma)的dmem中。
鼠腹膜肥大细胞组胺释放试验
如所述者纯化肥大细胞,并令其在37℃恢复2小时。随后将细胞以300细胞/孔种植在涂覆有20mg/ml纤连蛋白的96孔板上。将板在37℃孵化45分钟,之后检验。对于检验,将所有化合物稀释在cib中。加入化合物后5分钟,吸走上清液,在-80℃冷冻,直到使用htre组胺检验试剂盒(cisbioassays)根据制造商的使用说明书测定组胺水平为止。
drg解离和培养
将来自所有脊髓水平的drg神经元收集在冷dh10培养基(90%杜尔贝科改进伊格尔培养基(dmem)/f-12、10%fbs、青霉素(100u/ml)和链霉素(100μg/ml))中。在37℃使用蛋白水解酶(dispase)(5mg/ml)/i型胶原酶(1mg/ml)的酶混合物将drg消化45分钟。研磨后,将细胞在300g涡旋并再次悬浮在dh10中,之后种植在涂覆有聚-d-赖氨酸(0.5mg/ml)和层粘连蛋白(10μg/ml,invitrogen)的盖玻片上。使用以50ng/mlngf补充的dh10在37℃培养drg。
drg病毒转导
使用pspax2和pmd2.g生成编码用于mrgpr的各种cdna的慢病毒。通过在100,000g离心4小时另病毒成丸,用dh10培养基轻柔洗涤两次,并悬浮在dh10中。drg单离并培养1天后,用慢病毒将drg感染24小时过夜。次日上午,将培养基完全替换为以50ng/mlngf补充的新鲜dh10。感染24小时后,处理细胞进行钙成像。
drg电生理学
如上所述,收集来自3至5周龄鼠的drg神经元。培养1至3天后,将drg神经元转移到具有细胞外溶液的腔室内,该溶液含有144mmnacl、2.5mmkcl、2mmcacl2、0.5mmmgcl2、5mmhepes和10mm葡萄糖并且用naoh调节至ph7.4。使用尖端电阻为3至5mω的硼硅酸盐毛细玻璃电极(sutterinstrument)在大约23℃执行全细胞电流钳记录。内部溶液含有80mm醋酸钾、30mmkcl、40mmhepes和1mmcacl2,并使用氢氧化钾(koh)调节至ph7.4。选择直径为15至25μm的小直径神经元进行膜片箝。使用axopatch700b放大器和带pclamp9.2软件包的digidata1322a数字转换器(axoninstrument)获取数据。通过灌注20秒而加入1mm氯喹(cq),并且通过移液管加入50μm新鲜制备的胆红素。在每次细胞记录结束时,施加含有50mmkcl的溶液。仅将在加入kcl后将会激发动作电位的神经元视为健康的且适合在数据分析中使用。
微量热泳动结合试验
通过使用nanotempermonolithnt.115仪器27的微量热泳测定mrgpra1、mrgprx4和mrgrpc11朝向各种配体的结合等温线。使用10μm感兴趣的gfp标记受体将配体在结合缓冲液(20mmtris和150mmnacl,ph8.8)中在室温下孵化5分钟。将受体粗略纯化为来自稳定地表达该受体的细胞的膜组分45。在弱光下将血红素代谢物新鲜溶解在0.1mnaoh中,随后稀释到试验缓冲液中。将冻干的bam8-22溶解在结合缓冲液中。在使用受体孵化之前,评估每一配体的ph。将样本加载到来自nanotemper的nt.115疏水处理的毛细管中。使用20%led功率和15%mst功率执行微量热泳实验。使用来自三个独立实验的数据,以质量作用定律计算kd。单纯使用热泳评估胆红素与受体之间的结合,而通过t-jump评估bam8-22与mrgprc11之间的结合。排除具有剧烈的初始荧光偏差的样本。
[35s]gtpγs结合
通过测量放射性标记且不可水解形式的gtp与[35s]鸟苷-5’-(γ-硫代)三磷酸酯的结合([35s]gtpγs)测定mrgpr活化,如先前所述45。简单地说,将10μg的粗制膜组分稀释到以10μmgdp补充的175μl试验缓冲液(50mmhepes、5mmmgcl2、100mmnacl、1mmedta、0.1%triton80)中,在室温下孵化5分钟。随后,将膜在以50μm胆红素补充的最终体积为199μl的试验缓冲液中再孵化1分钟。随后加入10nm[35s]gtpγs而将样本带至200μl。在轻柔搅动下,将样本在4℃孵化2小时。通过在gf/b过滤器上快速过滤而终止实验,并使用洗涤缓冲液(50mmtris-hcl、5mmmgcl2和50mmnacl,ph7.4)洗涤三次。随后将过滤器浸没在闪烁液中并计数。通过使用10μm未标记gtpγs竞争而测定非特异性结合。作为两个独立的实验执行gtpγs结合试验,平行进行三组。
免疫组化
使用戊巴比妥麻醉成年鼠(5至6周龄),并先后灌注20ml冷0.1mpbs(ph7.4)和25ml冷固定剂(4%多聚甲醛(v/v)和14%饱和苦味酸(v/v),在0.1mpbs中)。从被灌注的鼠切除drg,在4℃将其在4%多聚甲醛中固定1小时。将组织在20%蔗糖(w/v)中低温保存超过24小时,之后包埋在最佳切割温度复合物(oct)中,使用冷冻切片机切片。将切片在载玻片上在37℃干燥1小时,并在21至23℃用4%多聚甲醛固定10分钟。在21至23℃将载玻片在封闭液(在pbs中的10%正常山羊血清(v/v)和0.2%tritonx-100(v/v),ph7.4)中预孵化1小时,随后在4℃用初级抗体孵化过夜。在21至23℃执行二级抗体孵化2小时。关于初级抗体,是结合至cgrp的兔抗体(t-4239,peninsula,1:1,000)和结合至gfp的兔抗体(a-11122,molecularprobes,1:1,000)。关于二级抗体,将山羊抗兔抗体(a11011,alexa568结合;a11008,alexa488结合;molecularprobes)以1:500稀释在封闭液中使用。
生成稳定地表达gfp标记的mrgpr的细胞
在先前所述报导中,生成表达gdp标记的mrgpra3、mrgprc11、mrgprd、mrgprx1和mrgprx2的hek293稳定细胞系21、23、46。简单地说,使用lipofectamine3000将含有感兴趣受体的质粒转染到hek细胞中。3天后,使用0.5mg/mlg418选择细胞。3周后,建立单克隆的克隆体,并鉴别每一最高表达的克隆体。就本研究而言,将mrgpra1和mrgprx4插入pegfp-n1中并转染到hek293细胞内。使用0.5mg/mlg418进行三周的mrgpr阳性细胞选择,此后,通过facs分选gfp阳性细胞并进行单克隆繁殖。如通过gfp荧光所测量的,选择两个表达类似水平的mrgpra1和mrgprx4的细胞系进行研究。
高压液相色谱(hplc)
使用25cm×4.6mmlc-18分析柱(xterra,waterscorporation)通过hplc检测血浆胆红素。使用流动相梯度洗脱胆红素:在60%甲醇/40%水(v/v)中的0.1m醋酸铵(ph5.2)(溶剂a)和100&甲醇(溶剂b)。如下述洗脱胆红素:0至14分钟:从100%a至100%b的线性梯度;14至19分钟:从100%a至100%b的线性梯度;19至24分钟:100%a的等度洗脱。胆红素展现大约14至15分钟的保留时间,并通过测量在450nm的吸收而检测。将10μm胆红素作为内标加入样本中,证实了对应于血浆胆红素的峰。
胆汁淤积的鼠模型和样本采集
将1-萘基异硫氰酸酯(anit;sigma)溶解在橄榄油(sigma)中。每天对动物口服给药25mg/kganit,持续5天。在第五天,令动物适应瘙痒行为。在第六天,将动物置于测试室中并录像一小时。计数界定为使用任一后爪进行连续抓挠动作的抓挠动作出现次数,并将在1小时期间以5分钟间隔获得的数据并入统计中。评估瘙痒行为后,对动物给药戊巴比妥(50mg/kg,腹腔注射)。通过心脏穿刺采集血液,并将其置于肝素化试管(bdbiosciences)内。离心之后,收集血浆,等量小样化,在-20℃存储直至分析。通过来自cellbiolabs的荧光试剂盒评估胆汁酸水平。在适用情况下,随后对小鼠进行组织学分析。
组织学
关于对anit诱发的胆汁淤积的组织学评估,对动物先后心脏灌注冷pbs和4%pfa(w/v)。切除肝脏,在4%pfa中固定过夜,通过10%至30%蔗糖(w/v)梯度低温保存。将肝脏包埋在oct中,用冷冻切片机切片。切片在室温下干燥1小时,随后用苏木精染色,用曙红共染色,冲洗,随后脱水。
量子力学计算
使用spartan16执行dfi计算,用wxmacmolplt建模。使用dft-hartreefock杂交b3lyp理论和6-31g(d)基组完成几何优化和单点能量计算。在298k气相基态计算能量。
血浆胆红素耗竭
或通过fecl3氧化为胆绿素ixα/胆绿素xiiiα,或通过免疫沉淀,将血浆胆红素耗竭。将fecl3制备为在0.1nhcl/甲醇中的20%fecl3溶液。在37℃将fecl3与血浆以1.5%fecl3的最终浓度回流10分钟。fecl3是温和的氧化剂,但展现将胆红素氧化为胆绿素的氧化还原电位47。也通过用5μg的正常兔igg或偶联至蛋白质a/g微珠的抗胆红素抗体(如先前所述生成10)将血浆在25℃孵化1小时,将胆红素免疫沉淀。为了将胆红素耗竭定量,用100%甲醇从样本中提取胆红素,并进行hplc和紫外-可见光谱分析。将吸光度调节至0od的基线,通过对色谱峰下面积积分来定量胆红素。
数据分析
除非另做说明,否则各组数据表达为均值±sem。使用双尾未配对学生t测试、精确概率检验和卡方检验来测定统计学比较中的显著性,并将p<0.05的差异视为显著。使用统计功率分析来证明样本尺寸,并将如通过f测试测得的方差确定为在全部治疗组之间是类似的。经历成功过程和/或治疗的样本或动物无一被排除在分析之外。以考量表型和治疗两者的封闭模式设计所有行为实验。
实施例13:胆红素引起非组胺能的、mrgpr依赖性的瘙痒
痒,临床上称为瘙痒,是被背根神经节中初级感觉神经元感知的对皮肤和粘膜表面的刺激5-8。尽管存在用于组胺介导的瘙痒的有效治疗手段,但非组胺能病症如黄疸相关瘙痒更难治2。黄疸,或者皮肤、巩膜和粘膜的黄化,是黄色代谢产物胆红素不正常蓄积的结果。
胆红素具备复杂的生理学和病理生理学特性。在生理学和略微提高的浓度(0.2至2.7mg/dl,3.4至46.2μm)下,胆红素可作为抗氧化剂9,且对神经10和心脏11均具有保护性。但在高水平下,例如在皮肤黄疸中(>5mg/dl,>85.5μm胆红素),其与瘙痒相关,这一关联早在公元前2世纪就首次引起了医生的关注1。
尽管黄疸与瘙痒之间的关联存在已久12,但早前并未将胆红素本身作为致痒原进行探究。为了确定胆红素是否直接引起瘙痒,将胆红素透皮注射到小鼠的颈背部。病理生理学浓度的胆红素以剂量依赖性模式刺激了对注射部位的抓挠(图23a)。使用以高亲和性结合胆红素的人血清白蛋白13-15预孵化胆红素,引起了较低程度的抓挠(图23a)。胆红素诱发抓挠动作的时间进程反映了两种良好表征的致痒原:组胺和氯喹(图23b)。
为了证实胆红素引起瘙痒而不是疼痛,将胆红素注射到小鼠脸颊,该部位是使得瘙痒刺激和疼痛刺激之间存在行为差异的注射部位16。在脸颊注射胆红素,正如在颈背注射,促进了计量依赖性的抓挠(图27a)。胆红素既不引起擦拭也不引起舔舐,表明其选择性地刺激瘙痒而不是疼痛(图27b至27c)。
对小鼠注射类似结构化的代谢产物,以切丁胆红素的致痒活性的特异性(图23d)。直接上位于胆红素的两种代谢产物——氯高铁血红素和胆绿素,尽管也是四吡咯类物质,但不诱发抓挠(图23d)。尽管氯高铁血红素、胆绿素和胆红素仅在它们之间显示极低的芳香性和电子差异,但它们在生理化学特性和结构方法存在实质性的不同(图23e)。
为了更好地理解这些差异,先后执行密度泛函理论(dft)计算17-20和单点能量结算,以弄清每种代谢产物的最优几何。不同于血红素和胆绿素,胆红素的四个吡咯环是伸展的且并不处于同一平面内(图23e)。dft计算指出,两种位于胆红素下游的细菌代谢产物——尿胆素原和粪胆素,采用类似的伸展构象。尿胆素原和粪胆素两者均能刺激抓挠行为(图23d),表明胆红素的吡咯环的伸展构象对于其致痒活性可能是重要的。
具有黄疸相关瘙痒的患者从抗组胺接收很少的有益效果3。与这些临床发现一致,组胺受体1阻滞剂西替利嗪(30mg/kg,腹腔注射)未能成功平复注射胆红素的小鼠的抓挠行为(图27d)。再者,胆红素不引起钙应答或诱发可感知的来自腹膜肥大细胞的组胺释放(图27e至27f)。
mas相关g蛋白偶联受体(mrgpr)家族的受体是非组胺能瘙痒的主要中介物21-24。为了测试mrgpr是否介导胆红素诱发的瘙痒,向缺少12个mrgpr基因簇的(簇-/-)鼠注射胆红素21(图28a)。簇-/-动物的抓挠动作比野生型(wt)鼠少大约75%,表明该簇内12个mrgpr中的一个或多个介导胆红素诱发的瘙痒(图23a)。
实施例14:胆红素活化鼠mrgpra1和人mrgprx4
为了鉴别mrgpr的可靠性,将在簇-/-鼠体内删除的12个mrgpr中的每一个独立地表达在人胚胎肾(hek)293细胞中,并监测施加胆红素时的细胞内钙的变化。为了确保在阳性配体-受体相互作用时观察到钙应答,使用稳定表达鼠科动物g蛋白α亚基gα15的hek293细胞,其中gα15是经由磷脂酶c(plc)将gpcr偶联至钙信号传导的gα蛋白。
在12种鼠受体中,仅有表达mrgpra1的hek细胞在施加胆红素时展现钙应答(ec50为145.9μm[96,220])(图24a和图24c)。对胆红素产生应答的相同细胞也对fmrf(一种mrgpra1激动剂)产生应答。为了确保胆红素以mrgpra1启动细胞信号传导,用gpcr信号传导的抑制剂(plc抑制剂u73122或gq抑制剂ym-254890)预处理表达mrgpra1的细胞。两种化合物均摧毁了胆红素诱发的钙应答(图24b至24c)。
除了胆红素本身之外,在黄疸相关瘙痒中,葡萄糖醛酸和的胆红素也往往得以上调。评估相似的胆红素衍生物是否将会活化mrgpra1。事实上,二牛磺酸化胆红素(缀合胆红素)活化了表达mrgpra1的细胞(图24d)。与最初的行为发现相符,氯高铁血红素未能成功活化mrgpra1(图24d)。除此之外,所筛选的12中mrgpr中没有对胆红素产生应答的(图24m、图28b至28f)。
鼠mrgpra家族在序列同源性方面最接近人mrgprx家族(图28a至28f)4、25、26。四种人mrgprx受体中,仅有表达mrgprx4的细胞对胆红素产生应答(ec50为61.9μm[44,87])(图24f和图24i)。正如在表达mrgpra1的细胞中一样,u73122和ym-254890在表达mrgprx4的细胞中抑制胆红素诱发的钙应答(图24g至24h)。缀合胆红素也活化mrgprx4,而氯高铁血红素没有这一效果(图24i)。
为了证实胆红素直接结合到所鉴别的受体,进行存在和不存在胆红素下的受体热泳试验。分子的热泳受到物理参数如尺寸、电荷和溶剂化的影响,并因此可用来评估分子间的相互作用27。使用这一途径,测得胆红素以92.9±15μm的kd结合mrgpra1,并且以54.4±13μm的kd结合mrgprx4(图24e和图24j)。胆红素展现极小到没有的对bam8-22受体mrgprc11的亲和性(图24n)。通过钙成像证实,氯高铁血红素不活化mrgpra1或mrgprx4(图24d和24i),也不结合mrgpra1或mrgprx4(图24e和图24j)。缀合胆红素结合mrgpra1和mrgprx4两者,但亲和性比胆红素低(图24e和图24j)。为了确认胆红素在结合时活化mrgpra1和mrgprx4,测量了二磷酸鸟苷(gdp)与三磷酸鸟苷(gtp)的交换,这是gpcr信号传导中的第一个事件。胆红素增加gtp与mrgpra1和mrgprx4膜复合体的结合,而不增加与mrgprc11膜复合体的结合(图24k)。为了证实胆红素在体内活化mrgpra1以引起瘙痒,使用crispr-cas9生成mrgpra1(a1-/-)敲除鼠系28(图29a至29c)。当注射胆红素时,a1-/-动物的抓挠动作显著少于wt鼠(图24l)。
实施例15:胆红素以mrgpr依赖性的方式活化感觉神经元
先前研究已经证明,mrgpra1和mrgprx4两者均被表达在背根神经节(drg)中感觉神经元的一个子集内4、25、26。6周龄成年鼠在低百分比的感觉神经元中表达mrgpra1(图25a)。施加50m胆红素在小直径(<30μm)wtdrg感觉神经元(50个中的5个)中引起强劲的动作电位。但是,胆红素未能在a1-/-神经元(60个中0个)中成功诱发动作电位(图25b)。感觉神经元中的mrgpra1表达与mrgpra3表达重叠,这是瘙痒感觉神经元的典型特征(dongetal.,2001;hanetal.,2012)。如通过电生理学和ca2+成像所测定的,对胆红素产生应答的感觉神经元与也对1mm氯喹(一种mrgpra3配体)产生应答的神经元部分地重叠(qinliu,dong,cell2009)(图25c、图30a)。胆红素感知神经元的平均体细胞直径为20.4±1.3μm,这是瘙痒感觉神经元的直径特征(图30b)。大约5%的wtdrg神经元对50m胆红素的施加产生应答,而来自簇-/-或a1-/-drg的产生应答的感觉神经元明显较少(图25d至25e)。
为了证实胆红素活化推定的mrgpra3阳性瘙痒神经元,对从tg(mrgpra3-cre);lsl-tdtomato鼠单离的drg神经元实施钙成像,其在mrgpra3阳性神经元中表达荧光蛋白tdtomato。50μm胆红素活化相当大百分比的tdtomato阳性神经元(图25f)。
之后确定mrgpra1或mrgprx4的表达是否足以使得神经元对胆红素敏感。为了解决这一问题,用携带mrgpra1、mrgprx4或mrgprx3的慢病毒转染簇-/-drg。胆红素活化14%的mrgpra1转导的簇-/-drg和32%的mrgprx4转导的簇-/-drg(图25g至25i)。用对照基因mrgprx3感染的簇-/-drg未能成功对胆红素产生应答。
之后解决胆红素在体内的缓慢增加是否将会刺激mrgpr依赖性的瘙痒。为了解决这一问题,将α-萘基异硫氰酸酯(anit)给药至鼠以诱发肝内胆汁淤积或者胆汁流动减缓或停滞30。胆汁是借以排泄胆红素的主要手段,并且胆汁淤积患者在他们的血液中展现升高的胆红素值和其它致痒原物质水平。在评估自发瘙痒之前,用25mg/kganit将wt、簇-/-和a1-/-动物治疗5天。wt、簇-/-和a1-/-动物展现同等程度的如通过肝脏组织学所测定的胆汁淤积性损伤,以及血浆胆红素、胆汁酸、碱性磷酸酶(alp)、天冬氨酸转氨酶(ast)、丙氨酸转氨酶(alt)和γ-谷氨酰转移酶(ggt)的相对增加(图31a至31d)。
实施例16:mrgpra1-/-、簇-/-和bvr-/-动物展现降低的胆汁淤积性瘙痒
与媒介物治疗相比,anit治疗在所有动物中均导致显著增加的瘙痒(图a)。但是,簇-/-和a1-/-鼠的抓挠动作明显少于wt鼠(图26a),暗示mrgpra1介导胆汁淤积性瘙痒的组分。在人体内,胆汁淤积性血清中的胆汁酸、内源性阿片类物质和lpa往往增加,并且这些物质已经显示介导瘙痒31-34。经anit治疗的动物的血清展现增加的胆汁酸(图31e),而内源性阿片类肽——甲硫氨酸脑啡肽35-36和产生lpa的酶——自家趋化素都不增加(图31f至31g)。
为了证实使用anit的簇-/-和a1-/-鼠的抓挠动物较少,是因为胆红素而非一些其它胆汁淤积性致痒原不再能够刺激mrgpra1依赖性的瘙痒,对wt和簇-/-鼠注射胆汁酸、阿片类物质和lpa。其它胆汁淤积性致痒原无一是mrgpr依赖性的,因为它们在wt和簇-/-动物体内全部引起同等程度的瘙痒(图31h至31k)。因此,使用anit的簇-/-和a1-/-鼠的抓挠动作较少,是因为mrgpra1特异性地介导黄疸型瘙痒。
为了进一步证明胆红素与mrgpra1相互作用以刺激胆汁淤积性瘙痒,生成了缺少用于胆红素的生物合成酶(胆绿素还原酶)的(bvr-/-)鼠37(图23e、图32a)。缺少bvr的鼠血浆中不具有可检测水平的胆红素(图32b至32d)。当用anit治疗时,bvr-/-的抓挠动作显著少于wt鼠(图26b)。胆汁酸、alp、ast、alt和ggt的血浆水平在经治疗的bvr-/-动物与wt对照物之间别无二致(图31a至31d)。对于anit的差异性应答并非由于异常的瘙痒回路,因为当注射氯喹或外源性胆红素时,bvr-/-鼠正常抓挠(图32e至32f)。
为了证实所观察的胆汁淤积性瘙痒差异不恰好是anit特异性的,将肝脏毒素环孢菌素a给药至wt、a1-/-和bvr-/-鼠38。在评估自发性瘙痒之前,用50mg/kg环孢菌素a或媒介物对小鼠治疗8天(图33a和图33b)。环孢菌素a在wt动物体内诱发了自发性瘙痒,而a1-/-和bvr-/-鼠的抓挠动作再一次显著少于wt鼠(图33a和图33b)。
评估mrgpr的药理学拮抗作用是否将会缓解胆汁淤积性瘙痒。最近,3-氨基酸肽qwf被鉴定为mrgpra1拮抗剂39。qwf废止了表达mrgpra1的细胞内的胆红素相关的钙信号传导,其ic50为2.9m[1,5](图34a)。反映其体外药理作用,共同注射0.25mg/kgqwf与胆红素显著减轻了与胆红素相关的瘙痒(图34b)。qwf造成的拮抗作用是胆红素特异性的,因为它不减轻与氯喹-mrgpra3相关的瘙痒(图34c)。
评估mrgpra1拮抗剂qwf是否在体内减轻胆汁淤积性瘙痒。如先前所述,对wt动物给药anit,但在行为分析之前30分钟,对小鼠经腹腔注射媒介物或1mg/kgqwf。使用qwf治疗的鼠的抓挠动作显著少于使用媒介物治疗的动物(图26d)。qwf治疗不改变总胆红素、ast、alt或alp的血浆水平,暗示qwf治疗不改变潜在的肝脏病理(图34d至34g)。
对于胆汁淤积性瘙痒,鼻胆管引流是最有效的治疗手段40。基于这一观察,预测从胆汁淤积动物单离的血浆将会引起瘙痒。事实上,当将来自具有胆汁淤积的wt动物的血浆注射到天然wt动物体内时,引起了瘙痒(图26e)。从缺乏胆红素的bvr-/-鼠单离出的胆汁淤积血浆(图32b至32d),引起了显著少于wt胆汁淤积血浆的抓挠动作(图26e)。在wt和bvr-/-胆汁淤积血浆之间,alp、ast和alt水平别无二致(图31a至31d),暗示来自原始wt和bvr-/-鼠的等量肝损伤。反之,bvr-/-血浆很可能因为缺乏胆红素而导致较低程度的瘙痒。
从四位苦于各种导致高胆红素血症的病症的患者体内单离出血浆(图26f)。四位患者的血浆在wt动物体内全部唤起了瘙痒(图26g)。当注射到a1-/-动物体内时,每位患者的血浆引起了较低程度的瘙痒(图26g)。为了评估从胆汁淤积血浆中移除胆红素是否可以是治疗性的,通过选择性氧化或抗胆红素抗体耗竭胆红素,随后再次评估其瘙痒能力。通过hplc和紫外-可见导数光谱两种方法验证胆红素的移除(图35a至35b)。向wt鼠注射使用fecl3或胆红素抗体处理后的患者#1血浆,导致了比注射未处理血浆和经正常igg处理的患者血浆更轻程度的瘙痒(图26h至26i)。
实施例17:
多种病理学条件导致黄疸,一种由于胆红素累积导致的皮肤黄化。具有黄疸的患者一般报告经历激烈的非组胺能的瘙痒1-3。尽管存在这一关联,但胆红素本身的致痒能力尚未得到探究,而且尚未鉴别出胆红素受体。本文中,演示了病理生理水平的胆红素通过mrgpr激励外周瘙痒感觉神经元并引起瘙痒,其中mrgpr是表达在初级感觉神经元中的一个g蛋白偶联受体家族4。胆红素结合并活化两种先前未表征的mrgpr:鼠mrgpra1和人mrgprx4。在另种病理高胆红素血症的鼠模型中显示,mrgpra1或bvr(产生胆红素的酶)的基因删除令瘙痒衰减。同样,从高胆红素血症患者单离的血浆在野生型动物体内唤起瘙痒,但在mrgpra1-/-动物体内不唤起瘙痒。移除胆红素降低了患者血浆的致痒能力。基于这些数据,以mrgpr为靶向是减轻黄疸诱发的瘙痒的一个有前景的策略。
迄今为止,没有已知的用于胆红素的细胞表面受体。本文中的结果表明,胆红素可能是疾病中不适合被忽视的惰性生物标记物,因为它很可能通过结合并活化mrgpr而唤起瘙痒。
并非每位苦于胆汁淤积性瘙痒的患者都有黄疸,暗示胆红素很可能是这些苦于胆汁淤积型瘙痒的患者体内存在的几种致痒原之一。其它合理的致痒原很可能包括胆汁酸、内源性阿片类物质和lpa,其可通过非mrgpr机制发挥作用(图31h至3k)。此外,并非每一个患有黄疸的患者都经历瘙痒。例如,患有杜宾-约翰逊综合征(dubin-johnsonsyndrome,一种牵涉胆红素转运蛋白abcc2中的突变的常染色体隐性遗传病)的患者,具有增加的血清缀合胆红素,但仍罕见关于瘙痒的抱怨41。这些患者和其它具有黄疸的患者不经历瘙痒可能存在几种原因。因为胆红素是被血清白蛋白强有力结合的亲脂性分子,血清中总胆红素值与组织中胆红素值之间很可能存在不一致。值得注意的是,胆汁淤积性瘙痒的最佳预测指标之一是梅奥(mayo)风险评分,其采用血清胆红素和白蛋白两个值12。此外,这些非瘙痒性黄疸病患者的血清胆红素值显著低于瘙痒性黄疸患者的血清胆红素值41。患有原发性胆汁性胆管炎的患者的总血清胆红素值典型比患有杜宾-约翰逊综合征的患者高2至3倍,暗示患有非瘙痒性黄疸的患者很可能不具备足以诱发瘙痒的胆红素值41。此外,在患有孤立高胆红素血症的患者体内,大多数胆红素很可能结合至白蛋白和其它血清蛋白,从而阻碍胆红素进入皮肤或与感觉神经上存在的受体相互作用13、42、43。尽管存在这些问题,但结果暗示,封闭mrgprx4可对那些苦于黄疸相关瘙痒的患者提供缓解。
实施例12-17的参考文献列述于下:
1.bassari,r.jaundiceassociatedpruritis:areviewofpathophysiologyandtreatment.worldj.gastroenterol.21,1404–11(2015).
2.kremer,a.e.,elferink,r.p.j.o.&beuers,u.pathophysiologyandcurrentmanagementofpruritusinliverdisease.clinreshepatolgastroenterol35,89–97(2011).
3.carstens,e.,akiyama,t.&bergasa,n.v.pruritusofcholestasis.(2014).
4.dong,x.,han,s.-k.,zylka,m.j.,simon,m.i.&anderson,d.j.adiversefamilyofgpcrsexpressedinspecificsubsetsofnociceptivesensoryneurons.cell106,619–632(2001).
5.lamotte,r.h.,dong,x.&ringkamp,m.sensoryneuronsandcircuitsmediatingitch.naturepublishinggroup15,19–31(2014).
6.bautista,d.m.,wilson,s.r.&hoon,m.a.whywescratchanitch:themolecules,cellsandcircuitsofitch.nat.neurosci.17,175–182(2014).
7.yosipovitch,g.&bernhard,j.d.clinicalpractice.chronicpruritus.n.engl.j.med.368,1625–1634(2013).
8.ikoma,a.,steinhoff,m.,
9.baranano,d.e.,rao,m.,ferris,c.d.&snyder,s.h.biliverdinreductase:amajorphysiologiccytoprotectant.proc.natl.acad.sci.u.s.a.99,16093–16098(2002).
10.dore,s.etal.bilirubin,formedbyactivationofhemeoxygenase-2,protectsneuronsagainstoxidativestressinjury.proc.natl.acad.sci.u.s.a.96,2445–2450(1999).
11.clark,j.e.etal.hemeoxygenase-1-derivedbilirubinamelioratespostischemicmyocardialdysfunction.am.j.physiol.heartcirc.physiol.278,h643–h651(2000).
12.talwalkar,j.a.,souto,e.,jorgensen,r.a.&lindor,k.d.naturalhistoryofpruritusinprimarybiliarycirrhosis.clin.gastroenterol.hepatol.1,297–302(2003).
13.jacobsen,j.&broderson,r.albumin-bilirubinbindingmechanism.jbiolchem258,6319–6326(1983).
14.breaven,g.h.,d'albis,a.&gratzer,w.b.theinteractionofbilirubinwithhumanserumalbumin.eur.j.biochem.33,500–509(1973).
15.griffiths,w.c.,diamond,i.&dextraze,p.thealbuminbindingofunconjugatedbilirubininserum.clin.biochem.8,254–260(1975).
16.shimada,s.g.&lamotte,r.h.behavioraldifferentiationbetweenitchandpaininmouse.pain139,681–687(2008).
17.hohenberg,p.&kohn,w.inhomogeneouselectrongas.physicalreviewb136,b864–+(1964).
18.kohn,w.&sham,l.j.self-consistentequationsincludingexchangeandcorrelationeffects.physicalreview140,1133–&(1965).
19.becke,a.d.density-functionalthermochemistry.3.theroleofexactexchange.journalofchemicalphysics98,5648–5652(1993).
20.stephens,p.j.,devlin,f.j.,chabalowski,c.f.&frisch,m.j.ab-initiocalculationofvibrationalabsorptionandcircular-dichroismspectrausingdensity-functionalforce-fields.journalofphysicalchemistry98,11623–11627(1994).
21.liu,q.etal.sensoryneuron-specificgpcrmrgprsareitchreceptorsmediatingchloroquine-inducedpruritus.cell139,1353–1365(2009).
22.sikand,p.,dong,x.&lamotte,r.h.bam8-22peptideproducesitchandnociceptivesensationsinhumansindependentofhistaminerelease.journalofneuroscience31,7563–7567(2011).
23.liu,q.etal.mechanismsofitchevokedbyβ-alanine.journalofneuroscience32,14532–14537(2012).
24.han,l.etal.asubpopulationofnociceptorsspecificallylinkedtoitch.nat.neurosci.16,174–182(2012).
25.lembo,p.m.c.etal.proenkephalinageneproductsactivateanewfamilyofsensoryneuron--specificgpcrs.nat.neurosci.5,201–209(2002).
26.zhang,l.etal.cloningandexpressionofmrgreceptorsinmacaque,mouse,andhuman.brainres.mol.brainres.133,187–197(2005).
27.duhr,s.&braun,d.whymoleculesmovealongatemperaturegradient.proc.natl.acad.sci.u.s.a.103,19678–19682(2006).
28.jinek,m.etal.aprogrammabledual-rna–guideddnaendonucleaseinadaptivebacterialimmunity.science337,816–821(2012).
29.flegel,c.etal.rna-seqanalysisofhumantrigeminalanddorsalrootgangliawithafocusonchemoreceptors.plosone10,e0128951(2015).
30.eliakim,m.,eisner,m.&ungar,h.experimentalintrahepaticobstructivejaundicefollowingingestionofalphanaphthyl-iso-thiocyanate.bullrescouncisrsecteexpmed8e,7–17(1959).
31.kremer,a.e.,martens,j.,kulik,w.&
32.alemi,f.etal.thetgr5receptormediatesbileacid-induceditchandanalgesia.j.clin.invest.123,1513–1530(2013).
33.bergasa,n.v.etal.acontrolledtrialofnaloxoneinfusionsforthepruritusofchroniccholestasis.ygast102,544–549(1992).
34.bergasa,n.v.etal.open-labeltrialoforalnalmefenetherapyforthepruritusofcholestasis.hepatology27,679–684(1998).
35.thornton,j.r.&losowsky,m.s.methionineenkephalinisincreasedinplasmainacuteliverdiseaseandispresentinbileandurine.j.hepatol.8,53–59(1989).
36.thornton,j.r.&losowsky,m.s.plasmaleucineenkephalinisincreasedinliverdisease.gut30,1392–1395(1989).
37.kutty,r.k.&maines,m.d.purificationandcharacterizationofbiliverdinreductasefromratliver.j.biol.chem.256,3956–3962(1981).
38.laupacis,a.,keown,p.a.,ulan,r.a.,sinclair,n.r.&stiller,c.r.hyperbilirubinaemiaandcyclosporinalevels.lancet2,1426–1427(1981).
39.azimi,e.etal.dualactionofneurokinin-1antagonistsonmas-relatedgpcrs.jciinsight1,e89362(2016).
40.hegade,v.s.etal.thesafetyandefficacyofnasobiliarydrainageinthetreatmentofrefractorycholestaticpruritus:amulticentreeuropeanstudy.aliment.pharmacol.ther.43,294–302(2016).
41.levitt,d.g.&levitt,m.d.quantitativeassessmentofthemultipleprocessesresponsibleforbilirubinhomeostasisinhealthanddisease.clinexpgastroenterol7,307–328(2014).
42.kozaki,n.etal.significanceofserumdelta-bilirubininpatientswithobstructivejaundice.j.surg.res.79,61–65(1998).
43.kalir,t.,catanese,g.s.&clejan,s.clinicaldiagnosticutilityofdeltabilirubin.labmed21,159–162(1990).
44.liu,q.etal.moleculargeneticvisualizationofararesubsetofunmyelinatedsensoryneuronsthatmaydetectgentletouch.nat.neurosci.10,946–948(2007).
45.vasavda,c.,zaccor,n.w.,scherer,p.c.,sumner,c.j.&snyder,s.h.measuringg-protein-coupledreceptorsignalingviaradio-labeledgtpbinding.jvisexp(2017).doi:10.3791/55561
46.mcneil,b.d.etal.identificationofamast-cell-specificreceptorcrucialforpseudo-allergicdrugreactions.nature519,237–241(2015).
47.dolphin,d.theporphyrins:biochemistry,parta-b.(academicpr,1978).
实施例18:mrgprx4反向激动剂和拮抗剂
使用384孔均匀时间分辨荧光试验(htrf
各化合物对抗mrgprx4受体的反向激动剂和拮抗剂活性提供在下表1中。通过上述技术筛选可商购的小分子库来鉴别表1的化合物。关于mrgprx4反向激动剂活性:“++++”表示基线下至少3标准偏差的活性;且“+++”表示基线下2标准偏差至小于3标准偏差的活性。关于mrgprx4拮抗剂活性:“++++”表示将胆红素诱发的信号阻断至少85%;且“+++”表示将胆红素诱发的信号阻断70%至低于85%。
表1.
mrgprx4调节剂
其它具体例
尽管已经连通其详细说明书而揭示本发明,但前述说明书试图例示性说明本发明而非限制本发明的范畴,本发明的范畴应为所附权利要求书的范畴所界定。其它方面、优点和修饰处于后附权利要求书的范畴内。
本文中所指的专利和科学文献构建了该领域技术人员所能应用的知识体系。本文中引用的所有美国专利和已公开或未公开的美国专利申请通过引用而并入本文。本文中引用的所有已公开的外国专利和专利申请通过引用而并入本文。以本文中引用的登录号指明的genbank和ncbi文件通过引用而并入本文。本文中引用的所有其它已出版的参考文献、文档、手稿和科学文献通过引用而并入本文。
尽管本发明已经参照其优选的具体实施方式得以部分地显示和说明,但该领域技术人员应理解,可对本发明的形式和细节进行各种改变而不悖离由所附权利要求书所涵盖的本发明范畴。
- 还没有人留言评论。精彩留言会获得点赞!