传感器的制作方法
本发明涉及用于检测靶标核酸的单核苷酸多态性(snp)或单核苷酸修饰的基因探针,以及确定靶标核酸混合池中的靶标核酸的单核苷酸多态性(snp)或单核苷酸修饰的百分比的方法。
背景技术:
单核苷酸多态性(snp)是基因组dna的特定序列中一个位点处的一个核碱基的变化,其在包括癌症在内的具有遗传组分的疾病的发展和预后中起重要作用。在临床研究、手术和诊断中,需要从等位基因(即snp)比值中提供快速、廉价且可靠的读数的方法以提供临床决策信息。
几种用于鉴别snp组成的商品化测定是已知的,例如,taqman。然而,尽管可以容易地将杂合性等位基因(即来自含有两种snp变体的两种dna拷贝的样品)与它们的纯合对应物(即两个相同拷贝)相区分,但是它仍难以定量含有非50/50的核碱基比的样品。这种情况可以出现在癌性组织区域中,其中突变程度(将提供通过手术除去的组织的量的信息)是未知的。或者,它可以出现在杂合mrna转录本中,其中转录了两种dna拷贝,但是一种大于另一种;这种情况可以指示与特定疾病有关的转录中的误调控。
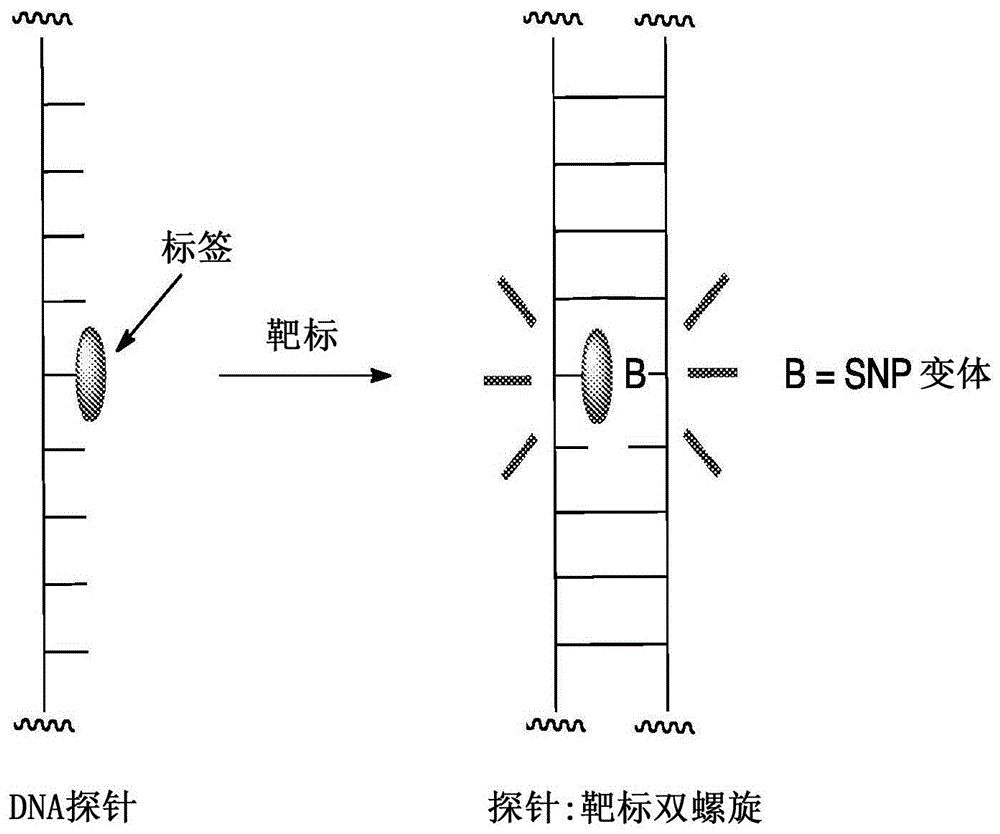
最近,开发了snp检测方法,其中可以常规地从dna靶标样品中读出snp类型(参见duprey等人,acschem.biol.,2016,11,717-721;zhao等人,biorg.med.chem.lett.,2012,22,129;duprey等人,chem.commun,2011,47,6629;和li等人,anal.chem.,2016,88,883–889)。与多种其他方法,包括商品化的那些一样,这种方法使用了涉及标签dna探针的双螺旋形成(杂交)以产生荧光信号。然而,这种方法中的一种差异在于所述分析基于双螺旋形成时所产生的信号强度(即信号强度),而不是基于双螺旋形成的好坏程度来提供信号。这意味着所述测定可以在室温下进行并且避免了对使用狭窄温度窗以确保仅一个转录本(或转录本产物)结合的需要。所述检测信号来自双螺旋形成时在特定监测波长(例如,426nm)升高或降低的探针链上的蒽标签的荧光发射,其中信号强度直接取决于相对碱基的类型(参见图1)。
duprey等人(acschem.biol.,2016,11,717-721)还证明杂交snp检测方法还可以区分碱基修饰(例如,胞嘧啶的甲基化或鸟嘌呤的氧化)以及碱基变化。
本发明的目标是提供改善的snp检测方法和提供用于这种snp检测的改善的探针。
技术实现要素:
根据本发明的第一方面,提供了用于检测靶标核酸的单核苷酸多态性(snp)或单核苷酸修饰的基因探针,基因探针包含:
-纳米颗粒;
-锚定至纳米颗粒表面的寡核苷酸探针,其包含具有通过接头基团并入其中的标签的寡核苷酸主链;和
-锚定至纳米颗粒表面的参比探针,其中参比探针包含标志物;
其中(a)标签是有机荧光标签并且所述标志物是基于过渡金属的荧光标志物;或者(b)标签是氧化还原活性标签并且所述标志物是基于过渡金属的氧化还原活性标志物。
适合地,标签能够在双链寡核苷酸的相邻碱基对之间部分插入和堆叠。
适合地,标志物不能够在双链寡核苷酸的相邻碱基对之间部分插入和堆叠。
将理解尽管本发明申请的工作实施例利用了使用荧光的实施方式(a),但是可以同样地使用利用电化学信号的实施方式(b)来实施本发明。
在另一个方面,还提供了包含根据本发明的第一方面的多种基因探针的组合物。这可以包含两个或更多个,或者5个或更多个,或者10个或更多个,或者50个或更多个,或者100个或更多个根据本发明的第一方面的基因探针。
组合物可以是溶液或混悬液。基因探针溶液可以具有至少0.1nm,至少0.5nm,至少1nm或至少5nm的浓度。组合物可以在水介质,例如,缓冲液中包含多个基因探针。
组合物可以包含一种或多种其他物质,如聚合物、溶剂、生物流体、蛋白、表面活性剂和稳定剂。在一些实施方式中,组合物包含聚丙烯酰胺、阴离子表面活性剂(例如,氟化表面活性剂,如
在一些实施方式中,组合物包含聚丙烯酰胺。可以将聚丙烯酰胺制备为溶液(例如,1mg/ml水溶液),将其以所需要的量(例如,0.1至1%v/v)加入至包含纳米颗粒的组合物中。
在一些实施方式中,组合物包含阴离子表面活性剂(例如,
在一些实施方式中,组合物包含血清(例如,人血清或胎牛血清)。血清的浓度可以为0.2%至2%(v/v)。
在一些实施方式中,组合物包含牛血清白蛋白(bsa)。可以将bsa制备为溶液(例如,1mg/ml水溶液),将其以所需要的量(例如,0.1至1%v/v)加入至包含纳米颗粒的组合物中。
本发明的基因探针提供了可以准确确定来自dna样品(例如,在来自癌性组织区域的那些中)或者来自mrna转录本的等位基因比例的用于杂合核酸样品的快速、廉价和定量评价。
寡核苷酸主链与所关心的靶标链形成双螺旋。它可以设计与靶标链互补。可以通过有机荧光标签发光强度的变化来检测单碱基变化。
本发明使得能够比率检测(ratiometricsensing),借此分析在两个不同波长下来自两个不同荧光团的检测信号。将一个信号强度除以另一个避免了确定初始探针浓度的需要;这简化且有利于检测方法,具体地其中探针浓度将难于确定的细胞环境中的分析。以类似的方式,在本发明的电化学实施方式中,可以分析来自两个不同的氧化还原活性材料的电流(或所产生的电荷)。
本发明允许比率系统,其使得能够检测不同的snp变体,而不需要每个实验的基线发光水平。一旦合成了新批次的本发明的基因探针,可以测量荧光标签与基于过渡金属的荧光标志物信号的比值,然后该比值可以用于使用该批次的所有后续实验。如果当归一化时,比值加倍,则存在错配的ca碱基对;然而如果比值减半,则存在匹配的cg碱基对。同样地,可以计算和使用来自氧化还原活性标签的电流(或所产生的电荷)与来自氧化还原活性标志物的电流(或所产生的电荷)的比值。
不需要每个实验的基线发光水平克服了当检测细胞内的snp靶标时,仅能进行单一蒽发光测量的问题。本发明所提供的比率检测法还克服了在探针细胞吸收中不同的问题。只要对于探针存在过量的靶标,则所测量的标签信号与标志物信号的比值将对于每个细胞中所存在的snp提供准确读数。
尽管比率检测本身并不是新的,但是以其中它们单独固定在纳米颗粒上的形式提供第一探针和第二(标准/参比)探针是新的。这是有利的,因为它提供了其中一起提供两种探针的稳定环境,并且存在在测试环境中两种探针的浓度相同的确定性,但是另外第二探针不与第一探针相互作用并因此一旦第一探针与不同靶标杂交时,其发光/信号不波动。
相反,先前对于使用荧光团的比率检测的努力遇到了问题:一旦结合至靶标,则第二荧光团显著波动。
因此,本发明的基因探针是有益的,其中它可以用于提供可靠的不依赖于浓度的第一探针的发光/信号水平。
本发明的基因探针的其他益处在于它能够定量含有非-50/50核碱基比的样品。
有利地,本发明的基因探针易于被细胞吸收而无需化学转染。
已知当置于金属纳米颗粒附近时,有机荧光团的发光剧烈降低,多达99.8%。参见dulkeith,e.等人nanolett.5,585–9(2005)。通过允许使用固定在金属纳米颗粒上的有机荧光标签,本发明与本领域的教导相反。
根据本发明的另一个方面,提供了确定靶标核酸混合池中的靶标核酸的单核苷酸多态性(snp)或单核苷酸修饰的百分比的方法,方法包括:
-将靶标核酸混合池与能够检测snp或单核苷酸修饰的寡核苷酸探针接触,其中寡核苷酸探针与靶标多核苷酸显著互补,并且其中寡核苷酸探针包含具有通过接头基团掺入其中的标签的寡核苷酸主链,其中标签是有机荧光标签或氧化还原活性标签,并且其中标签处于经布置与要检测的靶标核酸的核苷酸配对的位置,借此,
(i)取决于核苷酸的种类或修饰结构,有机荧光标签的光发射的强度是不同的;或者
(ii)取决于核苷酸的种类或修饰结构,氧化还原活性标签的电荷的强度是不同的;
-当靶标核酸的混合池与包含有机荧光标签的寡核苷酸探针接触时,检测有机荧光标签的荧光发射强度的变化百分比,或者当靶标核酸的混合池与包含氧化还原活性标签的寡核苷酸探针接触时,检测氧化还原活性标签的电荷强度的变化百分比;和
-通过将标签的强度变化百分比与已通过已知标准品的强度变化百分比的线性回归所确定的校准值相比较,确定单核苷酸多态性(snp)或单核苷酸修饰的百分比。
有利地,对于dna和rna序列的研究已表明了有机荧光标签的发光信号强度或者氧化还原活性标签的电荷强度与样品中的靶标中的snp/比值之间意外的线性相关性,因此使得能够校准snp比值(即等位比值),然后通过对给定波长的发光强度或者氧化还原活性标签的电荷强度的简单测量,读出未知混合物。方法提供了在等位基因(snp)比值中进行的快速、廉价且可靠的读数以提供临床决策信息。可以靶向所述dna序列,或者在适当情况下,间接分析mrna转录本(例如,通过cdna形成,然后pcr扩增)或者如果存在足够的靶标,直接分析(例如,细胞中mrna的检测)。
在一个实施方式中,标签是有机荧光标签,并且取决于核苷酸的种类或修饰结构,有机荧光标签的光发射的强度是不同的。在另一个实施方式中,标签是氧化还原活性标签,并且取决于核苷酸的种类或修饰结构,氧化还原活性标签的电荷强度是不同的。
本发明方法的寡核苷酸探针可以是本文所描述的根据本发明的基因探针的一部分或由本文所描述的根据本发明的基因探针组成。本发明方法的寡核苷酸探针可以包含与在本文中根据本发明的基因探针中所提供的相同的寡核苷酸探针。具体地,本发明的一个方面的实施方式可以等同地应用于本文中本发明的另一个方面的等同的实施方式。
根据本发明的另一个方面,提供了确定靶标核酸混合池中的靶标核酸的单核苷酸多态性(snp)或单核苷酸修饰的百分比的方法,方法包括:
-将靶标核酸混合池与本文中根据本发明的基因探针接触,基因探针能够检测snp或单核苷酸修饰,
-当靶标核酸的混合池与包含有机荧光标签的寡核苷酸探针接触时,检测有机荧光标签的荧光发射强度的变化百分比,或者当靶标核酸的混合池与包含氧化还原活性标签的寡核苷酸探针接触时,检测氧化还原活性标签的电荷强度的变化百分比;和
-通过将标签的强度变化百分比与已通过已知标准品的强度变化百分比的线性回归所确定的校准值相比较,确定单核苷酸多态性(snp)或单核苷酸修饰的百分比。
当靶标核酸混合池与寡核苷酸探针接触时,检测荧光标签发光变化百分比可以包括检测寡核苷酸探针与靶标核酸杂交时,所述荧光标签的发光变化。可以通过检测荧光标签和/或参比探针的发光或者发光强度变化来检测所述核酸探针与靶标核酸序列的杂交。可以通过荧光光谱学,例如,通过shimadzurf-5301pc荧光分光光度计检测和测量荧光发射。
当靶标核酸的混合池与包含氧化还原活性标签的寡核苷酸探针接触时,检测氧化还原活性标签的电荷强度的变化百分比可以包括当寡核苷酸探针与靶标核酸杂交时,检测氧化还原活性标签的电荷强度的变化。可以通过检测氧化还原活性标签和/或参比探针的电荷或者电荷强度变化来检测所述核酸探针与靶标核酸序列的杂交。
可以使用在本领域中熟知的技术连续检测电流。这些包括(但不限于)电子方法,例如,伏安法(例如,循环伏安法)或者电流分析法,或者光学法,例如,荧光或磷光。
使用cv-50w型bioanalyticalsystems(bas)电化学分析仪,在0.02cm2多晶金电极,在20±2℃,在100mm磷酸盐缓冲液(ph7)中进行循环伏安法(cv)。使用了包括改良的金-圆盘工作电极、饱和甘汞基准电极(sce,fisherscientific)和铂丝辅助电极的正常三-电极配置。通过改良的路金毛细管将电化学电池的工作隔室与参比隔室分开。然后,可以相对于sce报告电势。可以通过cv确定和分析多相电子转移率(nahir,1994;weber,1994;tender,1994)。
具体实施方式
将理解尽管可以在本发明的方法中使用本发明的基因探针,但这不是必需的。因此,相对于基因探针所述的所有特征用作方法可选、但不必需的特征。
在这方面,将注意到本发明的方法需要寡核苷酸探针。可以通过使用如存在于本发明的基因探针中的寡核苷酸探针来提供该寡核苷酸探针,即寡核苷酸探针锚定至纳米颗粒并且纳米颗粒还具有锚定其上的参比探针。
基因探针
本发明提供了基因探针以及相关组合物。基因探针包括纳米颗粒,锚定至纳米颗粒表面的寡核苷酸探针,和锚定至纳米颗粒表面的参比探针。
纳米颗粒可以是金属或非金属的或者是两种或更多种材料的复合材料。
纳米颗粒可以是金属纳米颗粒,例如,钪、钛、钒、铬、锰、铁、钴、镍、铜、锌、钇、锆、铌、钼、钌、铑、钯、银、镉、铪、钽、钨、铼、锇、铱、铂、金、钆、铝、镓、铟、锡、铊、铅、铋、镁、钙、锶、钡、锂、钠、钾、硼、硅、磷、锗、砷、锑及其组合、合金或氧化物的纳米颗粒。
在一些实施方式中,纳米颗粒可以从聚合物材料制备。说明性的聚合物材料包括(但不限于)聚(氮丙啶)(pei)、聚(氰基丙烯酸烷基酯)、聚(酰胺胺)树枝状聚合物(pamam)、聚(ε-己内酯)(pcl)、聚(乳酸-共-乙醇酸)(plga)或者聚酯(聚(乳酸)(pla))。
在一些实施方式中,纳米颗粒还可以涂覆分子以用于连接功能性元素。在一些情况下,涂层包含硫酸软骨素、葡聚糖硫酸酯、羧甲基葡聚糖、海藻酸、果胶、角叉藻聚糖、岩藻依聚糖、琼脂胶、紫菜聚糖、卡拉亚胶、洁冷胶、黄原胶、透明质酸、氨基葡萄糖、半乳糖胺、几丁质(或者壳聚糖)、聚谷氨酸、聚天冬氨酸、溶菌酶、细胞色素c、核糖核酸酶、胰蛋白酶原、糜蛋白酶原、α-糜蛋白酶、聚赖氨酸、聚精氨酸、组蛋白、鱼精蛋白、石墨烯、卵清蛋白或者糊精或环糊精。
在一个实施方式中,纳米颗粒由选自以下各项的材料形成:金属、金属氧化物(例如,二氧化钛)、二氧化硅、石墨烯和量子点(例如,cdte、cdse、cds、inp、inas、cuins2、agins2或pbse/pbs)。
在一个实施方式中,在本发明中使用的纳米颗粒包含贵金属。
贵金属纳米颗粒可以由元素周期表10和11族中的任何一种或多种元素形成。贵金属可以选自钯、银、铂和/或金。
贵金属纳米颗粒可以可选地是复合纳米颗粒。据考虑复合纳米颗粒可以包含贵金属以及二氧化硅或二氧化钛或石墨烯中的一种或多种。例如,它可以是由贵金属(例如,金)和石墨烯形成的复合材料。
在其他实施方式中,纳米颗粒是基本完全或者仅由贵金属,例如,金形成的。
在一些实施方式中,贵金属纳米颗粒由金、银和/或铂组成。在一些实施方式中,贵金属纳米颗粒由铂和/或金组成。
在一个实施方式中,纳米颗粒是金纳米颗粒。金纳米颗粒在医学研究中的应用是良好确立的,例如,在体内检测中。金纳米颗粒在生物培养基中具有优良的化学稳定性和优良的生物相容性。金纳米颗粒的表面可以容易地衍生化以辅助官能结构与所述颗粒连接。
在一个实施方式中,纳米颗粒可以具有1至500纳米或者1至400nm或者1至300nm或者1至200nm的最大直径。例如,纳米颗粒可以具有3至500nm,或者3至400nm,或者3至300nm,或者3至100nm的最大直径;在实施方式中,可以是5至400nm,或者5至300nm,或者5至200nm,或者5至100nm。纳米颗粒可以具有3至250nm,或者5至250nm,或者10至250nm的最大直径;在实施方式中,可以是3至200nm,或者5至200nm,或者10至200nm。
在一个实施方式中,纳米颗粒可以具有1至150纳米的最大直径。例如,纳米颗粒可以具有3至150nm,或者5至150nm,或者10至150nm的最大直径;在实施方式中,可以是3至100nm,或者5至100nm,或者10至100nm。
在一些实施方式中,纳米颗粒可以具有3至50nm,或者5至50nm,或者10至50nm,例如,10至30nm的最大直径。
技术人员将理解可以通过透射电子显微镜术(tem)确定纳米颗粒的尺寸。例如,jeol1200ex透射电子显微镜可以用于对纳米颗粒成像和确定尺寸。
纳米颗粒具有锚定至其表面的寡核苷酸探针。在一个实施方式中,锚定可以是由于寡核苷酸探针键合至纳米颗粒的表面,例如,共价键键合。在一个实施方式中,键合是通过硫键,例如,硫-金键。
两种主要化学修饰途径是用可以共价结合至纳米颗粒的官能团修饰寡核苷酸或者修饰纳米颗粒,从而它可以静电结合至寡核苷酸。
一般地,任何适合的化学性质可以用于将寡核苷酸探针锚定至所述表面,例如,点击化学可以通过寡核苷酸探针上的化学基团与纳米颗粒上相对/互补的反应基团的反应用于将寡核苷酸探针锚定至纳米颗粒表面。纳米颗粒表面和/或寡核苷酸探针可以包含用于将寡核苷酸探针锚定至纳米颗粒表面上的反应性或带电基团。锚定可以通过使用硫醇锚点。在一个实施方式中,基于寡核苷酸探针,硫醇锚点可以连接至胸腺嘧啶。锚点可以包含氨基磷酸酯键。作为另外一种选择,锚点可以包含三唑。
可以通过使用碳二亚胺交联剂,如edc(也称为edac;1-乙基-3-(3-二甲基氨丙基)碳二亚胺盐酸盐)或者dcc(二环己基碳二亚胺)固定来锚定寡核苷酸探针。例如,可以在用硬脂酸或十八烷基胺修饰的表面上通过使用碳二亚胺接头固定来锚定寡核苷酸探针。在另一个实施方式中,可以通过使用碳二亚胺交联剂,如edc在用伯胺基或者氨基乙硫醇修饰的表面上固定来锚定寡核苷酸探针。在另一个实施方式中,可以通过核酸,如单股dna在磷酸封端的表面上的连接来锚定寡核苷酸探针。所述磷酸可以包含mbpa(巯基丁基磷酸)。在另一个实施方式中,可以通过核酸在基底表面上的链烯烃双磷酸铝膜上的连接来锚定寡核苷酸探针。在另一个实施方式中,可以通过核酸碱基的氨基将寡核苷酸探针锚定至所述表面上的巯基硅烷涂层。在另一个实施方式中,使用官能化的聚吡咯来锚定寡核苷酸探针。
可以使用pividori等人,biosensors&bioelectronics15;191-303页,2000中所讨论的任一种共价交联反应来锚定所述核酸。
寡核苷酸探针可以包含修饰的核苷酸,包括反应基团以形成锚点。用于连接至所述表面的反应基团可以称为锚定单元。寡核苷酸探针可以包含修饰的胸腺嘧啶以用作锚点。锚点可以包含修饰的胸腺嘧啶。所述修饰的胸腺嘧啶可以包含用锚定单元修饰的脱氧胸腺嘧啶核苷(dt)。锚定单元可以包含硫醇基团,如二巯基化物。锚定单元可以包含至少两个或三个二巯基化物作为表面锚点。锚定单元可以包含连接至胸腺嘧啶,如胸腺嘧啶的c5位的炔丙基氨基戊醇接头。在一个实施方式中,寡核苷酸探针可以包含修饰的胸腺嘧啶,其包括用包含三个二巯基化物作为表面锚点的锚定单元和连接至胸腺嘧啶的c5位的炔丙基氨基戊醇单元修饰的脱氧胸腺嘧啶核苷(dt)。形成锚点的反应基团可以包含用于与抗生蛋白链菌素连接的生物素,或者包含用于与生物素连接的抗生蛋白链菌素。
可以通过使用向所述表面引入用于连接至用适当反应基团修饰的核酸探针的官能团(如硫醇、胺或醛)(其将形成锚定结合)的硅烷偶联剂来将寡核苷酸探针锚定至修饰的表面。
本领域已知通过dna链上的硫醇修饰将寡核苷酸共价连接至纳米颗粒,从而形成共价键,例如,s-au。参见sandstrom,p.等人,langmuir19,7537–7543(2003)。
用于使用硫醇修饰的dna共价涂覆颗粒的最广泛使用的方法是mirkin研究组所开发的“盐老化”法。参见hurst,s.j.等人,anal.chem.78,8313–8(2006)。在盐浓度缓慢提高之前,一次性将硫醇化寡核苷酸加入至纳米颗粒。在数小时的一段时间内进行盐浓度的这种升高,因为一次加入过多的盐将导致柠檬酸盐稳定的纳米颗粒聚集。盐使得所述颗粒最大涂覆,因为它降低了带负电荷的寡核苷酸之间的斥力,从而使得在纳米颗粒表面上更紧密的排列。
在替代性涂覆方法中,zhang等人发现在dna连接步骤期间,将溶液ph降低至3.0使得能够快速覆盖纳米颗粒。参见zhang,x.等人,j.am.chem.soc.7266–7269(2012)。
可以在本发明中使用将硫醇结合基团添加至寡核苷酸以及通过硫醇基团的后续连接的技术以将寡核苷酸探针锚定至纳米颗粒,例如,金纳米颗粒的表面。
使用硫辛酸结合基团在本领域中也是已知的。已发现当使用金纳米颗粒时,相对于单一硫醇键,这是更稳定的。通过可以通过两个硫原子结合至金的二硫化物的还原形成了双-硫醇化加合物。参见dougan,j.等人,nucleicacidsres.35,3668–75(2007)。
因此,可以合成硫辛酸的活化酯的形式,例如,如stokes,r.j.等人,chem.commun.(camb).2811–2813(2007)中所描述。同时,可以将胺基加入至寡核苷酸主链(例如,5'端)以提供胺封端的寡核苷酸。然后,可以通过形成酰胺键将所述活化酯偶联至胺封端的寡核苷酸,从而提供硫辛酸修饰的寡核苷酸。
可以在本发明中使用这种将硫辛酸结合基团添加至寡核苷酸以及通过硫辛酸结合基团的后续连接的技术以将寡核苷酸探针锚定至纳米颗粒,例如,金纳米颗粒的表面。
这种技术是优选的,因为所述硫辛酸包含c5链,其在纳米颗粒的表面和引入寡核苷酸主链的标签之间产生距离。
然而,将理解本发明不局限于通过硫辛酸结合基团的连接。提供用于结合至所述金属纳米颗粒表面的一个或多个硫原子并且包括在纳米颗粒表面和引入寡核苷酸主链的标签之间产生距离的链(如c3-18链或者c5-14链或者c6-12链)的任何结合基团可以是有益的。
在其中修饰寡核苷酸以添加结合基团的技术中,通常将在所述结合基团和寡核苷酸之间存在间臂基团,其有时称为间臂区。已知改变该间臂基团及其尺寸。例如,已知使用聚乙二醇(peg)间臂基团,并且已发现当与仅由10个a碱基或10个t碱基所组成的间臂基团相比时,这提高了寡核苷酸在纳米颗粒表面上的载量。参见hurst,s.j.等人,anal.chem.78,8313–8(2006)。
在相同参考文献中,还已描述超声处理显著提高了dna在纳米颗粒表面上的涂覆水平。据提议超声处理可以降低非特异性结合的dna的量,从而暴露更多纳米颗粒表面以用于dna结合。
因此,在本发明中,有可能在所述结合基团和寡核苷酸之间包括间臂基团,例如,peg间臂基团,以帮助提高锚定至纳米颗粒表面的寡核苷酸探针的量。
作为另外一种选择或者另外,在本发明中,有可能使用超声处理来帮助提高锚定至纳米颗粒表面的寡核苷酸探针的量。例如,可以使用超声处理10秒或以上,或者15秒或以上,例如,20至60秒。
本领域中已知的用于将寡核苷酸结合至纳米颗粒的另一个方法是用高度阳离子的化合物,如季铵链修饰纳米颗粒的表面。然后,将带负电荷的寡核苷酸通过静电相互作用结合至阳离子纳米颗粒。sandhu等人已使用这种方法成功将dna链递送至细胞。参见sandhu,k.k.等人,bioconjug.chem.13,3–6(2002)。
可以在本发明中使用这种通过纳米颗粒的表面修饰来使其阳离子化,例如,通过季铵链官能化的技术以将寡核苷酸探针锚定至纳米颗粒,例如,金纳米颗粒的表面。
使寡核苷酸探针锚定至纳米颗粒的益处在于在生物培养基中并且一旦进入细胞,纳米颗粒-固定的dna链往往更耐受否则将快速降解dna的核酸酶。因此,本发明的基因探针对于探测生物环境中的靶标物质(例如,mrna)是有用的。
寡核苷酸探针包括寡核苷酸主链以及通过接头基团引入其中的标签。因此,在探针中,在连接至标签的所述接头基团的任一侧上存在核苷酸。
使用自动dna合成的标准亚磷酰胺化学法可以用于将接头基团(并因此将标签)引入寡核苷酸主链。因此,所述接头基团具有至少两个羟基,其中一个被dmt(4,4'-二甲氧三苯甲基)基团保护,而另一个具有反应性亚磷酰胺部分。然后,可以对核苷酸碱基加该接头基团进行所述自动dna合成。
寡核苷酸主链可以包含5个或更多个核苷酸,如8个或更多个核苷酸,例如,8至60个核苷酸,或者9至50,或者10至40,或者12至30,或者15至25个核苷酸。
在一个实施方式中,寡核苷酸主链的长度可以为至少约8个核苷酸。在另一个实施方式中,寡核苷酸主链的长度可以为至少约10个核苷酸。在另一个实施方式中,寡核苷酸主链的长度可以为至少约12个核苷酸。在另一个实施方式中,寡核苷酸主链的长度可以为至少约15个核苷酸。在另一个实施方式中,寡核苷酸主链的长度可以为不超过约15个核苷酸。
在一个实施方式中,寡核苷酸主链的长度可以为不超过约40个核苷酸。在另一个实施方式中,寡核苷酸主链的长度可以为不超过约30个核苷酸。在另一个实施方式中,寡核苷酸主链的长度可以为不超过约20个核苷酸。在一个实施方式中,寡核苷酸主链的长度可以在约8至约50个核苷酸之间。在另一个实施方式中,寡核苷酸主链的长度可以在约8至约35个核苷酸之间。在另一个实施方式中,寡核苷酸主链的长度可以在约8至约30个核苷酸之间。在另一个实施方式中,寡核苷酸主链的长度可以在约10至约20个核苷酸之间。在另一个实施方式中,寡核苷酸主链的长度可以为约15个核苷酸。
寡核苷酸主链可以包含dna或由dna组成。寡核苷酸主链可以包含rna或由其组成。在一个实施方式中,寡核苷酸主链是寡核糖核苷酸。在另一个实施方式中,寡核苷酸主链可以包含核苷酸类似物或衍生物,如具有与dna或rna等价互补的功能性核苷酸类似物或衍生物或由其组成。寡核苷酸主链可以包含dna、rna和/或核苷酸类似物的组合。核苷酸类似物可以包含pna或lna。在另一个实施方式中,寡核苷酸主链可以包含pmo或由其组成。
接头基团、并因此标签可以位于寡核苷酸主链内的任何适合的位置。
在一个实施方式中,接头基团位于距锚定至纳米颗粒表面的寡核苷酸末端5个或更多个核苷酸,如7个或更多个,或者9个或更多个,或者11个或更多个,或者13个或更多个,或者15个或更多个。例如,可以位于距锚定至纳米颗粒表面的寡核苷酸末端7至20个核苷酸。
优选距锚定末端5个或更多个核苷酸的这种位置,因为这在纳米颗粒表面和连接至接头基团的标签之间产生距离。
在一个实施方式中,寡核苷酸探针包括p21寡核苷酸探针或由p21寡核苷酸探针组成:5'-agtcgcgxctcagct-3',其中x是标签的位点。在另一个实施方式中,寡核苷酸探针包括brafsnp寡核苷酸探针或由brafsnp寡核苷酸探针组成:5'-agatttcxctgtagc-3',其中x是标签的位点。
标签是荧光标签或氧化还原活性标签。适合地,标签能够在双链寡核苷酸的相邻碱基对之间部分插入和堆叠。
因此,标签适合地是平面芳烃或杂芳烃部分或者平面大环过渡金属络合物。
荧光标签可以是来自任何已知的有机非蛋白荧光团的荧光团分子。适合地,它包括具有3或4个环的芳烃或杂芳烃结构。在一个实施方式中,存在稠环结构;例如,可能存在稠合在一起的两个环或者稠合在一起的三个环或者稠合在一起的四个环。可能存在连接的稠环对,其中每个对具有稠合在一起的两个环。
荧光标签可以基于以下化学品家族中的任一种:噻嗪(例如,亚甲基蓝)或噻唑(例如,噻唑橙),cyclidene或菁(例如,yoyo-1),或者芘或占吨(例如,荧光素),或者吖啶(例如,吖啶橙),或者蒽或蒽醌。
在一个实施方式中,荧光标签包括芳烃或杂芳烃三环结构。可能存在稠合在一起的三个环。例如,其可以选自:占吨、蒽、蒽醌和吖啶;和其衍生物。
在一个实施方式中,荧光标签包括芳烃或杂芳烃四环结构。在一个实施方式中,四个环融合,例如,它可以是芘或其衍生物。在一个实施方式中,存在通过桥连非芳香部分(例如,c1-4亚烷基或亚烯基基团)连接在一起的两对稠环。例如,它可以是噻唑橙或噁唑黄或其衍生物。
在一个实施方式中,衍生物可以是芳烃或杂芳烃环结构的取代形式,其中一个或多个(例如,一个、二个、三个或四个)氢原子可以可选地被以下基团取代,所述基团独立地选自羟基、羧基、c1-4烷基、氨基(nr'2、其中每个r'独立地选自h和c1-4烷基)、c1-c4醚、硫酸盐、硫醇、c1-c4硫醚、硝基、腈、c1-c4酯、苯基、吡啶基、嘧啶基、呋喃基、吡咯基、苯硫基、咪唑基和噻唑基。衍生物可以是稠合三环结构的取代形式,其中一个或多个(例如,一个、二个、三个或四个)氢原子可选地被下列基团取代,所述基团独立地选自羟基、羧基、c1-4烷基、氨基(nr'2,其中每个r'独立地选自h和c1-4烷基)和c1-c4醚。
例如,吖啶衍生物包括原黄素、吖啶橙、吖啶红和吖啶黄。
在一个实施方式中,荧光标签是噻唑橙、芘、占吨、蒽、蒽醌或吖啶或其衍生物。
在一个实施方式中,荧光标签是噻唑橙、芘、蒽、蒽醌或吖啶或其衍生物。
在一个实施方式中,荧光标签是噻唑橙、芘或蒽或其衍生物。在一个实施方式中,荧光标签是噻唑橙、芘或蒽。
在一个实施方式中,荧光标签是蒽或其衍生物。在一个这种实施方式中,荧光标签是蒽。
“氧化还原活性”标签是指可以被氧化和还原的化合物,即,其含有接受和传递电子的一种或多种化学功能。
氧化还原活性标签可以是来自任何已知的非蛋白氧化还原活性分子的氧化还原活性分子。它可以适合地包括一个或多个有机基团。
在一个实施方式中,氧化还原活性标签包括具有3或4个环的芳烃或杂芳烃结构。在一个实施方式中,存在稠环结构;例如,可能存在稠合在一起的两个环或者稠合在一起的三个环或者稠合在一起的四个环。可能存在连接的稠环对,其中每个对具有稠合在一起的两个环。
氧化还原活性标签可以基于以下化学品家族中的任一种:菲啶(例如,乙锭)、酚噻嗪(例如,亚甲基蓝)、吩嗪(例如,吩嗪硫酸甲酯)、吖啶(例如,米帕林)、蒽醌(例如,道诺霉素)。氧化还原活性标签可以基于含有插入配体(例如,
在一个实施方式中,氧化还原活性标签包括大环过渡金属络合物。技术人员将理解大环过渡金属络合物包括环尺寸为至少9且具有3个或更多个供体位点,其中过渡金属键合在其中心的环配体化合物。4-配位大环过渡金属络合物具有4个供体位点。
在一个实施方式中,氧化还原活性标签选自4-配位大环过渡金属络合物,其中所述环配体化合物是平面的并且环尺寸为10或以上。
在一个实施方式中,大环过渡金属络合物的金属是钴co(ii)、镍ni(ii)、铜cu(ii)或铁fe(ii),例如,ni(ii)或cu(ii)。
在一个实施方式中,环配体化合物是平面的并且环尺寸为12或以上,例如,12至16。在一个实施方式中,环配体化合物是平面的并且环尺寸为14。
环可以适合地包括一个或多个双键,例如,两个或更多个双键,或者三个或更多个双键,或者4个或更多个双键。所述双键可以是c=c或c=n。
环可以适合地包括n和/或o供体原子。在一个实施方式中,所述供体位点的一个或多个是n,如两个或多个或三个或多个。优选地,所有4个供体位点是n。
环连接至接头基团,其可以如以下式(i)所示。
环还可以可选地具有一个或多个侧基。侧基可以取代环中任何一个或多个碳上的一个或多个氢。侧基可以(例如)选自羟基、羧基、c1-4烷基、氨基(nr'2、其中每个r'独立地选自h和c1-4烷基)、c1-c4醚、硫酸盐、硫醇、c1-c4硫醚、硝基、腈、c1-c4酯、苯基、吡啶基、嘧啶基、呋喃基、吡咯基、苯硫基、咪唑基和噻唑基。
在一个实施方式中,所述一个或多个侧基选自羟基、羧基、c1-4烷基、氨基(nr'2,其中每个r'独立地选自h和c1-4烷基)和c1-c4醚和c1-c4酯。
氧化还原活性标签可以是具有如下所示的cyclidene[14]配体的过渡金属络合物:
m可以是(例如)ni(ii)或cu(ii)或fe(ii)或co(ii)。在一个实施方式中,它是ni(ii)或cu(ii)。
可以可选地存在从该cyclidene[14]配体的环延伸出的一个或多个侧基。这些可以如上定义。
将理解4-配位大环过渡金属络合物可以提供插入所需的平面构型。此外,cyclidene可以理解为大小和形状与芳烃稠环结构,如芘类似。因此,它可以以类似的方式插入。
在一个实施方式中,氧化还原活性标签是具有如下所示的cyclidene[14]配体的过渡金属络合物:
m可以是(例如)ni(ii)或cu(ii)或fe(ii)或co(ii)。在一个实施方式中,它是ni(ii)或cu(ii)。
接头基团适合地在寡核苷酸主链的核苷酸之间提供了三个碳键。然后,这模拟了将通过糖基所提供的空间。
在一个实施方式中,接头基团可以基于氨基醇,如d-或l-苏氨醇或丝氨醇。
在一个实施方式中,接头基团基于d-或l-苏氨醇。苏氨醇中立体中心的存在使得能够选择两种立体异构体之一以“调节”探针的性质,因为这种立体化学的改变影响标签,如荧光团分子(例如,蒽)如何对不同snp靶标进行反应。
接头基团可以如式(i)所示:
其中
l连接至标签并且选自c3-16烷基(例如,c3-14或c3-12或c3-10烷基)、c3-16烯基(例如,c3-14或c3-12或c3-10烯基)和c3-16炔基(例如,c3-14或c3-12或c3-10炔基),
其中一个、二个或三个碳原子可以可选地被杂原子取代,杂原子独立地选自o、s和n,
并且其中一个、二个、三个或四个氢原子可以可选地被独立地选自以下各项的基团取代:羟基、羧基、氨基(nr'2、其中每个r'独立地选自h和c1-4烷基)、c1-c4烷氧基、c1-c4醚、c1-c4硫醚、硝基、腈、c1-c4酯、苯基、吡啶基、嘧啶基、呋喃基、吡咯基、苯硫基、咪唑基和噻唑基;
a、b和z分别独立地选自氢、c1-4烷基、氨基(nr'2,其中每个r'独立地为选自h和c1-4烷基)和c1-4烷氧基。
具有技术的读者将理解当一个、二个或三个碳原子被独立地选自o、s和n的杂原子取代时,烷基、环烷基、烯基或炔基基团中的碳的数目因此降低。因此,在包括杂原子取代的r基团中,参考杂原子取代前的烃基提供碳原子的数目;例如,甲硫乙烷和甲氧基乙烷分别是经历杂原子取代的c4烷基。
因此,接头基团在3'和5'羟基之间提供了3-碳间距,由于提供了对天然糖间距的模拟,因此其是有利的。此外,接头基团在寡核苷酸和标签之间提供了5-至18-碳的间距,从而确保所述金属纳米颗粒表面和标签,例如,有机荧光团标签之间存在足够的距离。
在一个实施方式中,l直接连接至标签。l可以直接连接至标签,例如,荧光团标签中的芳香环。
l可以选自c3-16烷基(例如,c3-14或c3-12或c3-10烷基),其中一个、二个或三个碳原子可以可选地被独立地选自o、s和n的杂原子取代,并且其中一个、二个、三个或四个氢原子可以可选地被以下基团取代,所述基团独立地选自羟基、羧基、氨基(nr'2,其中每个r'独立地选自h和c1-4烷基)、c1-c4烷氧基、c1-c4醚和c1-c4硫醚。
l可以选自c3-16烷基(例如,c3-14或c3-12或c3-10烷基或者c3-6烷基),其中1至3个碳原子被独立地选自o、s和n的杂原子取代,并且其中1至4个氢原子被以下基团取代,所述基团独立地选自羟基、羧基、氨基(nr'2,其中每个r'独立地选自h和c1-4烷基)、c1-c4烷氧基、c1-c4醚和c1-c4硫醚。
在一个实施方式中,烷基是直链。然而,当烷基具有三个或更多个碳原子时,它可以可选地是支链的。如果烷基是支链的,则优选地所述支链是c1或c2并且其余的碳原子形成烷基的主链。具体地,设想了其中存在从c2-10(例如,c3-10或者c4-10)主链延伸出的c1或c2大小的支链的实施方式。
在一个实施方式中,l基团含有酯部分。因此,用o原子取代碳原子,用羧基(=o)基团取代氢原子。在一个这种实施方式中,酯部分的碳直接连接至标签。
在一个实施方式中,l基团含有酰胺部分。因此,用n原子取代碳原子,用羧基取代氢原子。在一个这种实施方式中,酰胺部分的氮直接连接至3'和5'羟基之间的3-碳键。
在一个实施方式中,a、b和z分别独立地选自氢和c1-4烷基和nh2。在一个实施方式中,a、b和z中的一个或多个是氢。在一个实施方式中,a、b和z中的两个或更多个分别是氢。
在一个实施方式中,a、b和z中的一个或两个分别是氢,并且a、b和z中的一个或两个分别是c1-3烷基,例如,c1-2烷基。
在一个实施方式中,z是c1-3烷基,例如,c1-2烷基。
在一个实施方式中,l基团是c3-10(例如,c3-6)烷基,其中1个碳原子被o取代,1个氢原子被羧基取代,从而提供了酯部分,其中可选地所述酯部分的碳直接连接至标签,并且其中z是c1-3烷基,例如,c1-2烷基,并且其中可选地a和b均为氢。
在一个实施方式中,z是氢。在该实施方式中,接头基团因此如化学式(ia)所示:
在一个实施方式中:
l连接至荧光团标签并且选自c4-16烷基(例如,c4-14或c4-12或c4-10烷基)、c4-16烯基(例如,c4-14或c4-12或c4-10烯基)和c4-16炔基(例如,c4-14或c4-12或c4-10炔基),
其中一个、二个或三个碳原子可以可选地被杂原子取代,杂原子独立地选自o、s和n,
并且其中一个、二个、三个或四个氢原子可以可选地被独立地选自以下各项的基团取代:羟基、羧基、氨基(nr'2、其中每个r'独立地选自h和c1-4烷基)、c1-c4烷氧基、c1-c4醚、c1-c4硫醚、硝基、腈、c1-c4酯、苯基、吡啶基、嘧啶基、呋喃基、吡咯基、苯硫基、咪唑基和噻唑基;和
a和b分别独立地选自氢、c1-4烷基、氨基(nr'2,其中每个r'独立地为选自h和c1-4烷基)、c1-4烷氧基。
该接头基团是有益的,其中它在寡核苷酸和标签之间提供了6-至18-碳的间距,从而确保所述金属纳米颗粒表面和标签,例如,有机荧光团标签之间存在足够的距离。
l可以选自c4-16烷基(例如,c4-14或c4-12或c4-10烷基),其中一个、二个或三个碳原子可以可选地被独立地选自o、s和n的杂原子取代,并且其中一个、二个、三个或四个氢原子可以可选地被以下基团取代,所述基团独立地选自羟基、羧基、氨基(nr'2,其中每个r'独立地选自h和c1-4烷基)、c1-c4烷氧基、c1-c4醚和c1-c4硫醚。
l可以选自c4-12烷基(例如,c4-10烷基),其中1至3个碳原子被独立地选自o、s和n的杂原子取代,并且其中1至4个氢原子被以下基团取代,所述基团独立地选自羟基、羧基、氨基(nr'2,其中每个r'独立地选自h和c1-4烷基)、c1-c4烷氧基、c1-c4醚和c1-c4硫醚。
在一个实施方式中,l基团含有醚部分。因此,用o原子取代碳原子。在一个这种实施方式中,醚部分的氧直接连接至标签,例如,荧光团标签。所述氧可以直接连接至标签,例如,荧光团标签中的芳香环。
在一个实施方式中,l基团含有酰胺部分。因此,用n原子取代碳原子,用羧基取代氢原子。在一个这种实施方式中,酰胺部分的氮直接连接至3'和5'羟基之间的3-碳键。
在一个实施方式中,l基团是c4-12(例如,c4-10)烷基,其中用n原子取代碳原子,用羧基取代氢原子,从而提供酰胺部分,并且用o原子取代碳原子,从而提供醚部分。在一个这种实施方式中,醚部分的氧直接连接荧光团标签,例如,连接至荧光团标签中的芳香环。在一个这种实施方式中,酰胺部分的氮直接连接至3'和5'羟基之间的3-碳键。
允许根据以上定义的碳和/或氢原子的其他取代。
在一个实施方式中,l是键合至荧光标签的接头链并且选自c4-12烷基,例如,c4-10烷基,并且含有(i)酰胺部分和(ii)醚部分。酰胺部分的氮适合地直接连接至3'和5'羟基之间的3-碳键。醚部分的氧适合地直接连接至荧光标签的芳香环。在一个实施方式中,在醚部分和酰胺部分之间延伸c1-8,例如,c1-7烷基链。在一个实施方式中,烷基是直链。一个、二个或三个氢原子可以可选地被独立地选自以下各项的基团取代:羟基、羧基、硫醇和氨基(nr'2,其中每个r'独立地选自h和c1-4烷基);然而,在一个实施方式中,链上不存在取代基。
在一个实施方式中,l基团是-o-(c1-c9烷基)-conh-,如o-(c1-c8烷基)-conh-或者-o-(c1-c7烷基)-conh-。在每种情况下,链上的1至3个氢原子可以可选地被独立地选自以下各项的基团取代:羟基、羧基、氨基(nr'2,其中每个r'独立地选自h和c1-4烷基)、c1-c4烷氧基、c1-c4醚和c1-c4硫醚。
在一个实施方式中,烷基是直链。然而,当烷基具有三个或更多个碳原子时,它可以可选地是支链的。如果烷基是支链的,则优选地所述支链是c1或c2并且其余的碳原子形成烷基的主链。具体地,设想了其中存在从c2-10(例如,c3-10或者c4-10)主链延伸出的c1或c2大小的支链的实施方式。
在一个实施方式中,a和b分别独立地选自氢、c1-4烷基和nh2。在一个实施方式中,a和b分别独立地选自氢、c1-3烷基和nh2。在一个实施方式中,a和b分别独立地选自氢、c1-2烷基和nh2。
在一个实施方式中,a选自氢、c1-3烷基和nh2,并且b是氢。
在一个实施方式中,a和b均为氢,并因此接头基团基于丝氨醇。
在一个实施方式中,a是甲基并且b是氢,并因此接头基团基于苏氨醇。
一般地,其中a和b不同的实施方式可以是有利的,因为那么将存在立体中心,并且立体异构体之间的变化可以影响标签,例如,荧光标签如何对不同snp靶标进行反应。因此,这使得能够调节探针。
在一个实施方式中,接头基团如化学式(ib)所示
其中n是1至7的整数,例如,1、2、3、4、5、6或7。
可以通过在已知量的靶标中滴定直至所观察的荧光团标签发光不再变化来建立涂覆纳米颗粒表面的寡核苷酸探针的量。
在一个实施方式中,每个纳米颗粒存在3条或更多条寡核苷酸探针链,如4条或更多条或者5条或更多条。每个纳米颗粒可以存在3至5000条寡核苷酸探针链或更多条链,如4至4000或者5至3000或者10至1000,例如,10至500或者50到500条。
在一个实施方式中,每个纳米颗粒存在3条或更多条参比探针链,如4条或更多条或者5条或更多条。每个纳米颗粒可以存在3至5000条参比探针链或更多条链,如4至4000或者5至3000或者10至1000,例如,10至500或者50到500条。
在一些实施方式中,“载量”可以更高。当然,这在一定程度上将依赖于颗粒的尺寸。对于小于30nm的颗粒,在一些实施方式中,载量可以是每个纳米颗粒50或更多,或者100或更多,或者500或更多,或者1000或更多。对于大于30nm的颗粒,在一些实施方式中,载量可以是每个纳米颗粒2000或更多,或者4000或更多,或者6000或更多,或者8000或更多。
在一个实施方式中,寡核苷酸探针与参比探针载量的比值为约10:1至1:10,例如,5:1至1:5或者3:1至1:3,或者2:1至1:2。载量比可以为约1:1。每个纳米颗粒可以存在比寡核苷酸探针多至10倍更多的参比探针,例如,比寡核苷酸探针多至5倍或多至4倍或多至2倍更多。每个纳米颗粒可以存在比参比探针多至10倍更多的寡核苷酸探针,例如,比参比探针多至5倍或多至4倍或多至2倍更多。
所述金属纳米颗粒上寡核苷酸探针的表面密度可以为1×1010/cm2或更多,或者1×1011/cm2或更多,或者1×1012/cm2或更多,如1至5×1013/cm2。
所述金属纳米颗粒上参比探针的表面密度可以为1×1010/cm2或更多,或者1×1011/cm2或更多,或者1×1012/cm2或更多,如1至5×1013/cm2。
本发明的基因探针包括锚定至纳米颗粒表面的参比探针,其中参比探针包括标志物,标志物是基于过渡金属的荧光标志物或者基于过渡金属的氧化还原活性标志物。
本发明的主要益处在于使用稳定探针提供成功且准确的比率检测的能力。
比率检测包括分析来自两种不同试剂的检测信号,例如,两种不同波长下的两种不同的荧光团或者两种不同的氧化还原活性材料。将一个信号强度除以另一个避免了确定初始探针浓度的需要;这简化且有利于检测方法,具体地其中探针浓度将难于确定的细胞环境中的分析。尽管比率检测本身并不是新的,但是由于探针产物不稳定或者两种不同的荧光团彼此干扰,因此先前努力的成功是有限的。
在本发明中,纳米颗粒,例如,贵金属纳米颗粒的应用提供了成功的支架,在所述支架上可以稳定固定两个不同的荧光团或氧化还原活性材料并且其中这些不同的荧光团或氧化还原活性材料不会彼此不利地干扰,所述支架也不会不利地干扰荧光团/氧化还原活性材料。
参比探针的锚定可以是由于参比探针键合至纳米颗粒的表面,例如,共价键键合。在一个实施方式中,键合是通过硫键,例如,硫-金键。
这可以通过连接至标志物的连接基团进行。换言之,为了使参比探针锚定至纳米颗粒,例如,贵金属纳米颗粒表面,可以提供可以将标志物结合至纳米颗粒表面的连接基团。所述连接基团可以具体地包括一个或多个末端硫原子。
在一个实施方式中,标志物是基于过渡金属的荧光标志物并且在这种情况下,它可以是过渡金属与芳烃配体或基于螯合羧酸酯的配体的络合物。
所述过渡金属可以(例如)选自d-区过渡金属,如钌、铑、钨、铼、锇、铱、铂、铜和锌,或者选自f-区镧系金属,如铕。在一个实施方式中,它选自钌、铑、铱、锇和锌。它可以(例如)是钌、铱或锇。在一个实施方式中,它是钌。
将理解在具有低能量it*轨道(lowlyingit*orbitals)的配体,如芳烃配体的过渡金属络合物中通常会遇到光致发光。在本发明中,配体适合地是芳烃,并且优选地是杂芳烃。在一些实施方式中,金属络合物包括一种或多种配体,配体包括两个或更多个胺基。它可以是二胺配体,如二吡啶或菲咯啉,或者它可以是三胺配体,如三联吡啶。金属络合物可以包括一个、二个或三个配体,其独立地选自二吡啶和菲咯啉和三联吡啶。在一些实施方式中,金属络合物包括3个配体,其独立地选自二吡啶和菲咯啉和三联吡啶。当金属是d-区过渡金属,如钌、铑、铱或锇时,二胺配体,如二吡啶或菲咯啉,和三胺配体,如三联吡啶的应用是特别适合的。
然而,配体可以替代地是基于螯合羧酸酯的配体,如氨基聚羧酸,例如,edta或nta或dtpa。当金属是镧系金属,如铕时,这是特别适合的。
金属络合物中的配体可以分别独立地官能化或非官能化。
在一个实施方式中,标志物,例如,金属络合物中的至少一个配体被连接基团官能化。在一个实施方式中,所述连接基团包括提供末端硫原子的一个或多个基团,如硫醇基团、硫烷基团或二硫烷基团。这种含硫基团允许络合物结合至金属纳米颗粒的表面。
因此,在一个实施方式中,金属络合物包含一个或多个配体,例如,三个配体,其独立地选自二吡啶和菲咯啉和三联吡啶,并且这些二吡啶和/或菲咯啉和/或三联吡啶中的一个或多个被包含一个或多个含硫基团的连接基团官能化,含硫基团如硫醇基团、硫烷基团或二硫烷基团。
可以可选地将一个或多个其他官能团添加至二吡啶和/或菲咯啉和/或三联吡啶配体的芳香环。这些可以根据以下对r所提供的定义。
在一个实施方式中,金属络合物包含一个、二个或三个配体(例如,三个配体),其独立地选自式(ii)和式(iii)所示的配体:
其中:
每个n独立地选自0、1、2、3或4;
每个p独立地选自0、1、2或3;
或者每个q独立地选自0、1或2;和
每个r独立地选自c1-18烷基(例如,c2-16或c3-14或c4-12烷基)、c6-18环烷基(例如,c6-16或c6-14或c6-12环烷基)、c2-c18烯基(例如,c2-16或c3-14或c4-12烯基)和c2-c18炔基(例如,c2-16或c3-14或c4-12炔基),
其中一个、二个或三个碳原子可以可选地被杂原子取代,杂原子独立地选自o、s和n,
并且其中一个、二个或三个氢原子可以可选地被独立地选自以下各项的基团取代:羟基、羧基、硫醇、硫烷、二硫烷、氨基(nr'2、其中每个r'独立地选自h和c1-4烷基)、c1-c4烷氧基、c1-c4醚、c1-c4硫醚、硝基、腈、c1-c4酯、苯基、吡啶基、嘧啶基、呋喃基、吡咯基、苯硫基、咪唑基和噻唑基;
条件是络合物包含具有末端硫基的一个或多个配体。
具有技术的读者将理解当一个、二个或三个碳原子被独立地选自o、s和n的杂原子取代时,烷基、环烷基、烯基或炔基基团中的碳的数目因此降低。因此,在包括杂原子取代的r基团中,参考杂原子取代前的烃基提供碳原子的数目;例如,吡啶是经历杂原子取代的c6环烷基。
在一个实施方式中,每个r独立地选自c1-18烷基(例如,c2-16或c3-14或c4-12烷基)、c6-18环烷基(例如,c6-16或c6-14或c6-12环烷基)、c2-c18烯基(例如,c2-16或c3-14或c4-12烯基)和c2-c18炔基(例如,c2-16或c3-14或c4-12炔基),
其中一个、二个或三个碳原子可以可选地被杂原子取代,杂原子独立地选自o、s和n,
并且其中一个、二个或三个氢原子可以可选地被独立地选自以下各项的基团取代:羟基、羧基、硫醇、硫烷、二硫烷、氨基(nr'2、其中每个r'独立地选自h和c1-4烷基)、c1-c4烷氧基、c1-c4醚、c1-c4硫醚、硝基、腈、c1-c4酯。
在一个实施方式中,每个r独立地选自c1-18烷基(例如,c2-16或c3-14或c4-12烷基)、c6-18环烷基(例如,c6-16或c6-14或c6-12环烷基)、c2-c18烯基(例如,c2-16或c3-14或c4-12烯基)和c2-c18炔基(例如,c2-16或c3-14或c4-12炔基),
其中一个、二个或三个碳原子可以可选地被杂原子取代,杂原子独立地选自o、s和n,
并且其中一个、二个或三个氢原子可以可选地被独立地选自以下各项的基团取代:羟基、羧基、硫醇、硫烷、二硫烷和氨基(nr'2,其中每个r'独立地选自h和c1-4烷基)。
在一个实施方式中,一个或多个r基团含有酰胺部分。因此,用n原子取代碳原子,用羧基取代氢原子。
在一个实施方式中,一个或多个r基团含有醚部分。因此,用o原子取代碳原子。在一个这种实施方式中,醚部分的氧直接连接至配体的芳香环。
在一个实施方式中,存在一个或多个r基团,r基团是其中碳原子被o原子取代从而提供了醚部分的c4-16烷基。在一个这种实施方式中,醚部分的氧直接连接至配体的芳香环。
在一个实施方式中,存在一个或多个r基团,r基团是其中碳原子被n原子取代并且氢原子被羧基取代从而提供酰胺部分,并且碳原子被o原子取代从而提供醚部分的c4-16烷基。在一个这种实施方式中,醚部分的氧直接连接至配体的芳香环。
在一个实施方式中,烷基是直链。然而,烷基可以可选地是支链的。如果烷基是支链的,则优选地所述支链是c1或c2并且其余的碳原子(和取代碳原子的任何杂原子)形成烷基的主链。
在一些实施方式中,络合物包含具有至少两个末端硫基的一个或多个配体。络合物可以包含具有一个或多个末端二硫烷基团,例如,一个或多个末端1,2二硫烷基团的一个或多个配体。
在一些实施方式中,络合物仅包含一个具有一个或多个末端硫基的配体。配体可以具有一个或多个末端硫醇基团。在一个实施方式中,配体具有两个或更多个末端硫基。配体可以具有一个或多个末端二硫烷基团,例如,一个或多个末端1,2二硫烷基团。
在一个实施方式中,络合物包括式(ii)所示的配体,其中两个芳香环具有r基团,r基团具有一个或多个末端硫基,例如,两个或更多个末端硫基,如一个或多个末端1,2二硫烷基,或者一个或多个硫醇基团。
在一个实施方式中,络合物包括式(iii)所示的配体,其中两个或更多个芳香环分别具有r基团,r基团具有一个或多个末端硫基,例如,两个或更多个末端硫基,如一个或多个末端1,2二硫烷基,或者一个或多个硫醇基团。
在一个实施方式中,络合物包括式(iii)所示的配体,其中两个外芳香环具有r基团,r基团具有一个或多个末端硫基,例如,两个或更多个末端硫基,例如,一个或多个末端1,2二硫烷基。可选地,中央芳香环也具有r基团,r基团具有一个或多个末端硫基,例如,两个或更多个末端硫基,如一个或多个末端1,2二硫烷基,或者一个或多个硫醇基团。
在一个实施方式中,金属络合物包含独立地选自式(ii)和式(iii)所示的配体的三个配体,并且配体之一是取代的,而另外两个是未取代的。取代的配体具有一个或多个末端硫基,例如,两个或更多个末端硫基,例如,一个或多个末端1,2二硫烷基,或者一个或多个硫醇基团。取代的配体可以是式(ii)所示的配体,其中两个芳香环具有r基团,r基团具有一个或多个末端硫醇基团。取代的配体可以是式(ii)所示的配体,其中两个芳香环具有r基团,r基团具有两个或更多个末端硫基,如一个或多个末端1,2二硫烷基团。
在一个实施方式中,金属络合物是
钌吡啶ss(rubpyss)
由于其光稳定性,可见区内的激发和发射谱(与常规成象技术更相容)和大斯托克斯位移,这种钌吡啶ss探针对于使用是有利的。
钌吡啶ss探针的激发带(465nm,mlct带)和发射带(550-800nm)不同于蒽的那些(λex=350nm,λem=370-570nm)。因此,它对于与作为蒽或其衍生物的荧光标签的组合使用是有利的。
钌探针上两个二硫化物封端的分支的存在使得它能够结合至金属纳米颗粒,例如,金纳米颗粒的表面。
还可以考虑这种络合物的铱或锇的形式。
在一个实施方式中,金属络合物是:
一般地,在本发明的基因探针中,期望荧光标志物的激发带不同于荧光标签的激发带。同样地,期望荧光标志物的发射带不同于荧光标签的发射带。
在一个实施方式中,荧光标签基于蒽并且荧光标志物基于钌二吡啶络合物,如钌吡啶ss。
在一个实施方式中,标志物是基于过渡金属的氧化还原活性标志物并且在这种情况下,它可以是过渡金属与芳烃配体的络合物。
这可以是以上对于基于过渡金属的荧光标志物所述的类型的络合物。例如,基于过渡金属的氧化还原活性标志物可以是包含一个或多个配体,例如,三个配体的金属络合物,配体独立地选自二吡啶和菲咯啉和三联吡啶,其中这些二吡啶和/或菲咯啉和/或三联吡啶中的一个或多个被包含一个或多个含硫基团的连接基团官能化,含硫基团如硫醇基团、硫烷基团或二硫烷基团,并且其中金属是d-区过渡金属,如钌、铑、铱或锇。配体可以如以上所定义的式(ii)或(iii)所示。
具体地,基于过渡金属的氧化还原活性标志物可以是钌吡啶ss。
然而,还可以考虑其他基于过渡金属的氧化还原活性标志物。实例包括(但不限于)任何中性或带负电荷的探针,例如,铁氰化物/亚铁氰化物、二茂铁和其衍生物(例如,二茂铁的二甲基氨基甲基-、单羧酸-或者二羧酸-衍生物)、六氰基钌酸盐和六氰基锇酸盐。
在一个实施方式中,基于过渡金属的氧化还原活性标志物被连接基团官能化。在一个实施方式中,所述连接基团包括提供末端硫原子的一个或多个基团,如硫醇基团、硫烷基团或二硫烷基团。这种含硫基团允许络合物结合至金属纳米颗粒的表面。
将理解选择基于过渡金属的氧化还原活性标志物,从而它具有与氧化还原活性标签不同的氧化还原电势。
在一个实施方式中,氧化还原活性标签是基于cyclidene[14]配体的过渡金属络合物,并且氧化还原活性标志物基于钌二吡啶络合物,如钌吡啶ss,或者二茂铁。
可以通过组合本领域中已知的技术和方法来制备基因探针。获得或制备贵金属纳米颗粒是已知的并且在实施例中进行了说明。获得或制备寡核苷酸是已知的并且在实施例中进行了说明。获得或制备有机荧光标签(例如,蒽)是已知的并且可以通过已知合成化学路线实现接头基团的连接,并且这在实施例中进行了说明。可以用通过接头基团引入其中的有机荧光标签制备寡核苷酸。可以修饰寡核苷酸以帮助连接至纳米颗粒,例如,通过硫辛酸修饰,如实施例中所述的。获得或制备基于过渡金属的荧光标志物是已知的,如通过连接基团,例如,二硫烷基团提供标志物(例如,钌吡啶ss)一样。
然后,可以将寡核苷酸探针和参比探针连接至纳米颗粒的表面。当制备本发明的基因探针时,可以首先将寡核苷酸探针加入至金属纳米颗粒,然后添加参比探针。已发现这是基因探针合成的有效路线。
确定snp或单核苷酸修饰的方法
本发明还提供了确定靶标核酸混合池(群体)中靶标核酸的单核苷酸多态性(snp)或单核苷酸修饰的百分比的方法。
在一个实施方式中,这种方法利用了处于上述形式的基因探针,但这不是必需的。
靶标核酸混合池可以在样品中。样品可以包括细胞裂解液、体液样品或核酸样品,如纯化或部分纯化的核酸样品。靶标核酸可以是真核生物、原核生物或病毒核酸。真核生物核酸可以是哺乳动物或真菌的核酸。在一个实施方式中,靶标核酸是人的。靶标核酸可以与疾病或病况或者已知的snp相关。靶标核酸序列可以包括dna或rna或由其组成。靶标核酸序列可以包括dna和rna的混合物。靶标核酸序列可以包括基因组核酸。靶标核酸序列可以包括病毒rna;mrna;ncrna;小rna;和sirna;或其组合。靶标核酸序列可以包括线粒体核酸。靶标核酸序列可以包括染色体和/或非染色体dna或由其组成。在一个实施方式中,靶标核酸包括循环dna,如循环肿瘤dna(ctdna)。
在一个实施方式中,靶标核酸序列包括mrna转录本。在另一个实施方式中,靶标核酸序列可以包括由mrna转录本形成的cdna。pcr扩增可以用于在分析之前提高拷贝数,例如,就要检测的cdna来说。
在另一个实施方式中,靶标核酸混合池可以原位处于单细胞或细胞群体中。细胞或细胞群体可以是真核生物或原核生物。细胞或细胞群体可以是哺乳动物或真菌的。细胞或细胞群体可以是人的。细胞、细胞群体或样品可以来源于患者。例如,它可以是患有病况,或者怀疑患有病况,或者具有患病风险的患者。细胞、细胞群体或样品可以来源于未知病况患者。靶标核酸、细胞或细胞群体可以来自患有或者怀疑患有与snp或单核苷酸修饰有关的病况或者具有患病况的风险的受试者。snp或单核苷酸修饰靶标核酸可以与疾病或病况相关。snp或单核苷酸修饰靶标核酸可以指示疾病或病况。指征可以是诊断的或预后的。指征可以是出现疾病或病况的风险或可能性的指征。这些病况可以包括癌症或阿尔茨海默氏病。在另一个实施方式中,病况可以是镰刀形红细胞贫血症。技术人员将承认本文中的发明将对于与snp或单核苷酸修饰有关的任何疾病或病况的检测和监测有用。
与snp有关的病况或疾病可以包括癌症,如乳腺癌、肺癌、结肠直肠癌或黑素瘤。肺癌可以与pik3ca、kras、nras、akt1、alk或egfr的基因或其组合中的snp有关。结肠直肠癌可以与kras和/或pik3ca基因中的snp有关。乳腺癌可以与braf中的snp有关。
与snp有关的病况可以包括阿尔茨海默氏病或者镰刀形红细胞贫血症。阿尔茨海默氏病可以与p21基因中的snp有关。
snp可以处于选自p21、braf、pik3ca、kras、nras、akt1、alk和egfr的任何基因或其组合中。
癌症可以包括与braf基因中的snp有关的癌症,如一些乳腺癌。阿尔茨海默氏病可以与p21基因中的snp有关。snp可以包括p21基因颠换(rs1801270;c至a);其与阿尔茨海默氏病有关。snp可以包括braf基因颠换(v600e;x=t至a),其与癌症有关。
靶标核酸可以包括braf基因或者p21基因序列。在一个实施方式中,靶标核酸包括p21核糖核酸靶标:
3’-ucagcgcxgagucga-5’,其中x是snp位点。在另一个实施方式中,靶标核酸包括p21脱氧核糖核酸靶标:
3’-tcagcgcxgagtcga-5’,其中x是snp位点。在另一个实施方式中,靶标核酸包括brafsnp核酸靶标:
3’-tctaaagxgacatcg-5’,其中x是snp位点。
在一个实施方式中,snp包括单核苷酸向替代核苷酸的序列变化。受到多态性的核苷酸可以包括腺嘌呤(a)、胸腺嘧啶(t)、胞嘧啶(c)或者鸟嘌呤(g),或者就rna来说,腺嘌呤(a)、尿嘧啶(u)、胞嘧啶(c)或者鸟嘌呤(g)。
在另一个实施方式中,核苷酸修饰包括对核苷酸的天然或合成修饰或者由其组成。核苷酸修饰可以包括核酸的甲基化。核苷酸修饰可以包括核酸的羟甲基化。在另一个实施方式中,核苷酸修饰包括8-氧鸟嘌呤修饰或由其组成。在一个实施方式中,要通过寡核苷酸探针检测的靶标核酸的核苷酸可以包括甲基化核苷酸,如甲基化胞嘧啶。在一个实施方式中,甲基化核苷酸可以羟甲基化。
寡核苷酸探针可以包括dna或由其组成。寡核苷酸探针可以包括rna或由rna组成。在一个实施方式中,寡核苷酸探针是寡核糖核苷酸。在另一个实施方式中,寡核苷酸探针可以包含核苷酸类似物或衍生物,如具有与dna或rna等价互补的功能性核苷酸类似物或衍生物或由其组成。寡核苷酸探针可以包含dna、rna和/或核苷酸类似物的组合。核苷酸类似物可以包含pna或lna。在另一个实施方式中,寡核苷酸探针可以包含pmo或由pmo组成。
在一个实施方式中,寡核苷酸探针的长度可以为至少约8个核苷酸。在另一个实施方式中,寡核苷酸探针的长度可以为至少约10个核苷酸。在另一个实施方式中,寡核苷酸探针的长度可以为至少约12个核苷酸。在另一个实施方式中,寡核苷酸探针的长度可以为至少约15个核苷酸。在另一个实施方式中,寡核苷酸探针的长度可以为不超过约15个核苷酸。在另一个实施方式中,寡核苷酸探针的长度可以为不超过约20个核苷酸。在另一个实施方式中,寡核苷酸探针的长度可以为不超过约30个核苷酸。在另一个实施方式中,寡核苷酸探针的长度可以为不超过约40个核苷酸。在一个实施方式中,寡核苷酸探针的长度可以在约8至约50个核苷酸之间。在另一个实施方式中,寡核苷酸探针的长度可以在约8至约35个核苷酸之间。在另一个实施方式中,寡核苷酸探针的长度可以在约8至约30个核苷酸之间。在另一个实施方式中,寡核苷酸探针的长度可以在约10至约20个核苷酸之间。在另一个实施方式中,寡核苷酸探针的长度可以为约15个核苷酸。
寡核苷酸探针可以包括已知/预先确定的序列。寡核苷酸探针可以与靶标核酸序列互补。除荧光标签位置外,寡核苷酸探针可以与靶标核酸序列100%互补。寡核苷酸探针可以与靶标核酸序列至少约95%,或者至少约90%互补。寡核苷酸探针可以与靶标核酸序列至少约80%互补。除荧光标签位置外,寡核苷酸探针可以沿寡核苷酸探针的整个长度与靶标核酸序列基本互补。寡核苷酸探针可以沿探针至少约8个连续核苷酸长度与靶标核酸序列互补。寡核苷酸探针可以沿探针至少约10个连续核苷酸长度与靶标核酸序列互补。寡核苷酸探针可以沿探针至少约15个连续核苷酸长度与靶标核酸序列互补。寡核苷酸探针可以沿探针至少约18个连续核苷酸长度与靶标核酸序列互补。寡核苷酸探针可以沿探针至少约25个连续核苷酸长度与靶标核酸序列互补。寡核苷酸探针可以与靶标核酸序列足够互补,从而能够在严格条件下选择性杂交。寡核苷酸探针可以杂交至靶标核酸,如在严格条件下。
在一个实施方式中,寡核苷酸探针包括p21寡核苷酸探针或由p21寡核苷酸探针组成:5'-agtcgcgxctcagct-3',其中x是有机荧光标签或者氧化还原活性标签的位点。在另一个实施方式中,寡核苷酸探针包括brafsnp寡核苷酸探针或由brafsnp寡核苷酸探针组成:5'-agatttcxctgtagc-3',其中x是有机荧光标签或者氧化还原活性标签的位点。
当提及寡核苷酸探针序列时,技术人员将理解在序列中可以忍受一个或多个替换,可选地可以忍受两个替换,从而使其维持杂交至靶标序列的能力,或者当所述替换是在靶标序列中时,能力被认为是靶标序列的。使用标准/缺省参数,可以通过blast序列对比(www.ncbi.nlm.nih.gov/blast/)确定对序列同一性的提及。例如,根据本发明,序列可以具有至少99%的同一性并仍起作用。在其他实施方式中,根据本发明,序列可以具有至少98%的同一性并仍起作用。在另一个实施方式中,根据本发明,序列可以具有至少95%的同一性并仍起作用。
在本发明的方法中,寡核苷酸探针可以锚定至或能够锚定至表面。寡核苷酸探针可以缀合至纳米颗粒基递送载体或与之结合。纳米颗粒可以是金属纳米颗粒,例如,钪、钛、钒、铬、锰、铁、钴、镍、铜、锌、钇、锆、铌、钼、钌、铑、钯、银、镉、铪、钽、钨、铼、锇、铱、铂、金、钆、铝、镓、铟、锡、铊、铅、铋、镁、钙、锶、钡、锂、钠、钾、硼、硅、磷、锗、砷、锑及其组合、合金或氧化物的纳米颗粒。在一些实施方式中,纳米颗粒可以从聚合物材料制备。说明性的聚合物材料包括(但不限于)聚(氮丙啶)(pei)、聚(氰基丙烯酸烷基酯)、聚(酰胺胺)树枝状聚合物(pamam)、聚(ε-己内酯)(pcl)、聚(乳酸-共-乙醇酸)(plga)或者聚酯(聚(乳酸)(pla))。在一些实施方式中,纳米颗粒还可以涂覆分子以用于连接功能性元素。在一些情况下,涂层包含硫酸软骨素、葡聚糖硫酸酯、羧甲基葡聚糖、海藻酸、果胶、角叉藻聚糖、岩藻依聚糖、琼脂胶、紫菜聚糖、卡拉亚胶、洁冷胶、黄原胶、透明质酸、氨基葡萄糖、半乳糖胺、几丁质(或者壳聚糖)、聚谷氨酸、聚天冬氨酸、溶菌酶、细胞色素c、核糖核酸酶、胰蛋白酶原、糜蛋白酶原、α-糜蛋白酶、聚赖氨酸、聚精氨酸、组蛋白、鱼精蛋白、石墨烯、卵清蛋白或者糊精或环糊精。在一些实施方式中,纳米颗粒可以具有小于约500nm、400nm、300nm、200nm、100nm、80nm或50nm的至少一种尺寸。
在一个实施方式中,在方法中使用的寡核苷酸探针如以上相对于基因探针产物所定义的。因此,它锚定至贵金属纳米颗粒。
取决于核苷酸的种类或修饰结构,荧光标签光发射强度的差异可以是强度可检测的升高或者强度可检测的降低。取决于核苷酸的种类或修饰结构,氧化还原活性标签的电荷强度的差异可以是强度可检测的升高或者强度可检测的降低。技术人员将认识到基于标签和/或配对核苷酸或其修饰,强度将不同(即升高或降低)。例如,在其中有机荧光标签是蒽的实施方式中,当相对于与t配对,与a配对时,蒽可以提供可检测的强度升高。当相对于与t配对,与c配对时,蒽可以提供可检测的强度降低。
相对于寡核苷酸探针荧光标签的光发射波长,荧光标志物的光发射波长的差异可以是各个峰发射的差异。相对于寡核苷酸探针荧光标签的光发射波长,荧光标志物的光发射波长的差异可以为至少50nm。相对于寡核苷酸探针荧光标签的光发射波长,荧光标志物的光发射波长的差异可以在约50nm至400nm之间,或更多。所述差异可以为约200nm。
校准可以包括一旦寡核苷酸探针与具有已知snp或单核苷酸修饰比的多种靶标核酸标准品杂交,发光强度的变化百分比的检测。至少三种不同比值的标准品可以用于校准。
在一个实施方式中,将荧光标签发光变化百分比与已通过已知标准品的发光变化百分比的线性回归所确定的校准值相比较包括根据y=a+bx的线性回归计算,计算单核苷酸多态性(snp)或单核苷酸修饰的百分比,其中x是解释变量(发光变化百分比)并且y是因变量(单核苷酸多态性(snp)或单核苷酸修饰的百分比)。线的斜率为b,并且a是截距(当x=0时的y值)。
方法还可以包括第二基因探针的应用。可以使用单独的/第二基因探针进行相同的测定。相对于第一基因探针,第二基因探针可以包括对标签不同的接头长度。另外或者作为另外一种选择,相对于第一基因探针,第二基因探针可以包括不同的接头立体化学和/或不同的有机荧光标签或氧化还原活性标签。
第二基因探针的应用克服了一些情况中的问题,例如,是否不存在靶标或者校准线在一个碱基与另一个的特定比值与x轴相交。例如,在校准线与x轴相交的交点,在使用单一基因探针的测试中,将不清楚是否(i)在溶液中不存在靶标或者(ii)比值是否小于校准曲线x轴的阈值。然而,这可以通过双重基因探针法解决,其中与x轴的交叉将发生在不同的碱基比值。双重基因探针法还将提供对所得结果的进一步验证。
另外或作为另外一种选择,方法还可以包括在基因探针上使用第二荧光标签/报告蛋白或者第二氧化还原活性标签/报告蛋白。第二荧光标签/报告蛋白或第二氧化还原活性标签/报告蛋白可以根据情况,通过发光或电荷强度的变化表示双螺旋形成。
有利地,第二荧光标签/报告蛋白或者第二氧化还原活性标签/报告蛋白的应用克服了一些情况中的问题,例如,是否不存在靶标或者校准线在一个碱基与另一个的特定比值与x轴相交。第二荧光标签/报告蛋白或第二氧化还原活性标签/报告蛋白可以表示双螺旋形成,借此确认靶标核酸的存在或不存在,和使用替代或第二基因探针来读出小于第一基因探针的校准x轴阈值的比值的潜在需要。更有利地,第二荧光标签/报告蛋白或第二氧化还原活性标签/报告蛋白还允许读出snp变体比值的比率法。例如,两个探针之间的比值可以提供要应用的调整值/系数以解释探针浓度的差异。
根据本发明的另一个方面,提供了确定受试者中与已知的snp有关的病况状态的方法,方法包括:
提供来自所述受试者的包含靶标核酸的样品,其中靶标核酸可以包含snp;
根据本文中本发明的方法,相对于不具有snp的靶标核酸,确定样品中snp的百分比,
其中snp的百分比指示所述受试者中与snp有关的病况状态。
在一个实施方式中,所述状态可以为病况提供诊断和/或预后。另外或者作为另外一种选择,所述状态可以包含病况的发展。此外,另外或者作为另外一种选择,所述状态可以包含病况的严重程度。
考虑到探针还可以区分碱基修饰(即胞嘧啶的甲基化)以及碱基变化,本发明还可以用于表观遗传学筛选目的(即在样品内建立me-c/c比)。
根据本发明的另一个方面,提供了确定受试者靶标核酸的表观遗传学状态的方法,方法包括根据本文中所述的方法,确定靶标核酸的单核苷酸修饰百分比,其中靶标核酸的单核苷酸修饰百分比指示所述受试者中靶标核酸的表观遗传学状态。
在一个实施方式中,所述表观遗传学状态可以包括靶标核酸的遗传调控程度,其中所述调控与单核苷酸修饰有关。所述表观遗传学状态可以包括确定靶标核酸,具体地,参与遗传调控的核酸中核苷酸的甲基化或羟甲基化程度。甲基化/羟甲基化可以包括胞嘧啶甲基化/羟甲基化。
根据本发明的另一个方面,提供了根据本文中的发明的基因探针用于确定靶标核酸混合池中的靶标核酸的snp比或单核苷酸修饰比的应用。
所述使用可以是体外的。在另一个实施方式中,所述使用可以是体内的。在另一个实施方式中,所述使用可以原位处于细胞或细胞群体中。细胞群体可以是组织。
根据本发明的另一个方面,提供了根据本文中的发明的基因探针用于受试者中与snp或单核苷酸修饰有关的病况的诊断和/或预后的应用。
与snp有关的病况或疾病可以包括癌症,如乳腺癌、肺癌、结肠直肠癌或黑素瘤。肺癌可以与pik3ca、kras、nras、akt1、alk或egfr的基因或其组合中的snp有关。结肠直肠癌可以与kras和/或pik3ca基因中的snp有关。乳腺癌可以与braf中的snp有关。
与snp有关的病况可以包括阿尔茨海默氏病或者镰刀形红细胞贫血症。阿尔茨海默氏病可以与p21基因中的snp有关。
snp可以处于选自p21、braf、pik3ca、kras、nras、akt1、alk和egfr的任何基因或其组合中。
与单核苷酸修饰有关的病况可以包括巴雷特食管或癌症,如结肠直肠癌。结肠直肠癌可以与mlh1甲基化有关。单核苷酸修饰可以包括mlh1的甲基化。
根据本发明的另一个方面,提供了用于靶标核酸混合池中的靶标核酸的snp和/或单核苷酸修饰的比值的检测和分析的试剂盒,其中试剂盒包含:
-根据本文中的发明所述的基因探针,或者包含具有通过接头基团引入其中的标签的寡核苷酸主链的寡核苷酸探针,其中标签是有机荧光标签或氧化还原活性标签,并且其中标签处于经布置以与要检测的靶标核酸的核苷酸配对的位置;和
-用作校准中的标准品的第一标准靶标核酸,其中第一靶标核酸包含待分析的snp或单核苷酸修饰;和
-用作校准中的标准品的第二标准靶标核酸,其中第二靶标核酸不包括待分析的snp或单核苷酸修饰。
在一个实施方式中,以用于在校准中使用的具有预定比值的标准品混合物提供第一标准靶标核酸和第二标准靶标核酸。试剂盒可以包括1、2、3、4、5、6或更多种处于不同预定比值的第一标准靶标核酸和第二标准靶标核酸的标准品混合物。例如,第一标准品混合物可以相对于第二标准靶标核酸,包括1:0的第一标准靶标核酸。第二标准品混合物可以相对于第二标准靶标核酸,包括1:1的第一标准靶标核酸。第三标准品混合物可以相对于第二标准靶标核酸,包括0:1的第一标准靶标核酸。第四标准品混合物可以相对于第二标准靶标核酸,包括2:1的第一标准靶标核酸。第五标准品混合物可以相对于第二标准靶标核酸,包括1:2的第一标准靶标核酸。另外或者作为另外一种选择,试剂盒还可以包括标准品校准表,其包括相对于靶标核酸混合池中snp或单核苷酸修饰的百分比,发光或电荷强度变化的指示。另外或者作为另外一种选择,试剂盒可以包括通过所记录的靶标核酸混合池中发光或电荷强度变化使用的线性回归公式。
试剂盒可以包括核酸外切酶,如t4核酸外切酶以将dsdna转化为单链。试剂盒还可以包括用于靶标核酸扩增,如lamp或pcr扩增的引物和/或聚合酶。所述引物可以包括用于环介导等温扩增(lamp)的环引物。试剂盒还可以包括用于rna序列向cdna转化的反转录酶。
可以在室温下进行本文中的发明所述的方法和使用。室温可以是约24℃,例如约20-26℃之间。在本文中,可以在比寡核苷酸探针和靶标核酸的解链温度更低或显著更低的温度,例如,比寡核苷酸探针和靶标核酸的解链温度低至少5℃的温度进行本发明的方法。在本文中,可以在低于40℃、35℃、32℃、30℃或者28℃进行本发明的方法。
在本文所描述的基因探针或基因传感器的背景中,术语“基因”将理解为表示能够分析或检测核酸序列的传感器或探针。该术语包括(但不限于)基因序列、基因间序列或任何核酸序列。合成核酸序列也可以能够分析/检测。
本文所使用的术语“与……有关的病况或疾病”将理解为包括直接或间接由snp或单核苷酸修饰引起的受试者的疾病或病况。snp或单核苷酸修饰可以或可以不是导致病况或疾病的单一导致修饰,例如,snp或单核苷酸修饰可以与其他影响因素一起有助于病况或疾病。相关可以是临床相关。相关可以是统计相关。特定snp或单核苷酸修饰的比值的检测和/或发现可以表示受试者中患有或发生所述疾病或病况的风险更高。其他改变、症状或临床表现可以用于有助于确定病况或疾病的状态、诊断或预后。
技术人员将理解在适当情况下,本发明的一个实施方式或方面的可选特征可以可应用于本发明的其他实施方式或方面。
现将仅通过例如,参考附图,更详细地描述本发明的实施方式。
图1—snp检测机制的示意图,其中来自所连接的标签(通常为荧光团)的对通过靶标链的双螺旋形成的信号反应取决于标签相对(或者相对且邻近)的核碱基的种类。
图2—蒽标签化荧光探针的结构示意图。标签的立体化学为l(r,r)。接头基团可以是不同的,例如,n=5。
图3—所存在的a变体%相对于发光强度变化%的校准,以λex=350nm,在293k,使用1μm探针和1.5μm靶标在10mm磷酸钠缓冲液ph7和100mmnacl中对1ml样品实施校准。λex=350nm,λem=426nm,rt。
图4—所存在的c变体%相对于发光强度变化%的校准,以λex=350nm,在293k,使用1μm探针和1.5μm靶标在10mm磷酸钠缓冲液ph7和100mmnacl中对1ml样品实施校准。λex=350nm,λem=426nm,rt。
图5—所存在的c变体%相对于发光强度变化%的校准,以λex=350nm,在293k,使用1μm探针和1.5μm靶标在10mm磷酸钠缓冲液ph7和100mmnacl中对1ml样品实施校准。λex=350nm,λem=426nm,rt。
图6—通过在标准肽偶联条件下,将含有氨烷基基团的dna链与硫辛酸反应,使用由1,2-二硫烷末端基团所组成的连接基团(左图)对蒽标签化的dna链官能化。
图7—显示了钌吡啶ss探针的结构。
图8—用于比率检测的(左图)含有dna二硫烷链的aunp,aunp-a,和(右图)含有dna-二硫烷链和ru(bipy)3标签化双-二硫烷分子两者的aunp,aunp-b。
图9—使用aunp-a颗粒的所存在的a变体%相对于发光强度变化%的校准。误差线为使用rt下三次不同的aunp合成的三次重复的标准偏差。λex=350nm,λem=426nm。
图10—对于au-np-b,所存在的a%相对于蒽信号(426nm)/钌信号(630nm)的比值的校准。误差线为rt下三次重复的标准偏差。
图11—一旦与5l-蒽标签化寡核苷酸探针完全杂交,173条碱基合成寡核苷酸链的荧光变化百分比。误差线为来自3次重复的标准偏差。1μm靶标和1μm探针,并且其能够检测braf基因中的a/tsnp差异。
图12—3%琼脂糖凝胶以显示~150个碱基对的pcr产物。所述凝胶表示两个不同的pcr。凝胶a:泳道1-4显示了来自肿瘤组织的基因组dna的pcr产物,并且泳道5-8显示了来自健康组织的基因组dna的pcr产物。
图13—来自健康组织基因组dna(野生型)的pcr产物的测序数据。
图14—来自肿瘤组织基因组dna的pcr产物的测序数据。
图15—图(a)显示当添加至探针5'-agatttcxctgtagc-3'(braf,x=蒽5l,1μm)时,未纯化的pcr产物样品在426nm的完全荧光发射强度;图(b)显示了针对3000至5000单位之间的数据以更清楚地显示每个样品之间的差异。误差线显示了来自3次实验重复的标准偏差。
实施例
实施例1-基因探针的制备
蒽探针合成
2-(蒽-9-基氧)乙酸酯的合成
在圆底烧瓶中,将蒽酮(5.83g)和k2co3(4.15g)溶于脱气丙酮(200ml)并避光搅拌15分钟。然后,将溴乙酸乙酯(3.3ml)注入所述烧瓶并在n2下避光回流反应过夜。过滤溶液以除去k2co3并真空除去溶剂。将所述固体再溶于dcm(100ml)并用水清洗(50ml),然后用mgso4干燥。通过减压除去溶剂并通过柱色谱法(10%己烷:dcm)纯化所述固体(化合物2)以提供黄色固体(1.91g,23%)。
rf=0.54,在10%己烷:dcm中;1hnmr(300mhz,cdcl3)δ8.23(2h,d,j8.5,h7),8.09(1h,s,h12),7.84(2h,d,j8.1,h10),7.28-7.44(4h,m,h8h9),4.66(2h,s,h4),4.24(2h,q,j7.1,h2),1.23(3h,t,j7.1,h1);
tof-ms-es+[m+h]+281.12[m+na]+303.09
2-(蒽-9-基氧)乙酸的合成
在圆底烧瓶中,将1g2-(蒽-9-基氧)乙酸酯溶于10%naoh在etoh1:1(200ml)中的溶液,将其在n2下避光回流过夜。真空除去etoh并加入水(400ml),然后边使溶液涡漩边滴加浓hcl直至出现膏状沉淀物并且通过混合不消失以提供膏状固体(800mg,89%)。
1hnmr(300mhz,cdcl3)δ8.34(1h,s,h10),8.31(2h,d,j8.3,2xh5),8.06(2h,d,j8.0,2xh8),7.49-7.60(4h,m,2xh6,h7),4.91(2h,s,h2);13cnmr(100mhz,cdcl2)172.1(c1),149.5(c3),132.6(2xc9),128.9(2xc8),127.2(2xc6),126.1(2xc7),125.7(2xc6),123.6(c10),121.6(2xc5),71.2(c2);
tof-ms-es-[m-h]-251.06
2-(蒽-9-基氧基)-n-((2s,3s)-1,3-二羟基丁-2-基)乙酰胺的合成
在圆底烧瓶中,在惰性条件下,将2-(蒽-9-基氧)乙酸(300mg)溶于无水dmf(20ml)。加入2-(1h-苯并三唑-1-基)-1,1,3,3-四甲基脲六氟磷酸酯(hbtu)(0.455g)并将溶液避光搅拌15分钟。加入l-苏氨醇(0.126g)和dipea(0.21ml),并将溶液在40℃搅拌40小时。真空除去溶剂,然后通过柱色谱法(5%meoh:dcm)纯化产物以提供浅黄色固体(203mg,49%)。
rf=0.27,在dcm:5%meoh中;1hnmr(300mhz,cdcl3)δ8.38(1h,s,h15),8.30-8.35(2h,m,h10),8.06-8.11(2h,ddj8.4&2.0,h13),7.49-7.60(4h,m,h11,h12),4.74(2h,d,j5.8,h7),4.15-4.23(1h,m,h2),4.07-4.14(1h,m,h3),3.83(2h,m,h4),1.35(3h,d,j6.4,h1);13cnmr(100mhz,cdcl3)δ132.1(c14),128.3(c13),125.7(c11),125.3(c12),124.0(c9),122.9(c15),121.1(c10),73.2(c7),65.6(c2),61.6(c4),55.8(c3),19.3(c1);
tof-ms-es+[m+na]+362.1
蒽标签化荧光探针的合成
使用标准亚磷酰胺自动dna合成来合成探针,通过ms纯化并通过质谱(esms)表征。
在每种情况下,标签的立体化学为l(r,r),接头基团n=5(参见下文)。每个探针为15-聚体,其中第八位被蒽标签占据。
用于该工作的蒽探针是随机设计的15-聚体,其不会显示任何二级结构。p.um为探针序列;p.af为具有硫辛酸修饰的探针序列。探针链(p.um、p.af、p.1l和p.1d)是结合至金纳米颗粒的链并用于检测靶标链(dna-t.1,dna-t.2)。
在小组内的appliedbiosystems9394dna/rna合成仪上合成每条链。通过反相hplc纯化它们并通过质谱表征。
具有胺末端的dna合成
首先,用对其可以偶联激活的酯的胺基修饰dna。基于dna合成仪,作为末端添加5'胺c6修饰,从而提供胺末端探针链。
根据正常寡核苷酸合成,使用标准synbasecpg1μm(linktechnologies)在appliedbiosystems394dna/rna合成仪上合成序列。
通过苏氨醇单元,将2-(蒽-9-基氧基)-n-((2s,3s)-1,3-二羟基丁-2-基)乙酰胺整合到寡核苷酸主链中。
使用加热块(grantinstruments),在加热至55℃的1m氨中离柱进行碱基脱保护6小时。减压除去氨。
然后,使用clarity5μoligo-rp150×4.6mm(phenomenex)柱,通过半制备hplc(dionexuvd1705)纯化序列。在收集纯化的峰之后,真空除去溶剂(thermoscientificsavantspd131dda),然后溶于水并通过nap-10柱(gehealthcare)。通过质谱和分析型hplc(shimadzuuflc),在clarity5μoligo-rp150×4.6mm,5微米(phenomenex)柱上表征样品。
具有胺末端的rna合成
根据标准rna寡核苷酸合成,使用标准rna碱基(linktechnologies)在appliedbiosystems394dna/rna合成仪上合成序列。合成后,将序列留在柱上;然后,从所述合成仪除去柱并使用注射器,用2.5ml氨:乙醇(3:1)清洗,每30分钟清洗一次,清洗2小时。然后,将所述混合物倒入小瓶中,再次用1ml氨:乙醇(3:1)清洗所述柱。然后,将溶液在55℃加热6小时。一旦冷却,将溶液在旋转蒸发仪上干燥。将干燥的样品在0.5mltbaf(1m在thf中)中涡旋并静置过夜。
然后,使用水作为洗脱剂,将样品通过nap-10柱(gehealthcare)。然后,浓缩溶液,将375ml样品置于2mleppendorf中,向其中添加0.2ml乙酸钠(0.1m)和1.4ml异丙醇。将混合物在冷冻离心机中在4℃,以15000rpm离心15分钟。在真空离心浓缩仪(speedvac)中除去上清液,将颗粒在1ml水中复原,涡流以使其再溶解。然后,使用clarity5μoligo-rp150×4.6mm柱,通过半制备hplc纯化样品。然后,除去溶剂,使样品通过nap-10柱以脱盐。通过质谱和分析型hplc,在clarity5μoligo-rp150×4.6mm,5微米柱上表征样品。
2,5-二氧代吡咯烷-1-基5-(1,2-二硫烷-3-基)戊酸酯=硫辛酸的nhs酯的合成
在圆底烧瓶中,将1.84gn-(3-二甲基氨丙基)-n'-碳酰二亚胺盐酸盐溶于无水dcm(20ml)。将1.7mln,n-二异丙基乙胺(dipea)加入所述反应,并使所述反应搅拌10分钟。将反应容器置于冰浴中,然后将1.29gn-羟基琥珀酰亚胺(nhs)加入至所述混合物并使其搅拌。首先,将1.643g硫辛酸溶于10ml无水dcm,然后在5分钟内加入所述反应。然后,将反应在室温下保持搅拌过夜。用hcl(aq)(5%[v/v],50ml)清洗反应两次,然后用50ml水清洗。用na2so4干燥有机层,然后真空浓缩溶剂。通过加载至na2so4使残余物干燥,并通过柱色谱法(50%etac:50%己烷)纯化以提供黄色粉末状的纯化产物(化合物1)(0.451g,1.49mmol,19%)。
rf=0.57,在etac:己烷50:50中;1hnmr(300mhz,dmso)δ3.56–3.65(1h,m,h3),3.12–3.21(2h,m,h1),2.81(4h,s,h10),2.69(2h,t,j7.1,h7),2.38–2.46(1h,m,h2),1.84–1.93(1h,m,h2),1.4–1.7(6h,m,h4h5h6);13cnmr(100mhz,dmso)δ170.2(2xc9),168.9(c8),55.9(c3),40.1(c2),38.1(c1),33.8(c4),30.0(c7),27.6(c5),25.4(2xc10),24.0(c6),
tofmsei+[m]+303.09
寡核苷酸与硫辛酸结合剂的偶联
将胺修饰的寡核苷酸溶于碳酸钠缓冲液(100μl,0.1m)。加入溶于dmso(5μl)的5摩尔过量的硫辛酸的nhs酯。
使反应涡旋并在37℃加热过夜。然后,使用teaa缓冲液(0.1m)作为洗脱剂,将反应通过nap-5柱(gehealthcare)。然后,通过hplc纯化所述修饰的寡核苷酸并通过质谱表征。
(a)
(b)
用硫辛酸类似物修饰dna链
(a)激活的硫辛酸的nhs酯的形成
(b)将激活的nhs酯偶联至胺修饰的dna链
硫辛酸亚磷酰胺合成
5-(1,2-二硫烷-3-基)-n-(2-羟乙基)戊酰胺(化合物7)的合成)
在圆底烧瓶中,将硫辛酸(0.71g)和hobt(0.46g)溶于无水dmf(10ml)并在冰上搅拌。仍在冰上,向其中添加edc.hcl(0.66g)并将混合物搅拌1小时。使溶液加热至室温1小时。在单独的烧瓶中,将4-乙基吗啉(0.39g)和2-氨基乙-1-醇(0.15g)溶于无水dmf(5ml),然后将其加入含有硫辛酸的溶液,然后使其搅拌过夜。用dcm:h2o清洗溶液,然后减压除去dcm。通过柱色谱法在二氧化硅上(5%meoh,chcl3)纯化产物以提供黄色固体状产物(455mg,73%)。
rf=0.41,在chcl3:5%meoh中;1hnmr(300mhz,cdcl3)δ6.57(1h,s,h9),3.58-3.77(2h,m,h11),3.45-3.56(1h,m,h3),3.28-3.40(2h,m,h10),3.20-2.97(2h,m,h1),2.40(1h,dq,j12.6,6.1,h2a),2.16(2h,t,j7.3,h7),1.85(1h,dq,j13.2,6.7,h8b),1.52-1.72(4h,m,h4h6),1.33-1.45(2h,m,h5);13cnmr(100mhz,cdcl3)δ174.2(c8),61.9(c11),56.4(c3),42.4(c10),40.3(c2),38.5(c1),36.3(c7),34.6(c4),28.9(c5),25.4(c6);
tof-ms-es+[249.1]+
2-(5-(1,2-二硫烷-3-基)戊酰氨基)乙基(2-氰基乙基)二异丙基亚磷酰胺酯(化合物8)的合成
在圆底烧瓶中,在惰性气氛下,将5-(1,2-二硫烷-3-基)-n-(2-羟乙基)戊酰胺(125mg)溶于无水dcm(5ml)。向其中添加dipea(0.716ml)。将(i-pr2n)pclo(ch2)2cn(0.314ml)滴加至反应混合物,然后将反应保持搅拌2小时。一旦反应完成,加入脱气的etac(5ml),然后将溶液用脱气na2co3(2m,2×50ml),接着用脱气盐水(50ml)清洗,随后在na2so4上干燥。将溶液过滤并减压干燥,随后通过柱色谱法在活性氧化铝(etac:己烷:tea,50:49:1)上纯化以提供75%的得率。
rf;0.9;1hnmr(300mhz,cd3cn)δ3.44-3.90(7h,m,h3h11h12h14)3.34-3.44(2h,m,h10)2.99-3.17(2h,m,h1)2.60(2h,t,j6.2,h15)2.40(1h,dtd,j12.9,6.6,5.5,h2)2.13(2h,t,j7.5,h7)1.84(1h,dq,j12.7,7.0,h2)1.5-1.73(4h,m,h4h6)1.33-1.47(2h,m,h5)1.12(12h,dd,j6.9,4.6,h13);13cnmr(100mhz,cd3cn)173.0(c8),117.8(c16),62.5(c11),58.9(c14),56.9(c3),54.6(c7),43.3(c12),40.6(c10),38.8(c2),36.1(c1),34.8(c4),29.0(c5),25.6(c6),24.6(c13),20.4(c15);31pnmr(120mhz,cd3cn)δ148.0;
tof-ms-es+[m+h]+450,[m+na]+472。
钌-4,4'-二(5-硫辛酰胺基-1-戊氧基)-2,2'-二吡啶(钌吡啶ss)的合成
根据adams,s.j.等人,acsappl.mater.interfaces6,11598-11608(2014),合成钌基探针,钌-4,4'-二(5-硫辛酰胺基-1-戊氧基)-2,2'-二吡啶(钌吡啶ss)。
偶联的寡核苷酸
w=硫辛酸修饰
l=1l蒽探针
d=1d蒽探针
x=5l蒽探针
q=化合物8修饰
数字1或5表示蒽分子和苏氨醇单元之间的碳接头长度。l和d表示在合成中使用的苏氨醇异构体。
金纳米颗粒(aunp)的合成
从13nm颗粒开始,通过颗粒晶种法使颗粒生长,其合成如下所示。起初,反应物储液由以下组成:5mmhaucl4.h2o(100mg在50ml去离子水中)、57mm抗坏血酸(500mg在50ml去离子水中)和34mm无水柠檬酸钠(500mg在50ml去离子水中)。
13nm金纳米颗粒
在反应之前,将所有玻璃器皿在王水中浸泡至少30分钟,然后用去离子水漂洗所述玻璃器皿10次并在使用之前置于烘箱中。在配备有冷凝器的250ml圆底烧瓶中,将100ml2.75mm柠檬酸盐缓冲液(75:25柠檬酸钠:柠檬酸)加热直至沸腾,从而确保通过剧烈搅拌形成涡旋。在煮沸15分钟后,将1.6mg乙二胺四乙酸(edta)加入至溶液。在单独的烧瓶中,将25mlhaucl4.3h2o(sigmaaldrich)(8.5mg)置于烘箱中加热直至90℃。然后,将金溶液快速加入至所述柠檬酸盐缓冲溶液的涡旋中心并使其煮沸20分钟。20分钟后,关闭加热,并使溶液冷却至室温,但仍剧烈搅拌。
spr=519nm,数均分布=12nm(±3nm),强均分布=21nm(±6nm)
25nm金纳米颗粒
在250ml三颈圆底烧瓶中,用去离子水将30ml13nmaunp(2nm)的溶液稀释至40ml。剧烈搅拌溶液。然后,使用储液组成两种溶液,溶液a=1mmhaucl4.h2o(20ml),溶液b=2.85mm抗坏血酸和1.7mm无水柠檬酸钠(20ml)。然后,使用蠕动泵,在45min内将溶液a和b加入至aunp溶液。一旦添加,将aunp溶液回流30分钟并使其冷却至室温。
数均分布=22nm(±5nm),强均分布=31nm(±8nm)
50nm金纳米颗粒
在250ml三颈圆底烧瓶中,用去离子水将9ml25nmaunp(0.7nm)的溶液稀释至40ml。剧烈搅拌溶液。然后,使用储液组成两种溶液,溶液a=1mmhaucl4.h2o(20ml),溶液b=2.85mm抗坏血酸和1.7mm无水柠檬酸钠(20ml)。然后,使用蠕动泵,在45min内将溶液a和b加入至aunp溶液。一旦添加,将aunp溶液回流30分钟并使其冷却至室温,用0.01mnaoh中和溶液。
数均分布=38nm(±9nm),强均分布=56nm(±16nm)
100nm金纳米颗粒
将40ml50nmaunp(80pm)的溶液置于250ml三颈圆底烧瓶。剧烈搅拌溶液。然后,使用储液组成两种溶液,溶液a=4mmhaucl4.h2o(20ml),溶液b=11.4mm抗坏血酸和3.4mm无水柠檬酸钠(20ml)。然后,使用蠕动泵,在45min内将溶液a和b加入至aunp溶液。一旦添加,将aunp溶液回流30分钟并使其冷却至室温。
spr=561nm,数均分布=68nm(±20nm),强均分布=105nm(±32nm)(100%)
aunp的表征
粒径测量
将1ml2nmaunp样品置于一次性dt50012比色皿(sarstedt),然后在zetasizernano(malvern)上测量颗粒粒径。每个样品测试12次,重复3个样品,并取平均值。
透射电子显微术
使用镊子将铜网(3mm,formvar)保持在清洁且安全的区域,将20μl2nmaunp样品用移液器加至所述网上。使样品保持静置20分钟,20分钟之后使用滤纸吸去过量的样品。然后,使用jeol1200透射电子显微镜对样品成像。涂覆的aunp程序
涂覆aunp程序
用dna和钌吡啶ss涂覆13nmaunp
在含有磁力搅拌器的eppendorf中,在10mmph7.0的磷酸盐缓冲液中组成柠檬酸盐涂覆的aunp(13nm,3nm)。将硫辛酸修饰的dna(0.33μm)加入至aunp并搅拌2分钟,然后将溶液超声处理20秒。另外重复该过程2次,从而提供0.98μm的最终dna浓度。将钌吡啶ss(1.5μm)探针加入至颗粒并使其搅拌20分钟。重复该过程,从而提供3μm的最终钌吡啶ss浓度。用去离子水作为洗脱剂,使颗粒通过sephadexg-50柱(保存在20%的乙醇中)。采集最终的uv-vis光谱以确认浓度。
用p.1l和钌吡啶ss涂覆100nmaunp
在含有磁力搅拌器的eppendorf中,在10mmph7.0的磷酸盐缓冲液中组成柠檬酸盐涂覆的aunp(100nm,40pm)。将p.1l(0.25μm)加入至aunp并搅拌2分钟,然后将溶液超声处理20秒。另外重复该过程2次,从而提供0.75μm的最终dna浓度。将钌吡啶ss(1.13μm)探针加入至颗粒并使其搅拌20分钟。重复该过程,从而提供2.3μm的最终钌吡啶ss浓度。然后,使颗粒以13000rpm旋转沉淀90秒以形成沉淀颗粒。小心除去上清液,从而不扰动颗粒。将颗粒在去离子水中再分散。
spr=565nm,数均分布=73nm±26nm,强均分布=106±38nm。
用sirna和钌吡啶ss涂覆13nmaunp
在含有磁力搅拌器的eppendorf中,在10mmph7.0的磷酸盐缓冲液中组成柠檬酸盐涂覆的aunp(13nm,3nm)。将rna.1(0.33μm)加入至aunp并搅拌2分钟,然后将溶液超声处理20秒。纯化前采集颗粒的uv-vis光谱。另外重复该过程2次,从而提供0.98μm的最终rna.1浓度。将钌吡啶ss(1.5μm)探针加入至颗粒并使其搅拌20分钟。重复该过程,从而提供3μm的最终钌吡啶ss浓度。用去离子水作为洗脱剂,使颗粒通过sephadexg-50柱(保存在20%的乙醇中)。采集最终的uv-vis光谱以确认浓度。在10mmph7.0磷酸盐缓冲液和100mmnacl中组成颗粒。向该溶液中加入rna.2(0.4μm)。
spr=524nm,数均分布=15nm±3nm,强均分布=30nm±15nm。
荧光测试
用10mm磷酸盐缓冲液(ph7.0)和100mmnacl组成1μm双螺旋dna溶液,使用移液器使溶液彻底混合。对于dna-aunp样品,用10mm磷酸盐缓冲液(ph7.0)和100mmnacl组成2.5nmaunp样品,使用移液器使溶液彻底混合。
对于在shimadzurf-5301pc荧光分光光度计上测试的样品,蒽λex=350nm,λem=370-550nm,激发的狭缝宽度为5nm,发射的为10nm。每次测试的停留时间为1.0秒,1nm带宽,1次积累。
对于在flsp920时间分辨光谱仪(edinburgh)上测试的样品,蒽λex=350nm,λem=390-550nm,激发的狭缝宽度为5nm,发射的为10nm。每次测试的停留时间为1.0秒,1nm带宽,1次积累。对于钌探针,λex=465nm,λem=580-800nm,激发的狭缝宽度为15nm,发射的为15nm。每次测试的停留时间为1.0秒,3nm带宽,3次积累。
实施例2
使用荧光团标签探针,dna和rna靶标链中核碱基变体的等位基因比值的读数
1.简介
单核苷酸多态性(snp)是基因组dna的特定序列中一个位点处的一个核碱基的变化,其在具有遗传组分的疾病,包括癌症的发展和预后中起重要作用。在临床研究、手术和诊断中,需要从等位基因(即snp)比值中提供快速、廉价且可靠的读数的方法以提供临床决策信息。
在过去几年中,开发了snp检测方法,其中可以常规地从dna靶标样品中读出snp类型。这种方法使用了涉及标签dna探针的双螺旋形成(杂交)以产生荧光信号。然而,在本文中,本发明所使用的方法中的重要差异在于所述分析基于双螺旋形成时所产生的信号强度,而不是基于双螺旋形成的好坏程度来提供信号。这意味着所述测定可以在室温下进行并且避免了对使用狭窄温度窗以确保仅一个转录本(或转录本产物)结合的需要。目前,已公开的研究工作显示了含有位于位点的一个核碱基(纯合)或50/50的混合物(杂合)的靶标链样品的研究结果。在所有这些报道中,所述检测信号来自双螺旋形成时在特定监测波长(例如,426nm)升高或降低的探针链上的蒽标签的荧光发射,其中信号强度直接取决于相对碱基的类型(图1)。
在本文中,本发明表明对于一系列dna和rna序列,在与靶标中的snp/比值有关的发射信号中存在线性相关性,因此使得能够校准snp比值(即等位基因比值),然后通过对给定波长的发光强度的简单测量,读出未知混合物。
在以下部分2(游离探针)和3(aunp结合探针)中描述了对短(<20-聚体)合成dna和rna靶标的检测研究结果。部分4详细说明了对更长的(>100-聚体)靶标,包括来源于患者样品的pcr-扩增链所实施的研究。
2.对短(<20-聚体)合成dna和rna靶标的研究
本部分描述了对使用蒽标签化荧光探针检测两种不同的snp的研究工作。在每种情况下,标签的立体化学为l(r,r),接头基团n=5(参见图2)。每个探针为15-聚体,其中第八位被蒽标签占据。
如上所述,使用标准亚磷酰胺自动dna合成来合成探针,通过ms纯化并通过质谱(esms)表征。
2.1dna检测(braf基因突变)
探针:5’-agatttcxctgtagc-3’(braf,x=蒽5l)
靶标:3’-tctaaagxgacatcg-5’
snp:braf基因颠换(v600e;x=t至a);与癌症有关。
tm值:45.5(a);46(t)(5μm双螺旋,在10mm磷酸钠缓冲液ph7;100mmnacl中)。
图3显示了所得的校准图。
2.2dna检测(p21基因snp)
探针:5’-agtcgcgxctcagct-3’(zsuzsa,x=蒽5l)
靶标:3’-tcagcgcxgagtcga-5’
snp:p21基因颠换(rs1801270;c至a);与阿尔茨海默氏病有关。
tm值:60℃(a),63℃(c)(5μm双螺旋,在10mm磷酸钠缓冲液ph7;100mmnacl中)。
图4显示了所得的校准图。
使用校准,分析c和a靶标的未知杂合样品以确定所存在的c/a碱基的百分比。使用图4所示线性相关方程计算结果。通过相对于探针单独的荧光计算426nm的荧光变化百分比获得y值。该试验结果(参见表1)显示与未知样品的实测值非常接近。
表1.
当无靶标存在时,所得结果突出显示了一个问题:在校准与x轴的交点,测试不清楚是否(i)溶液中不存在靶标或者(ii)~80%的靶标链具有c核碱基变体,20%的具有a。然而,这通过以下方法解决:
·第二探针的应用:可以使用含有与蒽标签不同的接头长度、不同的接头立体化学或不同的荧光团的另外的探针来进行相同测试。在每种情况下,将以不同的c/a比值发生与x轴的相交。双重-探针法还提供了对所得结果的进一步验证;和/或
·在一个探针上第二荧光团标签的应用:第二荧光团简单地通过发光强度变化读出双螺旋形成;单独的标签使得能够进行比率法以读出snp变体比值(参见部分3)。
2.3rna检测(p21基因snp)
探针:5’-agtcgcgxctcagct-3’(zsuzsa,x=蒽5l)
靶标:3’-ucagcgcxgagucga-5’
snp:p21基因颠换(rs1801270;c至a);与阿尔茨海默氏病有关。
tm值:55.5℃(a),57℃(c)(5μm双螺旋,在10mm磷酸钠缓冲液ph7;100mmnacl中)。
图5显示了所得的校准图。
3.使用连接至金纳米颗粒的探针(au-np)对短(<20-聚体)合成dna靶标的研究
已知dna可以通过以下方法连接至金纳米颗粒(aunp):用含硫基团修饰以使得能够通过au-硫醇盐键进行表面固定化。决定将在本发明的方法中使用的荧光团标签snp-检测链固定化至aunp。该方法提供了以下优势:在生物培养基中并且一旦进入细胞,au-np固定化的dna链往往更耐受否则将快速降解dna的核酸酶。因此,该方法将对于检测生物环境中的靶标物质(例如,mrna)是有用的。另外,可以通过其他发光基团调节aunp以用于比率检测。比率检测包括分析在两个不同的波长,来自两个不同的荧光团的检测信号。将一个信号强度除以另一个避免了确定初始探针浓度的需要;这简化且有利于检测方法,具体地其中探针浓度将难于确定的细胞环境中的分析。其他发光基团也可以用于辅助细胞中的追踪。
通过在标准肽偶联条件下,将含有氨烷基基团的dna链与硫辛酸反应,使用由1,2-二硫烷末端基团所组成的连接基团对蒽标签化的dna链官能化(图6)。然后,用这些链(aunp-a,图8a)使aunp(直径约13nm)官能化,其中通过在水介质中,监测uv/vis光谱上向spr带的转变来核对链固定化。对于设计以研究比率检测的混合纳米颗粒(aunp-b,图8b),除dna链外,使用了具有良好表征的发光性质并且含有两个1,2-二硫烷末端基团的ru(bipy)3络合物(图7)。
探针:5’-agtcgcgxctcagct-3’(zsuzsa,x=蒽5l)
靶标:3’-tcagcgcxgagtcga-5’
snp:p21基因颠换(rs1801270;c至a);与阿尔茨海默氏病有关。
tm值:(aunp-a):57.5℃(a),59℃(c)(2nmaunp,在10mm磷酸钠缓冲液ph7;100mmnacl中)。
图9显示了所得的aunp-a的校准图。图10显示了所得的aunp-b的校准图。
图9中的数据意外地显示对于表面固定化的探针,线性相关性也是可能的,其百分比变化与相应游离探针的数据类似(图4)。图10中的图也显示使用该方法,比率检测是可能的。
4.对更长的dna链靶标,包括来自患者样品的那些的研究
4.1173-聚体的合成靶标
探针:5’-agatttcxctgtagc-3’(braf,x=蒽5l)
靶标:173-聚体,在中间含有:3'-tctaaagxgacatcg-5'
snp:braf基因颠换(v600e;x=t至a);与癌症有关。
使用在15-聚体合成靶标样品内具有不同百分比的brafv600et-a癌症突变所进行的荧光研究证明了线性相关性(部分2.1)。然而,决定对更长的合成173-聚体寡核苷酸靶标重复实验,因为这种长度将是通过来自实际患者样品的基因组dna(部分4.2)的pcr扩增将产生的链的尺寸的更实际的实例。由于brafv600e癌症突变通常是杂合的,而不是纯合的(即癌性组织预期将不会显示出大于50%的t-a转化),因此在样品中,在0%至50%a之间,而不是在50%至100%a之间选择更多的数据点。在下图11中显示了结果,并且再次显示了线性相关性。
通过一旦蒽标签化寡核苷酸探针结合,使用荧光变化百分比,该图可以用于区分细胞混合物中avst等位基因的量。例如,如果样品提供150%的荧光变化,则存在于样品中的a等位基因的量将为约47%。如所述15-聚体产物(图3)一样,与单独的探针相比,a靶标提供了更大的发光增加。然而,发光增加百分比(约300%)显著小于对所述短15-聚体(增加约700%)所发现的增加,推测因为所述173-聚体中未结合的(单链)序列可以折叠并与荧光团标签相互作用,这在某种程度上将改变它的直接环境。
4.2.基因组dna的pcr
然后,对含有wtdna(100%t,健康组织)或突变dna(癌性组织)的患者样品进行pcr循环。在琼脂糖凝胶上运行样品,并且可以在图12中显示结果。强烈的条带显示了优良的得率,其仅在通过改变不同组分优化pcr反应条件时出现。
一旦将双链pcr产物消化为单链dna(靶标链含有硫代磷酯引物以防止消化),则将样品提交测序。可以在图13和14中显示结果。在图中,用圆圈表示恶性黑色素瘤中改变的snp位置。在wtdna中,t碱基占据所述位置(图13),然而来自肿瘤组织的dna显示由于brafv600e突变的杂合性(参见上文),由a和t两者占据(图14)。因此,这些结果确认pcr产物中单链dna的修正序列对于来自健康组织的dna是100%t的,或者(推测上)对于来自完全癌性组织的dna是50%t和50%a的。
4.3pcr产物的荧光研究
下一个任务是确定snp检测技术对于通过来源于患者样品的基因组dna的pcr扩增所获得的样品是否可行。荧光研究需要至少等摩尔浓度的braf探针和靶标pcr产物,理想地,过量的产物以保证探针完全结合。然而,发现在pcr循环之后,将链消化为ssdna,然后最终纯化,得率降低了约85%。因此,在消化步骤之后进行了初步荧光研究,而未进行任何进一步的纯化步骤。
可喜地,数据显示尽管与单独的探针相比,与wtdna的结合的蒽发光强度稍微降低,但是肿瘤组织dna提供了预期的升高(图15)。因此,数据表明snp检测规程对于来源于患者样品的dna的确是可重复的。然而,一个意外的发现是高于含有单独探针的样品的预期发光强度。实施对照实验以确定荧光升高是否是由于pcr副产物或者未纯化的pcr混合物的另一种组分所造成的;这些显示用于使t7核酸外切酶失活的甲酰胺在缓冲液中,与单独的探针(~1600个单位)相比,使得探针和反应混合物的混合物产生了更高的荧光强度(~3600个单位)。然而,如图15中的结果所示,这个问题不妨碍来自癌性和健康组织的样品的发光强度分别预期升高和降低的观察结果。
可以存在几种对于使用pcr产物的荧光升高为何不如对于合成序列的结果所预期的高的原因,其预测对于杂合(50/50)混合物,升高约150%(图12)。最可能的原因是考虑到所遇到的浓度问题,pcr靶标可能未完全过量,从而导致混合物中存在一些未结合的探针,从而降低了信号强度。作为另外一种选择,与相应双螺旋相比,甲酰胺可以对单链探针中的蒽发光强度具有更强的副作用。最终,来自癌性组织的样品可能不是完全杂合的(即50%a和50%t)。
5.结论
这些实施例已证明使用通过监测双螺旋形成时荧光团标签dna探针的发光强度变化来运行的新型杂交测定,对dna或rna靶标样品中snp(等位基因)比值定量是可能的。定量来自对靶标链混合物中snp比值的发光强度的线性相关性的验证。
测定在室温下工作并且可以适合于在标准酶标仪上使用。
已对两种不同的医学病况,阿尔茨海默氏病和癌症证明了方法。然而,在原理上,只要两种双螺旋具有显著不同的发光谱和类似的稳定性(tm值),则方法对于与医学病况有关的任何snp组合通用(在本文中,所研究的靶标均为颠换,即c/a和t/a)。
发现还表明该方法对于(i)rna靶标以及dna靶标;(ii)可以在细胞环境或血浆中应用于比率检测的固定化在金纳米颗粒表面上的探针,例如,靶标循环肿瘤dna(ctdna)和(iii)靶标中的不同序列长度,从15-聚体至>100-聚体起作用。
来源于实际患者样品的pcr产物已显示产生了相同趋势。
考虑到这些链还可以区分碱基修饰(即胞嘧啶的甲基化)以及碱基变化,该方法还可以用于表观遗传学筛选目的(即在样品内建立me-c/c比)(duprey等人,acschem.biol.,2016,11,717-721)。
与其他已知测序或检测方法(例如,rna-seq、taqman)相比,该方法的优势涉及杂合核酸样品的评价;目前,尚没有用于准确确定来自dna样品(例如,来自癌性组织区的那些中的样品)或者来自mrna转录本的等位基因比值的快速、廉价和定量的方法。实施例提供了可以通过所主张的发明解决全部三个问题的证据。
- 还没有人留言评论。精彩留言会获得点赞!