用以产生被遗传修饰来表达所选抗体的B细胞的系统和方法与流程
相关申请的交叉引用
本申请要求2017年10月20日提交的美国临时专利申请号62/575,275、2017年11月1日提交的美国临时专利申请号62/580,303以及2018年1月29日提交的美国临时专利申请号62/623,371的优先权,所述美国临时专利申请中的每一者以引用的方式整体并入本文,所述引用的程度就好像在本文中完全阐述一样。
关于序列表的声明
与本申请相关的序列表以文本格式替代纸质拷贝加以提供,并且据此以引用的方式并入说明书中。含有序列表的文本文件的名称是18-024-wo-pct_st25.txt。文本文件是184kb,于2018年10月19日创建,并且正通过efs网进行电子提交。
发明领域
本公开提供了用以对b细胞进行遗传修饰以表达所选抗体的系统和方法。所述系统和方法能够用于:免除对经典疫苗接种的需要;提供针对当前无疫苗接种可用的感染物的保护;当患者另外经受免疫抑制时提供针对感染物的保护;和/或提供由治疗性抗体诸如在治疗自体免疫病症方面提供的益处。
发明背景
疫苗被设计来通过刺激b细胞以产生针对所靶向感染物的抗体来使受试者针对特定感染的免疫性增加。常规儿科疫苗接种是一种建立已久的临床干预,伴有相比较来说较低风险和较高功效。然而,不幸的是,疫苗接种不可用于所有感染物。作为一个实例,在美国,每年有数百万儿童由于感染呼吸道合胞病毒(rsv)而就医或造访急诊室。
数十年来,研究者已试图开发可诱导b细胞以产生有效针对病毒诸如rsv、人免疫缺陷病毒(hiv)和寨卡病毒(zikavirus)进行保护的抗体的疫苗。但用以诱导保护性抗体的所有尝试都已失败。得到广泛测试的唯一rsv疫苗实际上使得感染更加恶化:在疫苗接种之后产生的抗体不使病毒丧失能力,而是反而使它感染细胞的能力增强。除rsv、hiv和寨卡病毒之外,还有许多无有效疫苗可用的其他感染物。
除抗击感染之外,抗体还可适用作针对其他疾患诸如自体免疫疾病的治疗剂。然而,这些基于抗体的疗法通常要求重复注射抗体以维持保护作用。
还值得注意的是,众多患者经受骨髓或造血干细胞移植作为针对血液恶性肿瘤(例如白血病、淋巴瘤、骨髓瘤)的治疗。其他患者接受提供患者缺乏的治疗性基因的经遗传修饰造血干细胞的输注。所有这些治疗都要求在施用移植物或经遗传修饰造血干细胞之前移除患者的现有免疫系统,从而在治疗之后在患者的免疫系统达成群体恢复之前留下危险的免疫抑制窗。在这个免疫抑制时间期间,患者极其易感于感染诸如rsv、流感、副流感和偏肺病毒(mpv)。这些感染是高风险因素,并且与在这些治疗之后的众多死亡相关联。
技术实现要素:
本公开提供了用以对b细胞进行遗传修饰以表达所选抗体的系统和方法。在特定实施方案中,所选抗体降低或免除对现有疫苗接种的需要。在特定实施方案中,所选抗体针对由当前无有效疫苗接种策略可用的病毒(例如rsv、hiv、寨卡)所致的感染进行保护。在特定实施方案中,所选抗体降低或免除对治疗性抗体注射诸如被施用来治疗各种自体免疫病症的那些的需要。在特定实施方案中,所选抗体保护免疫抑制患者免遭感染。在特定实施方案中,本公开方法可用于对b细胞进行重新编程以针对数百种不同感染物或病原体进行保护,所有重新编程都通过涵盖数天的单一实验室操作达成。
在特定实施方案中,本公开通过将遗传构建体靶向插入b细胞的内源性基因组的特定区域中来提供这些益处。重要的是,由于b细胞内的遗传序列具有为抗体多样性所需的高可变性,所以对这些细胞的遗传修饰是困难的。这个高度遗传变异性使得直接靶向抗体编码区以进行遗传操作不切实际。此外,移除和替换b细胞的基因组的编码部分也不有效,因为这个方法会负性影响b细胞功能。
关于对b细胞进行遗传修饰以表达所选抗体的额外挑战因为抗体由被称为重链和轻链的不连续蛋白质单元形成而产生。不同链由b细胞基因组的不同部分编码,然而必须集合以形成功能性抗体。
本公开通过鉴定b细胞基因组的可被可靠地靶向以进行遗传插入,以及在被修饰时导致所插入遗传构建体相比于b细胞的天然基因组的相应部分被优先表达的恒定区来克服所指示挑战以及其他挑战。这个策略克服与b细胞基因组相关的序列可变性,并且还克服对移除和替换内源性b细胞基因组的部分以实现所选抗体的功能性表达的需要。克服对移除和替换内源性b细胞基因组的部分的需要会保持在遗传操作之后的b细胞功能。
在特定实施方案中,被靶向以进行遗传插入的所指示区域是在seqidno:85(人)或seqidno:86(小鼠)的eμ增强子元件的上游或下游的内含子区域。在特定实施方案中,被靶向以进行遗传插入的区域是选自seqidno:1或2(人)或seqidno:3或4(小鼠)的恒定内含子区。在特定实施方案中,seqidno:1内的用以靶向以进行遗传插入的人dna序列包括seqidno:5-24。在特定实施方案中,seqidno:2内的用以靶向以进行遗传插入的人dna序列包括seqidno:25-44。在特定实施方案中,seqidno:3内的用以靶向以进行遗传插入的小鼠dna序列包括seqidno:45-64。在特定实施方案中,seqidno:4内的用以靶向以进行遗传插入的小鼠dna序列包括seqidno:65-84。特别能够靶向这些位点以进行遗传修饰的遗传序列在本公开内描述为引导rna(grna)seqidno:87-89以及290-366。
在特定实施方案中,所插入遗传构建体的放置和组分导致所述所插入遗传构建体相比于b细胞的内源性基因组的相应部分被优先表达。这些实施方案还包括克服与抗体的部分由内源性b细胞基因组的不同区域编码相关的挑战的元件。
在特定实施方案中,遗传构建体被插入seqidno:1、2、3和4中的一者中,并且包括(i)启动子;(ii)信号肽;(iii)编码所选抗体的整个轻链的转基因;(iv)柔性接头或跳跃元件;(v)所选抗体的重链的可变部分;和(vi)导致b细胞的内源性重链恒定区的表达的剪接接合点。在这些实施方案中,以单一构建体形式表达所选抗体会克服与抗体的部分由内源性b细胞基因组的不同区域编码相关的挑战。对柔性接头的包括使所表达所选抗体的轻链部分和重链部分以允许它们形成功能性单元,并且同时使抗体部分与来自b细胞的内源性基因组的其他潜在表达的抗体链结合的风险降低的方式进行物理连接。对跳跃元件的使用不使轻链部分和重链部分进行物理连接,但它们以紧密邻近方式进行的表达也导致缔合以形成功能性单元,同时使抗体部分与来自b细胞的内源性基因组的其他潜在表达的抗体链结合的风险降低。对剪接接合点的包括导致所选抗体包括适合于b细胞的当前活化和/或成熟状态的重链恒定区。换句话说,可表达具有b细胞的内源性重链恒定区中的任一者的所选所表达抗体,并且与所选抗体一起表达的重链恒定区可天然地随时间而变化。
本公开还提供了用以确保仅有已被有效遗传修饰来表达所选抗体的b细胞被收集以进行配制和向患者施用的方法。举例来说,在遗传修饰之前,b细胞将天然地表达包括κ轻链或λ轻链的抗体。b细胞可被修饰来表达不同于它天然地表达的κ或λ链的轻链,并且仅有表达替换链的那些b细胞被选择进行配制和施用。
本公开还提供了用以有效修饰b细胞以提供本文所述的益处的众多额外策略。这些和其他策略更充分描述于以下具体实施方式中。
附图说明
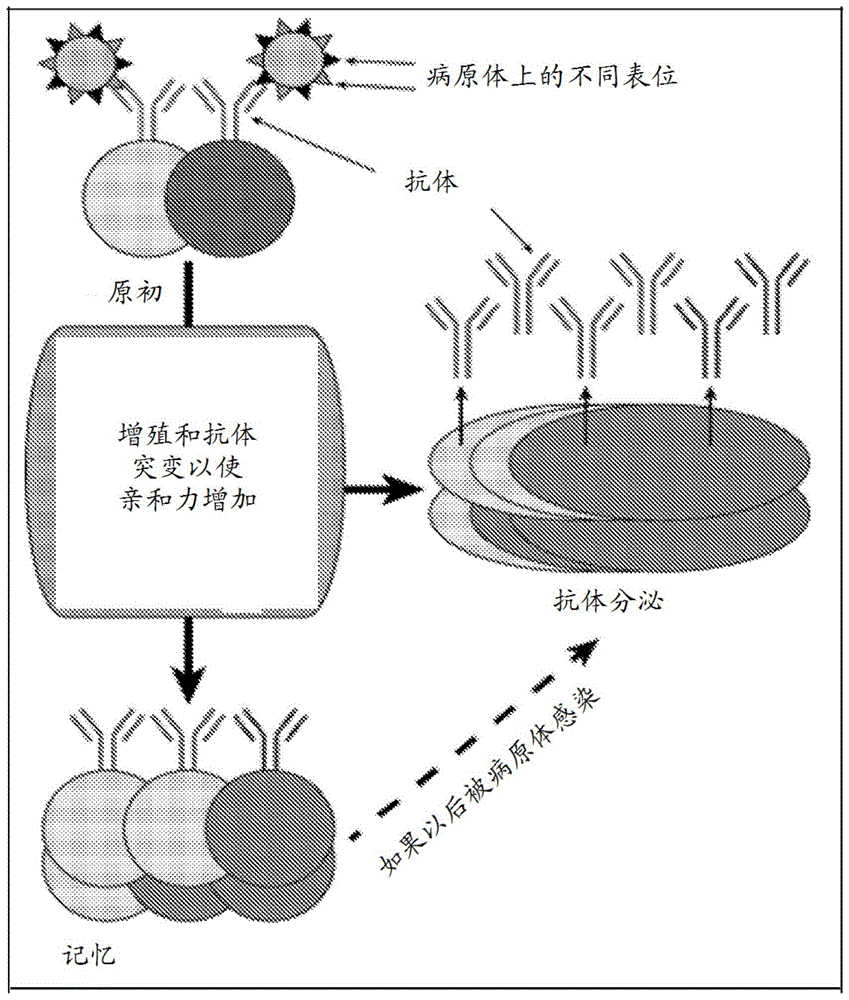
图1.对经典疫苗接种策略的b细胞应答的示意图。
图2a-图2c.针对呼吸道合胞病毒(rsv)的先前技术疫苗接种策略的示意图:(图2a)福尔马林(formalin)失活rsv疫苗;(图2b)“改进”rsv疫苗;以及(图2c)rsv表位骨架疫苗。
图3a-图3c.用以绕过疫苗接种以及直接提供针对rsv的保护性抗体的先前尝试的概述:(图3a)帕利珠单抗(palivizumab)注射;(图3b)腺病毒介导的帕利珠单抗表达;以及(图3c)干细胞遗传修饰和分化。
图4a、图4b.本文公开的保护策略的特定实施方案的示意图:(图4a)用以针对rsv进行保护的b细胞修饰;以及(图4b)用于同时保护的策略。
图5.在存在以及不存在感染下由b细胞亚型对帕利珠单抗的假设分泌。
图6a、图6b.(图6a)抗体基因和(图6b)抗体蛋白质的结构,从而强调本公开的技术挑战:抗体是由两个单独基因产物制得的蛋白质。在特定实施方案中,本文公开的编码所选抗体的合成遗传构建体利用跳跃元件(例如自裂解肽)来解决这个挑战。
图7.描绘内源性重链基因座的示意图,所述基因座包括进行重组的v、d和j区段、显示为圆圈和卵形的增强子元件、以及6个可被表达的潜在恒定区。b细胞通过表达μ/δ恒定区来起始,但可通过使间插dna缺失来转换成使用γ、α或ε恒定区。还应注意每个v区段与由箭号表示的在重组之后驱动重链的表达的重链启动子相关联。
图8a、图8b.因为两个蛋白质集合以形成抗体,所以可合乎需要的是靶向或失活b细胞的内源性抗体重链(igh)和/或内源性抗体轻链(igl)。在不存在所述靶向或失活下,可形成非所需杂合抗体(即内源性轻链与所选抗体重链配对,或反之亦然)。(图8a)一种用于达成内源性igh靶向的方法,并且所得嵌合体包括所选抗体(例如帕利珠单抗)的部分。(图8b)一种用于达成igl失活的方法。在所描绘方法中,终止密码子可放置在所插入遗传构建体的上游(或作为所插入遗传构建体的一部分)。
图9.描绘重链增强子与(上部)内源性vdj或(下部)由所插入遗传构建体编码的合成vdj的相互作用的示意图。启动子描绘成箭号。核酸描绘成框。b细胞天然地表达在最靠近eμ增强子的启动子的下游的核酸。在图9中描绘的内源性b细胞基因组中,最靠近eμ增强子的第一上游启动子于是驱动内源性重链vdj区段的表达。在eμ增强子与第一内源性启动子之间插入包括启动子的遗传构建体导致b细胞表达所插入遗传构建体而非内源性重链vdj区段。这个所插入基因可为重链的vdj可变区、连同重链可变vdj一起的配对完全抗体轻链、或能够以与b细胞重链恒定区的融合物形式表达的另一合成基因。在图9中,单独地表示恒定区以强调所插入遗传构建体可与潜在重链恒定区中的任一者一起表达。
图10.用于插入的靶标区域(人)。用于达成遗传构建体向基因组中插入的区域:1号:从末端j区(人中的ighj6,小鼠中的ighj4)至eμ增强子,或2号:从eμ增强子至恒定结构域转换区域的重复序列。
图11a、图11b.(图11a)人eμ内含子增强子(seqidno:85)和用以靶向以进行遗传插入的包括从ighj6至eμ内含子增强子的人dna序列(seqidno:1);(图11b)示例性相关grna(例如sgrna)靶标位点(seqidno.5-24)和grna序列(seqidno:88、89以及290-307)。
图12a、图12b.(图12a)用以靶向以进行遗传插入的包括从eμ内含子增强子至转换区域的人dna序列(seqidno:2);(图12b)示例性相关grna(例如sgrna)靶标位点(seqidno.25-44)和grna序列(seqidno:308-327)。
图13a、图13b.(图13a)小鼠eμ内含子增强子(seqidno:86)和用以靶向以进行遗传插入的包括从ighj4至eμ内含子增强子的小鼠dna序列(seqidno:3);(图13b)示例性相关grna(例如sgrna)靶标位点(seqidno.45-64)和grna序列(seqidno:87以及328-346)。
图14a、图14b.(图14a)用以靶向以进行遗传插入的包括从eμ内含子增强子至转换区域的小鼠dna序列(seqidno:4);(图14b)示例性相关grna(例如sgrna)靶标位点(seqidno.65-84)和grna序列(seqidno:347-366)。
图15a、图15b.图15a是描绘利用crispr/cas9基因编辑系统将编码抗rsv抗体的遗传构建体插入内源性重链基因座中的示意图。遗传构建体可包括是与在插入位点处的基因组dna同源的核苷酸突出部分的同源臂或同源缝线。图15b描绘dna修复模板的额外实例,所述模板包括由与cas9/sgrna对基因组的切割相呼应的侧接于所插入序列的用以产生双链dna断裂的sgrna靶标位点侧接的序列(上部)、含有侧接于所插入序列的长同源臂(中部)以及通过dna寡聚物的退火产生的侧接于所插入序列的短同源臂(下部)的单链dna。
图16.描绘:(上部)用编码抗rsv抗体的重链可变区的遗传构建体加以修饰的经修饰重链基因座;(中部)用编码抗rsv抗体的轻链可变区的遗传构建体加以修饰的经修饰轻链基因座;以及(下部)用编码抗rsv抗体的轻链(即igl)和抗rsv抗体的重链可变区,其中在所述轻链与所述重链可变区之间具有接头(包括strep-tag)的遗传构建体加以修饰的经修饰重链基因座的示意图。
图17.由如本文公开的经修饰记忆b细胞和经修饰抗体分泌性b细胞针对多种病原体进行同时保护的示意图。
图18a-图18c.对小鼠和人b细胞中的所靶向内含子区域的高效cas9切割。用cas9/sgrna核糖核蛋白复合物进行的电穿孔介导小鼠和人b细胞中的有效切割。用cas9/sgrna复合物对细胞进行电穿孔。在电穿孔后3天利用通过分解对插入缺失进行追踪(tide)来评估(图18a)小鼠b细胞株系(a20);(图18b)原代b细胞;和(图18c)人b细胞株系(ramos)中的编辑效率。
图19.编码rsv特异性抗体的遗传构建体向小鼠b细胞中的插入。
图20.对经遗传修饰b细胞的富集和分析。
图21.经遗传修饰b细胞分泌rsv结合抗体。
图22a、图22b.非同源性末端接合(nhej)和微同源性介导的末端接合(mmej)方法提供长同源性引导的修复(hdr)的用于对原代小鼠b细胞进行基因组工程改造的替代方案。(图22a)对原代b细胞进行致敏24小时,与腺相关病毒(aav)共孵育12小时,洗涤,并且加以电穿孔或直接转移至二级培养中,持续3天,随后分析mcherry表达。(图22b)对原代b细胞进行致敏24小时,加以模拟电穿孔,或用模板+cas9/sgrna加以电穿孔,并且转移至二级培养中,持续5天,随后分析mcherry表达。
图23a-图23e.编码功能性抗体的新型遗传构建体向小鼠和人b细胞株系中的插入使得能够表达表面结合型和分泌型抗体。(图23a)igh基因座的显示部分抗体构建体的插入位点的图解,以及对表面结合型和分泌型抗体的描绘。emab=合成抗体,在本文中可与synab互换使用。(图23b)用rsv融合前f蛋白四聚体(rsv-四聚体)和抗streptagii四聚体(αtagab四聚体)对未修饰或经抗rsv合成抗体(αrsvsynab)修饰小鼠a20b细胞株系的染色。(图23c)用rsv融合前f蛋白四聚体和抗streptagii抗体四聚体对未修饰或经抗rsvsynab修饰人ramosb细胞株系的染色。(图23d)关于由未修饰或经抗rsvsynab修饰a20细胞培养物的培养基获得的抗体与rsv融合前f蛋白的结合的elisa。帕利珠单抗用作阳性对照。(图23e)关于由未修饰或经抗rsvsynab修饰ramos细胞培养物的培养基获得的抗体与rsv融合前f蛋白的结合的elisa。帕利珠单抗用作阳性对照。
图24a–图24c.具有新型特异性的原代小鼠b细胞的产生。(图24a)在富集之前用抗streptagii四聚体(左侧图版)以及在富集和扩增之后用抗streptagii四聚体(中间图版)和rsv融合前病毒蛋白质四聚体(右侧图版)对模拟处理小鼠b细胞株系(上部)或经抗rsvsynab修饰小鼠b细胞株系(下部)的表面染色。(图24b)关于由未修饰或经抗rsvsynab修饰小鼠b细胞培养物的培养基获得的抗体与rsv融合前f蛋白的结合的elisa。帕利珠单抗用作阳性对照。抗体结合用多克隆抗人ig抗体和结合于hrp的抗小鼠ig抗体的1:1混合物检测。(24c)与3t3-cd40l饲养细胞和il-21一起培养的经富集bsynab细胞的快速扩增。
图25a-图25i.示例性序列。(图25a)示例性sgrna序列(seqidno:87、88、89)、基因组同源区(seqidno:90-95)以及拼接寡核苷酸(seqidno:96-101);(图25b)人抗rsvemabaav(2531bp(seqidno:102)以及相关核苷酸和蛋白质序列(seqidno:110-126、280、285));(图25c)小鼠抗rsvemabaav(3134bp(seqidno:103)以及相关核苷酸和蛋白质序列(seqidno:127-141、281、286));(图25d)小鼠emab-rsv-dsdna(1736bp(seqidno:104)以及相关核苷酸和蛋白质序列(seqidno:142-144));(图25e)人emab-vrc01-aav(2551bp(seqidno:105)以及相关核苷酸和蛋白质序列(seqidno:145-152、282、287));(图25f)人-emab-medi8852-aav(2544bp(seqidno:106)以及相关核苷酸和蛋白质序列(seqidno:153-160、283、288));(图25g)人-emab-amm01-aav(2555bp(seqidno:107)以及相关核苷酸和蛋白质序列(seqidno:161-169、284、289));(图25h)balb/cmrsv拼接整合序列(2261bp(seqidno:108)以及相关核苷酸和蛋白质序列(seqidno:170-172));以及(图25i)tt-hrsv-t7整合序列(1707bp(seqidno:109)以及相关核苷酸和蛋白质序列(seqidno:173-175))。
图26a-图26d.(图26a)在eμ增强子上游的用于插入新抗体盒的所靶向区域;通过靶向这个区域,所插入emab基因可由天然的(但为所插入的)igh启动子驱动,从而使对免疫球蛋白表达的天然控制最大化。为使得能够达成一击插入以及使脱靶相互作用最小化,emab构建体以单链融合物形式表达。这个融合物由完全轻链序列以具有57个氨基酸的甘氨酸-丝氨酸接头连接于重链的可变区组成。以物理方式连接轻链和重链使所插入emab与内源性轻链之间的错误配对的可能性最小化。优化剪接接合点允许emab剪接于下游内源性igh恒定区。这允许emab以重链同种型类别中的任一者表达。(图26b)伯基特淋巴瘤(burkitts-lymphoma)源性b细胞株系天然地表达与λ轻链配对的igm的表面形式和分泌形式。使用单体rsv-f蛋白和streptactin检测源于帕利珠单抗的经工程改造αrsv-emab的表达,所述streptactin是一种对接头中的streptagii基序具有高亲和力的经修饰链霉亲和素。经αrsv-emab修饰ramos细胞表达可在细胞的表面上检测到的经工程改造rsv特异性抗体。(图26c)经工程改造rsv特异性抗体还以分泌形式在上清液中检测到。(图26d)经αrsv-emab修饰细胞而非对照细胞应答于蛋白质抗原展现快速和持续的钙信号传导。
图27a-图27g.人b细胞通过配对的cas9-sgrna以及aav模板递送而被高效遗传修饰来表达单链emab。(图27a)人细胞工程改造过程的图示。第0天:从pbmc分离b细胞,并且用cd40l、il2、il10、il15和cpg寡核苷酸致敏。第2天:将细胞用cas9/sgrnarnp加以电穿孔,并且在电穿孔后1小时用编码emabhr模板的aav处理,随后如对于第0天所述进行培养。第4天:关于抗原结合或标签表达来选择细胞。第4-15l天:在表达cd40l、il2和il21的经照射饲养细胞上,在补充以il15的情况下使所选细胞扩增。第15-18天:在采用il6、il15和ifnγ的情况下,将细胞转换成无饲养细胞分化培养。(图27b)来自6个独立pbmc供者的用emab靶向cas9/sgrnarnp处理的b细胞中的插入缺失频率。(图27c)跨越靶向sgrna位点的具有某一报告频率的所有人snp。(图27d)关于在培养的第4天时rsv-f融合前单体与所培养对照或经rsv-emab遗传修饰人b细胞的结合的代表性facs。(图27e)在对来自6个独立供者的b细胞进行工程改造之后,rsv-emabb细胞的频率。(图27f)关于在致敏细胞(第2天)以及体外分化细胞(第18天)的情况下,浆细胞标志物(cd19、cd27、cd38和cd138)的facs。(图27g)关于在培养的第18天时对照b细胞或流感靶向medi8852-emabb细胞的培养基中的分泌型抗ha主干抗体的elisa。
图28.单链emab是一种用于表达抗病毒抗体的灵活平台。将人b细胞加以模拟电穿孔(对照b,上部横行),或用源于所指示广泛中和性抗体构建体的可变区和人κ(帕利珠单抗、vrc01和medi8852)或λ(amm01)轻链的emab构建体加以遗传修饰(下部横行)。对照和经emab工程改造细胞用源于所指示病原体的匹配抗原:rsv-f单体,或hiv-env、ebvgh/gl或ha主干的四聚体加以染色。
图29a-图29d.emab在有效igh等位基因上的插入可阻断内源性igh产生。(图29a)ramosigh等位基因的图解:一个有效等位基因含有emab靶标位点,并且一个等位基因具有c-myc易位,从而消除emab靶标位点。(图29b)显示在输入ramos细胞(关于cd79b+进行门控)和经αrsv-emab工程改造ramos细胞(关于cd79b+/rsv-f+进行门控)的情况下,λ轻链的表面表达和rsv-f抗原结合的流式细胞计量术。(图29c)原代igh等位基因的图解:一个有效等位基因,以及一个不具有功能性重组vdj的非有效等位基因,所述等位基因两者均含有emab靶标位点。(图29d)显示在输入经分选λ轻链+b细胞(关于cd79b+进行门控)和经αrsv-emab工程改造b细胞(关于cd79b+/rsv-f+进行门控)上,λ轻链的表面表达和rsv-f抗原结合的流式细胞计量术。
图30a-图30e.用αrsv-emab盒对原代小鼠b细胞的工程改造。(图30a)小鼠b细胞工程改造过程的图示。第0天:通过负性选择从脾和外周淋巴结(pln)分离b细胞,并且用cd40l-ha、抗hamab和il4致敏。第1天:将细胞用cas9/sgrnarnp连同dsdna一起加以电穿孔(dsdna条件),或用单独cas9/sgrnarnp加以电穿孔,随后在电穿孔后1小时用含有emabhr模板的aav处理(aav条件)。接着如对于第0天所述来在培养中维持细胞。第3天:关于抗原结合或标签表达来选择细胞。第4-8l天:在表达cd40l的经照射饲养细胞上,在补充以il-21的情况下使所选细胞扩增。(图30b)用igh靶向cas9/sgrnarnp处理的b细胞中的插入缺失百分比。(图30c)关于在对照b细胞或使用dsdna或aav模板工程改造的emabb细胞的情况下,与单体融合前rsv-f蛋白的结合的代表性facs。(图30d)用dsdna或aav模板工程改造的b细胞中的emab细胞的频率。(图30e)对照b细胞或使用dsdna或aav模板工程改造的b细胞的上清液中的抗rsv特异性分泌型抗体。
图31a-图31d.由经工程改造αrsv-emabb细胞达成的免遭病毒性感染的保护。(图31a)由转移的emab细胞达成的抗病毒保护的图示。第0天:通过腹膜内注射转移1.5x107个经富集rsv-emabb细胞。第5天:在15mg/kg下进行帕利珠单抗腹膜内注射。第6天:抽取血液以测量抗病毒ab效价。第7天:用106pfursv病毒进行鼻内激发。第12天:测量肺中的病毒效价。(图31b)在转移rsv-emab细胞之前或之后24小时,以rsv-f单体和streptactin标签结合测量的rsv-emab受体的表面表达。(图31c)在第6天时小鼠中的αrsv-f抗体的血浆效价。(图31d)不具有转移细胞,具有αrsv-emabb细胞,具有对照b细胞,或在感染之前48小时在腹膜内递送15mg/kg帕利珠单抗的小鼠的肺中的rsv病毒效价。
图32a、图32b.人抗体分泌性细胞向nsg小鼠的多路转移。(图32a)人emabb细胞向nsg小鼠中转移的示意图。第0天:通过腹膜内注射来转移如图27中所述加以产生的5×106个抗流行性感冒emabb细胞和5×106个抗rsvemabb。第7天:抽取血液以测定血清中的抗体产生。(图32b)关于相对于对照血清(无转移),接受emab细胞的小鼠中的抗rsv-f抗体和抗ha主干抗体的血清效价(双重转移)的elisa。
图33a、图33b.用于向小鼠(图33a)和人(图33b)igh基因座中进行emab盒的长型插入的模板。在每个基因组的上部横行上指示的是种系igh基因座中的元件的位置,所述元件包括最终j区、eμ内含子增强子元件以及μ恒定结构域的开始。指示了cas9/sgrna靶标位点的位置(切割位点)。在下方显示的是包括在小鼠aav和dsdna构建体(图33a)以及人aav构建体(图33b)中的靶向同源臂的位置。还显示的是如在基因组中插入的emab盒。
具体实施方式
疫苗被设计来通过刺激b细胞以产生针对所靶向感染物的抗体来使受试者针对特定感染的免疫性增加。抗体是可提供针对病原体的保护的蛋白质。抗体可结合病原体,并且当这个结合干扰病原体的正常功能时具有保护性。举例来说,许多保护性抗体结合病原体的阻断所述病原体进入细胞的部分。抗体可连接于b细胞的表面(被称为b细胞受体),但在分泌至血液中时施加它们的大部分保护性功能。
病原体可指可导致疾病的任何物质,并且病原性可指物质导致疾病的能力。病原体的实例包括可感染宿主并导致疾病的病毒、细菌和真菌。病原体的其他实例包括导致疾病的宿主源性蛋白质或其他宿主源性物质,诸如作为一种与众多自体免疫疾患(例如关节炎)相关的炎症性分子的肿瘤坏死因子α(tnfα)以及作为在阿尔茨海默氏病(alzheimer’sdisease)期间在脑中积累的纤维蛋白的β淀粉样蛋白斑块。在特定实施方案中,癌细胞和/或肿瘤也可基于它们导致疾病的能力而被称为病原体或病原性物质。
在暴露于疫苗或天然病原体后,提供在疫苗中和/或存在于病原体上的表位可结合存在于原初b细胞上的b细胞受体。这个结合可导致b细胞的活化以及保护性抗体的产生。
原初b细胞是指在它已与它的表位接触之前的b细胞。每个原初b细胞表达具有独特表位特异性的独特抗体。由每个原初b细胞表达的独特抗体通过遗传重组随机产生。原初b细胞表达膜结合型抗体(即b细胞受体),并且在表位结合后,可快速增殖。在增殖和成熟期间,抗体基因经受体细胞突变,此用于使表位结合的亲和力增加。在b细胞成熟期间发生的表位结合亲和力增加为针对病原体的有效保护所需。单一原初b细胞能够经受几十次细胞分裂以产生数千个表达相同抗体或已被突变来使与病原体的结合改进的相关抗体的抗体分泌性b细胞和记忆b细胞(图1)。
除活性抗体分泌性b细胞之外,记忆b细胞对于针对病原体的保护也是重要的。记忆b细胞通常不主动分泌抗体,但可快速分化成抗体分泌性细胞。记忆b细胞快速分化成抗体分泌性细胞可帮助免疫系统发动对二次感染或先前已通过疫苗接种遭遇的病原体的快速应答(mcheyzer-williams等,natrevimmunol.2011;12(1):24-34;taylor等,trendsimmunol.2012;33(12):590-7)。举例来说,当由抗体分泌性b细胞产生的抗体的水平已减弱时,记忆b细胞维持针对乙型肝炎病毒的保护(williams等,vaccine.2001;19(28-29):4081-5;bauer等,vaccine.2006;24(5):572-7)。因此,成功疫苗刺激全都能够表达以高亲和力结合病原体上的表位的抗体的抗体分泌性b细胞和长命记忆b细胞的产生。
不幸的是,有许多无疫苗可用的感染物。无可用有效疫苗策略的感染物的实例包括rsv、hiv和寨卡病毒。
关于rsv,在1960年代发生的福尔马林失活rsv疫苗的灾难性失败可能不归因于未能诱导靶向rsv的抗体分泌性b细胞和记忆b细胞。有可能的是疫苗诱导了不中和rsv,而是反而使rsv感染增强的抗体的产生(图2a)(blanco等,humvaccin.2010;6(6):482-92;broadbent等,influenzaotherrespirviruses.2015;9(4):169-78)。这强调疫苗必须实现的微妙平衡:诱导产生靶向某些表位的“保护性”抗体,同时避免刺激产生靶向不正确表位的“病原性”抗体(图2a)。
在2015年对世界卫生组织国际临床试验登记平台(worldhealthorganizationinternationalclinicaltrialsregistryplatform)的分析鉴定了自从2008年以来在临床上评估的9种候选rsv疫苗,所述疫苗都未进展超过2期测试(broadbent等,influenzaotherrespirviruses.2015;9(4):169-78)。在这些试验之中,仅有三个试验已完成,并且仅有一个试验已报告结果。称为medi-559的那个疫苗似乎使rsv感染减轻,但呼吸道症状对于进一步测试来说是过高的(malkin等,plosone.2013;8(10):e77104)。这些数据表明尽管medi-559诱导了保护性抗体的产生,但它可能还诱导了病原性抗体的产生(图2b)。
其他“改进”疫苗接种策略涉及改变向患者施用的制剂。这些包括用以使病毒失活/减毒的替代性方法,以及对佐剂进行的旨在使炎症性应答增加的改变(broadbent等,influenzaotherrespirviruses.2015;9(4):169-78;garg等,thejournalofgeneralvirology.2014;95(pt5):1043-54;swanson等,jvirol.2014;88(20):11802-10;widjaja等,plosone.2015;10(6):e0130829;stewart-jones等,plosone.2015;10(6):e0128779)。这些方法中的一些已在动物模型中产生保护性抗体增加,但诱导病原性抗体的可能性使得有可能这些“改进”rsv疫苗将遭受与medi-559相同的命运。
为试图使对由保护性抗体靶向的表位的免疫应答聚集,一种新近方法已在于将单一rsv表位移植于非rsv骨架上(图2c)。这个方法消除对其他rsv表位具有特异性的病原性抗体的可能性,因为它们不存在于骨架中。用rsv表位骨架对恒河猴(rhesusmacaque)的疫苗接种导致由一些动物产生中和抗体,但仅在3-5次注射之后(correia等,nature.2014;507(7491):201-6)。
还已开发了用以绕过疫苗接种以及直接提供保护性抗体的方法。针对rsv的唯一临床核准防治性治疗是注射高亲和力rsv特异性保护性抗体帕利珠单抗(图3a)(thepreventstudygroup.pediatrics.1997;99(1):93-9;theimpact-rsvstudygroup.pediatrics.1998;102(3pt1):531-7)。不幸的是,历经5个月的一系列帕利珠单抗的$10,000花费已限制它用于处于重度rsv感染的高风险下的儿童(meissner和kimberlin,pediatrics.2013;132(5):915-8)。被设计来持续多达1年的其他rsv特异性抗体当前正经受临床评估(influenzaotherrespirviruses.2015;9(4):169-78)。然而,每年进行抗体再注射对于达成终生保护不切实可行。
为消除对终身注射的需要,已开发了其中腺病毒载体用于将编码保护性抗体的基因转移至肌肉细胞中的方法(图3b)(schnepp和johnson,curropinhivaids.2014;9(3):250-6)。有前景的是,腺病毒介导的帕利珠单抗表达部分地保护小鼠免遭rsv感染(skaricic等,virology.2008;378(1):79-85)。然而,这个方法的限制是制造实现抗体的保护性水平所必需的高剂量的病毒的成本较高(24)。高剂量是必需的,因为相较于由单一b细胞每秒分泌估计10,000个抗体,由肌肉细胞对抗体的表达是低下的(helmreich等,jbiolchem.1961;236:464-73;hibi和dosch,eurjimmunol.1986;16(2):139-45)。b细胞通过对它们的蛋白质产生机构进行完全重新编程以聚焦于抗体分泌来实现这个高分泌速率。在制造能力方面无重大改变的情况下,腺病毒介导的向肌肉细胞中的抗体基因转移不是用于rsv预防的实际可行选项。
另一方法使用慢病毒载体来将编码保护性抗体的基因并入造血干细胞的基因组中,所述造血干细胞将随后被诱导以分化成抗体分泌性b细胞(图3c)。这个方法的一个限制是抗体基因插入是随机的,此会引入导致疾病的脱靶遗传效应的风险。这个方法的第二限制是从造血干细胞诱导抗体分泌性细胞的分化需要长久的两个月体外培养条件(luo等,blood.2009;113(7):1422-31)。最后限制是这个策略将不产生可在感染后得以加强的抗体源。因此,如果抗体分泌性细胞不以较高数目存在或不是长命的,那么针对感染的保护将是不充分的。
在特定实施方案中,本公开通过对b细胞进行遗传工程改造以表达所选抗体(例如针对感染物的抗体(例如帕利珠单抗;图4a))来提供绕过疫苗接种和/或消除对重复治疗性抗体注射的需要。特别可用于遗传工程改造的b细胞的类型包括现有抗体分泌性b细胞、记忆b细胞、原初b细胞、b1b细胞和边缘区b细胞。原初b细胞具有最大增殖和功能性潜力,并且可进入生发中心应答以及改进它们的结合能力。b1b细胞表达bcr,并且迁移至不同位置诸如腹膜腔。b1b细胞在通过bcr刺激后快速分化成抗体分泌性细胞,并且不需要用于t细胞的信号来达成最优功能。边缘区b细胞主要位于脾的边缘区中,并且在通过bcr刺激后快速分化成抗体分泌性细胞。边缘区b细胞也不需要来自t细胞的信号来达成最优功能。对这些b细胞子组中的一者或多者进行遗传工程改造可产生用以治疗进行性或即刻感染的基线水平的抗体,以及在未来再感染的情况下的长命诱导性抗体源。图4b显示利用本公开的教义的用于针对众多病原体进行同时保护的相关策略,而图5描绘在存在以及不存在感染下由示例性b细胞亚型对帕利珠单抗的假设分泌。
本公开通过将包括转基因的遗传构建体插入内源性抗体基因座中来提供对b细胞的遗传工程改造,所述基因座被特定选择以利用内源性b细胞基因组的结构和功能。举例来说,将编码所选抗体的至少一部分的转基因插入内源性抗体基因座中可允许通过利用内源性抗体表达调控机构来稳健产生所述所选抗体。转基因可指编码外来(即外源性)蛋白质的一段dna。遗传构建体可指意图用于引入细胞中以允许表达外来蛋白质的经人工构建核酸区段。
在特定实施方案中,本公开提供了被修饰来表达所选抗体的b细胞。抗体由两个基因即重链基因和轻链基因产生。通常,抗体包括重链的两个相同拷贝以及轻链的两个相同拷贝(参见例如图6b)。重链是两个亚单位中的较大亚单位,并且每个重链包括vdj区段和恒定区(在图6b中显示为“c”)。vdj区段(或vdj)是指编码抗体重链的结合病原体上的表位的独特部分的v、d和j基因区段的独特配对。因此,v是指基因区段中的与d和j区段随机配对以编码抗体重链的结合病原体上的表位的独特部分的一者。类似地,d是指基因区段中的与v和j区段随机配对以编码抗体重链的结合病原体上的表位的独特部分的一者。最后,j是指基因区段中的与v和d区段随机配对以编码抗体重链的结合病原体上的表位的独特部分的一者。存在可以多种不同组合形式集合以形成特定重链的特定vdj区段的若干v区段、d区段和j区段(参见例如图7)。
每个b细胞仅使单一vdj组合与保守恒定c区配对以形成全长重链。重链c区可与其他免疫蛋白诸如fc受体相互作用以使其他免疫细胞活化。所有原初b细胞都表达相同c区区段,但可在活化之后变为表达不同c区区段,并且不同c区赋予抗体不同功能。举例来说,一个c基因区段编码ε,并且表达ε的抗体是“ige”。ige型抗体结合身体的细胞,并且经常介导过敏反应。表达αc区的抗体是iga抗体;表达γc区的抗体是igg抗体,并且表达μc区的抗体是igm抗体。人基因组包括存在于染色体14上的单一重链基因座。
再次参照图6b,抗体的轻链(igl)包括可变区和恒定区。轻链可变区包括v和j基因区段,并且轻链恒定区可包括单一免疫球蛋白恒定结构域。人表达两种不同轻链:igκ,所述igκ由染色体2上的免疫球蛋白κ基因座编码;以及igλ,所述igλ由染色体22上的免疫球蛋白λ基因座编码。
图6a描绘编码igh链和igl链的内源性b细胞基因组的示意图。图8a和图8b描绘本公开的外源性遗传构建体可插入在何处以实现所选抗体的表达的初始示意图。图8a描绘将包括[终止信号、所选抗体(在此处是pv)的igl链、跳跃元件(在此处是2a)、以及重链的vdj区段]的遗传构建体插入内源性igh基因组中内源性vdj区段与内源性c区编码区段之间。这个方法导致表达整个外源性igl链、重链的外源性vdj区段、以及重链的内源性c区。表达包括内源性c区的抗体可为有用的,例如因为这可允许经修饰b细胞基于天然b细胞活化和成熟状态来调节c区表达。举例来说,重链基因座的恒定区中的选择性剪接可允许经修饰b细胞在表达膜结合型抗体与表达分泌型抗体之间进行转换。这个方法还允许在不需要切除内源性vdj的情况下表达外源性vdj。这个特征是有益的,因为vdj是相对大型的dna区段,并且它的切除可负性影响细胞功能。
图9描绘具有关于内源性b细胞基因组的结构和功能,以及本公开如何利用这个结构和功能来实现所选抗体的表达的更多细节的类似示意图。启动子区域为实现基因区段的转录所必需。重链可变区(vh)启动子选择性地在b细胞谱系中具有活性,并且包括在转录起始位点的100碱基对(bp)内的tata框、inr元件和八聚体元件。vh启动子活性处于由内源性b细胞基因组的eμ增强子元件(灰色卵形)和位于重链基因座的3’末端,邻近于重链α恒定基因的增强子元件(灰色圆圈)达成的邻近性依赖性调控下。eμ增强子元件是在免疫球蛋白重链基因座的j重链区段与cμ(mu)区段之间的700bp内含子内的dna内含子区域(长度是40至1500bp)。它可结合活化蛋白以使重链基因的转录增加或活化。人eμ增强子元件的序列以seqidno:85提供于图11a中。小鼠eμ增强子元件的序列以seqidno:86提供于图13a中。
将包括vh启动子的遗传构建体插入在内源性重链可变区与内源性eμ增强子之间可降低或阻断由内源性vh启动子所致的转录活化,因为eμ增强子将使转录在最邻近上游启动子处起始。以这个方式,内源性vdj的表达可被阻断而不需要移除这种大型dna区段(如所指示,所述移除对于细胞功能和存活来说是有问题的)。在特定实施方案中,vdj重组移除vh启动子与eμ增强子之间的遗传物质,此使增强子位于离本文公开的遗传构建体的外源性启动子具有适当距离处以从所插入遗传构建体中的启动子开始使转录活化。在特定实施方案中,不移除内源性遗传物质。在特定实施方案中,移除少于50个碱基对。在特定实施方案中,外源性遗传构建体内的vh启动子包括igk或igl的天然轻链启动子、天然人igh启动子、脾病灶形成性病毒启动子sffv、j558h10启动子或igvh1-69启动子。
图10提供用于遗传构建体插入的靶标区域的另一示意图。这些靶标区域涵盖存在于所有b细胞中的两个保守区域:从末端j基因区段(在人中是ighj6,在小鼠中是ighj4)至重链内含子增强子(eμ),以及从eμ至与dna转换重组相关的重复序列。
在特定实施方案中,内源性b细胞基因组的被靶向以插入遗传构建体的区域在seqidno:85或86的eμ增强子的上游。图11a-图14b提供可被靶向以进行遗传构建体插入来实现如本文公开的所选抗体的表达的特定序列。
图11a提供ighj6至eμ内含子增强子的人dna序列(seqidno:1;>hg38_dna范围=chr14:105862523-1058632445'添凑=03'添凑=0链=-重复屏蔽=无)。图11b提供这个序列内的用以靶向的包括seqidno:5-24的示例性范围(例如grna位点)以及相关grna序列(seqidno:88、89以及290-307)。作为实例,在特定实施方案中,seqidno:88的sgrna(也参见图25a)可用于靶向seqidno:7的grna位点。在特定实施方案中,seqidno:89的sgrna(也参见图25a)可用于靶向seqidno:10的grna位点。
图12a提供区域2的人dna序列:eμ内含子增强子至转换区域(seqidno:2;>hg38_dna范围=chr14:105860383-1058616905'添凑=03'添凑=0链=-)。图12b提供这个序列内的用以靶向的包括seqidno:25-44的示例性范围(例如grna位点)以及相关grna序列(seqidno:308-327)。
图13a提供区域1的小鼠dna序列:从ighj4至eμ内含子增强子(seqidno:3;>mm10_dna范围=chr12:113427973-1134285545'添凑=03'添凑=0链=-重复屏蔽=无)。图13b提供这个序列内的用以靶向的包括seqidno:45-64的示例性范围(例如grna位点)以及相关grna序列(seqidno:87以及328-346)。作为一实例,在特定实施方案中,seqidno:87的sgrna(也参见图25a)可用于靶向seqidno:46的grna位点。
图14a提供区域2的小鼠dna序列:从eμ内含子增强子至转换区域(seqidno:4;>mm10_dna范围=chr12:113425446-1134269735'添凑=03'添凑=0链=-重复屏蔽=无)。图14b提供这个序列内的用以靶向的包括seqidno.65-84的示例性范围(例如grna位点)以及相关grna序列(seqidno:347-366)。
因此,在特定实施方案中,本公开提供包括(i)启动子和(ii)编码所选抗体的一部分的转基因的遗传构建体在内含子区域处的靶向插入,所述内含子区域在所有b细胞中都恒定(在重组之前和之后),并且(i)相对于与所述启动子相互作用的增强子元件加以定位;以及(ii)呈使得b细胞的内源性重链vdj序列不表达的构型。在特定实施方案中,所选抗体的所编码部分包括抗体的整个轻链以及重链的vdj区段。所选抗体的这些部分可与由经修饰b细胞在任何给定时间表达的重链恒定区一起表达。遗传构建体的特定实施方案还可包括或编码信号肽、柔性接头、跳跃元件和/或剪接接合点。
本公开的一个技术挑战是抗体是由两个单独基因产物即重链(igh)和轻链(igl)制得的蛋白质(图6a、图6b)。这意味着,在特定实施方案中,两个遗传位置均必须被同时修饰以适当地表达所选抗体。然而,本公开还提供了用以在不必须修饰两个遗传位置的情况下产生功能性所选抗体的策略。允许达成此举的一种方法是通过使用允许通过单一构建体进行抗体表达的序列。在特定实施方案中,这通过在遗传构建体内包括跳跃元件实现。跳跃元件的一个实例是自裂解肽,诸如自裂解“2a”肽。2a肽通过导致核糖体在确定位置处跳过对肽键的合成,从而导致从一个mrna产生两个蛋白质来起作用。2a序列是短的(例如20个氨基酸),从而有助于在尺寸受限制的构建体中使用,并且蛋白质在1:1比率下产生。特定实例包括t2a(gsg)egrgslltcgdveenpgp(seqidno:176);p2a(gsg)atnfsllkqagdveenpgp(seqidno:177);e2a(gsg)qctnyallklagdvesnpgpp(seqidno:178);以及f2a(gsg)vkqtlnfdllklagdvesnpgp(seqidno:179)。
在特定实施方案中,遗传构建体包括内部核糖体进入位点(ires)序列。ires可位于遗传构建体的重链vdj的上游。ires是允许核糖体在mrna分子上的第二内部位点处使翻译起始,从而导致从一个mrna产生两个蛋白质的非编码结构化rna序列。然而,相比于2a驱动的翻译,ires驱动的翻译具有较低效率,从而导致转录物中第二蛋白质的表达较低。
在特定实施方案中,遗传构建体在所选抗体的轻链部分与所选抗体的重链部分之间编码柔性接头。接头可为以允许连接的序列相互作用以形成功能性单元的方式使一个蛋白质结构域柔性连接于另一蛋白质结构域的一系列氨基酸。
在特定序列中,柔性接头可包括一个或多个系列的甘氨酸和丝氨酸组合,所述组合对接头序列提供柔性。示例性gly-ser接头包括(ggs)n(seqidno:180)、(gggs)n(seqidno:181)和(ggggs)n(seqidno:182),其中n=1–100以及介于其之间的每个整数。在特定实施方案中,n=10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30。在特定实施方案中,gly-ser接头包括50-80个氨基酸。在特定实施方案中,gly-ser接头包括54、57或60个氨基酸。在特定实施方案中,gly-ser接头由seqidno:116编码。在特定实施方案中,gly-ser接头包括seqidno:122。
柔性接头的额外实例包括(kesgsvsseqlaqfrsld)n(seqidno:183)和(egkssgsgseskst)n(seqidno:184)。在这些接头中,接头中的gly和ser残基被设计来提供柔性,而glu和lys被添加来改进溶解性。bird,re等science,1988;242:423–426。在特定实施方案中,n=1–100以及介于其之间的每个整数。在特定实施方案中,n=10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30。在特定实施方案中,这些接头包括50-80个氨基酸。
特定实施方案包括允许在由遗传构建体编码的rna与由内源性重链恒定区编码的rna之间进行剪接的剪接接合点。在特定实施方案中,遗传构建体在3’末端包括剪接接合点序列。剪接可指通过被称为剪接体的rna/蛋白质复合物来移除内含子以及将外显子接合在一起。剪接接合点是指直接侧接于外显子的内含子序列。在外显子的3’末端的剪接接合点可包括剪接供体位点。剪接供体位点序列通常以“gu”开始。在特定实施方案中,剪接接合点可包括在vdj的末个外显子之后的内含子的40-80bp。在特定实施方案中,剪接接合点包括侧接于人ighj1基因区段或小鼠ighj3基因的3’末端的内含子的40-80bp。在特定实施方案中,剪接接合点包括cag/gtaagt,其中切割和剪接发生在大写g(由“剪接”注释加以指示)之后。在特定实施方案中,剪接接合点包括cag/gtgagt。ca形成丝氨酸密码子的末尾,并且g使来自恒定区的第一密码子开始。在特定实施方案中,在用于插入人基因座中的遗传构建体中,具有侧接序列的剪接接合点包括seqidno:124或151。在特定实施方案中,在用于插入小鼠基因座中的遗传构建体中,具有侧接序列的剪接接合点包括seqidno:139。
本文公开的遗传构建体还可编码信号肽。示例性信号肽包括源于人igh重链的信号肽,诸如melglswifllailkgvqc(seqidno:185);melglrwvflvailegvqc(seqidno:186);mkhlwfflllvaaprwvls(seqidno:187);mdwtwrilflvaaatgahs(seqidno:188);mdwtwrflfvvaaatgvqs(seqidno:189);mefglswlflvailkgvqc(seqidno:190);mefglswvflvalfrgvqc(seqidno:191);和mdllhknmkhlwfflllvaaprwvls(seqidno:192);以及源于人igl轻链的信号肽,诸如mdmrvpaqllgllllwlsgarc(seqidno:193);和mkyllptaaagllllaaqpama(seqidno:194)。在特定实施方案中,在用于插入人基因座中的遗传构建体中,信号肽由seqidno:112编码,并且包括seqidno:118。在特定实施方案中,在用于插入小鼠基因座中的遗传构建体中,信号肽由seqidno:129编码,并且包括seqidno:134。也参见图25b-图25i以及haryadir等,tplosonev.10(2);2015pmc4338144。
如所指示,本公开的特定实施方案利用在内源性b细胞基因组内的所靶向位置处插入外源性遗传构建体。在特定实施方案中,所述靶向插入可通过在遗传构建体的一个或两个末端上包括同源区来促进。同源区(即同源缝线或同源臂)与在所需插入位点处的序列同源。在特定实施方案中,同源臂是指包括在遗传构建体中的与正被修饰的dna区域100%同一的dna区段。在特定实施方案中,100%同一性可不为实现靶向插入所需(例如至少90%同一性可为足够的)。
同源区导致遗传构建体紧接于所靶向遗传区域排列,并且来自遗传构建体的dna部分被调换至通过基因编辑技术切割的区域中。在特定实施方案中,遗传构建体可包括具有20至1,500bp的基因组同源性的上游基因组同源末端,以及具有20至1,500bp的基因组同源性的下游基因组同源末端。同源区域可例如提供如图15a中所示的“同源缝线”,所述同源缝线可介导遗传构建体插入所靶向插入位点中。在特定实施方案中,上游基因组同源末端和下游基因组同源末端可包括与在重链vdj区与重链eμ增强子元件之间的基因组序列具有同源性的序列。在特定实施方案中,同源区域可特别地包括20-50个碱基对;300-500个碱基对;350-550个碱基对;900-1,000个碱基对或400-600个碱基对。在特定实施方案中,同源区域可特别地包括30-40个碱基对(例如36个碱基对);445-455个碱基对(例如450个碱基对);495-510个碱基对(例如503个碱基对);和/或960-980个碱基对(例如968个碱基对)。在特定实施方案中,用于小鼠遗传构建体中的同源区包括seqidno:90、91、96、97、127、140、142、143、170和171。在特定实施方案中,用于人遗传构建体中的同源区包括seqidno:92-95、98-101、110、125、153、173和174。
在特定实施方案中,遗传构建体还编码标签序列。标签序列可为有用的,例如以使表达遗传构建体的细胞可在遗传修饰过程期间被鉴定和/或分选,和/或以使它们可在向受试者施用之后受控制。举例来说,在特定实施方案中,它可用于在向受试者施用之后追踪和/或终止经遗传修饰细胞。示例性标签包括
在特定实施方案中,本公开提供了一种用于所选抗体表达的遗传构建体,所述遗传构建体包括或编码(i)重链启动子,和/或(ii)免疫球蛋白轻链,和/或(iii)重链可变区,和/或(iv)终止密码子;和/或(v)跳跃元件和/或(vi)剪接接合点和/或(vii)同源臂和/或(viii)接头和/或(ix)标签。
特定实施方案包括或编码:(i)重链启动子;(ii)信号肽;(iii)所选抗体的整个轻链;(iv)柔性接头或跳跃元件;(v)所选抗体重链的可变区;和(vi)剪接接合点。
特定实施方案包括或编码:(i)重链启动子;(ii)信号肽;(iii)所选抗体的整个轻链;(iv)柔性接头或跳跃元件;(v)所选抗体重链的可变区;(vi)剪接接合点,和(vii)同源臂。
特定实施方案包括或编码:(i)重链启动子;(ii)信号肽;(iii)所选抗体的整个轻链;(iv)柔性接头或跳跃元件;(v)所选抗体重链的可变区;(vi)剪接接合点,(vii)同源臂;和(viii)标签。
图15b描绘dna修复模板的额外实例。还可使用的dna修复模板的实例包括合成dna模板和腺相关病毒。在特定实施方案中,合成dna模板可包括双链dna(dsdna),所述双链dna包括或编码由与基因组中的靶标位点具有同源性的20-1,500个碱基对侧接的启动子和所选抗体部分。在特定实施方案中,合成dna模板可包括单链dna(ssdna),所述单链dna包括或编码由与基因组中的靶标位点具有同源性的10-80个碱基对或400-1000个碱基对侧接的启动子和所选抗体部分。在特定实施方案中,合成dna模板可包括在末端通过磷酸化加以修饰以使dna连接效率增加的dsdna与ssdna两者。在特定实施方案中,dsdna与ssdna两者均可在末端用硫代磷酸酯键加以修饰以使稳定性增加,并且防止核酸内切酶消化。
在特定实施方案中,腺相关病毒可包括由与基因组中的靶标位点具有同源性的20-1,500个碱基对侧接的编码合成抗体部分的区段。在特定实施方案中,启动子和合成抗体部分编码序列可由匹配于基因组中的靶标位点的同源序列侧接。
在特定实施方案中,包括dna修复机构(例如同源缝线、合成dna模板)的遗传构建体可利用如以下更详细所述的基因编辑系统诸如crispr、talen、megatal、锌指核酸酶和/或腺相关病毒加以递送。举例来说,可向b细胞施用基因组靶向元件、基因组切割元件和本文所述的遗传构建体。
作为本公开的应用的一特定实例,b细胞可被修饰来表达帕利珠单抗抗体。b细胞可用遗传构建体加以修饰,所述遗传构建体包括侧接于重链启动子的80bp同源臂,所述重链启动子在来自帕利珠单抗的由2a肽分隔的完整轻链(iglpv)和vdj重链基因区段(vdjpv)的上游。在此处,2a肽被包括来诱导核糖体跳跃事件(donnelly等,thejournalofgeneralvirology.2001;82(pt5):1013-25),所述核糖体跳跃事件允许重链和轻链以通常将缔合以形成所选抗体的单独亚单位形式产生。在特定实施方案中,终止密码子可被包括在所插入重链启动子的上游以使内源性重链可变区的任何潜在转录停止。
图16描绘“如所修饰的”b细胞基因组的一实例,而图17描绘表达所选抗体的所得b细胞群体。
以下段落提供关于(i)示例性所选抗体和序列;(ii)基因编辑技术和细胞分选;(iii)经修饰b细胞的制剂;和(iv)使用方法的更详细描述。
(i)示例性所选抗体和序列。在特定实施方案中,所选抗体是可提供针对病原体或疾患(例如自体免疫疾病)的保护作用的抗体。在特定实施方案中,所选抗体是抗rsv抗体、抗hiv抗体、抗登革病毒(denguevirus)抗体、抗百日咳博德特氏菌(bordatellapertussis)抗体、抗丙型肝炎抗体、抗流感病毒抗体、抗副流感病毒抗体、抗偏肺病毒(mpv)抗体、抗巨细胞病毒抗体、抗艾伯斯坦巴尔病毒(epsteinbarrvirus)抗体;抗单纯疱疹病毒抗体、抗艰难梭菌(clostridiumdifficile)细菌毒素抗体或抗肿瘤坏死因子(tnf)抗体。
在特定实施方案中,所选抗体是嵌合抗体。在特定实施方案中,嵌合抗体是指包括:(i)至少一个由b细胞的内源性基因组编码的部分,和(ii)至少一个由所插入遗传构建体编码的部分的合成抗体。在特定实施方案中,嵌合抗体包括内源性重链恒定结构域、外源性免疫球蛋白可变和恒定轻链、以及外源性可变重链。
以下抗体和序列可用于提供针对目标病原体或抗原具有靶向结合的所选抗体(除非指示,否则意指kabat编号):
一示例性抗rsv抗体是帕利珠单抗,其靶向rsv融合蛋白,并且用于预防或减轻rsv感染。
在特定实施方案中,抗rsv抗体是小鼠帕利珠单抗,所述小鼠帕利珠单抗包括可变重链序列,所述可变重链序列包括:
qvelqesgpgilqpsqtlsltcsfsgfslstsgmsvgwirqpsgeglewladiwwddkkdynpslksrltiskdtssnqvflkitgvdtadtatyycarsmitnwyfdvwgagttvtvss(seqidno:138);以及可变轻链序列,所述可变轻链序列包括:
diqltqspaimsaspgekvtmtcsasssvgymhwyqqklstspklqiydtsklasgvpgrfsgsgsgnsysltissiqaedvatyycfrgsgypftfgqgtkleik(seqidno:205)。
另一示例性抗rsv抗体是人帕利珠单抗,并且包括可变轻链序列,所述可变轻链序列包括:
diqmtqspstlsasvgdrvtitckcqlsvgymhwyqqkpgkapklliydtsklasgvpsrfsgsgsgteftltisslqpdfatyycfqgsgypftfgggtkleikr(seqidno:206);以及可变重链序列,所述可变重链序列包括:
qvtlresgpalvkptqtltltctfsgfslstsgmsvgwirqppgkalewladiwwddkkdynpslksrltiskdtsknqvvlkvtnmdpadtatyycarsmitnwyfdvwgagtt(seqidno:123)。
在可变重链和可变轻链内,被称为互补决定区(cdr)的区段决定表位结合。每个重链具有三个cdr(即cdrh1、cdrh2和cdrh3),并且每个轻链具有三个cdr(即cdrl1、cdrl2和cdrl3)。
另一示例性抗rsv抗体描述于美国专利号9,403,900中。这个抗rsv抗体包括可变重链,所述可变重链含有包括gasinsdnyywt(seqidno:207)的cdrh1序列、包括hisytgntyytpslks(seqidno:208)的cdrh2序列和包括cgayvlisncgwfds(seqidno:209)的cdrh3序列;以及可变轻链,所述可变轻链含有包括qasqdistyln(seqidno:210)的cdrl1序列、包括gasnlet(seqidno:211)的cdrl2序列和包括qqyqylpyt(seqidno:212)的cdrl3序列。
示例性抗rsv抗体还包括ab1128(可从millipore获得)和ab20745(可从abcam获得)。
抗hiv抗体的一实例是10e8,其是结合gp41的广泛中和性抗体。10e8抗hiv抗体包括可变重链,所述可变重链含有包括gfdfdnaw(seqidno:213)的cdrh1序列、包括itgpgegwsv(seqidno:214)的cdrh2序列和包括tgkyydfwsgyppgeeyfqd(seqidno:215)的cdrh3序列;以及可变轻链,所述可变轻链含有包括tgdslrshyas(seqidno:216)的cdrl1序列、包括gknnrps(seqidno:217)的cdrl2序列和包括ssrdksgsrlsv(seqidno:218)的cdrl3序列。
抗hiv抗体的另一实例是vrc01,其是结合gp120的cd4结合位点的广泛中和性抗体。vrc01抗体包括可变重链,所述可变重链含有包括gyefidct(seqidno:219)的cdrh1序列、包括kprggavn(seqidno:220)的cdrh2序列和包括rgkncdynwdfehw(seqidno:221)的cdrh3序列;以及可变轻链,所述可变轻链含有包括qygs的cdrl1序列、包括sgs的cdrl2序列和包括qqyef(seqidno:222)的cdrl3序列。
示例性抗hiv抗体还包括ab18633和39/5.4a(可从abcam获得);以及h81e(可从thermofisher获得)。
抗登革病毒抗体的一实例是描述于u.s.20170233460中的抗体55,并且包括可变重链,所述可变重链含有包括evqlhqsgaelvkpgasvklsctvsgfnik(seqidno:223)的cdrh1序列、包括wvkqrpeqglewi(seqidno:224)的cdrh2序列和包括atikadtssntaylqlisltsedtavyycaf(seqidno:225)的cdrh3序列;以及可变轻链,所述可变轻链含有包括diqmtqspaslsvsvgetvtitc(seqidno:226)的cdrl1序列、包括wyqqkqgkspqllvy(seqidno:227)的cdrl2序列和包括gvpsrfsgsgsgtqyslkinslqsedfgtyyc(seqidno:228)的cdrl3序列。
抗登革病毒抗体的另一实例是描述于美国专利号8,637,035中的db2-3,并且包括可变重链,所述可变重链含有包括ytftdyait(seqidno:229)的cdrh1序列、包括glistyygdsfynqkfkg(seqidno:230)的cdrh2序列和包括tirdgkamdy(seqidno:231)的cdrh3序列;以及可变轻链,所述可变轻链含有包括rssqslvhsngntylh(seqidno:232)的cdrl1序列、包括kvsnrfs(seqidno:233)的cdrl2序列和包括sqsthvpyt(seqidno:234)的cdrl3序列。抗登革病毒抗体的实例还包括ab155042和ab80914(两者均可从abcam获得)。
抗百日咳抗体的一实例描述于美国专利号9,512,204中,并且包括可变重链,所述可变重链包括qvqlqqpgselvrpgasvklsckasgykftsywmhwvkqrpgqglewignifpgsgstnydekfnskatltvdtssntaymqlssltsedsavyyctrwlsgayfdywgqgttvtvss(seqidno:235),以及可变轻链,所述可变轻链包括qivltqspalmsaspgekvtmtcsasssvsfmywyqqkprsspkpwiyltsnlpsgvparfsgsgsgtsysltissmeaedaatyycqqwsshpptfgsgtkleik(seqidno:236)。
抗丙型肝炎抗体的一实例包括可变重链;所述可变重链含有包括sygmhw(seqidno:237)的cdrh1序列、包括viwldgsntyyadsvkgr(seqidno:238)的cdrh2序列和包括ardiftvargviiyfdy(seqidno:239)的cdrh3序列;以及可变轻链,所述可变轻链含有包括rasqsvssyla(seqidno:240)的cdrl1序列、包括dasnrat(seqidno:241)的cdrl2序列和包括qqrsnwvt(seqidno:242)的cdrl3序列。抗丙型肝炎抗体的实例还包括mab8694(可从millipore获得)和c7-50(可从abcam获得)。
抗流感病毒抗体的一实例描述于美国专利号9,469,685中,并且包括可变重链,所述可变重链含有包括gmtsnsla(seqidno:243)的cdrh1序列、包括iipvfetp(seqidno:244)的cdrh2序列和包括atsaggivnyylsfni(seqidno:245)的cdrh3序列;以及可变轻链,所述可变轻链含有包括qtittw(seqidno:246)的cdrl1序列、包括kts的cdrl2序列和包括qqystysgt(seqidno:247)的cdrl3序列。抗流感病毒抗体的一实例还包括c102(可从thermofisher获得)。
一示例性抗mpv抗体包括mpe8。
示例性抗cmv抗体包括mcmv5322a、mcmv3068a、ljp538和ljp539。rg7667包括mcmv5322a和mcmv3068a的混合物,而csj148包括ljp538和ljp539的混合物。也参见例如deng等,antimicrobialagentsandchemotherapy62(2)e01108-17(2018年2月);以及dole等,antimicrobialagentsandchemotherapy60(5)2881-2887(2016年5月)。
抗ebv抗体的一实例包括可变重链,所述可变重链含有包括ytfihfgisw(seqidno:248)的amm01cdrh1序列、包括idtnngntnyaqslqg(seqidno:249)的amm01cdrh2序列和包括ralemghrsgfpfdy(seqidno:250)的amm01cdrh3序列;以及可变轻链,所述可变轻链含有包括gghnigaknvh(seqidno:251)的amm01cdrl1序列、包括ydsdrps(seqidno:252)的amm01cdrl2序列和包括cqvwdsgrghplyv(seqidno:253)的amm01cdrl3序列。
抗hsv抗体的实例包括hsv8-n和mb66。
示例性抗艰难梭菌抗体包括阿克托单抗(actoxumab)和贝兹托单抗(bezlotoxumab)。也参见例如wilcox等,nengljmed376(4)305-317(2017)。
可商购获得的抗tnf抗体包括英夫利昔单抗(infliximab)(
在特定实施方案中,英夫利昔单抗的cdr包括:重链残基26-37、52-70和103-116以及轻链残基24-39、55-61和94-102。在特定实施方案中,英夫利昔单抗的重链以evkleesggglvqpggsmk(seqidno:254)开始,并且轻链以dilltqspailsvspger(seqidno:255)开始。
在特定实施方案中,英夫利昔单抗包括可变重链,所述可变重链含有包括ifsnhw(seqidno:256)的cdrh1序列、包括rsksinsath(seqidno:257)的cdrh2序列和包括nyygsty(seqidno:258)的cdrh3序列;以及可变轻链,所述可变轻链含有包括fvgssih(seqidno:259)的cdrl1序列、包括kyasesm(seqidno:260)的cdrl2序列和包括qshsw(seqidno:261)的cdrl3序列。
在特定实施方案中,阿达木单抗包括可变重链,所述可变重链含有包括tfddya(seqidno:262)的cdrh1序列、包括twnsghid(seqidno:263)的cdrh2序列和包括vsylstassl(seqidno:264)的cdrh3序列;以及可变轻链,所述可变轻链含有包括girnyla(seqidno:265)的cdrl1序列、包括yaastlq(seqidno:266)的cdrl2序列和包括rynra(seqidno:267)的cdrl3序列。
在特定实施方案中,塞利珠单抗包括可变重链,所述可变重链含有包括vftdyg(seqidno:268)的cdrh1序列、包括ntyigepi(seqidno:269)的cdrh2序列和包括gyrsyam(seqidno:270)的cdrh3序列;以及可变轻链,所述可变轻链含有包括nvgtnva(seqidno:271)的cdrl1序列、包括ysasfly(seqidno:272)的cdrl2序列和包括qyniy(seqidno:273)的cdrl3序列。
可在本公开的教义内使用的众多额外抗体序列是可用的,并且为本领域普通技术人员所知。可商购获得的抗体的序列信息可见于药物库数据库(drugbankdatabase)、cas登记库(casregistry)和/或rscb蛋白质数据库(proteindatabank)中。此外,本领域普通技术人员可易于获得编码本文所述的所选抗体的部分的核酸序列。
(ii)基因编辑技术和细胞分选。基因编辑系统允许控制遗传疗法的靶标位点。在本公开的教义内,可使用能够进行精确序列靶向和修饰的任何基因编辑系统。这些系统通常包括用于精确靶向的靶向元件和用于切割所靶向遗传位点的切割元件。引导rna是靶向元件的一个实例,而各种核酸酶提供切割元件的实例。靶向元件和切割元件可为单独分子或例如由纳米粒子连接。或者,靶向元件和切割元件可连接在一起以成为一个双重目的分子。当意图插入治疗性核酸序列时,系统还可包括与遗传构建体相关联的同源性引导的修复模板(即如上所述的同源臂)。然而,如以下进一步所详述,不同基因编辑系统可采用不同组分和构型,同时维持精确靶向、切割和修饰所选基因组位点的能力。
特定实施方案利用锌指核酸酶(zfn)作为基因编辑剂。zfn是被工程改造来在特定位置处结合和裂解dna的一类位点特异性核酸酶。zfn用于在dna序列中的特定位点处引入双链断裂(dsb),此使得zfn能够靶向多种不同细胞中的基因组内的独特序列。此外,在双链断裂之后,发生同源性引导的修复(hdr)或非同源性末端接合(nhej)以修复dsb,由此使得能够进行基因组编辑。
zfn通过使锌指dna结合结构域融合于dna裂解结构域来合成。dna结合结构域包括三个至六个是转录因子的锌指蛋白。dna裂解结构域包括例如foki核酸内切酶的催化结构域。foki结构域以二聚体形式起作用,从而需要两个具有针对靶标序列上的位点的独特dna结合结构域的构建体。foki裂解结构域在分隔两个倒置半位点的具有五个或六个碱基对的间隔体序列内进行裂解。
对于关于zfn的额外信息,参见kim等proceedingsofthenationalacademyofsciencesoftheunitedstatesofamerica93,1156-1160(1996);wolfe等annualreviewofbiophysicsandbiomolecularstructure29,183-212(2000);bibikova等science300,764(2003);bibikova等genetics161,1169-1175(2002);miller等theembojournal4,1609-1614(1985);以及miller等naturebiotechnology25,778-785(2007)。
特定实施方案可使用转录活化子样效应物核酸酶(talen)作为基因编辑剂。talen是指包括转录活化子样效应物(tale)dna结合蛋白和dna裂解结构域的融合蛋白。talen用于通过在dna中诱导dsb来编辑基因和基因组,所述dsb诱导细胞中的修复机制。通常,两个talen必须结合,并且侧接于dna裂解结构域的靶标dna位点的每一侧以进行二聚化以及诱导dsb。在细胞中,dsb通过nhej修复,或如果存在外源性双链供体dna片段,那么通过hdr修复。
如所指示,talen已被工程改造来结合例如内源性基因组的靶标序列,并且在所述靶标序列的位置处切割dna。talen的tale是由黄单胞菌属(xanthomonas)细菌分泌的dna结合蛋白。tale的dna结合结构域包括高度保守的具有33或34个氨基酸的重复序列,其中相异残基在每个重复序列的第12和第13位置处。被称为重复可变双残基(rvd)的这两个位置显示与特异性核苷酸识别的强烈关联。因此,靶向特异性可通过改变rvd中的氨基酸以及并入非常规rvd氨基酸来改进。
可用于talen融合物中的dna裂解结构域的实例是野生型和变异foki核酸内切酶。对于关于talen的额外信息,参见boch等science326,1509-1512(2009);moscou和bogdanove,science326,1501(2009);christian等genetics186,757-761(2010);以及miller等naturebiotechnology29,143-148(2011)。
特定实施方案利用megatal作为基因编辑剂。megatal具有单链稀切点裂解核酸酶结构,其中tale与兆碱基大范围核酸酶的dna裂解结构域融合。兆碱基大范围核酸酶,也被称为归巢核酸内切酶,是在同一结构域中具有dna识别功能与核酸酶功能两者的单一肽链。与talen相比,megatal仅需要递送单一肽链以达成功能活性。
在特定实施方案中,内源性b细胞基因组可使用crispr基因编辑系统来靶向。crispr核酸酶系统是赋予对外来遗传元件诸如质粒和噬菌体的抗性,并且提供一种形式的获得免疫性的原核免疫系统。crispr是含有碱基序列的短重复的dna基因座。在原核免疫系统的情形下,每个重复继之以间隔dna的短区段,所述短区段属于原核生物所暴露于的外来遗传元件。与间隔体交替散布的这个crispr重复序列阵列可被转录成rna。rna可被加工成成熟形式,并且与核酸酶诸如cas(crispr相关)核酸酶缔合。包括具有可杂交于外来遗传元件的序列的rna和cas核酸酶的crispr-cas系统可接着识别以及切割基因组中的这些外源性遗传元件。
crispr-cas系统不要求产生定制蛋白质来靶向特定序列,而是单一cas酶可通过短引导rna分子(crrna)加以程序化以识别特定dna靶标。细菌和古细菌适应性免疫性的crispr-cas系统显示蛋白质组成和基因组基因座构造的极大多样性。crispr-cas系统基因座具有超过50个基因家族,并且不存在绝对通用的基因,从而指示基因座构造的快速进化和极大多样性。迄今为止,采用多管齐下的方法,存在对93种cas蛋白的395个概况的全面cas基因鉴定。分类包括特征基因概况加基因座构造的特征。提出了对crispr-cas系统的一种新的分类,其中这些系统被广泛分成两个类别,类别1具有多亚单位效应复合物,而类别2具有由cas9蛋白例示的单亚单位效应模块。
已开发至少三种不同cas9核酸酶用于基因组编辑。第一是野生型cas9,其在特定dna位点处引入双链断裂(dsb),从而导致dsb修复机构的活化。dsb可通过非同源性末端接合(nhej)、同源性引导的修复(hdr)或微同源性介导的修复(mmej)来修复。nhej可涉及在修复期间接合的两个末端之间不具有同源性(<5bp)的情况下修复dsb;hdr可涉及在修复期间接合的末端之间具有大同源区域(100个或更多个核苷酸)的情况下修复dsb;并且mmej可涉及在修复期间接合的末端之间具有小(5至50bp)同源区域的情况下修复dsb。另一类型的cas9包括被称为cas9d10a的突变cas9,所述突变cas9仅具有切口酶活性,此意味着它仅裂解一个dna链,并且不使nhej活化。因此,dna修复仅通过hdr路径来进行。第三是核酸酶缺陷性cas9(dcas9),其不具有裂解活性,但能够结合dna。因此,dcas9能够靶向基因组的特定序列而不进行裂解。通过使dcas9与各种效应结构域融合,dcas9可被用作基因沉默或活化工具。
除1类和2类crispr-cas系统之外,更新近地,已鉴定由cpf1例示的推定2类v型crispr-cas类别,zetsche等(2015)cell163(3):759-771。cpf1核酸酶特别地可借助于短的三碱基对识别序列(ttn)来在靶标位点选择方面提供附加灵活性,所述识别序列被称为原间隔体邻近基序或pam。cpf1的切割位点离pam序列至少18bp,因此,酶可在indel(插入和缺失)形成之后重复切割指定基因座,从而使hdr的效率增加。此外,具有粘性末端的交错dsb容许达成定向特异性供体模板插入。
关于crispr-cas系统及其组分的额外信息描述于us8697359、us8771945、us8795965、us8865406、us8871445、us8889356、us8889418、us8895308、us8906616、us8932814、us8945839、us8993233和us8999641以及与它们相关的申请;以及wo2014/018423、wo2014/093595、wo2014/093622、wo2014/093635、wo2014/093655、wo2014/093661、wo2014/093694、wo2014/093701、wo2014/093709、wo2014/093712、wo2014/093718、wo2014/145599、wo2014/204723、wo2014/204724、wo2014/204725、wo2014/204726、wo2014/204727、wo2014/204728、wo2014/204729、wo2015/065964、wo2015/089351、wo2015/089354、wo2015/089364、wo2015/089419、wo2015/089427、wo2015/089462、wo2015/089465、wo2015/089473和wo2015/089486、wo2016205711、wo2017/106657、wo2017/127807以及与它们相关的申请中。
特定实施方案将tracrrna和crrna组合成单一合成单引导rna(sgrna,利用例如seqidno:87-89或290-366)。在特定实施方案中,sgrna可包括与crrna类似的具有二十个核苷酸的序列以及tracrrna序列。对于某些基因编辑系统,靶标序列可邻近于pam(例如5’-20nt靶标–ngg-3’)。在特定实施方案中,靶标序列可包括pam(seqidno:5-84)。在特定实施方案中,引导rna(grna)包括邻近于pam的由基因组编辑复合物靶向的靶标位点。grna可包括邻近于pam的至少16、17、18、19、20、21或22个核苷酸。
在特定实施方案中,切割元件在经工程改造grna的辅助下针对所靶向dna位置(图25a(sternberg等,molcell.2015;58(4):568-74))。具有侧接于切割基因组区域的同源臂的遗传构建体通过同源性引导的dna修复机制被高效插入这个位置中(参见例如图15b(elliott等,molcellbiol.1998;18(1):93-101))。使用这个方法,内源性抗体的表达将被消除,并且编码所选抗体的基因将被插入所靶向遗传位置中。这个靶向插入使由随机遗传插入所致的脱靶效应的可能性消除或显著降低。
在特定实施方案中,靶向每个内源性抗体的小鼠或人igh的sgrna靶向在j区的下游100bp的区域(图9)。在实验性实例中,这个区域被靶向来表达所选抗体帕利珠单抗的含有来自内源性基因组的c区的形式(图7和图9)。crispr.mit.edu算法(hsu等,natbiotechnol.2013;31(9):827-32)鉴定了22个针对这个区域的被预测具有少许(如果有的话)脱靶结合的靶向序列。单个靶向序列可被插入全长sgrna中,并且在如所描述的孵育(schumann等,procnatlacadsciusa.2015;112(33):10437-42)之前即刻与核酸酶诸如cas9混合,并且电穿孔至b细胞中(kim等,jimmunol.1979;122(2):549-54)。因为对由cas9达成的dna切口的细胞修复经常导致基因功能丧失(symington和gautier,annurevgenet.2011;45:247-71),所以靶向抗体编码区的高效sgrna预期会导致出现一些缺乏抗体的b细胞,此可易于通过流式细胞计量术评估。靶向内含子序列的sgrna的活性可通过测序或通过酶促测定诸如t7核酸内切酶测定来评估。
在特定实施方案中,基因组靶向和切割元件可通过电穿孔、纳米粒子介导的递送和/或病毒载体递送来施用。电穿孔可例如用于递送靶向元件和/或切割元件,因为细胞膜通常不允许所述外来分子进入细胞中。电穿孔将电击传送至细胞,所述电击暂时允许所述外来分子穿过细胞膜。
在特定实施方案中,用于插入的遗传构建体可通过电穿孔、纳米粒子介导的递送和/或病毒载体递送来施用。腺相关病毒载体包括源于例如腺病毒5(ad5)、腺病毒35(ad35)、腺病毒11(ad11)、腺病毒26(ad26)、腺病毒48(ad48)或腺病毒50(ad50)以及腺相关病毒(aav;参见例如美国专利号5,604,090;kay等,nat.genet.24:257(2000);nakai等,blood91:4600(1998))的那些。
在特定实施方案中,基因组靶向和切割元件可通过电穿孔施用,并且用于插入的遗传构建体可通过aav介导的递送施用。在特定实施方案中,基因组靶向和切割元件可通过纳米粒子介导的递送来施用,并且用于插入的遗传构建体可通过aav介导的递送来施用。
在特定实施方案中,包括转基因的遗传构建体可在电穿孔之前即刻或不久与靶向元件(例如sgrna)和切割元件(例如cas9或cpf1)混合。所选抗体表达可稍后(例如3天后)通过流式细胞计量术测量细胞与荧光标签化靶标蛋白质的结合来确认。可使用用于检测和分析表位特异性b细胞的富集和分析方法。pape等,science.2011;331(6021):1203-7;taylor等,jexpmed.2012;209(3):597-606;taylor等,jexpmed.2012;209(11):2065-77;haasken等,jimmunol.2013;191(3):1055-62;taylor等,jimmunolmethods.2014;405:74-86;nanton等,eurjimmunol.2015;45(2):428-41;hamilton等,jimmunol.2015;194(10):5022-34;taylor等,science.2015;347(6223):784-7)。这些方法允许检测频率格外地低至总b细胞群体的0.00002%的所选抗体表达性b细胞(taylor等,science.2015;347(6223):784-7)。
在特定实施方案中,可在递送遗传构建体之前或之后基于标志物表达来鉴定和/或分选细胞。举例来说,可有用的是在递送遗传构建体之前从样品分离特定类型的b细胞(例如记忆b细胞、抗体分泌性b细胞、原初b细胞、b1b细胞、边缘区b细胞)。作为另一实例,可有用的是使b细胞与存在于血液样品中的其他细胞分离。cd19是由b细胞表达的蛋白质的一实例,仅有身体的少许其他细胞表达。通过用荧光分子标记cd19,可特异性鉴定b细胞。b220是一种可用于鉴定小鼠b细胞的标志物。
cd27是由记忆而非原初人b细胞表达的蛋白质的一实例。通过用荧光分子标记cd27,可鉴定记忆b细胞。
cd21是不由一些能够在感染之后快速分泌抗体的记忆人b细胞表达(或在低程度上表达)的蛋白质的一实例。低cd21表达可用于确定被致敏以达成浆细胞分化的b细胞。通过用荧光分子标记cd21,这些b细胞可通过例如负性选择来特异性鉴定。
人原初b细胞可通过标志物概况igm+igd+cd27-来鉴定。小鼠原初b细胞可通过标志物概况cd38+gl7-igm+igd+来鉴定。人b1b细胞可通过标志物概况cd5+cd43+来鉴定。小鼠b1b细胞可通过标志物概况cd43+低b220来鉴定。人边缘区b细胞可通过标志物概况cd21+++igm++igd-cd27+来鉴定。小鼠边缘区b细胞可通过标志物概况cd21+++igm++igd-来鉴定。
特定实施方案可利用cd19+cd27+cd21lo标志物概况。
cd45是用于鉴定和/或分离用于本文所述的实验中的细胞类型的标志物。不同小鼠品系表达称为cd45的蛋白质的不同形式,被称为cd45.1和cd45.2。在本文公开的实验中,来自表达cd45.2的小鼠的b细胞将被获取以及转移至表达cd45.1的小鼠中。通过用不同荧光分子标记cd45.1和cd45.2,可鉴定来自供体动物的细胞,因为它们表达cd45.2而非cd45.1。
特定实施方案包括在遗传修饰之后基于外源性轻链的表达来分选b细胞。举例来说,天然地表达κ轻链的b细胞可被修饰来表达包括λ轻链的所选抗体。天然地表达λ轻链的b细胞可被修饰来表达包括κ轻链的所选抗体。基于外源性轻链的表达的分选将允许仅分离表达所选抗体的那些b细胞。在特定实施方案中,仅分离完全缺乏它们的内源性轻链的表面表达的那些b细胞以进行配制和向受试者施用。
在特定实施方案中,细胞可使用流式细胞计量术鉴定和/或分离。流式细胞计量术是一种使用激光来单个地分析标记数百万个单个细胞的荧光分子的灵敏和强力分析方法。通过分析标记每个细胞的荧光分子的组合,可鉴定不同b细胞亚型。流式细胞计量术可用于鉴定b细胞子组,并且分析这些细胞内所选抗体(例如帕利珠单抗)的表达。
在特定实施方案中,修饰b细胞的方法可包括获得造血干细胞(hsc),和/或将遗传构建体递送至hsc。hsc可指天然地产生b细胞以及免疫系统的所有其他细胞的干细胞类型。hsc可例如从脐带血获得。
本文所述的特定实验结果利用a20细胞来开发遗传修饰方法,随后前移至新鲜分离的b细胞。a20是一种由小鼠b细胞制得的永生化细胞系。
在特定实施方案中,b细胞可从人受试者获得,并且所得b细胞或其子组可加以离体修饰。
经修饰b细胞的制剂。一旦修饰,细胞即可从培养基收集,并且洗涤以及以治疗有效量浓缩至载体中。示例性载体包括盐水、缓冲盐水、生理盐水、水、汉克氏溶液(hanks'solution)、林格氏溶液(ringer'ssolution)、nonnosol-r(abbottlabs)、plasma-lyte
在特定实施方案中,载体可补充以人血清白蛋白(hsa)或其他人血清组分或胎牛血清。在特定实施方案中,输注用载体包括具有5%透明质酸钠盐(has)或右旋糖的缓冲盐水。额外等张剂包括多羟基糖醇,包括三羟基或更高级糖醇,诸如甘油、赤藓糖醇、阿拉伯糖醇、木糖醇、山梨糖醇或甘露糖醇。
载体可包括缓冲剂,诸如柠檬酸盐缓冲剂、丁二酸盐缓冲剂、酒石酸盐缓冲剂、反丁烯二酸盐缓冲剂、葡萄糖酸盐缓冲剂、草酸盐缓冲剂、乳酸盐缓冲剂、乙酸盐缓冲剂、磷酸盐缓冲剂、组氨酸缓冲剂和/或三甲胺盐。
稳定剂是指在功能方面可在增积剂至有助于防止细胞粘附于容器壁的添加剂的范围内的宽泛种类的赋形剂。典型稳定剂可包括多羟基糖醇;氨基酸,诸如精氨酸、赖氨酸、甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、丙氨酸、鸟氨酸、l-亮氨酸、2-苯丙氨酸、谷氨酸和苏氨酸;有机糖或糖醇,诸如乳糖、海藻糖、水苏糖、甘露糖醇、山梨糖醇、木糖醇、核糖醇、肌肉肌醇、半乳糖醇、甘油和环醇、诸如肌醇;peg;氨基酸聚合物;含硫还原剂,诸如脲、谷胱甘肽、硫辛酸、硫代乙酸钠、硫代甘油、α-单硫代甘油和硫代硫酸钠;低分子量多肽(即<10个残基);蛋白质诸如hsa、牛血清白蛋白、明胶或免疫球蛋白;亲水性聚合物诸如聚乙烯吡咯烷酮;单糖诸如木糖、甘露糖、果糖和葡萄糖;二糖诸如乳糖、麦芽糖和蔗糖;三糖诸如棉子糖以及多糖诸如右旋糖酐。
当必要或有益时,制剂可包括局部麻醉剂诸如利多卡因(lidocaine)以减轻在注射部位处的疼痛。
示例性防腐剂包括苯酚、苯甲醇、间甲酚、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、十八烷基二甲基苯甲基氯化铵、苯扎卤铵、氯化六羟季铵、对羟基苯甲酸烷基酯诸如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯、儿茶酚、间苯二酚、环己醇和3-戊醇。
制剂可包括例如大于102个经修饰b细胞、大于103个经修饰b细胞、大于104个经修饰b细胞、大于105个经修饰b细胞、大于106个经修饰b细胞、大于107个经修饰b细胞、大于108个经修饰b细胞、大于109个经修饰b细胞、大于1010个经修饰b细胞或大于1011个经修饰b细胞。
使用方法。本文公开的方法包括用本文公开的制剂治疗受试者(例如人、兽医学动物(狗、猫、爬行动物、鸟)、家畜(例如马、牛、山羊、猪、鸡)和研究动物(例如猴、大鼠、小鼠、鱼))。治疗受试者包括递送治疗有效量。治疗有效量包括提供有效量、防治性治疗和/或治疗性治疗的那些。
“有效量”是组合物的为在受试者中产生所需生理变化所必需的量。有效量经常出于研究目的而施用。本文公开的有效量可在与评估疾患的显现、进展和/或消退相关的动物模型或体外测定中产生统计显著影响。
“防治性治疗”包括向不展示疾患的征象或症状或仅展示疾患的早期征象或症状的受试者施用的治疗,以致治疗出于减弱或降低显现所述疾患的风险的目的而施用。因此,防治性治疗充当针对疾患的预防性治疗。在特定实施方案中,防治性治疗减轻、延迟或预防疾患的恶化。特定实施方案包括在不存在当前有效的疫苗下,施用本文所述的制剂作为防治性保护措施。特定实施方案包括作为对常规疫苗接种策略的替代,施用本文所述的制剂作为防治性保护措施。特定实施方案包括作为对常规疫苗接种策略的补充,施用本文所述的制剂作为防治性保护措施。
“治疗性治疗”包括向展示疾患的症状或征象的受试者施用的治疗,并且出于减弱或消除所述疾患的那些征象或症状的目的而向所述受试者施用。治疗性治疗可降低、控制或消除疾患的存在性或活动性,和/或减轻、控制或消除疾患的副作用。
在特定实施方案中,疾患是感染。
作为有效量、防治性治疗或治疗性治疗起作用不是互相排斥的,并且在特定实施方案中,所施用剂量可实现超过一种治疗类型。
在特定实施方案中,治疗有效量提供抗病原体作用。抗病原体作用可包括抗感染作用。抗感染作用可包括减少感染的发生,减轻感染的严重性,降低感染的持续时间,降低受感染细胞的数目,降低受感染组织的体积,增加预期寿命,诱导受感染细胞对免疫清除的敏感性,减轻感染相关的疼痛,和/或减轻或消除与所治疗感染相关的症状。
在特定实施方案中,治疗有效量提供消炎作用。消炎作用可包括减轻炎症相关的疼痛、发热、发红、肿胀和/或功能丧失。
在特定实施方案中,治疗有效量提供抗克罗恩氏病(crohn’sdisease)作用或抗溃疡性结肠炎作用。抗克罗恩氏病作用或抗溃疡性结肠炎作用可包括减轻腹泻,减轻直肠出血,减轻不可解释的重量损失,减轻发热,减轻腹部疼痛和痉挛,减轻疲劳和精力低下感觉,和/或恢复食欲。
在特定实施方案中,治疗有效量提供抗关节炎作用。抗关节炎作用可包括减轻关节疼痛、僵硬、肿胀、发红,和/或恢复活动范围。关节炎的类型包括类风湿性关节炎(ra)、僵直性脊椎炎和牛皮癣性关节炎。
在特定实施方案中,治疗有效量提供抗斑块牛皮癣作用。抗斑块牛皮癣作用可包括减轻红斑、鳞屑斑点、瘙痒、灼热、酸痛、甲床异常和/或关节肿胀或僵硬。
在特定实施方案中,b细胞可从受试者获得,b细胞的子组可加以离体修饰,接着经修饰b细胞可被配制以及向所述受试者施用。在特定实施方案中,受试者的b细胞的第一子组可用第一遗传构建体加以修饰以产生针对第一病原体的所选抗体,并且受试者的b细胞的第二子组可用第二遗传构建体加以修饰以产生针对第二病原体的所选抗体,由此提供针对两种病原体的保护性抗体。如所指示,可形成针对任何数目的病原体的b细胞,并且向受试者施用。在特定实施方案中,所选抗体可为抗rsv抗体、抗hiv抗体、抗登革病毒抗体、抗百日咳博德特氏菌抗体、抗丙型肝炎抗体、抗流感病毒抗体、抗副流感病毒抗体、抗mpv抗体、抗巨细胞病毒抗体、抗艾伯斯坦巴尔病毒抗体;抗单纯疱疹病毒抗体、抗艰难梭菌细菌毒素抗体和/或抗tnf抗体。在特定实施方案中,所选抗体可为抗rsv抗体、抗流感病毒抗体、抗副流感病毒抗体和/或抗mpv抗体中的一者或多者。在特定实施方案中,所选抗体可为抗rsv抗体、抗流感病毒抗体、抗副流感病毒抗体和抗mpv抗体。在特定实施方案中,所选抗体是帕利珠单抗。
在特定实施方案中,b细胞可从已免疫匹配于接受者的骨髓供者或造血干细胞供者获得。在特定实施方案中,供者的b细胞的第一子组可用第一遗传构建体加以修饰以产生针对第一病原体的所选抗体,并且供者的b细胞的第二子组可用第二遗传构建体加以修饰以产生针对第二病原体的所选抗体,由此提供针对两种病原体的保护性抗体。如所指示,可形成针对任何数目的病原体的b细胞,并且向受试者施用。在特定实施方案中,所选抗体可为抗rsv抗体、抗hiv抗体、抗登革病毒抗体、抗百日咳博德特氏菌抗体、抗丙型肝炎抗体、抗流感病毒抗体、抗副流感病毒抗体、抗mpv抗体、抗巨细胞病毒抗体、抗艾伯斯坦巴尔病毒抗体;抗单纯疱疹病毒抗体、抗艰难梭菌细菌毒素抗体和/或抗tnf抗体。在特定实施方案中,所选抗体可为抗rsv抗体、抗流感病毒抗体、抗副流感病毒抗体和/或抗mpv抗体中的一者或多者。在特定实施方案中,所选抗体可为抗rsv抗体、抗流感病毒抗体、抗副流感病毒抗体和抗mpv抗体。在特定实施方案中,所选抗体是帕利珠单抗。经遗传修饰b细胞可向接受者施用以提供针对感染的保护(例如抗感染作用)直至所移植细胞使接受者的自身免疫系统达成群体恢复。
在特定实施方案中,接受者正接受来自供者的骨髓或造血干细胞移植作为对血液恶性肿瘤的治疗。血液恶性肿瘤的实例包括急性淋巴细胞性白血病、b细胞前淋巴细胞性白血病、伯基特淋巴瘤/白血病、慢性淋巴细胞性白血病(cll)、弥漫性大b细胞淋巴瘤、滤泡性淋巴瘤(i、ii、iii或iv级)、霍奇金氏淋巴瘤(hodgkin'slymphoma)、血管内大b细胞淋巴瘤、淋巴瘤、淋巴浆细胞性淋巴瘤、套膜细胞淋巴瘤、边缘区淋巴瘤(结节外和结节性)、纵隔(胸腺)大b细胞淋巴瘤、多发性骨髓瘤、非霍奇金氏淋巴瘤、poems综合征/骨硬化骨髓瘤、原发性渗出淋巴瘤、脾边缘区淋巴瘤、小淋巴细胞性淋巴瘤、郁积性多发性骨髓瘤(smm)和瓦尔登斯特伦氏巨球蛋白血症(waldenstrom'smacroglobulinemia)。
在特定实施方案中,接受者正接受提供接受者正缺乏的基因的经遗传修饰造血干细胞。这些接受者可具有可通过造血干细胞来提供治疗性基因加以治疗的原发性或继发性免疫缺陷。世界卫生组织认定了超过80种原发性免疫缺陷疾病。这些疾病的特征在于免疫系统具有内在缺陷,其中在一些情况下,身体不能产生任何或足够的针对感染的抗体。在其他情况下,用以对抗感染的细胞防御未能适当地运转。通常,原发性免疫缺陷是遗传性病症。x染色体连锁的重度联合免疫缺陷(scid-x1)是原发性免疫缺陷的另一实例。x染色体连锁的scid导致由共同γ链基因(γc)中的突变引起的细胞免疫消减与体液免疫消减两者,此导致不存在t淋巴细胞和天然杀伤(nk)淋巴细胞。
继发性或获得性免疫缺陷不是遗传性遗传异常的结果,而是发生在其中免疫系统由在免疫系统外部的因素损害的个体中。实例包括创伤、病毒、化学疗法、毒素和污染。获得性免疫缺陷综合征(aids)是继发性免疫缺陷病症的由病毒即人免疫缺陷病毒(hiv)引起的一实例,其中t淋巴细胞的消减致使身体不能对抗感染。
在特定实施方案中,b细胞可从受试者获得,b细胞的子组可加以离体修饰,接着经修饰b细胞可被配制以及向所述受试者施用。在特定实施方案中,受试者的b细胞的第一子组可用第一遗传构建体加以修饰以产生针对炎症性分子诸如炎症性细胞因子的所选抗体,由此提供针对炎症进行保护的抗体。在特定实施方案中,所选抗体可为抗tnf抗体和/或抗il-1抗体。在特定实施方案中,所选抗体是英夫利昔单抗、阿达木单抗和/或戈利木单抗和/或它们的核准生物类似物。
对于施用,可初始基于来自体外测定和/或动物模型研究的结果来估计治疗有效量(在本文中也称为剂量)。所述信息可用于更准确确定适用于目标受试者中的剂量。向特定受试者施用的实际剂量可由医师、兽医或研究者在考虑诸如身体和生理因素的参数的情况下确定,所述因素包括年龄、先前疫苗接种(如果有的话)、目标、体重、疾患严重性、疾患类型、疾患分期、先前或并行治疗干预、受试者的特发病和施用途径。
如所指示,在特定实施方案中,经修饰b细胞表达允许例如在向受试者施用之后进行追踪和/或消除的标签。
示例性剂量可包括大于102个经修饰b细胞、大于103个经修饰b细胞、大于104个经修饰b细胞、大于105个经修饰b细胞、大于106个经修饰b细胞、大于107个经修饰b细胞、大于108个经修饰b细胞、大于109个经修饰b细胞、大于1010个经修饰b细胞或大于1011个经修饰b细胞。
在特定实施方案中,所选抗体的作用可使用病毒效价来度量。病毒效价是指可检测的病毒量。高病毒效价意味着高感染水平。最优保护性应答在效价降至零的情况下观察到。
如将由本领域普通技术人员所了解,尽管已描述特定实施方案,但额外实施方案也可在本公开的范围内加以利用。以下描述提供代表性额外实施方案的描述和实现。
示例性实施方案。
1.一种对b细胞进行遗传工程改造以表达所选抗体的方法,所述方法包括将包括(i)启动子和(ii)编码所选抗体的一部分的转基因的遗传构建体靶向插入在内含子区域处,所述内含子区域在所有b细胞中都恒定,并且(i)相对于与所述启动子相互作用以驱动所述转基因的表达的增强子元件加以定位;以及(ii)呈使得所述b细胞的内源性抗体编码基因组的一部分不表达的构型。
2.一种对b细胞进行遗传工程改造以表达所选抗体的方法,所述方法包括向seqidno:1、seqidno:2、seqidno:3或seqidno:4中插入包括或编码(i)重链启动子、(ii)信号肽、(iii)所述所选抗体的全长轻链;(iv)柔性接头或跳跃元件;(v)所述所选抗体的重链的可变区;和(vi)剪接接合点的遗传构建体,由此对所述b细胞进行遗传工程改造以表达所述所选抗体。
3.如实施方案1或2所述的方法,其中所述b细胞的内源性可变重链编码基因组在遗传修饰期间不切除。
4.如实施方案1-3中的任一者所述的方法,其中所述所选抗体是抗呼吸道合胞病毒(rsv)抗体、抗人免疫缺陷病毒(hiv)抗体、抗登革病毒抗体、抗百日咳博德特氏菌抗体、抗丙型肝炎抗体、抗流感病毒抗体、抗副流感病毒抗体、抗偏肺病毒(mpv)抗体、抗巨细胞病毒抗体、抗艾伯斯坦巴尔病毒抗体;抗单纯疱疹病毒抗体、抗艰难梭菌细菌毒素抗体或抗肿瘤坏死因子(tnf)抗体。
5.如实施方案1-4中的任一者所述的方法,其中所述遗传构建体包括seqidno:102-175、278、279或280-289。
6.如实施方案2-5中的任一者所述的方法,其中所述柔性接头在所述所选抗体的所述全长轻链与所述所选抗体的所述重链的所述可变区之间。
7.如实施方案2-6中的任一者所述的方法,其中所述柔性接头选自seqidno:180-184。
8.如实施方案2-7中的任一者所述的方法,其中所述柔性接头是包括50-80个氨基酸的gly-ser接头。
9.如实施方案2-8中的任一者所述的方法,其中所述柔性接头是包括57个氨基酸的gly-ser接头。
10.如实施方案2-6、8或9中的任一者所述的方法,其中所述柔性接头是seqidno:122。
11.如实施方案2-10中的任一者所述的方法,其中所述跳跃元件在所述所选抗体的所述全长轻链与所述所选抗体的所述重链的所述可变区之间。
12.如实施方案2-11中的任一者所述的方法,其中所述跳跃元件是自裂解肽。
13.如实施方案12所述的方法,其中所述自裂解肽选自seqidno:176-179。
14.如实施方案2-13中的任一者所述的方法,其中所述跳跃元件是内部核糖体进入位点(ires)。
15.如实施方案2-14中的任一者所述的方法,其中所述重链启动子选自seqidno:111和128。
16.如实施方案2-15中的任一者所述的方法,其中所述重链启动子是igvh1-69或j558h10。
17.如实施方案2-16中的任一者所述的方法,其中所述信号肽选自seqidno:118、134以及185-194。
18.如实施方案2-17中的任一者所述的方法,其中所述信号肽源于人igh重链或人igl轻链。
19.如实施方案1-18中的任一者所述的方法,其中所述遗传构建体包括同源臂。
20.如实施方案19所述的方法,其中所述同源臂包括seqidno:90-101、110、125、127、140、142、143、153、170、171、173、174、278或279。
21.如实施方案1-20中的任一者所述的方法,其中所述遗传构建体编码标签。
22.如实施方案21所述的方法,其中所述标签包括
23.如实施方案21或22所述的方法,其中所述标签包括seqidno:122或195-204。
24.如实施方案1-23中的任一者所述的方法,所述方法还包括将选自seqidno:87-89以及290-366中的一者或多者的引导rna(grna)序列和核酸酶递送至所述b细胞。
25.如实施方案24所述的方法,其中所述递送通过电穿孔、纳米粒子或病毒介导的递送来达成。
26.如实施方案1-25中的任一者所述的方法,其中所述遗传构建体是腺相关病毒载体的一部分。
27.如实施方案24-26中的任一者所述的方法,其中所述grna和所述核酸酶通过电穿孔递送,并且所述遗传构建体作为腺相关病毒载体的一部分加以递送。
28.如实施方案24-27中的任一者所述的方法,其中所述核酸酶是cas9或cpf1。
29.如实施方案24-28中的任一者所述的方法,其中由所述grna序列中的一者或多者靶向的靶标序列选自seqidno:5-84中的一者或多者,并且所述grna选自seqidno:87-89以及290-366中的一者或多者。
30.如实施方案1-29中的任一者所述的方法,其中所述所选抗体是抗rsv抗体,包括帕利珠单抗、ab1128或ab20745。
31.如实施方案1-30中的任一者所述的方法,其中所述所选抗体是:含有包括seqidno:138的重链和包括seqidno:136的轻链的帕利珠单抗;含有包括seqidno:138的重链和包括seqidno:205的轻链的帕利珠单抗;含有包括seqidno:123的重链和包括seqidno:120的轻链的抗rsv抗体;或含有包括seqidno:123的重链和包括seqidno:206的轻链的抗rsv抗体。
32.如实施方案1-30中的任一者所述的方法,其中所述所选抗体是含有包括seqidno:207的cdrh1、包括seqidno:208的cdrh2、包括seqidno:209的cdrh3;包括seqidno:210的cdrl1、包括seqidno:211的cdrl2和包括seqidno:212的cdrl3的抗rsv抗体。
33.如实施方案1-29中的任一者所述的方法,其中所述所选抗体是抗hiv抗体,包括10e8、vrc01、ab18633或39/5.4a。
34.如实施方案1-29或33中的任一者所述的方法,其中所述所选抗体是含有包括seqidno:150的重链和包括seqidno:149的轻链的抗hiv抗体。
35.如实施方案1-29或33中的任一者所述的方法,其中所述所选抗体是含有包括seqidno:213的cdrh1、包括seqidno:214的cdrh2、包括seqidno:215的cdrh3、包括seqidno:216的cdrl1、包括seqidno:217的cdrl2和包括seqidno:218的cdrl3,或包括seqidno:219的cdrh1、包括seqidno:220的cdrh2、包括seqidno:221的cdrh3、包括qygs的cdrl1、包括sgs的cdrl2和包括seqidno:222的cdrl3的抗hiv抗体。
36.如实施方案1-29中的任一者所述的方法,其中所述所选抗体是抗登革病毒抗体,包括抗体55、db2-3、ab155042或ab80914。
37.如实施方案1-29或36中的任一者所述的方法,其中所述所选抗体是含有包括seqidno:223的cdrh1、包括seqidno:224的cdrh2、包括seqidno:225的cdrh3;包括seqidno:226的cdrl1、包括seqidno:227的cdrl2和包括seqidno:228的cdrkl3,或包括seqidno:229的cdrh1、包括seqidno:230的cdrh2、包括seqidno:231的cdrh3、包括seqidno:232的cdrl1、包括seqidno:233的cdrl2和包括seqidno:234的cdrl3的抗登革病毒抗体。
38.如实施方案1-29中的任一者所述的方法,其中所述所选抗体是含有包括seqidno:235的重链和包括seqidno:236的轻链的抗百日咳抗体。
39.如实施方案1-29中的任一者所述的方法,其中所述所选抗体是抗丙型肝炎抗体,包括mab8694或c7-50。
40.如实施方案1-29或39中的任一者所述的方法,其中所述所选抗体是含有包括seqidno:237的cdrh1、包括seqidno:238的cdrh2、包括seqidno:239的cdrh3、包括seqidno:240的cdrl1、包括seqidno:241的cdrl2和包括seqidno:242的cdrl3的抗丙型肝炎抗体。
41.如实施方案1-29中的任一者所述的方法,其中所述所选抗体是抗流感病毒抗体,包括c102。
42.如实施方案1-29或41中的任一者所述的方法,其中所述所选抗体是含有包括seqidno:159的重链和包括seqidno:158的轻链的抗流感病毒抗体。
43.如实施方案1-29或41中的任一者所述的方法,其中所述所选抗体是含有包括seqidno:243的cdrh1、包括seqidno:244的cdrh2、包括seqidno:245的cdrh3、包括seqidno:246的cdrl1、包括kts的cdrl2和包括seqidno:247的cdrl3的抗流感病毒抗体。
44.如实施方案1-29中的任一者所述的方法,其中所述所选抗体是抗mpv抗体,包括mpe8。
45.如实施方案1-29中的任一者所述的方法,其中所述所选抗体是抗cmv抗体,包括mcmv5322a、mcmv3068a、ljp538或ljp539。
46.如实施方案1-29中的任一者所述的方法,其中所述所选抗体是含有包括seqidno:168的重链和包括seqidno:166的轻链的抗ebv抗体。
47.如实施方案1-29中的任一者所述的方法,其中所述所选抗体是含有包括seqidno:248的cdrh1、包括seqidno:249的cdrh2、包括seqidno:250的cdrh3、包括seqidno:251的cdrl1、包括seqidno:252的cdrl2和包括seqidno:253的cdrl3的抗ebv抗体。
48.如实施方案1-29中的任一者所述的方法,其中所述所选抗体是抗hsv抗体,包括hsv8-n和mb66。
49.如实施方案1-29中的任一者所述的方法,其中所述所选抗体是抗艰难梭菌抗体,包括阿克托单抗或贝兹托单抗。
50.如实施方案1-29中的任一者所述的方法,其中所述所选抗体是抗tnf抗体,包括英夫利昔单抗、阿达木单抗、依那西普、塞利珠单抗或它们的被接受的生物类似物。
51.如实施方案1-29或50中的任一者所述的方法,其中所述所选抗体是含有包括seqidno:254的重链和包括seqidno:255的轻链;包括seqidno:256的cdrh1、包括seqidno:257的cdrh2和包括seqidno:258的cdrh3;包括seqidno:259的cdrl1、包括seqidno:260的cdrl2和包括seqidno:261的cdrl3;包括seqidno:262的cdrh1、包括seqidno:263的cdrh2和包括seqidno:264的cdrh3;包括seqidno:265的cdrl1、包括seqidno:266的cdrl2和包括seqidno:267的cdrl3;包括seqidno:268的cdrh1、包括seqidno:269的cdrh2和包括seqidno:270的cdrh3;或包括seqidno:271的cdrl1、包括seqidno:272的cdrl2和包括seqidno:273的cdrl3的抗tnf抗体。
52.如实施方案1-51中的任一者所述的方法,其中遗传修饰利用包括seqidno:87、88、89、90-175、278-366中的任一者的序列。
53.如实施方案1-52中的任一者所述的方法,其中所述b细胞是抗体产生性b细胞、记忆b细胞、原初b细胞、b1b细胞或边缘区b细胞。
54.一种b细胞,所述b细胞根据如实施方案1-53中的任一者所述的方法加以修饰。
55.如实施方案54所述的b细胞,其中所述b细胞是抗体分泌性b细胞、记忆b细胞、原初b细胞、b1b细胞或边缘区b细胞。
56.一种在有需要的受试者中提供抗感染作用的方法,所述方法包括向所述受试者施用治疗有效量的如实施方案54或55所述的b细胞,由此提供抗感染作用。
57.如实施方案56所述的方法,其中所述提供免除对疫苗接种的需要。
58.如实施方案56或57所述的方法,其中所述施用替代疫苗接种方案。
59.如实施方案56-58中的任一者所述的方法,其中所述受试者经受免疫抑制。
60.如实施方案56-59中的任一者所述的方法,其中所述受试者经受免疫抑制作为治疗方案的一部分,所述治疗方案包括骨髓移植、造血干细胞移植或施用经遗传修饰造血干细胞。
61.一种在有需要的受试者中提供消炎作用的方法,所述方法包括向所述受试者施用治疗有效量的如实施方案54或55所述的b细胞,由此提供消炎作用。
62.一种用于修饰b细胞以表达所选抗体的遗传构建体,所述遗传构建体包括或编码(i)重链启动子、(ii)信号肽、(iii)所述所选抗体的全长轻链;(iv)柔性接头或跳跃元件;(v)所述所选抗体的重链的可变区;和(vi)剪接接合点。
63.如实施方案62所述的遗传构建体,所述遗传构建体包括seqidno:102-175或280-289。
64.如实施方案62或63所述的遗传构建体,其中所述柔性接头在所述所选抗体的所述全长轻链与所述所选抗体的所述重链的所述可变区之间。
65.如实施方案62-64中的任一者所述的遗传构建体,其中所述柔性接头选自seqidno:180-184。
66.如实施方案62-65中的任一者所述的遗传构建体,其中所述柔性接头是包括50-80个氨基酸的gly-ser接头。
67.如实施方案62-66中的任一者所述的遗传构建体,其中所述柔性接头是包括57个氨基酸的gly-ser接头。
68.如实施方案62-64、66或67中的任一者所述的遗传构建体,其中所述柔性接头是seqidno:122。
69.如实施方案62-68中的任一者所述的遗传构建体,其中所述跳跃元件在所述所选抗体的所述全长轻链与所述所选抗体的所述重链的所述可变区之间。
70.如实施方案62-69中的任一者所述的遗传构建体,其中所述跳跃元件是自裂解肽。
71.如实施方案70所述的遗传构建体,其中所述自裂解肽选自seqidno:176-179。
72.如实施方案62-69中的任一者所述的遗传构建体,其中所述跳跃元件是内部核糖体进入位点(ires)。
73.如实施方案62-72中的任一者所述的遗传构建体,其中所述重链启动子选自seqidno:111和128。
74.如实施方案62-73中的任一者所述的遗传构建体,其中所述重链启动子是igvh1-69或j558h10。
75.如实施方案62-74中的任一者所述的遗传构建体,其中所述信号肽选自seqidno:118、134以及185-194。
76.如实施方案62-75中的任一者所述的遗传构建体,其中所述信号肽源于人igh重链或人igl轻链。
77.如实施方案62-76中的任一者所述的遗传构建体,其中所述遗传构建体包括同源臂。
78.如实施方案77所述的遗传构建体,其中所述同源臂包括seqidno:90-101、110、125、127、140、142、143、153、170、171、173、174、278或279。
79.如实施方案62-78中的任一者所述的遗传构建体,其中所述遗传构建体编码标签。
80.如实施方案79所述的遗传构建体,其中所述标签包括
81.如实施方案79或80所述的遗传构建体,其中所述标签包括seqidno:122或195-204。
82.如实施方案62-81中的任一者所述的遗传构建体,其中所述所选抗体是抗rsv抗体,包括帕利珠单抗、ab1128或ab20745。
83.如实施方案62-82中的任一者所述的遗传构建体,其中所述所选抗体是:含有包括seqidno:138的重链和包括seqidno:136的轻链的帕利珠单抗;含有包括seqidno:138的重链和包括seqidno:205的轻链的帕利珠单抗;含有包括seqidno:123的重链和包括seqidno:120的轻链的抗rsv抗体;或含有包括seqidno:123的重链和包括seqidno:206的轻链的抗rsv抗体。
84.如实施方案62-82中的任一者所述的遗传构建体,其中所述所选抗体是含有包括seqidno:207的cdrh1、包括seqidno:208的cdrh2、包括seqidno:209的cdrh3;包括seqidno:210的cdrl1、包括seqidno:211的cdrl2和包括seqidno:212的cdrl3的抗rsv抗体。
85.如实施方案62-81中的任一者所述的遗传构建体,其中所述所选抗体是抗hiv抗体,包括10e8、vrc01、ab18633或39/5.4a。
86.如实施方案62-81或85中的任一者所述的遗传构建体,其中所述所选抗体是含有包括seqidno:150的重链和包括seqidno:149的轻链的抗hiv抗体。
87.如实施方案62-81或85中的任一者所述的遗传构建体,其中所述所选抗体是含有包括seqidno:213的cdrh1、包括seqidno:214的cdrh2、包括seqidno:215的cdrh3、包括seqidno:216的cdrl1、包括seqidno:217的cdrl2和包括seqidno:218的cdrl3,或包括seqidno:219的cdrh1、包括seqidno:220的cdrh2、包括seqidno:221的cdrh3、包括qygs的cdrl1、包括sgs的cdrl2和包括seqidno:222的cdrl3的抗hiv抗体。
88.如实施方案62-81中的任一者所述的遗传构建体,其中所述所选抗体是抗登革病毒抗体,包括抗体55、db2-3、ab155042或ab80914。
89.如实施方案62-81或88中的任一者所述的遗传构建体,其中所述所选抗体是含有包括seqidno:223的cdrh1、包括seqidno:224的cdrh2、包括seqidno:225的cdrh3;包括seqidno:226的cdrl1、包括seqidno:227的cdrl2和包括seqidno:228的cdrkl3,或包括seqidno:229的cdrh1、包括seqidno:230的cdrh2、包括seqidno:231的cdrh3、包括seqidno:232的cdrl1、包括seqidno:233的cdrl2和包括seqidno:234的cdrl3的抗登革病毒抗体。
90.如实施方案62-81中的任一者所述的遗传构建体,其中所述所选抗体是含有包括seqidno:235的重链和包括seqidno:236的轻链的抗百日咳抗体。
91.如实施方案62-81中的任一者所述的遗传构建体,其中所述所选抗体是抗丙型肝炎抗体,包括mab8694或c7-50。
92.如实施方案62-81或91中的任一者所述的遗传构建体,其中所述所选抗体是含有包括seqidno:237的cdrh1、包括seqidno:238的cdrh2、包括seqidno:239的cdrh3、包括seqidno:240的cdrl1、包括seqidno:241的cdrl2和包括seqidno:242的cdrl3的抗丙型肝炎抗体。
93.如实施方案62-81中的任一者所述的遗传构建体,其中所述所选抗体是抗流感病毒抗体,包括c102。
94.如实施方案62-81或93中的任一者所述的遗传构建体,其中所述所选抗体是含有包括seqidno:159的重链和包括seqidno:158的轻链的抗流感病毒抗体。
95.如实施方案62-81或93中的任一者所述的遗传构建体,其中所述所选抗体是含有包括seqidno:243的cdrh1、包括seqidno:244的cdrh2、包括seqidno:245的cdrh3、包括seqidno:246的cdrl1、包括kts的cdrl2和包括seqidno:247的cdrl3的抗流感病毒抗体。
96.如实施方案62-81中的任一者所述的遗传构建体,其中所述所选抗体是抗mpv抗体,包括mpe8。
97.如实施方案62-81中的任一者所述的遗传构建体,其中所述所选抗体是抗cmv抗体,包括mcmv5322a、mcmv3068a、ljp538或ljp539。
98.如实施方案62-81中的任一者所述的遗传构建体,其中所述所选抗体是含有包括seqidno:168的重链和包括seqidno:166的轻链的抗ebv抗体。
99.如实施方案62-81中的任一者所述的遗传构建体,其中所述所选抗体是含有包括seqidno:248的cdrh1、包括seqidno:249的cdrh2、包括seqidno:250的cdrh3、包括seqidno:251的cdrl1、包括seqidno:252的cdrl2和包括seqidno:253的cdrl3的抗ebv抗体。
100.如实施方案62-81中的任一者所述的遗传构建体,其中所述所选抗体是抗hsv抗体,包括hsv8-n和mb66。
101.如实施方案62-81中的任一者所述的遗传构建体,其中所述所选抗体是抗艰难梭菌抗体,包括阿克托单抗或贝兹托单抗。
102.如实施方案62-81中的任一者所述的遗传构建体,其中所述所选抗体是抗tnf抗体,包括英夫利昔单抗、阿达木单抗、依那西普、塞利珠单抗或它们的被接受的生物类似物。
103.如实施方案62-81或102中的任一者所述的遗传构建体,其中所述所选抗体是含有包括seqidno:254的重链和包括seqidno:255的轻链;包括seqidno:256的cdrh1、包括seqidno:257的cdrh2和包括seqidno:258的cdrh3;包括seqidno:259的cdrl1、包括seqidno:260的cdrl2和包括seqidno:261的cdrl3;包括seqidno:262的cdrh1、包括seqidno:263的cdrh2和包括seqidno:264的cdrh3;包括seqidno:265的cdrl1、包括seqidno:266的cdrl2和包括seqidno:267的cdrl3;包括seqidno:268的cdrh1、包括seqidno:269的cdrh2和包括seqidno:270的cdrh3;或包括seqidno:271的cdrl1、包括seqidno:272的cdrl2和包括seqidno:273的cdrl3的抗tnf抗体。
104.一种用于对b细胞进行遗传修饰的试剂盒,所述试剂盒包括如实施方案62-103中的任一者所述的遗传构建体和靶向seqidno:1、seqidno:2、seqidno:3或seqidno:4的grna。
105.如实施方案104所述的试剂盒,其中所述grna选自seqidno:87、88、89以及290-366中的一者或多者。
106.如实施方案104或105所述的试剂盒,所述试剂盒还包括核酸酶。
107.如实施方案106所述的试剂盒,其中所述核酸酶是cas9或cpf1。
108.如实施方案104-107中的任一者所述的试剂盒,所述试剂盒还包括纳米粒子或腺相关病毒载体。
109.如实施方案104-108中的任一者所述的试剂盒,其中所述grna和所述核酸酶与纳米粒子相关联。
110.如实施方案104-109中的任一者所述的试剂盒,其中所述遗传构建体是腺相关病毒载体的一部分。
实施例1.在不采用疫苗的情况下提供针对呼吸道合胞病毒感染的终身保护。呼吸道合胞病毒(rsv)是患有慢性肺病、先天性心脏病或早产的幼小儿童特别是婴儿的重度呼吸道疾病的主要原因。体液免疫性可介导针对rsv的有效保护,由重组抗体
对于rsv以及其他难以通过疫苗接种来对抗的疾病,通过对原代b细胞进行工程改造以引发所需治疗性抗体的表达来绕过疫苗接种极其具有吸引力。免疫球蛋白(ig)基因座是极其巨大的,多样的,并且经受广泛基因组重组和编辑。此外,免疫球蛋白基因的转录以产生膜形式与分泌形式两者依赖于由调控性dna元件对mrna剪接和多腺苷酸化的调控。这个复杂性已使得作为用于对淋巴细胞进行细胞工程改造的传统方法的病毒转导对于产生治疗性b细胞来说在技术上不切实际。
特定实施方案包括一种用于通过单击免疫遗传工程改造来对原代b细胞抗体特异性进行快速和选择性重新编程的平台。这个平台利用微同源性介导的末端接合dna修复路径在原代b细胞中的高活性来在由cas9/sgrna核糖蛋白创建dna断裂之后插入完全合成的杂合双链/单链dna模板。这个方法的关键是保留内源性调控元件,此允许对表面结合型和分泌型抗体表达进行天然控制。此外,策略不局限于rsv。可有可能的是仅采用单次血液抽取以及数天后的后续细胞输注来表达针对实际上任何病原体具有保护性的抗体。
材料和方法。sgrna的设计。使用crisprgold(crisprgold.mdc-berlin.de)设计靶向小鼠和人igh基因座中的内含子序列的sgrna,并且以在前三个5’和3’末端rna残基处并有2’-o-甲基类似物和3’硫代磷酸酯核苷酸间键联的合成形式产生(synthego)。
基因组靶向序列如下:
小鼠:uuauacaguauccgaugcau(seqidno:87)
人:gucucaggagcggugucugu(seqidno:89)
模板序列的设计和装配。
人:抗体构建体包括igvh1-69重链启动子区域(seqidno:111)、帕利珠单抗的全长密码子优化轻链(seqidno:113(核苷酸)和seqidno:120(氨基酸))、含有streptagii基序的3个串联拷贝的具有57个氨基酸的甘氨酸-丝氨酸接头(seqidno:116(核苷酸)和seqidno:122(氨基酸))、帕利珠单抗重链的密码子优化可变区(seqidno:117(核苷酸)和seqidno:123(氨基酸))、以及具有60bp的源于人ighj1基因区段的侧接序列的剪接接合点(seqidno:124)。
小鼠:mcherry模板包括j5558h10重链启动子、完全的密码子优化mcherry开放阅读框和sv40多腺苷酸化位点。抗体构建体包括j5558h10重链启动子(seqidno:128,v.alove等molecularimmunology2000)、全长密码子优化抗体轻链(seqidno:130(核苷酸)和seqidno:135(氨基酸))、含有streptagii序列的两个串联拷贝的具有57个氨基酸的甘氨酸-丝氨酸接头(seqidno:116(核苷酸)和seqidno:122(氨基酸))、重抗体链的密码子优化可变区(seqidno:133(核苷酸)和seqidno:138(氨基酸))、以及具有60bp的源于小鼠ighj3基因区段的侧接序列的剪接接合点(seqidno:139)。
缝合寡核苷酸(即拼接寡核苷酸)的退火。以合成方式产生与pam远端和pam近端非靶标dna链具有36bp的互补性,以及与所插入模板具有50-100bp的互补性的缝合寡核苷酸,并且在使用之前预先退火于dna模板(例如seqidno:96-101)。拼接寡核苷酸可提供如图15中所示的“同源缝线”。
腺相关病毒(aav)病毒载体模板递送。aav病毒载体含有mnd启动子、完全的密码子优化mcherry开放阅读框和sv40多腺苷酸化位点,由2个小鼠sgrna识别位点或400bp的同源序列侧接。在293t细胞中产生用aav6病毒衣壳加以假型化的aav病毒粒子,并且通过蔗糖梯度离心纯化并储存在-80℃下。对于病毒递送模板dna,在电穿孔之前12小时添加浓缩aav病毒以达到最终体积是总培养体积的10%。
小鼠b细胞培养和电穿孔。基础b细胞培养基包括具有10%胎牛血清(hyclone)、10mmhepes(gibco)、1mm丙酮酸钠(gibco)、55μmβ-巯基乙醇(sigma)、以及100u/ml青霉素加100μg/ml链霉素(gibco)的rpmi培养基,例外之处是在如所指示的无抗生素步骤中。
通过用磁性珠粒(miltenyi)进行负性选择来从脾和淋巴结分离b细胞,并且在补充以100ng/ml重组无载体ha标签化小鼠cd40l(r&dsystems)、100ng/ml抗ha抗体(克隆543851,r&dsystems)和4ng/ml小鼠il-4(r&dsystems)的b细胞培养基中在2×106/毫升下培养24小时。接着,如下使用neon转染系统和10μl吸头对b细胞进行电穿孔。使cas9蛋白(invitrogen)和合成sgrna(synthego)在3μgcas9/900ngsgrna的比率下混合,并且在室温下孵育至少10分钟。将b细胞用pbs洗涤,并且在2.5×107个细胞/毫升的最终密度下与cas9/sgrna和预先装配的dna模板一起混悬于neon缓冲液t中。对细胞进行电穿孔(1675v,10毫秒,3次脉冲),并且立刻分配至预先温热的无抗生素培养基中。
对于细胞扩增,使b细胞与经照射(80戈瑞)3t3-cd40l饲养细胞在20ng/ml小鼠il-21存在下共培养。
利用通过分解对插入缺失进行追踪(tide)来评估sgrna活性。在电穿孔后3-5天时从模拟处理细胞和经cas9处理细胞分离总基因组dna。使用以下寡聚物,通过pcr来扩增侧接于切割位点的500-600bp区域:
小鼠:正向:ggctccaccagacctctcta(seqidno:274)
反向:aacctcagtcaccgtctcct(seqidno:275)
人:正向:acagtaagcatgcctcctaag(seqidno:276)
反向:gccactctagggcctttgtt(seqidno:277)
结果。结果显示于图18a-图18c、图22a和图22b、图23b-图23e、以及图24a-图24c中。图18a、图18b和图18c分别显示在用cas9/sgrna核糖核蛋白对细胞进行电穿孔之后,在靶标igh基因座处对小鼠b细胞株系a20、原代小鼠b细胞和人b细胞株系ramos的成功切割。图22a和图22b描绘mcherry荧光蛋白报告体向原代小鼠b细胞的igh基因座中的插入。图23b和图23c显示在部分抗体盒插入a20小鼠b细胞株系(图23b)和ramos人b细胞株系(图23c)中之后,抗rsv抗体的表面表达。图23d和图23e显示在部分抗体盒插入a20小鼠b细胞株系(图23d)和ramos人b细胞株系(图23e)中之后,抗rsv抗体的分泌。图24a显示在部分抗体盒插入原代小鼠b细胞中之后,在初始时(左侧图版)以及在体外富集和扩增之后(右侧图版),抗rsv抗体的表面表达。图24b显示在部分抗体盒插入原代小鼠b细胞株系中之后,抗rsv抗体的分泌。图24c显示经工程改造b细胞的体外增殖潜力。
实施例2.这个实施例的目标在于通过对igh基因座进行基因组工程改造来产生维持对分泌型和表面ig表达的天然控制的具有确定特异性的经遗传修饰b细胞。由于存在于b细胞中的高度可变序列,所以b细胞中的igh基因座是难以靶向以进行基因组工程改造的区域。b细胞发育导致历经超过1兆dna碱基进行的v、d和j元件的重组以产生对抗体多样性重要的vdj可变区。在b细胞个体发生的晚些时候,不同恒定区之间的类别转换导致历经类似序列范围而丧失dna(综述于watson等,(2017).trendsimmunol38(7):459-470中)。
这个序列可变性使得直接靶向抗体编码区不切实际。然而,末个j基因区段与涉及于类别转换中的转换区域之间的小dna区域存在于所有b细胞中。这个通用靶标含有关键内含子eμ增强子,所述eμ增强子是尽管它们伴有弱启动子,但协作以驱动igh基因的高水平表达的若干强力增强子元件中的一者。这些增强子的活性部分地由启动子相对于eμ增强子的邻近性调控,并且在重组vdj区段与eμ增强子之间插入转基因可完全阻断vdj转录(delpy等,(2002).jimmunol169(12):6875-6882)。出于这个原因,用于这个实施例中的方法靶向在eμ增强子的上游的区域以插入新抗体盒(图26a)。通过靶向这个区域,所插入emab基因可由天然的(但为所插入的)igh启动子驱动,从而使对免疫球蛋白表达的天然控制最大化。
为使得能够达成一击插入以及使脱靶相互作用最小化,emab构建体以单链融合物形式表达。这个融合物由完全轻链序列以具有57个氨基酸的甘氨酸-丝氨酸接头连接于重链的可变区组成,所述接头如已对于单链f(ab)片段所述。(koerber等,(2015).jmolbiol427(2):576-586)(图26a)。这个接头含有streptagii基序的3个串联重复,以有助于检测和富集经遗传修饰细胞(schmidt和skerra(2007).natprotoc2(6):1528-1535)。以物理方式连接轻链和重链使所插入emab与内源性轻链之间的错误配对的可能性最小化。优化剪接接合点允许emab剪接于下游内源性igh恒定区。这允许emab以重链同种型类别中的任一者表达。
在ramos人b细胞株系中测试策略。这个伯基特淋巴瘤源性b细胞株系天然地表达与λ轻链配对的igm的表面形式和分泌形式。在这些实验中,使用单体rsv-f蛋白和streptactin检测源于帕利珠单抗的经工程改造αrsv-emab的表达,所述streptactin是一种对接头中的streptagii基序具有高亲和力的经修饰链霉亲和素。经αrsv-emab遗传修饰ramos细胞表达经工程改造rsv特异性抗体,所述抗体可在细胞的表面上(图26b)以及以分泌形式在上清液中(图26c)检测到。为确认emabbcr与对bcr信号传导至关重要的二级蛋白质复合物一起装配,使ramos细胞暴露于用多聚化rsv-f抗原进行的刺激。经αrsv-emab工程改造细胞而非对照细胞应答于蛋白质抗原展现快速和持续的钙信号传导(图26d)。这些数据用于确认emab工程改造方法的可行性。
接着,使用多步骤扩增和分化过程来遗传修饰人原代b细胞(图27a)。用预先复合的引导rna和cas9进行的电穿孔导致对基因组dna的高度高效切割,从而导致对遍及多个独立供者分析的靶标等位基因中的70%中的这个区域的有缺陷修复(图27b)。sgrna靶标位点在人中强烈保守,无报告单核苷酸多态性在高于1%的频率下加以报告(图27c)。添加aav递送的αrsv-emab盒对人b细胞进行高效重新编程以结合rsv-f蛋白(图27d)。值得注意的是,emabb细胞已从测试的每个人供者成功产生,具有24%的平均工程改造率(图27e)。在产生emab期间的体外培养和分化使抗体分泌潜力增加。致敏细胞在第2天时表达高水平的cd19,以及低量的浆细胞标志物cd138、cd27和cd138,这不同于在第18天时的具有较低水平的cd19以及增加的cd38、cd27和cd138的细胞(图27f)。对应于细胞表面标志物的这些改变,分化的经emab工程改造b细胞分泌大量所靶向抗体(图27g)。总之,这些数据显示能够快速和高效工程改造原代b细胞以产生特异性保护性抗体。
为显示平台的灵活方面,测试了源于3种额外广泛中和性抗病毒抗体的emab盒,所述抗体包括抗hiv靶向vrc01、ebv靶向amm01和流感ha主干靶向medi8852。原代b细胞被所有4种构建体高效重新编程,所述构建体包括具有κ(帕利珠单抗、vrc01、medi8852)轻链与λ(amm01)轻链两者的抗体(图28)。这些数据显示emab平台具有灵活和广泛可应用性质。
阻断内源性ig重链的产生对于使emab的产生最大化以及使来自经遗传修饰细胞的未知内源性抗体的产生的潜力最小化是重要的。ramosb细胞株系内源性表达与λ轻链配对的igh。用连接于κ轻链的αrsv-emab工程改造这些细胞使得能够使用表面λ轻链表达作为igh表达的有效量度。此外,ramos细胞已经受c-myc易位,从而破坏一个igh等位基因,以致任何emab插入都将必然在有效等位基因中(图29a)。输入ramos细胞在表面上表达高水平的λ轻链,而表达αrsv-emab的细胞已几乎完全丧失λ表达(图29b)。这些数据指示emab在有效等位基因上的插入可有效阻断内源性igh的表达。在几乎所有原代b细胞中,一个igh等位基因具有有效vdj重排,而另一等位基因不经受vdj重组,或加以无效重组。然而,这些等位基因均具有用于emab插入的潜在位点(图29c)。为测试emab插入的影响,用αrsv-emab遗传修饰表达λ轻链的纯化原代b细胞。输入细胞继续在表面上表达与λ轻链配对的内源性抗体。相比之下,一半经αrsv-emab工程改造b细胞已丧失λ轻链表达(图29d)。在ramos和原代b细胞的情况下所见的差异性表达样式表明如果插入有效等位基因中,那么emab插入可阻断内源性igh表达。表面轻链的差异性表达是用于纯化仅表达emab构建体的细胞的途径。或者,在任一等位基因处进行插入的潜力提供通过选择用于工程改造的抗病毒记忆b细胞的初始汇合物,或通过在每个等位基因上插入不同盒来产生双抗体表达性emab细胞的可能性。
已显示了能够工程改造b细胞,接着确认细胞在鼠病毒性感染模型中的保护能力。使用与在人原代b细胞的情况下使用的过程类似的致敏、电穿孔+emab盒递送以及扩增的过程(图30a),产生鼠emabb细胞。采用电穿孔与预先复合的引导rna和cas9组合,切割是高度高效的,从而导致对所分析的dna中的80%中的这个区域的有缺陷修复(图30b)。通过aav递送鼠αrsv-emab盒可重现地修饰了小鼠b细胞,其中8-24%的鼠b细胞结合rsv-f(图30c、图30d)。使用含有短同源区的双链dna(dsdna)而非aav,也实现了在1-7%的细胞中的插入(图30c、图30d,也参见实施例1),从而提供使用单纯合成组分对b细胞进行emab工程改造的潜力。分泌型经工程改造抗体的高效价也可在通过两种方法产生的培养上清液中检测到(图30e)。
为测试抗病毒保护的潜力,将1.5x107个经遗传修饰小鼠b细胞输注至野生型balbc/byj小鼠中,随后进行血液抽取和rsv激发(图31a)。在转移经遗传修饰b细胞之后6天,rsv特异性抗体和经遗传修饰b细胞存在于血液中(图31b、图31c)。重要的是,接受经遗传修饰b细胞的小鼠几乎完全受到针对rsv感染的保护(图31d)。这个保护接近于通过在感染之前2天注射帕利珠单抗提供的保护(图31d)。将靶向rsv和流感的混合人emab细胞转移至nod-scidil2rγnull(nsg)小鼠产生靶向两种病毒的抗体的血清效价(图32a、图32b)。这些结果显示本文公开的经遗传修饰b细胞针对病毒性感染进行保护。
方法。单链抗体模板序列的设计。人:抗体构建体包括igvh1-69重链启动子区域(seqidno:111)、全长抗体轻链(例如seqidno:113、145、154和161(核苷酸)和seqidno:119、148、157和165(氨基酸))、含有streptagii基序的3个串联拷贝的具有57个氨基酸的甘氨酸-丝氨酸接头(seqidno:116(核苷酸)和seqidno:122(氨基酸))、重链的可变区(例如seqidno:117、147、156和164(核苷酸)和seqidno:123、150、159和168(氨基酸))、以及具有60个碱基对的源于匹配ighj可变区的侧接序列的剪接接合点(例如seqidno:124和151)。
小鼠:抗体构建体包括j5558h10重链启动子(seqidno:128,v.alove等molecularimmunology2000)、全长密码子优化抗体轻链(例如seqidno:130(核苷酸)和seqidno:135(氨基酸))、含有streptagii序列的三个串联拷贝的具有57个氨基酸的甘氨酸-丝氨酸接头(seqidno:116(核苷酸)和seqidno:122(氨基酸))、重抗体链的密码子优化可变区(例如seqidno:133(核苷酸)和seqidno:138(氨基酸))、以及具有60个碱基对的源于小鼠ighj3基因区段的侧接序列的剪接接合点(例如seqidno:139)。
示例性抗体构建体的完全序列可在图25b-图25i中获得。
重组aav载体的产生。通过使用pei将aav载体、血清型6衣壳和腺病毒辅助质粒(phelper)三重转染至hek293t细胞中来产生aav载体。在转染后24小时,将培养基变为无血清dmem,并且在72小时之后,收集细胞,通过冷冻-解冻来溶解,用全能核酸酶(benzonase)处理,历经碘克沙醇(iodixanol)梯度加以纯化,随后使用amiconultra-15管柱(emdmillipore)浓缩至pbs中(choi等,(2007).currprotocmolbiol第16章:单元1625)。病毒储备物的效价通过对aav基因组进行qpcr来测定,并且在每微升5×1010至1×1012的范围内(aurnhammer等,(2012).humgenethermethods23(1):18-28)。
鼠dsdnaemab模板的产生。
通过如下经修饰dna寡聚物来扩增αrsv-emab模板,并且添加短同源区。
正向引物:(含有5’磷酸酯,小鼠基因组同源区用粗体表示)
反向引物(含有硫代磷酸酯稳定的dna键(*),小鼠基因组同源区用粗体表示)
dsdna模板通过pcr扩增,使用minelutepcr净化管柱(qiagen)纯化以及浓缩。
细胞系。3t3-mscd40l借助于nihaids试剂计划(aids部门,niaid,nih:目录号12535)从markconnors博士处获得。在具有10%胎牛血清(gibco)、100u/ml青霉素加100μg/ml链霉素(gibco)、以及g418(350μg/ml)的dmem培养基中培养3t3细胞。
ramos细胞从atcc(crl-1596tm)获得。在具有10%胎牛血清(gibco)以及100u/ml青霉素加100μg/ml链霉素(gibco)的rpmi培养基中培养ramos细胞。
小鼠b细胞培养和电穿孔。基础b细胞培养基包括具有10%胎牛血清(geminibiosciences)、10mmhepes(gibco)、1mm丙酮酸钠(gibco)、55μmβ-巯基乙醇(sigma)、以及100u/ml青霉素加100μg/ml链霉素(gibco)的rpmi培养基,例外之处是在如所指示的无抗生素步骤中。
通过用磁性珠粒(miltenyi)进行负性选择来从脾和淋巴结分离b细胞,并且在补充以100ng/ml重组无载体ha标签化小鼠cd40l(r&dsystems)、100ng/ml抗ha抗体(克隆543851,r&dsystems)和4ng/ml小鼠il-4(r&dsystems)的b细胞培养基中在2×106/毫升下培养24小时。接着,如下使用neon转染系统对b细胞进行电穿孔。使cas9蛋白(invitrogen)和合成sgrna(synthego)在1μgcas9对300ngsgrna的比率下混合,并且在室温下孵育至少10分钟。将b细胞用pbs洗涤,并且在2.5×107个细胞/毫升的最终密度下与12μgcas9rnp/106个细胞一起混悬于neon缓冲液t中。对于dsdna条件,还在电穿孔中包括7.5μgdsdna模板/106个细胞。对细胞进行电穿孔(1675v,10毫秒,3次脉冲),并且立刻分配至预先温热的无抗生素培养基中。对于aav条件,添加处于pbs中的浓缩aav直至最终培养体积的15%。在电穿孔之后,用补充以100ng/ml重组无载体ha标签化小鼠cd40l(r&dsystems)、100ng/ml抗ha抗体(克隆543851,r&dsystems)、4ng/ml小鼠il-4(r&dsystems)和20ng/ml小鼠il-21(biolegend)的b细胞培养基使b细胞再扩增48小时。对于二级扩增,使b细胞与经照射(80戈瑞)nih3t3-cd40l饲养细胞在20ng/ml小鼠il-21(biolegend)存在下共培养。
人b细胞培养和电穿孔。用于人b细胞培养的基础培养基(hbcm)是在imdm培养基中具有10%fbs(geminibiosciences)、100u/ml青霉素和100μg/ml链霉素(gibco),例外之处是在如所指示的无抗生素步骤中。
人pbmc通过弗雷德哈钦森癌症研究中心(fredhutchinsoncancerresearchcenter)获得。使细胞解冻,并且根据制造商方案,使用militenyib细胞分离试剂盒ii(人),利用负性选择进行分离。将经分离细胞在0.5-1.0*10^6个细胞/毫升下再混悬于补充以100ng/mlmegacd40l(enzolifesciences)、50ng/ml重组il-2(biolegend)、50ng/mlil-10(shenendoahbiotech)、10ng/mlil-15(shenandoahbiotech)、1μg/mlcpgodn2006(idt)的hbcm中。
在刺激48小时之后,使用neon转染系统对细胞进行电穿孔。使cas9蛋白(invitrogen)和h7sgrna(synthego)在室温下在2:1比率下在缓冲液t中预先复合20分钟。将细胞用pbs(gibco)洗涤,并且于缓冲液t中在2.5*10^7个细胞/毫升的最终浓度下再混悬于含有预先复合的cas9rnp的缓冲液t中。将细胞-rnp混合物上样至10ulneon转染吸头中,并且根据制造商方案,以1750v、20ms和1次脉冲的设置进行电穿孔。在电穿孔之后立刻,将细胞涂铺至不具有抗生素的如上所述的刺激培养基中。在30分钟之后,添加aav以达到10-15%培养体积的最终浓度,并且充分混合。在2-4小时之后,将细胞转移至较大培养皿中以允许达成进一步扩增。
在电穿孔之后两天,将细胞用经荧光染料标记抗原或streptactin染色,并且选择经遗传修饰细胞。对于二级扩增,使b细胞与经照射(80戈瑞)nih3t3-cd40l饲养细胞在含有5μg/ml人重组胰岛素(sigma)、50μg/ml转铁蛋白(sigma)、50ng/ml重组il-2(biolegend)、20ng/mlil-21(biolegend)和10ng/mlil-15(shenandoahbiotech)的hbcm中共培养。
为促进分化成浆细胞,将细胞从扩增条件转移至新鲜无饲养细胞培养条件中,所述培养条件含有补充以5μg/ml人重组胰岛素(sigma)、50μg/ml转铁蛋白(sigma)、500u/ml通用i型ifn蛋白(r&dsystems)、50ng/mlil-6(shenendoahbiotech)、10ng/mlil-15(shenendoahbiotech)的hbcm。
通过tide来评估sgrna活性。在电穿孔后3-5天时从模拟处理细胞和经cas9/sgrna处理细胞分离总基因组dna。使用以下寡聚物,通过pcr来扩增侧接于sgrna靶标位点的500-600碱基对区域:
小鼠:
正向:ggctccaccagacctctcta(seq.idno:274)
反向:aacctcagtcaccgtctcct(seqidno:275)
人:
正向:acagtaagcatgcctcctaag(seqidno:276)
反向:gccactctagggcctttgtt(seqidno:277)
对纯化pcr产物进行sanger测序,并且使用ice算法(hsiau等,(2018)."inferenceofcrispreditsfromsangertracedata."biorxiv)来确定相对于经模拟电穿孔细胞,经cas9/sgrna电穿孔细胞中的插入缺失的频率。
蛋白质抗原。融合前rsv-f蛋白、ebvgh/gl复合物以及经修饰hiv包膜抗原(426ctm4d1-3)如所描述(mclellan等,(2013).science342(6158):592-598;mcguire等,(2016).natcommun7:10618;snijder等,(2018).immunity48(4):799-811e799)加以产生。稳定化流感ha主干如所描述(yassine等,(2015).natmed21(9):1065-1070)从源于病毒株h11999nc的vrc克隆3925产生。单体融合前rsv-f蛋白用alexa-488(thermofisher)标记。所有其他蛋白质都使用在0.8至2之间的生物素:蛋白质摩尔比缀合于生物素,随后用链霉亲和素-pe或链霉亲和素-apc(prozyme)进行四聚化。
流式细胞计量术。在facsymphony机器(bdbioscience)上进行流式细胞计量分析,在ariaii(bdbioscience)上分选细胞,并且使用flowjo软件(treestar)分析数据。
在小鼠中进行的emab治疗研究。动物研究在合乎弗雷德哈钦森癌症中心机构动物护理和使用委员会(fredhutchinsoncancercenterinstitutionalanimalcareandusecommittee)的要求的情况下加以核准和进行。
对于rsv激发,emab或对照b细胞以1.5×107个细胞的单次腹膜内(ip)剂量施用。对于被动转移帕利珠单抗,小鼠接受腹膜内15mg/kg的单次剂量。gfp表达性rsv(为简单起见,在本文中被称为rsv)得到了慷慨地提供(munir等,(2008).jvirol82(17):8780-8796)。年龄匹配的balb/cbyj小鼠(jacksonlabs)用处于40μlpbs中的106pfu的经蔗糖纯化rsv在鼻内接种。在感染后第5天收集肺,并且通过空斑测定如先前所述测定效价(murphy等,(1990).vaccine8(5):497-502)。简要来说,使肺在gentlemacs离解器中在2ml培养基中均质化,通过在400×g下离心10分钟加以澄清化,接着快速冷冻以及储存在-80℃下。将上清液一式两份于dmem培养基中加以1:10和1:20稀释。在24孔板中将100μl的每个稀释液添加至汇合vero细胞中,在37℃下持续2小时。接着添加0.8%甲基纤维素的覆盖层,并且将板孵育5天,随后在typhoon成像器上采用针对gfp的滤光片设置进行成像。通过对在最高阳性稀释度的情况下的空斑数目进行计数以及关于稀释因子加以修正来计算以pfu/肺表示的效价。
对于人细胞的移入,人emabb细胞以5×106个细胞/emab特异性(总体1×107)的单次腹膜内剂量向nod-scidil2rγnull(nsg)小鼠(由fhcrc培育研究室产生)施用。在转移后7天,抽取血液,并且通过elisa测定血清中的针对rsv-f和ha主干的人emab效价。
统计分析。使用graphpadprism7进行统计分析。使用采用韦尔奇氏修正(welch’scorrection)的未配对t检验进行成对比较。
本文所述的核酸序列使用核苷酸碱基的如37c.f.r.§1.822中定义的标准字母缩写显示。在一些情况下,仅显示每个核酸序列的一个链,但互补链应被理解为包括在它将在其中是适当的实施方案中。举例来说,互补于包括seqidno:5-84的靶标位点的序列提供用以靶向这些位点的grna靶向序列。
可利用编码如本文所述的所选抗体构建体的任何核酸。本文公开的核酸序列的变体包括各种序列多态性、突变和改变,其中序列差异不实质上影响所编码蛋白质的功能。术语核酸或“基因”可不仅包括编码序列,而且还包括调控区诸如启动子、增强子和终止区。所述术语还可包括从mrna转录物剪接的所有内含子和其他dna序列,以及由选择性剪接位点所致的变体。编码核酸可为引导一种或多种所选抗体构建体的表达的dna或rna。这些核酸序列可为转录成rna的dna链序列或翻译成蛋白质的rna序列。核酸序列包括全长核酸序列以及由全长蛋白质获得的非全长序列两者。序列还可包括一种或多种天然序列的可被引入来在特定细胞类型中提供密码子偏好的简并密码子。编码所选抗体构建体的核酸序列可易于根据所选抗体构建体的相关氨基酸序列制备。
蛋白质序列的“变体”包括相较于在本文中其他地方公开的蛋白质序列,具有一个或多个氨基酸添加、缺失、终止位置或取代的那些。
氨基酸取代可为保守性或非保守性取代。本文公开的蛋白质序列的变体可包括具有一个或多个保守性氨基酸取代的那些。“保守性取代”或“保守性氨基酸取代”涉及见于以下保守性取代群组中的一者中的取代:群组1:a、g、s、t;群组2:d、e;群组3:n、q;群组4:r、k、h;群组5:i、l、m、v;以及群组6:f、y、w。
另外,氨基酸可根据类似功能、化学结构或组成而分组成保守性取代群组(例如酸性、碱性、脂族、芳族或含硫)。举例来说,出于取代的目的,脂族分组可包括g、a、v、l和i。包括被视为彼此的保守性取代的氨基酸的其他群组包括:含硫:m和c;酸性:d、e、n和q;小型脂族非极性或略微极性残基:a、s、t、p和g;极性带负电荷残基以及它们的酰胺:d、n、e和q;极性带正电荷残基:h、r和k;大型脂族非极性残基:m、l、i、v和c;以及大型芳族残基:f、y和w。
非保守性取代包括显著影响:具有改变的区域中的肽骨架的结构(例如α螺旋或β折叠结构);分子的在靶标位点处的电荷或疏水性;或侧链的体积的那些。一般预期会在蛋白质的性质方面产生最大变化的非保守性取代是以下那些:其中(i)亲水性残基(例如s或t)可被取代成疏水性残基(例如l、i、f、v或a)(或由疏水性残基取代);(ii)c或p可被取代成任何其他残基(或由任何其他残基取代);(iii)具有电正性侧链的残基(例如k、r或h)可被取代成电负性残基(例如q或d)(或由电负性残基取代);或(iv)具有大体积侧链的残基(例如f)可被取代成不具有大体积侧链的残基(例如g)(或由不具有大体积侧链的残基取代)。额外信息见于creighton(1984)proteins,w.h.freemanandcompany中。
本文公开的核酸和蛋白质序列的变体还包括与本文公开的参考序列具有至少70%序列同一性、至少80%序列同一性、至少85%序列同一性、至少90%序列同一性、至少95%序列同一性、至少96%序列同一性、至少97%序列同一性、至少98%序列同一性或至少99%序列同一性的序列。
关于本文鉴定的序列的“序列同一性百分比(%)”定义为在使序列对准以及必要时引入空位以实现最大序列同一性百分比之后,候选序列中的与参考序列中的核酸或氨基酸残基同一的核酸或氨基酸残基的百分比。出于确定核酸或氨基酸序列同一性百分比的目的的比对可以属于本领域中的技能的各种方式实现,例如使用可公开获得的计算机软件诸如blast、blast-2、align、align-2或megalign(dnastar)软件。本领域技术人员可确定适于测量比对的参数,包括为历经所比较序列的全长实现最大对准所需的任何算法。举例来说,使用wu-blast-2计算机程序(altschul等,methodsinenzymology,266:460-480(1996))产生序列同一性%值,所述计算机程序使用若干搜索参数,其中大多数被设置成缺省值。未设置成缺省值的那些(即可调参数)用以下值加以设置:重叠间距=1,重叠分数=0.125,字阈值(t)=11以及评分矩阵blosum62。
变体将通常展现与参考核酸或肽序列相同的定性生物活性,并且引发大致上类似的生物应答,但可根据需要选择变体以改进参考核酸或肽的特征。对变体的筛选可使用本文所述的实验方案进行。
如将由本领域普通技术人员所了解,本文公开的每个实施方案可包含它的特定所陈述要素、步骤、成分或组分,基本上由它的特定所陈述要素、步骤、成分或组分组成,或由它的特定所陈述要素、步骤、成分或组分组成。因此,术语“包括(include/including)”应解释为叙述:“包含、由……组成、或基本上由……组成”。过渡术语“包含(comprise/comprises)”意指包括但不限于,并且允许包括未指定的要素、步骤、成分或组分,甚至以重大数量包括。过渡短语“由……组成”排除未指定的任何要素、步骤、成分或组分。过渡短语“基本上由……组成”将实施方案的范围限于指定的要素、步骤、成分或组分以及不实质上影响实施方案的那些。实质性影响将导致b细胞对所选抗体的表达统计显著降低。
除非另外指示,否则说明书和权利要求中使用的表述成分的数量、性质诸如分子量、反应条件等的所有数值都应被理解为在所有情况下都由术语“约”加以修饰。因此,除非相反指示,否则说明书和随附权利要求中阐述的数值参数是可视为本发明所设法获得的所需性质而变化的近似值。至少,并且不试图限制对权利要求的范围的等同物的原则的应用,每个数值参数应至少根据所报告的有效数字的数值以及通过应用普通舍入技术来解释。当需要进一步明晰性时,术语“约”在与陈述数值或范围联合使用时具有由本领域技术人员合理地归于它的含义,即表示稍微大于或稍微小于所述陈述值或范围,在所述陈述值的±20%;所述陈述值的±19%;所述陈述值的±18%;所述陈述值的±17%;所述陈述值的±16%;所述陈述值的±15%;所述陈述值的±14%;所述陈述值的±13%;所述陈述值的±12%;所述陈述值的±11%;所述陈述值的±10%;所述陈述值的±9%;所述陈述值的±8%;所述陈述值的±7%;所述陈述值的±6%;所述陈述值的±5%;所述陈述值的±4%;所述陈述值的±3%;所述陈述值的±2%;或所述陈述值的±1%的范围内。
尽管阐述本发明的广泛范围的数值范围和参数是近似值,但特定实例中阐述的数值被尽可能精确地加以报告。然而,任何数值都固有地含有必然由见于它们的相应测试测量中的标准偏差所致的某些误差。
除非本文另外指示或由上下文明确反驳,否则在描述本发明的情形下(尤其在以下权利要求的情形下)使用的术语“一个(种)(a/an)”、“这个(种)(the)”以及类似指示物应被解释为涵盖单数与复数两者。本文中对数值范围的叙述仅意图充当单独地涉及属于所述范围内的每个单独数值的简写方法。除非本文另外指示,否则每个单独数值就好像它在本文中被单独地叙述一样并入说明书中。除非本文另外指示或另外由上下文明确反驳,否则本文所述的所有方法都可以任何适合顺序进行。除非另外要求,否则本文提供的任何和所有实例或示例性措辞(例如“诸如”)的使用都仅意图更好阐明本发明,并且不对本发明的范围造成限制。说明书中无措辞应被解释为指示任何非要求要素为实施本发明所必需。
本文公开的本发明的替代性要素或实施方案的分组不应被解释为限制。每个群组成员都可单独地或与所述群组的其他成员或本文中所见的其他要素进行任何组合而被提及和要求。可以预期,群组的一个或多个成员可由于适宜性和/或可专利性的原因而被包括在群组中或从群组中删除。当任何所述包括或删除发生时,说明书被视为含有如所修改的群组,由此满足随附权利要求中所用的所有马库什群组(markushgroup)的书面描述。
本文描述了本发明的某些实施方案,包括为发明者所知用于执行本发明的最佳模式。当然,关于这些所描述实施方案的变化形式将在阅读先前描述后变得为本领域普通技术人员显而易知。本发明者预期熟练技术人员在适当时采用所述变化形式,并且本发明者意图本发明以与本文特定描述的方式不同的方式加以实施。因此,本发明包括随附于其的权利要求中叙述的主题的如由适用法律容许的所有修改形式和等同物。此外,除非本文另外指示或另外由上下文明确反驳,否则上述要素以其所有可能的变化形式的任何组合都由本发明涵盖。
此外,已在整篇本说明书中对专利、印刷出版物、期刊文章和其他书面文本进行大量参考(本文参考材料)。参考材料中的每一者单独地以引用的方式关于它们的被参考教义而被整体并入本文。
最后,应了解本文公开的本发明的实施方案说明本发明的原理。可采用的其他修改形式在本发明的范围内。因此,举例而非限制来说,可根据本文教义利用本发明的替代性配置。因此,本发明不限于精确地如所显示和所描述的那样。
本文显示的详情是举例来说的,并且仅出于对本发明的优选实施方案进行说明性讨论的目的,并且为了提供据信是对本发明的各种实施方案的原理和概念性方面的最有用和易于理解的描述的描述而呈现。就此而言,不试图相比于为达成对本发明的基本理解所必需的详细程度,以更详细方式显示本发明的结构细节,与附图和/或实例一起进行描述使得本领域技术人员显而易知本发明的若干形式可如何在实践中体现。
除非在以下实例中明确地和清楚地修改,或当对含义的应用致使任何诠释无意义或基本上无意义时,否则本公开中使用的定义和解释旨在以及意图在任何未来诠释中起支配作用。在其中对术语的诠释将致使它无意义或基本上无意义的情况下,定义应从第3版韦伯斯特氏词典(webster'sdictionary,3rdedition)或为本领域普通技术人员所知的词典诸如牛津生物化学和分子生物学词典(oxforddictionaryofbiochemistryandmolecularbiology,anthonysmith编,oxforduniversitypress,oxford,2004)获取。
- 还没有人留言评论。精彩留言会获得点赞!